Introduzione
L’emocromatosi ereditaria è una malattia da sovraccarico di ferro ed è la condizione genetica più comune nelle persone di origine europea. L’emocromatosi ereditaria di tipo 1 è attribuibile principalmente a due mutazioni del gene HFE, con il 95% delle persone colpite che hanno la mutazione p.C282Y (p.Cyst282Tyr) e il 4% che ha il genotipo eterozigote composto p.C282Y/p.Hist63Asp. 1 La mutazione p.C282Y altera un amminoacido chiave, che negli adulti compromette la segnalazione della proteina HFE e porta a una ridotta espressione di mRNA dell’epcidina, a una diminuzione dei livelli plasmatici di epcidina e a un eccessivo accumulo sistemico di ferro. 2
La variante p.C282Y è presente nel 10-15% delle popolazioni di origine nordeuropea, con circa 1/150 persone omozigoti3 e la più alta prevalenza di genotipi segnalata in Irlanda e Gran Bretagna. Negli Stati Uniti, la prevalenza di eterozigoti (C282Y/no mutazioni p.C282Y) nel terzo National Health and Nutrition Examination Survey (NHANES III)4 (n=5171) è stata del 9,5% (95% intervallo di confidenza 8,1% a 11,3%) nei bianchi non ispanici, con una prevalenza più bassa nei neri non ispanici (2).3%, dall’1,5% al 3,4%) e messicano-americani (2,8%, dall’1,9% al 4,0%): lo 0,3% (dallo 0,1% allo 0,8%) dei bianchi non ispanici studiati era omozigote p.C282Y, con un solo caso di omozigoti p.C282Y negli altri due gruppi. Altre mutazioni HFE legate al sovraccarico di ferro sono presenti in altre popolazioni.
L’emocromatosi ereditaria è caratterizzata dall’accumulo di ferro negli organi parenchimali, e la presentazione clinica include classicamente la cirrosi epatica, il diabete e le alterazioni del colore della pelle, ma la diagnosi è ora comunemente innescata da stanchezza cronica o artropatia. 5 I pazienti affetti da emocromatosi sono suscettibili ad alcune infezioni,6 ma il genotipo p.C282Y è anche associato a bassi livelli di colesterolo lipoproteico a bassa densità. 7
Studi su parenti stretti di pazienti con emocromatosi associata a p.C282Y hanno suggerito un’elevata penetrazione nella malattia clinica: per esempio, Jacobs et al8 hanno studiato 735 parenti di primo grado di 224 omozigoti olandesi p.C282Y con emocromatosi clinicamente palese e hanno trovato che il 45,7% di questi familiari aveva una diagnosi correlata all’emocromatosi rispetto al 19,4% nei controlli della popolazione generale. Tuttavia, diversi studi nella popolazione generale hanno suggerito una penetrazione molto più bassa della malattia clinica. Il più grande precedente studio genetico non familiare sull’emocromatosi (HEIRS9) ha esaminato 62-749 donne e 36-962 uomini (di età compresa tra i 25 e i 100 anni, età media 50 anni) provenienti da cinque centri clinici nordamericani e comprendeva 299 omozigoti HFE p.C282Y. Le associazioni genotipiche sono state testate con l’artrite, il diabete, le malattie del fegato, le malattie cardiache e l’impotenza o l’infertilità. L’unica associazione trovata è stata tra l’omozigotismo p.C282Y e “qualsiasi malattia del fegato” negli uomini (odds ratio 3,28, intervallo di confidenza del 95% da 1,49 a 7,22 rispetto a nessuna delle due varianti HFE), con malattia del fegato presente nel 3,3% degli uomini omozigoti p.C282Y studiati. Allo stesso modo, Beutler et al10 hanno studiato 41-38 persone (n=152 omozigoti p.C282Y) che frequentavano una clinica di valutazione della salute negli Stati Uniti e hanno concluso che meno dell’1% degli omozigoti p.C282Y sviluppano “franca emocromatosi clinica”.”Tuttavia, la penetrazione clinica è meglio valutata su una vita intera, o almeno più tardi, e una recente revisione di quattro studi di coorte di omozigoti p.C282Y non trattati (totale 107 uomini e 129 donne) ha suggerito che il 9% degli omozigoti p.C282Y maschili alla fine sviluppano ciò che gli autori hanno considerato una grave malattia del fegato. 11 Il ferro si accumula con l’avanzare dell’età, ma i dati di grandi campioni di persone anziane omozigoti per p.C282Y sono stati limitati. La flebotomia è efficace nel prevenire il sovraccarico di ferro e nel ridurre o stabilizzare diversi ma non tutti i risultati clinici,5 specialmente se iniziata precocemente. È indicato il reperimento di casi di emocromatosi e di varianti HFE in parenti stretti, ma lo screening della popolazione generale non è raccomandato. 1213 Ciò è in parte dovuto alla scarsa penetrazione clinica della malattia epatica e all’assenza di un eccesso di mortalità negli studi più importanti. 14
Abbiamo stimato le associazioni tra lo stato HFE p.C282Y e le condizioni comuni potenzialmente legate all’emocromatosi nel grande campione genotipizzato della Biobank del Regno Unito. Abbiamo replicato gli approcci precedentemente utilizzati negli studi delle mutazioni HFE in campioni generali di grandi dimensioni (principalmente in HEIRS9 e Beutler et al10), con alcune estensioni. Abbiamo testato le associazioni genotipiche con condizioni precedentemente legate allo stato HFE p.C282Y o viste in persone con emocromatosi15, ovvero emocromatosi, malattie del fegato (e cancro del fegato), diabete mellito, malattia coronarica e fibrillazione atriale, artrosi,16 artrite (e sostituzioni dell’anca17), osteoporosi,18 stanchezza,5 e suscettibilità alle infezioni6 valutate attraverso la comparsa di polmonite. Abbiamo utilizzato i dati su 451-243 volontari della comunità della Biobanca del Regno Unito di origine europea di età compresa tra i 40 e i 70 anni al basale. Abbiamo anche esaminato le associazioni con i risultati per la variante HFE p.H63D, più l’effetto combinato di altre tre varianti genetiche di piccolo effetto che influenzano i livelli di ferro: rs855791 (gene più vicino: TMPRSS6), rs7385804 (TFR2), e rs8177240 (TF). 19
Metodi
I set di dati dello studio della Biobanca del Regno Unito comprendono 502-634 volontari di età compresa tra i 40 e i 70 anni (con piccoli numeri fino a 73 anni), reclutati tramite invito postale a coloro che sono registrati presso il Servizio Sanitario Nazionale del Regno Unito, che vivono nel raggio di 25 miglia da 22 centri di valutazione in Inghilterra, Scozia e Galles. Le valutazioni di base (2006-10) comprendevano la demografia, lo stile di vita, l’anamnesi delle malattie e le misurazioni fisiologiche. 20 I partecipanti hanno dato il consenso informato per la genotipizzazione e il collegamento dei dati alle cartelle cliniche. I volontari tendevano ad essere più sani al baseline rispetto alla popolazione generale del Regno Unito. 21
Genotipizzazione e selezione del campione
I dati erano relativi a 451 243 partecipanti alla biobanca britannica di origine europea con informazioni sul genotipo HFE p.C282Y (rs1800562). Abbiamo anche studiato l’HFE p.H63D (rs1799945), nonché tre varianti legate al ferro in altri geni19 (rs855791, rs7385804, e rs8177240: vedi informazioni supplementari).
Accertamento della malattia
L’accertamento della prevalenza della malattia è avvenuto attraverso le risposte dei partecipanti alle voci del questionario sulle malattie diagnosticate dal medico al basale, e le cartelle cliniche dei pazienti ricoverati dal 1996 all’intervista al basale secondo i codici ICD-10 (classificazione internazionale delle malattie, decima revisione) (vedi tabella 1 supplementare e informazioni supplementari). Le diagnosi accertate sono state emocromatosi, condizioni epatiche (qualsiasi, in base ai codici ICD-10), cancro al fegato (solo casi accidentali), polmonite, malattia coronarica (infarto miocardico o angina), fibrillazione atriale, diabete mellito (prevalentemente di tipo 2 ma incluso il tipo 1, poiché la tipizzazione del diabete nell’emocromatosi potrebbe essere poco chiara), osteoporosi, osteoartrite e artrite reumatoide. Il numero di partecipanti omozigoti p.C282Y con cancro al fegato (al basale), cardiomiopatia diagnosticata o insufficienza cardiaca, o che riferiscono impotenza o infertilità, era troppo basso per essere analizzato. I partecipanti si sono autodenunciati se stavano assumendo farmaci per l’abbassamento del colesterolo e se avevano avuto una protesi d’anca; questi sono stati utilizzati nelle analisi di sensibilità.
La stanchezza o la letargia segnalata nelle due settimane precedenti allo studio della Biobanca britannica è stata riclassificata da “per niente”, “diversi giorni”, “più della metà dei giorni” e “quasi ogni giorno”, combinando le ultime due categorie, rispetto alle altre. I partecipanti che hanno risposto “non sanno” o “preferiscono non rispondere” sono stati esclusi dalle analisi (<3% degli intervistati).
Il follow-up è stato nei dati dei ricoveri ospedalieri fino a marzo 2016, nei registri nazionali dei tumori (fino a settembre 2015), o nella registrazione dei decessi (febbraio 2016): il follow-up massimo è stato di 9,4 anni (media di 7 anni). Le analisi di ogni condizione incidente escludono quelle con ogni diagnosi al basale.
Dati mancanti
Abbiamo escluso i partecipanti senza dati di genotipo imputati (n=15-333/502-642, 3,0%) e quelli con imputazione imprecisa per p.C282Y (n=183/487-409, 0,04%). Meno dello 0,5% dei partecipanti non ha avuto risposte registrate alle domande sulle autodiagnosi di malattia, sull’abbassamento del colesterolo, sull’uso di farmaci per l’abbassamento del colesterolo, sulla sostituzione dell’anca o sulla frequenza della stanchezza. Dato il basso livello di dati mancanti, abbiamo escluso i partecipanti con dati specifici mancanti da ogni analisi, come necessario.
Analisi statistica
Abbiamo cercato di replicare gli approcci precedentemente utilizzati negli studi delle mutazioni HFE in campioni generali di grandi dimensioni (principalmente in HEIRS9 e Beutler et al10), con alcune estensioni. La regressione logistica ha testato le associazioni di condizioni genotipiche di base (sezione trasversale) del genotipo, con modelli di regressione dei pericoli proporzionali Cox per tutte le cause di mortalità e le condizioni di incidente. I modelli sono stati adattati per età, centro di valutazione, sottostruttura della popolazione utilizzando i primi cinque componenti principali della variazione genetica generata nei partecipanti di origine europea e microarray di genotipizzazione (Affymetrix Axiom array 90% partecipanti, Affymetrix BiLEVE array, condivisione >95% del contenuto). Nelle analisi di sensibilità per i modelli di diagnosi degli incidenti abbiamo utilizzato modelli di rischio concorrenti Fine e Gray, con tutti i casi di mortalità come rischio concorrente. 22 Tutte le analisi sono state eseguite in Stata v14.1 con le funzioni stcox e stcrreg per i modelli di regressione dei pericoli proporzionali Cox e i modelli di rischio concorrenti, rispettivamente. Il Function prtest è stato utilizzato per verificare la presenza di differenze significative nelle proporzioni. Le cifre sono state generate in R v3.4.1 utilizzando i pacchetti metafor (v2.0) e ggplot2 (v2.2.1). Un’ipotesi dei modelli di regressione dei pericoli proporzionali di Cox (e dei rischi concorrenti) è che il rapporto di pericolo rimanga costante nel tempo. La funzione STATA stphtest è stata utilizzata per verificare se l’ipotesi di pericolo proporzionale è stata violata nei nostri modelli. Abbiamo seguito la raccomandazione dell’American Medical Association che i valori P <0,001 non devono essere specificati (vedi il materiale supplementare per i valori P effettivi, spesso molto più bassi).
Abbiamo cercato di replicare gli approcci utilizzati in precedenza, ma non abbiamo registrato un protocollo di analisi specifico prima di intraprendere queste analisi. Analogamente, non sono stati predefiniti i contenuti specifici delle misure di morbilità complessiva in eccesso.
Test multipli
Il nostro studio è essenzialmente una replica di studi precedenti (in particolare HEIRS9 e Beutler et al10), esaminando le associazioni tra le due principali mutazioni HFE e la morbilità associata all’emocromatosi. Le nostre analisi principali hanno testato 11 risultati chiave, tutti precedentemente implicati nel singolo processo di base condiviso di sovraccarico di ferro, ovvero emocromatosi, malattie cardiovascolari, diabete mellito, qualsiasi malattia del fegato (con subanalisi di cancro al fegato), osteoartrite, osteoporosi, artrite reumatoide, polmonite, fibrillazione atriale, stanchezza e morte. Abbiamo eseguito analisi separate per uomini e donne, sulla base di prove a priori dell’insorgenza tardiva della malattia nelle donne. Dopo le analisi principali, che comprendono l’intero gruppo di età compresa tra i 40 e i 70 anni, abbiamo fornito stime del sottogruppo di età, in quanto l’accumulo di ferro progredisce con l’avanzare dell’età. Esistono ampie evidenze per le associazioni dei confronti studiati nelle persone con emocromatosi o con il genotipo p.C282Y, quindi le probabilità a priori non erano piccole, anche se non quantificate in un campione comparabile. Abbiamo riportato ed evidenziato una misura sintetica principale (cioè una o più delle malattie associate all’emocromatosi di base in tutti gli uomini e le donne studiati separatamente) come nostro principale risultato complessivo. Dato il contesto di questa analisi, abbiamo riportato semplici valori di P senza correzione per i test multipli, poiché abbiamo testato le associazioni con elevate probabilità precedenti. Tuttavia, abbiamo anche eseguito la correzione dei test multipli di Benjamini-Hochberg e riportiamo l’effetto sui risultati principali.
Randomizzazione mendeliana
Per testare l’ipotesi che i genotipi HFE influenzino il rischio di malattia incidente influenzando i livelli di ferro, abbiamo utilizzato metodi di analisi di randomizzazione mendeliana. La saturazione media della transferrina (%) (la misura clinica più specifica del carico di ferro) è stata utilizzata per ciascuno dei cinque gruppi di genotipi HFE (p.C282Y omozigoti, p.C282Y eterozigoti, p.C282Y/p.H63D eterozigoti composti, p.H63D da solo, e quelli senza nessuna delle due mutazioni), come riportato da Allen et al. 23 Abbiamo usato il pacchetto R (v3.5.1) BSDA (v1.2.0) e il function tsum.test per determinare la differenza di saturazione della transferrina tra ciascun genotipo e il gruppo senza mutazioni p.C282Y (vedi tabella supplementare 10). Per ognuno dei sei principali esiti dell’incidente (emocromatosi, malattia epatica, cancro al fegato, osteoartrite, osteoporosi e diabete) abbiamo eseguito i modelli di regressione dei rischi proporzionali di Cox, utilizzando le stesse combinazioni di genotipi HFE come in Allen 2008 (vedi tabella supplementare 10). Il pacchetto R MendelianRandomisation (v0.3.0) ha testato se l’associazione tra genotipo HFE e i risultati dell’incidente può essere causata da differenze nella saturazione della transferrina dovute al genotipo. Il risultato ponderato della varianza inversa è stato il metodo primario, e i metodi mediano ponderato e MR-Egger sono stati utilizzati come analisi di sensibilità per verificare la coerenza e la polarizzazione.
Coinvolgimento del paziente e del pubblico
I pazienti e i partecipanti sono stati e sono ampiamente coinvolti nello studio della Biobanca britannica. Abbiamo utilizzato dati anonimi già raccolti e quindi nessun paziente è stato coinvolto nella definizione della domanda di ricerca o delle misure di esito. A nessun paziente è stato chiesto di dare consigli sull’interpretazione o di scrivere i risultati. La UK Biobank ha notificato ai partecipanti i risultati rilevanti per la salute nella valutazione di base, ma non vi è stata alcuna notifica individuale dei risultati successivi, anche per quanto riguarda la genotipizzazione. Abbiamo in programma di diffondere i risultati generali della ricerca per studiare i partecipanti e la comunità di pazienti interessata.
Risultati
Le analisi hanno incluso i 451 243 partecipanti alla Biobanca del Regno Unito di origine europea di età compresa tra i 40 e i 70 anni al baseline, di cui 2890 erano omozigoti per p.C282Y (0,6%, ovvero 1 su 156) e 64-4444 (14).3%) eterozigote per p.C282Y: il restante gruppo senza mutazioni p.C282Y presenti, indipendentemente dallo stato p.H63D, ha costituito il gruppo di confronto chiave per le analisi principali (n=383-909, 85,1%).
L’emocromatosi (ereditaria non specificata nei dati diagnostici disponibili) è stata diagnosticata (tabella 1) al basale nel 7,3% (210/2890) degli omozigoti p.C282Y nel complesso (contro lo 0,02% di quelli senza mutazioni p.C282Y), aumentando al 15,1% (437/2890) al termine del follow-up (contro lo 0,04% di quelli senza mutazioni p.C282Y). I tassi di diagnosi di emocromatosi sono stati più elevati negli uomini: 156 su 1294 omozigoti maschi su 1294 p.C282Y (12,1%, intervallo di confidenza del 95% dal 10,3% al 14,0%; tabella 1) al basale, aumentando a 281 (21,7%, 19,5% al 24,1%) alla fine del follow-up. Nel 1596 donne, le diagnosi di emocromatosi erano presenti al basale in 54 (3,4%, dal 2,6% al 4,4%), salendo a 156 (9,8%, dall’8,4% all’11,2%) durante il follow-up.
| Caratteristiche | Uomini | Donne | |||||
|---|---|---|---|---|---|---|---|
| Omozigoti | Heterozygotes | Nessuna mutazione p.C282Y* | Omozigoti | Heterozygotes | Nessuna mutazione p.C282Y* | ||
| Tutte le età (40-70 anni): | |||||||
| No (%) | 1294 (0.6) | 29 536 (14.3) | 175 539 (85.1) | 1596 (0.65) | 34 908 (14.3) | 208 370 (85.1) | |
| Età minima (SD) (anni) | 56.85 (8.18) | 57.01 (8.12) | 57.00 (8.11) | 56.94 (7.98) | 56.48 (7.97) | 56.61 (7.94) | |
| ■Nessun (%) consumo di alcolici al giorno† | 324 (25.1) | 7544 (25.6) | 46 342 (26.4) | 256 (16.0) | 5765 (16.5) | 35 191 (16.90) | |
| No (%) con diagnosi di base di emocromatosi | 156 (12.1) | 56 (0.2) | 55 (0.03) | 54 (3.4) | 17 (0.05) | 16 (0.01) | |
| Anziani (60-70 anni): | |||||||
| No (%) | 593 (0.6) | 13 599 (14.3) | 80 945 (85.1) | 719 (0.7) | 14 905 (14.1) | 90 214 (85.2) | |
| Età dei fagioli (SD) (anni) | 64.19 (2.84) | 64.29 (2.85) | 64.25 (2.86) | 64.26 (2.82) | 64.02 (2.86) | 64.04 (2.84) | |
| Nessun (%) consumo di alcolici al giorno†. | 173 (29.2) | 3962 (29.2) | 24 277 (30.0) | 125 (17.4) | 2696 (18.1) | 16 714 (18.5) | |
| No (%) con diagnosi di base di emocromatosi | 81 (13.7) | 31 (0.2) | 35 (0.04) | 34 (4.7) | 7 (0.05) | 5 (0.01) | |
Sono state registrate anche le diagnosi prevalenti e incidentali dell’emocromatosi stessa (indipendentemente dal sottotipo) per le persone con il genotipo eterozigote p.C282Y, i genotipi p.H63D e il genotipo composito p.C282Y/p.H63D, con il 10,7% delle diagnosi registrate nei partecipanti con nessuna delle mutazioni studiate (vedere la tabella supplementare 2 per le diagnosi prevalenti, e la tabella supplementare 4 per le diagnosi incidentali).
p.C282Y stato omozigote e condizioni prevalenti
Diverse associazioni con le diagnosi studiate erano presenti negli uomini (campione intero di età compresa tra i 40 e i 70 anni al basale, fig 1 e tabella 2; vedi tabella supplementare 2 per i risultati completi). Maschio p.C282Y omozigoti p.C282Y aveva una maggiore prevalenza di emocromatosi diagnosticata (odds ratio 411,1, 95% intervallo di confidenza 299,0 a 565,3, P<0,001), così come l’osteoartrite (2,01, 1,71 a 2,36, P<0,001), malattie del fegato (4.30, dal 2,97 al 6,18, P<0,001), artrite reumatoide (2,23, dall’1,51 al 3,31, P<0,001), e diabete mellito (1,53, dall’1,16 all’1,98, P=0,002), rispetto a nessuna mutazione p.C282Y (n=175-539, indipendentemente dallo stato H63D). Le associazioni erano presenti anche per l’osteoporosi (2,23, da 1,49 a 3,57, P<0,001) e la polmonite (1,62, da 1,20 a 2,19, P=0,002). Contrariamente a questi aumenti della morbilità, le diagnosi di malattia coronarica erano meno comuni (0,76, da 0,61 a 0,95; P=0,016), anche se questa associazione non era più significativa dopo la correzione per i test multipli (Benjamini-Hochberg corretto P=0,069): tutte le altre associazioni erano ancora significative dopo la correzione dei test multipli. Non sono state riscontrate associazioni con stanchezza o fibrillazioni atriali negli uomini di età compresa tra i 40 e i 70 anni.
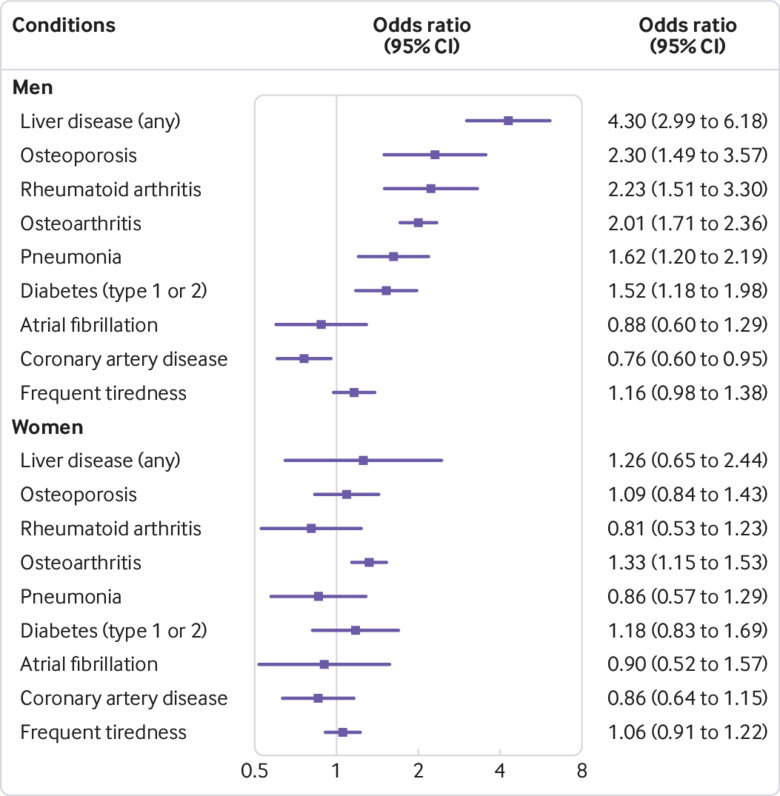
Fig. 1.Condizioni prevalenti nel campione studiato (di età compresa tra i 40 e i 70 anni alla linea di base): Trama forestale di associazioni che confronta lo stato omozigote p.C282Y senza mutazioni p.C282Y, indipendentemente dallo stato p.H63D, in uomini e donne. I rapporti di probabilità sono ottenuti da modelli di regressione logistica adattati per età, tipo di matrice di genotipizzazione e componenti genetiche principali. Vedere la tabella supplementare 2 per i dettagli
| Condizioni di base | Uomini | Donne | |||||
|---|---|---|---|---|---|---|---|
| Omozigoti | Eterozigoti | Nessuna mutazione p.C282Y* | Omozigoti | Heterozygotes | Nessuna mutazione p.C282Y* | ||
| Emocromatosi | 156 (12.1) | 56 (0.2) | 55 (0.03) | 54 (3.4) | 17 (0.05) | 16 (0.01) | |
| Fibrillazione atriale | 27 (2.1) | 769 (2.6) | 4166 (2.4) | 13 (0.8) | 307 (0.9) | 1751 (0.8) | |
| CAD (infarto del miocardio o angina) | 84 (6.5) | 2434 (8.2) | 14 341 (8.2) | 47 (2.9) | 1141 (3.3) | 6495 (3.1) | |
| Diabete (tipo 1 o 2) | 61 (4.7) | 1000 (3.4) | 5523 (3.15) | 31 (1.9) | 568 (1.6) | 3371 (1.6) | |
| Malattia del fegato | 31 (2.4) | 178 (0.6) | 910 (0.5) | 9 (0.6) | 149 (0.4) | 864 (0.4) | |
| Osteoartrite | 182 (14.1) | 2268 (7.7) | 13 105 (7.5) | 227 (14.2) | 3780 (10.8) | 22 522 (10.8) | |
| Osteoporosi | 21 (1.6) | 206 (0.7) | 1164 (0.7) | 57 (3.57) | 1042 (2.98) | 6305 (3.03) | |
| Polmonite | 45 (3.5) | 654 (2.2) | 3844 (2.2) | 24 (1.5) | 634 (1.8) | 3626 (1.7) | |
| Artrite reumatoide | 26 (2.0) | 249 (0.8) | 1552 (0.9) | 22 (1.4) | 533 (1.5) | 3399 (1.6) | |
| Stanchezza | 68 (11.9) | 1085 (8.3) | 6455 (8.3) | 76 (11.4) | 1365 (9.65) | 8630 (10.1) | |
| ≥1 diagnosi di emocromatosi del nucleo† | 346 (26.7) | 3518 (11.9) | 19 778 (11.3) | 304 (19.05) | 4743 (13.6) | 28 487 (13.7) | |
| ≥1 condizione (qualsiasi) | 421 (32.5) | 4922 (16.7) | 28 143 (16.0) | 398 (24.9) | 6888 (19.7) | 41 531 (19.9) | |
Nelle donne di età compresa tra i 40 e i 70 anni, l’omozigosi p.C282Y (n=1596, fig. 1) è stata associata solo all’emocromatosi (odds ratio 438,0, intervallo di confidenza del 95% da 247,9 a 773,9, P<0,001) e all’osteoartrite (1,33, da 1,15 a 1,53; P<0,001). L’emocromatosi è stata associata all’emocromatosi p.C282Y in tutti e tre i sottogruppi di 10 anni e in entrambi i sessi (vedi tabella supplementare 2). La maggior parte delle altre condizioni associate allo stato omozigote p.C282Y nel complesso negli uomini ha raggiunto anche una significatività statistica nei sottogruppi di 50-59 anni e 60-70 anni (vedi fig. 1 supplementare), mentre l’associazione con l’osteoartrite era presente in tutti e tre i gruppi di età. La frequente stanchezza o letargia era associata all’omozigosi p.C282Y solo negli uomini di età compresa tra i 60 e i 70 anni (1,43, 1,10-1,84; P=0,007). Nelle donne, nessuna delle analisi specifiche per età ha raggiunto un significato.
Abbiamo ripetuto analisi prevalenti, tra cui un termine di interazione tra il genotipo p.C282Y e il sesso, per verificare se la differenza osservata tra uomini e donne era statisticamente significativa. Il sesso ha interagito in modo significativo con p.C282Y per l’osteoporosi prevalente (P=0,004 per l’interazione), l’osteoartrite (P<0,001 per l’interazione), l’artrite reumatoide (P<0,001 per l’interazione), la polmonite (P=0,01 per l’interazione) e le malattie del fegato (P=0,001 per l’interazione). In tutti i casi, essendo maschio ha aumentato l’associazione.

Fig. 1.Condizioni prevalenti nel campione studiato (età 40-70 anni alla linea di base): Trama forestale di associazioni che confronta lo stato omozigote p.C282Y senza mutazioni p.C282Y, indipendentemente dallo stato p.H63D, in uomini e donne. I rapporti di probabilità sono ottenuti da modelli di regressione logistica adattati per età, tipo di matrice di genotipizzazione e componenti genetiche principali. Vedere la tabella supplementare 2 per i dettagli
p.C282Y associazioni di stato omozigoti con condizioni di incidente
Durante il follow-up (media 7 (massimo 9,4) anni), 107 p.C282Y partecipanti omozigoti sono morti (rapporto di pericolo 1,23, intervallo di confidenza del 95% da 1,01 a 1,48, P=0,04 rispetto a 11-92 decessi in partecipanti senza mutazioni p.C282Y; vedi fig. 2 supplementare). Le associazioni specifiche di età e sesso con la mortalità non hanno raggiunto la significatività, e l’associazione complessiva con la mortalità non era più significativa dopo l’aggiustamento per i test multipli (Benjamini-Hochberg P=0,36; vedi tabella supplementare 3). Si veda anche l’analisi post hoc della causa di morte nella sezione sulle analisi di sensibilità.
Negli uomini di età compresa tra i 40 e i 70 anni senza una diagnosi di emocromatosi al basale, gli omozigoti p.C282Y avevano più probabilità di avere una diagnosi di emocromatosi durante il follow-up rispetto ai partecipanti senza mutazioni p.C282Y (hazard ratio 286,2, intervallo di confidenza del 95% da 211,0 a 388,0). Le donne omozigoti p.C282Y avevano anche una maggiore probabilità di ricevere una diagnosi di emocromatosi (427,3, 285,4-639,7). Nel complesso, gli omozigoti p.C282Y maschili avevano maggiori probabilità di ricevere una diagnosi durante il follow-up rispetto agli omozigoti p.C282Y femminili (1,73, da 1,33 a 2,25, P<0,001). Il numero di diagnosi incidente nel gruppo degli omozigoti p.C282Y era relativamente basso (vedi tabella supplementare 4), ma i maschi omozigoti p.C282Y di età compresa tra 40 e 70 anni avevano una maggiore incidenza di qualsiasi malattia del fegato (2,35, da 1,60 a 3,43, P<0,001), così come il cancro al fegato incidente (n=11 nei maschi omozigoti p.C282Y, rapporto di rischio 8,88, intervallo di confidenza del 95% da 4,79 a 16,45, P<0,001). Sono state inoltre riscontrate associazioni con l’osteoartrite incidente sia negli uomini che nelle donne di età compresa tra i 40 e i 70 anni (1,84, 1,20-2,80, P=0,005, e 1,81, 1,26-2,60, P=0,001, rispettivamente) e con l’osteoporosi incidente nel maschio p.C282Y omozigoti (2,18, da 1,13 a 4,21, P=0,021), anche se quest’ultima associazione non era più significativa dopo la correzione per i test multipli (Benjamini-Hochberg P=0,14). Abbiamo ripetuto le analisi delle diagnosi di incidenti tra cui un termine di interazione tra il sesso e il genotipo p.C282Y: solo il cancro al fegato (P=0,038 per l’interazione) e le malattie del fegato (P=0,049 per l’interazione) i termini di interazione erano statisticamente significativi, con il sesso maschile che aumentava la dimensione stimata dell’effetto.
Come sovraccarico di ferro in emocromatosi colpisce molti tessuti parenchimali, abbiamo anche calcolato una misura sintetica della morbilità incidente in eccesso, per consentire la stima delle differenze assolute complessive di morbilità. Abbiamo stimato l’incidenza delle diagnosi fondamentali legate all’emocromatosi, ovvero l’emocromatosi stessa, qualsiasi malattia del fegato (incluso il cancro al fegato), il diabete, l’osteoartrite o l’artrite reumatoide. Durante il follow-up medio di sette anni, il 15,7% degli uomini omozigoti p.C282Y (di tutte le età) ha sviluppato almeno una condizione “di base” (dopo aver escluso i casi prevalenti) rispetto al 5,0% degli uomini senza mutazioni p.C282Y (10.7 punti percentuali di differenza, intervallo di confidenza del 95% da 8,4 a 13,4; P<0,001); nelle donne le rispettive stime sono state del 10,1% contro il 3,4% (6,7 punti percentuali di differenza, da 5,0 a 8,3; P<0,001, vedi tabella supplementare 5). Queste stime assolute aumentano con l’età (fig. 2, vedi tabella supplementare 5). Nell’analisi time-to-event, sia l’uomo che la donna p.C282Y omozigoti hanno avuto maggiori rischi per la morbilità incidente (uomini: rapporto di rischio 3,37, intervallo di confidenza del 95% da 2,87 a 3,97, P<0,001; donne 2,99, da 2,51 a 3,55, P<0,001; fig. 3; vedere le figg. 3 e 4 supplementari). Le analisi di sensibilità che combinano le diagnosi di cui sopra (emocromatosi, qualsiasi malattia del fegato, cancro al fegato, diabete, osteoartrite e artrite reumatoide) con l’osteoporosi e la polmonite hanno fornito stime leggermente superiori: Il 19,3% degli omozigoti maschi di età compresa tra i 40 e i 70 anni ha sviluppato almeno una condizione durante il follow-up (dopo aver escluso i casi prevalenti) rispetto all’8,7% dei partecipanti senza mutazioni di p.C282Y (10,6% di differenza, 95% di intervallo di confidenza dal 13,2% all’8,1%, P<0,001). Nelle donne, le rispettive stime sono state del 12,4% contro il 6,2% (6,2% di differenza, 8,0% a 4,4%, P<0,001).
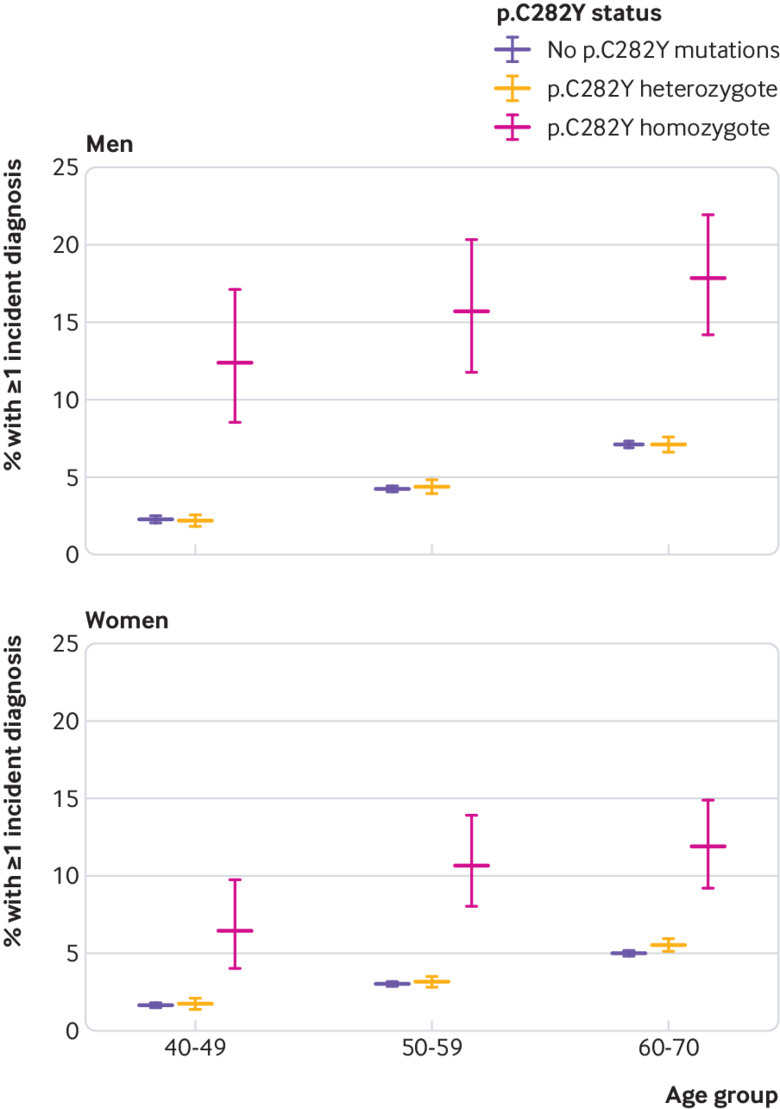
Fig. 2.Percentuale di partecipanti con almeno una diagnosi di incidente durante il follow-up, per fascia d’età, sesso e genotipo p.C282Y. Sono indicate percentuali assolute e intervalli di confidenza del 95%. Le diagnosi includono emocromatosi, qualsiasi malattia del fegato, cancro al fegato, diabete, osteoartrite e artrite reumatoide. Sono esclusi i casi prevalenti. Tutti i confronti sono senza mutazioni di p.C282Y, indipendentemente dallo stato di p.H63D. Vedere la tabella supplementare 5 per i dettagli
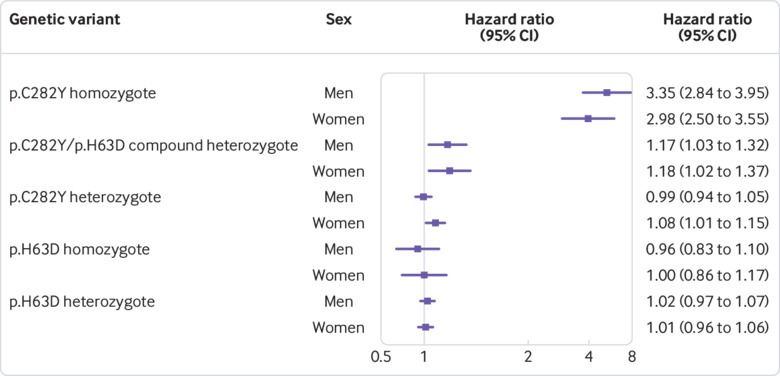
Fig. 3.Fig. 3. Trama forestale di associazioni per lo sviluppo di almeno una condizione incidente associata a p.C282Y (emocromatosi incidente, malattia del fegato (compreso il cancro del fegato), diabete (tipo 1 o 2), artrite reumatoide, o osteoartrite) alla fine del follow-up, stratificata per genotipo e sesso. I rapporti di pericolo sono da modelli tempo-evento (regressione proporzionale dei pericoli di Cox) adattati per età, tipo di matrice genotipica e componenti genetiche principali. I gruppi omozigoti ed eterozigoti (rispettivamente p.C282Y/p.C282Y e p.C282Y/-) sono confrontati con partecipanti che non presentano mutazioni p.C282Y, indipendentemente dallo stato p.H63D. I gruppi p.C282Y/p.H63D sono confrontati con partecipanti senza mutazioni p.C282Y e p.H63D. I gruppi p.H63D/p.H63D e p.H63D/- sono confrontati con partecipanti senza mutazioni p.H63D. Vedi tabella supplementare 4 per i dettagli

Fig. 2.Percentuale di partecipanti con almeno una diagnosi di incidente durante il follow-up, per fascia d’età, sesso e genotipo p.C282Y. Sono indicate percentuali assolute e intervalli di confidenza del 95%. Le diagnosi includono emocromatosi, qualsiasi malattia del fegato, cancro al fegato, diabete, osteoartrite e artrite reumatoide. Sono esclusi i casi prevalenti. Tutti i confronti sono senza mutazioni di p.C282Y, indipendentemente dallo stato di p.H63D. Vedere la tabella supplementare 5 per i dettagli

Fig. 3.Fig. 3. Trama forestale di associazioni per lo sviluppo di almeno una condizione incidente associata a p.C282Y (emocromatosi incidente, malattia del fegato (compreso il cancro del fegato), diabete (tipo 1 o 2), artrite reumatoide, o osteoartrite) alla fine del follow-up, stratificato per genotipo e sesso. I rapporti di pericolo sono da modelli tempo-evento (regressione proporzionale dei pericoli di Cox) adattati per età, tipo di matrice genotipica e componenti genetiche principali. I gruppi omozigoti ed eterozigoti (rispettivamente p.C282Y/p.C282Y e p.C282Y/-) sono confrontati con partecipanti che non presentano mutazioni p.C282Y, indipendentemente dallo stato p.H63D. I gruppi p.C282Y/p.H63D sono confrontati con partecipanti senza mutazioni p.C282Y e p.H63D. I gruppi p.H63D/p.H63D e p.H63D/- sono confrontati con partecipanti senza mutazioni p.H63D. Vedi tabella supplementare 4 per i dettagli
Penetrazione complessiva in p.C282Y omozigoti
La penetrazione globale (cioè, avere almeno una diagnosi di emocromatosi; qualsiasi malattia del fegato, compreso il cancro al fegato; diabete; osteoartrite; o artrite reumatoide, comprese le diagnosi prevalenti e incidenti alla fine del follow-up, età media 63,8 anni) è stata del 38,3% in p.Gli uomini omozigoti C282Y (di tutte le età) rispetto al 15,7% degli uomini senza mutazione p.C282Y, ovvero un ulteriore 22,6% degli omozigoti maschi p.C282Y ha sviluppato una o più di queste diagnosi (intervallo di confidenza del 95% dal 19,9% al 25,2%, P<0,001, con i tassi assoluti più alti nei gruppi più anziani. Nelle donne, le rispettive stime sono state del 27,2% (dal 25,0% al 29,4%) contro il 16,6% (dal 16,6% al 16,8%), l’eccesso di morbilità del 10,6% (dall’8,4% al 12,8%, P<0,001) (vedi fig. 5 supplementare e tabella 5 supplementare).
Morbilità incidente in p.C282Y/p.H63D composto eterozigoti
Dei 451 243 partecipanti, 10 701 (2,4%) erano eterozigoti composti p.C282Y/p.H63D (4955 erano uomini, 46,3%). La mortalità non è stata aumentata in p.C282Y/p.H63D eterozigoti composti (P=0,31) rispetto ai partecipanti con mutazioni p.C282Y e p.H63D.
Dopo aver escluso 79 partecipanti con una diagnosi prevalente di emocromatosi, gli eterozigoti composti hanno avuto una maggiore probabilità di diagnosi di emocromatosi incidente (uomini n = 46, casi di eterozigoti composti, rapporto di rischio 33.63, intervallo di confidenza del 95% da 21,44 a 52,76, P<0,001; donne n=17, 34,74, da 16,47 a 73,29, P<0,001) rispetto ai partecipanti con mutazioni p.C282Y e p.H63D (n=268-577, di cui 122-841 uomini, 45,7%).
I partecipanti eterozigoti composti erano anche più probabili di avere almeno una diagnosi incidente di emocromatosi, qualsiasi malattia del fegato, compreso il cancro del fegato, diabete, osteoartrite o artrite reumatoide (uomini: hazard ratio 1,17, 95% intervallo di confidenza 1.03 a 1,33, P=0,016; donne: 1,18, 1,03 a 1,37, P=0,022; fig 3; vedi tabella supplementare 4 per i dettagli), anche se queste associazioni non erano più significative dopo la correzione per i test multipli (Benjamini-Hochberg P=0,14 e 0,14, rispettivamente).
Morbilità incidente in p.C282Y eterozigoti
Complessivamente, 64-444 partecipanti sono stati eterozigoti per p.C282Y (indipendentemente dallo stato di p.H63D, 14,3%), di cui 29-526 uomini (45,8% di 64-444). La mortalità non è aumentata in p.C282Y eterozigoti (P>0,05) rispetto ai partecipanti senza mutazioni p.C282Y. Dopo aver escluso i partecipanti con emocromatosi prevalente, gli eterozigoti p.C282Y avevano una maggiore probabilità di diagnosi di emocromatosi (uomini: rapporto di rischio 5.77, intervallo di confidenza del 95% da 4,09 a 8,13, P<0,001; donne: 5,30, da 3,201 a 8,78, P<0,001) rispetto a nessuna mutazione p.C282Y (n=383-909 (45,72%) di cui 175-539 uomini).
Dopo aver escluso gli eterozigoti composti 10-660 p.C282Y/p.H63D, i soli eterozigoti semplici p.C282Y avevano ancora più probabilità di avere una diagnosi di emocromatosi incidente (3,42, da 2,17 a 5,38, P<0,001) rispetto a quelli senza mutazioni p.C282Y o p.H63D. Non abbiamo osservato un eccesso di morbilità (almeno una diagnosi di emocromatosi incidente; qualsiasi malattia del fegato, incluso il cancro al fegato; diabete; osteoartrite; o artrite reumatoide) negli uomini eterozigoti p.C282Y (P=0,78) e una probabilità nominalmente aumentata nelle donne eterozigoti p.C282Y (1,08, da 1,01 a 1,15, P=0,023) rispetto a quelle senza mutazioni p.C282Y (fig. 3). Dopo aver escluso gli eterozigoti composti 10-660 p.C282Y/p.H63D, le donne eterozigoti p.C282Y non avevano più un rischio maggiore di eccesso di morbilità incidente (1,07, da 0,99 a 1,15, P=0,07) rispetto alle donne senza mutazioni p.C282Y o p.H63D.
Interazioni con varianti di ferro a piccolo effetto
Abbiamo testato le interazioni tra p.C282Y e un unico punteggio di rischio genetico per l’aumento dei livelli di ferro negli uomini di età compresa tra 40 e 70 anni (combinando tre alleli associati ai livelli di ferro,19 ponderati per la dimensione dell’effetto, esclusi p.C282Y e p.H63D: vedi informazioni supplementari). Non abbiamo trovato interazioni significative (P>0,05) per le malattie prevalenti o incidenti individualmente (vedi tabella supplementare 6). Tuttavia, per l’eccesso di morbilità incidente (almeno una diagnosi di emocromatosi; qualsiasi malattia del fegato, compreso il cancro al fegato; diabete; osteoartrite; o artrite reumatoide) era presente un’interazione statistica tra p.C282Y omozigosi e il punteggio di rischio genetico singolo di ferro (P=0.001, Benjamini-Hochberg P=0.018). In ulteriori indagini, gli uomini omozigoti p.C282Y al di sopra del punteggio medio di rischio genetico del ferro singolo hanno avuto un aumento del 51% del rischio di una diagnosi incidente (di emocromatosi; qualsiasi malattia del fegato, compreso il cancro del fegato; diabete; osteoartrite; o artrite reumatoide; rapporto di rischio 1,51, intervallo di confidenza del 95% da 1,09 a 2,09, P=0,01) rispetto agli omozigoti p.C282Y al di sotto del punteggio medio di rischio genetico del ferro singolo.
Analisi della sensibilità
Date le associazioni di omozigosi p.C282Y con una minore prevalenza di malattia coronarica negli uomini di età compresa tra i 40 e i 70 anni al basale, abbiamo testato associazioni con l’uso di farmaci per l’abbassamento del colesterolo (47-141 di 206-175 uomini (22,9%)). p.C282Y uomini omozigoti (di età compresa tra i 40 e i 70 anni) avevano una ridotta probabilità di utilizzare farmaci per l’abbassamento del colesterolo al basale (odds ratio 0.76, intervallo di confidenza del 95% da 0,68 a 0,85; P<0,001) rispetto agli uomini senza mutazioni p.C282Y. p.C282Y donne omozigote (di età compresa tra 40 e 70 anni) hanno anche riportato un minor uso di farmaci per l’abbassamento del colesterolo (0,75, da 0,67 a 0,84; P<0,001), sebbene l’associazione p.C282Y con la malattia coronarica non fosse significativa in questo gruppo (P>0,05). Abbiamo anche ripetuto le analisi delle associazioni significative di p.C282Y con diagnosi prevalenti e incidenti che escludono l’uso di farmaci per l’abbassamento del colesterolo da parte dei partecipanti. Tutte le associazioni sono rimaste significative, con stime di effetto coerenti o maggiori (ad eccezione della malattia coronarica prevalente, che è diventata non significativa dopo la rimozione del gruppo a rischio di malattia cardiovascolare trattato: P=0,8) (vedi tabella supplementare 7 per i risultati completi). Date le associazioni omozigoti p.C282Y con l’artrite e l’osteoporosi, abbiamo effettuato ulteriori analisi sull’autosostentamento della sostituzione dell’anca al basale (per fornire un endpoint rigido): sia il maschio che la femmina p.C282Y omozigoti p.C282Y hanno avuto tassi più elevati di sostituzione dell’anca (2,62, da 1,97 a 3,49, P<0,001 e 1,90, da 1,52 a 2,54, P<0,001, rispettivamente) rispetto ai partecipanti senza mutazioni p.C282Y.
Data l’associazione nominalmente significativa dell’omozigote p.C282Y con l’eccesso di mortalità (quando si combinano uomini e donne, di età compresa tra i 40 e i 70 anni al baseline) durante il follow-up, abbiamo intrapreso analisi post hoc sulle cause di morte. Il medico ha registrato che la causa principale di 14 di questi decessi è stata il cancro al fegato (carcinoma a cellule epatiche n=10, carcinoma del dotto biliare intraepatico n=4), e 12 di questi tumori del fegato si sono verificati in omozigoti maschi p.C282Y. Il rapporto di probabilità per gli omozigoti p.C282Y per il cancro del fegato come causa di morte era 8,40 (intervallo di confidenza del 95% da 4,68 a 15,05, P<0,001) rispetto a nessuna mutazione p.C282Y: uomini 14,01 (da 7,20 a 27,28, P<0,001); non significativo nelle femmine P=0,26. Non sono state registrate altre principali cause di morte in più di 10 dei partecipanti omozigoti p.C282Y deceduti.
Il campione di Biobanca del Regno Unito studiato comprendeva 27-573 coppie di parenti di primo grado (coefficiente di parentela KING >0,177). Per evitare l’inflazione delle associazioni da effetti familiari, abbiamo escluso un partecipante selezionato a caso da ogni coppia relativa al terzo grado (coefficiente di parentela >0,0442) o più vicino (n=71-651), lasciando 379-592 partecipanti non imparentati per le analisi di sensibilità. I risultati sono stati simili ai risultati principali (vedi tabella supplementare 8): la proporzione di omozigoti maschi p.C282Y di età compresa tra 40 e 70 anni con almeno una diagnosi associata positivamente (emocromatosi; qualsiasi malattia del fegato, compreso il cancro del fegato; diabete; artrite reumatoide; o osteoartrite) era 14.6%, rispetto al 5,0% di quelli senza mutazioni p.C282Y (eccesso assoluto di 9,58 punti percentuali, intervallo di confidenza del 95% da 7,12 a 12,05): i risultati comparativi per il campione complessivo sono stati rispettivamente del 15,7% e del 5,0%, suggerendo che l’inclusione o l’esclusione ha scarso effetto sulle stime.
Abbiamo testato gli effetti di rischio moltiplicativo (termini di interazione statistica) tra lo stato omozigote p.C282Y e il consumo giornaliero di alcol negli uomini di età compresa tra 40 e 70 anni per ogni condizione di base associata, più la misura combinata della morbilità: nessuna interazione è stata significativa (P>0,05), il che implica che l’assunzione giornaliera di alcol sembra essere un fattore di rischio additivo per i risultati studiati. In ulteriori analisi, l’88,4% degli uomini di età compresa tra i 40 e i 70 anni ha riferito l’assunzione settimanale di alcolici, e quelli nella top 20% dell’assunzione di alcolici hanno consumato più di 37,2 unità (1 unità = 10 ml) ogni settimana. Negli uomini senza mutazioni p.C282Y, il fatto di essere nel 20% di alcolici è stato associato a un aumento del rischio di malattie epatiche (hazard ratio 1,75, intervallo di confidenza del 95% da 1,55 a 1,96, P<0,001) rispetto agli altri gruppi di assunzione di alcolici (esclusi quelli con dati mancanti). Allo stesso modo, anche gli omozigoti maschi p.C282Y nel 20% dell’assunzione di alcolici avevano aumentato il rischio di malattie epatiche incidenti (2,49, da 1,02 a 6,06, P=0,04), ma gli intervalli di confidenza erano ampi e sovrapposti alla stima precedente.
Abbiamo ripetuto le analisi primarie delle diagnosi di incidenti utilizzando modelli di regressione dei rischi concorrenti, con tutti i casi di mortalità come rischio concorrente. 22 Abbiamo trovato che l’inclusione della mortalità come rischio concorrente alterava solo leggermente le associazioni (vedi tabella supplementare 9), suggerendo che i risultati primari presentati dai modelli di regressione dei rischi proporzionali di Cox sono affidabili e non distorti dall’inclusione dei partecipanti che sono morti nel gruppo censurato.
Abbiamo indagato se le associazioni HFE p.C282Y con malattie specifiche potrebbero essere dovute alla co-localizzazione statistica con altre varianti genetiche nella regione (vedi metodi supplementari). Nessuna prova forte ha supportato un probabile ruolo causale per altre varianti, anche se cinque dei sette potenziali candidati non sono stati direttamente genotipizzati, quindi un ulteriore lavoro può essere giustificato (vedi risultati supplementari).
Poiché non erano disponibili misure della saturazione della transferrina, abbiamo modellato le associazioni di varianti genetiche correlate alla saturazione della transferrina con diagnosi che utilizzano approcci di randomizzazione mendeliana (tabelle supplementari 10 e 11). Negli uomini, l’aumento della saturazione della transferrina geneticamente strumentata (riportato da Allen et al23) è stato associato all’emocromatosi incidente (la varianza inversa ponderata β=0,15, P<0.001), malattie del fegato (β=0,016, P=0,005), cancro al fegato (β=0,047, P<0,001), osteoartrite (β=0,012, P=0,005), osteoporosi (β=0,015, P=0,02), ma non diabete (tipo 1 o 2: β=0,006, P=0,06). Nelle donne, l’aumento della saturazione della transferrina geneticamente strumentata è stato associato ad emocromatosi incidente (β=0,25, P<0,001) e osteoartrite (β=0,015, P=0,002). Le associazioni sono state coerenti nelle analisi di sensibilità. I risultati completi sono disponibili nella tabella supplementare 11, e le figure supplementari 8-14 mostrano i singoli genotipi HFE tracciate contro il rischio di malattia incidente. È necessaria cautela nell’interpretazione di questi risultati in quanto i metodi potrebbero non applicarsi ai livelli estremi di saturazione della transferrina visti nei genotipi HFE (ad esempio, Allen et al23 hanno riportato una saturazione media della transferrina del 73% negli omozigoti maschi p.C282Y rispetto al 30% nei maschi senza mutazioni p.C282Y; cioè, più di 40 deviazioni standard al di sopra della media per il genotipo di tipo selvatico).
Infine, per esplorare ulteriormente la rilevanza per la pratica clinica quotidiana nel Regno Unito, abbiamo stimato le proporzioni dei casi di ciascuna condizione che si sono verificati in uomini e donne omozigoti p.C282Y. Negli uomini, l’1,59% di tutte le sostituzioni dell’anca al basale erano in omozigoti p.C282Y. Durante il follow-up il 5,82% di tutti i tumori del fegato incidente nel campione studiato della Biobanca del Regno Unito si è verificato negli omozigoti p.C282Y (vedi tabella supplementare 4), l’1,45% delle malattie epatiche incidente, l’1,40% dell’osteoporosi incidente, 1.Il 12% dell’osteoartrite incidente, lo 0,89% del diabete incidente (tipo 1 o 2), lo 0,86% dell’artrite reumatoide incidente, e lo 0,67% della polmonite incidente nel campione di UK Biobank studiato si è verificato in omozigoti maschi p.C282Y.
Discussione
Le prove precedenti hanno suggerito che la penetrazione nella malattia nell’emocromatosi ereditaria a più alto rischio di emocromatosi HFE p.C282Y era comune tra i membri della famiglia degli omozigoti p.C282Y, ma la penetrazione nei campioni della comunità è risultata essere bassa. Abbiamo studiato un ampio campione di volontari della comunità con sede nel Regno Unito di età compresa tra i 40 e i 70 anni alla linea di base, con un follow-up medio di sette anni. p.C282Y uomini omozigoti di età compresa tra i 40 e i 70 anni avevano un sostanziale eccesso di morbilità alla linea di base in diversi sistemi corporei tipicamente affetti da emocromatosi, con una maggiore prevalenza di emocromatosi stessa, diabete, artrite reumatoide, osteoartrite e malattie epatiche rispetto a persone senza mutazioni p.C282Y. Nelle analisi prospettiche durante il follow-up, lo stato omozigote p.C282Y è stato anche associato a una sostanziale morbilità incidente sia negli uomini che nelle donne: il 15,7% degli uomini ha sviluppato almeno un’emocromatosi incidente, diabete, artrite o malattia epatica rispetto al 5,0% negli uomini senza mutazioni p.C282Y, con le rispettive stime per le donne del 10,1% e del 3,4%. Questi tassi di incidenza da soli indicano che la penetrazione della malattia diagnosticata negli omozigoti p.C282Y non era insolita nel nostro campione comunitario. Abbiamo anche trovato un aumento nominalmente significativo della mortalità negli omozigoti p.C282Y nel complesso (nonostante la ridotta prevalenza di malattia coronarica negli uomini), anche se il numero di decessi è stato piccolo. L’eccesso di morbilità con gli altri genotipi studiati (p.C282Y eterozigote, p.C282Y/p.H63D genotipo composito) è stato modesto, anche se questi genotipi sono stati associati a diagnosi di emocromatosi in eccesso.
Limitazioni e confronti con studi precedenti
Sebbene la UK Biobank sia un campione volontario, la nostra prevalenza osservata di eterozigoti p.C282Y (14,3% nella UK Biobank) è simile al 14,1% di un gruppo di discendenza prevalentemente britannica o irlandese in Australia. 24 I nostri risultati sono ampiamente coerenti con quelli di Asberg et al,25 che hanno studiato i livelli di saturazione della transferrina nei 65-238 norvegesi (età media 49 anni) in un’indagine sanitaria basata sulla popolazione e hanno trovato lo stato omozigote p.C282Y in 171 uomini (prevalenza della popolazione 0,68%) e 126 donne (prevalenza 0,41%) con evidenza sierologica di sovraccarico di ferro. Complessivamente, il 57% di questi uomini e il 52% di queste donne omozigote p.C282Y aveva aumentato le concentrazioni di alanina aminotransferasi (suggerendo un coinvolgimento epatico), oltre ad affaticamento, dolori articolari, impotenza (uomini) o diabete mellito, con dolori articolari presenti solo nel 20,3% degli uomini e nel 13,0% delle donne. Altri dati rappresentativi di una vasta popolazione campione sugli esiti sanitari di p.C282Y sono limitati, con il più grande studio (HEIRS9) che esamina i genotipi in 99-711 partecipanti nordamericani provenienti dalle pratiche di assistenza primaria e dai laboratori di prelievo del sangue (età media 50 anni, n=299 p.C282Y omozigoti). HEIRS ha trovato solo un’associazione tra lo stato omozigote p.C282Y e qualsiasi malattia del fegato negli uomini. Beutler et al9 hanno studiato 41-38 individui che avevano scelto di frequentare le cliniche di valutazione della salute offerte dalla Kaiser Permanente in California, con i 152 omozigoti p.C282Y che avevano solo un eccesso di “problemi al fegato” o epatite, e gli autori hanno concluso una “migliore stima” che meno dell’1% degli omozigoti sviluppano “franca emocromatosi clinica”.”Anche i più grandi studi precedenti contenevano un numero relativamente piccolo di individui omozigoti p.C282Y rispetto alla UK Biobank (n=2890 contro HEIRS9 n=299, Kaiser Permanente n=152), limitando la loro potenza statistica per rilevare diagnosi in eccesso: per esempio, Beutler et al10 avevano solo il 19% di potenza a P=0.05 per rilevare la nostra associazione omozigote maschile p.C282Y con il diabete (odds ratio 1,44 in UK Biobank) nel loro campione di 56 uomini omozigoti p.C282Y. Nell’analisi della UK Biobank sul diabete incidente, abbiamo avuto l’80% di potere di rilevare un rapporto di probabilità di 1,034 nel nostro campione di 1281 uomini omozigoti p.C282Y rispetto a 174-760 controlli rispetto ai controlli senza mutazioni p.C282Y (n=6358 casi incidenti contro 169-683 controlli), con P<0,05.
Molti studi più piccoli26 hanno esaminato le associazioni p.C282Y utilizzando una metodologia diversa e con risultati diversi, con una penetranza clinica complessiva bassa nella predominante eterozigote p.C282Y studiata. Abbiamo anche trovato una bassa incidenza di emocromatosi associata diagnosi di emocromatosi con p.C282Y stato eterozigote solo (rispetto a nessuna mutazione p.C282Y, escludendo p.C282Y omozigoti). Abbiamo trovato una modesta associazione tra il genotipo eterozigote composto p.C282Y/p.H63D e l’eccesso di morbilità incidente negli uomini di età compresa tra i 40 e i 49 anni. È necessario un ulteriore lavoro per stabilire se questa associazione si replica in altre popolazioni e se i fattori interagenti aumentano il rischio di malattia in questo e negli altri genotipi. I nostri risultati hanno incluso un’associazione nominalmente significativa con la mortalità nel gruppo omozigote p.C282Y maschile e femminile combinati, anche se questo si basava su soli 107 decessi: studi precedenti hanno riportato un aumento della mortalità in pazienti con emocromatosi ereditaria e malattia epatica, ma non altrimenti. 2728 Il cancro al fegato è stato registrato sui certificati di morte di 14 dei 107 deceduti omozigoti p.C282Y nel nostro studio. Nell’analisi di specifiche diagnosi di incidenti abbiamo tenuto conto di questa mortalità differenziale utilizzando analisi di rischio concorrenti in un’analisi di sensibilità: questo ha fatto poca differenza per i risultati, probabilmente a causa del numero relativamente piccolo di decessi.
Un aspetto benefico dello stato omozigote p.C282Y è la nostra scoperta che la prevalenza della malattia coronarica è stata ridotta negli uomini, così come l’uso di farmaci per l’abbassamento del colesterolo sia negli uomini che nelle donne di età compresa tra i 40 e i 70 anni. Questo è coerente con i bassi livelli di colesterolo a bassa densità di lipoproteine precedentemente riportati728 in p.C282Y omozigoti. Miller e Hutchins29 trovato una ridotta prevalenza di malattia coronarica in pazienti con emocromatosi. In un’analisi di randomizzazione mendeliana, Gill et al30 hanno recentemente trovato che livelli di ferro geneticamente determinati più elevati erano associati a un ridotto rischio di malattia coronarica (anche se dati separati sugli omozigoti HFE p.C282Y non sono stati modellati). Un’ulteriore applicazione dell’analisi di randomizzazione mendeliana potrebbe aiutare a chiarire il contributo dei livelli di ferro ad altre morbilità studiate.
Altri limiti delle nostre analisi includono che i volontari della UK Biobank tendevano ad essere più sani della popolazione generale21 alla linea di base. Inoltre, è possibile che i tassi di risposta alla biobanca britannica siano stati influenzati dallo stato di mutazione HFE o dalla morbilità associata. Come notato, la prevalenza complessiva di omozigosi p.C282Y (1 su 156) è stata simile ai precedenti rapporti per gruppi di discendenza britannica o irlandese, e la variante p.C282Y era in equilibrio Hardy-Weinberg (P>0,05) nella UK Biobank, il che implica che i genotipi osservati sono presenti nelle proporzioni previste, senza alcun segno di perdita differenziale o di eccesso di omozigoti p.C282Y. Ancora più importante, abbiamo trovato alti tassi di emocromatosi incidente associato diagnosi di emocromatosi con p.C282Y omozigoti durante il periodo di follow-up, dopo aver escluso le persone con diagnosi prevalenti al basale. Il campione della Biobanca del Regno Unito comprendeva un’ampia gamma di esposizioni e gruppi socioeconomici diversi,21 e le analisi prospettiche sono molto meno influenzate dai modelli di risposta del campione al basale. Questi fattori e la somiglianza dei nostri risultati con il campione di popolazione norvegese di Asberg et al25 suggeriscono che i nostri risultati sono solidi e probabilmente applicabili alla popolazione del Regno Unito e ad altre popolazioni di origine europea.
Il campione della Biobanca del Regno Unito comprendeva alcune serie di persone imparentate, valutate attraverso la somiglianza delle varianti a livello di genoma (coefficiente di parentela KING). Nelle nostre stime degli incidenti, abbiamo escluso quelli con diagnosi di emocromatosi esistenti al basale e abbiamo trovato che i risultati erano simili sia che includessimo o escludessimo parenti fino al terzo grado (vedi analisi di sensibilità e tabella supplementare 6). Tuttavia, la Biobanca del Regno Unito non dispone di dati che indichino se ciascun partecipante alla Biobanca del Regno Unito, imparentato o meno, provenisse da una famiglia con una forte storia di diagnosi di emocromatosi.
Per le diagnosi di incidenti, abbiamo utilizzato modelli di regressione del rischio concorrenti che tengono conto del rischio di mortalità concorrente nelle analisi di sensibilità, poiché molte persone ricevono una diagnosi di emocromatosi solo in età avanzata, quando la mortalità di fondo è sostanziale (si veda ad esempio lo studio clinico della biobanca eMERGE31 in sette centri medici nordamericani), anche se le stime che utilizzano la semplice regressione di Cox hanno dato risultati simili (si vedano le informazioni supplementari). Abbiamo utilizzato modelli di regressione proporzionale dei pericoli per le stime di incidenza, che presuppongono che i pericoli non variano nel tempo. I test di questa ipotesi sono risultati negativi per tutti i risultati esaminati, con una sola eccezione: il diabete negli uomini, che ha mostrato pochi casi negli omozigoti p.C282Y durante i primi due anni (vedi informazioni supplementari). Dopo aver escluso i primi due anni di dati, l’associazione tra omozigotismo p.C282Y e diabete incidente non presentava più una violazione significativa dell’ipotesi di rischio proporzionale. Nel complesso, quindi, non abbiamo trovato alcuna evidenza di un eccesso di morbilità negli omozigoti p.C282Y nei primi anni di follow-up, come potrebbe accadere se queste persone avessero maggiori probabilità di partecipare a questo studio genetico volontario a causa della morbilità preesistente.
La nostra analisi manca di misure di sovraccarico di ferro. Le concentrazioni di ferritina nel siero sono aumentate nell’80% degli uomini (>300 µg/L) e nel 50% delle donne (>200 µg/L) con omozigotismo p.C282Y. 32 In una coorte di popolazione australiana di età media di 65 anni, l’evidenza sierologica di sovraccarico di ferro (ferritina sierica ≥1000 μg/L, considerata grave dagli autori originali) è stata riscontrata nel 35% degli uomini e nel 6% delle donne con omozigoti p.C282Y. 23 In uno studio su pazienti genotipizzati in biobanche cliniche eMERGE in sette sistemi sanitari statunitensi,31 il 100% dei maschi e il 50% delle femmine omozigoti p.C282Y presentava saturazioni di transferrina superiori al 50%. Livelli più elevati di deposizione di ferro con genotipi HFE sono stati riportati anche nei risultati preliminari dei sottogruppi della UK Biobank sia per l’imaging del fegato (con sette degli otto omozigoti studiati p.C282Y con evidenza di sovraccarico di ferro33) che con il genotipo HFE per la deposizione di ferro in alcune regioni cerebrali. 34 Il lavoro futuro, che include misure relative al ferro nel siero, potrebbe aiutare a identificare i fattori che influenzano il motivo per cui alcuni omozigoti p.C282Y sviluppano una malattia associata, ma non altri, e potrebbe anche aiutare a informare gli studi traslazionali per migliorare la diagnosi.
Siamo stati in grado di studiare principalmente le diagnosi cliniche, ma sono state riportate diagnosi errate di malattia correlata al ferro, ad esempio, con la diagnosi errata di artrosi correlata alla deposizione di ferro come osteoartrite o artrite reumatoide. 35 Tuttavia, i nostri risultati per le associazioni di omozigoti p.C282Y con le diagnosi muscoloscheletriche36 (tra cui l’artrite16173738 , la sostituzione dell’anca e l’osteoporosi) sono coerenti con i rapporti precedenti. Poiché il follow-up è attualmente limitato nella durata e non include le diagnosi registrate per le cure primarie, le nostre stime dell’eccesso di morbilità sono probabilmente prudenti.
Abbiamo evitato l’aggiustamento per i confonditori comunemente esaminati negli studi osservazionali, come il fumo, la dieta o l’esercizio fisico, in quanto i genotipi studiati sono ereditati al momento del concepimento e non sono alterati dall’esposizione successiva. Come p.C282Y uomini e donne omozigoti avevano più artrite alla linea di base, non sarebbe sorprendente se hanno quindi fatto meno esercizio fisico, e l’adeguamento per tali effetti a valle potrebbe influenzare i risultati. Invece abbiamo fornito analisi di sensibilità sull’assunzione di alcol, come il principale studiato in precedenza che modifica l’esposizione.
L’aggiustamento per i test statistici multipli è particolarmente importante quando si esaminano molte associazioni statistiche per verificare la presenza di esiti non correlati e con basse probabilità che le associazioni siano presenti in precedenza. Tuttavia, la nostra analisi è essenzialmente una replica di precedenti studi simili. La deposizione di ferro in eccesso nell’emocromatosi ereditaria provoca un danno diffuso al tessuto parenchimale, portando a diverse diagnosi diverse attraverso il meccanismo comune dell’accumulo di ferro. 15 È inoltre stabilito che l’incidenza dell’emocromatosi è più alta negli uomini che nelle donne e che aumenta con l’avanzare dell’età. Vi sono ampie evidenze di associazioni dei confronti studiati nei pazienti con emocromatosi o con il genotipo p.C282Y, o entrambi, per cui le probabilità precedenti erano elevate, anche se non quantificate in un ampio campione di comunità. Per affrontare ulteriormente i test multipli abbiamo selezionato solo le condizioni verificabili precedentemente legate all’emocromatosi, abbiamo identificato chiaramente le analisi di sensibilità post hoc e abbiamo fornito una stima sommaria di tutte le diagnosi di incidenti in eccesso. Abbiamo anche riportato i valori P corretti di Benjamini-Hochberg per quantificare la significatività dei test multipli corretti: sono necessari maggiori dati soprattutto sulle associazioni che non erano più significative.
Implicazioni cliniche e politiche
Precedenti studi a livello comunitario su persone omozigoti per p.C282Y hanno suggerito una bassa penetrazione, con Beutler et al10 che stimano che meno dell’1% sviluppa “emocromatosi clinica franca”. In UK Biobank, l’emocromatosi è stata infine diagnosticata nel 21,7% degli omozigoti p.C282Y maschili e nel 9,8% delle donne p.C282Y, alla fine del follow-up. Questi tassi diagnostici sono paragonabili allo studio clinico della biobanca eMERGE31 condotto in sette centri medici nordamericani, che ha rilevato che complessivamente il 24,4% degli uomini e il 14,0% delle donne p.C282Y omozigoti p.C282Y aveva una diagnosi di emocromatosi (n=106, età media della diagnosi 61,5 anni). È interessante notare che le curve di sopravvivenza alla diagnosi in eMERGE suggeriscono che all’età di 90 anni, quasi il 50% degli uomini e circa il 25% delle donne p.C282Y omozigoti avevano una diagnosi di emocromatosi. È chiaro quindi che l’emocromatosi diagnosticata clinicamente alla fine si sviluppa in grandi proporzioni di omozigoti p.C282Y.
La flebotomia e altri interventi di riduzione del ferro sono efficaci per migliorare gli esiti clinici5 in soggetti con alti livelli di ferro, soprattutto se avviati prima dello sviluppo delle patologie correlate: una volta accertate le patologie, l’efficacia è limitata, soprattutto per l’artrosi. Inoltre, un recente studio randomizzato39 che utilizzava l’eritrocitaferesi in omozigoti p.C282Y con concentrazioni di ferritina sierica moderatamente aumentate ha riportato miglioramenti nella stanchezza del paziente, con pochi eventi avversi. Sembra probabile che l’intervento prima dello sviluppo di patologie negli omozigoti p.C282Y nella comunità possa prevenire un onere sostanziale di morbilità in eccesso.
Lavoro futuro
È necessario un ulteriore lavoro per confermare le associazioni omozigote p.C282Y con la mortalità su follow-up più lunghi, con un’ulteriore chiarificazione delle cause di morte. È inoltre necessario un lavoro per stabilire se si sviluppa una morbilità in eccesso ancora maggiore in età più avanzata rispetto a quella studiata in questa sede, soprattutto nelle donne, con l’aumentare del tempo trascorso dalla menopausa. Anche gli studi su larga scala degli omozigoti p.C282Y, che includono misure dirette dello stato del ferro, potrebbero aiutare a identificare ulteriori fattori di rischio e a migliorare la previsione dei risultati. Sono inoltre necessari ulteriori dati sulla morbilità associata alle varianti HFE a basso rischio. Sono necessarie ulteriori analisi per identificare possibili varianti aggiuntive che contribuiscono alla penetrazione dell’emocromatosi e ulteriori analisi della co-localizzazione statistica potrebbero aiutare a distinguere le varianti causali condivise e distinte per ciascuna delle varie manifestazioni cliniche dell’emocromatosi.
È necessario un ulteriore lavoro per stabilire se i livelli di colesterolo a bassa densità di lipoproteine aumentano dopo l’intervento di riduzione del ferro e se il rischio di malattia coronarica può essere mantenuto basso con le statine e altri interventi preventivi. Potrebbe essere che la prevenzione della malattia coronarica potrebbe sostituire l’effetto benefico di livelli di ferro più elevati sugli esiti della malattia coronarica in omozigoti p.C282Y, smascherando tutti gli effetti dannosi dell’accumulo di ferro sulla sopravvivenza.
Sebbene l’emocromatosi ereditaria sia considerata adatta a diversi criteri per lo screening genetico10 , la bassa penetrazione clinica precedentemente riportata nei portatori di p.C282Y non giustificava lo screening al di là dei parenti stretti. Alla luce delle prove accumulate che la penetranza alla morbilità clinicamente diagnosticata negli omozigoti p.C282Y non è rara e che molti casi vengono tralasciati o diagnosticati solo dopo che si è sviluppata una sostanziale morbilità, è necessario un maggiore lavoro per valutare i vari approcci possibili per migliorare la prevenzione e l’accertamento precoce dei casi. Le questioni da valutare includono le varie opzioni per i test (ad esempio, con i test iniziali di ferritina sierica o di saturazione della transferrina, o forse attraverso la genotipizzazione iniziale), e le diverse popolazioni o gruppi di pazienti che potrebbero essere presi di mira.
Conclusioni
Nel grande campione della comunità della biobanca britannica, gli omozigoti HFE p.C282Y hanno registrato un sostanziale eccesso di prevalenza e di morbilità clinica incidente. Questo eccesso di morbilità era più evidente negli uomini, ma era presente anche nelle donne, ed era più comune con l’avanzare dell’età. Poiché il sovraccarico di ferro associato a p.C282Y è prevenibile e in parte curabile, è giustificato il riesame dei molti aspetti legati alla raccomandazione di un accertamento precoce esteso del caso o di uno screening.
Ciò che è già noto su questo argomento
- La mutazione omozigote HFE p.C282Y è la causa principale del disturbo da sovraccarico di ferro ereditario emocromatosi (tipo 1) nelle popolazioni di origine europea.
- Il sovraccarico di ferro è prevenibile e in parte curabile con la venezione, ma la diagnosi è spesso mancata o ritardata
- Studi comunitari hanno riportato una bassa penetrazione, con una segnalazione che meno dell’1% degli omozigoti p.C282Y ha sviluppato un’emocromatosi clinica franca
Cosa aggiunge questo studio
- Combinando la diagnosi di base e quella incidente (età media 63,8 anni), 1 maschio su 5 in più di omozigoti p.C282Y è stato diagnosticato come avente una o più emocromatosi, qualsiasi malattia del fegato, diabete mellito, artrite reumatoide o osteoartrite, rispetto a quelle senza mutazioni (ignorando p.H63D)
- Nelle donne, 1 su 10 morbilità più sviluppata
- Le questioni relative all’offerta di screening e al miglioramento dell’accertamento precoce dei casi per gli omozigoti p.C282Y devono essere riesaminate
References
- Adams PC. Epidemiology and diagnostic testing for hemochromatosis and iron overload. Int J Lab Hematol. 2015; 37(Suppl 1):25-30. DOI | PubMed
- Hollerer I, Bachmann A, Muckenthaler MU. Pathophysiological consequences and benefits of HFE mutations: 20 years of research. Haematologica. 2017; 102:809-17. DOI | PubMed
- Bomford A. Genetics of haemochromatosis. Lancet. 2002; 360:1673-81. DOI | PubMed
- Steinberg KK, Cogswell ME, Chang JC. Prevalence of C282Y and H63D mutations in the hemochromatosis (HFE) gene in the United States. JAMA. 2001; 285:2216-22. DOI | PubMed
- Powell LW, Seckington RC, Deugnier Y. Haemochromatosis. Lancet. 2016; 388:706-16. DOI | PubMed
- Khan FA, Fisher MA, Khakoo RA. Association of hemochromatosis with infectious diseases: expanding spectrum. Int J Infect Dis. 2007; 11:482-7. DOI | PubMed
- Adams PC, Pankow JS, Barton JC. HFE C282Y homozygosity is associated with lower total and low-density lipoprotein cholesterol: The hemochromatosis and iron overload screening study. Circ Cardiovasc Genet. 2009; 2:34-7. DOI | PubMed
- Jacobs EMG, Hendriks JCM, Marx JJM. Morbidity and mortality in first-degree relatives of C282Y homozygous probands with clinically detected haemochromatosis compared with the general population: the HEmochromatosis FAmily Study (HEFAS). Neth J Med. 2007; 65:425-33. PubMed
- Adams PC, Reboussin DM, Barton JC, Hemochromatosis and Iron Overload Screening (HEIRS) Study Research Investigators. Hemochromatosis and iron-overload screening in a racially diverse population. N Engl J Med. 2005; 352:1769-78. PubMed
- Beutler E, Felitti VJ, Koziol JA, Ho NJ, Gelbart T. Penetrance of 845G–> A (C282Y) HFE hereditary haemochromatosis mutation in the USA. Lancet. 2002; 359:211-8. DOI | PubMed
- Grosse SD, Gurrin LC, Bertalli NA, Allen KJ. Clinical penetrance in hereditary hemochromatosis: estimates of the cumulative incidence of severe liver disease among HFE C282Y homozygotes. Genet Med. 2018; 20:383-9. DOI | PubMed
- Burke W, Thomson E, Khoury MJ. Hereditary hemochromatosis: gene discovery and its implications for population-based screening. JAMA. 1998; 280:172-8. DOI | PubMed
- U.S. Preventive Services Task Force. Screening for hemochromatosis: recommendation statement. Ann Intern Med. 2006; 145:204-8. PubMed
- Waalen J, Felitti V, Gelbart T, Ho NJ, Beutler E. Penetrance of hemochromatosis. Blood Cells Mol Dis. 2002; 29:418-32. DOI | PubMed
- Mohamed M, Phillips J. Hereditary haemochromatosis. BMJ. 2016; 353:i3128. DOI | PubMed
- Elmberg M, Hultcrantz R, Simard JF, Carlsson Å, Askling J. Increased risk of arthropathies and joint replacement surgery in patients with genetic hemochromatosis: a study of 3,531 patients and their 11,794 first-degree relatives. Arthritis Care Res (Hoboken). 2013; 65:678-85. DOI | PubMed
- Wang Y, Gurrin LC, Wluka AE. HFE C282Y homozygosity is associated with an increased risk of total hip replacement for osteoarthritis. Semin Arthritis Rheum. 2012; 41:872-8. DOI | PubMed
- Valenti L, Varenna M, Fracanzani AL, Rossi V, Fargion S, Sinigaglia L. Association between iron overload and osteoporosis in patients with hereditary hemochromatosis. Osteoporos Int. 2009; 20:549-55. DOI | PubMed
- Benyamin B, Esko T, Ried JS, InterAct Consortium. Novel loci affecting iron homeostasis and their effects in individuals at risk for hemochromatosis. Nat Commun. 2014; 5:4926. DOI | PubMed
- Sudlow C, Gallacher J, Allen N. UK biobank: an open access resource for identifying the causes of a wide range of complex diseases of middle and old age. PLoS Med. 2015; 12:e1001779. DOI | PubMed
- Fry A, Littlejohns TJ, Sudlow C. Comparison of Sociodemographic and Health-Related Characteristics of UK Biobank Participants With Those of the General Population. Am J Epidemiol. 2017; 186:1026-34. DOI | PubMed
- Fine JP, Gray RJ. A Proportional Hazards Model for the Subdistribution of a Competing Risk. J Am Stat Assoc. 1999; 94:496-509. DOI
- Allen KJ, Gurrin LC, Constantine CC. Iron-overload-related disease in HFE hereditary hemochromatosis. N Engl J Med. 2008; 358:221-30. DOI | PubMed
- Olynyk JK, Cullen DJ, Aquilia S, Rossi E, Summerville L, Powell LW. A population-based study of the clinical expression of the hemochromatosis gene. N Engl J Med. 1999; 341:718-24. DOI | PubMed
- Asberg A, Hveem K, Thorstensen K. Screening for hemochromatosis: high prevalence and low morbidity in an unselected population of 65,238 persons. Scand J Gastroenterol. 2001; 36:1108-15. DOI | PubMed
- European Association For The Study Of The Liver. EASL clinical practice guidelines for HFE hemochromatosis. J Hepatol. 2010; 53:3-22. DOI | PubMed
- Adams PC, Speechley M, Kertesz AE. Long-term survival analysis in hereditary hemochromatosis. Gastroenterology. 1991; 101:368-72. DOI | PubMed
- Pankow JS, Boerwinkle E, Adams PC. HFE C282Y homozygotes have reduced low-density lipoprotein cholesterol: the Atherosclerosis Risk in Communities (ARIC) Study. Transl Res. 2008; 152:3-10. DOI | PubMed
- Miller M, Hutchins GM. Hemochromatosis, multiorgan hemosiderosis, and coronary artery disease. JAMA. 1994; 272:231-3. DOI | PubMed
- Gill D, Del Greco M F, Walker AP, Srai SKS, Laffan MA, Minelli C. The Effect of Iron Status on Risk of Coronary Artery Disease: A Mendelian Randomization Study-Brief Report. Arterioscler Thromb Vasc Biol. 2017; 37:1788-92. PubMed
- Gallego CJ, Burt A, Sundaresan AS. Penetrance of Hemochromatosis in HFE Genotypes Resulting in p.Cys282Tyr and p.[Cys282Tyr];[His63Asp] in the eMERGE Network. Am J Hum Genet. 2015; 97:512-20. DOI | PubMed
- Adams PC, Barton JC. Haemochromatosis. Lancet. 2007; 370:1855-60. DOI | PubMed
- McKay A, Willman H, Dennix A. UK Biobank Study of Liver Iron Overload Shows Variable Penetrance of different genotypes. Hepatology. 2017; 66:A433-4.
- Elliott LT, Sharp K, Alfaro-Almagro F. Genome-wide association studies of brain imaging phenotypes in UK Biobank. Nature. 2018; 562:210-6. PubMed
- Husar-Memmer E, Stadlmayr A, Datz C, Zwerina J. HFE-related hemochromatosis: an update for the rheumatologist. Curr Rheumatol Rep. 2014; 16:393. DOI | PubMed
- Guggenbuhl P, Brissot P, Loréal O. Miscellaneous non-inflammatory musculoskeletal conditions. Haemochromatosis: the bone and the joint. Best Pract Res Clin Rheumatol. 2011; 25:649-64. DOI | PubMed
- Sahinbegovic E, Dallos T, Aigner E. Musculoskeletal disease burden of hereditary hemochromatosis. Arthritis Rheum. 2010; 62:3792-8. DOI | PubMed
- Donnelly SC, Joshi NG, Thorburn D. Prevalence of genetic haemochromatosis and iron overload in patients attending rheumatology and joint replacement clinics. Scott Med J. 2010; 55:14-6. DOI | PubMed
- Ong SY, Gurrin LC, Dolling L. Reduction of body iron in HFE-related haemochromatosis and moderate iron overload (Mi-Iron): a multicentre, participant-blinded, randomised controlled trial. Lancet Haematol. 2017; 4:e607-14. PubMed
Fonte
Pilling LC, Tamosauskaite J, Jones G, Wood AR, Jones L, et al. (2019) Common conditions associated with hereditary haemochromatosis genetic variants: cohort study in UK Biobank. The BMJ 364k5222. https://doi.org/10.1136/bmj.k5222





