Abstract
Introduzione
Diversi lignaggi di cani (famiglia Canidae) e iene (famiglia Hyaenidae) hanno sviluppato in modo indipendente sorprendenti adattamenti schiacciaossa, come crani altamente robusti, mascelle, denti e ampie aree di attacco per potenti muscoli masticatori. Queste morfologie altamente specializzate di schiacciamento delle ossa sono probabilmente associate alla caccia sociale (Van Valkenburgh e Koepfli, 1993; Van Valkenburgh et al., 2003), come meglio esemplificato dalla iena maculata vivente (Kruuk, 1972). Le iene maculate cacciano e si nutrono in gruppo, hanno un sistema gastrointestinale in grado di scomporre grandi quantità di ossa consumate e di scaricare feci ad alto contenuto di carbonato (Macdonald, 1978; Estes, 1991; Hulsman et al., 2010). Se i canidi estinti, simili a quelli della iena, consumassero una quantità paragonabile di ossa – e, in caso affermativo, come queste ossa vengono elaborate all’interno del loro sistema gastrointestinale – rimangono questioni irrisolvibili per mancanza di prove fossili. Queste domande sono affrontate direttamente in questo studio con la prima scoperta di coproliti (feci fossilizzate) da uno degli archetipi dei cani mangiaossa, il Borofago. I borofagini sono un gruppo di carnivori con tratti morfologici craniodentali altamente specializzati, indicativi di un adattamento alla rottura delle ossa, e sono stati a lungo riconosciuti come un membro terminale della sottofamiglia Borophaginae che si è estinta poco prima dell’inizio delle glaciazioni in Nord America (Wang et al., 1999). Pertanto, la comprensione della paleoecologia di questi top predatori ha importanti implicazioni per la ricostruzione delle dinamiche comunitarie nel continente prima dell’estinzione dei megafaoni e dell’abitazione umana.
Abbiamo analizzato un nuovo campione di coproliti recentemente scoperto dalla Formazione di Mehrten (ultimo Miocene, 5.3-6.4 Ma) nella Contea di Stanislaus, California. Numerosi frammenti ossei sulla superficie esterna e all’interno dei coproliti suggeriscono fortemente che sono stati prodotti da Borophagus, che è ampiamente rappresentato da fossili del corpo nella stessa area di produzione di fossili, offrendo così una rara opportunità per esaminare direttamente la dieta di un estinto osso schiacciare predatore top. Nonostante i miglioramenti nella nostra comprensione della biomeccanica della convergenza funzionale degli adattamenti craniodentali tra ienidi eurasiatici-africani e canidi borofagini nordamericani (Werdelin, 1989; Tseng e Wang, 2010; Tseng e Wang, 2011), inferenze alimentari sono state fatte in precedenza solo dalle ossa fossilizzate di questi predatori. La scoperta di coproliti offre così il primo sguardo nel cibo ingerito ed escreto da questi ‘cani ienoidi’ (Simpson, 1945), così come diversi tratti legati al loro comportamento territoriale, la caccia sociale, e la digestione delle ossa che erano precedentemente inavvicinabili. Questo studio esamina 14 coproliti recuperati da due località della zona del lago Turlock, così come il loro presunto produttore, Borophagus parvus. Le nostre scoperte forniscono nuove intuizioni sulla paleoecologia di questo gruppo di predatori di punta e perfezionano la loro posizione nella rete alimentare alla fine dell’Epoca del Miocene in Nord America.
Abbreviazioni istituzionali
F:AM Frick Collection of the American Museum of Natural History, New York, New York; FMNH, Field Museum of Natural History, Chicago, Illinois; LACM, Natural History Museum of Los Angeles County, Los Angeles, California; UCMP, Museum of Paleontology at University of California, Berkeley, California.
Risultati e discussione
Produttore di coproliti di Mehrten
Il gran numero di ossa all’interno della maggior parte dei coproliti di Mehrten esclude gli erbivori come loro produttori. La dimensione dei coproliti indica inoltre che i grandi carnivori sono i loro produttori originali. Per i carnivori di medie e grandi dimensioni della Formazione di Mehrten, Wagner (1976, 1981) ha elencato un cane schiacciaossa Borophagus secundus (=Osteoborus cyonoides), un piccolo coyote delle dimensioni di Eucyon davisi, un tasso ancestrale Pliotaxidea garberi, un precoce Plesiogulo marshalli, e un gatto ancestrale Pseudaelurus vicino a P. hibbardi. Più recentemente, Balisi et al. (2018) hanno aggiunto una volpe, Vulpes stenognathus, alla lista. Di questi, Vulpes, Eucyon, Pliotaxidea, e Plesiogulo possono essere esclusi in quanto troppo piccoli per produrre scaglie delle dimensioni dei coproliti di Mehrten, mentre la vera natura dei felini di Mehrten è poco conosciuta.
Tra i grandi canidi di Mehrten, Balisi et al. (2018) hanno riconosciuto due canidi schiacciaossa, B. secundus e B. parvus, che sono gli unici taxa a misura di lupo abbastanza grandi da essere i produttori dei coproliti di Mehrten. Di queste due specie, B. secundus è raro, rappresentato da due mascelle e denti frammentari più 1-2 denti di riferimento discutibili, mentre B. parvus è molto meglio rappresentato da 27 esemplari. Nella principale località produttrice di coprolito (vedi Materiali e metodi), la località LACM 3937 (=Dennis Garber T-34), un isolato P2 o P3 (UCMP 235515) è discutibilmente riferito a B. secundus (Balisi et al., 2018), mentre nella località LACM 3935, non si trova alcun carnivoro identificabile (Figura 9).
I coproliti di Mehrten sono paragonabili per dimensioni (Tabella 1) alle scat da lupi esistenti e sono generalmente più grandi di quelli dei coyote viventi, nonostante la significativa sovrapposizione tra i diametri scat dei lupi (media 27 mm, range 13-47 mm) e dei coyote (media 21 mm, range 7-34 mm) (Weaver and Fritts, 1979; Reid, 2015). Nei carnivori africani esistenti, Harrison (2011) ha documentato diametri scat di 20-35 mm di cani da caccia africani, Lycaon pictus, e iena striata, Hyaena hyaena. Pertanto, con un diametro massimo di 31,2 mm, i coproliti di Mehrten sono più probabilmente prodotti da un borofago delle dimensioni di un lupo piuttosto che da un Eucyon delle dimensioni di un coyote o di una volpe. Delle due specie di Mehrten Borophagus, B. parvus è stato il più probabile produttore di coproliti di Mehrten in base alle dimensioni del corpo e alla rappresentazione molto migliore dei fossili del corpo, anche se non si può escludere la possibilità di B. secundus.
Morfologia della coprolite
Adottiamo uno schema modificato per la caratterizzazione dei pellet di aggregati di coprolito ienidici introdotto da Diedrich (2012), ma usiamo terminologie diverse per gli orientamenti (Figura 1A). Anche se la morfologia scat dei lupi e delle iene esistenti può essere in qualche modo diversa – in base alla lunghezza della ritenzione nel tratto digestivo, al contenuto di fibre e acqua delle feci e alla durezza del terreno su cui sono state lasciate cadere le scaglie – i nostri coproliti di Mehrten (Figure 2 e 3) sembrano condividere sostanziali somiglianze con quelli delle iene viventi (Figura 1B). Dei 14 coproliti catalogati individualmente, cinque sono probabilmente una prima caduta a causa del loro terminale smussato su almeno una delle loro estremità e del loro diametro relativamente maggiore (LACM 158707, 158708, 158708, 158709, 158711, e 158712). Tuttavia, solo uno, il LACM 158709, ha la tipica forma di una pallina conica (Figura 1A), anche se il LACM 158707 rappresenta una variante della combinazione di pallina conica e disco che non è riuscita a separarsi dopo la caduta. Il LACM 158708 ha una conicità su entrambe le estremità, suggerendo che la moderna terminologia del pellet di iena di Diedrich (2012) non si applica completamente ai canidi di Mehrten. Il resto dei nove pezzi sono tutti pellet incompleti, e la loro esatta posizione all’interno della stringa di scat è difficile da determinare.
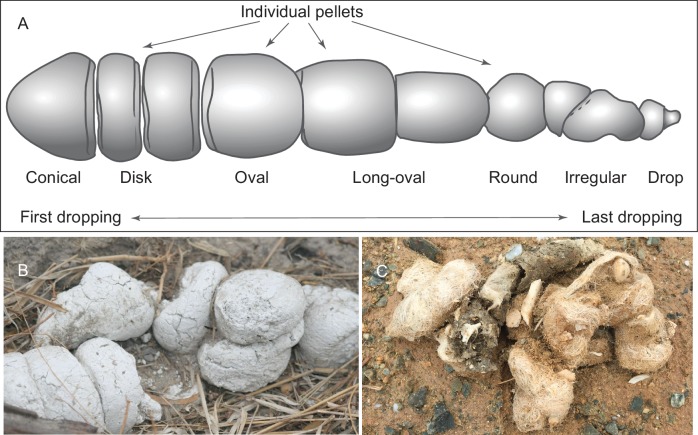
Figura 1.(A) morfologia dei singoli pellet in un assemblaggio completo di feci da un singolo evento di caduta da parte della iena maculata esistente, Crocuta crocuta. Adattato da ([Diedrich, 2012]:Figura 4), ad eccezione dell’orientamento (l’orientamento anteriore/posteriore di Diedrich è in contrasto con il senso tradizionale di anatomia). (B) scatti di iena maculata esistente (immagine fissa riprodotta da un video della rivista Smithsonian, disponibile all’indirizzo http://www.smithsonianmag.com/videos/category/weird-science/weird-science-hyena-poop/?no128ist). (C) immagini di un lupo grigio; si noti la conservazione dei frammenti ossei e dei peli (foto di Xiaoming Wang del 21 settembre 2016 nel bacino di Xorkol, nella regione autonoma di Uygur, nel sud dello Xinjiang, Cina).
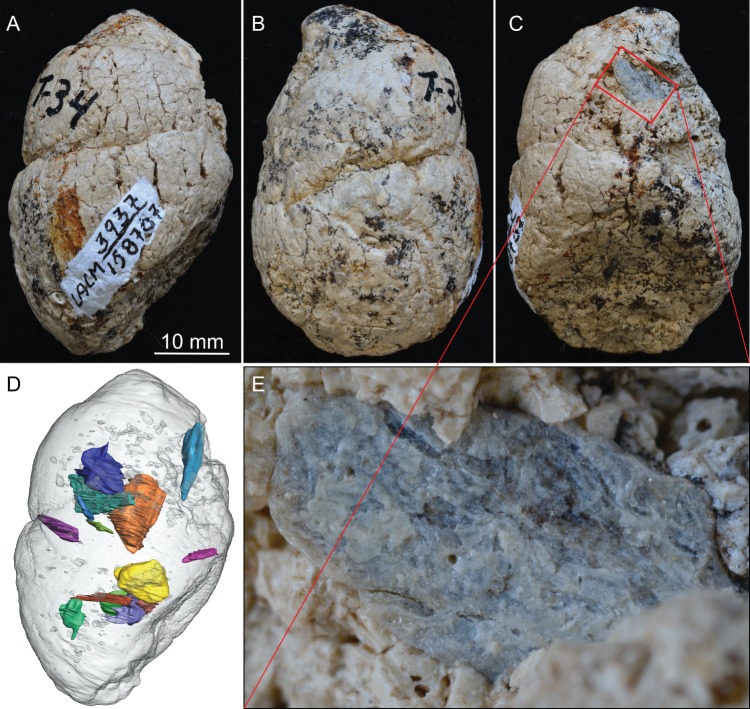
Figura 2.LACM 158707, un coprolito completo della località LACM 3937 (=Turlock Lake 34), Mehrten Formation, Stanislaus County, California, raccolto da Dennis Garber.(A) vista laterale, la parte superiore è verso l’estremità distale (prima caduta); (B) un’altra vista laterale a circa 90° da A; (C) un’altra vista laterale a circa 90° di ulteriore rotazione da B; (D) 14 frammenti ossei (in vari colori) segmentati digitalmente all’interno del coprolito (grigio chiaro) con lo stesso orientamento di A; (E) primo piano di un frammento osseo esposto (non identificato) su C che mostra l’incisione acida (sfaldatura) sulla superficie esterna.Vedere anche il Video 1 per mostrare le relazioni tridimensionali delle singole ossa all’interno di questo coprolito.
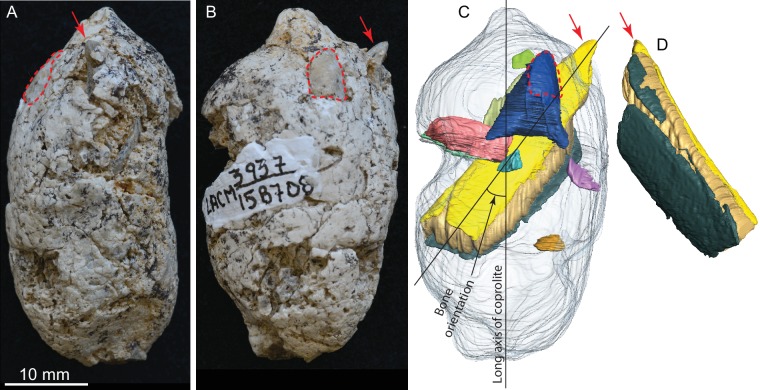
Figura 3.LACM 158708, un coprolito completo e ossa contenute all’interno, dalla località LACM 3937, Mehrten Formation, Stanislaus County, California, raccolte da Dennis Garber.(A) vista laterale, la parte superiore è verso l’estremità distale (prima cadente); (B) un’altra vista laterale a circa 90° da A; (C) singole ossa separate digitalmente (in colori diversi) all’interno della matrice coprolite (grigio chiaro), vista identica a quella di B; (D) una vista ruotata di un frammento di costola visto in C, che mostra il lato convesso (esterno), forme gialle e verde scuro che rappresentano rispettivamente l’interno (verso la cavità toracica) e l’esterno dell’osso corticale, e marrone giallastro incastrato tra le ossa corticali essendo osso cancellous. Frecce rosse indicano la stessa punta sporgente del frammento di costola, e linee tratteggiate rosse definiscono i contorni esposti di un osso piatto (per lo più sepolto all’interno della matrice di coprolito; il pezzo blu scuro in C mostra l’intera estensione di questo osso all’interno della coprolito). Ad eccezione della costola, tutti gli altri frammenti ossei non sono identificabili. Vedere anche il Video 2 e il file di segmentazione Avizo originale (link web) per mostrare le relazioni tridimensionali delle singole ossa all’interno di questo coprolito.
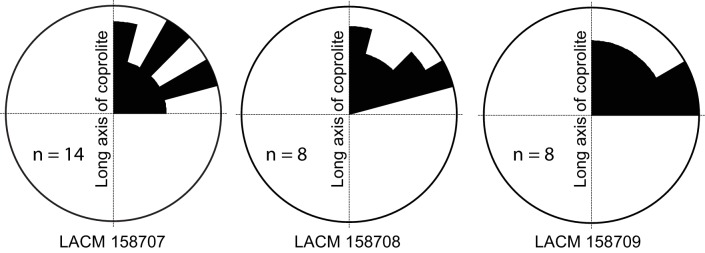
Figura 4.Diagramma a rosa degli orientamenti ossei all’interno dei coproliti.Si presentano solo pellet di coprolito con almeno otto frammenti ossei all’interno e un asse lungo chiaro. (Nel caso del LACM 158709, vedi Figura 3A: sebbene la sua dimensione assiale sia simile al suo diametro, la sua estremità distale costretta dà un orientamento univoco del suo asse lungo). Gli angoli (0-90°) sono tra l’asse lungo della coprolite e l’asse lungo dei frammenti ossei nello spazio tridimensionale (vedi Figura 3C per una definizione degli angoli). Dati della Tabella 1.
Se la valutazione di cui sopra è corretta, il campione di coprolito di Mehrten è probabilmente costituito da singoli pellet provenienti da eventi di caduta multipli, eventualmente da più individui. Questo è suggerito anche da diversi gradi di disidratazione tra i diversi pellet di coprolito (Figura 5E), cioè non sono stati defecati contemporaneamente. Se questo è il caso, e supponendo che i coproliti non siano stati trasportati (non c’è alcun segno di trasporto), la località LACM 3937 potrebbe essere stata un’antica ‘latrina’ per la defecazione sociale e per la marcatura dei confini territoriali. Tali luoghi sono stati ben documentati nelle iene maculate esistenti (Kruuk, 1972), nei coyote (Gese e Ruff, 1997) e nei lupi (Asa et al., 1985; Harrington e Asa, 2003). Sebbene tale comportamento sia comune tra i carnivori sociali, non è stato documentato nei carnivori estinti.
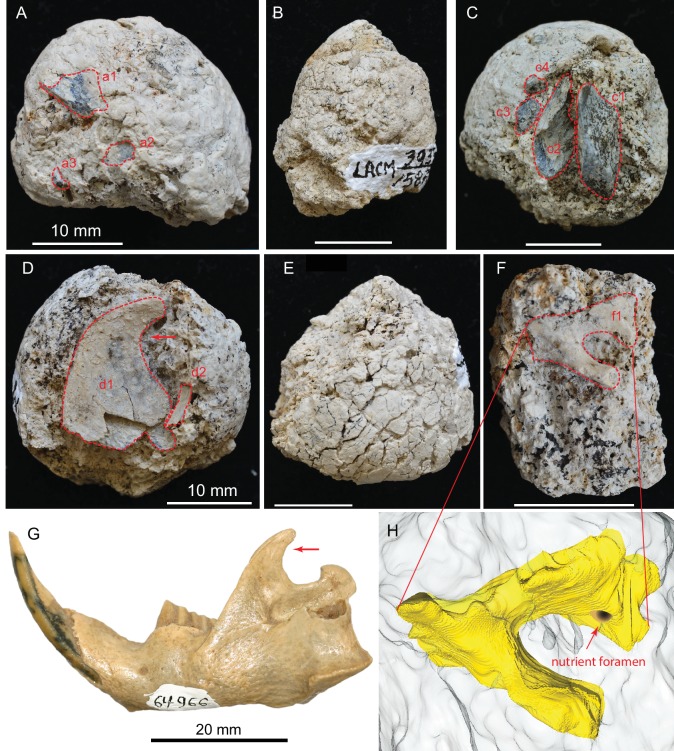
Figura 5.(A) LACM 158709 con tre frammenti ossei visibili (a1, a2, a3); (B) LACM 158710; (C) LACM 158711 con quattro frammenti ossei visibili parzialmente preparati (c1-c4); (D) LACM 158712 con due frammenti ossei visibili parzialmente esposti (d1, d2); (E) LACM 158713, crepe superficiali che suggeriscono l’essiccazione prima della sepoltura; (F) LACM 158716 con un frammento osseo parzialmente esposto (f1); (G) mandibola sinistra dell’atomo di Eucastor esistente, rispetto al frammento di processo coronoide della mandibola (frecce rosse) di d1 in D (FMNH 64966; foto per gentile concessione di Joshua Samuels); (H) osso ricostruito digitalmente (di colore giallo; lo sfondo grigio chiaro è matrice coprolita) di f1 in F, provvisoriamente identificato come l’aspetto ventrale del forame ovale nella base-fenoide di un mammifero di medie dimensioni. Linee rosse tratteggiate indicano i contorni esposti delle ossa. Tutte le scale per i coproliti sono di 10 mm.
I coproliti di Mehrten mantengono sezioni trasversali quasi perfettamente arrotondate, non mostrano alcun segno di assestamento o appiattimento post-defecazione, né vi è alcun segno di deformazione durante l’impatto iniziale di caduta. Questo suggerisce che le feci originali sono state in grado di mantenere la loro integrità sia a causa di una matrice relativamente dura e priva di umidità, e/o perché le ossa all’interno più l’alto contenuto calorico della matrice hanno dato luogo a feci relativamente rigide al momento della defecazione. Né i coproliti mostrano segni importanti di alterazione post-defecazione, suggerendo una sepoltura veloce dopo la caduta. Le ossa sono abbondanti in tutti i coproliti, consistenti nel 5% del volume totale di tutti i coproliti (intervallo 2-25%; vedere la Tabella 1 per le stime del volume individuale). Come esempi, descriviamo qui di seguito due coproliti completi.
| Dimensioni del coprolito | Dimensioni dell’osso | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numero di catalogo LACM | Diametro massimo × lunghezza (mm) | Volume della coprolite (mm3) | Volume della matrice (mm3) | Frazione della matrice | Frammenti ossei contenuti | Lunghezza massima dell’osso (mm) | Larghezza massima dell’osso (mm) | Orientamento osseo (gradi) | Volume dell’osso (mm3) | Frazione ossea/coprolite | ||||
| 158706 | 24.6* × 31.9* | 5871 | 5871 | 100% | Nessuno | |||||||||
| 158707 | 31.2 × 47.2 | 18508 | 17823 | 96% | Osso_1 | 8.1 | 6.6 | 70 | 155 | |||||
| Osso_2 | 16.5 | 5.1 | 24 | 56 | ||||||||||
| Osso_3 | 10.6 | 7.8 | 8 | 207 | ||||||||||
| Osso_4 | 6.1 | 5.1 | 70 | 23 | ||||||||||
| Osso_5 | 4.6 | 4.6 | 63 | 26 | ||||||||||
| Osso_6 | 7.9 | 7.2 | 10 | 43 | ||||||||||
| Osso_7 | 3.6 | 2.4 | 32 | 11 | ||||||||||
| Osso_8 | 11.4 | 4.7 | 12 | 45 | ||||||||||
| Osso_9 | 5.5 | 1.7 | 85 | 3 | ||||||||||
| Osso_10 | 4.7 | 2.8 | 40 | 5 | ||||||||||
| Osso_11 | 11.0 | 2.2 | 68 | 8 | ||||||||||
| Osso_12 | 8.5 | 4.8 | 43 | 78 | ||||||||||
| Osso_13 | 5.0 | 3.9 | 58 | 10 | ||||||||||
| Osso_14 | 6.1 | 3.6 | 37 | 14 | ||||||||||
| Osso totale | 685 | 4% | ||||||||||||
| 158708 | 24.9 × 44.6 | 10184 | 8814 | 87% | Osso_1 | 3.0 | 2.1 | 21 | 3 | |||||
| Osso_2 | 11.1 | 4.4 | 15 | 25 | ||||||||||
| Osso_3 | 16.1 | 10.0 | 14 | 344 | ||||||||||
| Osso_4 | 5.6 | 3.4 | 39 | 11 | ||||||||||
| Osso_5 Corteccia | 8.3 | 7.7 | 61 | 14 | ||||||||||
| Osso_5 Midollo | 9.7 | 6.8 | 61 | 104 | ||||||||||
| Osso_6 | 5.1 | 3.4 | 49 | 11 | ||||||||||
| Osso_7 | 4.3 | 2.1 | 70 | 6 | ||||||||||
| Osso_8 Costola lunga | 31.0 | 7.0 | 46 | 156 | ||||||||||
| Midollo osseo_8 Costola | 30.1 | 8.2 | 46 | 574 | ||||||||||
| Osso_8 Costola corta | 29.4 | 8.7 | 46 | 122 | ||||||||||
| Osso totale | 1370 | 13% | ||||||||||||
| 158709 | 27.1 × 23.4 | 6556 | 6341 | 97% | Osso_1 | 12.5 | 2.3 | 65 | 21 | |||||
| Osso_2 | 7.9 | 4.5 | 80 | 45 | ||||||||||
| Osso_3 | 12.6 | 4.4 | 24 | 53 | ||||||||||
| Osso_4 | 6.6 | 2.3 | 45 | 10 | ||||||||||
| Osso_5 | 5.0 | 2.2 | 54 | 10 | ||||||||||
| Osso_6 | 3.6 | 1.9 | 72 | 5 | ||||||||||
| Osso_7 | 6.1 | 4.5 | 11 | 28 | ||||||||||
| Osso_8 | 10.6 | 4.9 | 81 | 42 | ||||||||||
| Osso totale | 214 | 3% | ||||||||||||
| 158710 | 21.3 × 26.6 | 4066 | 4066 | 100% | Nessuno | |||||||||
| 158711 | 29.1* × 31.2* | 11741 | 11251 | 96% | Osso_1 | 16.9 | 7.1 | 197 | ||||||
| Osso_2 | 18.7 | 6.3 | 93 | |||||||||||
| Osso_3 | 6.8 | 3.0 | 13 | |||||||||||
| Osso_4 | 13.1 | 7.1 | 169 | |||||||||||
| Osso_5 | 6.5 | 3.7 | 18 | |||||||||||
| Osso totale | 490 | 4% | ||||||||||||
| 158712 | 29.4 × 27.5* | 8284 | 8012 | 97% | Osso_1 | 21.3 | 12.3 | 37 | 234 | |||||
| Osso_2 | 13.2 | 3.1 | 67 | 18 | ||||||||||
| Osso_3 | 7.1 | 2.5 | 2 | 7 | ||||||||||
| Osso_4 | 3.4 | 1.9 | 18 | 2 | ||||||||||
| Osso_5 | 8.6 | 2.8 | 75 | 12 | ||||||||||
| Totale | 272 | 3% | ||||||||||||
| 158713 | 27.5 × 25.6* | 8694 | 8454 | 97% | Osso_1 | 15.2 | 6.5 | 26 | 107 | |||||
| Osso_2 | 10.4 | 8.7 | 44 | 114 | ||||||||||
| Osso_3 | 4.7 | 1.9 | 66 | 5 | ||||||||||
| Osso_4 | 4.9 | 2.7 | 72 | 14 | ||||||||||
| Osso totale | 240 | 3% | ||||||||||||
| 158714 | 17.7* × 20.9* | 1570 | 1508 | 96% | Osso_1 | 8.2 | 5.2 | 29 | 62 | 4% | ||||
| 158715 | 18.0* × 24.0* | 2481 | 2443 | 98% | Ossa_1 | 71 | 39 | 2% | ||||||
| 158716 | 20.5* × 14.9* | 1245 | 1197 | 96% | Osso_1 | 10.2 | 9.0 | 70 | 48 | 4% | ||||
| 158717 | 18.7* × 19.6* | 1424 | 1071 | 75% | Osso 1 | 18.9 | 12.7 | 14 | 353 | 25% | ||||
| Totale | 76851 | Totale | 3773 | 5% | ||||||||||

Figura 1.(A) morfologia dei singoli pellet in un assemblaggio completo di feci da un singolo evento di caduta da parte della iena maculata esistente, Crocuta crocuta. Adattato da ([Diedrich, 2012]:Figura 4), ad eccezione dell’orientamento (l’orientamento anteriore/posteriore di Diedrich è in contrasto con il senso tradizionale di anatomia). (B) scatti di iena maculata esistente (immagine fissa riprodotta da un video della rivista Smithsonian, disponibile all’indirizzo http://www.smithsonianmag.com/videos/category/weird-science/weird-science-hyena-poop/?no128ist). (C) immagini di un lupo grigio; si noti la conservazione dei frammenti ossei e dei peli (foto di Xiaoming Wang del 21 settembre 2016 nel bacino di Xorkol, nella regione autonoma di Uygur, nel sud dello Xinjiang, Cina).

Figura 2.LACM 158707, un coprolito completo della località LACM 3937 (=Turlock Lake 34), Mehrten Formation, Stanislaus County, California, raccolto da Dennis Garber.(A) Vista laterale, la parte superiore è verso l’estremità distale (prima caduta); (B) un’altra vista laterale a circa 90° da A; (C) un’altra vista laterale a circa 90° di ulteriore rotazione da B; (D) 14 frammenti ossei (in vari colori) segmentati digitalmente all’interno del coprolito (grigio chiaro) con lo stesso orientamento di A; (E) primo piano di un frammento osseo esposto (non identificato) su C che mostra l’incisione acida (sfaldatura) sulla superficie esterna.Vedere anche il Video 1 per mostrare le relazioni tridimensionali delle singole ossa all’interno di questo coprolito.

Figura 3.LACM 158708, un coprolito completo e ossa contenute all’interno, proveniente dalla località LACM 3937, Mehrten Formation, Stanislaus County, California, raccolto da Dennis Garber.(A) vista laterale, la parte superiore è verso l’estremità distale (prima goccia); (B) un’altra vista laterale a circa 90° da A; (C) singole ossa separate digitalmente (in colori diversi) all’interno della matrice di coprolito (grigio chiaro), vista identica a quella di B; (D) una vista ruotata di un frammento di costola visto in C, che mostra il lato convesso (esterno), forme gialle e verde scuro che rappresentano rispettivamente l’interno (verso la cavità toracica) e l’esterno dell’osso corticale, e marrone giallastro incastrato tra le ossa corticali essendo l’osso cancello. Le frecce rosse indicano la stessa punta sporgente del frammento di costola, e le linee tratteggiate rosse definiscono i contorni esposti di un osso piatto (per lo più sepolto all’interno della matrice di coprolito; il pezzo blu scuro in C mostra l’intera estensione di questo osso all’interno della coprolito). Ad eccezione della costola, tutti gli altri frammenti ossei non sono identificabili. Vedere anche il Video 2 e il file di segmentazione Avizo originale (link web) per mostrare le relazioni tridimensionali delle singole ossa all’interno di questo coprolito.

Figura 4.Diagramma a rosa degli orientamenti ossei all’interno dei coproliti.Vengono presentati solo pellet di coprolito con almeno otto frammenti ossei all’interno e un asse lungo chiaro. (Nel caso del LACM 158709, vedi Figura 3A: anche se la sua dimensione assiale è simile al suo diametro, la sua estremità distale costretta dà un orientamento univoco del suo asse lungo). Gli angoli (0-90°) sono tra l’asse lungo della coprolite e l’asse lungo dei frammenti ossei nello spazio tridimensionale (vedi Figura 3C per una definizione degli angoli). Dati della Tabella 1.

Figura 5.(A) LACM 158709 con tre frammenti ossei visibili (a1, a2, a3); (B) LACM 158710; (C) LACM 158711 con quattro frammenti ossei visibili parzialmente preparati (c1-c4); (D) LACM 158712 con due frammenti ossei visibili parzialmente esposti (d1, d2); (E) LACM 158713, crepe superficiali che suggeriscono l’essiccazione prima della sepoltura; (F) LACM 158716 con un frammento osseo parzialmente esposto (f1); (G) mandibola sinistra dell’atomo di Eucastor esistente, rispetto al frammento di processo coronoide della mandibola (frecce rosse) di d1 in D (FMNH 64966; foto per gentile concessione di Joshua Samuels); (H) osso ricostruito digitalmente (di colore giallo; lo sfondo grigio chiaro è matrice coprolita) di f1 in F, provvisoriamente identificato come l’aspetto ventrale del forame ovale nella base-fenoide di un mammifero di medie dimensioni. Linee rosse tratteggiate indicano i contorni esposti delle ossa. Tutte le scale per i coproliti sono di 10 mm.
LACM 158707 (Figura 2, Video 1)

Video 1.1. Filmato LACM 158707: Un video di scansione microCT del LACM 158707 con ossa variamente colorate segmentate digitalmente all’interno del coprolito.2. Video in Avizo Lite 9.2 di Stuart C. White.
Si tratta di un coprolito quasi perfettamente conservato e anche uno dei più grandi, che misura 31,2 mm di diametro massimo. L’estremità smussata suggerisce un pellet terminale (prima caduta, Figura 1A). Questo coprolito è composto da due pellet non separati, come delineato da una scanalatura visibile. L’estremità prossimale (ultima goccia) ha una superficie piatta, che rappresenta una separazione netta dal pellet successivo. Un singolo osso è visibile sulla superficie esterna, con almeno 14 frammenti ossei riconoscibili nell’immagine CT (Figura 2D), anche se tutti sono piccoli pezzi non identificabili.

Video 1.1. Filmato LACM 158707: Un video di scansione microCT del LACM 158707 con ossa variamente colorate segmentate digitalmente all’interno del coprolito.2. Video in Avizo Lite 9.2 di Stuart C. White.
LACM 158708 (Figura 3, Video 2 )

Video 2.2. Filmato LACM 158708: Un video di scansione microCT del LACM 158708 con ossa variamente colorate segmentate digitalmente all’interno del coprolito.Video in Avizo Lite 9.2 di Stuart C. White.
Questo è un altro dei più completi pellet di coprolito. La sezione trasversale è quasi perfettamente arrotondata, anche se c’è un distinto appiattimento su un lato, che indica la caduta su un terreno duro durante la defecazione. Questo coprolito contiene anche il pezzo di osso più grande, un frammento di una costola che misura 29 mm di lunghezza × 9,2 mm di larghezza × 5,1 mm di spessore, che si estende quasi per tutta la lunghezza del pellet (Figura 3C,D). L’estremità terminale di questa costola sporge anche al di fuori del coprolito sull’estremità affusolata, lasciando una punta affilata, lunga 3 mm, che sporge ad angolo nella parete laterale dell’intestino e mostra una modesta lucidatura sulla sua superficie (frecce rosse in Figura 3). Un altro pezzo di osso (racchiuso da una linea tratteggiata rossa in Figura 3) ha una superficie esterna arrotondata con una corteccia sottile riempita interamente da osso cancello, suggerendo un’articolazione articolare. La dimensione di questo osso è coerente con una testa di costola per l’asta, anche se non possiamo identificare positivamente questo come tale senza una preparazione fisica. Altri due altri pezzi più piccoli di ossa sono identificati da immagini scansionate con microCT. Il volume osseo totale è pari al 13% della matrice di coprolito per il LACM 158708, tra i più alti di tutti i coproliti (Tabella 1).

Video 2.Filmato LACM 158708: Un video di scansione microCT del LACM 158708 con ossa variamente colorate segmentate digitalmente all’interno del coprolito.Video in Avizo Lite 9.2 di Stuart C. White.
Ossa all’interno di coprolito
La maggior parte delle ossa all’interno dei coproliti, anche se completamente esposte, sono troppo piccole e troppo frammentarie per essere identificate da un particolare elemento o da un particolare taxon al di là dei mammiferi o addirittura dei vertebrati. Tale difficoltà può anche essere aggravata da ricostruzioni microCT segmentate digitalmente. Queste ossa digitalmente separate sono spesso una replica inesatta delle forme reali, soprattutto a causa della elevata somiglianza di opacità a raggi X tra le ossa e la matrice circostante. Con l’eccezione di un singolo frammento di costola in LACM 158708, tutte le altre ossa virtualmente segmentate mancano di dettagli morfologici sufficienti per essere identificate senza ambiguità.
In generale, manca un chiaro orientamento rispetto all’asse lungo di ogni coprolito (Figura 4). Questa casualità può essere il risultato di diversi fattori. Ad eccezione della frammentazione della costola – che, a causa della sua lunghezza, deve essere allineata lungo l’asse lungo del coprolito (Figura 3C,D)- la maggior parte delle ossa sono relativamente piccole, e il diametro dell’intestino non è un fattore limitante nel loro orientamento. La mancanza di un orientamento longitudinale può anche essere dovuta ad una matrice relativamente viscosa (basso contenuto di acqua) e alla compattazione durante l’ultimo viaggio (disidratazione) delle feci attraverso l’intestino crasso.
Modifiche superficiali sulle ossa includono l’arrotondamento degli angoli, la lucidatura della superficie e l’incisione acida. La superficie esterna di un osso piccolo (linea tratteggiata rossa nella Figura 3B) esposta alla parete dell’intestino ha subito una lucidatura visibile; questa superficie lucidata è stata anche macchiata di un colore più scuro rispetto alle parti non lucidate. La lucidatura è nota per essere presente nell’80% delle ossa in scat di lupo esistente ([Esteban-Nadal et al., 2010]:Figura 18). L’acquaforte e la desquamazione sono visibili su un osso esposto nel LACM 158707 (Figura 2D,E); questo è relativamente raro nello scat dei lupi esistenti, che si verifica solo nello 0,9% delle ossa contenute nello scat di lupo ([Esteban-Nadal et al., 2010]:Figura 18).
Circa il 5% delle ossa recuperate da scat di lupo vivente può essere identificato alla loro specie di preda (Fosse et al., 2012). Quattro frammenti ossei di coproliti di Mehrten, costituiti dall’8% del numero totale di frammenti ossei (Tabella 1), conservano una morfologia originale sufficiente per essere ristretta a taxa o struttura anatomica più specifica. Essi sono descritti di seguito.
Osso dell’arto di uccello in LACM 158711 (c2 in Figura 5C)
Un grosso pezzo di osso, che misura almeno 6,0 × 3,6 mm in sezione trasversale, ha pareti sottili e una struttura interna cava, probabilmente appartenente a un osso di un arto di uccello. Lo spessore della parete è di 0,8 mm, e ha molti puntoni sottili sulle sue superfici interne. L’estrema cavità di questo osso è in netto contrasto con un frammento di osso di arto adiacente (c1 in Figura 5C) che ha uno spessore corticale di 4,6 mm. L’unico uccello fossile finora riportato dal membro del serbatoio di Modesto è un’oca, Branta (Wagner, 1981).
Ramus ascendente del dentario di un castoro in LACM 158712 (d1 in Figura 5D)
Un osso piatto molto grande, che assomiglia al ramoscello ascendente di un castoro, si estende per la larghezza del coprolito. I cerchi anteriori e dorsali sono intatti. Il bordo posteriore è a pareti molto sottili, e non possiamo essere certi che il suo vero bordo sia completamente intatto. Una parte di quest’ultimo è abbastanza liscia da poter essere eventualmente intatta; in caso affermativo, identifichiamo provvisoriamente quest’osso come un ramus ascendente di castoro. Due castori, Castor californicus e Dipoides vallicula, sono entrambi noti nella Formazione di Mehrten (Wagner, 1981) e appartengono al clade semiaquatico del castoro (Rybczynski, 2007). Tutti loro possiedono un ramus ascendente uncinato all’indietro altamente diagnostico (processo coronoide; vedi il confronto con quello di Eucastor tortus in Figura 5G, una specie esistente adiacente a Dipoides nella filogenesi del castoro) che è forse correlato al comportamento di taglio del legno. Tuttavia, a causa del bordo posteriore mal conservato, non possiamo escludere che questo osso sia la porzione distale di una scapola. (Se una scapola appartiene probabilmente a un mammifero di media taglia).
Basicranium di un mammifero di medie dimensioni in LACM 157716 (f1 in Figura 5F e ricostruzione digitale in Figura 5H)
Un forame incompleto e profondo di 3,0 mm di lunghezza massima e 2,1 mm di larghezza minima è orlato da una mensola incompleta da un lato e da una struttura a trave dall’altro. Sulla parete del lato più largo del forame più grande c’è un piccolo forame nutriente, di diametro inferiore a 1 mm. Una tale configurazione è più frequentemente vista nella regione basicranial, come il forame ovale anteriore alla bolla timpanica in Odocoileus vivente, che ha anche un nutriente forame sulla parete mediale del forame ovale. Tuttavia, le dimensioni di questo forame sul LACM 158716 e la sua anatomia dettagliata non corrispondono esattamente a quelle di Odocoileus. Data la scarsa conservazione, questo osso non è facilmente identificabile al di là della sua posizione anatomica.
Costola di un grande mammifero nel LACM 158708 (Figura 3)
Una leggera curvatura e una forma allungata con quattro pareti relativamente dritte rendono questo osso facilmente identificabile come il segmento prossimale di una costola. I lupi moderni si nutrono tipicamente degli organi interni, come il cuore, i polmoni e il fegato (Stahler et al., 2006), e la gabbia toracica è il principale ostacolo per raggiungere gli organi. I dati sperimentali suggeriscono anche che le costole di mammifero sono una parte altamente desiderabile della dieta moderna lupo lupo, con circa il 99% delle costole di essere consumato (cioè l’1% lasciato intatto) e le costole sono i frammenti ossei più frequentemente (25%) identificati recuperati da scat ([Klippel et al., 1987]:Tabelle 1 e 2). La grande dimensione di questo osso (>30 mm di lunghezza) è inusuale, tipicamente composta da una piccola percentuale di scat carnivori ([Kolska Horwitz, 1990]:Tabella 1). Con le grandi dimensioni di quest’osso, possiamo stimare l’intervallo minimo di dimensioni corporee delle prede (vedi Figure 10-12).
| Famiglia | Genere | Specie | Numero del campione |
|---|---|---|---|
| Antilocapridae | Antilocapra | americana | LACM 30482 |
| Tayassuidae | Tayassu | pecari | LACM 86904 |
| Camelidae | Lama | guanacoe | LACM 31328 |
| Camelidae | Vicugna | vicugna | LACM 54706 |
| Cervidae | Cervus | asse | LACM 529 |
| Cervidae | Cervus | dama | LACM 30452 |
| Cervidae | Cervus | dama | LACM 30876 |
| Cervidae | Cervus | eldi | LACM 86095 |
| Cervidae | Cervus | nippon | LACM 31069 |
| Cervidae | Cervus | porcino | LACM 85966 |
| Cervidae | Cervus | timorensis | LACM 86012 |
| Cervidae | Odocoileus | emionus | LACM 307 |
| Cervidae | Odocoileus | emionus | LACM 30903 |
| Cervidae | Odocoileus | virginianus | LACM 52442 |
Confronto con le moderne scansioni di lupo
I dati sperimentali sulla dieta moderna del lupo grigio e il loro scat permettono di quantificare il contenuto di scat e di identificare le prede. Tuttavia, la maggior parte di questi metodi si basano sulla selezione della materia molle nelle feci del lupo (ad esempio [Floyd et al., 1978; Weaver, 1993]), che in genere non sono conservate nei coproliti. Uno studio sui frammenti ossei conservati in scat di lupo iberico (Canis lupus signatus) fornisce una valida base di confronto (Esteban-Nadal et al., 2010). Nei campioni spagnoli, il numero di frammenti scheletrici per scat varia da uno a 96 ([Esteban-Nadal et al., 2010]:Tabella 2), il limite superiore è sostanzialmente superiore a quello dei nostri campioni fossili. Questo numero maggiore di ossa può essere probabilmente spiegato da due fattori. In primo luogo, anche se Esteban-Nadal et al. non l’hanno dichiarato in modo specifico, il loro conteggio di uno scat comprende quasi certamente l’intera feci espulse in un singolo evento di caduta, in contrasto con il nostro trattamento di un singolo singolo pezzo di coprolito. (i nostri pezzi di coprolito disarticolati corrispondono ai singoli pellet di una lunga serie di scat descritti in [Diedrich, 2012]:Figura 4) (Figura 1). In secondo luogo, le ossa di scat di lupo esistenti sono campionate in modo esaustivo (raccolte attraverso campioni secchi e/o vagliate dopo trattamenti chimici) in contrasto con le nostre ispezioni visive in immagini a scansione microCT. Piccole ossa che hanno una radio-opacità simile a quella della matrice circostante possono potenzialmente non essere rilevate nei conteggi (Tabella 1). Se si escludono i due fattori di cui sopra, i coproliti fossili del Mehrten possono contenere un numero di frammenti ossei paragonabile a quelli presenti nello scat di lupo iberico.
Più dell’80% dei frammenti ossei in scat di lupo iberico non sono identificabili in un particolare osso o taxon. Uno studio sui lupi polacchi aveva un tasso del 95% di ossa non identificate (Fosse et al., 2012). Lo stesso vale per i coproliti canidi di Mehrten: quattro ossa relativamente grandi sono identificate su 48 in totale (cioè il 92% di ossa non identificate). Infine, anche le dimensioni dei singoli frammenti ossei in scat di lupi esistenti sono approssimativamente paragonabili a quelle dei nostri fossili. Le ossa digerite hanno una gamma di dimensioni piuttosto uniforme da 1-2 cm a pochi mm di diametro.
Adattamenti per la frantumazione delle ossa in Borofago
Borofago e ienidi che rompono le ossa come Crocuta condividono diverse caratteristiche craniodentali che sono state interpretate come adattamenti per una dieta durofaga. Questi includono robusti denti delle guance che spesso mostrano una forte usura delle cuspidi (la p4 e m1 inferiore nel borofago e la p3 e p4 inferiore in Crocuta; Figura 6A). Le dentizioni superiori e inferiori di entrambi i taxa presentano anche microstrutture specializzate dello smalto (Hunter-Schreger Bands) dei denti della guancia interpretate per rappresentare risposte evolutive alla resistenza a cibi sempre più duri e abrasivi (Rensberger e Wang, 2005; Tseng, 2011). Sia nella morfologia dentale che nella microstruttura dello smalto, Borophagus e Crocuta hanno più somiglianze tra loro che con il Canis (Figura 6A,C). Tuttavia, le analisi macro-usura del dente carnassiale inferiore (m1) in campioni di popolazione dei tre carnivori dimostrano che la Crocuta che si rompe l’osso esistente presenta in media un’usura delle cuspidi molto più estrema rispetto al Canis o al Borofago (DeSantis et al., 2017) (Figura 6B). In termini di forma cranica, Crocuta è intermedia tra Borophagus e Canis nell’avere un rostro moderatamente allungato e una fronte moderatamente liscia, mentre il Borophagus ha la combinazione di un rostro relativamente corto con un aspetto più “a gradini” della fronte (Figura 6D-E). Tuttavia, all’interno del contesto filogenetico dei rispettivi lignaggi, Borophagus e Crocuta rappresentano estremi simili lungo un continuum morfologico evolutivo, con Canis situato oltre il morfospaziale occupato da canidi borofagini o ienidi (Tseng e Wang, 2011; Balisi et al., 2018) (Figura 6E). Infine, i confronti delle distribuzioni di stress complessive durante le simulazioni di morso carnassiale unilaterale (P4) con l’analisi agli elementi finiti indicano che la crania di Crocuta e Borophagus sono più simili l’una all’altra nell’esporre modelli di stress più bassi e più dissipati rispetto al Canis (Tseng, 2011) (Figura 6F). Queste caratteristiche morfologiche funzionali (ad eccezione dei dati di macrousura del Borophagus, qui presentati di recente) sono state utilizzate per giustificare le classificazioni sia del Borophagus che di Crocuta come ecomorfi specializzati nella rottura delle ossa.
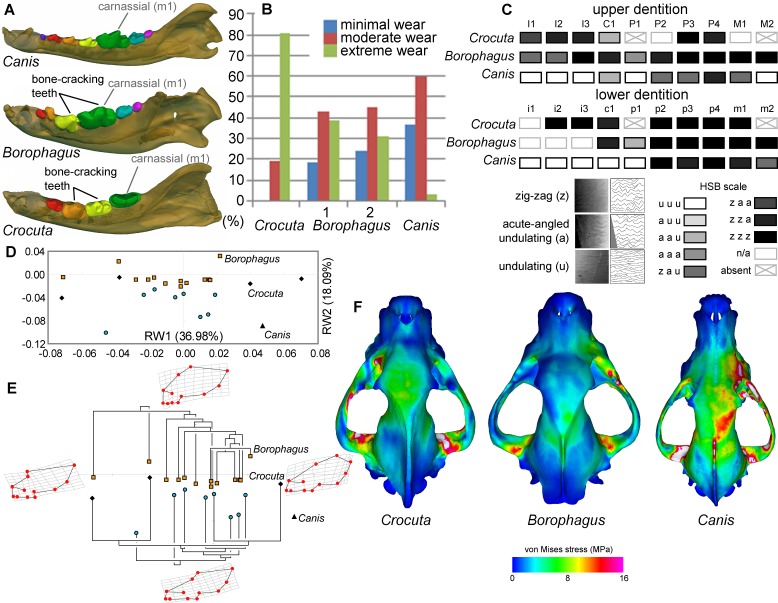
Figura 6.Figura 6. Confronto della morfologia funzionale craniodentale in Canis, Borofago e Crocuta.(A) Omologia della dentizione inferiore e posizioni dei denti che rompono l’osso funzionalmente analoghe. Le mascelle sono scalate alla stessa lunghezza. (B) Dati macroscopici da campioni di primo molare inferiore di Crocuta crocuta (Africa sub-sahariana) (dati da [DeSantis et al., 2017]), Borophagus parvus (nuovi dati basati su campioni AMNH da (1) Quibiris Formation, Arizona e (2) Big Sandy Formation, Arizona), e Canis lupus (nuovi dati basati su campioni AMNH da Alberta, Canada). (C) Hunter-Schreger Band (HSB) modelli di microstruttura dello smalto nella dentatura superiore e inferiore dei tre carnivori; tonalità più scure indicano un grado più elevato di specializzazione HSB a zig-zag (modificato dalla Figura 2 di [Tseng, 2011]). (D) Morfospaziale degli assi di ordito relativo (RW) da un’analisi morfometrica geometrica di fossili (simboli ombreggiati) ed esistenti (simboli neri) canide e ienide forma cranica, e (E) relazioni filogenetiche di canidi borofagina (in alto) e ienidi (in basso) tracciate su dati morfometrici, con Canis indicato da triangolo nero. Sia (D) che (E) sono modificati dalla Figura 5 di Tseng e Wang (2011). (F) von Mises distribuzioni di stress nel cranio durante le simulazioni di morso premolare destro quarto destra quarto morso utilizzando 3-D analisi agli elementi finiti, con colori più caldi che indicano uno stress più elevato. Crania sono scalati alla stessa lunghezza (modificato dalla Figura 7 da [Tseng, 2013]).

Figura 6.Figura 6. Confronto della morfologia funzionale craniodentale in Canis, Borofago e Crocuta.(A) Omologia della dentizione inferiore e le posizioni dei denti che rompono l’osso funzionalmente analoghi. Le mascelle sono scalate alla stessa lunghezza. (B) Macrowear dati da campioni di primo molare inferiore di Crocuta crocuta (Africa sub-sahariana) (dati da [DeSantis et al., 2017]), Borophagus parvus (nuovi dati basati su campioni AMNH da (1) Quibiris Formation, Arizona e (2) Big Sandy Formation, Arizona), e Canis lupus (nuovi dati basati su campioni AMNH da Alberta, Canada). (C) Hunter-Schreger Band (HSB) modelli di microstruttura dello smalto nella dentatura superiore e inferiore dei tre carnivori; tonalità più scure indicano un grado più elevato di specializzazione HSB a zig-zag (modificato dalla Figura 2 di [Tseng, 2011]). (D) Morfospaziale degli assi di ordito relativo (RW) da un’analisi morfometrica geometrica di fossili (simboli ombreggiati) ed esistenti (simboli neri) canide e ienide forma cranica, e (E) relazioni filogenetiche di canidi borofagina (in alto) e ienidi (in basso) tracciate su dati morfometrici, con Canis indicato da triangolo nero. Sia (D) che (E) sono modificati dalla Figura 5 di Tseng e Wang (2011). (F) von Mises distribuzioni di stress nel cranio durante le simulazioni di morso premolare destro quarto destra quarto morso utilizzando 3-D analisi agli elementi finiti, con colori più caldi che indicano uno stress più elevato. Crania sono scalati alla stessa lunghezza (modificato dalla Figura 7 da [Tseng, 2013]).
Ricostruzione del potenziale ruolo ecologico del borofago
Consumo di ossa
Le ossa come fonte alimentare supplementare devono rappresentare un guadagno netto se il costo di lavorazione delle ossa (sia per ingestione che per digestione) può essere gestito. L’osso compatto medio è costituito da circa il 30% di matrice organica (Eastoe e Eastoe, 1954; Guyton e Hall, 2006), per lo più fibre di collagene. La componente organica (valore nutrizionale) è ancora più elevata se si considera anche il midollo nell’osso cancello. Vivere iene maculate in Africa possiedono adattamenti morfologici e fisiologici che permettono un uso efficiente delle ossa e sono noti per consumare l’intera carcassa (appena uccisi o scavati), senza lasciare ossa. Le ossa delle iene uccise vengono lasciate intatte solo durante la stagione del parto degli gnu, quando il cibo (vitelli) è sovrabbondante, ma anche le ossa non consumate vengono mangiate dopo la stagione del parto (Kruuk, 1972). Le iene striate e marroni, invece, sembrano elaborare le ossa in misura minore sulla base di assemblaggi di accumulo osseo (Wagner, 2006), e questo si riflette nella loro struttura di microusura dentale (DeSantis et al., 2017).
Anche se l’alimentazione delle carogne e il consumo di ossa sono forse strettamente associati, in quanto gli habitat sempre più aperti rendono le carcasse più visibili, soprattutto grazie agli indizi visivi degli scavenger aviari (Creel, 2001), il consumo di ossa in sé non è sempre legato allo scavenging. Un’alimentazione sociale competitiva tra i predatori sociali può essere un miglior predittore del consumo di ossa (Figura 8). Il primo adattamento dentale schiacciante delle ossa negli ienidi, come Percrocuta, è apparso nel Miocene medio dell’Eurasia (Qiu et al., 1988; Ginsburg, 1999), circa 15 milioni di anni fa. Prima di allora, questa nicchia era in gran parte occupata da mammiferi carnivori non carnivori, come gli ienodonti, gli ossienodonti e gli entelodonti. I canidi, tuttavia, avevano in realtà sviluppato adattamenti simili molto prima, come nell’esperocyonina Enhydrocyon nel tardo Oligocene (più di 28 Ma) del Nord America (Wang, 1994). Durante il Mio-Pliocene, le borofagine si erano evolute almeno due lignaggi schiacciaossa nelle sottotribù Aelurodontina e Borophagina (Wang et al., 1999). I generi avanzati in questi due cladi – Aelurodon in Aelurodontina, Epicyon e Borophagus in Borophagina- avevano acquisito autonomamente premolari robusti per lo schiacciamento di prede dure, anche se i loro loci di premolari schiacciaossa sono diversi (Figura 7).
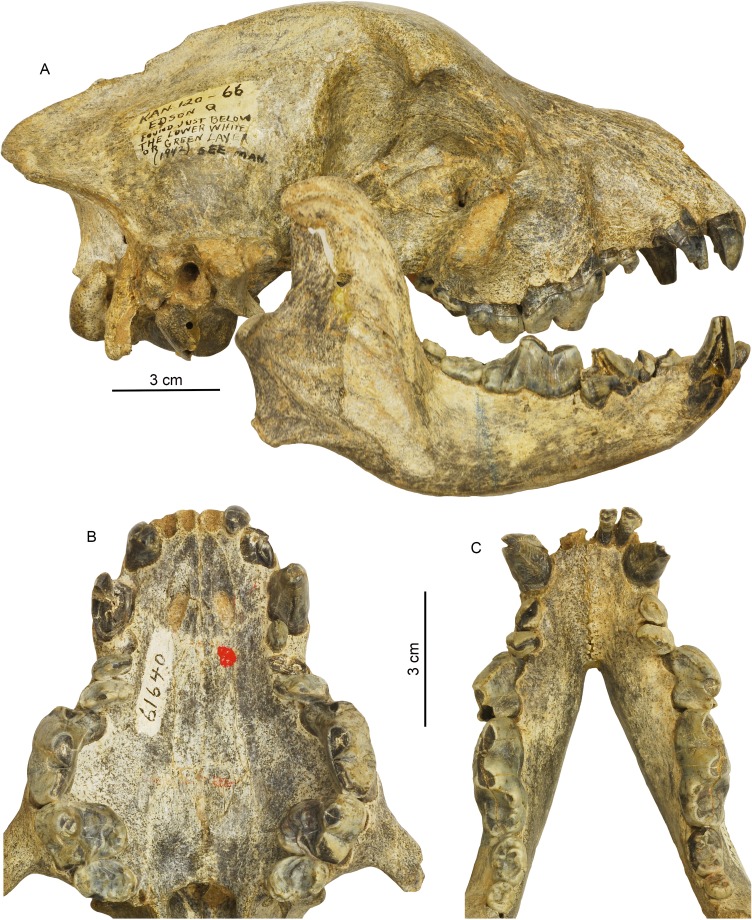
Figura 7.Morfologia cranica e dentale del Borophagus secundus (F:AM 61640 da Edson Quarry, Marshall Ranch, Sherman County, Kansas, tardo Hemphillian).Una serie di caratteristiche è comunemente associata ad adattamenti di schiacciamento osseo, come una fronte altamente voltata, rostro accorciato e l’imbibizione associata di premolari, mascelle inferiori ispessite, palato allargato, denti delle guance inferiori svasati lateralmente, P4 ingrandito differenzialmente rispetto a P3 e p4 rispetto a p3, e premolari anteriori (P1-3 e p1-3) ridotti a piccoli picchetti che non sono più in funzione in occlusione. (A) vista laterale destra del cranio e della mandibola; (B) vista occlusale dei denti superiori; e (C) vista occlusale dei denti inferiori.

Figura 8.Concezione artistica di alimentazione da parte di un branco di cani schiacciaossa della specie Borophagus secundus, taxon sorella di Borophagus parvus, di Mauricio Antón.Un’alimentazione di gruppo competitiva non permette di raccogliere e scegliere la carne per un consumo tranquillo e può essere stata una forza trainante per l’utilizzo completo delle carcasse. Adattato da Wang et al., 2008: figura 5.4 e con il permesso di riproduzione di Mauricio Antón.
Come la più antica famiglia vivente di carnivori, i canidi sono sorti nel tardo Eocene più di 36 milioni di anni fa (Wang, 1994; Wang et al., 2008). Il tempo di divergenza tra canidi e ienidi dovrebbe essere ancora più precoce, risalendo alla divisione iniziale tra caniformi e feliformi (Spaulding e Flynn, 2012). I canidi borofagini si sono evoluti piuttosto presto nella storia dei canidi nel primo Oligocene, circa 32 Ma. Gli ienidi, invece, hanno avuto origine piuttosto tardi, probabilmente nel primo Miocene d’Europa, circa 21-22 Ma (Werdelin e Solounias, 1991; Ginsburg, 1999). Nonostante questo inizio tardivo, gli ienidi hanno sviluppato la dentizione più avanzata per la frantumazione delle ossa, apparentemente legata al loro piano dentale feliforme di base di ridurre fortemente la parte macinante della dentizione (M1 e m1 talonide-m2), lasciando spazio all’allargamento dei loro premolari. I canidi, d’altra parte, sono vincolati dal loro piano dentale meno specializzato di mantenere una sostanziale batteria molare superiore e inferiore di macinatura, con meno spazio per l’ingrandimento dei premolari. Pertanto, nonostante un inizio molto più precoce, la frantumazione delle ossa nei canidi non è mai avanzata al livello di specializzazione come ienidi.
Tra gli ienidi viventi, le iene maculate sono state osservate come le più capaci mangiatrici di ossa rispetto alle iene striate e probabilmente alle iene marroni (Leakey et al., 1999). Tuttavia, al di là degli studi che mostrano una modificazione ossea differenziale nei siti di tana di diverse specie di iene, non esiste un corpo di ricerca significativo su come le iene striate e le iene brune cacciano in modo diverso e su come le differenze comportamentali influenzino la loro preferenza alimentare così come intesa dalle scats (Watts e Holekamp, 2007). Dato il campione di coprolito di Borophagus e la morfologia funzionale di rottura delle ossa (Figura 6), la preponderanza di prove indica le iene striate o marroni come analoghi adatti al Borophagus nei sistemi masticatori e gastrointestinali che trattano le ossa in modo meno approfondito rispetto alle iene maculate. La seguente discussione sul possibile ruolo ecologico del Borophagus dovrebbe essere considerata con questa differenza in mente.

Figura 7.Morfologia cranica e dentale del Borophagus secundus (F:AM 61640 da Edson Quarry, Marshall Ranch, Sherman County, Kansas, tardo Hemphillian).Una serie di caratteristiche è comunemente associata ad adattamenti di schiacciamento osseo, come una fronte altamente voltata, rostro accorciato e l’imbibizione associata di premolari, mascelle inferiori ispessite, palato allargato, denti delle guance inferiori svasati lateralmente, P4 ingrandito differenzialmente rispetto a P3 e p4 rispetto a p3, e premolari anteriori (P1-3 e p1-3) ridotti a piccoli picchetti che non sono più in funzione in occlusione. (A) vista laterale destra del cranio e della mandibola; (B) vista occlusale dei denti superiori; e (C) vista occlusale dei denti inferiori.

Figura 8.Figura 8. Concezione artistica di alimentazione da parte di un branco di cani schiacciaossa della specie Borophagus secundus, taxon sorella di Borophagus parvus, di Mauricio Antón.Un’alimentazione di gruppo competitiva non permette di raccogliere e scegliere la carne per un consumo tranquillo e può essere stata una forza trainante per l’utilizzo completo delle carcasse. Adattato da Wang et al., 2008: figura 5.4 e con il permesso di riproduzione di Mauricio Antón.
Digestione ossea
Il sistema gastrointestinale delle iene si è apparentemente evoluto per gestire grandi quantità di ossa. Le feci ienidiche, in particolare quelle della iena maculata (Crocuta crocuta), sono note per contenere fosfati di calcio altamente digeriti sotto forma di polveri bianche e residui ossei (Figura 1B) (Estes, 1991). In misura minore, anche lo scat di iena striata (Hyaena hyaena hyaena) è bianco o grigio chiaro (Macdonald, 1978; Hulsman et al., 2010). Queste polveri bianche sono costituite da sali di calcio e fosfato, Ca3(PO4)2-1.5Ca(OH)2, simili all’idrossiapatite, il principale componente inorganico delle ossa (Kruuk, 1972). Supponendo che l’antenato comune di Crocuta e Hyaena abbia acquisito il sistema gastrointestinale di dissoluzione ossea, tale caratteristica deve essere esistita più di 8,6 Ma se si considera il tempo di divergenza molecolare di questi due generi (Koepfli et al., 2006).
Tuttavia, nonostante si deduca che la iena maculata abbia un ambiente altamente acido all’interno del suo tratto gastrointestinale, non è disponibile alcuna misura pubblicata (Beasley et al., 2015). Le iene maculate sono anche note per rigurgitare contenuti indigeribili, come la pelle e i capelli (Kruuk, 1972; Silvestre et al., 2000). I cani domestici viventi hanno un pH gastrico di 1,08-2,07 (Sagawa et al., 2009); questo è paragonabile agli spazzini con stomaco altamente acido per la protezione contro i microbi estranei, come il tacchino avvoltoio (uno spazzino obbligato; 1,3 ± 0,08) e il falco dalla coda rossa (uno spazzino facoltativo; 1,8 ± 0,27) (Beasley et al., 2015). Così, questa iperacidità nei cani è principalmente attribuito a scavenging. Non è chiaro se esiste una relazione lineare tra il valore del pH dello stomaco e la quantità di residui ossei nelle scaglie. Senza studi dettagliati del processo digestivo nelle iene esistenti, non si sa se una combinazione di differenze chimiche e meccaniche nell’apparato digerente sia responsabile delle differenze nelle dimensioni dei residui ossei osservate tra i borofagi e i lupi vivi, da un lato, e le iene maculate, dall’altro. Tuttavia, l’esame del contenuto dello stomaco delle iene striate indica che esse sono in grado di digerire alcune ossa in misura simile alle iene maculate (Kingdon, 1977).
Documentazione sui coproliti
Nonostante l’alta concentrazione di carbonati, la moderna iena scat maculata moderna si ammorbidisce e si scioglie facilmente nella stagione delle piogge (Kruuk, 1972), e non sorprende che i coproliti ienidi siano raramente conservati nel registro dei fossili. Quando lo sono, quelle delle iene da grotta (Crocuta crocuta spelaea) sono le più comuni (Diedrich, 2012; Fourvel et al., 2015; Sanz et al., 2016). Le feci altamente concentrate e calpestate possono dar luogo a “letti fosfatici bianchi”, come nelle grotte del Pleistocene in Europa con le note attività delle iene da grotta (Diedrich, 2012).
In Nord America, i record di coproliti canidi sono altrettanto scarsi. Nel sito di Pipestone Springs Main Pocket (tarda formazione di Eocene Renova, Jefferson County, Montana), piccoli coproliti sono stati attribuiti a Hesperocyon (Lofgren et al., 2015). Frammenti di ossa all’interno dei coproliti appartengono per lo più a piccoli vertebrati, tra cui marsupiali, lucertole, lagomorfi, e roditori di dimensioni scoiattolo, suggerendo una dieta di prede per lo più piccole. Denti di Hesperocyon sono stati segnalati anche per verificarsi in alcuni coproliti dell’Oligocene nella Formazione Brule dalle Badlands Big del Sud Dakota (Parris e Holman, 1978).
Caccia sociale
Le moderne iene maculate e i lupi sono cacciatori sociali, e i pasti sono condivisi rispettivamente dai clan e dai branchi. Le iene maculate consumano l’intero scheletro, ossa incluse, di solito in una sola sessione di alimentazione (Kruuk, 1972). Al contrario, i lupi spesso non sono in grado di rompere le ossa degli arti grandi, come quelle dei bisonti europei, e lasciano intatte parti sostanziali dello scheletro; tuttavia, gli scheletri delle prede più piccole, come i cervi rossi, subiscono molti più danni e meno ossa rimangono intatte (Fosse et al., 2012). A questo proposito, le capacità di lavorazione delle ossa dei lupi sono più vicine a quelle delle iene brune e striate di quanto lo siano le iene maculate. Le iene brune e a strisce sono cercatori e cacciatori solitari nella maggior parte delle osservazioni, anche se hanno strutture sociali associate ad accumuli ossei nelle tane (Watts e Holekamp, 2007). Le borofagine che rompono le ossa, come i borofagi, sono dotate di denti molto più robusti e mascelle robuste di quelle dei lupi grigi esistenti (Balisi et al., 2018), anche se come clade non hanno raggiunto il grado di specializzazione morfologica osservato nelle iene (Van Valkenburgh et al., 2003). È quindi ragionevole supporre che il borofago sia in grado di rompere ossa più grandi di quelle dei lupi vivi, possibilmente paragonabili agli ienidi. Se i borofagi consumerebbero sistematicamente o meno un intero scheletro è ancora una questione di speculazione, ma questo probabilmente dipenderà dalla competitività del loro gruppo di alimentazione.
Van Valkenburgh et al., 2003 hanno considerato i grandi canidi borofagini – come Epicicon saevus, E. haydeni, Borophagus secundus, Aelurodon ferox e A. taxoides (B. parvus non è stato incluso nel loro studio) – come cacciatori a causa della loro morfometria craniodentale e dell’abbondanza nel registro dei fossili, così come per considerazioni energetiche. A differenza dei felini che comunemente sviluppano un artiglio retrattile affilato come arma efficace per la cattura delle prede (Gonyea e Ashworth, 1975), i canidi non hanno mai sviluppato un artiglio retrattile (con la possibile eccezione dei loro antenati arboricoli; [Wang, 1993]). Vanvalkenburgh e Hertel (1993) e Van Valkenburgh et al., 2003, hanno quindi sostenuto che questi grandi borofaghi erano probabilmente cacciatori sociali per superare la loro incapacità di catturare grandi prede da un singolo individuo. Inoltre, Carbone et al. (1999) hanno dimostrato una relazione empirica tra la dimensione corporea dei carnivori e la dimensione delle loro prede: i predatori esistenti con una massa corporea di 21,5-25 kg o superiore tendono a predare animali della loro stessa massa corporea o superiore, forse per considerazioni energetiche. La nostra stima della massa corporea per Mehrten B. parvus è di 18,9 ± 1,6 kg in base alla lunghezza del primo molare inferiore o 24,3 ± 3,7 kg in base alla circonferenza ossea degli arti e all’area corticale (vedi Materiali e metodi). Quest’ultimo è generalmente considerato più accurato perché le ossa lunghe, in quanto portatrici dirette di peso, sono proporzionali alle dimensioni del corpo (ad esempio, [Anyonge, 1993]). Mehrten B. parvus è quindi paragonabile per dimensioni del corpo al moderno lupo dalla criniera Chrysocyon brachyurus (23 kg) e al cane selvatico africano Lycaon pictus (24 kg).
A causa di alcuni paralleli dentali e postcranici tra le borofagine e le iene moderne, i “cani ienoidi”, come erano conosciuti in precedenza i borofagini (VanderHoof e Gregory, 1940; Simpson, 1945), sono stati spesso liquidati come semplici spazzini (Munthe, 1989) e come tali non si presumeva che fossero in grado di guidare direttamente l’evoluzione della loro preda. Tali idee sbagliate, tuttavia, sono un mito popolare sulle iene tanto quanto un riflesso dei cani fossili. Fino all’80% del cibo consumato dalle moderne iene maculate è ottenuto dai loro stessi sforzi di caccia (Kruuk, 1972), in contrasto con le iene marroni e a strisce che sono principalmente spazzini onnivori di grandi prede con meno del 5% del cibo consumato da uccisioni fresche (Macdonald, 1978; Rieger, 1981; Mills, 1982). Come cacciatori attivi non dipendenti dalla disponibilità di carogne, le iene maculate hanno tipicamente una densità di popolazione molto maggiore e una distribuzione più ampia rispetto ai loro parenti spazzini. Alcuni grandi borofaghi, come il Borophagus secundus, hanno una distribuzione continentale e un’abbondante documentazione fossile che suggerisce fortemente che anche loro erano cacciatori (Wang et al., 1999; Wang et al., 2008). Al contrario, le iene brune e le iene striate mantengono sia intervalli geografici di specie più piccole sia densità di popolazione più basse, entrambe probabilmente associate alla loro caccia solitaria di prede più piccole rispetto a quelle preferite dalle iene maculate (Wagner, 2006). Dalle sole nuove prove di coprolito, non è chiaro se B. parvus dei Mehrten abbia superato la soglia di taglia e sia diventato un predatore obbligato di grandi prede. Le nostre stime approssimative sulle dimensioni del corpo, basate sul frammento di costola più grande all’interno di uno dei coproliti (LACM 158708), suggeriscono che il Turlock Lake Borophagus probabilmente predava ungulati di dimensioni equivalenti a quelle di un moderno cervo mulo Odocoileus hemionus (45-150 kg), vicuña Vicugna vicugna (35-65 kg) e guanaco Lama guanicoe (90-140 kg): animali sostanzialmente più grandi delle loro dimensioni (vedi Materiali e metodi). Tuttavia, i resti di prede di dimensioni simili sono noti da fonti di iene maculate, striate e brune e potrebbero rappresentare sia animali spazzolati (più probabilmente per le iene striate e brune) sia animali attivamente cacciati (più probabilmente per le iene maculate) (Kruuk, 1972; Wagner, 2006). Combinata con altre prove presentate nei paragrafi precedenti, la presenza di grandi prede è coerente con – anche se non supporta esclusivamente – Borophagus come cacciatori sociali di grandi prede di mammiferi.
Considerazione del ruolo ecologico del Borofago
Morfologicamente, i canidi della borofagina iena si sono evoluti e sono stati limitati al Nord America durante tutta la loro storia fossile. Intorno al periodo dell’estinzione dei Borofagi verso la fine del Pliocene, e segnando la fine delle specie di canidi iena-simili in Nord America, un’unica stirpe di ienidi si è dispersa in Nord America (Berta, 1981; Tseng et al., 2013). Una (potenzialmente due) specie di Chasmaporthetes ienidi, come le iene maculate nella loro capacità biomeccanica craniodentale (Tseng et al., 2011), ma con scheletri postcranici molto più cursorialmente adattati (Berta, 1981), ha lasciato un record fossile diffuso ma raro. Rari fossili di Chasmaporthetes dall’Arizona, Florida e dalla costa del Pacifico del Messico provenienti da località altrimenti produttive suggeriscono che gli ambienti di conservazione erano significativamente diversi tra le località di Borophagus e Chasmaporthetes, oppure che i Chasmaporthetes erano molto meno abbondanti nella densità di popolazione in quelle località. Indipendentemente dalle ragioni dell’apparente rarità degli ienidi nordamericani rispetto ai borofagi, l’ecomorfologia del rompi-ossa si è estinta in Nord America non più tardi delle estinzioni dei megafaoni del Pleistocene. Anche se ci sono prove che un altro canide, il terribile lupo Canis dirus, aveva alcuni gradi di adattamento morfologico per il consumo di alimenti duri come le ossa (Figueirido et al., 2015), la pressione selettiva per tali abitudini alimentari può essere stato di breve durata e sensibile alle condizioni ambientali locali piuttosto che una tendenza macroevolutiva a lungo termine (Van Valkenburgh e Koepfli, 1993; DeSantis et al., 2015).
I tratti morfologici distintivi associati all’ecomorfologia che spacca le ossa (premolari robusti e bulbose, archi zigomatici profondi, regione frontale arcuata e seno frontale espanso) sono o poco sviluppati o assenti nei carnivori esistenti (coyote, volpi, puma) che si trovano oggi nelle regioni geografiche precedentemente occupate da Borofago (Werdelin, 1989; Tseng e Wang, 2010; Tseng e Wang, 2011). Questa differenza suggerisce che non esiste un equivalente morfologico ecologico del Borofago nelle moderne reti alimentari nordamericane. Pertanto, i nuovi dati e la reinterpretazione della morfologia funzionale del Borofago supportano l’inferenza che la loro estinzione ha segnato la fine di una diffusa ecomorfologia spaccaossa in Nord America. In combinazione con il ruolo potenzialmente significativo dei decompositori megafaunistici (al contrario di quelli microbici), come le iene maculate esistenti, nell’influenzare o accelerare i percorsi e i tassi del ciclo dei nutrienti bypassando gli invertebrati e i decompositori microbici nella rete alimentare detritica (Wilson e Wolkovich, 2011), l’estinzione del borofago potrebbe aver avuto un impatto molto più significativo sulle dinamiche della rete alimentare rispetto a quanto precedentemente riconosciuto.
I confronti morfologici e comportamentali di cui sopra suggeriscono che, a prescindere dal fatto che il borofago fosse ecologicamente equivalente alla iena maculata del predatore di punta o alla iena bruna o alla iena striata, di piccole dimensioni, cacciatrice di prede e di grandi prede, una tale nicchia ecologica che spacca le ossa non è più presente nei moderni ecosistemi nordamericani. Inoltre, l’evidenza suggerisce che questo cambiamento nella composizione della comunità ecologica è un fenomeno relativamente recente. (1) Il frequente consumo di ossa nel Borophagus è supportato sia dalla struttura craniodentale che dalla biomeccanica e ora (in questo studio) anche da prove di coprolito, suggerendo che il Borophagus può aver influenzato il flusso di energia nelle reti alimentari nordamericane in modo simile a ciò che gli avvoltoi e le iene possono fare oggi in Africa (DeVault et al., 2003; Wilson e Wolkovich, 2011). (2) La digestione ossea nel Borophagus, come evidenziato dalla composizione dei coproliti, è meno simile a quella delle iene maculate e più simile a quella dei lupi e, in qualche misura, delle iene marroni e striate, suggerendo che il Borophagus è simile alle iene maculate nella morfologia craniodentale più che nella fisiologia gastrointestinale, rappresentando una combinazione unica di tratti. (3) Il record di coprolito di altri canidi e ienidi mostra che il Borophagus si è evoluto per consumare più ossa rispetto ai canidi precedenti, ma non ha raggiunto il grado di digestione ossea evocato dagli ienidi fossili o viventi. (4) La presenza di frammenti ossei di grandi prede di mammiferi è coerente con l’interpretazione del Borophagus come cacciatori di grandi prede, come lupi e iene maculate, ma non preclude un’interpretazione più simile al ruolo ecologico osservato nelle iene marroni e striate. (5) I siti fossili di Borophagus del Miocene e del Pliocene coprono l’area che è, oggi, quasi tutta l’area continentale degli Stati Uniti fino al Messico settentrionale, sovrapponendosi alle attuali gamme di canidi predatori come coyote e volpi e felini come i puma; queste specie viventi sono tutti predatori di alto livello con poche o nessuna delle caratteristiche morfologiche craniodentali ossee osservate nel Borophagus.
Alla luce di questi risultati, un’importante direzione di ricerca futura è quella di esaminare se l’estinzione pre-Ice Age of the hyena-like, bone-eating scavenger rappresentata dal Borophagus ha avuto un effetto fondamentale sull’evoluzione delle dinamiche della rete alimentare (attraverso la modifica del flusso di energia) durante l’era glaciale. Il borofago non è stato sostituito da una morfologia ecologica simile sulla cuspide temporale dell’instaurazione degli ecosistemi nordamericani moderni. Comprendere l’impatto di tale esclusione permanente di un predatore/decompositore sarebbe importante per comprendere le reti alimentari moderne simpatriche.
Conclusione
Contenuti da un nuovo campione di coproliti attribuiti a Borophagus parvus da fine del miocene (5,3-6,4 Ma) sedimenti nel nord della California fornire una visione di prima mano nella dieta di questo gruppo nordamericano di osso-creazione predatori top. La vasta gamma di dimensioni dei frammenti ossei scoperti all’interno dei coproliti suggerisce che questi predatori consumato piccole prede di vertebrati così come cervi mammiferi delle dimensioni di cervi. La digestione incompleta delle ossa delle prede nei coproliti suggerisce anche che, nonostante un grado comparabile di adattamento craniodentale per la durofagia, i canidi spaccaossa possedevano ancora un processo digestivo diverso dalle iene maculate – che sono in grado di scomporre completamente le ossa in polvere – ed erano più simili alle iene striate a questo proposito. Questi risultati suggeriscono che questi canidi che rompono le ossa erano potenzialmente cacciatori sociali con una miscela unica di caratteristiche tipiche dei canidi e caratteristiche simili alla iena. La nicchia ecologica occupata dal comune e diffuso Borophagus non è stata sostituita da altri carnivori o altri mammiferi dopo la loro estinzione pliocenica, indicando potenzialmente un cambiamento fondamentale nelle dinamiche della rete alimentare in Nord America con l’inizio dell’era glaciale.
Materiali e metodi
Tutti i coproliti fossili e i relativi fossili di vertebrati studiati dalla Formazione di Mehrten sono ospitati nel Museo di Storia Naturale della Contea di Los Angeles (LACM). Sono state studiate anche altre collezioni di fossili della Formazione di Mehrten, ospitate nel Museo di Paleontologia dell’Università della California (UCMP). Le stime delle dimensioni del corpo si basano per lo più su confronti nella collezione di Mammalogia del LACM.
Dodici coproliti fossili sono stati scansionati in uno scanner microCT Skyscan1172 con una risoluzione di 26,98 micrometri. Le immagini di base risultanti sono state ricostruite e il set di dati risultante è stato importato nelle Figi (v. 2.0). Nelle Figi, la luminosità e il contrasto dell’immagine sono stati ottimizzati, le immagini sono state convertite da 16 a 8 bit e i pixel sono stati binnati di un fattore due in tutti i piani. Questo set di immagini elaborate è stato poi importato in Avizo Lite 9.0.1 per l’analisi. Per facilitare il rilevamento dei frammenti ossei all’interno della matrice di coprolito, ogni dataset di immagini è stato lisciato separatamente applicando un filtro mediano 3D alle immagini utilizzando valori di prossimità di 6, 18 e 26 pixel. Le immagini trasversali sono state esaminate utilizzando ciascuno dei livelli di lisciatura, così come le immagini originali non lisciate. Le strutture identificate come osso sono state contrassegnate utilizzando lo strumento pennello con l’opzione di gamma limitata per definire con la massima precisione i bordi dell’osso/matrice. Nel caso di frammenti ossei multipli in un coprolito, ciascuno di essi è stato marcato separatamente. Ogni frammento osseo segmentato comprendeva sia la porzione corticale che quella cancellata dove presente (tranne nel caso di un frammento di costola grande). Il modulo di statistica dei materiali Avizo è stato utilizzato per determinare il volume di ogni frammento osseo e la matrice circostante. Gli strumenti di misurazione Avizo sono stati utilizzati per determinare la lunghezza e la larghezza massime di ogni frammento osseo, nonché l’orientamento dell’asse lungo di ogni frammento rispetto all’asse lungo della coprolite.
Fauna, flora, rapporto di età, impostazione deposizionale e paleoclima
VanderHoof (1933) è stato il primo a segnalare un cavallo fossile, Pliohippus tantalus, proveniente dalla vicina Oakdale nella contea di Stanislaus, California. Anche se la località di Oakdale ha prodotto solo pochi fossili da allora, ha segnalato il potenziale di scoperta di fossili di vertebrati nella Formazione di Mehrten, così come di piante associate (VanderHoof, 1933; Axelrod, 1944). Un cranio parziale di Megalonyx mathisi è stato descritto successivamente da Black Rascal Creek in ‘Upper Mehrten Formation’ (Hirschfeld e Webb, 1968). La raccolta sistematica di fossili nell’area del lago Turlock, per lo più da parte di uno di noi (DG), è stata effettuata già negli anni ’50. In una tesi di dottorato non pubblicata, Wagner (1981) ha esaminato l’ambiente geologico e ha delineato un quadro biostratigrafico della Formazione di Mehrten in relazione ai fossili di vertebrati. Più recentemente, Sankey et al. (2015) hanno reinvestigato i siti fossili del lago Turlock e hanno iniziato un processo di integrazione dei fossili di Mehrten in un contesto geologico moderno (informazioni stratigrafiche archiviate in LACM e UCMP) (vedi anche [Sankey e Biewer, 2017]).
La fauna vertebrata del bacino idrico di Modesto Membro della Formazione di Mehrten (come definito in [Wagner, 1981]) era scarsamente diffusa e con adeguate descrizioni di poche forme: un nuovo pesce salmonide “dai denti a sciabola” Smilodonichthys rastrosus (Cavender e Miller, 1972; Sankey et al, 2016), un pesce osseo Orthodon microlepidotus (Casteel e Hutchison, 1973), un tasso del Nuovo Mondo estinto Pliotaxidea garberi (Wagner, 1976), due salamandre pletoriche Aneides lugubris e Batrachoseps sp. (Clark, 1985), e più recentemente, una tartaruga gigante Hesperotestudo orthopygia (Biewer et al., 2014; Biewer et al., 2015; Biewer et al., 2016). Wang et al., 1999 e Tedford et al., 2009 hanno elencato una selezione di borofagine e canidi canini selezionati dalla Formazione di Mehrten senza descrizione o illustrazione. Una revisione sistematica dei canidi di Mehrten è stata completata da Balisi et al. (2018) che ha riconosciuto quattro specie: Borophagus parvus, B. secundus, Vulpes stenognathus e Eucyon davisi. Si veda Wagner (1981) per un elenco faunistico preliminare del resto dei mammiferi inediti.
I quattro canidi di cui sopra sono tutti conosciuti nell’era dei mammiferi terrestri nordamericani efiliani (Wang et al., 1999; Tedford et al., 2009). Il borofago parvus parvus, tuttavia, è il più restrittivo sia nella fascia geografica (sud-occidentale degli Stati Uniti) che cronologica (tardo Efilliano), offrendo il miglior potenziale per la valutazione dell’età. Wang et al. (1999) hanno commentato la caratteristica dentale leggermente più derivata del Mehrten B. parvus, rispetto ai materiali topotype della Fauna locale di Redington nel membro inferiore della formazione di Quiburis nella Contea di Pima, Arizona sud-orientale, che è stata magneticamente limitata all’interno di Chron 3An.2n (6.436-6.733 Ma) (Lindsay et al., 1984; Hilgen et al., 2012). Se questi caratteri sono il risultato di una cronoclina, il Mehrten B. parvus può essere leggermente più giovane della sua controparte dell’Arizona. Wagner (1981) ha considerato la Fauna Locale del Bacino di Modesto equivalente in età alla Fauna Locale di Pinole nell’area della Baia di San Francisco, che è sovrapposta da un tufo datato (5,3 ± 0,1 Ma) all’interno della Formazione di Pinole e collocato nell’ultimo Hemphillian (Hh4) (Tedford et al., 2004). Se i confronti di cui sopra sono corretti, la Fauna Locale del Bacino di Modesto dovrebbe rientrare nell’ultimo Efilliano (Hh4), possibilmente entro 5.3-6.4 Ma.
Da due località, T-14 (località LACM 3917, Isola del Fosso d’Oca Cemento =UCMP V6878=V90008) e T-20 (località LACM 3923, Leaf Island), su due piccole isole nella parte occidentale del lago Turlock (la prima mostrata in Figura 9A), Axelrod (1980) ha elencato 25 specie di piante fossili di quella che ha chiamato Turlock Late Flora, composta da 8 alberi (tra cui una conifera), 13 arbusti, 3 piante erbacee perenni, e 1 o 2 viti. In particolare, i taxa acquatici, come Cyperus (flatsedges), Juncus (giunchi) e Typha (code di gatto), sono noti per vivere lungo i margini di ruscelli, laghi e stagni, e le località di piante fossili sono state proposte come depositi lacustri “a una certa distanza dalla riva” (Axelrod, 1980). Questa flora era caratterizzata come un bosco di querce-savana e un assemblaggio di pianure alluvionali, e i confronti con la vegetazione moderna delle regioni vicine suggerivano un paleoclima leggermente più fresco (temperatura media annuale 15,5°C) e considerevolmente più umido (precipitazioni 635 mm) rispetto all’attuale area del Turlock Lake (17,5°C e 335 mm per le misure corrispondenti). Questo spostamento verso un clima più continentale nell’odierno Turlock Lake è stato suggerito dall’innalzamento della fascia costiera e dai suoi effetti di ombreggiamento della pioggia durante il Pleistocene (Axelrod, 1980).
La maggior parte dei coprolites completi abbastanza per essere assegnati ad un numero di campo Dennis Garber sono prodotti da un’unica località, la località LACM 3937 (=UCMP località V68134, Dennis Garber T-34), mentre un solo coprolite è della località LACM 3935 (=Dennis Garber T-32) (Figura 9A). Entrambi si trovano nell’angolo nord-occidentale del lago Turlock; si trovano a meno di 300 m l’uno dall’altro e provengono approssimativamente dallo stesso orizzonte stratigrafico. T-32 è stato successivamente suddiviso all’interno di T-34 come una singola località. Le esposizioni che producono fossili sono in una vasta area che forma una forma a gomito. All’estremità nord, ci sono due strati di cenere vulcanica bianca a sandwich un argilla limosa marrone (Figura 9B). Questa esposizione di cenere continua all’estremità orientale dell’area, che ha una litologia simile a quelle ad ovest, anche se sembra esserci un rapporto più alto tra argilla e limo e il contatto tra la cenere e l’argilla sembra più nitido. ([Retallack, 1997]:foto a colori 24) ha osservato che i coproliti carnivori sono comuni nelle sequenze di terreni ben drenati a causa della loro composizione fosfatica e delle ossa chiuse.
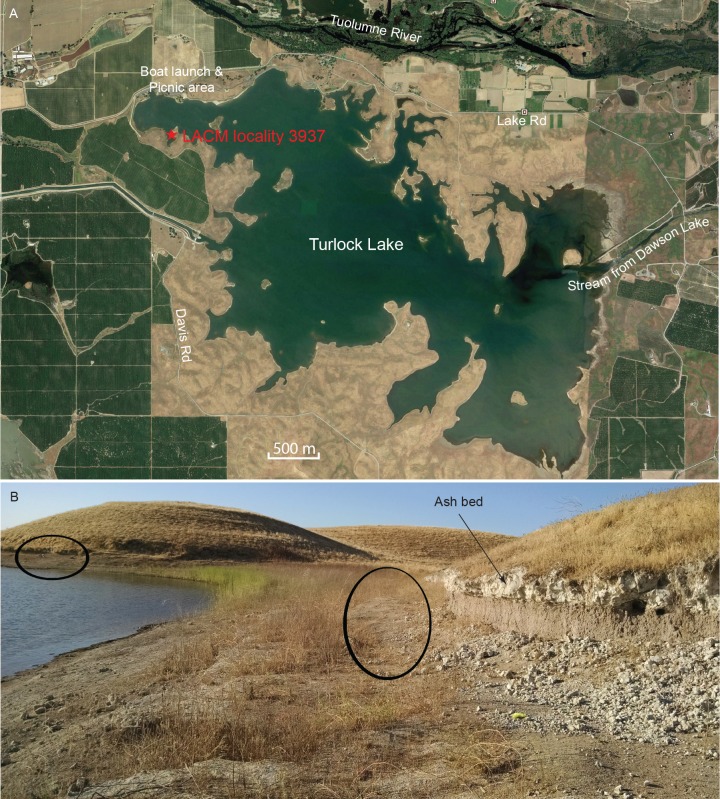
Figura 9.Mappa e foto della località dei coproliti.(A) immagine satellitare dell’area del lago Turlock (37°36-37’N 120°34-36’W) da Google Earth Pro, data immagine 31 marzo 2015 (Google Earth Pro (versione 7.1.5.1557), [Google Inc, 2015]); la stella rossa è la posizione approssimativa della località LACM 3937 (= località Dennis Garber T-34) e della località LACM 3935 (= località Dennis Garber T-32). (B) località LACM 3937, che guarda a sud; gli ovali neri sono posizioni approssimative degli orizzonti produttori di fossili e quella a sinistra è la posizione dei coproliti; fotografia di Jacob Biewer del 5 settembre 2015.

Figura 9.Mappa e foto della località di coprolito.(A) immagine satellitare dell’area del lago Turlock (37°36-37’N 120°34-36’W) da Google Earth Pro, data immagine 31 marzo 2015 (Google Earth Pro (versione 7.1.5.1557), [Google Inc, 2015]); la stella rossa è la posizione approssimativa della località LACM 3937 (= località Dennis Garber T-34) e della località LACM 3935 (= località Dennis Garber T-32). (B) località LACM 3937, che guarda a sud; gli ovali neri sono posizioni approssimative degli orizzonti produttori di fossili e quella a sinistra è la posizione dei coproliti; fotografia di Jacob Biewer del 5 settembre 2015.
Stima delle dimensioni del corpo del predatore
Diverse equazioni di regressione mettono in relazione le misurazioni scheletriche o dentali con la massa corporea dei canidi esistenti e di altri carnivori (Van Valkenburgh, 1990; Anyonge, 1993; Anyonge e Roman, 2006), consentendo di prevedere la massa corporea dei canidi estinti sulla base di misurazioni di elementi isolati. I proxy della massa corporea e la loro affidabilità differiscono leggermente, con misure dell’area della sezione trasversale delle ossa degli arti prossimali portanti che generano stime più accurate rispetto ai predittori dentali. I predittori dentali sono comunque utili, tuttavia, perché i denti tendono ad essere conservati più abbondantemente rispetto alla postcrania.
Utilizzando l’equazione di Van Valkenburgh (1990), abbiamo generato una distribuzione delle masse corporee a partire dalle lunghezze di 76 primi molari inferiori (carnassiali) di B. parvus compilati da Wang et al. (1999) e Balisi et al. (2018). Abbiamo anche misurato due omeri di B. parvus ben conservati (F:AM 75903-B, F:AM 67955) e un femore (F:AM 63008-A) presso il Museo Americano di Storia Naturale, utilizzando le equazioni canide di Anyonge (1993) per calcolare la massa corporea a partire dalla circonferenza omerale, dalla sezione trasversale corticale e dai secondi momenti di area.
Basandosi sulle lunghezze dei primi molari inferiori, B. parvus ha una massa corporea mediana di 18,9 ± 1,6 kg (Figura 10). La popolazione dell’Arizona, con una massa mediana di 19,2 ± 1,6 kg, tende ad essere più grande nella dimensione del corpo rispetto alla popolazione della California, con una massa mediana di 18,1 ± 2,0 kg.
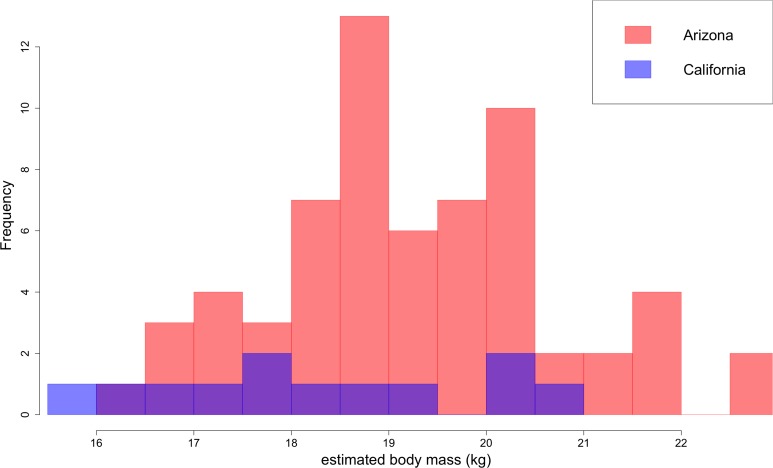
Figura 10.Figura 10. Distribuzione della massa corporea di B. parvus stimata a partire dalle lunghezze del primo molare inferiore (carnassiale) utilizzando l’equazione di Van Valkenburgh (1990).La popolazione dell’Arizona tende ad essere più grande nella dimensione del corpo rispetto alla popolazione della California, che comprende in gran parte gli individui di Turlock Lake.
Le equazioni che utilizzano misure dell’omero e del femore, tutti gli esemplari della popolazione dell’Arizona, hanno generato stime più elevate rispetto alle stime dentali sia della popolazione dell’Arizona che della California. Per F:AM 75903-B, un omero distale, abbiamo calcolato la massa corporea utilizzando un’approssimazione della circonferenza (22,8 kg), dell’area corticale (25,829 kg), del secondo momento di area nel piano anteroposteriore (20,898 kg) e del secondo momento di area nel piano mediolaterale (29,33 kg); queste quattro stime hanno prodotto una misura mediana di 24,315 ± 3,656 kg. Per F:AM 67955, un omero completo, abbiamo ottenuto una stima delle dimensioni del corpo di 32,4 kg utilizzando un’approssimazione della circonferenza. Per F:AM 63008-A, un femore prossimale, abbiamo stimato 20,2 kg.
Queste stime dentali e postcraniche della massa corporea collocano B. parvus nella stessa classe dimensionale del dingo Canis lupus dingo (20 kg), lupo criniera Chrysocyon brachyurus (23 kg), cane selvatico africano Lycaon pictus (24 kg), lupo rosso Canis rufus (30 kg), e iena striata Hyaena hyaena hyaena (35 kg) (Nowak, 1999; Macdonald, 2006). Queste specie esistenti (tranne il crisocione onnivoro) sono da carnivore a ipercarnivoro.

Figura 10.Distribuzione della massa corporea di B. parvus stimata a partire dalle lunghezze del primo molare inferiore (carnassiale) utilizzando l’equazione di Van Valkenburgh (1990).La popolazione dell’Arizona tende ad essere più grande nella dimensione del corpo rispetto alla popolazione della California, che comprende in gran parte gli individui di Turlock Lake.
Stima delle dimensioni corporee delle prede
Diverse specie di ungulati fossili sono state registrate al lago Turlock (Wagner, 1981), fornendo un bacino di potenziali prede taxa e un punto di partenza per la nostra analisi. Abbiamo assemblato una collezione comparativa di 14 individui di ungulati appartenenti a 12 specie esistenti presso il LACM, che abbraccia il più possibile la diversità familiare conservata al Turlock Lake (Tabella 2). Ogni esemplare comprendeva una serie completa di costole su almeno un lato del corpo. Abbiamo cercato di campionare le famiglie di ungulati registrate da Wagner (1981) o, se estinte, la famiglia esistente più strettamente correlata (ad esempio, i Cervidi esistenti come proxy per i Paleomericidi). I perissodattili esistenti non sono stati campionati perché i perissodattili del lago Turlock tendono ad essere o equidi preistorici più piccoli degli equidi moderni, per i quali gli artiodattili esistenti più piccoli potrebbero servire come proxy, o i Teleoceras rinocerontidi, che sono probabilmente troppo grandi per generare il frammento di costola conservato nel coprolito.
Il frammento di costola di coprolito ha una larghezza anteroposteriore di 9,1 mm e uno spessore mediolaterale di 5,2 mm. Utilizzando i calibri Mitutoyo con un’approssimazione di 0,01 mm, abbiamo registrato due misurazioni su ciascuna delle 13 costole per specie: (1) lo spessore mediolaterale nel punto in cui misurava 9,1 mm anteroposteriore, e (2) la larghezza anteroposteriore nel punto in cui misurava 5,2 mm mediolaterale (Figura 11). Le 13 misurazioni delle costole per specie sono state visualizzate utilizzando trame di linee. Le specie rappresentate da linee che intersecano la linea orizzontale che segnava la corrispondente misurazione della costola coprolita sono state interpretate come vicine per dimensioni all’animale da preda rappresentato dalla costola. Poiché gli esemplari non disponevano di metadati che includessero la massa corporea, abbiamo ottenuto dalla letteratura stime della massa corporea delle specie.

Figura 11.Metodi di misurazione delle costole illustrati su metà di una gabbia toracica di cervo di Eld (Cervus eldi).Le costole anteriori sono a destra; posteriori, a sinistra. Per questa serie di misurazioni, le targhette colorate indicano dove ogni costola misura 9,1 mm di larghezza anteroposteriore. Il corrispondente spessore mediolaterale nei punti contrassegnati è stato poi registrato. Le costole senza etichetta colorata erano più larghe o più strette per gran parte della loro lunghezza rispetto alle due misure fisse di larghezza e spessore della coprolite.
La Figura 12 traccia la larghezza anteroposteriore o lo spessore mediolaterale di ogni costola tra i taxa esistenti rispetto alle corrispondenti misurazioni nel frammento di costola di coprolito. Le lacune nei dati indicano che le costole erano più larghe o più strette per gran parte della loro lunghezza rispetto alle due misurazioni fisse, e quindi non sono state misurate.
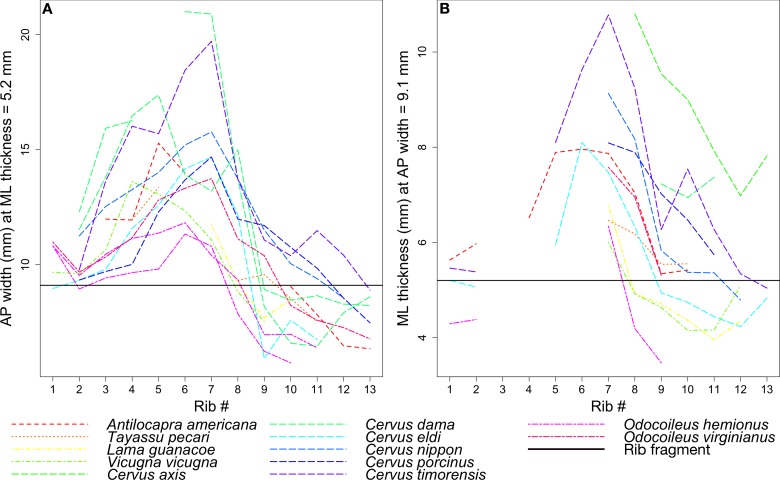
Figura 12.Misurazioni delle costole per specie.La linea nera orizzontale in entrambe le trame indica la misura corrispondente per il frammento di costola di coprolito. (A) Larghezza anteroposteriore della costola dove ha uno spessore mediolaterale di 5,2 mm, lo spessore del frammento di costola. (B) Spessore mediolaterale della costola dove ha una larghezza anteroposteriore di 9,1 mm, la larghezza del frammento di costola.
Data la sua morfologia relativamente piatta, è improbabile che il frammento di costola coprolita provenga dalle costole 1 o 2, che tendono ad essere rotonde in sezione trasversale, nonostante le linee che rappresentano queste costole nella Figura 12 che intersecano la linea nera che segna il frammento. In generale, le costole esaminate cominciano ad appiattirsi intorno alla costola 3 o 4, e diventano approssimativamente quadrate intorno alla costola 7 fino alla costola 10 prima di restringersi e arrotondarsi di nuovo nella costola 11 fino alla fine. Pertanto, ci siamo concentrati sulle linee di specie che intersecano la linea del frammento solo intorno alla costola 7 alla costola 10.
Dati i punti di intersezione delle linee di specie con la linea del frammento, le tre specie di ungulati più vicine per dimensioni all’animale la cui costola è conservata nel coprolito sono il cervo mulo Odocoileus hemionus (45-150 kg), la vicuna Vicugna vicugna (35-65 kg), e il guanaco Lama guanicoe (90-140 kg) (Nowak, 1999; Macdonald, 2006).

Figura 11.Metodi di misurazione delle costole illustrati su metà di una gabbia toracica di cervo di Eld (Cervus eldi).Le costole anteriori sono a destra; posteriori, a sinistra. Per questa serie di misurazioni, le targhette colorate indicano dove ogni costola misura 9,1 mm di larghezza anteroposteriore. Il corrispondente spessore mediolaterale nei punti contrassegnati è stato poi registrato. Le costole senza etichetta colorata erano più larghe o più strette per gran parte della loro lunghezza rispetto alle due misure fisse di larghezza e spessore della coprolite.

Figura 12.Misurazioni delle costole per specie.La linea nera orizzontale in entrambe le trame indica la misura corrispondente per il frammento di costola di coprolito. (A) Larghezza anteroposteriore della costola dove ha uno spessore mediolaterale di 5,2 mm, lo spessore del frammento di costola. (B) Spessore mediolaterale della costola dove ha una larghezza anteroposteriore di 9,1 mm, la larghezza del frammento di costola.
References
- Anyonge W, Roman C. New body mass estimates for Canis dirus, the extinct Pleistocene dire wolf. Journal of Vertebrate Paleontology. 2006; 26:209-212. DOI
- Anyonge W. Body mass in large extant and extinct carnivores. Journal of Zoology. 1993; 231:339-350. DOI
- Asa CS, Mech LD, Seal US. The use of urine, faeces, and anal-gland secretions in scent-marking by a captive wolf (Canis lupus) pack. Animal Behaviour. 1985; 33:1034-1036. DOI
- Axelrod DI. The Mulholland flora. Carnegie Institute of Washington Publication Contributions to Paleontology. 1944; 553:103-146.
- Axelrod DI. Contributions to the Neogene paleobotany of central California. University of California Publication in Geological Sciences. 1980; 121:1-212.
- Balisi M, Casey C, Van Valkenburgh B. Dietary specialization is linked to reduced species durations in North American fossil canids. Royal Society Open Science. 2018b. DOI
- Balisi M, Wang X, Sankey J, Biewer J, Garber D. Fossil canids from the Mehrten Formation, Late Cenozoic of Northern California. Journal of Vertebrate Paleontology. 2018a; 38DOI
- Beasley DE, Koltz AM, Lambert JE, Fierer N, Dunn RR. The evolution of stomach acidity and its relevance to the human microbiome. PLoS One. 2015; 10DOI | PubMed
- Berta A. The Plio-Pleistocene hyaena Chasmaporthetes ossifragus from Florida. Journal of Vertebrate Paleontology. 1981; 1:341-356. DOI
- Biewer J, Sankey J, Hutchison JH, Garber D. A fossil giant tortoise from the Mehrten Formation of northern California. PaleoBios. 2016; 33:1-13.
- Biewer J, Sankey J, Hutchison JH, Wagner HM, Garber D. First identification and description of the Great Plains giant tortoise Hesperotestudo cf. H. orthopygia from the early Pliocene (Hemphillian) Mehrten Formation of Stanislaus County, California. Journal of Vertebrate Paleontology. 2015; 90
- Biewer J, Sankey J, Hutchison JH, Wagner HM, Wilson W, Gonzales M. Giant tusk-tooth salmon and Galapogos-sized tortoises from the latest Miocene of Central California. Journal of Vertebrate Paleontology. 2014; 92
- Carbone C, Mace GM, Roberts SC, Macdonald DW. Energetic constraints on the diet of terrestrial carnivores. Nature. 1999; 402:286-288. DOI | PubMed
- Casteel RW, Hutchison JH. Orthodon (Actinopterygii, Cyprinidae) from the Pliocene and Pleistocene of California. Copeia. 1973; 1973:358-361. DOI
- Cavender TM, Miller RR. Smilodonichthys rastrosus a new Pliocene salmonid fish from western United States. Bulletin of the Museum of Natural History University of Oregon. 1972; 18:1-44.
- Clark JM. Fossil Plethodontid Salamanders from the latest Miocene of California. Journal of Herpetology. 1985; 19:41-47. DOI
- Creel S. Four factors modifying the effect of competition on carnivore population dynamics as illustrated by African wild dogs. Conservation Biology. 2001; 15:271-274. DOI
- DeSantis LRG, Schubert BW, Schimitt-Linville E, Ungar PS, Donohue SL, Haupt RJ. Dental microwear textures of carnivorans from the La Brea Tar Pits, California, and potential extinction implications. Natural History Museum of Los Angeles County Science Series. 2015; 42:37-52.
- DeSantis LRG, Tseng ZJ, Liu J, Hurst A, Schubert BW, Jiangzuo Q. Assessing niche conservatism using a multiproxy approach: dietary ecology of extinct and extant spotted hyenas. Paleobiology. 2017; 43:286-303. DOI
- DeVault TL, Rhodes, Jr. OE, Shivik JA. Scavenging by vertebrates: behavioral, ecological, and evolutionary perspectives on an important energy transfer pathway in terrestrial ecosystems. Oikos. 2003; 102:225-234. DOI
- Diedrich CG. Typology of Ice Age spotted hyean Crocuta crocuta spelaea (Goldfuss, 1823) coprolite aggregate pellets from the European late Pleistocene and their significance at dens and scavenging sites. New Mexico Museum of Natural History and Science Bulletin. 2012; 57:369-378.
- Eastoe JE, Eastoe B. The organic constituents of mammalian compact bone. Biochemical Journal. 1954; 57:453-459. DOI | PubMed
- Esteban-Nadal M, Cáceres I, Fosse P. Characterization of a current coprogenic sample originated by Canis lupus as a tool for identifying a taphonomic agent. Journal of Archaeological Science. 2010; 37:2959-2970. DOI
- Estes RD. The Behavior Guide to African Mammals, Including Hoofed Mammals, Carnivores, Primates. University of California Press: Berkeley; 1991.
- Figueirido B, Martín-Serra A, Tseng ZJ, Janis CM. Habitat changes and changing predatory habits in North American fossil canids. Nature Communications. 2015; 6DOI | PubMed
- Floyd TJ, Mech LD, Jordan PA. Relating wolf scat content to prey consumed. The Journal of Wildlife Management. 1978; 42:528-532. DOI
- Fosse P, Wajrak A, Fourvel J-B, Madelaine S, Esteban-Nadal M, Cáceres I, Yravedra J, Brugal J-P, Prucca A, Haynes G. Bone modification by modern wolf (Canis lupus): a taphonomic study from their natural feeding places. Journal of Taphonomy. 2012; 10:197-217.
- Fourvel J-B, Fosse P, Fernandez P, Antoine P-O. Large mammals of Fouvent-Saint-Andoche (Haute-Saône, France): a glimpse into a Late Pleistocene hyena den. Geodiversitas. 2015; 37:237-266. DOI
- Gese EM, Ruff RL. Scent-marking by coyotes, Canis latrans: the influence of social and ecological factors. Animal Behaviour. 1997; 54:1155-1166. DOI | PubMed
- Ginsburg L. The Miocene Land Mammals of Europe. Verlag Dr. Friedrich Pfeil: München; 1999.
- Gonyea W, Ashworth R. The form and function of retractile claws in the Felidae and other representative carnivorans. Journal of Morphology. 1975; 145:229-238. DOI | PubMed
- Google Inc. Mountain View, CA; 2015. Publisher Full Text
- Guyton JE, Hall AC. Textbook of Medical Physiology. W. B. Saunders: Philadelphia; 2006.
- Harrington FH, Asa CS. Wolves: Behavior, Ecology, and Conservation. University of Chicago Press: Chicago; 2003.
- Harrison T. Paleontology and Geology of Laetoli: Human Evolution in Context. Volume 1: Geology, Geochronology, Paleoecology and Paleoenvironment, Vertebrate Paleobiology and Paleoanthropology. Springer: New York; 2011.
- Hilgen FJ, Lourens LJ, Van Dam JA, Beu AG, Foyes AF, Cooper RA, Krijgsman W, Ogg JG, Piller WE, Wilson DS. The Geologic Time Scale 2012. Elsevier: Amsterdam; 2012. DOI
- Hirschfeld SE, Webb SD. Plio-Pleistocene megalonychid sloths of North America. Bulletin of the Florida State Museum, Biological Sciences Series. 1968; 12:213-296.
- Hulsman A, Dalerum F, Swanepoel L, Ganswindt A, Sutherland C, Paris M. Patterns of scat deposition by brown hyaenas Hyaena brunnea in a mountain savannah region of South Africa. Wildlife Biology. 2010; 16:445-451. DOI
- Kingdon J. East African Mammals, an Atlas of Evolution in Africa: Volume IIIA (Carnivores). Academic Press: London; 1977.
- Klippel WE, Snyder LM, Parmalee PW. Taphonomy and archaeologically recovered mammal bone from southeast Missouri. Journal of Ethnobiology. 1987; 7:155-169.
- Koepfli KP, Jenks SM, Eizirik E, Zahirpour T, Van Valkenburgh B, Wayne RK. Molecular systematics of the Hyaenidae: relationships of a relictual lineage resolved by a molecular supermatrix. Molecular Phylogenetics and Evolution. 2006; 38:603-620. DOI | PubMed
- Kolska Horwitz LR. The origin of partially digested bones recovered from archaeological contexts in Israel. Paléorient. 1990; 16:97-106. DOI
- Kruuk H. The Spotted Hyena: A Study of Predation and Social Behavior. University of Chicago Press: Chicago; 1972.
- Leakey LN, Milledge SAH, Leakey SM, Edung J, Haynes P, Kiptoo DK, McGeorge A. Diet of striped hyaena in northern Kenya. African Journal of Ecology. 1999; 37:314-326. DOI
- Lindsay EH, Opdyke ND, Johnson NM. Blancan-Hemphillian land mammal ages and late cenozoic mammal dispersal events. Annual Review of Earth and Planetary Sciences. 1984; 12:445-488. DOI
- Lofgren DL, Shen C, Duday N, Ylagan C, Lofgren K, Homidan J, Santana-Grace D, Lai R. Coprolites from Pipestone Springs Main Pocket, Montana, and their paleoecological and taphonomic significance. Journal of Vertebrate Paleontology. 2015; 2015:166.
- Macdonald DW. Observations on the behaviour and ecology of the striped hyaena, Hyaena hyaena, in Israel. Israel Journal of Zoology. 1978; 27:189-198.
- Macdonald DW. The Encyclopedia of Mammals. Oxford University Press: Oxford; 2006.
- Mills MGL. Hyaena brunnea. Mammalian Species. 1982; 194:1-5. DOI
- Munthe K. The skeleton of the Borophaginae (Carnivora, Canidae), morphology and function. University of California Publications Bulletin of the Department of Geological Sciences. 1989; 133:1-115.
- Nowak RM. Walker’s Mammals of the World. The Johns Hopkins University Press: Baltimore; 1999.
- Parris DC, Holman JA. An Oligocene snake from a coprolite. Herpetologica. 1978; 34:258-264.
- Qiu Z-x, Ye J, Cao J-x. A new species of Percrocuta from Tongxin, Ningxia. Vertebrata PalAsiatica. 1988; 26:116-127.
- Reid REB. A morphometric modeling approach to distinguishing among bobcat, coyote and gray fox scats. Wildlife Biology. 2015; 21:254-262. DOI
- Rensberger JM, Wang X. Microstructural reinforcement in the canine enamel of the hyaenid Crocuta crocuta, the FelidPuma concolorand the late miocene canid Borophagus secundus. Journal of Mammalian Evolution. 2005; 12:379-403. DOI
- Retallack GJ. A Colour Guide to Paleosols. John Wiley & Sons Ltd: New York; 1997.
- Rieger I. Hyaena hyaena. Mammalian Species. 1981; 150:1-5.
- Rybczynski N. Castorid phylogenetics: Implications for the evolution of swimming and tree-exploitation in beavers. Journal of Mammalian Evolution. 2007; 14:1-35. DOI
- Sagawa K, Li F, Liese R, Sutton SC. Fed and fasted gastric pH and gastric residence time in conscious beagle dogs. Journal of Pharmaceutical Sciences. 2009; 98:2494-2500. DOI | PubMed
- Sankey J, Biewer J, Basuga J, Palacio F, Wagner HM, Garber D. The giant, spike-toothed salmon, Oncorhynchus rastrosus and the "Proto-Tuolumne River" early Pliocene of Central California. PaleoBios. 2016; 33:1-6.
- Sankey JT, Biewer J, Wilson W, Basuga J, George M, Palacio F. Kayaking for paleo – relocating and documenting the turlock lake fossil sites, upper mehrten formation (Early Pliocene: Hemphillian LMA) Stanislaus County, California. Journal of Vertebrate Paleontology. 2015;207.
- Sankey JT, Biewer J. The Giant Spike-Toothed Salmon and Other Extinct Wildlife of Central California. Dowitcher Press: Santa Barbara, California; 2017.
- Sanz M, Daura J, Égüez N, Brugal J-P. Not only hyenids: a multi-scale analysis of upper pleistocene carnivore coprolites in cova del coll verdaguer (NE Iberian Peninsula). Palaeogeography, Palaeoclimatology, Palaeoecology. 2016; 443:249-262. DOI
- Silvestre I, Novelli O, Bogliani G. Feeding habits of the spotted hyaena in the Niokolo Koba National Park, Senegal. African Journal of Ecology. 2000; 38:102-107. DOI
- Simpson GG. The principles of classification and a classification of mammals. Bulletin of the American Museum of Natural History. 1945; 85:1-350.
- Spaulding M, Flynn JJ. Phylogeny of the Carnivoramorpha: the impact of postcranial characters. Journal of Systematic Palaeontology. 2012; 10:653-677. DOI
- Stahler DR, Smith DW, Guernsey DS. Foraging and feeding ecology of the gray wolf (Canis lupus): lessons from Yellowstone National Park, Wyoming, USA. The Journal of Nutrition. 2006; 136:1923S-1926. DOI | PubMed
- Tedford RH, Albright LB, Barnosky AD, Ferrusquía-Villafranca I, Hunt RM, Storer JE, Swisher CC, Voorhies MR, Webb SD, Whistler DP. Late Cretaceous and Cenozoic Mammals of North America. Columbia University Press: New York; 2004. DOI
- Tedford RH, Wang X, Taylor BE. Phylogenetic Systematics of the North American Fossil Caninae (Carnivora: Canidae). Bulletin of the American Museum of Natural History. 2009; 325:1-218. DOI
- Tseng ZJ, Antón M, Salesa MJ. The evolution of the bone-cracking model in carnivorans: cranial functional morphology of the Plio-Pleistocene cursorial hyaenid Chasmaporthetes lunensis (Mammalia: Carnivora). Paleobiology. 2011; 37:140-156. DOI
- Tseng ZJ, Li Q, Wang X. A new cursorial hyena from Tibet, and analysis of biostratigraphy, paleozoogeography, and dental morphology of Chasmaporthetes (Mammalia, Carnivora). Journal of Vertebrate Paleontology. 2013; 33:1457-1471. DOI
- Tseng ZJ, Wang X. Cranial functional morphology of fossil dogs and adaptation for durophagy in Borophagus and Epicyon (Carnivora, Mammalia). Journal of Morphology. 2010; 271:1386-1398. DOI | PubMed
- Tseng ZJ, Wang X. Do convergent ecomorphs evolve through convergent morphological pathways? Cranial shape evolution in fossil hyaenids and borophagine canids (Carnivora, Mammalia). Paleobiology. 2011; 37:470-489. DOI
- Tseng ZJ. Variation and implications of intra-dentition Hunter-Schreger band pattern in fossil hyaenids and canids (Carnivora, Mammalia). Journal of Vertebrate Paleontology. 2011; 31:1163-1167. DOI
- Tseng ZJ. Testing adaptive hypotheses of convergence with functional landscapes: a case study of bone-cracking hypercarnivores. PLoS ONE. 2013; 8DOI | PubMed
- Van Valkenburgh B, Koepfli K-P. Mammals as Predators. Oxford University Press: Oxford; 1993.
- Van Valkenburgh B, Sacco T, Wang X. Vertebrate Fossils and Their Context: Contributions in Honor of Richard H. Tedford. Bulletin of the American Museum of Natural History; 2003. DOI
- Van Valkenburgh B. Body Size in Mammalian Paleobiology: Estimation and Biological Implications. Cambridge University Press: Cambridge; 1990.
- VanderHoof VL, Gregory JT. A review of the genus Aelurodon. University of California Publications Bulletin of the Department of Geological Sciences. 1940; 25:143-164.
- VanderHoof VL. A skull of Pliohippus tantalus from the later Tertiary of the Sierran foothills of California. University of California Publications Bulletin of the Department of Geological Sciences. 1933; 23:183-193.
- Vanvalkenburgh B, Hertel F. Tough times at la brea: tooth breakage in large carnivores of the late pleistocene. Science. 1993; 261:456-459. DOI | PubMed
- Wagner AP. Biological Sciences. Montana State University: Bozeman; 2006.
- Wagner HM. A new species of Pliotaxidea (Mustelidae: Carnivora) from California. Journal of Paleontology. 1976; 50:107-127.
- Wagner HM. Geochronology of the Mehrten Formation in Stanislaus County. California. Ph.D. dissertation, Dep. Geology, University California: Riverside; 1981.
- Wang X, Tedford RH, Antón M. Dogs: Their Fossil Relatives & Evolutionary History. Columbia University Press: New York; 2008. DOI
- Wang X, Tedford RH, Taylor BE. Phylogenetic systematics of the Borophaginae (Carnivora: Canidae). Bulletin of the American Museum of Natural History. 1999; 243:1-391.
- Wang X. Transformation from plantigrady to digitigrady: functional morphology of locomotion in Hesperocyon (Canidae: Carnivora). American Museum Novitates. 1993; 3069:1-23.
- Wang X. Phylogenetic systematics of the Hesperocyoninae (Carnivora: Canidae). Bulletin of the American Museum of Natural History. 1994; 221:1-207.
- Watts HE, Holekamp KE. Hyena societies. Current Biology. 2007; 17:R657-R660. DOI | PubMed
- Weaver JL, Fritts SH. Comparison of coyote and wolf scat diameters. The Journal of Wildlife Management. 1979; 43:786-788. DOI
- Weaver JL. Refining the equation for interpreting prey occurrence in gray wolf scats. The Journal of Wildlife Management. 1993; 57:534-538. DOI
- Werdelin L, Solounias N. The Hyaenidae: taxonomy, systematics and evolution. Fossils and Strata. 1991; 30:1-104.
- Werdelin L. Constraint and adaptation in the bone-cracking canid Osteoborus (Mammalia: Canidae). Paleobiology. 1989; 15:387-401. DOI
- Wilson EE, Wolkovich EM. Scavenging: how carnivores and carrion structure communities. Trends in Ecology & Evolution. 2011; 26:129-135. DOI | PubMed
Fonte
Wang X, White SC, Balisi M, Biewer J, Sankey J, et al. () First bone-cracking dog coprolites provide new insight into bone consumption in . eLife 7e34773. https://doi.org/10.7554/eLife.34773





