Introduzione
L’intestino umano ospita una comunità microbica abbondante e diversificata che è unica per un individuo come un’impronta digitale (Human Microbiome Project Consortium, 2012). Nonostante la variabilità tra gli individui, è chiaro che la composizione e la funzionalità del microbiota intestinale si associa alla salute dell’ospite, avendo funzioni specializzate nella nutrizione, nel metabolismo energetico, nello sviluppo del sistema immunitario e nella difesa dell’ospite (Thursby e Juge, 2017). La composizione del microbiota intestinale è modellata da influenze sia genetiche che ambientali, attraverso un processo continuo che può iniziare nell’utero (Perez-Muñoz et al., 2017) e fluttua per tutta la vita di un individuo (Odamaki et al., 2016). In un adulto sano, la popolazione batterica all’interno dell’intestino è costituita prevalentemente da membri dei Firmicutes e dei Bacteroidetes phyla strettamente anaerobici, con rappresentazioni minori di membri dei Proteobacteria e Actinobacteria phyla (Eckburg et al., 2005; Ley et al., 2008).
Poiché non esistono due microbiomi intestinali identici, la definizione di ciò che comprende un microbioma intestinale sano dal punto di vista dell’inventario rimane poco chiara (Human Microbiome Project Consortium, 2012). Nonostante ciò, è generalmente accettato che avere una comunità intestinale stabile e diversificata sia correlato a uno stato intestinale sano (Lloyd-Price et al., 2016). Un’alterazione del microbiota che è associata a esiti funzionali negativi sulla fisiologia intestinale, come un’infiammazione localizzata o un’elaborazione metabolica disturbata, è nota come disbiosi intestinale (Petersen e Round, 2014). Tipicamente, la disbiosi intestinale è caratterizzata da una bassa diversità microbica (Kriss et al., 2018).
Le osservazioni delle disbiosi microbiche sono sempre più spesso associate a una vasta gamma di malattie umane, comprese le allergie (Penders et al., 2007; Bunyavanich et al., 2016), l’asma (Arrieta et al., 2015), le malattie infiammatorie intestinali (IBD) (Fujimoto et al., 2013; Gevers et al., 2014; Takahashi et al., 2016; Nishino et al., 2018), sindrome dell’intestino irritabile (IBS) (Liu et al., 2017), obesità (Schwiertz et al., 2010) e malattie cardiovascolari (Cui et al., 2017; Jie et al., 2017). Tuttavia, l’evidenza che la disbiosi è causale nello sviluppo di queste condizioni rimane difficile da stabilire, in tutti i casi tranne che in alcuni. L’uso di topi privi di germi, nati e cresciuti in un ambiente sterile, gioca un ruolo fondamentale nel dimostrare le associazioni causali tra il microbiota intestinale e la malattia (Balish e Warner, 2002; Bäckhed et al., 2004; Berer et al., 2011). Nel caso dell’obesità, il fenotipo metabolico del donatore, sia esso magro o obeso, può essere ricapitolato da un trasferimento di microbiota fecale in topi privi di germi (Ridaura et al., 2013). Condizioni di assenza di germi sono state trovate anche per essere protettive contro lo sviluppo di colite e ileite in modelli di topo di tipo IBD con trasmissione della malattia solo dopo il trasferimento di un microbiota intestinale disbiotico (Sellon et al., 1998; Schaubeck et al., 2016).
La crescente evidenza di un ruolo causale del microbiota intestinale in condizioni di malattia multipla ha portato allo sviluppo di approcci terapeutici mirati volti ad alterare la composizione microbica. Tra questi, il trapianto di microbiota fecale (FMT) ha costantemente dimostrato la capacità di superare la disbiosi associata ad una serie di condizioni attraverso un profondo effetto sostenuto sul microbioma intestinale (ad esempio, Weingarden et al., 2015; Broecker et al., 2016; Kumar et al., 2017; Moss et al., 2017). L’FMT è considerata una forma non raffinata di batterioterapia che utilizza le diverse comunità microbiche intestinali di un donatore sano. Le vie tipiche di somministrazione ai riceventi di FMT includono il parto endoscopico (Mattila et al., 2012), il parto con tubo naso-intestinale (Tian et al., 2017), i clisteri di ritenzione (Lee et al., 2014), o l’ingestione di capsule (Youngster et al., 2014).
La definizione di successo dell’FMT si basa principalmente su una risposta clinica positiva nel ricevente. Tuttavia, dal punto di vista microbiologico, il successo dell’FMT può anche essere definito da uno spostamento del profilo microbico intestinale di un individuo verso quello del donatore. Noi sosteniamo che il successo dell’FMT può essere considerato un processo in due fasi; in primo luogo richiede che il microbioma trapiantato si innesti all’interno del nuovo ospite e aumenti la comunità commensale locale, dopo di che si può osservare un miglioramento clinico.
La selezione di un donatore di feci appropriato è un componente chiave per il successo dell’FMT (Vermeire et al., 2016). I donatori vengono sottoposti a screening clinici per garantire che non contengano agenti patogeni o malattie trasmissibili (Kelly et al., 2015). Un elenco dettagliato delle linee guida per la selezione dei donatori si trova nel rapporto sull’FMT nella pratica clinica basato sulle prove recentemente pubblicato (Cammarota et al., 2017). I donatori sono tipicamente descritti come efficaci o inefficaci per quanto riguarda la loro capacità di contribuire al successo dell’FMT. Il confronto dei profili dei microbioti intestinali di diversi donatori ha rivelato che la diversità microbica è un affidabile fattore predittivo del successo dell’FMT (Kump et al., 2018). Tuttavia, è anche noto che una varietà di fattori aggiuntivi, sia genetici che ambientali, influenzano il successo dell’FMT (Figura 1).
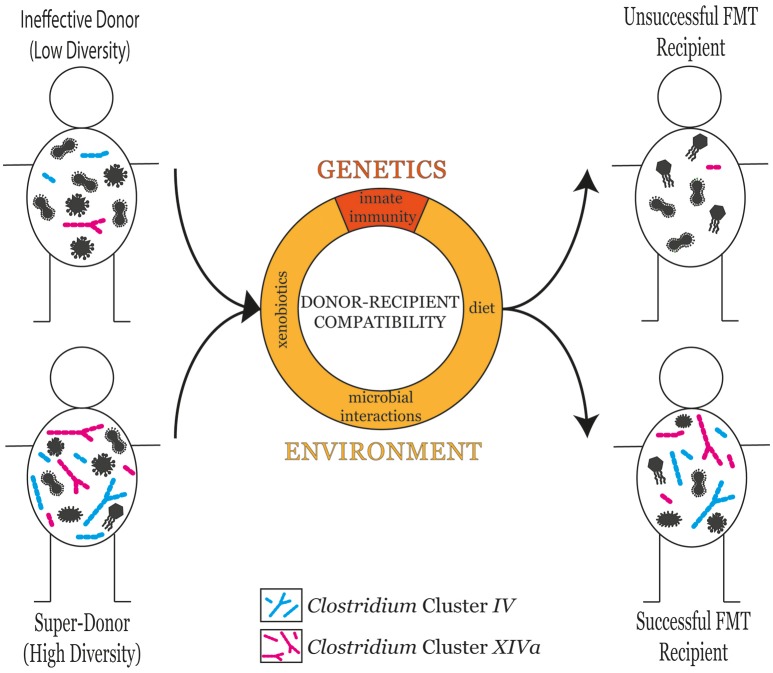
Figura 1.La diversità microbica del donatore è un buon indicatore del successo dell’FMT nel ricevente. Tuttavia, anche la compatibilità donatore-ricevente gioca un ruolo influente nel determinare il successo dell’FMT. La compatibilità donatore-ricevente può derivare da fattori genetici, come le differenze nelle risposte immunitarie innate, o da fattori ambientali, tra cui la dieta, l’esposizione xenobiotica e le interazioni microbiche.
Recentemente, il termine “super-donatore” è stato proposto per descrivere i donatori le cui feci producono risultati di FMT significativamente più positivi rispetto alle feci di altri donatori. Lo scopo di questa revisione è quello di esplorare le prove del fenomeno dei super-donatori di FMT e di altri fattori che possono contribuire al successo del trattamento, concentrandosi in particolare sulla caratterizzazione dei microbioti intestinali che è stata eseguita sui donatori. Si discute il concetto di specie chiave di volta come predittori del successo dell’FMT e si considera la possibile influenza della genetica ospite e della dieta sull’innesto e sul mantenimento dell’FMT. Infine, suggeriremo una logica per abbandonare l’approccio “un solo sgabello va bene per tutti”.

Figura 1.La diversità microbica del donatore è un buon predittore del successo dell’FMT nel ricevente. Tuttavia, la compatibilità donatore-ricevente gioca anche un ruolo influente nel determinare il successo dell’FMT. La compatibilità donatore-ricevente può derivare da fattori genetici, come le differenze nelle risposte immunitarie innate, o da fattori ambientali, tra cui la dieta, l’esposizione xenobiotica e le interazioni microbiche.
FMT per l’infezione ricorrente da Clostridium difficile
L’ingestione di feci umane per scopi sanitari è stata documentata per la prima volta dai medici erboristi cinesi nel quarto secolo (de Groot et al., 2017). Negli ultimi anni, l’FMT è stato ampiamente ed efficacemente utilizzato per il trattamento delle infezioni ricorrenti da Clostridium difficile (CDI) in pazienti non responsivi alla terapia antibiotica (van Nood et al., 2013; Cammarota et al., 2015; Lee et al., 2016; Kao et al., 2017). C. difficile è un agente patogeno intestinale opportunistico che viene soppresso in individui sani dal microbiota intestinale commensale (Borriello, 1990). Tuttavia, quando la diversità del microbiota intestinale viene ridotta, ad esempio, dopo un ciclo di antibiotici, la resistenza alla colonizzazione del microbiota commensale viene disturbata (Leffler e Lamont, 2015). C. difficile ha quindi il potenziale di proliferare indisturbato, producendo enterotossine che portano a infiammazioni intestinali e diarrea (Warny et al., 2005). Forse in modo piuttosto controintuitivo, la CDI viene trattata in primo luogo con antibiotici che curano circa l’80% dei casi (Fekety et al., 1997). Tuttavia, il 20% degli individui sperimenterà una CDI ricorrente dopo la terapia antibiotica (Leffler e Lamont, 2015). L’FMT è un nuovo approccio terapeutico per la CDI ricorrente che agisce per ripristinare il microbiota intestinale commensale e a sua volta ristabilisce la resistenza alla colonizzazione per inibire la crescita di C. difficile (Eiseman et al., 1958).
Una recente revisione sistematica e meta-analisi dell’FMT per il trattamento della CDI ha riportato un tasso di guarigione primaria del 92% su 30 serie di casi e sette studi di controllo randomizzati (Quraishi et al., 2017). Le analisi microbiche effettuate su pazienti affetti da CDI prima e dopo l’FMT hanno confermato che l’FMT è in grado di ripristinare rapidamente la diversità microbica nei pazienti in proporzioni simili a quelle dei donatori (Song et al., 2013; Shankar et al., 2014; Kelly et al., 2016; Staley et al., 2016; Khanna et al., 2017; Kellingray et al., 2018). La scelta del donatore, sia esso un parente, un coniuge o un volontario anonimo, non sembra influenzare l’efficacia clinica dell’FMT (Kassam et al., 2013). Allo stesso modo, non sono stati riscontrati effetti specifici per il donatore in un ampio studio di coorte che comprendeva 1999 pazienti affetti da CDI e 28 donatori di FMT (Osman et al., 2016). Nel complesso, l’FMT sembra essere un trattamento sicuro ed efficace per il ripristino microbico in situazioni in cui la crescita eccessiva di un particolare agente patogeno ha portato a una riduzione della diversità e dell’abbondanza della popolazione di organismi commensali (ad esempio, disbiosi grave).
FMT per malattie croniche associate a disbiosi intestinale
Incoraggiati dal travolgente successo dell’FMT nella risoluzione di CDI ricorrenti, i ricercatori hanno iniziato a studiare il potenziale terapeutico dell’FMT per una vasta gamma di altre malattie associate a forme meno gravi di disbiosi intestinale. Tra questi studi esplorativi, l’FMT per il trattamento della IBD è stato molto presente (sistematicamente rivisto Paramsothy et al., 2017b). Tuttavia, l’FMT è stato sperimentato anche in diversi altri disturbi gastrointestinali [IBS (Pinn et al., 2014; Holvoet et al., 2017, 2018; Mizuno et al., 2017; Aroniadis et al., 2018; Halkjær et al., 2018; Johnsen et al., 2018), costipazione (Tian et al., 2017; Ding et al., 2018), colite allergica (Liu et al., 2017)] e per vari tipi di fegato (Kao et al., 2016; Bajaj et al., 2017; Philips et al., 2017; Ren et al., 2017), sangue (Kakihana et al., 2016; Spindelboeck et al., 2017; DeFilipp et al., 2018), metabolici (Vrieze et al., 2012; Kootte et al., 2017) e neurologici (He et al., 2017a; Kang et al., 2017; Makkawi et al., 2018). Rispetto alla CDI, l’efficacia clinica dell’FMT per queste malattie più croniche è stata finora modesta, con una variabilità molto più elevata nella risposta del paziente che probabilmente riflette l’eziologia sfaccettata di questi disturbi.
FMT per la malattia infiammatoria intestinale (IBD): L’emergere del Super-donatore dell’FMT
IBD comprende sia il morbo di Crohn che la colite ulcerosa; due disturbi debilitanti caratterizzati da infiammazione cronica recidivante della mucosa intestinale (Gajendran et al., 2018). In contrasto con CDI, non vi è alcuna prova che i risultati IBD da una crescita eccessiva di un agente patogeno specifico. Piuttosto, la malattia è probabilmente causata da complesse interazioni che coinvolgono la genetica dell’ospite, il sistema immunitario, e microbiota intestinale (Ni et al., 2017). Sia la malattia di Crohn che la colite ulcerosa sono ampiamente caratterizzate da una ridotta diversità del microbiota intestinale con una minore abbondanza relativa dei Batteroiditi e dei Firmicuti phyla e proporzioni più elevate di Proteobatteri (Manichanh et al., 2006; Frank et al., 2007; Sokol et al., 2008; Walker et al., 2011; Gevers et al., 2014; Machiels et al., 2014; Nishino et al., 2018). Una riduzione specifica dell’abbondanza di specie batteriche produttrici di butirrato, in particolare Faecalibacterium prausnitzii, è stata osservata sia per la malattia di Crohn che per la colite ulcerosa (Fujimoto et al., 2013; Lopez-Siles et al., 2015; Takahashi et al., 2016). Nel frattempo, per la malattia di Crohn, è stato anche riportato un aumento della forma pro-infiammatoria dell’Escherichia coli (Darfeuille-Michaud et al., 2004; Martin et al., 2004; Baumgart et al., 2007).
Il primo case report di successo di un FMT per il trattamento della IBD è stato pubblicato nel 1989 quando un maschio con colite ulcerosa refrattaria ha ottenuto una remissione clinica per 6 mesi dopo un clistere di ritenzione con feci di donatori sani (Bennet e Brinkman, 1989). Successivamente, un gran numero di studi di FMT sono stati condotti su pazienti affetti da IBD con esiti clinici variabili, tassi di remissione e longevità di effetto (Zhang et al., 2013; Cui et al., 2015; Moayyedi et al., 2015; Rossen et al., 2015; Suskind et al., 2015; Vaughn et al., 2016; Vermeire et al., 2016; Costello et al., 2017; He et al., 2017b; Nishida et al., 2017; Paramsothy et al., 2017a; Goyal et al., 2018; Kump et al., 2018). Recentemente, Paramsothy et al. hanno effettuato una revisione sistematica e una meta-analisi di 53 studi (quattro RCT, 30 coorti, 19 casi di studio) di FMT in pazienti IBD (Paramsothy et al., 2017b). Evitando distorsioni di pubblicazione, la loro analisi degli studi di coorte ha rivelato che l’FMT è stato più efficace nell’indurre la remissione nei pazienti con malattia di Crohn rispetto ai pazienti con colite ulcerosa (52 vs. 33%, rispettivamente). Per quanto riguarda la colite ulcerosa, un numero maggiore di infusioni di FMT e una somministrazione più bassa del tratto gastrointestinale sono stati associati con un miglioramento dei tassi di remissione.
A differenza degli studi di CDI, gli studi di FMT condotti su pazienti affetti da IBD hanno spesso identificato risposte differenziali dei riceventi che sono state associate alla variabilità delle feci del donatore (Khanna, 2018). Attualmente, le feci utilizzate per l’FMT non sono standardizzate in termini di selezione del donatore (correlate vs. non correlate), di preparazione (fresche vs. congelate, aerobiche vs. anaerobiche), o della dose che viene somministrata (dosi singole vs. multiple) (Kelly et al., 2015). Mentre le incongruenze nei protocolli di FMT rendono difficile il confronto tra i diversi studi, esiste un ampio grado di variabilità nelle risposte cliniche all’FMT tra i riceventi che sono stati sottoposti allo stesso disegno di studio. È un peccato che le informazioni sul background genetico di un ricevente o sull’assunzione di cibo non siano ancora valutate di routine, soprattutto se si considera che alcuni casi di IBD hanno una componente genetica sottostante (de Lange et al., 2017). A causa della mancanza di informazioni genetiche, gli investigatori si sono invece concentrati sull’effetto donatore-dipendente e hanno proposto l’esistenza dei cosiddetti super-donatori per spiegare la variazione delle risposte dei riceventi.
Il primo studio a registrare l’effetto super-donatore è stato uno studio di controllo randomizzato che stava studiando l’efficacia dell’FMT per indurre la remissione clinica nei pazienti con colite ulcerosa (Moayyedi et al., 2015). Moayyedi et al. hanno assegnato 75 pazienti con malattia attiva a clisteri settimanali contenenti materiale fecale o acqua (placebo) per un periodo di 6 settimane. L’FMT si è dimostrato superiore al placebo, con conseguenti tassi di remissione endoscopica e clinica significativamente più elevati, anche se di modesto effetto (24 vs. 5%, rispettivamente), dopo 7 settimane. Dei nove pazienti che sono entrati in remissione, sette avevano ricevuto FMT dallo stesso donatore. Pertanto, si è sostenuto che il successo dell’FMT dipendeva dal donatore.
Attualmente non è possibile prevedere l’efficacia clinica di un donatore prima dell’FMT nei pazienti affetti da IBD. È stato suggerito che i tassi di remissione potrebbero essere migliorati mettendo insieme le feci del donatore, limitando le possibilità che un paziente riceva solo feci inefficaci (Kazerouni e Wein, 2017). Questo approccio di pooling delle feci è stato recentemente indagato su una coorte australiana di 85 pazienti affetti da colite ulcerosa da lieve a moderata, nel più grande studio di controllo randomizzato di FMT per IBD fino ad oggi (Paramsothy et al., 2017a). Invece di ricevere FMT da un solo donatore, ai pazienti del braccio di trattamento è stata somministrata una miscela di feci che conteneva i contributi di un massimo di sette diversi donatori con la speranza che gli effetti dipendenti dal donatore potessero essere omogeneizzati. Oltre a questo, è stato adottato un programma di dosaggio molto più intensivo, con una prima somministrazione di FMT tramite colonscopia, seguita da clisteri fecali, cinque volte a settimana per 8 settimane. Nonostante l’approccio multi-donatore e il dosaggio intensivo, Paramsothy et al. hanno raggiunto tassi di remissione post-FMT (FMT, 27% vs. placebo, 8%, p = 0,02) simili a quelli riportati in precedenza (Moayyedi et al., 2015; Rossen et al., 2015). In particolare, tuttavia, sia la remissione clinica che quella endoscopica sono state necessarie per ottenere risultati primari in questo studio (Paramsothy et al., 2017a), mentre gli studi precedenti si sono concentrati principalmente sui soli tassi di remissione endoscopica o clinica (Ishikawa et al., 2017; Nishida et al., 2017). È stato dimostrato che la miscela di feci in pool ha una maggiore diversità microbica rispetto alle singole feci in base al solo conteggio delle OTU e alle misure di diversità filogenetica. Le successive analisi dei diversi lotti di feci hanno scoperto che un donatore sembrava mostrare un effetto super-donatore. In particolare, i pazienti che hanno ricevuto lotti di FMT che contenevano feci da questo unico donatore hanno mostrato un tasso di remissione più alto rispetto a quelli i cui lotti di FMT non includevano il super-donatore (37 vs. 18%, rispettivamente) (Paramsothy et al., 2017a).
FMT per altri disturbi: Esiste anche un effetto Super-Donatore?
Attualmente mancano prove di super-donatori di FMT in altri disturbi al di fuori dell’IBD. Le serie di casi e i rapporti limitano la capacità di identificare gli effetti dei super-donatori a causa delle dimensioni limitate del campione. Tuttavia, nonostante la mancanza di studi di coorte di grandi dimensioni, diversi studi hanno accennato alla possibilità di un effetto dipendente dal donatore sull’esito dell’FMT (Vrieze et al., 2012; Kootte et al., 2017; Mizuno et al., 2017). Ad esempio, in uno studio pilota di breve durata su 18 uomini di mezza età affetti da sindrome metabolica, è stato riscontrato che gli FMT da donatori magri (FMT allogenici) corrispondono a un aumento del 75% della sensibilità insulinica e a una maggiore diversità dei batteri intestinali nel ricevente rispetto agli FMT autologhi (derivati dal paziente) (Vrieze et al., 2012). In seguito è stato notato che i pazienti che hanno sperimentato un miglioramento più robusto della sensibilità all’insulina dopo l’FMT erano stati tutti riceventi dallo stesso donatore. In un successivo studio su 38 uomini caucasici con sindrome metabolica, anche il donatore magro FMT ha portato a un miglioramento significativo della sensibilità insulinica periferica a 6 settimane. Tuttavia, questo effetto è stato perso dal follow-up di 18 settimane (Kootte et al., 2017). Per l’FMT allogenico sono stati utilizzati 11 donatori magri, sette dei quali sono stati utilizzati per più di un ricevente. Sebbene non siano stati riportati effetti dipendenti dal donatore, gli autori hanno notato che “i donatori di feci multiple potrebbero spiegare gli effetti transitori e variabili visti nel gruppo allogenico”. Mentre la ricerca sull’FMT in questo campo progredisce da serie di casi su piccola scala a studi clinici randomizzati controllati con placebo su larga scala, resta da vedere se il fenomeno del super-donatore si generalizza ad altre condizioni al di fuori dell’IBD.
Profilazione microbica e metabolica: Possiamo caratterizzare un super-donatore?
Per far luce sulle diverse risposte dei pazienti all’FMT e per scoprire eventuali effetti dipendenti dal donatore, una serie di studi ha effettuato un profilo microbico sui donatori e sui riceventi prima e dopo l’FMT (Vrieze et al., 2012; Moayyedi et al., 2015; Rossen et al., 2015; Vaughn et al., 2016; Vermeire et al., 2016; Bajajaj et al., 2017; Fuentes et al., 2017; Mizuno et al., 2017; Paramsothy et al., 2017a; Kump et al., 2018). Nonostante la mancanza di studi basati su studi di grandi dimensioni, un tema chiave ha cominciato ad emergere: la diversità microbica del donatore ha un ruolo influente nel successo terapeutico dell’FMT (Vermeire et al., 2016; Kump et al., 2018).
È stato costantemente dimostrato che i riceventi di FMT sperimentano un significativo aumento della diversità dei microbioti intestinali, tipicamente spostando la composizione verso il profilo del rispettivo donatore di feci (Vaughn et al., 2016; Paramsothy et al., 2017b). Coloro che ottengono una risposta clinica all’FMT (risponditori) mostrano tipicamente una maggiore diversità microbica rispetto a coloro che non la ottengono (non risponditori) (Vaughn et al., 2016; Vermeire et al., 2016) (Figura 1). In linea con queste osservazioni, la diversità microbica del donatore di feci si è dimostrata essere uno dei fattori più significativi che influenzano l’esito dell’FMT (Kump et al., 2018). In una coorte belga IBD, Vermeire et al. hanno osservato una ricchezza batterica significativamente più elevata nei donatori che hanno prodotto una risposta clinica all’FMT rispetto a quelli che non lo hanno fatto (Vermeire et al., 2016).
È stata anche esplorata una specifica firma microbica che è correlata all’efficacia clinica dell’FMT per l’IBD (Moayyedi et al., 2015; Rossen et al., 2015; Vermeire et al., 2016; Fuentes et al., 2017; Nishida et al., 2017; Paramsothy et al., 2017a; Kump et al., 2018). Tra i vari taxa che sono stati segnalati, i Clostridium Clostridium Clostridium Clusters IV e XIVa hanno sempre dimostrato di essere indicativi di una risposta positiva dei pazienti all’FMT (Rossen et al., 2015; Fuentes et al., 2017; Paramsothy et al., 2017a). I Clostridium Clostridium Clusters IV e XIVa sono gruppi informali di batteri che comprendono per lo più generi della famiglia delle Ruminococcaceae e delle Lachnospiraceae, rispettivamente. È stato dimostrato che i generi specifici all’interno di questi gruppi di Clostridium (ad esempio, Roseburia, Oscillibacter, Blautia, Dorea) sono aumentati in abbondanza relativa nei rispondenti dopo l’FMT (Moayyedi et al., 2015; Rossen et al., 2015; Vermeire et al., 2016; Paramsothy et al., 2017a). Allo stesso modo, i donatori di feci che sono ricchi di membri specifici dei Clostridium Clostridium Clostridium Clusters IV e XIVa sono risultati essere predittivi di una risposta sostenuta all’FMT nei pazienti affetti da IBD (Rossen et al., 2015; Fuentes et al., 2017). In particolare, il microbioma intestinale del super-donatore identificato da Moayyedi et al. è stato arricchito con le famiglie delle Ruminococcaceae e delle Lachnospiraceae (Moayyedi et al., 2015).
Per caratterizzare ulteriormente i super-donatori di FMT, sono state studiate le differenze metaboliche tra chi risponde e chi non risponde. In particolare, una maggiore produzione di butirrato da parte dei membri chiave all’interno dei Clostridium Clostridium Clusters IV e XIVa è stata associata a una prolungata remissione clinica in IBD in risposta alla terapia con FMT (Fuentes et al., 2017). Il butirrato è un importante acido grasso a catena corta (SCFA), prodotto da batteri nell’intestino, con funzioni specializzate nella modulazione immunitaria e nella fornitura di energia (Tan et al., 2014). Una maggiore produzione di butirrato è stata anche associata alla risoluzione CDI dopo l’FMT (Kellingray et al., 2018). Allo stesso modo, la specie produttrice di butirrato Roseburia intestinalis è stata trovata ad aumentare di due volte e mezzo il numero di partecipanti obesi a cui è stato somministrato l’FMT da donatori magri (Vrieze et al., 2012).
Collettivamente, le osservazioni pubblicate suggeriscono che il ripristino microbico può portare ad alterazioni dei risultati metabolici, che possono essere responsabili del ripristino dell’omeostasi intestinale in individui disbiotici. Ciò è coerente con l’idea che la chiave del successo dell’FMT risiede nella capacità del donatore di trasferire elevati livelli di particolari specie chiave ai riceventi. Per le condizioni infiammatorie, come la IBD e la sindrome metabolica, il trasferimento di taxa produttori di butirrato può essere importante per il ripristino terapeutico. Al contrario, i donatori con un’elevata abbondanza di Bifidobatterio possono essere più efficaci nel trattamento dei pazienti affetti da IBS (Mizuno et al., 2017).
Il concetto di specie chiave di volta è stato recentemente impiegato in uno studio di FMT per l’encefalopatia epatica ricorrente (rHE) (Bajajaj et al., 2017). L’esposizione frequente agli antibiotici causa disbiosi e diminuisce l’abbondanza relativa delle famiglie che producono SCFA nei pazienti rHE (Chen et al., 2011). Pertanto, è stato adottato un approccio di selezione razionale dei donatori, in cui i dati microbiologici sono stati utilizzati per selezionare un donatore con la più alta abbondanza relativa di famiglie di Lachnospiraceae e Ruminococcaceae dalla banca universale dei donatori di feci, OpenBiome (Bajajaj et al., 2017). In totale, 10 pazienti hanno ricevuto un ciclo di 5 giorni di antibiotici ad ampio spettro seguito da un singolo clistere FMT dal donatore selezionato. A 5 mesi dopo la FMT, nessuno dei 10 pazienti con FMT ha avuto una recidiva di HE, rispetto alla metà (5/10) dei pazienti di controllo che hanno ricevuto l’attuale standard di cura (lattulosio e rifaximina). La profilazione del microbioma intestinale ha rivelato che i pazienti con FMT avevano un arricchimento per le Ruminococcacee ma non per le Lachnospiraceae a 20 giorni dopo la FMT. Mentre la selezione razionale dei donatori è un passo nella giusta direzione, questi risultati suggeriscono che l’arricchimento microbico nel donatore non garantisce completamente l’arricchimento nel ricevente FMT. Le forze che regolano l’innesto di FMT non devono quindi basarsi esclusivamente sull’input del donatore.
Interazioni microbiche che influenzano l’ingestione di FMT
L’innesto FMT comporta l’integrazione o l’istituzione di ceppi microbici derivati da donatori nella comunità microbica del ricevente. Attualmente, sembra che i fattori più importanti per prevedere l’innesto di ceppi in FMT siano l’identità tassonomica e l’abbondanza di ceppi sia nel donatore che nel ricevente prima dell’FMT (Smillie et al., 2018). Il sequenziamento metagenomico profondo consente l’analisi del livello di ceppo per il monitoraggio delle alterazioni microbiche e dell’innesto nel microbioma intestinale post-FMT. Ad esempio, Li et al. hanno dimostrato che i nuovi ceppi microbici del donatore avevano una maggiore probabilità di innesto se il ricevente possedeva già quella specie (Li et al., 2016). Ciò li ha portati a suggerire che le differenze nell’innesto microbico tra individui dello stesso donatore possono derivare da incompatibilità di ceppi tra il donatore e il ricevente FMT. Smillie et al. hanno riferito che ceppi di una data specie sono stati impiantati in modo “tutto o niente”, in modo tale che i ceppi sono stati completamente conservati o completamente sostituiti da ceppi del donatore nel microbioma intestinale post-FMT del ricevente (Smillie et al., 2018). Nel frattempo, a livello di comunità, i riceventi di FMT hanno ospitato una complessa miscela di specie post FMT sia di origine del ricevente, sia di origine del donatore, sia di specie di nuova acquisizione (Smillie et al., 2018). Nel complesso, sembra che le interazioni microbiche abbiano un ruolo significativo nell’innesto di FMT, il che aiuta a spiegare perché i riceventi doppi di un FMT donatore non presentano identici profili microbiotici intestinali.
L’influenza della genetica ospite: Risposta immunitaria all’FMT
Si stima che la genetica spieghi il 5-10% della variabilità dei taxa batterici osservata tra individui (Willing et al., 2010; Goodrich et al., 2014, 2016; Wang et al., 2016; Xie et al., 2016; Hall et al., 2017). Tra i taxa che sono stati ritenuti ereditabili, la maggior parte sono stati collegati a geni che sono coinvolti nell’immunità innata (Hall et al., 2017). Il microbiota intestinale è noto per essere strettamente connesso al sistema immunitario dell’ospite attraverso un rapporto di sviluppo reciproco. In particolare, il microbiota è fondamentale per lo sviluppo appropriato del sistema immunitario e, a sua volta, il sistema immunitario aiuta a modulare la comunità microbica attraverso un equilibrio di percorsi pro e antinfiammatori (Belkaid e Hand, 2014; Vatanen et al., 2016). Pertanto, rimane possibile che le incompatibilità derivanti dall’FMT possano essere attribuibili a un’elevata risposta immunitaria al microbiota trapiantato, eventualmente derivante da una differenza genetica di fondo tra il donatore e il ricevente.
Tenendo conto di ciò, un approccio di screening immunitario è stato recentemente indagato in un caso di studio di FMT per la colite ulcerosa (Ponce-Alonso et al., 2017). Per evitare il rigetto di FMT da parte del sistema immunitario, è stata ottenuta una biopsia rettale da un paziente affetto da colite ulcerosa al fine di isolare una popolazione di cellule linfoidi. Queste cellule linfoidi derivate dal paziente sono state incubate con diversi campioni di microbiota intestinali isolati da tre donatori di feci sane. Il microbiota del donatore che ha portato alla più bassa induzione di interleuchine pro-infiammatorie è stato successivamente selezionato per la FMT. L’FMT si è rivelato un successo clinico per il paziente affetto da colite ulcerosa. Il profilo del microbioma intestinale ha rivelato che il microbioma intestinale del paziente con colite ulcerosa era diventato indistinguibile da quello del donatore, indicando un innesto FMT di grande successo. Mentre lo screening immunitario in questo caso ha portato ad un esito positivo per il paziente con FMT, il tempo e i costi associati all’esecuzione di tale screening limitano la scalabilità a popolazioni di pazienti più ampie. Idealmente, lo sviluppo di un saggio con tampone rettale rapido e semplice per valutare la risposta immunitaria sarebbe un approccio di screening molto più fattibile per il futuro. In ogni caso, la limitata letteratura in questo settore deve essere integrata da studi su più ampia scala per confermare l’importanza dello screening immunitario prima dell’FMT.
Fattori che influenzano gli effetti a lungo termine dell’FMT
Si potrebbe sostenere che un FMT di successo non solo richiede che il microbiota trapiantato si innesti all’interno dell’intestino del ricevente, ma anche che i nuovi organismi acquisiti devono essere sostenuti per mantenere il beneficio terapeutico. Sulla base di analisi longitudinali in pazienti che hanno ricevuto FMT per CDI ricorrente, è noto che le alterazioni dei microbioti indotte da FMT possono durare ovunque da pochi giorni a pochi anni dopo il trasferimento (Weingarden et al., 2015; Broecker et al., 2016; Kumar et al., 2017; Moss et al., 2017). Un recente studio FMT/CDI di Moss et al. ha scoperto che, nonostante la somiglianza a breve termine tra i profili dei microbioti intestinali del donatore e del ricevente, la concordanza è stata significativamente ridotta dopo un anno (Moss et al., 2017). Nello studio FMT di Moayeddi et al. otto dei nove pazienti affetti da colite ulcerosa che erano in remissione alla settima settimana dopo la FMT erano ancora in remissione un anno dopo, senza alcun caso di ricaduta (Moayyedi et al., 2015). Purtroppo, le analisi microbiomiche non sono state effettuate su questi pazienti durante il follow-up, quindi si può solo presumere che i loro microbioti trapiantati siano rimasti stabili.
Oltre alle differenze genetiche sottostanti tra il donatore e il ricevente, anche le pressioni di selezione dietetica e le successive esposizioni agli antibiotici possono influenzare l’efficacia a lungo termine della terapia con FMT. Per la CDI ricorrente, la stabilità a lungo termine dell’FMT è meno rilevante perché l’eliminazione dell’agente patogeno e il ripristino della popolazione commensale è raggiunto rapidamente. Pertanto, è improbabile che una graduale deviazione dal profilo intestinale del donatore provochi una recrudescenza della malattia, a patto che non vi siano ulteriori insulti alla popolazione di intestino commensale. Al contrario, la sostenibilità del microbiota post-FMT nei pazienti con malattie croniche, come l’IBD o l’obesità, può essere molto più pertinente. Questo perché la disbiosi microbica associata a queste condizioni non è stata ancora provata nell’uomo come causa o conseguenza della malattia (Ni et al., 2017). È più probabile che la disbiosi microbica sia solo uno dei diversi fattori che contribuiscono alla progressione della malattia in questi individui. Se è così, può essere che l’FMT fornisca solo un sollievo temporaneo ai sintomi del paziente e che siano necessarie ulteriori “ricariche di FMT” per la gestione continua della malattia. L’ottimizzazione di approcci non invasivi per il parto di FMT, come il parto in capsule, sarà quindi importante per andare avanti.
Sostenere il microbioma trapiantato attraverso la dieta potrebbe essere un’aggiunta benefica ai protocolli di FMT (Thompson et al., 2016). La dieta è nota per svolgere un ruolo significativo nel plasmare il microbioma intestinale in via di sviluppo sia nell’infanzia che in età adulta (Singh et al., 2017). La dieta fornisce ai microbi commensali i substrati necessari per la loro proliferazione e sopravvivenza (Koh et al., 2016). È stato dimostrato che un rapido cambiamento nella dieta, come il passaggio da una dieta basata su animali a una dieta esclusivamente vegetale, può alterare la composizione del microbiota intestinale entro 24 ore (David et al., 2014). In condizioni infiammatorie, come l’IBD e la sindrome metabolica, l’FMT può agire per superare l’ostacolo iniziale nel fornire ai pazienti livelli terapeutici di batteri antinfiammatori. Successivamente, la dieta può essere cruciale nel fornire la fibra necessaria a sostenere la crescita dei batteri produttori di SCFA.
Abbandonare l’approccio “Uno sgabello va bene per tutti
Disbiosi microbica è un termine generico per indicare una comunità intestinale malsana o squilibrata. Come tale, la struttura della popolazione che si ritiene rappresenti la disbiosi microbica è variabile tra diversi disturbi (Duvallet et al., 2017). Inoltre, il deficit microbico di un individuo può non rispecchiare necessariamente quello di un altro individuo e quindi non sorprende che i pazienti rispondano in modo diverso alla FMT. Man mano che vengono generati più dati clinici e microbici relativi all’FMT, sta diventando chiaro che “uno sgabello non si adatta a tutti” nel contesto del trattamento di malattie croniche con disbiosi microbica. Allo stesso modo, la selezione dei donatori basata esclusivamente su linee guida di screening clinico non fornisce alcuna garanzia di successo di FMT. Sembra che la risposta di un paziente all’FMT dipenda principalmente dalla capacità del microbiota del donatore di ripristinare gli specifici disturbi metabolici associati al suo particolare fenotipo di malattia. Se questo è vero, un approccio di corrispondenza donatore-ricevente, in cui un paziente viene sottoposto a screening per identificare le perturbazioni funzionali specifiche del suo microbiota, può essere il modo migliore per procedere. Il paziente potrebbe quindi essere abbinato a uno specifico donatore di FMT noto per essere arricchito in taxa associato alla via metabolica che deve essere ripristinata. Lo screening della tolleranza immunitaria sarebbe anche utile per ridurre l’impatto delle incompatibilità donatore-ricevente derivanti dalle differenze sottostanti nelle risposte immunitarie innate.
Un approccio alternativo alla corrispondenza donatore-ricevente è quello di somministrare FMT di precisione, che sono più simili a un probiotico che a un trapianto fecale intero. Oltre agli ovvi vantaggi normativi e di consumo inerenti a questo approccio, un FMT di precisione rimuove gli effetti dipendenti dal donatore fornendo ai pazienti una miscela definita di batteri che in precedenza si sono dimostrati utili per la risoluzione della malattia (ad esempio, migliorando la produzione di butirrato in condizioni infiammatorie). Ad esempio, fornire ai pazienti affetti da IBD una formulazione mirata a base di microbiota contenente solo produttori di butirrato sarebbe un’alternativa logica, più sicura e potenzialmente preferibile per il paziente rispetto al trapianto fecale completo. Finora sono stati sperimentati approcci di precisione nel trattamento della CDI, ma con risultati contrastanti (Petrof et al., 2013; Emanuelsson et al., 2014). Può essere che la struttura della comunità microbica nel suo complesso giochi un ruolo più influente nel successo dell’FMT rispetto all’isolamento delle sole specie critiche. Indipendentemente da ciò, approcci mirati di batterioterapia dovrebbero essere studiati per le malattie croniche come un modo per aggirare i rischi associati alla somministrazione di materiale fecale.
Mentre gran parte della letteratura FMT si è concentrata sul fatto che i batteri sono l’agente terapeuticamente attivo, la risoluzione positiva della CDI con l’utilizzo di filtrati fecali sterili ha suggerito che gli elementi non batterici potrebbero giocare un ruolo più significativo di quanto precedentemente apprezzato (Ott et al., 2017). In una serie di casi preliminari, a cinque pazienti con CDI ricorrente è stata somministrata una soluzione di feci che era stata filtrata per rimuovere piccole particelle e batteri. Il filtrato fecale è stato trovato per contenere detriti batterici, proteine, DNA, composti antimicrobici, metaboliti e virus. In particolare, pochi giorni dopo il trasferimento, tutti e cinque i pazienti avevano raggiunto la risoluzione CDI e sono rimasti privi di sintomi per tutta la durata dello studio (fino a 6 mesi). Sebbene limitato dal numero di pazienti che sono stati trattati, questo studio preliminare dimostra che la risoluzione della CDI può essere raggiunta da elementi diversi dalla componente batterica viva delle feci. Coerentemente con questo, Zuo et al. hanno recentemente riportato che il trasferimento di batteriofagi durante l’FMT è stato associato ai risultati della risoluzione della CDI (Zuo et al., 2018). Analogamente, Conceição-Neto et al. hanno suggerito che il viro eucariotico era associato al trattamento di successo della colite ulcerosa da FMT (Conceição-Neto et al., 2018).
Conclusione
Nonostante sia stata riportata in letteratura già nel IV secolo, la ricerca FMT è ancora agli albori, in particolare per quanto riguarda il meccanismo di effetto. La mancanza di grandi studi clinici randomizzati controllati di FMT per il trattamento di malattie croniche ha fatto sì che molte osservazioni, come l’esistenza di super-donatori di FMT, non siano ancora solidamente supportate da prove empiriche. Il numero crescente di studi su piccola scala, anche se difficili da confrontare tra loro, suggeriscono tuttavia che il donatore gioca un ruolo influente nei risultati dell’FMT per le indicazioni al di fuori della CDI. Da allora sono stati compiuti notevoli sforzi per identificare i vari fattori che contribuiscono al successo dell’FMT. In senso lato, l’elevata diversità del microbiota intestinale, in particolare nel donatore, sembra essere la migliore previsione della risposta del paziente all’FMT. Più specificamente, l’efficacia dell’FMT dipende probabilmente dalla capacità del donatore di fornire i taxa necessari per ripristinare i deficit metabolici nei riceventi che contribuiscono alla malattia. Un’ulteriore caratterizzazione dei super-donatori porterà probabilmente allo sviluppo di formulazioni di FMT più raffinate per aiutare a standardizzare la terapia e ridurre la variabilità della risposta del paziente. Parallelamente, la continua ottimizzazione dei protocolli di FMT, compreso il passaggio ad approcci basati sulle capsule, aiuterà a combattere i problemi di longevità associati all’FMT e creerà un’alternativa più amichevole per il paziente agli attuali schemi di gestione della malattia.
Contributi dell’autore
BW ha scritto il manoscritto. TV e WC hanno commentato il manoscritto. JOS ha diretto e contribuito alla stesura del manoscritto.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
References
- Aroniadis O. C., Brandt L. J., Oneto C., Feuerstadt P., Sherman A., Wolkoff A. W.. 742 – A double-blind, randomized, placebo-controlled trial of fecal microbiota transplantation capsules (FMTC) for the treatment of diarrhea-predominant irritable bowel syndrome (IBS-D). Gastroenterology. 2018; 154:S-154-S-155. DOI
- Arrieta M. C., Stiemsma L. T., Dimitriu P. A., Thorson L., Russell S., Yurist-Doutsch S.. Early infancy microbial and metabolic alterations affect risk of childhood asthma. Sci. Transl. Med. 2015; 7:307ra152. DOI | PubMed
- Bäckhed F., Ding H., Wang T., Hooper L. V., Koh G. Y., Nagy A.. The gut microbiota as an environmental factor that regulates fat storage. Proc. Natl. Acad. Sci.U.S.A.. 2004; 101:15718-15723. DOI | PubMed
- Bajaj J. S., Kassam Z., Fagan A., Gavis E. A., Liu E., Cox I. J.. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: a randomized clinical trial. Hepatology. 2017; 66:1727-1738. DOI | PubMed
- Balish E., Warner T.. Enterococcus faecalis induces inflammatory bowel disease in interleukin-10 knockout mice. Am. J. Pathol. 2002; 160:2253-2257. DOI | PubMed
- Baumgart M., Dogan B., Rishniw M., Weitzman G., Bosworth B., Yantiss R.. Culture independent analysis of ileal mucosa reveals a selective increase in invasive Escherichia coli of novel phylogeny relative to depletion of Clostridiales in Crohn’s disease involving the ileum. ISME J. 2007; 1:403-418. DOI | PubMed
- Belkaid Y., Hand T. W.. Role of the microbiota in immunity and inflammation. Cell. 2014; 157:121-141. DOI | PubMed
- Bennet J. D., Brinkman M.. Treatment of ‘ulcerative colitis by implantation of normal colonic flora. Lancet. 1989; 1:164. DOI | PubMed
- Berer K., Mues M., Koutrolos M., Rasbi Z. A., Boziki M., Johner C.. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 2011; 479:538-541. DOI | PubMed
- Borriello S. P.. The influence of the normal flora on Clostridium difficile colonisation of the gut. Ann. Med. 1990; 22:61-67. DOI | PubMed
- Broecker F., Klumpp J., Schuppler M., Russo G., Biedermann L., Hombach M.. Long-term changes of bacterial and viral compositions in the intestine of a recovered Clostridium difficile patient after fecal microbiota transplantation. Cold Spring Harb. Mol. Case Stud. 2016; 2:a000448. DOI | PubMed
- Bunyavanich S., Shen N., Grishin A., Wood R., Burks W., Dawson P.. Early-life gut microbiome composition and milk allergy resolution. J. Allergy Clin. Immunol. 2016; 138:1122-1130. DOI | PubMed
- Cammarota G., Ianiro G., Tilg H., Rajilić-Stojanović M., Kump P., Satokari R.. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017; 66:569-580. DOI | PubMed
- Cammarota G., Masucci L., Ianiro G., Bibbò S., Dinoi G., Costamagna G.. Randomised clinical trial: faecal microbiota transplantation by colonoscopy vs. vancomycin for the treatment of recurrent Clostridium difficile infection. Aliment. Pharmacol. Ther. 2015; 41:835-843. DOI | PubMed
- Chen Y., Yang F., Lu H., Wang B., Chen Y., Lei D.. Characterization of fecal microbial communities in patients with liver cirrhosis. Hepatology. 2011; 54:562-572. DOI | PubMed
- Conceição-Neto N., Deboutte W., Dierckx T., Machiels K., Wang J., Yinda K. C.. Low eukaryotic viral richness is associated with faecal microbiota transplantation success in patients with UC. Gut. 2018; 67:1558-1559. DOI | PubMed
- Costello S. P., Soo W., Bryant R. V., Jairath V., Hart A. L., Andrews J. M.. Systematic review with meta-analysis: faecal microbiota transplantation for the induction of remission for active ulcerative colitis. Aliment. Pharmacol. Ther. 2017; 46:213-224. DOI | PubMed
- Cui B., Feng Q., Wang H., Wang M., Peng Z., Li P.. Fecal microbiota transplantation through mid-gut for refractory Crohn’s disease: safety, feasibility, and efficacy trial results. J. Gastroenterol. Hepatol.. 2015; 30:51-58. DOI | PubMed
- Cui L., Zhao T., Hu H., Zhang W., Hua X.. Association study of gut flora in coronary heart disease through high-throughput sequencing. Biomed. Res. Int.. 2017; 2017:3796359. DOI | PubMed
- Darfeuille-Michaud A., Boudeau J., Bulois P., Neut C., Glasser A. L., Barnich N.. High prevalence of adherent-invasive Escherichia coli associated with ileal mucosa in Crohn’s disease. Gastroenterology. 2004; 127:412-421. DOI | PubMed
- David L. A., Maurice C. F., Carmody R. N., Gootenberg D. B., Button J. E., Wolfe B. E.. Diet rapidly and reproducibly alters the human gut microbiome. Nature. 2014; 505:559-563. DOI | PubMed
- de Groot P. F., Frissen M. N., de Clercq N. C., Nieuwdorp M.. Fecal microbiota transplantation in metabolic syndrome: history, present and future. Gut Microbes. 2017; 8:253-267. DOI | PubMed
- de Lange K. M., Moutsianas L., Lee J. C., Lamb C. A., Luo Y., Kennedy N. A.. Genome-wide association study implicates immune activation of multiple integrin genes in inflammatory bowel disease. Nat. Genet.. 2017; 49:256-261. DOI | PubMed
- DeFilipp Z., Peled J. U., Li S., Mahabamunuge J., Dagher Z., Slingerland A. E.. Third-party fecal microbiota transplantation following allo-HCT reconstitutes microbiome diversity. Blood Adv.. 2018; 2:745-753. DOI | PubMed
- Ding C., Fan W., Gu L., Tian H., Ge X., Gong J.. Outcomes and prognostic factors of fecal microbiota transplantation in patients with slow transit constipation: results from a prospective study with long-term follow-up. Gastroenterol. Rep.. 2018; 6:101-107. DOI | PubMed
- Duvallet C., Gibbons S. M., Gurry T., Irizarry R. A., Alm E. J.. Meta-analysis of gut microbiome studies identifies disease-specific and shared responses. Nat. Commun.. 2017; 8:1784. DOI | PubMed
- Eckburg P. B., Bik E. M., Bernstein C. N., Purdom E., Dethlefsen L., Sargent M.. Diversity of the human intestinal microbial flora. Science. 2005; 308:1635-1638. DOI | PubMed
- Eiseman B., Silen W., Bascom G. S., Kauvar A. J.. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery. 1958; 44:854-859. PubMed
- Emanuelsson F., Claesson B. E., Ljungström L., Tvede M., Ung K. A.. Faecal microbiota transplantation and bacteriotherapy for recurrent Clostridium difficile infection: a retrospective evaluation of 31 patients. Scand. J. Infect. Dis.. 2014; 46:89-97. DOI | PubMed
- Fekety R., McFarland L. V., Surawicz C. M., Greenberg R. N., Elmer G. W., Mulligan M. E.. Recurrent Clostridium difficile diarrhea: characteristics of and risk factors for patients enrolled in a prospective, randomized, double-blinded trial. Clin. Infect. Dis.. 1997; 24:324-333. DOI | PubMed
- Frank D. N., St. Amand A. L., Feldman R. A., Boedeker E. C., Harpaz N., Pace N. R.. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc. Natl. Acad. Sci.U.S.A.. 2007; 104:13780-13785. DOI | PubMed
- Fuentes S., Rossen N. G., van der Spek M. J., Hartman J. H., Huuskonen L., Korpela K.. Microbial shifts and signatures of long-term remission in ulcerative colitis after faecal microbiota transplantation. ISME J.. 2017; 11:1877-1889. DOI | PubMed
- Fujimoto T., Imaeda H., Takahashi K., Kasumi E., Bamba S., Fujiyama Y.. Decreased abundance of Faecalibacterium prausnitzii in the gut microbiota of Crohn’s disease. J. Gastroenterol. Hepatol.. 2013; 28:613-619. DOI | PubMed
- Gajendran M., Loganathan P., Catinella A. P., Hashash J. G.. A comprehensive review and update on Crohn’s disease. Dis. Mon.. 2018; 64:20-57. DOI | PubMed
- Gevers D., Kugathasan S., Denson L. A., Vázquez-Baeza Y., Van Treuren W., Ren B.. The treatment-naive microbiome in new-onset Crohn’s disease. Cell Host Microbe. 2014; 15:382-392. DOI | PubMed
- Goodrich J. K., Davenport E. R., Beaumont M., Jackson M. A., Knight R., Ober C.. Genetic determinants of the gut microbiome in UK twins. Cell Host Microbe. 2016; 19:731-743. DOI | PubMed
- Goodrich J. K., Waters J. L., Poole A. C., Sutter J. L., Koren O., Blekhman R.. Human genetics shape the gut microbiome. Cell. 2014; 159:789-799. DOI | PubMed
- Goyal A., Yeh A., Bush B. R., Firek B. A., Siebold L. M., Rogers M. B.. Safety, clinical response, and microbiome findings following fecal microbiota transplant in children with inflammatory bowel disease. Inflamm. Bowel Dis.. 2018; 24:410-421. DOI | PubMed
- Halkjær S. I., Christensen A. H., Lo B. Z. S., Browne P. D., Günther S., Hansen L. H.. Faecal microbiota transplantation alters gut microbiota in patients with irritable bowel syndrome: results from a randomised, double-blind placebo-controlled study. Gut. 2018; 67:2107-2115. DOI | PubMed
- Hall A. B., Tolonen A. C., Xavier R. J.. Human genetic variation and the gut microbiome in disease. Nat. Rev. Genet.. 2017; 18:690-699. DOI | PubMed
- He Z., Cui B. T., Zhang T., Li P., Long C. Y., Ji G. Z.. Fecal microbiota transplantation cured epilepsy in a case with Crohn’s disease: the first report. World J. Gastroenterol.. 2017a; 23:3565-3568. DOI | PubMed
- He Z., Li P., Zhu J., Cui B., Xu L., Xiang J.. Multiple fresh fecal microbiota transplants induces and maintains clinical remission in Crohn’s disease complicated with inflammatory mass. Sci Rep.. 2017b; 7:4753. DOI | PubMed
- Holvoet T., Joossens M., Boelens J., Christiaens E., Heyerick L., Verhasselt B.. 617 – fecal microbiota transplantation in irritable bowel syndrome with predominant abdominal bloating: results from a double blind, placebo-controlled clinical trial. Gastroenterology. 2018. DOI
- Holvoet T., Joossens M., Wang J., Boelens J., Verhasselt B., Laukens D.. Assessment of faecal microbial transfer in irritable bowel syndrome with severe bloating. Gut. 2017; 66:980-982. DOI | PubMed
- Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome. Nature. 2012; 486:207-214. DOI | PubMed
- Ishikawa D., Sasaki T., Osada T., Kuwahara-Arai K., Haga K., Shibuya T.. Changes in intestinal microbiota following combination therapy with fecal microbial transplantation and antibiotics for Ulcerative Colitis. Inflamm. Bowel Dis.. 2017; 23:116-125. DOI | PubMed
- Jie Z., Xia H., Zhong S. L., Feng Q., Li S., Liang S.. The gut microbiome in atherosclerotic cardiovascular disease. Nat. Commun.. 2017; 8:845. DOI | PubMed
- Johnsen P. H., Hilpüsch F., Cavanagh J. P., Leikanger I. S., Kolstad C., Valle P. C.. Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial. Lancet Gastroenterol. Hepatol.. 2018; 3:17-24. DOI | PubMed
- Kakihana K., Fujioka Y., Suda W., Najima Y., Kuwata G., Sasajima S.. Fecal microbiota transplantation for patients with steroid-resistant acute graft-versus-host disease of the gut. Blood. 2016; 128:2083-2088. DOI | PubMed
- Kang D. W., Adams J. B., Gregory A. C., Borody T., Chittick L., Fasano A.. Microbiota transfer therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study. Microbiome. 2017; 5:10. DOI | PubMed
- Kao D., Roach B., Park H., Hotte N., Madsen K., Bain V.. Fecal microbiota transplantation in the management of hepatic encephalopathy. Hepatology. 2016; 63:339-340. DOI | PubMed
- Kao D., Roach B., Silva M., Beck P., Rioux K., Kaplan G. G.. Effect of oral capsule– vs colonoscopy-delivered fecal microbiota transplantation on recurrent Clostridium difficile infection. JAMA. 2017; 318:1985. DOI | PubMed
- Kassam Z., Lee C. H., Yuan Y., Hunt R. H.. Fecal Microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. Am. J. Gastroenterol.. 2013; 108:500-508. DOI | PubMed
- Kazerouni A., Wein L. M.. Exploring the efficacy of pooled stools in fecal microbiota transplantation for microbiota-associated chronic diseases. PLoS ONE. 2017; 12:e0163956. DOI | PubMed
- Kellingray L., Gall G. L., Defernez M., Beales I. L. P., Franslem-Elumogo N., Narbad A.. Microbial taxonomic and metabolic alterations during faecal microbiota transplantation to treat Clostridium difficile infection. J. Infect.. 2018; 77:107-118. DOI | PubMed
- Kelly C. R., Kahn S., Kashyap P., Laine L., Rubin D., Atreja A.. Update on fecal microbiota transplantation : indications, methodologies, mechanisms, and outlook. Gastroenterology. 2015; 149:223-237. DOI | PubMed
- Kelly C. R., Khoruts A., Staley C., Sadowsky M. J., Abd M., Alani M.. Effect of fecal microbiota transplantation on recurrence in multiply recurrent Clostridium difficile infection. Ann. Intern. Med.. 2016; 165:609-616. DOI | PubMed
- Khanna S.. Microbiota replacement therapies: innovation in gastrointestinal care. Clin. Pharmacol. Ther.. 2018; 103:102-111. DOI | PubMed
- Khanna S., Vazquez-Baeza Y., González A., Weiss S., Schmidt B., Muñiz-Pedrogo D. A.. Changes in microbial ecology after fecal microbiota transplantation for recurrent C. difficile infection affected by underlying inflammatory bowel disease. Microbiome. 2017; 5:55. DOI | PubMed
- Koh A., De Vadder F., Kovatcheva-Datchary P., Bäckhed F.. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell. 2016; 165:1332-1345. DOI | PubMed
- Kootte R. S., Levin E., Salojärvi J., Smits L. P., Hartstra A. V., Udayappan S. D.. Improvement of insulin sensitivity after lean donor feces in metabolic syndrome is driven by baseline intestinal microbiota composition. Cell Metab.. 2017; 26:611-619. DOI | PubMed
- Kriss M., Hazleton K. Z., Nusbacher N. M., Martin C. G., Lozupone C. A.. Low diversity gut microbiota dysbiosis: drivers, functional implications and recovery. Curr. Opin. Microbiol.. 2018; 44:34-40. DOI | PubMed
- Kumar R., Yi N., Zhi D., Eipers P., Goldsmith K. T., Dixon P.. Identification of donor microbe species that colonize and persist long term in the recipient after fecal transplant for recurrent Clostridium difficile. npj Biofilms Microb.. 2017; 3:12. DOI
- Kump P., Wurm P., Gröchenig H. P., Wenzl H., Petritsch W., Halwachs B.. The taxonomic composition of the donor intestinal microbiota is a major factor influencing the efficacy of faecal microbiota transplantation in therapy refractory ulcerative colitis. Aliment. Pharmacol. Ther.. 2018; 47:67-77. DOI | PubMed
- Lee C. H., Belanger J. E., Kassam Z., Smieja M., Higgins D., Broukhanski G.. The outcome and long-term follow-up of 94 patients with recurrent and refractory Clostridium difficile infection using single to multiple fecal microbiota transplantation via retention enema. Eur. J. Clin. Microbiol. Infect. Dis.. 2014; 33:1425-1428. DOI | PubMed
- Lee C. H., Steiner T., Petrof E. O., Smieja M., Roscoe D., Nematallah A.. Frozen vs fresh fecal microbiota transplantation and clinical resolution of diarrhea in patients with recurrent Clostridium difficile infection. JAMA. 2016; 315:142-149. DOI | PubMed
- Leffler D. A., Lamont J. T.. Clostridium difficile infection. N Engl J Med.. 2015; 372:1539-1548. DOI | PubMed
- Ley R. E., Hamady M., Lozupone C., Turnbaugh P. J., Ramey R. R., Bircher J. S.. Evolution of mammals and their gut microbes. Science. 2008; 320:1647-1651. DOI | PubMed
- Li S. S., Zhu A., Benes V., Costea P. I., Hercog R., Hildebrand F.. Durable coexistence of donor and recipient strains after fecal microbiota transplantation. Science. 2016; 352:586-589. DOI | PubMed
- Liu H. N., Wu H., Chen Y. Z., Chen Y. J., Shen X. Z., Liu T. T.. Altered molecular signature of intestinal microbiota in irritable bowel syndrome patients compared with healthy controls: a systematic review and meta-analysis. Dig. Liver Dis.. 2017; 49:331-337. DOI | PubMed
- Liu S. X., Li Y. H., Dai W. K., Li X. S., Qiu C. Z., Ruan M. L.. Fecal microbiota transplantation induces remission of infantile allergic colitis through gut microbiota re-establishment. World J. Gastroenterol.. 2017; 23:8570-8581. DOI | PubMed
- Lloyd-Price J., Abu-Ali G., Huttenhower C.. The healthy human microbiome. Genome Med.. 2016; 8:51. DOI | PubMed
- Lopez-Siles M., Martinez-Medina M., Abellà C., Busquets D., Sabat-Mir M., Duncan S. H.. Mucosa-associated Faecalibacterium prausnitzii phylotype richness is reduced in patients with inflammatory bowel disease. Appl. Environ. Microbiol.. 2015; 81:7582-7592. DOI | PubMed
- Machiels K., Joossens M., Sabino J., De Preter V., Arijs I., Eeckhaut V.. A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosis in patients with ulcerative colitis. Gut. 2014; 63:1275-1283. DOI | PubMed
- Makkawi S., Camara-Lemarroy C., Metz L.. Fecal microbiota transplantation associated with 10 years of stability in a patient with SPMS. Neurol. Neuroimmunol. Neuroinflamm.. 2018; 5:e459. DOI | PubMed
- Manichanh C., Rigottier-Gois L., Bonnaud E., Gloux K., Pelletier E., Frangeul L.. Reduced diversity of faecal microbiota in Crohn’s disease revealed by a metagenomic approach. Gut. 2006; 55:205-211. DOI | PubMed
- Martin H. M., Campbell B. J., Hart C. A., Mpofu C., Nayar M., Singh R.. Enhanced Escherichia coli adherence and invasion in Crohn’s disease and colon cancer. Gastroenterology. 2004; 127:80-93. DOI | PubMed
- Mattila E., Uusitalo-Seppälä R., Wuorela M., Lehtola L., Nurmi H., Ristikankare M.. Fecal transplantation, through colonoscopy, is effective therapy for recurrent Clostridium difficile infection. Gastroenterology. 2012; 142:490-496. DOI | PubMed
- Mizuno S., Masaoka T., Naganuma M., Kishimoto T., Kitazawa M., Kurokawa S.. Bifidobacterium-rich fecal donor may be a positive predictor for successful fecal microbiota transplantation in patients with irritable bowel syndrome. Digestion. 2017; 96:29-38. DOI | PubMed
- Moayyedi P., Surette M. G., Kim P. T., Libertucci J., Wolfe M., Onischi C.. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial. Gastroenterology. 2015; 149:102-109. DOI | PubMed
- Moss E. L., Falconer S. B., Tkachenko E., Wang M., Systrom H., Mahabamunuge J.. Long-term taxonomic and functional divergence from donor bacterial strains following fecal microbiota transplantation in immunocompromised patients. PLoS ONE. 2017; 12:e0182585. DOI | PubMed
- Ni J., Wu G. D., Albenberg L., Tomov V. T.. Gut microbiota and IBD: causation or correlation?. Nat. Rev. Gastroenterol. Hepatol.. 2017; 14:573-584. DOI | PubMed
- Nishida A., Imaeda H., Ohno M., Inatomi O., Bamba S., Sugimoto M.. Efficacy and safety of single fecal microbiota transplantation for Japanese patients with mild to moderately active ulcerative colitis. J. Gastroenterol.. 2017; 52:476-482. DOI | PubMed
- Nishino K., Nishida A., Inoue R., Kawada Y., Ohno M., Sakai S.. Analysis of endoscopic brush samples identified mucosa-associated dysbiosis in inflammatory bowel disease. J. Gastroenterol.. 2018; 53:95-106. DOI | PubMed
- Odamaki T., Kato K., Sugahara H., Hashikura N., Takahashi S., Xiao J. Z.. Age-related changes in gut microbiota composition from newborn to centenarian: a cross-sectional study. BMC Microbiol.. 2016; 16:90. DOI | PubMed
- Osman M., Stoltzner Z., O’Brien K., Ling K., Koelsch E., Dubois N.. Donor efficacy in fecal microbiota transplantation for recurrent clostridium difficile: evidence from a 1,999-patient cohort. Open Forum Infect. Dis.. 2016; 3:841. DOI
- Ott S. J., Waetzig G. H., Rehman A., Moltzau-Anderson J., Bharti R., Grasis J. A.. Efficacy of sterile fecal filtrate transfer for treating patients with Clostridium difficile infection. Gastroenterology. 2017; 152:799-811. DOI | PubMed
- Paramsothy S., Kamm M. A., Kaakoush N. O., Walsh A. J., van den Bogaerde J., Samuel D.. Multidonor intensive faecal microbiota transplantation for active ulcerative colitis: a randomised placebo-controlled trial. Lancet. 2017a; 389:1218-1228. DOI | PubMed
- Paramsothy S., Paramsothy R., Rubin D. T., Kamm M. A., Kaakoush N. O., Mitchell H. M.. Faecal microbiota transplantation for inflammatory bowel disease: a systematic review and meta-analysis. J. Crohn’s Colitis. 2017b; 11:1180-1199. DOI | PubMed
- Penders J., Thijs C., van den Brandt P. A., Kummeling I., Snijders B., Stelma F.. Gut microbiota composition and development of atopic manifestations in infancy: the KOALA birth Cohort study. Gut. 2007; 56:661-667. DOI | PubMed
- Perez-Muñoz M. E., Arrieta M.-C., Ramer-Tait A. E., Walter J.. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome. 2017; 5:48. DOI | PubMed
- Petersen C., Round J. L.. Defining dysbiosis and its influence on host immunity and disease. Cell Microbiol.. 2014; 16:1024-1033. DOI | PubMed
- Petrof E. O., Gloor G. B., Vanner S. J., Weese S. J., Carter D., Daigneault M. C.. Stool substitute transplant therapy for the eradication of Clostridium difficile infection: ‘RePOOPulating’ the gut. Microbiome. 2013; 1:3. DOI | PubMed
- Philips C. A., Pande A., Shasthry S. M., Jamwal K. D., Khillan V., Chandel S. S.. Healthy donor fecal microbiota transplantation in steroid-ineligible severe alcoholic hepatitis: a pilot study. Clin. Gastroenterol. Hepatol.. 2017; 15:600-602. DOI | PubMed
- Pinn D. M., Aroniadis O. C., Brandt L. J.. Is fecal microbiota transplantation the answer for irritable bowel syndrome? A single-center experience. Am. J. Gastroenterol.. 2014; 109:1831-1832. DOI | PubMed
- Ponce-Alonso M., Garcia-Fernandez S., Aguilera L., Rodriguez de santiago E., Foruny J. R., Roy G.. P782 A new compatibility test for donor selection for faecal microbiota transplantation in ulcerative colitis. J Crohn’s Colitis. 2017; 11:S480-S481. DOI
- Quraishi M. N., Widlak M., Bhala N., Moore D., Price M., Sharma N.. Systematic review with meta-analysis: the efficacy of faecal microbiota transplantation for the treatment of recurrent and refractory Clostridium difficile infection. Aliment. Pharmacol. Ther.. 2017; 46:479-493. DOI | PubMed
- Ren Y. D., Ye Z. S., Yang L. Z., Jin L. X., Wei W. J., Deng Y. Y.. Fecal microbiota transplantation induces hepatitis B virus e-antigen (HBeAg) clearance in patients with positive HBeAg after long-term antiviral therapy. Hepatology. 2017; 65:1765-1768. DOI | PubMed
- Ridaura V. K., Faith J. J., Rey F. E., Cheng J., Duncan A. E., Kau A. L.. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science. 2013; 341:1241214. DOI | PubMed
- Rossen N. G., Fuentes S., van der Spek M. J., Tijssen J. G., Hartman J. H., Duflou A.. Findings from a randomized controlled trial of fecal transplantation for patients with ulcerative colitis. Gastroenterology. 2015; 149:110-118. DOI | PubMed
- Schaubeck M., Clavel T., Calasan J., Lagkouvardos I., Haange S. B., Jehmlich N.. Dysbiotic gut microbiota causes transmissible Crohn’s disease-like ileitis independent of failure in antimicrobial defence. Gut. 2016; 65:225-237. DOI | PubMed
- Schwiertz A., Taras D., Schäfer K., Beijer S., Bos N. A., Donus C.. Microbiota and SCFA in lean and overweight healthy subjects. Obesity. 2010; 18:190-195. DOI | PubMed
- Sellon R. K., Tonkonogy S., Schultz M., Dieleman L. A., Grenther W., Balish E.. Resident enteric bacteria are necessary for development of spontaneous colitis and immune system activation in interleukin-10-deficient mice. Infect. Immun.. 1998; 66:5224-5231. PubMed
- Shankar V., Hamilton M. J., Khoruts A., Kilburn A., Unno T., Paliy O.. Species and genus level resolution analysis of gut microbiota in Clostridium difficile patients following fecal microbiota transplantation. Microbiome. 2014; 2:13. DOI | PubMed
- Singh R. K., Chang H. W., Yan D., Lee K. M., Ucmak D., Wong K.. Influence of diet on the gut microbiome and implications for human health. J. Transl. Med.. 2017; 15:73. DOI | PubMed
- Smillie C. S., Sauk J., Gevers D., Friedman J., Sung J., Youngster I.. Strain tracking reveals the determinants of bacterial engraftment in the human gut following fecal microbiota transplantation. Cell Host Microbe.. 2018; 23:229-240. DOI | PubMed
- Sokol H., Pigneur B., Watterlot L., Lakhdari O., Bermúdez-Humarán L. G., Gratadoux J. J.. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc. Natl. Acad. Sci. U S A.. 2008; 105:16731-16736. DOI | PubMed
- Song Y., Garg S., Girotra M., Maddox C., von Rosenvinge E. C., Dutta A.. Microbiota dynamics in patients treated with fecal microbiota transplantation for recurrent Clostridium difficile infection. PLoS ONE.. 2013; 8:e81330. DOI | PubMed
- Spindelboeck W., Schulz E., Uhl B., Kashofer K., Aigelsreiter A., Zinke-Cerwenka W.. Repeated fecal microbiota transplantations attenuate diarrhea and lead to sustained changes in the fecal microbiota in acute, refractory gastrointestinal graft-versus-host-disease. Haematologica. 2017; 102:e210-e213. DOI | PubMed
- Staley C., Kelly C. R., Brandt L. J., Khoruts A., Sadowsky M. J.. Complete microbiota engraftment is not essential for recovery from recurrent Clostridium difficile infection following fecal microbiota transplantation. MBio. 2016; 7:e01965-e01916. DOI | PubMed
- Suskind D. L., Brittnacher M. J., Wahbeh G., Shaffer M. L., Hayden H. S., Qin X.. Fecal microbial transplant effect on clinical outcomes and fecal microbiome in active Crohn’s disease. Inflamm. Bowel Dis.. 2015; 21:556-563. DOI | PubMed
- Takahashi K., Nishida A., Fujimoto T., Fujii M., Shioya M., Imaeda H.. Reduced abundance of butyrate-producing bacteria species in the fecal microbial community in Crohn’s disease. Digestion. 2016; 93:59-65. DOI | PubMed
- Tan J., McKenzie C., Potamitis M., Thorburn A. N., Mackay C. R., Macia L.. The role of short-chain fatty acids in health and disease. Adv. Immunol.. 2014; 121:91-119. DOI | PubMed
- Thompson S., Guetterman H., Taylor A., Bogner A., Martin D., Farrell J. J.. Dietary predictors of fecal microbiota transplantation success. J. Acad. Nutr. Diet.. 2016; 116:A76. DOI
- Thursby E., Juge N.. Introduction to the human gut microbiota. Biochem. J.. 2017; 474:1823-1836. DOI | PubMed
- Tian H., Ge X., Nie Y., Yang L., Ding C., McFarland L.V.. Fecal microbiota transplantation in patients with slow-transit constipation: a randomized, clinical trial. PLoS ONE. 2017; 12:e0171308. DOI | PubMed
- van Nood E., Vrieze A., Nieuwdorp M., Fuentes S., Zoetendal E. G., de Vos W. M.. Duodenal infusion of donor feces for recurrent Clostridium difficile. N. Engl. J. Med.. 2013; 368:407-415. DOI | PubMed
- Vatanen T., Kostic A. D., d’Hennezel E., Siljander H., Franzosa E.A., Yassour M.. Variation in microbiome LPS immunogenicity contributes to autoimmunity in humans. Cell. 2016; 165:842-853. DOI | PubMed
- Vaughn B. P., Vatanen T., Allegretti J. R., Bai A., Xavier R. J., Korzenik J.. Increased intestinal microbial diversity following fecal microbiota transplant for active Crohn’s disease. Inflamm. Bowel Dis.. 2016; 22:2182-2190. DOI | PubMed
- Vermeire S., Joossens M., Verbeke K., Wang J., Machiels K., Sabino J.. Donor species richness determines faecal microbiota transplantation success in inflammatory bowel disease. J Crohn’s Colitis. 2016; 10:387-394. DOI | PubMed
- Vrieze A., Van Nood E., Holleman F., Salojärvi J., Kootte R. S., Bartelsman J. F.. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012; 143:913-916. DOI | PubMed
- Walker A. W., Sanderson J. D., Churcher C., Parkes G. C., Hudspith B. N., Rayment N.. High-throughput clone library analysis of the mucosa-associated microbiota reveals dysbiosis and differences between inflamed and non-inflamed regions of the intestine in inflammatory bowel disease. BMC Microbiol.. 2011; 11:7. DOI | PubMed
- Wang J., Thingholm L. B., Skiecevičiene J., Rausch P., Kummen M., Hov J. R.. Genome-wide association analysis identifies variation in vitamin D receptor and other host factors influencing the gut microbiota. Nat. Genet.. 2016; 48:1396-1406. DOI | PubMed
- Warny M., Pepin J., Fang A., Killgore G., Thompson A., Brazier J.. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet. 2005; 366:1079-1084. DOI | PubMed
- Weingarden A., González A., Vázquez-Baeza Y., Weiss S., Humphry G., Berg-Lyons D.. Dynamic changes in short- and long-term bacterial composition following fecal microbiota transplantation for recurrent Clostridium difficile infection. Microbiome. 2015; 3:10. DOI | PubMed
- Willing B. P., Dicksved J., Halfvarson J., Andersson A. F., Lucio M., Zheng Z.. A pyrosequencing study in twins shows that gastrointestinal microbial profiles vary with inflammatory bowel disease phenotypes. Gastroenterology. 2010; 139:1844-1854. DOI | PubMed
- Xie H., Guo R., Zhong H., Feng Q., Lan Z., Qin B.. Shotgun metagenomics of 250 adult twins reveals genetic and environmental impacts on the gut microbiome. Cell Syst.. 2016; 3:572-584. DOI | PubMed
- Youngster I., Russell G. H., Pindar C., Ziv-Baran T., Sauk J., Hohmann E. L.. Oral, capsulized, frozen fecal microbiota transplantation for relapsing Clostridium difficile infection. JAMA. 2014; 312:1772. DOI | PubMed
- Zhang F. M., Wang H. G., Wang M., Cui B. T., Fan Z. N., Ji G. Z.. Fecal microbiota transplantation for severe enterocolonic fistulizing Crohn’s disease. World J. Gastroenterol.. 2013; 19:7213-7216. DOI | PubMed
- Zuo T., Wong S. H., Lam K., Lui R., Cheung K., Tang W.. Bacteriophage transfer during faecal microbiota transplantation in Clostridium difficile infection is associated with treatment outcome. Gut. 2018; 67:634-643. DOI | PubMed
Fonte
Wilson BC, Vatanen T, Cutfield WS, O’Sullivan JM (2019) The Super-Donor Phenomenon in Fecal Microbiota Transplantation. Frontiers in Cellular and Infection Microbiology 92. https://doi.org/10.3389/fcimb.2019.00002





