Introduzione
Il diabete e il cancro alla prostata sono 2 condizioni molto comuni che colpiscono gli uomini più anziani. I medici di medicina generale sono spesso coinvolti nella diagnosi e nella gestione di entrambe le malattie.
Numerosi studi hanno riportato una minore incidenza di cancro alla prostata tra gli uomini con diabete,1,2,3,4 anche se il rischio di cancro aggressivo alla prostata è più alto5,6 e una prognosi più sfavorevole7,8 sono state notate anche. Le ragioni del minor rischio di cancro alla prostata non sono chiare, ma sono stati proposti sia meccanismi fisiologici che pregiudizi di rilevazione.9
Alcuni studi hanno proposto che il minor rischio di cancro alla prostata può essere dovuto all’uso di comuni farmaci antidiabetici, che agiscono direttamente o attraverso la rilevazione ritardata.10 La metformina, un farmaco che riduce il glucosio con proprietà antineoplastiche comunemente usato come trattamento di prima linea per il diabete, è stato suggerito per essere protettivo nelle prime fasi della tumorigenesi del cancro alla prostata.11 È anche possibile che la downregulation della crescita delle cellule epiteliali della prostata da parte della metformina possa portare a livelli più bassi di antigene prostatico specifico (PSA), che mascherano la presenza del cancro alla prostata o ne ritardano l’individuazione, portando ad un apparente riduzione del rischio. Le sulfoniluree e gli analoghi dell’insulina, che sono comunemente usati come terapie di seconda e terza linea per il diabete, possono portare ad un aumento dei livelli di fattore di crescita insulino-simile e quindi promuovere la crescita del cancro alla prostata e contemporaneamente aumentare i livelli di PSA.12,13
Per chiarire ulteriormente le potenziali associazioni di farmaci antidiabetici con lo sviluppo del cancro alla prostata, questo studio è stato suddiviso in 4 sottostudi utilizzando la stessa fonte di dati. Gli obiettivi erano di esplorare il potenziale di bias di rilevazione esaminando l’associazione dei farmaci antidiabetici con (1) i livelli di PSA dopo la prescrizione iniziale; (2) la frequenza del test del PSA e la biopsia della prostata; (3) la probabilità di avere una biopsia se il PSA è stato elevato; e (4) la probabilità di rilevazione del cancro alla prostata alla biopsia negli uomini esposti a farmaci antidiabetici rispetto agli uomini non esposti.
Metodi
I dati sono stati ricavati dal PSA di Stoccolma e dal Registro delle biopsie, un registro basato sulla popolazione dei test PSA e delle procedure di biopsia prostatica nella contea di Stoccolma, in Svezia, dal 2003.14 I dati sui test del PSA e sui risultati della biopsia sono stati ottenuti dai 3 laboratori ufficiali della regione di Stoccolma (Karolinska University Laboratory, Aleris e Unilabs). Le date di spedizione delle prescrizioni per specifici farmaci sono state determinate attraverso il collegamento con il Registro Nazionale dei Farmaci Prescritti utilizzando i codici chimici anatomici terapeutici (cioè, metformina, A10BA e A10BD; sulfonilurea, A10BBB; e insulina, A10A), con i dati disponibili dal 1 ° luglio 2005. Le covariate aggiuntive includono l’età, il livello di istruzione (basso: <10 anni, medio: 10-12 anni e alto: >12 anni di istruzione formale), stato civile (sposati o non sposati), storia familiare di cancro alla prostata (qualsiasi cancro alla prostata nei parenti maschi di primo grado), e comorbilità (Indice di comorbilità di Charlson [CCI] derivato dalla Classificazione Statistica Internazionale delle Malattie e dei Problemi di Salute Correlati, codici della Decima Revisione (ICD-10) per i ricoveri ospedalieri nei 10 anni precedenti, esclusi i codici per il diabete; gli uomini senza ricovero ospedaliero hanno totalizzato 0).
L’approvazione etica è stata ottenuta dal comitato etico regionale di Stoccolma. Tutti i dati di questo studio sono stati identificati e il comitato etico ha rinunciato al consenso informato.
La segnalazione segue la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia (STROBE) per gli studi di coorte, ove applicabile. Una panoramica dei 4 sottostudi è mostrata nella Figura 1.
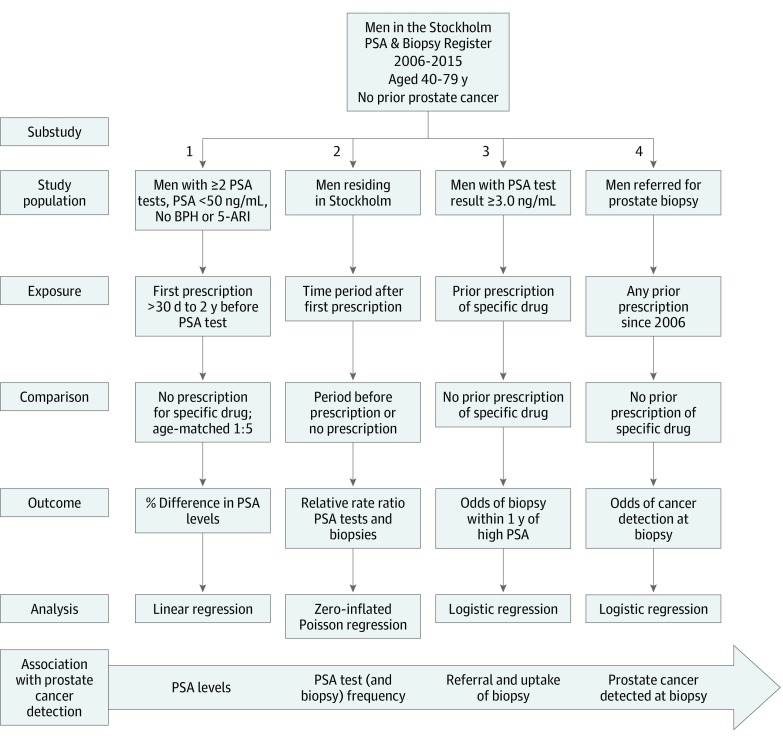
Figura 1.Panoramica dei disegni di studio per ogni sotto-studioLe esposizioni erano classi separate di farmaci antidiabetici comuni (metformina, sulfonilurea, insulina) e tutti combinati. BPH indica iperplasia prostatica benigna, PSA, antigene prostatico specifico, e 5-ARI, inibitori della 5α-reduttasi. Per convertire il PSA in microgrammi per litro, moltiplicare per 1,0.

Figura 1.Panoramica dei disegni di studio per ogni sotto-studioLe esposizioni erano classi separate di farmaci antidiabetici comuni (metformina, sulfonilurea, insulina) e tutti combinati. BPH indica iperplasia prostatica benigna, PSA, antigene prostatico specifico, e 5-ARI, inibitori della 5α-reduttasi. Per convertire il PSA in microgrammi per litro, moltiplicare per 1,0.
Variazione dei livelli PSA
Sono stati selezionati uomini di età compresa tra i 40 e i 79 anni tra il 1° gennaio 2006 e il 31 dicembre 2015, con almeno 2 test PSA, che consentono di misurare i livelli di PSA prima e dopo l’uso dei farmaci. Gli uomini con una precedente diagnosi di cancro alla prostata, diagnosi di iperplasia prostatica benigna, resezione transuretrale della prostata, prescrizione di inibitori della 5α-reduttasi, o concentrazioni di PSA nel siero superiori a 50 ng/mL (da convertire in microgrammi per litro, moltiplicare per 1,0) sono stati esclusi per evitare influenze di malattie o trattamenti prostatici.
L’esposizione a ciascuna classe di farmaci antidiabetici è stata considerata separatamente. Gli uomini esposti comprendevano tutti coloro che hanno ricevuto la prima prescrizione per quella classe di farmaci tra 2 date consecutive di test PSA entro 2 anni prima e dopo la data della prima prescrizione, con 30 giorni o più di esposizione prima del secondo test. Cinque uomini confrontati per età, senza alcuna prescrizione precedente per quel farmaco, che si erano sottoposti a 2 test PSA entro 2 anni dalla data della rispettiva prescrizione, sono stati selezionati in modo casuale attraverso un approccio di campionamento dell’incidenza. Un periodo di rodaggio di 6 mesi dal 1° luglio al 31 dicembre 2005 è stato utilizzato per ridurre al minimo l’errore di classificazione della prima prescrizione di ogni classe di farmaci (cioè, quelli con qualsiasi farmaco antidiabetico durante quel periodo sono stati esclusi perché non potevano essere considerati nuovi esposti).
L’associazione dell’uso di farmaci antidiabetici con i livelli di PSA è stata valutata utilizzando la regressione multivariabile dei minimi quadrati ordinari, con una concentrazione di PSA trasformata in log al secondo test come variabile dipendente, regolata per il PSA premedicato (trasformata in log), l’istruzione, lo stato civile, l’ICC, la storia familiare, l’anno del test, la durata tra i test e l’esposizione ad altri farmaci antidiabetici prima del secondo test del PSA. La trasformazione a livello di log dei coefficienti β ha prodotto la differenza percentuale dei livelli di PSA tra gli uomini esposti a specifici farmaci antidiabetici e quelli non esposti dopo aver tenuto conto delle differenze nel PSA premedicato.
Frequenza dei test PSA e delle biopsie della prostata
Gli uomini che vivevano a Stoccolma tra il 2006 e il 2015 sono stati inclusi come una coorte dinamica. Ognuno di essi ha contribuito a tempo di persona mentre aveva tra i 40 e i 79 anni, o fino alla data di emigrazione, morte o diagnosi di cancro alla prostata. Il numero di test PSA e di procedure bioptiche intraprese è stato determinato per ogni anno solare di follow-up sulla base delle date dei test o delle procedure registrate nel PSA di Stoccolma e nel Registro delle biopsie. Per gli uomini esposti, il tempo della persona è stato suddiviso nell’anno della prima prescrizione di farmaci antidiabetici e codificato come esposto da quell’anno in poi. Gli uomini che hanno prescritto farmaci antidiabetici durante il periodo di rodaggio (dal 1° luglio 2005 al 31 dicembre 2005) sono stati codificati come esposti per l’intero periodo di follow-up.
I rapporti di tasso relativo che confrontano la frequenza dei test del PSA e delle procedure di biopsia negli uomini esposti e non esposti sono stati determinati utilizzando la regressione di Poisson multivariabile a zero gonfiore, con aggiustamento per età, anno solare, livello di istruzione, stato civile e storia familiare del cancro alla prostata e aggiustamento reciproco per metformina, sulfonilurea e insulina. Ulteriori analisi sono state effettuate in base alle quali gli individui che hanno prescritto farmaci antidiabetici in qualsiasi momento durante il follow-up sono stati classificati come esposti per l’intero periodo, con l’attenzione ai comportamenti di salute in quelli predisposti a sviluppare il diabete.
Referenza e partecipazione alla biopsia
La probabilità di una biopsia prostatica a seguito di un PSA elevato è stata esaminata utilizzando la regressione logistica multivariabile all’interno della coorte ammissibile il cui PSA misurava 3,0 ng/mL o superiore (o ≥4,0 ng/mL). Se più di 1 risultato del test è stato elevato, la più alta concentrazione di PSA durante il periodo di studio è stata selezionata come test PSA indice. Il ricevimento di una biopsia prostatica entro 12 mesi dalla data del test PSA è stato il risultato di interesse. Precedenti prescrizioni per metformina, sulfonilurea o insulina sono state considerate contemporaneamente come esposizioni di interesse. Le covariate includevano l’età, l’anno del test del PSA, l’istruzione, lo stato civile, l’anamnesi familiare e l’ICC.
Individuazione del cancro alla prostata alla biopsia
Sono stati selezionati uomini di età compresa tra i 40 e i 79 anni che hanno subito biopsie alla prostata tra il 2006 e il 2015. Sono state escluse le biopsie di conferma e di follow-up dopo la diagnosi di cancro. L’esito principale è stato l’individuazione del cancro alla prostata alla biopsia. Gli uomini sono stati considerati esposti a farmaci antidiabetici se avevano ricevuto almeno 1 prescrizione medica 30 giorni o più prima della data della biopsia, dal 1° luglio 2005 in poi. Le associazioni tra farmaci antidiabetici e biopsia positiva sono state studiate utilizzando la regressione logistica binaria multivariabile. I modelli sono stati adattati per età, livello di istruzione, stato civile, ICC, storia familiare e concentrazione di PSA prima della biopsia (log-transformato), e diverse classi di farmaci antidiabetici. Abbiamo modellato il rilevamento del cancro alla prostata, inclusa solo la prima biopsia, e anche tutte le biopsie prediagnostiche della prostata, con l’aggiustamento per il clustering dovuto alla non indipendenza. Sono state effettuate ulteriori analisi della durata dell’esposizione a ciascun farmaco, insieme ad analisi di sottogruppi per specifici intervalli di concentrazione del PSA che hanno scatenato la biopsia.
Analisi statistica
I metodi statistici utilizzati in questo studio hanno incluso la regressione multivariabile ordinaria meno quadrata (lineare) (sottostudio 1), la regressione di Poisson (sottostudio 2), e la regressione logistica binaria (sottostudi 3 e 4), con il livello di significatività statistica impostato a 2-coda P<<.05. Tutte le analisi sono state effettuate utilizzando il software statistico Stata versione 14 (StataCorp) da novembre 2018 a marzo 2019.
Risultati
Livelli di PSA nel siero
Sono state identificate quattro coorti separate di farmaci antidiabetici (metformina, 4583 partecipanti; sulfonilurea, 1104 partecipanti; insulina, 987 partecipanti; e prima di qualsiasi farmaco antidiabetico, 4424 partecipanti). Le caratteristiche di ciascuna coorte, insieme ai rispettivi gruppi di confronto in base all’età, sono fornite nella eTabella 1 del supplemento. L’età mediana (intervallo interquartile) al test PSA di base era di 65,0 (59,4-70,5) anni per la metformina, 65,5 (59,7-71,3) anni per la sulfonilurea e 66,3 (60,5-72,5) anni per l’insulina. I livelli mediani (intervallo interquartile) del PSA prima della prima prescrizione erano più bassi per gli uomini esposti rispetto a quelli non esposti, per qualsiasi uso antidiabetico (1,2 [0,7-2,5] ng/mL contro 1,6 [0,8-3,2] ng/mL), e in tutte le fasce d’età per ogni farmaco antidiabetico (Figura 2).
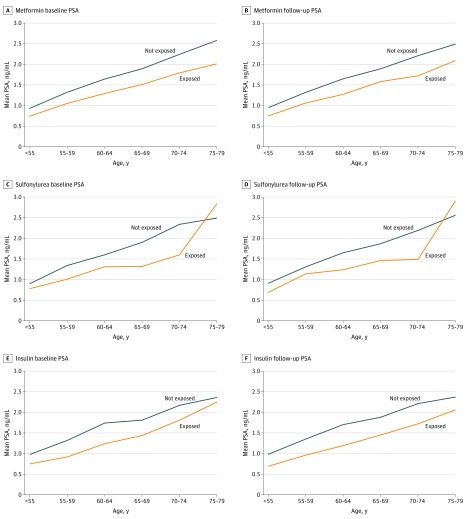
Figura 2.Livelli di antigene specifico della prostata (PSA) specifici per l’età negli uomini esposti e non esposti a farmaci per il diabete, prima e dopo la prescrizione inizialePer convertire il PSA in microgrammi per litro, moltiplicare per 1,0.
I risultati della regressione multivariabile sono mostrati nella Tabella 1. Non sono state osservate differenze nei livelli di PSA post-medicazione per qualsiasi classe di farmaci rispetto agli uomini non esposti. Il livello di PSA prescritto e il tempo tra i test PSA sono stati associati positivamente al PSA al follow-up, mentre l’ICC di 2 o superiore è stata associata a livelli di PSA più bassi (eTabella 2 nel supplemento). Non sono stati riscontrati modelli evidenti per quanto riguarda la durata dell’esposizione a qualsiasi farmaco antidiabetico, anche se una differenza significativa è stata osservata per 1-6 mesi di uso di insulina, ma non per periodi più lunghi.
| Durata dell’uso di farmaci prima del test PSA, mo | No. Esposto | Differenza (95% CI), %. | P Valore |
|---|---|---|---|
| Primo antidiabetico, qualsiasi | |||
| Durata prima del test PSA | 4424 | -0,9 (da -2,3 a 0,5) | .21 |
| 1-6 | 1741 | -2,0 (da -4,2 a 0,2) | .07 |
| 7-12 | 1433 | 0,2 (da -1,9 a 2,4) | .86 |
| 13-18 | 737 | -0,6 (da -3,7 a 2,6) | .71 |
| 19-24 | 513 | -0,2 (da -3,8 a 3,4) | .90 |
| Metformina | |||
| Durata prima del test PSA | 4583 | -0,7 (da -2,1 a 0,8) | .38 |
| 1-6 | 1799 | -1,0 (da -3,2 a 1,1) | .35 |
| 7-12 | 1491 | -0,4 (da -2,5 a 1,8) | .75 |
| 13-18 | 767 | 0,1 (da -3,1 a 3,3) | .95 |
| 19-24 | 526 | -1,2 (da -4,9 a 2,4) | .51 |
| Sulfonilurea | |||
| Durata prima del test PSA | 1104 | 4,1 (da -0,8 a 9,1) | .10 |
| 1-6 | 431 | 5,2 (da -0,7 a 11,1) | .08 |
| 7-12 | 366 | 5,5 (da -0,5 a 11,5) | .07 |
| 13-18 | 171 | 0,4 (da -6,1 a 6,9) | .90 |
| 19-24 | 136 | 5,0 (da -3,1 a 13,2) | .22 |
| Insulina | |||
| Durata prima del test PSA | 978 | -6,5 (da -13,8 a 0,8) | .08 |
| 1-6 | 404 | -9,4 (da -18,0 a -0,9) | .03 |
| 7-12 | 301 | -2,0 (-10,2 a 6,3) | .64 |
| 13-18 | 171 | -6,1 (da -15,9 a 3,7) | .22 |
| 19-24 | 102 | -3,6 (da -14,7 a 7,5) | .53 |

Figura 2.Livelli di antigene specifico della prostata (PSA) specifici per l’età negli uomini esposti e non esposti a farmaci per il diabete, prima e dopo la prescrizione inizialePer convertire il PSA in microgrammi per litro, moltiplicare per 1,0.
Frequenza del test del PSA e della biopsia prostatica
La descrizione della coorte e i tassi grezzi del test del PSA e della biopsia prostatica sono forniti nella eTabella 3 del supplemento. Un totale di 564-666 uomini senza cancro alla prostata (età media, 65 [40-79] anni) hanno contribuito con 4-252-532 anni-persona di follow-up tra il 2006 e il 2015. Il tasso medio annuo di test del PSA era di 223 per 1000, mentre il tasso medio annuo di biopsia era di 6,5 per 1000.
Le analisi multivariate (Tabella 2; eTabella 4 nel supplemento) indicano un aumento della frequenza dei test del PSA e delle procedure di biopsia tra gli uomini con istruzione superiore, gli uomini sposati e quelli con una storia familiare di cancro alla prostata. Tassi di test del PSA sono stati leggermente più elevati tra gli uomini prescritti metformina (rapporto di tasso relativo [RR], 1,07; 95% CI, 1,06-1,09) e sulfonilurea (RR, 1,06; 95% CI, 1,03-1,08), ma inferiore per l’insulina (RR, 0,79; 95% CI, 0,77-0,81). Nel complesso, gli uomini che hanno ricevuto farmaci antidiabetici in qualsiasi momento durante il follow-up hanno avuto tassi leggermente inferiori di test del PSA (RR, 0,93; 95% CI, 0,92-0,94) rispetto a quelli mai esposti.
| Esposizione | Frequenza, RR (95% CI)a | Biopsia in seguito a PSA elevato, OR (95% CI)b,c | ||
|---|---|---|---|---|
| Test PSA | Biopsia della prostata | ≥3,0 ng/mL (n=53-357) | ≥4,0 ng/mL (n = 38-719) | |
| Metformina | 1.07 (1.06-1.09) | 0.76 (0.70-0.83) | 0.87 (0.80-0.96) | 0.87 (0.79-0.96) |
| Sulfonylurea | 1.06 (1.03-1.08) | 0.93 (0.83-1.04) | 0.88 (0.78-1.00) | 0.88 (0.76-1.01) |
| Insulina | 0.79 (0.77-0.81) | 0.67 (0.60-0.75) | 0.83 (0.74-0.93) | 0.81 (0.71-0.92) |
| Qualsiasi farmaco antidiabeticod | 0.93 (0.92-0.94) | 0.59 (0.55-0.62) | 0.87 (0.80-0.96) | 0.77 (0.71-0.82) |
Per quanto riguarda la frequenza delle procedure di biopsia prostatica, gli uomini che hanno prescritto la metformina avevano tassi ridotti (RR, 0,76; 95% CI, 0,70-0,83), così come quelli prescritti per l’insulina (RR, 0,67; 95% CI, 0,60-0,75). I tassi di biopsia non differivano per la sulfonilurea. Nel complesso, gli uomini che hanno ricevuto un qualsiasi farmaco antidiabetico durante il follow-up hanno avuto un tasso significativamente più basso di biopsia prostatica (RR, 0,59; 95% CI, 0,55-0,62).
Rinvio e partecipazione alla biopsia
In totale, 53-357 uomini hanno avuto almeno 1 risultato del test PSA 3,0 ng/mL o superiore, e 38-719 almeno 1 risultato 4,0 ng/mL o superiore, di cui il 36% e il 43%, rispettivamente, sono stati sottoposti a biopsia prostatica entro 12 mesi. Le caratteristiche sono presentate nella eTabella 5 del Supplemento a seconda che sia stata eseguita o meno una biopsia. L’uso di farmaci antidiabetici è stato associato a una minore probabilità di biopsia a seguito di un elevato PSA (Tabella 3; eTabella 6 nel Supplemento). Tra gli uomini con livello di PSA 3,0 ng/mL o superiore, i rapporti di probabilità corrette erano 0,87 (95% CI, 0,80-0,96) per gli uomini che avevano usato la metformina, 0,88 (95% CI, 0,78-1,00) per gli uomini che avevano usato la sulfonilurea, e 0,83 (95% CI, 0,74-0,93) per gli uomini che avevano usato l’insulina rispetto a nessuna esposizione precedente. Un modello simile è stato osservato tra gli uomini con livello di PSA 4,0 ng/mL o superiore.
| Farmaci antidiabetici | Metformina | Sulfonylurea | Insulina | |||
|---|---|---|---|---|---|---|
| No. Esposto | OR (95% CI) | No. Esposto | OR (95% CI) | No. Esposto | OR (95% CI) | |
| Qualsiasi uso precedente | 1974 | 1.03 (0.92-1.16) | 878 | 1.10 (0.93-1.30) | 900 | 0.96 (0.82-1.13) |
| Anni di utilizzo precedenteb | ||||||
| <1 | 412 | 1.19 (0.96-1.47) | 213 | 0.95 (0.71-1.27) | 175 | 1.01 (0.73-1.41) |
| Da 1 a <2 | 325 | 0.93 (0.73-1.18) | 156 | 1.09 (0.77-1.54) | 140 | 0.92 (0.64-1.31) |
| Da 2 a <3 | 262 | 0.98 (0.75-1.27) | 104 | 1.06 (0.72-1.56) | 85 | 0.90 (0.57-1.41) |
| Da 3 a <4 | 205 | 0.99 (0.74-1.32) | 102 | 1.20 (0.81-1.78) | 99 | 0.97 (0.64-1.46) |
| ≥4 | 770 | 1.01 (0.85-1.20) | 303 | 1.16 (0.90-1.49) | 401 | 0.99 (0.80-1.23) |
| Qualsiasi uso precedente, stratificato da trigger PSA, ng/mLc | ||||||
| <3 | 285 | 1.02 (0.72-1.44) | 133 | 0.88 (0.53-1.46) | 133 | 0.83 (0.51-1.36) |
| Da 3 a <6 | 738 | 1.00 (0.83-1.20) | 284 | 1.02 (0.78-1.35) | 290 | 0.90 (0.69-1.17) |
| Da 6 a <10 | 468 | 1.17 (0.94-1.45) | 210 | 1.23 (0.91-1.66) | 208 | 1.14 (0.85-1.53) |
| Da 10 a <20 | 247 | 0.96 (0.71-1.31) | 108 | 1.09 (0.72-1.63) | 123 | 0.92 (0.63-1.36) |
| ≥20 | 163 | 0.95 (0.60-1.52) | 100 | 1.16 (0.66-2.02) | 97 | 1.15 (0.64-2.05) |
Individuazione del cancro alla prostata alla biopsia
Le caratteristiche degli uomini sottoposti a biopsia sono indicate nella eTabella 7 del supplemento. In totale sono stati inclusi 32-123 uomini che hanno subito 39-160 biopsie. Un totale del 41% ha avuto un cancro alla prostata rilevato alla biopsia.
I risultati della regressione logistica multivariabile hanno indicato che la precedente esposizione a metformina, sulfonilurea o insulina non era associata ai risultati della biopsia (Tabella 3; eTabella 8 nel supplemento). I risultati sono stati simili se si considerano tutti gli eventi bioptici e solo la prima biopsia. Non vi era alcuna indicazione di un’associazione dose-risposta per qualsiasi classe di farmaci. Anche i risultati delle analisi stratificate in base alla concentrazione di PSA di trigger non hanno mostrato alcuna associazione in nessun intervallo di PSA.
Discussione
Questo studio di coorte, utilizzando i dati di uno studio di registro a livello di popolazione, ha rilevato che (1) l’uso di farmaci antidiabetici non è stato associato in modo differenziato ai livelli di PSA, anche se i livelli di PSA nel siero erano inferiori a quelli di un gruppo di confronto di uomini della stessa età prima della prescrizione iniziale di farmaci antidiabetici; (2) la frequenza complessiva dei test del PSA era più bassa tra gli uomini che ricevevano qualsiasi farmaco antidiabetico rispetto a quelli che non lo ricevevano, ma era più alta dopo l’inizio dell’uso di metformina e sulfonilurea e più bassa dopo l’inizio dell’uso di insulina; (3) le procedure di biopsia della prostata erano meno frequenti negli uomini che avevano mai prescritto farmaci antidiabetici, anche quando il livello di PSA era elevato; e (4) i tassi di rilevamento del cancro alla prostata alla biopsia non differivano tra gli uomini esposti ai comuni farmaci antidiabetici, indipendentemente dai livelli di trigger del PSA.
I nostri risultati di nessuna differenza nei livelli di PSA dopo le prescrizioni iniziali di farmaci antidiabetici non supportano l’ipotesi che l’uso di comuni farmaci antidiabetici porta a livelli di PSA più bassi che possono mascherare la presenza di cancro alla prostata negli uomini con diabete. Mentre i livelli sierici più bassi di PSA tra gli uomini con diabete sono stati costantemente segnalati,15,16,17,18 prove di specifici farmaci antidiabetici sono mischiate. Diversi rapporti19,20 indicano livelli di PSA più bassi tra gli uomini che assumono diverse classi di farmaci, mentre un altro21 ha riportato livelli di PSA più bassi solo tra gli uomini che ricevono metformina, anche se senza una chiara associazione dose-risposta. Al contrario, altri studi22,23 hanno riportato concentrazioni di PSA più elevate tra gli uomini che usano la metformina. La variazione dei risultati può essere dovuta a differenze nel disegno dello studio e nella popolazione di confronto. Ad esempio, limitando la popolazione dello studio agli uomini con diabete22,23 possono dare risultati diversi da studi su tutta la popolazione. Ad eccezione dell’articolo di Wallner et al,16 nessuno di questi studi ha tenuto conto delle differenze nei livelli di PSA prima dell’uso dei farmaci. I nostri risultati, che si sono adeguati alle differenze nei livelli di PSA premedicati, aiutano a ridurre i livelli di PSA associati alla malattia piuttosto che ai farmaci. Per quanto riguarda l’uso di insulina, sono state osservate differenze significative nei livelli di PSA post-medicazione per l’esposizione entro 6 mesi dalla misurazione del PSA. Tuttavia, questi risultati sono coerenti con una maggiore riduzione relativa della concentrazione di PSA con il peggioramento della malattia.20,24
Gli studi che esaminano la frequenza dei test del PSA tra gli uomini con diabete sono scarsi, nonostante il bias di rilevazione sia una possibile spiegazione per il minor rischio di cancro alla prostata. Mentre una minore frequenza di test è stata riportata tra gli uomini obesi, che sono a maggior rischio di sviluppare il diabete,25,26 test PSA più frequenti sono stati segnalati negli uomini con condizioni comorbide, in particolare le condizioni cardiovascolari.26,27 Per il diabete in particolare, alcuni26,28,29 ma non tutti24,30 studi riportano una maggiore frequenza di test del PSA tra gli uomini con diabete. I nostri risultati suggeriscono che gli uomini che sono suscettibili di sviluppare il diabete si sottopongono al test del PSA meno frequentemente, ma una volta prescritta la metformina e la sulfonilurea si sottopongono a test leggermente più frequenti rispetto a quelli che non ricevono farmaci. Fowke et al29 hanno ipotizzato che tassi più elevati di test PSA negli uomini con specifiche condizioni croniche possono essere collegati alla necessità di esami del sangue di routine. I nostri risultati supportano questa teoria. La ridotta frequenza dei test del PSA dopo l’inizio dell’uso di insulina può riflettere le raccomandazioni di non offrire il test del PSA a uomini con un’aspettativa di vita limitata a causa di malattie croniche (ad esempio, diabete grave).31
I tassi di biopsia più bassi negli uomini che ricevono farmaci antidiabetici possono essere in parte spiegati dai livelli più bassi di PSA in questi uomini. Tuttavia, i nostri risultati indicano anche che relativamente meno uomini che ricevono farmaci antidiabetici vengono sottoposti a biopsia quando il PSA è elevato. Non possiamo determinare se questa associazione sia dovuta a una diminuzione dei tassi di riferimento o a una minore conformità alle raccomandazioni bioptiche. Ci sono stati rapporti di una minore conformità con le raccomandazioni bioptiche tra gli uomini diabetici all’interno degli studi (ad esempio, A Clinical Research Study to Reduce the Incidence of Prostate Cancer in Men Who Are at Increased Risk [RIDUCE] [RIDUZIONE] [Studio di ricerca clinica per ridurre l’incidenza del cancro alla prostata negli uomini a rischio aumentato].32 e il test per la prevenzione del cancro al selenio e alla vitamina E [SELEZIONARE],33 anche se non è stata osservata alcuna associazione nella sperimentazione per la prevenzione del cancro alla prostata [PCPT].33). Tuttavia, i medici possono anche essere meno propensi a raccomandare la biopsia a causa dell’aumento della comorbilità associata al diabete, che può limitare l’idoneità dell’uomo al trattamento radicale.
Non abbiamo trovato alcuna differenza nei tassi di rilevamento del cancro alla prostata alla biopsia, che si applica a diversi intervalli di trigger del PSA, suggerendo che l’uso di farmaci per il diabete non è associato al rilevamento del cancro alla prostata alla biopsia. Se i livelli più bassi di PSA mascheravano la presenza del cancro alla prostata, ci si potrebbe aspettare un aumento della diagnosi del cancro alla prostata. I nostri risultati non sono coerenti con le segnalazioni di un aumento del rilevamento del cancro alla prostata tra gli uomini con diabete o con uno scarso controllo glicemico.34,35,36 Due dei suddetti studi, tuttavia, sono stati intrapresi in popolazioni asiatiche dove è più evidente un’associazione positiva piuttosto che negativa tra diabete e rischio di cancro alla prostata.37 Inoltre, studi precedenti non hanno esaminato specificamente i risultati della biopsia in relazione a specifici farmaci antidiabetici, che possono migliorare gli effetti del diabete stesso.
Punti di forza e limitazioni
I punti di forza di questo studio includono le sue grandi dimensioni e la copertura a livello di popolazione, con l’inclusione di tutti i farmaci antidiabetici prescritti, il test del PSA e le procedure di biopsia per gli uomini a Stoccolma tramite collegamenti a registri di alta qualità. A differenza degli studi precedenti, il nostro studio ha misurato specificamente le differenze nei livelli di PSA con l’aggiustamento per il PSA prima della prima prescrizione. Questo è vantaggioso, in quanto le associazioni tra i farmaci e l’esito possono essere più facilmente distinte dalle associazioni tra malattia ed esito. Inoltre, abbiamo esplorato diversi potenziali meccanismi attraverso i quali i farmaci antidiabetici possono essere associati alla diagnosi del cancro alla prostata all’interno della stessa coorte e nello stesso periodo di tempo per fornire una valutazione più completa del potenziale di bias di diagnosi.
Anche questo studio ha delle limitazioni, tra cui l’accesso ai dati delle prescrizioni solo a partire dal luglio 2005. Tuttavia, abbiamo incluso un periodo di rodaggio di 6 mesi. In secondo luogo, nelle nostre analisi non abbiamo considerato tutti i possibili farmaci per il diabete, anche se metformina, sulfonilurea e insulina sono i farmaci più comuni utilizzati in Svezia per il diabete.38 Inoltre, gli uomini il cui diabete è gestito solo attraverso interventi sulla dieta e sullo stile di vita possono essere stati inclusi nel gruppo non esposto. La mancanza di dati di assistenza primaria su comorbidità specifiche e fattori di stile di vita come l’IMC e il fumo ha limitato la nostra capacità di controllo per i confonditori. Un’altra limitazione è stata la mancanza di regolazione per altri farmaci comuni, come gli antipertensivi o i farmaci per abbassare i lipidi, che possono potenzialmente influenzare i livelli di PSA. Tuttavia, sono stati esclusi gli uomini che hanno ricevuto inibitori della 5α-reduttasi o che hanno subito una resezione transuretrale della prostata. Inoltre, i dati sulla tecnica di biopsia, sul numero di nuclei e sul volume della prostata non erano disponibili per tutti gli uomini.
Conclusioni
I nostri risultati non supportano l’ipotesi che l’associazione inversa tra diabete e rischio di cancro alla prostata sia mediata attraverso l’uso di farmaci antidiabetici che abbassano il PSA e mascherano la presenza di cancro alla prostata. I nostri risultati indicano il potenziale di distorsione della diagnosi (ad esempio, meno biopsie intraprese quando il PSA è elevato), il che può spiegare alcuni dei rischi più bassi negli uomini con diabete.
References
- Type 2 diabetes and risk of prostate cancer: a meta-analysis of observational studies. Prostate Cancer Prostatic Dis. 2013; 16(2)DOI | PubMed
- Diabetes mellitus and risk of prostate cancer: a meta-analysis. Diabetologia. 2004; 47(6):1071-1078. DOI | PubMed
- A meta-analysis of diabetes mellitus and the risk of prostate cancer. Cancer Epidemiol Biomarkers Prev. 2006; 15(11):2056-2062. DOI | PubMed
- Diabetes mellitus and risk of prostate cancer: an updated meta-analysis based on 12 case-control and 25 cohort studies. Acta Diabetol. 2012; 49(suppl 1):S235-S246. DOI | PubMed
- Type of diabetes mellitus and the odds of Gleason score 8 to 10 prostate cancer. Int J Radiat Oncol Biol Phys. 2012; 82(3):e463-e467. DOI | PubMed
- Does diabetes mellitus increase the risk of high-grade prostate cancer in patients undergoing radical prostatectomy?. Prostate Cancer Prostatic Dis. 2011; 14(1):74-78. DOI | PubMed
- Does pre-existing diabetes affect prostate cancer prognosis? a systematic review. Prostate Cancer Prostatic Dis. 2010; 13(1):58-64. DOI | PubMed
- A systematic review of the literature exploring the interplay between prostate cancer and type two diabetes mellitus. Ecancermedicalscience. 2018; 12:802. DOI | PubMed
- Why are diabetics at reduced risk for prostate cancer? a review of the epidemiologic evidence. Urol Oncol. 2012; 30(5):735-743. DOI | PubMed
- The relationship between diabetes, prostate-specific antigen screening tests, and prostate cancer. Cancer Causes Control. 2018; 29(10):907-914. DOI | PubMed
- A review for clinicians: prostate cancer and the antineoplastic properties of metformin. Urol Oncol. 2017; 35(1):21-29. DOI | PubMed
- Metformin and sulfonylureas in relation to cancer risk in type II diabetes patients: a meta-analysis using primary data of published studies. Metabolism. 2013; 62(7):922-934. DOI | PubMed
- Diabetes mellitus and risk of prostate cancer in the health professionals follow-up study. Int J Cancer. 2009; 124(6):1398-1403. DOI | PubMed
- Prostate-specific antigen (PSA) testing is prevalent and increasing in Stockholm County, Sweden, despite no recommendations for PSA screening: results from a population-based study, 2003-2011. Eur Urol. 2013; 63(3):419-425. DOI | PubMed
- Serum prostate-specific antigen levels in men with type 2 diabetes. Diabetes Care. 2008; 31(5):930-931. DOI | PubMed
- Changes in serum prostate-specific antigen levels and the identification of prostate cancer in a large managed care population. BJU Int. 2013; 111(8):1245-1252. DOI | PubMed
- Prostate-specific antigen values in diabetic and nondiabetic US men, 2001-2002. Am J Epidemiol. 2006; 164(10):978-983. DOI | PubMed
- The effect of demographic and clinical factors on the relationship between BMI and PSA levels. Prostate. 2011; 71(15):1631-1637. DOI | PubMed
- The risk of prostate cancer for men on aspirin, statin or antidiabetic medications. Eur J Cancer. 2015; 51(6):725-733. DOI | PubMed
- Association of diabetes and body mass index with levels of prostate-specific antigen: implications for correction of prostate-specific antigen cutoff values?. Cancer Epidemiol Biomarkers Prev. 2009; 18(5):1350-1356. DOI | PubMed
- The relationship between metformin and serum prostate-specific antigen levels. Prostate. 2016; 76(15):1445-1453. DOI | PubMed
- Influence of metformin use on PSA values, free-to-total PSA, prostate cancer incidence and grade and overall survival in a prospective screening trial (ERSPC Aarau). World J Urol. 2015; 33(8):1189-1196. DOI | PubMed
- Impact of metformin on serum prostate-specific antigen levels: data from the national health and nutrition examination survey 2007 to 2008. Medicine (Baltimore). 2017; 96(51)DOI | PubMed
- Association of diabetes with prostate cancer risk in the multiethnic cohort. Am J Epidemiol. 2009; 169(8):937-945. DOI | PubMed
- Health disparities in clinical practice patterns for prostate cancer screening by geographic regions in the United States: a multilevel modeling analysis. Prostate Cancer Prostatic Dis. 2013; 16(2):193-203. DOI | PubMed
- Prostate-specific antigen testing in inner London general practices: are those at higher risk most likely to get tested?. BMJ Open. 2016; 6(7)DOI | PubMed
- Trends in prostate-specific antigen test use, 2000-2005. Public Health Rep. 2011; 126(2):228-239. DOI | PubMed
- Diabetes, prostate cancer screening and risk of low- and high-grade prostate cancer: an 11 year historical population follow-up study of more than 1 million men. Diabetologia. 2016; 59(8):1683-1691. DOI | PubMed
- Obesity and prostate cancer screening among African-American and Caucasian men. Prostate. 2006; 66(13):1371-1380. DOI | PubMed
- Factors related to prostate-specific antigen-based prostate cancer screening in primary care: retrospective cohort study of 120,587 French men over the age of 50 years. JMIR Public Health Surveill. 2018; 4(4)DOI | PubMed
- EAU-ESTRO-ESUR-SOIG Guidelines on Prostate Cancer.Publisher Full Text
- Baseline subject characteristics predictive of compliance with study-mandated prostate biopsy in men at risk of prostate cancer: results from REDUCE. Prostate Cancer Prostatic Dis. 2016; 19(2):202-208. DOI | PubMed
- Biases in recommendations for and acceptance of prostate biopsy significantly affect assessment of prostate cancer risk factors: results from two large randomized clinical trials. J Clin Oncol. 2016; 34(36):4338-4344. DOI | PubMed
- The association of diabetes and positive prostate biopsy in a US veteran population. Prostate Cancer Prostatic Dis. 2012; 15(1):70-74. DOI | PubMed
- Impact of diabetes mellitus on the detection of prostate cancer via contemporary multi (≥ 12)-core prostate biopsy. Prostate. 2012; 72(1):51-57. DOI | PubMed
- Poor glycemic control of diabetes mellitus is associated with higher risk of prostate cancer detection in a biopsy population. PLoS One. 2014; 9(9)DOI | PubMed
- Diabetes mellitus and prostate cancer risk in Asian countries: a meta-analysis. Asian Pac J Cancer Prev. 2012; 13(8):4097-4100. DOI | PubMed
- Incidence, prevalence and mortality of type 2 diabetes requiring glucose-lowering treatment, and associated risks of cardiovascular complications: a nationwide study in Sweden, 2006-2013. Diabetologia. 2016; 59(8):1692-1701. DOI | PubMed
Fonte
Beckmann K, Crawley D, Nordström T, Aly M, Olsson H, et al. (2019) Association Between Antidiabetic Medications and Prostate-Specific Antigen Levels and Biopsy Results. JAMA Network Open 2(11): e1914689. https://doi.org/10.1001/jamanetworkopen.2019.14689





