Introduzione
Il flutter atriale (AFL) e la fibrillazione atriale (AF) sono spesso raggruppati insieme in termini di stratificazione del rischio e negli studi epidemiologici.1,2 L’incidenza della fibrillazione atriale è circa un sedicesimo di quella della fibrillazione atriale.3 L’incidenza di AFL è stato segnalato per essere 88 per 100 000 persone, e l’incidenza di AFL solitario è stato segnalato per essere 37 per 100 000 persona-anni nella popolazione generale durante i 4 anni di studio osservazionale di osservazione della Marshfield Epidemiologic Study Area.4 La fluttuazione atriale è simile alla fibrillazione atriale in quanto la sua incidenza aumenta con l’età4,5 e contribuisce all’insufficienza cardiaca, all’ictus e alla mortalità.3,6 Pertanto, la gestione farmacologica della FA è di solito considerata come per la FA, soprattutto per prevenire gli eventi tromboembolici.7 Anche se AF e AFL condividono molti fattori di rischio comuni per l’occorrenza,4,5,8,9 sono state segnalate differenze nei risultati clinici. Ad esempio, uno studio10 ha riportato una maggiore incidenza di mortalità tra i pazienti con FA rispetto a quelli con FA durante un periodo di osservazione di 7 anni, e un altro studio11 ha riportato una minore incidenza di ictus tra i pazienti con FA solitaria rispetto a quelli con FA. Anche se lo studio Framingham Cuore3 trovato che AF e AFL sono stati associati con l’esito uguale di ictus, i risultati sono indeboliti dalla piccola popolazione di studio.
Il sistema di punteggio CHA2DS2-VASc è stato sviluppato nel 201012 ed è calcolato secondo un sistema di punti in cui vengono assegnati 2 punti per un’anamnesi di ictus o di attacco ischemico transitorio (S2) o di età (A2) superiore ai 75 anni e 1 punto ciascuno per un’età (A) compresa tra i 65 e i 74 anni o per un’anamnesi di insufficienza cardiaca congestizia (C), ipertensione (H), diabete (D), malattie vascolari (V) (infarto del miocardio e arterie periferiche) e sesso femminile (categoria di sesso [Sc]). CHA2DS2-VASc è attualmente il sistema di punteggio standard per la stratificazione del rischio per prevedere gli eventi tromboembolici nei pazienti con FA e LCA ed è un mezzo per stratificare il rischio di ospedalizzazione per l’insufficienza cardiaca e la mortalità in questi pazienti.13,14 Sulla base dei distinti meccanismi elettrofisiologici sottostanti e substrati miocardici di AFL e AF,15,16 l’incidenza di ictus ischemico, il ricovero per insufficienza cardiaca e la mortalità per tutte le cause dovrebbe essere diversa a seconda dei diversi livelli di punteggio CHA2DS2-VASc. Pertanto, abbiamo condotto questo studio per valutare l’incidenza dell’ictus ischemico, del ricovero per insufficienza cardiaca e della mortalità per tutte le cause tra i pazienti con FA e FA stratificati per livelli di punteggio CHA2DS2-VASc in un ampio database nazionale basato sulla popolazione.
Metodi
Fonte dei dati
Questo studio retrospettivo di coorte a livello nazionale ha analizzato i dati del Taiwan National Health Insurance Research Database (NHIRD) che sono stati rilasciati dagli Istituti nazionali di ricerca sanitaria di Taiwan dal 1 gennaio 1997 al 31 dicembre 2012. Il NHIRD contiene informazioni sull’assistenza sanitaria di oltre 23 milioni di residenti di Taiwan iscritti al programma obbligatorio di assicurazione sanitaria nazionale.17,18La banca dati comprende i dati di registrazione e demografici, le prescrizioni di farmaci, gli interventi e gli esami, le visite ambulatoriali complete, i ricoveri ospedalieri, lo stato vitale e le malattie, che sono registrati con i codici ICD-9-CM (International Classification of Diseases, Ninth Revision, Clinical Modification). Nel NHIRD, i numeri di identificazione dei pazienti sono criptati per proteggere la loro privacy, e la procedura di criptaggio è coerente in modo che sia possibile collegare i reclami appartenenti allo stesso iscritto e che possano essere seguiti longitudinalmente. Questo studio è stato approvato dal comitato di revisione istituzionale del Chang Gung Memorial Hospital e il comitato etico ha rinunciato alla necessità di un consenso informato scritto. Questo studio ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia (STROBE).
AF, AFL e coorti di controllo abbinate
Le diagnosi di FA e di LCA sono state confermate da più di 2 diagnosi ambulatoriali o 1 diagnosi ospedaliera nel NHIRD, come convalidato in studi precedenti.19,20 La data dell’indice è stata definita come la data della prima diagnosi di AF o AFL. Dopo aver escluso 246 pazienti con informazioni mancanti, sono stati identificati 308-543 pazienti con nuova diagnosi di FA o LCA dal 1° gennaio 2001 al 31 dicembre 2012 e quelli di 20 anni o più sono stati arruolati in questo studio. Dopo aver escluso i pazienti con FA con una diagnosi concomitante di FA e quelli con FA con una diagnosi concomitante di FA durante il periodo di osservazione, abbiamo identificato 260-912 pazienti adulti con una diagnosi di AFL o FA solitaria (Figura 1). Abbiamo anche escluso i pazienti con malattie cardiache reumatiche, quelli che sono stati sottoposti a interventi chirurgici per malattie valvolari, e quelli con cause reversibili di AF e AFL, come l’ipertiroidismo e la sepsi coesistente o la chirurgia cardiaca quando AF o AFL è stata diagnosticata durante lo stesso ricovero. Sono stati esclusi anche i pazienti che hanno ricevuto una terapia che può aver influito sui risultati dello studio durante il periodo di osservazione, come l’ablazione con catetere a radiofrequenza per la FA o la LBF e la terapia anticoagulante. Il sottoutilizzo di anticoagulanti orali per i pazienti con FA non valvolare in Asia (prevalenza di circa il 20%-30%), anche a Taiwan,21,22 ha fornito l’opportunità di valutare i pazienti con FA e LCA che non hanno ricevuto un’adeguata terapia di prevenzione dell’ictus, riducendo così al minimo i pregiudizi di selezione. Pertanto, sono stati esclusi anche gli anticoagulanti prescritti ai pazienti dopo la data di riferimento. Un totale finale di 188-811 pazienti sono stati arruolati nella coorte solitaria di AF non valvolare, con 6390 nella coorte solitaria di AFL non valvolare (Figura 1).
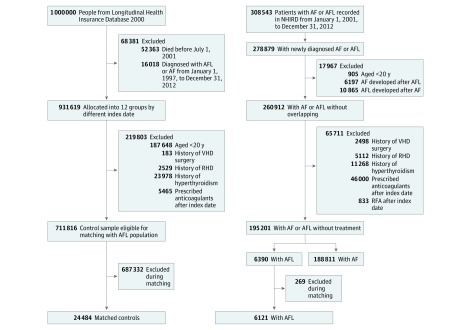
Figura 1.Diagramma di flusso del disegno dello studioLa FA indica fibrillazione atriale; AFL, flutter atriale; NHIRD, National Health Insurance Research Database; RFA, ablazione a radiofrequenza; RHD, cardiopatia reumatica; e VHD, cardiopatia valvolare.
I partecipanti al controllo sono stati definiti come quelli senza diagnosi di FA o AFL tra il 1° gennaio 1997 e il 31 dicembre 2012, e sono stati selezionati dal 2000 Longitudinal Health Insurance Database, che fornisce dati anonimi collegati longitudinalmente di 1.000.000 arruolati (quasi il 5% della popolazione di Taiwan) campionati a caso dal 2000 Registry for Beneficiaries of the NHIRD. Il Longitudinal Health Insurance Database è stato convalidato come campione rappresentativo della popolazione taiwanese in termini di età, sesso e fascia salariale media.23 I partecipanti al controllo sono stati divisi casualmente in 12 sottogruppi in base a diverse date dell’indice, con l’anno medio fissato come data dell’indice (ad esempio, 1 luglio 2001, 1 luglio 2002, e così via fino al 1 luglio 2012) in ogni sottogruppo. I criteri di esclusione per il gruppo di controllo erano l’età inferiore ai 20 anni, le cardiopatie reumatiche o l’ipertiroidismo, l’intervento chirurgico per le cardiopatie valvolari durante il periodo di osservazione e la terapia anticoagulante dopo la data dell’indice. Un totale finale di 711-816 partecipanti al controllo erano idonei per l’abbinamento di età e sesso con i 6390 pazienti con AFL perché la popolazione AFL era di solito più anziana di quella senza AFL o AF, e 24 484 partecipanti al controllo che erano esattamente abbinati utilizzando un rapporto 4:1 alla coorte AFL per età, sesso e anno di indice componevano la coorte di controllo abbinata (Figura 1).

Figura 1.Diagramma di flusso del disegno dello studioLa FA indica fibrillazione atriale; AFL, flutter atriale; NHIRD, National Health Insurance Research Database; RFA, ablazione a radiofrequenza; RHD, cardiopatia reumatica; e VHD, cardiopatia valvolare.
Valutazione dei risultati secondo il CHA2DS2-VASc Score
I partecipanti allo studio sono stati seguiti e i dati sono stati analizzati dalla data dell’indice fino all’esito clinico definito o fino al 31 dicembre 2012. Sono stati valutati tre esiti clinici: ictus ischemico, ospedalizzazione per insufficienza cardiaca e mortalità totale. Il ricovero per insufficienza cardiaca e l’ictus ischemico sono stati definiti in base alla diagnosi principale al momento del ricovero. La mortalità per tutte le cause è stata definita come ritiro dal programma di assicurazione sanitaria nazionale.24 I risultati clinici nei 3 gruppi (AF, AFL e coorti di controllo) sono stati confrontati tra i diversi livelli di CHA2DS2-VASc. Il punteggio più basso è 0 e quello più alto è 9 nel sistema di punteggio CHA2DS2-VASc, con punteggi più alti che indicano un maggiore rischio di ictus ischemico. Questo sistema di punteggio è stato utilizzato anche in una popolazione asiatica,25,26 e la distribuzione dell’incidenza dell’ictus ischemico era paragonabile a quella di altri studi.27,28 Ogni paziente è stato classificato in un livello CHA2DS2-VASc (0, 1, 2, 3, 4 e 5-9) perché le componenti età e sesso di CHA2DS2-VASc erano già abbinate tra le coorti di controllo e AFL.
Risultati e risultati di AF, AFL, Comorbidità, Comorbidità e risultati
La fibrillazione atriale (codice ICD-9-CM 427.31), l’AFL (codice ICD-9-CM 427.32) e tutte le comorbilità sono state definite in base alle diagnosi effettuate durante il ricovero o in almeno 2 visite cliniche consecutive (eTabella 1 nel supplemento). L’elevata accuratezza della diagnosi di FA basata sulla codifica ICD-9-CM nel NHIRD è stata confermata in uno studio precedente,29 e un valore predittivo positivo per la diagnosi di AFL del 97,5% è stato riportato in precedenza.30 Le altre comorbilità riportate in letteratura31,32 sono stati anche convalidati, di cui ipertensione, diabete e dislipidemia sono stati diagnosticati secondo il codice ICD-9-CM e l’uso di farmaci correlati per aumentare l’accuratezza diagnostica (eTable 2 nel supplemento). In termini di risultati dello studio, abbiamo precedentemente convalidato le principali diagnosi di insufficienza cardiaca e di ictus ischemico al momento dell’ammissione all’indice nei pazienti con FA e LCA,30 e i valori predittivi positivi sono stati del 94,2% per l’ictus ischemico e del 97,6% per il ricovero per insufficienza cardiaca.
Analisi statistica
Le caratteristiche cliniche dei pazienti (cioè, età, sesso, comorbilità di base e farmaci) sono state confrontate tra i 3 gruppi (AF vs AFL vs coorti di controllo abbinate) utilizzando l’analisi della varianza a 1 via per le variabili continue o il test χ 2 per le variabili categoriche. Per i confronti a coppie tra i 2 gruppi di studio, abbiamo usato l’aggiustamento Bonferroni. I rischi di esiti clinici (ictus ischemico, ospedalizzazione per insufficienza cardiaca e mortalità per cause naturali) sono stati espressi come densità di incidenza (ID), definite come il numero di eventi per 100 persone-anno. Gli IC del 95% circa degli ID sono stati poi calcolati in base alla distribuzione di Poisson. I confronti dell’incidenza dei risultati clinici tra 2 coorti qualsiasi sono stati fatti utilizzando l’analisi di regressione dei pericoli proporzionali di Cox nei livelli di punteggio di CHA2DS2-VASc in pool (range di punteggio, 0-9) o a un livello stratificato di CHA2DS2-VASc (0, 1, 2, 2, 3, 4 e 5-9). Inoltre, la proporzione di ogni componente di CHA2DS2-VASc è stata anche confrontata tra le 3 coorti utilizzando il test χ 2 o l’analisi a 1 via della varianza con le correzioni di Bonferroni. Per l’analisi primaria (regressione dei pericoli proporzionali Cox), abbiamo condotto un’analisi di sensibilità in cui sono stati esclusi i pazienti che hanno ricevuto eventuali farmaci antiaritmici dopo la data dell’indice. Poiché i pazienti con FA erano più anziani di 6 anni rispetto ai pazienti con FA, è stata condotta un’analisi di falsificazione per rilevare la confusione residua.33 Abbiamo scelto il carcinoma epatocellulare come punto finale della falsificazione a causa della sua elevata incidenza a Taiwan e della mancanza di prove di differenza tra le coorti di FA e AFL. I livelli di significatività statistica sono stati fissati come P<0,05 su due lati e in questo studio non è stato effettuato alcun aggiustamento dei test multipli (molteplicità). Per tutte le analisi statistiche è stato utilizzato il software SAS per Windows, versione 9.4 (SAS Institute Inc). I partecipanti con informazioni demografiche mancanti (cioè, sesso e data di nascita) sono stati esclusi dall’analisi (<0,1%). Nessun partecipante non era disponibile per il follow-up.
Risultati
Caratteristiche di base delle coorti di controllo AF, AFL e di controllo abbinate
In totale hanno partecipato allo studio 219-416 persone di età e sesso pari a 219-416 anni. C’erano 188-811 pazienti nella coorte AF (età media [SD], 73,8 [13,4] anni; 104 703 [55,5%] uomini), 6121 pazienti nella coorte AFL (età media [SD], 67 anni.7 [15,8] anni; 3735 [61,0%] maschio), e 24-484 pazienti nella coorte di controllo abbinata (età media [SD], 67,3 [15,6] anni; 14-940 [61,0%] maschio). La coorte AF era più anziana, era più predonante femminile, e aveva una prevalenza significativamente più alta di comorbidità, compresa la storia di ictus, rispetto alle altre 2 coorti (Tabella). Le coorti AF e AFL avevano tassi di prevalenza significativamente più elevati di tutte le comorbidità (Tabella) e una storia di ictus e/o eventi tromboembolici e infarto del miocardio rispetto alla coorte di controllo, e questa osservazione è stata coerente con la differenza nell’uso di farmaci correlati (eTabella 3 nel supplemento). In termini di punteggio CHA2DS2-VASc, la coorte AF ha avuto il punteggio medio più alto di CHA2DS2-VASc, mentre la coorte di controllo ha avuto il punteggio più basso (Tabella).
| Caratteristica | Coorte di controllo abbinata (n = 24 484) | Coorte AFL (n = 6121) | Coorte AF (n=188 811) |
|---|---|---|---|
| Età, media (SD), y | 67.3 (15.6) | 67.7 (15.8) | 73.8 (13.4)b,c |
| Fascia d’età, y | |||
| <65 | 8764 (35.8) | 2191 (35.8) | 41 199 (21.8)b,c |
| 65-74 | 6008 (24.5) | 1502 (24.5) | 43 340 (23.0)b,c |
| ≥75 | 9712 (39.7) | 2428 (39.7) | 104 272 (55.2)b,c |
| Sesso | |||
| Maschio | 14 940 (61.0) | 3735 (61.0) | 104 703 (55.5)b,c |
| Femmina | 9544 (39.0) | 2386 (39.0) | 84 108 (44.5)b,c |
| Comorbidità | |||
| Ipertensione | 8486 (34.7) | 3248 (53.1)b | 108 094 (57.2)b,c |
| Diabete | 3173 (13.0) | 1201 (19.6)b | 36 086 (19.1)b |
| Malattia cardiaca ischemica | 2766 (11.3) | 2115 (34.6)b | 70 381 (37.3)b,c |
| Dislipidemia | 2018 (8.2) | 775 (12.7)b | 20 408 (10.8)b,c |
| Malattia polmonare cronica ostruttiva | 1835 (7.5) | 1208 (19.7)b | 43 897 (23.2)b,c |
| Gotta | 1512 (6.2) | 594 (9.7)b | 18 739 (9.9)b |
| Funzione epatica anormale | 1621 (6.6) | 749 (12.2)b | 21 119 (11.2)b,c |
| Tumore maligno | 1209 (4.9) | 543 (8.9)b | 14 903 (7.9)b,c |
| Scompenso cardiaco | 579 (2.4) | 798 (13.0)b | 27 716 (14.7)b,c |
| Malattia arteriosa periferica | 347 (1.4) | 163 (2.7)b | 5128 (2.7)b |
| Stato renale | |||
| Malattia renale non cronica | 23 387 (95.5) | 5113 (83.5)b | 159 348 (84.4)b |
| Malattia renale cronica senza dialisi | 933 (3.8) | 762 (12.4)b | 23 422 (12.4)b |
| Malattia renale cronica con dialisi | 164 (0.7) | 246 (4.0)b | 6041 (3.2)b,c |
| Storia della malattia | |||
| ictus o tromboembolismo sistemico | 1995 (8.1) | 968 (15.8)b | 35 845 (19.0)b,c |
| Corsa | 1881 (7.7) | 868 (14.2)b | 32 823 (17.4)b,c |
| Infarto del miocardio | 360 (1.5) | 377 (6.2)b | 9165 (4.9)a,b |
| Punteggio CHA2DS2-VASc, medio (SD) | 2.2 (1.7) | 3.0 (1.9)b | 3.5 (1.9)b,c |
| Gruppo CHA2DS2-VASc | |||
| 0 | 4047 (16.5) | 538 (8.8) | 10 738 (5.7) |
| 1 | 5458 (22.3) | 1040 (17.0) | 18 348 (9.7) |
| 2 | 5191 (21.2) | 1095 (17.9) | 29 782 (15.8) |
| 3 | 4490 (18.3) | 1132 (18.5) | 39 058 (20.7) |
| 4 | 2847 (11.6) | 1024 (16.7) | 37 423 (19.8) |
| 5-9 | 2451 (1.0) | 1292 (21.1) | 53 462 (28.3) |
Corsa ischemica
Con un follow-up medio (SD) di 3,1 (2,9) anni, gli ID di ictus ischemico erano 3,08 (95% CI, 3,03-3,13) nella coorte AF, 1,45 (95% CI, 1,28-1,62) nella coorte AFL, e 0,97 (95% CI, 0,92-1,03) nelle coorti di controllo, e ci sono state differenze significative tra loro (Figura 2A). Quando si stratificano i gruppi per punteggio CHA2DS2-VASc, gli ID di ictus ischemico aumentato con il livello di punteggio CHA2DS2-VASc in tutte e 3 le coorti (Figura 3).34 Inoltre, l’ID dell’ictus ischemico a un punteggio CHA2DS2-VASc di 1 nella coorte AF (ID, 1,14; 95% CI, 1,06-1,22) era simile a quello di un punteggio CHA2DS2-VASc di 2 nella coorte AFL (ID, 1,02; 95% CI, 0,69-1,34) (Figura 3 e Figura 4A). Inoltre, l’ID di ictus ischemico a un punteggio CHA2DS2-VASc di 2 nella coorte AF (ID, 2,30; 95% CI, 2,20-2,40) era simile a quello di un punteggio CHA2DS2-VASc di 4 nella coorte AFL (ID, 2,30; 95% CI, 1,72-2,88) (Figura 3 e Figura 4A). L’ID di ictus ischemico nella coorte AF (ID, 3,99; 95% CI, 3,23-4,76) è stato significativamente più alto in tutti i livelli di punteggio CHA2DS2-VASc rispetto alla coorte di controllo, mentre l’ID di ictus ischemico nella coorte AFL (ID, 2.83; 95% CI, 2,48-3,18) era solo significativamente più alto con punteggi di CHA2DS2-VASc di 5 a 9 (hazard ratio, 1,29; 95% CI, 1,02-1,62; P==.03) rispetto alla coorte di controllo (Figura 4A). L’ID dell’ictus ischemico era significativamente più alto nella coorte AF che nella coorte AFL in quasi tutti i livelli, tranne che con un punteggio CHA2DS2-VASc di 0 (Figura 4A). Le informazioni dettagliate di confronto dell’ictus ischemico sono fornite nella eTabella 4 del supplemento.
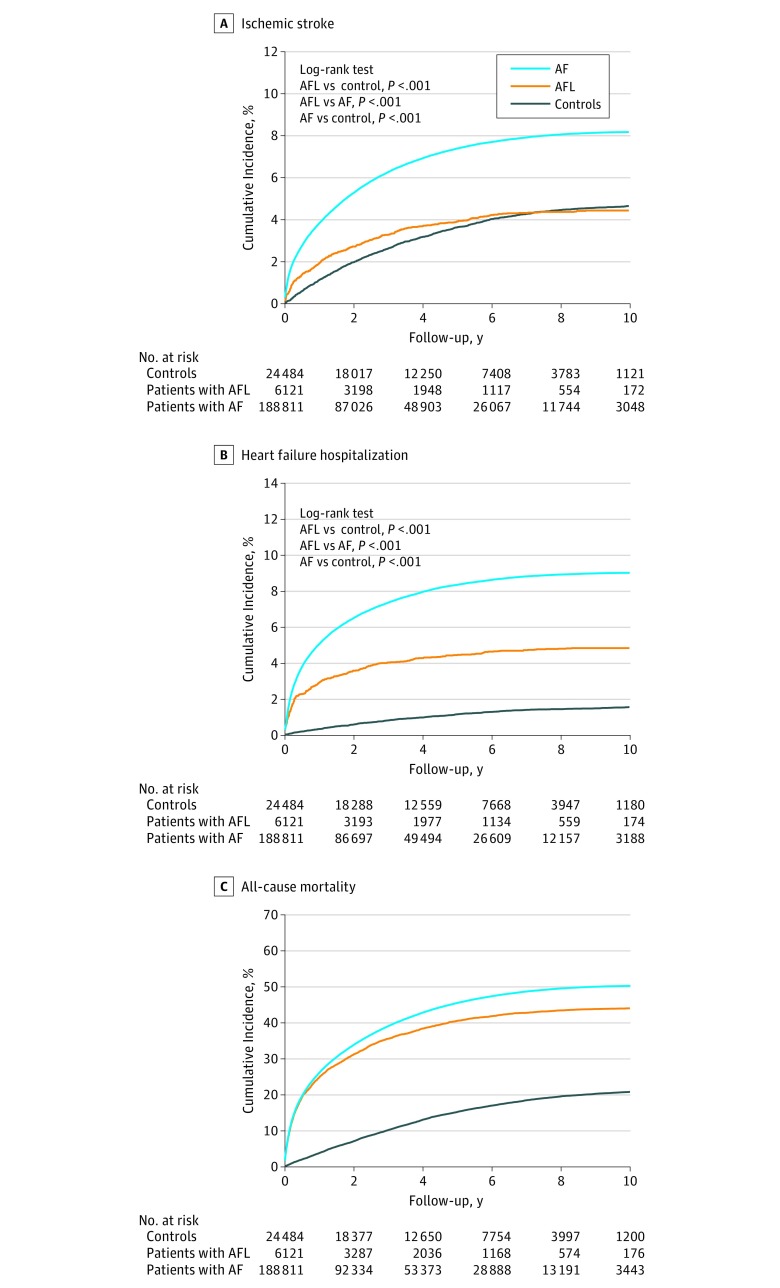
Figura 2.Figura 2. Curve Kaplan-Meier per ictus ischemico, ricovero in ospedale per insufficienza cardiaca e mortalità totale nella fibrillazione atriale (AF), flutter atriale (AFL) e gruppi di controllo accoppiati in condizioni reali
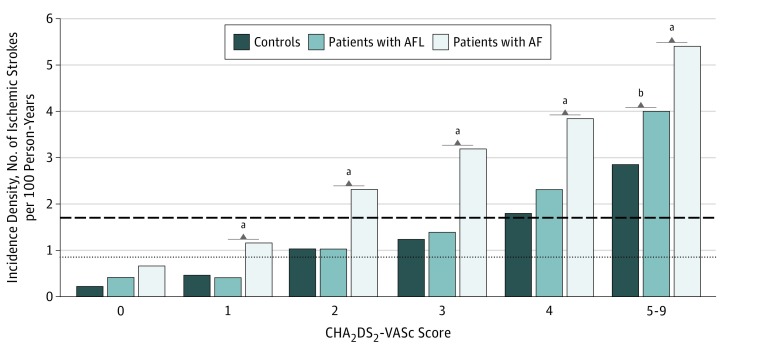
Figura 3.Figura 3. Densità di incidenza dell’ictus ischemico tra la fibrillazione atriale (AF), il flutter atriale (AFL) e le coorti di controllo abbinate con diversi punteggi CHA2DS2-VAScLa linea tratteggiata indica il valore di cutoff dell’incidenza annuale (1,7%) necessario per la prescrizione di farmaci anticoagulanti orali; la linea tratteggiata, il valore di cutoff dell’incidenza annuale (0,9%) necessario per la prescrizione di anticoagulanti orali non-vitaminici K secondo lo studio di Eckman et al.34aP<<.001 per le coorti AF vs AFL.bP<.001 per AFL contro le coorti di controllo abbinate.
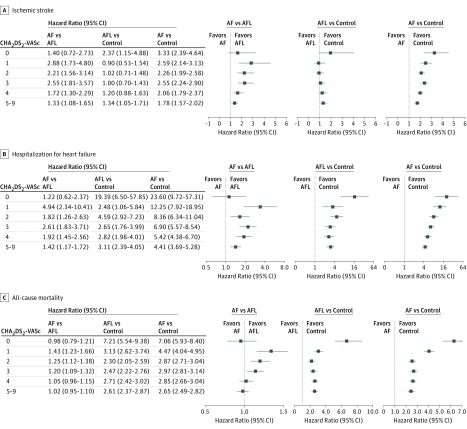
Figura 4.Figura 4. Confronto dei risultati clinici tra i risultati clinici della fibrillazione atriale (FA), del flutter atriale (AFL) e delle coorti di controllo attraverso diversi punteggi CHA2DS2-VAScLe barre di errore indicano il 95% di IC.

Figura 2.Figura 2. Curve Kaplan-Meier per ictus ischemico, ospedalizzazione per insufficienza cardiaca e mortalità totale nella fibrillazione atriale (AF), flutter atriale (AFL) e gruppi di controllo accoppiati in condizioni reali

Figura 3.Figura 3. Densità di incidenza dell’ictus ischemico tra la fibrillazione atriale (AF), il flutter atriale (AFL) e le coorti di controllo abbinate con diversi punteggi CHA2DS2-VAScLa linea tratteggiata indica il valore di cutoff dell’incidenza annuale (1,7%) necessario per la prescrizione di farmaci anticoagulanti orali; la linea tratteggiata, il valore di cutoff dell’incidenza annuale (0,9%) necessario per la prescrizione di anticoagulanti orali non contenenti vitamina K secondo lo studio di Eckman et al.34aP<<.001 per le coorti AF vs AFL.bP<.001 per AFL contro le coorti di controllo abbinate.

Figura 4.Figura 4. Confronto dei risultati clinici tra i risultati clinici della fibrillazione atriale (FA), del flutter atriale (AFL) e delle coorti di controllo attraverso diversi punteggi CHA2DS2-VAScLe barre di errore indicano il 95% di IC.
Ricovero in ospedale per insufficienza cardiaca
Gli ID per il ricovero per insufficienza cardiaca erano 3,39 (95% IC, 3,34-3,44) nella coorte AF, 1,57 (95% CI, 1,39-1,74) nella coorte AFL, e 0,32 (95% CI, 0,29-0,35) nella coorte di controllo, ed erano significativamente diversi l’uno dall’altro (Figura 2B). Quando abbiamo stratificato i gruppi per punteggio CHA2DS2-VASc, gli ID di ospedalizzazione per insufficienza cardiaca sono aumentati con il livello di punteggio CHA2DS2-VASc in tutte e 3 le coorti (Figura 4B). Gli ID di ospedalizzazione per insufficienza cardiaca nelle coorti AF e AFL erano significativamente più alti in tutti i livelli di CHA2DS2-VASc rispetto a quelli della coorte di controllo (Figura 4B). L’ID di ospedalizzazione per insufficienza cardiaca era significativamente più alta nella coorte AF che nella coorte AFL in quasi tutti i livelli, tranne che con un punteggio di CHA2DS2-VASc pari a 0 (Figura 4B). Inoltre, le differenze tra la coorte AFL e AF e tra AFL e coorti di controllo persistevano man mano che il punteggio CHA2DS2-VASc aumentava.
Mortalità per tutte le cause
Gli ID per la mortalità per tutte le cause sono stati 17,8 (95% IC, 17,7-17,9) nella coorte AF, 13,9 (95% CI, 13,4-14,4) nella coorte AFL, e 4,2 (95% CI, 4,1-4,4) nella coorte di controllo, e ci sono state differenze significative tra loro (Figura 2C). Quando abbiamo stratificato i gruppi per punteggio CHA2DS2-VASc, gli ID di tutti i fattori di mortalità sono aumentati con il livello di punteggio CHA2DS2-VASc in tutte e 3 le coorti (Figura 4C). Le ID di mortalità per tutte le cause nelle coorti AF e AFL erano significativamente più alte in tutti i livelli del punteggio di CHA2DS2-VASc rispetto a quelle della coorte di controllo (Figura 4C). L’ID della mortalità per tutte le cause era significativamente più alta nella coorte AF rispetto alla coorte AFL con punteggi di 1, 2 e 3 di CHA2DS2-VASc. Inoltre, la differenza di ID tra la coorte AFL e le coorti di controllo persisteva, mentre la differenza nell’incidenza della mortalità per cause naturali tra le coorti AF e AFL è diminuita con l’aumento del punteggio CHA2DS2-VASc.
Discussione
Questo studio di coorte a livello nazionale ha rilevato che i pazienti con FA e LCA avevano tassi di prevalenza di comorbidità significativamente più elevati rispetto agli individui di controllo abbinati. Inoltre, l’ID dell’ictus ischemico nella coorte AF era significativamente più alto in tutti i livelli del punteggio di CHA2DS2-VASc rispetto a quello dei controlli abbinati, mentre l’ID dell’ictus ischemico nella coorte AFL era solo significativamente più alto con punteggi di CHA2DS2-VASc da 5 a 9 rispetto a quello della coorte di controllo. Inoltre, l’ID di ospedalizzazione per insufficienza cardiaca e mortalità per tutte le cause nella coorte AF e AFL era significativamente più alto in tutti i livelli di punteggio CHA2DS2-VASc rispetto a quelli della coorte di controllo.
Implicazioni cliniche reali della FA, AFL e Coorti di controllo
In questo studio, le coorti AF e AFL hanno avuto tassi di prevalenza di comorbidità significativamente più elevati rispetto alla coorte di controllo, e la coorte AF ha avuto tassi di prevalenza di diverse comorbidità significativamente più elevati rispetto alla coorte AFL. Queste differenze nelle comorbilità tra i 3 gruppi possono aver contribuito ai diversi gradi di miopatia atriale, al rimodellamento endocardico e all’attivazione neuroumorale nelle 3 coorti e, quindi, ai diversi esiti clinici. Il rischio di ictus ischemico tra i pazienti con FA era più vicino a quello tra i controlli abbinati rispetto al rischio tra i pazienti con FA (Figura 2A); questo risultato è coerente con quello dello studio di Biblo et al.11 Inoltre, l’incidenza della mortalità per cause naturali nella coorte AFL era più vicina a quella della coorte AF rispetto a quella della coorte di controllo abbinata (Figura 2C), mentre l’incidenza del ricovero per insufficienza cardiaca nella coorte AFL era tra quella del controllo e quella della coorte AF (Figura 2B). Questi risultati nell’insufficienza cardiaca e nella mortalità di tutte le cause tra le coorti AF, AFL e di controllo sono stati riportati anche nello studio Framingham Heart Study.3
Punteggio CHA2DS2-VASc sui risultati clinici
Il sistema di punteggio CHA2DS2-VASc viene utilizzato per prevedere l’incidenza annuale dell’ictus ischemico,12 la mortalità e l’insufficienza cardiaca14,35 nei pazienti con FA e LCA. Pertanto, abbiamo utilizzato il sistema di punteggio CHA2DS2-VASc per valutare le incidenze di ictus ischemico, ospedalizzazione per insufficienza cardiaca, e tutti i fattori che causano la mortalità nelle coorti AF e AFL. Coerente con gli studi precedenti,35,36 i tassi di incidenza di ictus ischemico, ospedalizzazione per insufficienza cardiaca, e la mortalità di tutte le cause sono aumentati con l’aumento del punteggio di CHA2DS2-VASc nelle coorti AF e AFL. L’incidenza di ictus ischemico nella coorte AFL era superiore a quella della coorte di controllo, ma più vicina a quella della coorte AF con un elevato punteggio di CHA2DS2-VASc. La differenza di ospedalizzazione per insufficienza cardiaca tra le 3 coorti persisteva con l’aumento del punteggio CHA2DS2-VASc. In termini di mortalità per tutte le cause, la differenza tra la coorte AFL e quella di controllo persisteva in tutti i livelli del punteggio CHA2DS2-VASc, mentre la differenza tra la coorte AF e AFL diminuiva con l’aumento del punteggio CHA2DS2-VASc. Pertanto, il punteggio CHA2DS2-VASc ha avuto implicazioni diverse per i risultati clinici tra le 3 coorti. Tuttavia, il sistema di punteggio CHA2DS2-VASc riflette le comorbilità sottostanti, e più comorbilità sono associate a una maggiore mortalità.37 Pertanto, la differenza nell’ictus ischemico, nel ricovero per insufficienza cardiaca e nella mortalità per tutte le cause tra le coorti AF e AFL può diventare meno evidente con l’aumento del punteggio CHA2DS2-VASc (Figura 4).
Implicazioni cliniche nella prevenzione dell’ictus ischemico
Secondo le attuali linee guida7 e una meta-analisi,6 I pazienti con FA devono essere trattati allo stesso modo dei pazienti con FA per prevenire l’ictus ischemico. Tuttavia, gli studi osservazionali nella meta-analisi erano eterogenei nei loro dati e risultati, e il più grande studio11 ha riferito che i pazienti con FA hanno avuto un rischio maggiore di ictus rispetto ai controlli, ma un rischio minore rispetto ai pazienti con FA, che è simile ai nostri risultati. Pertanto, i nostri risultati suggeriscono che l’efficacia e la sicurezza degli anticoagulanti orali per ridurre l’ictus ischemico nei pazienti con FA con il punteggio CHA2DS2-VASc attualmente raccomandato dovrebbe essere rivalutato. Secondo le linee guida della Società Europea di Cardiologia del 2016 per la prevenzione dell’ictus ischemico nei pazienti con FA e FA, la terapia anticoagulante dovrebbe essere prescritta per i pazienti con un punteggio CHA2DS2-VASc pari o superiore a 2, e gli anticoagulanti orali senza vitamina K dovrebbero essere considerati per i pazienti con un punteggio CHA2DS2-VASc pari o superiore a 1 a causa dei benefici clinici netti.7,38,39 Nello studio attuale, l’ID dell’ictus ischemico con un punteggio CHA2DS2-VASc di 1 nella coorte AF era simile a quello con un punteggio CHA2DS2-VASc di 2 nella coorte AFL, e l’ID dell’ictus ischemico con un punteggio CHA2DS2-VASc di 2 nella coorte AF era simile a quello con un punteggio CHA2DS2-VASc di 4 nella coorte AFL (Figura 3 e Figura 4A). Inoltre, 2 studi34,39 si raccomanda di prescrivere una terapia anticoagulante ai pazienti con FA con un’incidenza annua di ictus ischemico pari o superiore all’1,7%. Sulla base di diversi studi clinici, uno di questi studi34 ha raccomandato di prendere in considerazione gli anticoagulanti orali non contenenti vitamina K per via orale quando l’incidenza annuale dell’ictus è pari o superiore allo 0,9%. Analogamente, i nostri risultati indicano che ai pazienti con FAL possono essere prescritti anticoagulanti quando il punteggio di CHA2DS2-VASc è 4 o superiore (con un ID del 2,3%) e anticoagulanti orali non-vitaminici K quando il punteggio di CHA2DS2-VASc è 2 o superiore (con un ID dell’1,0%) (Figura 3). Tuttavia, da un punto di vista della significatività statistica, le incidenze di ictus ischemico nella coorte AF attraverso tutti i livelli di CHA2DS2-VASc e nella coorte AFL con un punteggio di CHA2DS2-VASc da 5 a 9 erano significativamente superiori rispetto alla coorte di controllo. Pertanto, gli anticoagulanti orali devono essere considerati per i pazienti con FA e i pazienti con FA quando il punteggio di CHA2DS2-VASc è 5 o superiore (Figura 4A).
Limitazioni
Ci sono diversi limiti a questo studio retrospettivo della banca dati di coorte. In primo luogo, l’AF non è stata sottoclassificata in AF parossistica, persistente e cronica, e l’AFL non è stata sottoclassificata in AFL tipica e atipica nel NHIRD. Sebbene diversi tipi di AF e AFL possano avere esiti clinici diversi, non sono stati riportati gli esiti clinici di diversi tipi di AF o AFL secondo il punteggio CHA2DS2-VASc.
In secondo luogo, sebbene l’accuratezza delle diagnosi di FA e AFL e i risultati clinici basati su un database assicurativo possano non essere gli stessi di quelli derivanti dall’esame delle cartelle cliniche e dei dati degli esami rilevanti, il nostro studio precedente30 e altri29,32 ha trovato un elevato valore predittivo positivo e un’accuratezza delle banche dati assicurative, e le grandi dimensioni della banca dati in questo studio dovrebbero essere sufficienti per raggiungere una conclusione statistica accurata.31,40
In terzo luogo, nel nostro studio possono essere possibili distorsioni di selezione nella selezione di pazienti a rischio relativamente basso di ictus ischemico a causa dell’esclusione di qualsiasi terapia anticoagulante durante il periodo di osservazione. Tuttavia, nell’analisi dei sottogruppi per i pazienti esclusi che hanno ricevuto una terapia anticoagulante durante il periodo di osservazione (n = 46.000), l’ID annuale dell’ictus ischemico era più alto nella coorte AF (ID, 6.16; 95% CI, 6.04-6.29) che nella coorte AFL (ID, 2.).65; 95% IC, 2.00-3.31) (eTabella 5 nel Supplemento), e non sono state riscontrate differenze significative nelle caratteristiche di base tra i pazienti con FA e i pazienti con AFL a cui sono stati prescritti anticoagulanti dopo un evento di ictus ischemico dopo la data dell’indice (eTabella 6 nel Supplemento). Pertanto, l’esclusione dei pazienti che ricevono una terapia anticoagulante durante il nostro periodo di osservazione dovrebbe avere scarso effetto sui nostri risultati. Inoltre, anche se alcune evidenze non hanno indicato differenze significative tra il controllo del ritmo e il controllo del ritmo (focus dei farmaci antiaritmici) nei pazienti con FA e LCA,41,42 non siamo riusciti a concludere completamente che qualsiasi farmaco antiaritmico non ha avuto alcuna influenza sui risultati dello studio. Pertanto, abbiamo eseguito un’analisi di sensibilità dopo aver escluso coloro che assumevano un farmaco antiaritmico (eTable 7 nel supplemento), e i risultati indicano che i modelli di ictus ischemico, ospedalizzazione per insufficienza cardiaca, e la mortalità di tutte le cause di mortalità tra le coorti di controllo AFL, AFL, e abbinato erano gli stessi della nostra analisi principale. L’ablazione con catetere produce un alto tasso di successo per la conversione del seno nei pazienti affetti da AFL,43 mentre non ha un tasso di successo comparabile nei pazienti con FA.44 Sebbene rare evidenze supportino una correlazione tra l’ablazione tra l’ablazione del catetere e i risultati clinici nei pazienti con FA, nei nostri studi abbiamo escluso tali pazienti per ridurre al minimo i possibili pregiudizi. La cardioversione elettrica è un altro problema per la conversione del seno; tuttavia, una meta-analisi45 ha concluso che la cardioversione elettrica non ha influenzato l’incidenza dell’ictus. Inoltre, non è stato possibile valutare la presentazione clinica durante la cardioversione elettrica e il tasso di successo della cardioversione elettrica e non è possibile definire chiaramente se la cardioversione elettrica è stata eseguita per la FA o la FA nello studio del database. Pertanto, non abbiamo incluso la cardioversione elettrica nel nostro studio.
In quarto luogo, il nostro studio non ha esaminato se l’anticoagulazione non debba essere utilizzata in pazienti con FAL e con un punteggio CHA2DS2-VASc pari o superiore a 4 per prevenire l’ictus ischemico. Non erano disponibili dati relativi alla differenza di ictus ischemico tra pazienti con FAL con e senza terapia anticoagulante con un punteggio CHA2DS2-VASc pari o inferiore a 4 e sono necessari ulteriori studi per chiarire questo punto. Quinto, sebbene non sia stato possibile escludere completamente gli eventi di FA nella coorte AFL sulla base dei codici ICD-9-CM, abbiamo comunque trovato differenze significative nell’identificazione dell’ictus ischemico, del ricovero per insufficienza cardiaca e di tutte le cause di mortalità tra le 3 coorti. In sesto luogo, il nostro studio ha iscritto solo i partecipanti taiwanesi, e non sappiamo se il nostro risultato possa essere estrapolato alle popolazioni non asiatiche; pertanto, è necessario condurre ulteriori studi. Settimo, gli studi osservazionali non randomizzati sono soggetti a confusione residua o a confusione non misurata; tuttavia, la nostra analisi di falsificazione non ha rivelato alcuna forte evidenza di confusione residua nel confronto tra i gruppi AF e AFL (eTable 8 nel supplemento).
Conclusioni
Questo ampio studio di coorte a livello nazionale ha dimostrato risultati clinici diversi nei pazienti con e senza AFL e AFL rispetto a quelli senza AFL. Gli ID di ictus ischemico nella coorte della FA erano significativamente più alti in tutti i livelli del punteggio CHA2DS2-VASc rispetto alla coorte di controllo corrispondente, mentre gli ID di ictus ischemico nella coorte AFL erano solo significativamente più alti con punteggi CHA2DS2-VASc da 5 a 9 rispetto a quelli della coorte di controllo. Inoltre, gli ID di ospedalizzazione per l’insufficienza cardiaca e la mortalità per tutte le cause nella coorte AF e AFL erano significativamente più alti in tutti i livelli del punteggio CHA2DS2-VASc rispetto a quelli dei controlli. Il nostro studio suggerisce di effettuare ulteriori ricerche per rivalutare il beneficio clinico netto degli anticoagulanti orali per prevenire l’ictus ischemico nei pazienti con FA secondo il livello attualmente raccomandato del punteggio CHA2DS2-VASc.
References
- Absolute and attributable risks of atrial fibrillation in relation to optimal and borderline risk factors: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 2011; 123(14)DOI | PubMed
- Worldwide epidemiology of atrial fibrillation: a Global Burden of Disease 2010 Study. Circulation. 2014; 129(8):837-847. DOI | PubMed
- Atrial flutter: clinical risk factors and adverse outcomes in the Framingham Heart Study. Heart Rhythm. 2016; 13(1):233-240. DOI | PubMed
- Incidence and predictors of atrial flutter in the general population. J Am Coll Cardiol. 2000; 36(7):2242-2246. DOI | PubMed
- Increasing prevalence of atrial fibrillation and flutter in the United States. Am J Cardiol. 2009; 104(11):1534-1539. DOI | PubMed
- Atrial flutter and thromboembolic risk: a systematic review. Heart. 2015; 101(18):1446-1455. DOI | PubMed
- 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016; 37(38):2893-2962. DOI | PubMed
- Diabetes mellitus is a strong, independent risk for atrial fibrillation and flutter in addition to other cardiovascular disease. Int J Cardiol. 2005; 105(3):315-318. DOI | PubMed
- Risk factors and genetics of atrial fibrillation. Heart Fail Clin. 2016; 12(2):157-166. DOI | PubMed
- A population-based study of mortality among patients with atrial fibrillation or flutter. Am J Med. 2002; 113(5):365-370. DOI | PubMed
- Risk of stroke in patients with atrial flutter. Am J Cardiol. 2001; 87(3):346-349, A9. DOI | PubMed
- Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on Atrial Fibrillation. Chest. 2010; 137(2):263-272. DOI | PubMed
- CHA2DS2-VASc scores predict mortality after hospitalization for atrial fibrillation. Int J Cardiol. 2015; 185:293-296. DOI | PubMed
- CHADS2 and CHA2DS2-VASc risk factors to predict first cardiovascular hospitalization among atrial fibrillation/atrial flutter patients. Am J Cardiol. 2012; 109(10):1526-1533. DOI | PubMed
- 2015 ACC/AHA/HRS guideline for the management of adult patients with supraventricular tachycardia: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2016; 133(14):e471-e505. DOI | PubMed
- Mother rotors and fibrillatory conduction: a mechanism of atrial fibrillation. Cardiovasc Res. 2002; 54(2):204-216. DOI | PubMed
- An overview of the healthcare system in Taiwan. London J Prim Care (Abingdon). 2010; 3(2):115-119. DOI | PubMed
- Utilizing health information technology to support universal healthcare delivery: experience of a national healthcare system. Telemed J E Health. 2015; 21(9):742-747. DOI | PubMed
- Using the CHA2DS2-VASc score for refining stroke risk stratification in ‘low-risk’ Asian patients with atrial fibrillation. J Am Coll Cardiol. 2014; 64(16):1658-1665. DOI | PubMed
- Age threshold for increased stroke risk among patients with atrial fibrillation: a nationwide cohort study from Taiwan. J Am Coll Cardiol. 2015; 66(12):1339-1347. DOI | PubMed
- Use of antithrombotics in atrial fibrillation in Africa, Europe, Asia and South America: insights from the International RealiseAF Survey. Arch Cardiovasc Dis. 2014; 107(2):77-87. DOI | PubMed
- Get With the Guidelines-Stroke performance indicators: surveillance of stroke care in the Taiwan Stroke Registry: Get With the Guidelines-Stroke in Taiwan. Circulation. 2010; 122(11):1116-1123. DOI | PubMed
- Publisher Full Text
- Association between nucleoside analogues and risk of hepatitis B virus–related hepatocellular carcinoma recurrence following liver resection. JAMA. 2012; 308(18):1906-1914. DOI | PubMed
- Validation of a modified CHA2DS2-VASc score for stroke risk stratification in Asian patients with atrial fibrillation: a nationwide cohort study. Stroke. 2016; 47(10):2462-2469. DOI | PubMed
- Comparisons of CHADS2 and CHA2DS2-VASc scores for stroke risk stratification in atrial fibrillation: which scoring system should be used for Asians?. Heart Rhythm. 2016; 13(1):46-53. DOI | PubMed
- CHA2DS2-VASc score (congestive heart failure, hypertension, age ≥75 [doubled], diabetes mellitus, prior stroke or transient ischemic attack [doubled], vascular disease, age 65-74, female) for stroke in Asian patients with atrial fibrillation: a Korean nationwide sample cohort study. Stroke. 2017; 48(11):2984-2990. DOI | PubMed
- Comparison between CHADS2 and CHA2DS2-VASc score for risk stratification of ischemic stroke in Japanese patients with non-valvular paroxysmal atrial fibrillation not receiving anticoagulant therapy. Int Heart J. 2014; 55(2):119-125. DOI | PubMed
- Continuation of statin therapy and a decreased risk of atrial fibrillation/flutter in patients with and without chronic kidney disease. Atherosclerosis. 2014; 232(1):224-230. DOI | PubMed
- Different implications of heart failure, ischemic stroke, and mortality between nonvalvular atrial fibrillation and atrial flutter: a view from a national cohort study. J Am Heart Assoc. 2017; 6(7):e006406. DOI | PubMed
- Concordance between patient self-reports and claims data on clinical diagnoses, medication use, and health system utilization in Taiwan. PLoS One. 2014; 9(12):e112257. DOI | PubMed
- Validation of algorithms to identify stroke risk factors in patients with acute ischemic stroke, transient ischemic attack, or intracerebral hemorrhage in an administrative claims database. Int J Cardiol. 2016; 215:277-282. DOI | PubMed
- Falsification end points for observational studies. JAMA. 2013; 309(17):1769-1770. DOI | PubMed
- Moving the tipping point: the decision to anticoagulate patients with atrial fibrillation. Circ Cardiovasc Qual Outcomes. 2011; 4(1):14-21. DOI | PubMed
- Predictors for stroke and death in non-anticoagulated Asian patients with atrial fibrillation: the Fushimi AF Registry. PLoS One. 2015; 10(11):e0142394. DOI | PubMed
- The predictive ability of the CHADS2 and CHA2DS2-VASc scores for bleeding risk in atrial fibrillation: the MAQI(2) experience. Thromb Res. 2014; 134(2):294-299. DOI | PubMed
- Socioeconomic status and the 25×25 risk factors as determinants of premature mortality: a multicohort study and meta-analysis of 1.7 million men and women. Lancet. 2017; 389(10075):1229-1237. DOI | PubMed
- Net clinical benefit of new oral anticoagulants (dabigatran, rivaroxaban, apixaban) versus no treatment in a “real world” atrial fibrillation population: a modelling analysis based on a nationwide cohort study. Thromb Haemost. 2012; 107(3):584-589. DOI | PubMed
- Current trial-associated outcomes with warfarin in prevention of stroke in patients with nonvalvular atrial fibrillation: a meta-analysis. Arch Intern Med. 2012; 172(8):623-631. DOI | PubMed
- Validation of the National Health Insurance Research Database with ischemic stroke cases in Taiwan. Pharmacoepidemiol Drug Saf. 2011; 20(3):236-242. DOI | PubMed
- Rate- and rhythm-control therapies in patients with atrial fibrillation: a systematic review. Ann Intern Med. 2014; 160(11):760-773. DOI | PubMed
- Optimal treatment strategy for patients with paroxysmal atrial fibrillation: J-RHYTHM Study. Circ J. 2009; 73(2):242-248. DOI | PubMed
- Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. Am J Cardiol. 2009; 104(5):671-677. DOI | PubMed
- Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol. 2009; 2(4):349-361. DOI | PubMed
- Electrical cardioversion for atrial fibrillation and flutter.. Cochrane Database Syst Rev. 2017; 11:CD002903. PubMed
Fonte
Lin Y, Chen Y, Chen T, Lin M, Liu C, et al. (2018) Comparison of Clinical Outcomes Among Patients With Atrial Fibrillation or Atrial Flutter Stratified by CHA. JAMA Network Open 1(4): e180941. https://doi.org/10.1001/jamanetworkopen.2018.0941





