Introduzione
Il fenomeno del placebo si riferisce al miglioramento dei sintomi del paziente quando riceve un agente inerte o una procedura. I placebo sono stati associati non solo al comfort del paziente ma anche alle risposte benefiche (effetto placebo) almeno dal XVIII secolo.1,2 Ci sono diverse spiegazioni su questo fenomeno, tra cui i percorsi neurobiologici, il rapporto medico-paziente e il contesto psicosociale del paziente.3
Gli eventi avversi (AE) derivanti dalla somministrazione di placebo sono chiamati effetti nocebo.4,5,6 Queste AA sono state studiate principalmente in analgesia, dermatologia, psichiatria (depressione) e neurologia.7,8,9,10 In oncologia, ci sono diversi studi sull’effetto placebo associato alla risposta obiettiva e al miglioramento delle condizioni cliniche, ma ce ne sono solo alcuni sugli AA con placebo.11,12,13
Anche se gli studi hanno rilevato che circa il 25% dei pazienti randomizzati ha riferito di AA con placebo che potrebbero essere abbastanza gravi da portare all’interruzione dello studio, è stato riconosciuto che tre quarti degli operatori sanitari e dei pazienti non erano a conoscenza dell’esistenza di AA con placebo.6,14,15,16 Il tipo e l’incidenza degli AA sembrano essere simili in entrambi i gruppi (trattamento e placebo) tra i diversi studi clinici randomizzati (RCT). Queste somiglianze possono essere attribuibili alla comunicazione di potenziali AA nel consenso informato.6,17,18
Anche se ci si aspetta che i pazienti segnalino per lo più AA di basso grado dopo trattamenti chirurgici o radioterapia, in letteratura sono descritti sintomi che compromettono i sintomi come la stanchezza da moderata a grave.19,20 Questi fattori, così come i sintomi correlati alla recidiva, possono anche contribuire agli effetti tossici analizzati durante le prove in ambiente adiuvante.
Lo scopo di questo studio è stato quello di determinare l’incidenza di placebo AE riportati negli RCT dei moderni farmaci antitumorali. Solo gli studi che includevano pazienti in ambiente adiuvante sono stati considerati in grado di escludere le AA causate da una malattia non trattata o persistente.
Metodi
Strategia di ricerca della letteratura
Questa ricerca di meta-analisi ha seguito la linea guida PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses).21 La ricerca sistematica della letteratura è stata effettuata il 15 aprile 2018, utilizzando pubblicazioni disponibili su MEDLINE (PubMed). La ricerca finale è stata limitata agli studi clinici e alle pubblicazioni in lingua inglese dal 1° gennaio 2000 alla data della ricerca. I seguenti termini di ricerca sono stati utilizzati per recuperare tutti gli studi dalla biblioteca PubMed: coadiuvante, mantenimento, consolidamento e placebo, oltre a parole chiave specifiche relative al tipo di cancro. La strategia di ricerca è descritta in dettaglio nei metodi eMethods del supplemento.
Per l’inclusione era obbligatoria una progettazione in doppio cieco, randomizzata, controllata con placebo, fase 3. Nel gruppo di controllo non erano ammessi altri trattamenti antitumorali oltre al placebo. Sono stati inclusi solo studi che prevedevano una terapia mirata (tirosina chinasi, BRAF o inibitori MEK) o farmaci correlati all’immunoterapia (agenti che potenziano direttamente l’attività immunitaria antitumorale) nel setting adiuvante. Sono stati esclusi gli studi che utilizzano la chemioterapia, la terapia endocrina o l’interferone, perché questi farmaci sono associati a incidenze e tipi di EA notevolmente diversi, che potrebbero alterare l’interpretazione dei risultati. Inoltre, sono stati rari gli studi che hanno randomizzato i pazienti alla chemioterapia o alla terapia ormonale rispetto al placebo nel setting adiuvante. Sono stati esclusi anche studi che includevano pazienti con qualsiasi evidenza di malattia o pazienti arruolati prima del 2000, così come studi senza reclutamento completo o con punti finali primari non associati all’efficacia del trattamento del cancro (ad esempio, ricerche di farmacocinetica, biomarcatori o fattori predittivi). Considerando i criteri eterogenei per determinare quest’ultima affermazione tra gli studi in un contesto adiuvante, sono stati inclusi solo gli studi che includevano pazienti sottoposti a resezioni macroscopicamente complete. Infine, sono stati esclusi gli studi con informazioni essenziali non disponibili, come il tasso di AE di grado 3 a 4.
Selezione dello studio ed estrazione dei dati
Le prove sono state inizialmente selezionate considerando i titoli e gli abstract. Due ricercatori hanno esaminato gli abstract per l’inclusione (D.H.E. e F.D.W.). I criteri di ammissibilità sono stati applicati agli articoli a testo integrale durante la selezione finale. L’elenco risultante degli articoli inclusi è stato discusso da tutti gli investigatori per garantire l’accuratezza della decisione finale. È stata analizzata la ridondanza dovuta ai dati riportati su gruppi di pazienti identici in diverse pubblicazioni e sono state eliminate le duplicazioni. I dati del testo completo e dell’appendice sono stati estratti e le informazioni critiche di ogni articolo sono state registrate su moduli predefiniti. Il numero totale di pazienti nell’analisi di sicurezza è stato raccolto dagli articoli inclusi. Sono stati registrati il disegno dello studio, i tipi e gli stadi del cancro, la versione dei Common Terminology Criteria for Adverse Events (CTCAE), la durata prevista del trattamento, la via di somministrazione e il tempo che intercorre tra la resezione chirurgica e la randomizzazione. Sono stati effettuati confronti tra il gruppo di trattamento (terapia attiva) e il gruppo placebo per gli EA di grado da 1 a 5, l’interruzione del trattamento, la riduzione della dose, l’interruzione del trattamento e la durata dell’esposizione al trattamento.
Analisi statistica
Le frequenze e le analisi descrittive sono state eseguite per ogni variabile utilizzando SPSS (IBM), versione 23.0. La meta-analisi è stata effettuata con un modello ad effetti casuali condotto nel pacchetto Meta di R Studio Software, versione 1.1.456 (RStudio). L’eterogeneità tra gli studi è stata valutata dalle statistiche I2. I risultati sono stati riportati sotto forma di parcelle forestali che mostrano la proporzione di AA di grado 3-4 placebo negli studi inclusi con il 95% di IC. La frequenza delle AA di grado 3-4 quando si confronta il gruppo di trattamento con il gruppo placebo è stata analizzata dal coefficiente di correlazione del rango di Spearman. Lo strumento Cochrane Collaboration risk of bias è stato utilizzato in modo indipendente da 2 ricercatori (M.R.C. e J.B.).22 I disaccordi sono stati risolti per consenso. Il rischio di riassunto dei pregiudizi è stato effettuato utilizzando RevMan (Cochrane Collaboration), versione 5.1. Il bias di pubblicazione è stato valutato utilizzando i test Egger con un grafico ad imbuto.23
Risultati
Risultati della ricerca
Utilizzando la strategia di ricerca definita, sono state ottenute un totale di 731 pubblicazioni. Il flusso di ricerca è descritto in dettaglio nella Figura 1. Dopo la rimozione delle duplicazioni, sono stati vagliati tutti i titoli e gli abstract degli studi risultanti. È stata condotta un’analisi del testo completo per i 26 articoli risultanti, che ha portato a 10 prove incluse per la meta-analisi. Due studi sono stati esclusi dallo studio perché non erano disponibili informazioni relative alle AA di grado 3-4.24,25
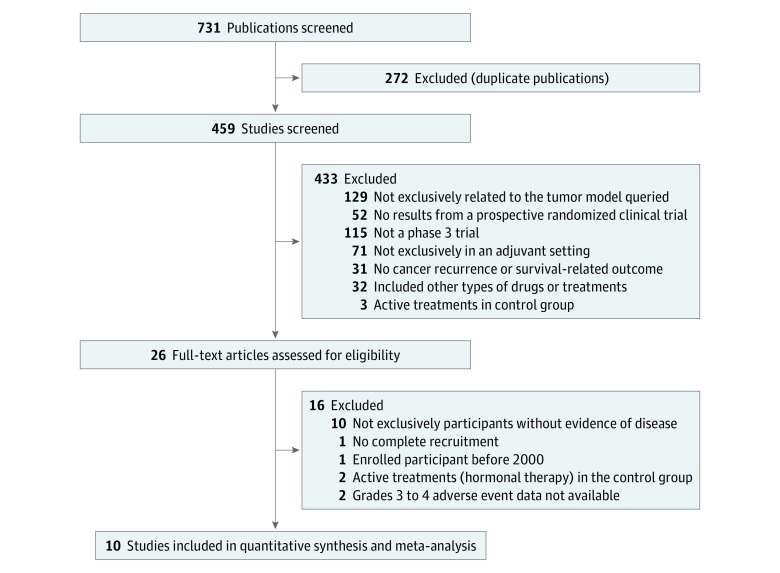
Figura 1.Studio di selezione del processo di selezione degli studi clinici randomizzati dei moderni farmaci antitumorali

Figura 1.Studio di selezione del processo di selezione degli studi clinici randomizzati dei moderni farmaci antitumorali
Studi inclusi
Un totale di 10 RCT sono stati presi in considerazione per questa revisione che comprendeva 4 tipi di tumore: melanoma, 4 RCT; tumore polmonare non a piccole cellule, 1 RCT; tumore stromale gastrointestinale, 1 RCT; e carcinoma a cellule renali, 4 RCT. Gli studi selezionati hanno coinvolto un totale di 11-143 pazienti, di cui 6270 (56,3%) nei gruppi di trattamento (età media [SD], 55,6 [4,2] anni) e 4873 (43,7%) nei gruppi placebo (età media [SD], 55,9 [4,3] anni) (eTabella 1 nel supplemento).
Nei gruppi placebo, il 64% dei partecipanti erano uomini e il 36% donne, mentre la maggior parte dei pazienti era bianca (89,8%). La maggior parte dei pazienti dello studio aveva un performance status del gruppo di oncologia cooperativa orientale di 0 (76,9%), con una distribuzione del 22,3% con un performance status di 1 e dell’1,4% con un performance status di 2. Un riassunto dei dati estratti dagli studi selezionati,26-35 compreso il percorso di somministrazione del placebo, è riportato nella Tabella 1. Ulteriori informazioni sono disponibili nella eTabella 2 del Supplemento.
| Studio | Tipo di cancro | Gruppo di trattamento Farmaco | Via di somministrazione | Stadio del cancro | Versione CTCAE |
|---|---|---|---|---|---|
| Eggermont et al,26 2015 | Melanoma | Ipilimumab | Parenterale | III | 3.0 |
| Long et al,27 2017 | Melanoma | Dabrafenib e trametinib | Orale | III | 4.0 |
| Maio et al,28 2018 | Melanoma | Vemurafenib | Orale | IIC-IIIC | 4.0 |
| Eggermont et al,29 2018 | Melanoma | Pembrolizumab | Parenterale | III | 4.0 |
| Vansteenkiste et al,30 2016 | Cancro polmonare non a piccole cellule | MAGE-A3 | Parenterale | IB, II, IIIA | 3.0 |
| DeMatteo et al,31 2009 | Tumore stromale gastrointestinale | Imatinib | Orale | T≥3 cm | 3.0 |
| Haas et al,32 2016 | Carcinoma a cellule renali | Gruppo di trattamento 1: sunitinib; gruppo di trattamento 2: sorafenib | Orale | I-III | 3.0 |
| Motzer et al,33 2017 | Carcinoma a cellule renali | Pazopanib | Orale | II (alto grado)-IV (M0) | 4.0 |
| Chamie et al,34 2017 | Carcinoma a cellule renali | Girentuximab | Parenterale | I-II (alto grado), III-IV (M0) | NR |
| Ravaud et al,35 2016 | Carcinoma a cellule renali | Sunitinib | Orale | III-IV (M0) | 3.0 |
Risultati dello studio
Le caratteristiche degli studi selezionati che confrontano i gruppi di trattamento con i gruppi di placebo sono dettagliate nella Tabella 2. L’incidenza media dei gruppi di trattamento con placebo di qualsiasi grado è stata dell’85,1% (95% CI, 79,2%-91,0%). La frequenza di AA di grado da 3 a 4 nei gruppi di trattamento rispetto ai gruppi placebo tra tutti gli studi è mostrata in eFigure 1 nel Supplemento. I più frequenti (media [SD]) di grado 3 a 4 di placebo sono stati l’ipertensione (2,8% [2,2%]), la stanchezza 1,0% [0,9%] e la diarrea (0,8% [0,6%]) (Tabella 3).
| Studio | Numero di pazientia | Studio Mediano Durata del farmaco di studio, mo | Pazienti che hanno interrotto lo studio del farmaco, n. (%) | Pazienti con eventi avversi, n. (%) | Eventi avversi di grado 5, n.b | ||
|---|---|---|---|---|---|---|---|
| Eventi avversi | Ricorrenza della malattia | Qualsiasi grado | Grado 3-4 | ||||
| Eggermont et al,26 2015 | |||||||
| Gruppo di trattamento | 471 | 3 | 245 (52) | 132 (28) | 465 (99) | 254 (54) | 5 |
| Gruppo placebo | 474 | 15 | 20 (4) | 273 (58) | 431 (91) | 118 (25) | 0 |
| Long et al,27 2017 | |||||||
| Gruppo di trattamento | 435 | 11 | 114 (26) | 23 (5) | 422 (97) | 180 (41) | 1c |
| Gruppo placebo | 432 | 10 | 12 (3) | 175 (41) | 380 (88) | 61 (14) | 0 |
| Maio et al,28 2018 | |||||||
| Gruppo di trattamento | 247 | 12 | 49 (20) | 26 (10) | 245 (99) | 141 (57) | 0 |
| Gruppo placebo | 247 | 12 | 5 (2) | 87 (35) | 219 (89) | 37 (15) | 0 |
| Eggermont et al,29 2018 | |||||||
| Gruppo di trattamento | 509 | 12 | 70 (14) | 109 (21) | 475 (93) | 161 (32) | 1 |
| Gruppo placebo | 502 | 12 | 11 (2) | 179 (36) | 453 (90) | 93 (19) | 0 |
| Vansteenkiste et al,30 2016d | |||||||
| Gruppo di trattamento | 1515 | NR | 120 (8) | 555 (37) | 1369 (90) | 233 (15) | 0 |
| Gruppo placebo | 757 | NR | 54 (7) | 271 (36) | 556 (73) | 114 (15) | 0 |
| DeMatteo et al,31 2009 | |||||||
| Gruppo di trattamento | 337 | NR | 57 (17) | 1 (0.3) | 333 (99) | 104 (31) | 0 |
| Gruppo placebo | 345 | NR | 11 (3) | 41 (12) | 314 (91) | 63 (18) | 0 |
| Haas et al,32 2016 | |||||||
| Gruppo di trattamento 1e | 625 | 11 | 124 (20) | 52 (8) | NR | 394 (63) | 3 |
| Gruppo di trattamento 2f | 628 | 11 | 128 (20) | 54 (8) | NR | 450 (72) | 1 |
| Gruppo placebo | 626 | 12 | 33 (5) | 102 (16) | NR | 159 (25) | 0 |
| Motzer et al,33 2017 | |||||||
| Gruppo di trattamento | 766 | 10.5 | 278 (36) | 47 (6) | 755 (99) | 469 (61) | 1 |
| Gruppo placebo | 762 | NR | 40 (5) | 148 (19) | 675 (89) | 161 (21) | 0 |
| Chamie et al,34 2017 | |||||||
| Gruppo di trattamento | 431 | 5.2 | 7 (2) | 29 (7) | 288 (67) | 51 (12) | 0 |
| Gruppo placebo | 424 | 5.1 | 4 (1) | 30 (7) | 281 (66) | 45 (11) | 0 |
| Ravaud et al,35 2016 | |||||||
| Gruppo di trattamento | 306 | 12.4 | 86 (28) | 22 (7) | 305 (100) | 185 (61) | 0 |
| Gruppo placebo | 304 | 12.4 | 17 (6) | 59 (19) | 269 (89) | 59 (19) | 0 |
| Studio | Totale pazienti, n. | Eventi avversi dovuti a sintomi, n. di pazienti (%) | Eventi avversi non sintomatici, numero di pazienti (%) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Fatica | Nausea | Diarrea | Vomitare | Dolore addominale | Pyrexia | Rash | Sindrome del piede a mano | ALT Aumentato | AST aumentato | Ipertensione | |||
| Studi sul melanoma | |||||||||||||
| Eggermont et al,26 2015 | |||||||||||||
| Gruppo di trattamento | 471 | 10 (2.1) | 1 (0.2) | 46 (10) | 2 (0.4) | 2 (0.4) | 5 (1) | 6 (1) | NR | 25 (5) | 20 (4.2) | NR | |
| Gruppo placebo | 474 | 7 (1.4) | 0 | 9 (2) | 1 (0.2) | 1 (0.2) | 1 (0.2) | 0 | NR | 0 | 0 | NR | |
| Long et al,27 2017 | |||||||||||||
| Gruppo di trattamento | 435 | 19 (4) | 4 (1) | 4 (1) | 4 (1) | NR | 23 (5) | 0 | NR | 16 (4) | 16 (4) | 25 (6) | |
| Gruppo placebo | 432 | 1 (0.2) | 0 | 1 (0.2) | 0 | NR | 2 (0.5) | 1 (0.2) | NR | 1 (0.2) | 1 (0.2) | 8 (2) | |
| Maio et al,28 2018 | |||||||||||||
| Gruppo di trattamento | 247 | 7 (3) | 1 (0.4) | 5 (2) | 0 | 1 (0.4) | 0 | 14 (5.4) | NR | 14 (5.4) | 8 (3) | 6 (2) | |
| Gruppo placebo | 247 | 1 (0.4) | 0 | 2 (1) | 0 | 0 | 0 | 3 (1) | NR | 1 (0.4) | 1 (0.4) | 2 (1) | |
| Eggermont et al,29 2018 | |||||||||||||
| Gruppo di trattamento | 509 | 4 (0.8) | 0 | 4 (0.8) | NR | NR | NR | 1 (0.2) | NR | NR | NR | NR | |
| Gruppo placebo | 502 | 2 (0.4) | 0 | 3 (0.6) | NR | NR | NR | 0 | NR | NR | NR | NR | |
| Studio sul cancro ai polmoni non a piccole cellule | |||||||||||||
| Vansteenkiste et al,30 2016 | |||||||||||||
| Gruppo di trattamento | 1515 | 7 (0.5) | NR | NR | NR | NR | 3 (0.2) | NR | NR | NR | NR | NR | |
| Gruppo placebo | 757 | 1 (0.1) | NR | NR | NR | NR | 0 | NR | NR | NR | NR | NR | |
| Studio del tumore gastrointestinale stromale | |||||||||||||
| DeMatteo et al,31 2009 | |||||||||||||
| Gruppo di trattamento | 337 | 7 (1.6) | 8 (2) | 10 (2) | 8 (2) | 12 (3) | NR | NR | NR | 9 (2.6) | 0 | NR | |
| Gruppo placebo | 345 | 4 (1) | 4 (1) | 5 (1) | 2 (0.6) | 6 (1) | NR | NR | NR | 7 (1.9) | 0 | NR | |
| Studi sul carcinoma delle cellule renalib | |||||||||||||
| Haas et al,32 2016 | |||||||||||||
| Gruppo di trattamento 1c | 625 | 110 (18) | 23 (4) | 62 (10) | 14 (2) | NR | NR | 15 (2) | 94 (15) | NR | NR | 105 (17.2) | |
| Gruppo di trattamento 2d | 628 | 44 (7) | 8 (1) | 58 (9) | 7 (1) | NR | NR | 95 (15.3) | 208 (33) | NR | NR | 102 (16) | |
| Gruppo placebo | 626 | 19 (3) | 1 (0.2) | 3 (0.5) | 2 (0.3) | NR | NR | 3 (0.5) | 7 (1) | NR | NR | 26 (4) | |
| Motzer et al,33 2017 | |||||||||||||
| Gruppo di trattamento | 766 | 17 (2.2) | 4 (0.5) | 52 (6.8) | 3 (0.4) | 8 (1.1) | NR | 1 (0.1) | 19 (2.5) | 120 (15.7) | 46 (6) | 197 (25.7) | |
| Gruppo placebo | 762 | 5 (0.7) | 0 | 7 (0.9) | 3 (0.4) | 1 (0.1) | NR | 0 | 0 | 5 (0.6) | 1 (0.1) | 46 (6) | |
| Ravaud et al,35 2016 | |||||||||||||
| Gruppo di trattamento | 306 | 15 (4.9) | 6 (2) | 12 (3.9) | 7 (2.3) | 5 (1.6) | 1 (0.3) | 2 (0.7) | 49 (16) | NR | NR | 24 (7.8) | |
| Gruppo placebo | 304 | 4 (1.3) | 0 | 1 (0.3) | 0 | 1 (0.3) | 0 | 0 | 1 (0.3) | NR | NR | 4 (1.3) | |
L’incidenza degli effetti tossici di grado da 3 a 4 nei gruppi di placebo degli studi selezionati è stata inclusa nella meta-analisi. 26-35 L’incidenza complessiva degli effetti randomizzati di grado 3-4 degli EA placebo di grado 3-4 è stata del 18% (95% CI, 15%-21%), con un alto livello di eterogeneità (I2=86%) (Figura 2). L’incidenza degli AA di grado da 3 a 4 placebo ha raggiunto valori superiori al 20% in 3 prove. Quando la stessa analisi è stata eseguita analizzando gli studi che coinvolgevano placebo orali e parenterali, l’incidenza di AA di grado 3 a 4 placebo è stata del 19% (95% CI, 16%-23%) per i placebo orali e del 17% (95% CI, 12%-23%) per i placebo parenterali. Dopo aver suddiviso per diversi tipi di tumore, l’incidenza degli AA di grado 3 – 4 placebo è stata del 18% (95% IC, 14%-23%) negli RCT del melanoma e del 19% (95% CI, 14%-25%) negli RCT del carcinoma a cellule renali, con elevata eterogeneità (I2=85% e 91% rispettivamente) (eFig. 2 nel Supplemento).
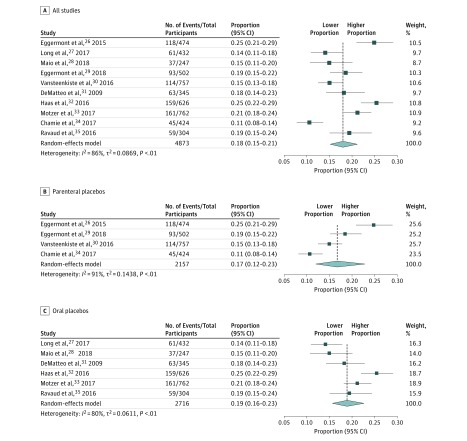
Figura 2.Figura 2. Percentuale di eventi avversi di grado da 3 a 4 placebo negli studi clinici randomizzati sui moderni farmaci antitumoraliLa linea verticale mostra l’effetto complessivo. I marcatori dei dati indicano la proporzione di eventi avversi di grado da 3 a 4 per ogni studio. La dimensione dei marcatori dei dati indica il peso rispettivo dei singoli effetti nell’analisi complessiva. Le barre di errore indicano il 95% di IC.
Una correlazione positiva è stata osservata nella frequenza di grado 3 a 4 AE tra i gruppi di trattamento e placebo (ρ = 0,7; P = 03) (eFigure 3 nel supplemento). Non sono stati segnalati decessi associati all’intervento con placebo. Nello studio di Vansteenkiste et al,30 Il 52% dei pazienti ha ricevuto una chemioterapia adiuvante prima della randomizzazione sia nel trattamento che nei gruppi placebo. Le percentuali di AA di grado da 3 a 4 nei 2 gruppi erano uguali.
La maggior parte degli studi ha riportato una durata mediana del farmaco nello studio placebo di 10-15 mesi (ad eccezione dello studio di Chamie et al,34 che ha riportato 5,1 mesi). Complessivamente, la media delle interruzioni del trattamento farmacologico nello studio è stata del 3,9% (95% di IC, 2,7%-5,2%) e a causa della recidiva della malattia è stata del 27,9% (95% di IC, 17,7%-36,3%). Inoltre, la riduzione della dose di farmaco da studio e l’interruzione del trattamento a causa del placebo sono state informate solo in 4 studi, con una media del 7% (95% IC, 0,8%-14,8%) per la riduzione della dose di farmaco da studio e dell’11% (95% IC, 3,2%-18,8%) per l’interruzione del trattamento (eTabella 2 nel Supplemento).

Figura 2.Figura 2. Percentuale di eventi avversi di grado da 3 a 4 placebo negli studi clinici randomizzati sui moderni farmaci antitumoraliLa linea verticale mostra l’effetto complessivo. I marcatori dei dati indicano la proporzione di eventi avversi di grado da 3 a 4 per ogni studio. La dimensione dei marcatori dei dati indica il peso rispettivo dei singoli effetti nell’analisi complessiva. Le barre di errore indicano il 95% di IC.
Rischio di distorsioni
Le considerazioni sul rischio di distorsione stimata per ogni prova sono dettagliate in eFigure 4 nel Supplemento. Tutti gli studi hanno avuto un basso rischio di bias a randomizzazione e mascheramento, considerando che entrambi erano criteri di inclusione. Un totale del 60% degli studi aveva un rischio non chiaro di bias associato a dati incompleti, principalmente per la riduzione della dose e l’interruzione. Il grafico ad imbuto per il bias di pubblicazione non ha mostrato alcuna asimmetria (eFigure 5 nel supplemento).
Discussione
Negli RCT, i gruppi placebo sono progettati per creare un contesto mascherato in cui i risultati apprezzati nel gruppo di controllo sono attribuibili al setting investigativo per identificare l’effetto reale del trattamento assegnato nel gruppo di terapia attiva.36 La necessità di mascherare negli RCT sia degli sperimentatori che dei pazienti espone l’importanza dell’effetto placebo e degli AA placebo nella pratica clinica. Pertanto, gli RCT, idealmente in doppio cieco con un gruppo placebo (controllo), sono diventati uno standard per la ricerca clinica.37
La sicurezza è un requisito per gli RCT. Gli eventi avversi segnalati sia nei gruppi di terapia attiva che in quelli con placebo sono una questione di interesse. Tuttavia, solo pochi studi hanno affrontato questo problema nei pazienti affetti da cancro. In una revisione di 37 RCT di pazienti con diversi tipi di cancro, Chvetzoff e Tannock18 ha riferito di AA nel 10% – 60% dei pazienti del gruppo placebo. Gli studi clinici adiuvanti sono stati esclusi da tale revisione. Gli EA comuni erano simili tra gli studi analizzati, e gli autori hanno descritto che c’era un’associazione nel tipo e nel tasso di EA tra il gruppo di trattamento e il gruppo placebo, proprio come è stato trovato nel nostro studio. In uno studio, Foster et al.12 analizzato 2 RCT tra i pazienti con cancro avanzato in ambiente adiuvante. Gli autori hanno descritto che tra i 446 pazienti inclusi che hanno ricevuto solo placebo, 155 dei 5234 placebo AE riportati erano di grado 3 a 5 secondo la CTCAE. A nostra conoscenza, non esistono studi precedenti che abbiano analizzato l’incidenza di placebo di grado superiore nel setting adiuvante.
Nel presente studio, i tassi di interruzione dovuti agli AA placebo sono stati uguali o superiori al 5% in 4 studi. Inoltre, in diversi modelli di malattia, sono stati descritti tassi considerevoli di AA placebo di grado superiore e i tassi di interruzione sono stati riportati in pazienti con fibromialgia (9,5%), emicrania (4,8%) e sclerosi multipla (2,2%).38,39,40 Va considerato che i pazienti che sono stati inclusi nell’analisi di interruzione a causa del tasso di recidiva della malattia sono stati di conseguenza esclusi dal tasso di interruzione dovuto agli AA. In alcuni studi,26,29 Gli elevati tassi di ricorrenza hanno coinciso con un’elevata incidenza di AA di grado 3-4 placebo. I pazienti che sperimentano una recidiva di malattia potrebbero anche riportare effetti che potrebbero essere considerati come AA di grado elevato nel contesto di uno studio.
La durata media della somministrazione di placebo è un fattore da tenere in considerazione quando si considerano le segnalazioni di AA con placebo. Negli studi analizzati, uno studio34 con una bassa esposizione mediana al placebo di grado 3-4, mentre gli studi hanno riportato una bassa percentuale di AA di grado 3-4 placebo, mentre gli studi26,32,35 con la più alta esposizione mediana al placebo, ha riportato un’alta percentuale di AA di grado 3-4 placebo.
I fattori contestuali associati alla partecipazione agli studi clinici possono contribuire all’eterogenea frequenza di AA con placebo severo, e devono essere prese in considerazione diverse spiegazioni. In primo luogo, i suggerimenti e le aspettative negative potrebbero essere sollevate dai dati forniti durante il processo di consenso informato. Per illustrare questo punto, in un RCT di aspirina come trattamento per l’angina instabile, è stata riportata una maggiore incidenza di irritazione gastrointestinale in centri che ne hanno specificato la potenziale insorgenza nel consenso informato rispetto a unità di ricerca che non includevano tale rischio.41 L’incertezza di ricevere un trattamento attivo o un placebo può anche avere un ruolo nel disagio dei pazienti. Inoltre, l’ingresso in un RCT è spesso associato a una maggiore esposizione a un ambiente stressante (ad esempio, l’interazione con i pazienti sintomatici e la ricerca di informazioni sul cancro), che può anche essere associato a suggerimenti negativi tra i pazienti suscettibili. Abbiamo considerato che la chemioterapia e la terapia ormonale siano associate a diversi profili AE rispetto al tipo di farmaci selezionati per la nostra analisi. Di conseguenza, i pazienti randomizzati al gruppo placebo in studi chemioterapici o di terapia ormonale potrebbero essere esposti a informazioni sostanzialmente diverse nei loro consensi, il che porterebbe a un profilo distinto di suggerimenti e aspettative.
In secondo luogo, una maggiore frequenza di visite mediche e di esami medici può essere associata ad un aumento del rischio di sovradiagnosi degli AA. La ricezione di una diagnosi non benefica può portare a inutili esami aggiuntivi e può aumentare il danno iatrogeno.42 Quest’ultimo punto dovrebbe essere attentamente analizzato nel contesto di un paziente che potrebbe subire un AA grave in cui il doppio cieco non permette al medico di sapere se il paziente sta ricevendo il farmaco attivo o il placebo.
In terzo luogo, il tasso di EA di grado superiore potrebbe essere sottovalutato a causa di una sottovalutazione. In una revisione43 di 3 RCT che includevano pazienti con cancro avanzato o che si trovavano nell’ambiente adiuvante, c’era discordanza nella valutazione degli effetti tossici, compresi i casi in cui i pazienti hanno descritto che avevano “molto” tossicità. Alcune situazioni durante la segnalazione di AE, come l’assenza di strumenti predefiniti per standardizzare le decisioni riguardanti l’attribuzione e l’esistenza di categorie basate sui sintomi definite dai criteri CTCAE, potrebbero spiegare la sottovalutazione dell’AE.44
Infine, le differenze sostanziali tra i pazienti che si sono sottoposti a un trattamento locale per il cancro e gli individui sani potrebbero essere considerati come altri fattori che potrebbero spiegare la comparsa di EA. Ad esempio, è stato riportato un affaticamento da moderato a grave nel 17%-23% dei pazienti con tumore polmonare non a piccole cellule in fase iniziale che si sono sottoposti a trattamento locale.20,45 In tutte le prove incluse, il tempo dalla resezione chirurgica alla randomizzazione è stato da 12 a 13 settimane. Pertanto, le possibili AA sovrapposte alle procedure chirurgiche erano le stesse per l’intera popolazione, e questo pregiudizio poteva essere mitigato.
Secondo i risultati di questa meta-analisi, la somministrazione di placebo può essere associata a gravi EA. Questo risultato, spesso non incluso nei consensi informati, dovrebbe essere noto prima di prendere una decisione autonoma di partecipare a un RCT. Anche se molti pazienti possono sperimentare AA di alto grado dopo un trattamento locale per il cancro, l’alto tasso di AA gravi con placebo negli RCT suggerisce che l’uso di placebo in qualsiasi situazione in ambiente adiuvante dovrebbe essere attentamente considerato.
L’uso del placebo può essere proposto in determinate circostanze, ad esempio, quando ci si aspetta un’alta incidenza di AA soggettivi o se sono previsti punti finali non oggettivi per determinare i fattori associati al gruppo di terapia attiva. Nuovi approcci dovrebbero essere presi in considerazione da sperimentatori, sponsor, autorità regolatorie e gruppi di supporto ai pazienti. Parallelamente, i pazienti dovrebbero essere informati sui potenziali rischi relativi alla randomizzazione del farmaco sperimentale o del placebo, e le autorità regolatorie non dovrebbero trascurare le implicazioni bioetiche degli RCT.
Limitazioni
Le implicazioni di questi risultati possono essere limitate alla popolazione eterogenea inclusa nell’analisi. Nel testo completo e nelle appendici supplementari di alcuni studi non erano disponibili dati che potessero ostacolare la comprensione completa degli AA con placebo. Per questo motivo, non è stato possibile stabilire alcuna associazione tra sesso, caratteristiche etniche/razziali, età, stadio tumorale, comorbilità o composizione del placebo e la presenza di AA di grado da 3 a 4. Altri potenziali fattori che potrebbero contribuire, come i diversi tipi di trattamento locale del cancro che i pazienti hanno subito prima di entrare nello studio, potrebbero aggiungere eterogeneità alla popolazione analizzata.
Come conseguenza del numero limitato di studi analizzati e dell’elevato livello di eterogeneità ottenuto, l’incidenza di AA di alto grado di placebo dovrebbe essere considerata con cautela. Ulteriori indagini in questo settore con un gran numero di RCT potrebbero aiutare ad ottenere una migliore comprensione dei potenziali fattori che contribuiscono agli AA placebo.
Conclusioni
Questa revisione sistematica e meta-analisi ha rilevato che la somministrazione di placebo è stata associata ad una percentuale sostanziale di placebo di grado 3 a 4 in RCT in doppio cieco in ambiente adiuvante. L’eterogeneità all’interno delle popolazioni incluse è stata osservata.
References
- The powerful placebo. JAMA. 1955; 159(17)DOI | PubMed
- William Cullen and a missing mind-body link in the early history of placebos. J R Soc Med. 2008; 101(2):89-92. DOI | PubMed
- New insights into the placebo and nocebo responses. Neuron. 2008; 59(2):195-206. DOI | PubMed
- The placebo effect in healthy volunteers: influence of experimental conditions on the adverse events profile during phase I studies. Clin Pharmacol Ther. 1993; 54(5):578-583. DOI | PubMed
- The nocebo effect: history and physiology. Prev Med. 1997; 26(5, pt 1):612-615. DOI | PubMed
- Nonspecific medication side effects and the nocebo phenomenon. JAMA. 2002; 287(5):622-627. DOI | PubMed
- The magnitude of nocebo effects in pain: a meta-analysis. Pain. 2014; 155(8):1426-1434. DOI | PubMed
- The imagined itch: brain circuitry supporting nocebo-induced itch in atopic dermatitis patients. Allergy. 2015; 70(11):1485-1492. DOI | PubMed
- Differences in adverse effect reporting in placebo groups in SSRI and tricyclic antidepressant trials: a systematic review and meta-analysis. Drug Saf. 2009; 32(11):1041-1056. DOI | PubMed
- Nocebo in motor neuron disease: systematic review and meta-analysis of placebo-controlled clinical trials. Amyotroph Lateral Scler Frontotemporal Degener. 2017; 18(7-8):576-582. DOI | PubMed
- Placebo and nocebo effects in randomized double-blind clinical trials of agents for the therapy for fatigue in patients with advanced cancer. Cancer. 2010; 116(3):766-774. DOI | PubMed
- Comparative “nocebo effects” in older patients enrolled in cancer therapeutic trials: observations from a 446-patient cohort. Cancer. 2017; 123(21):4193-4198. DOI | PubMed
- The Placebo and Nocebo Effects in Cancer Treatment: Psychological Aspects of Cancer. Springer: Boston, MA; 2013. DOI
- The placebo: from specificity to the non-specific and back. Psychol Med. 1993; 23(3):569-578. DOI | PubMed
- Scientific and ethical issues in the use of placebo controls in clinical trials. Annu Rev Public Health. 1994; 15(1):19-38. DOI | PubMed
- The influence of the nocebo effect in clinical trials. Open Access J Clin Trials. 2012; 4:61-68. DOI
- Nocebo in clinical trials for depression: a meta-analysis. Psychiatry Res. 2014; 215(1):82-86. DOI | PubMed
- Placebo effects in oncology. J Natl Cancer Inst. 2003; 95(1):19-29. DOI | PubMed
- Symptom distress in older adults following cancer surgery. Cancer Nurs. 2013; 36(4):292-300. DOI | PubMed
- Fatigue and functional impairment in early-stage non–small cell lung cancer survivors. J Pain Symptom Manage. 2011; 41(2):426-435. DOI | PubMed
- Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. Ann Intern Med. 2009; 151(4):264-269, W64. DOI | PubMed
- Publisher Full Text
- Bias in meta-analysis detected by a simple, graphical test. BMJ. 1997; 315(7109):629-634. DOI | PubMed
- Adjuvant erlotinib versus placebo in patients with stage IB-IIIA non-small-cell lung cancer (RADIANT): a randomized, double-blind, phase III trial. J Clin Oncol. 2015; 33(34):4007-4014. DOI | PubMed
- Gefitinib versus placebo in completely resected non-small-cell lung cancer: results of the NCIC CTG BR19 study. J Clin Oncol. 2013; 31(27):3320-3326. DOI | PubMed
- Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. Lancet Oncol. 2015; 16(5):522-530. DOI | PubMed
- Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma. N Engl J Med. 2017; 377(19):1813-1823. DOI | PubMed
- Adjuvant vemurafenib in resected, BRAFV600 mutation-positive melanoma (BRIM8): a randomised, double-blind, placebo-controlled, multicentre, phase 3 trial. Lancet Oncol. 2018; 19(4):510-520. DOI | PubMed
- Adjuvant pembrolizumab versus placebo in resected stage III melanoma. N Engl J Med. 2018; 378(19):1789-1801. DOI | PubMed
- Efficacy of the MAGE-A3 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small-cell lung cancer (MAGRIT): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2016; 17(6):822-835. DOI | PubMed
- Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial. Lancet. 2009; 373(9669):1097-1104. DOI | PubMed
- Adjuvant sunitinib or sorafenib for high-risk, non-metastatic renal-cell carcinoma (ECOG-ACRIN E2805): a double-blind, placebo-controlled, randomised, phase 3 trial. Lancet. 2016; 387(10032):2008-2016. DOI | PubMed
- Randomized phase III trial of adjuvant pazopanib versus placebo after nephrectomy in patients with localized or locally advanced renal cell carcinoma. J Clin Oncol. 2017; 35(35):3916-3923. DOI | PubMed
- Adjuvant weekly girentuximab following nephrectomy for high-risk renal cell carcinoma: the ARISER randomized clinical trial. JAMA Oncol. 2017; 3(7):913-920. DOI | PubMed
- Adjuvant sunitinib in high-risk renal-cell carcinoma after nephrectomy. N Engl J Med. 2016; 375(23):2246-2254. DOI | PubMed
- Biological, clinical, and ethical advances of placebo effects. Lancet. 2010; 375(9715):686-695. DOI | PubMed
- The importance of placebo effects in pain treatment and research. JAMA. 1994; 271(20):1609-1614. DOI | PubMed
- Nocebo in fibromyalgia: meta-analysis of placebo-controlled clinical trials and implications for practice. Eur J Neurol. 2012; 19(5):672-680. DOI | PubMed
- Nocebo in headaches: implications for clinical practice and trial design. Curr Neurol Neurosci Rep. 2012; 12(2):132-137. DOI | PubMed
- Nocebo effects in multiple sclerosis trials: a meta-analysis. Mult Scler. 2010; 16(7):816-828. DOI | PubMed
- The consent form as a possible cause of side effects. Clin Pharmacol Ther. 1987; 42(3):250-253. DOI | PubMed
- Medicalisation and overdiagnosis: what society does to medicine. Int J Health Policy Manag. 2016; 5(11):619-622. DOI | PubMed
- Symptomatic toxicities experienced during anticancer treatment: agreement between patient and physician reporting in 3 randomized trials. J Clin Oncol. 2015; 33(8):910-915. DOI | PubMed
- Adverse event reporting in oncology clinical trials—lost in translation?. Expert Opin Drug Saf. 2016; 15(7):893-896. DOI | PubMed
- Evaluating quality of life and pulmonary function of long-term survivors of non–small cell lung cancer treated with radical or postoperative radiotherapy. Am J Clin Oncol. 2009; 32(1):65-72. DOI | PubMed
Fonte
Chacón MR, Enrico DH, Burton J, Waisberg FD, Videla VM, et al. (2018) Incidence of Placebo Adverse Events in Randomized Clinical Trials of Targeted and Immunotherapy Cancer Drugs in the Adjuvant Setting. JAMA Network Open 1(8): e185617. https://doi.org/10.1001/jamanetworkopen.2018.5617





