Abstract
Introduzione
Lo Streptococcus pneumoniae (pneumococco) e l’Haemophilus influenzae di tipo b (Hib) sono cause comuni di polmonite, meningite e altre infezioni gravi nei bambini. Si stima che lo pneumococco sia stato responsabile di 735000 decessi in bambini non infetti da HIV e di 14-5 milioni di malattie totali nei bambini nel 2000.1 Si stima che Hib abbia causato 363.000 decessi in bambini non infetti da HIV e 8-1 milioni di episodi totali in bambini nello stesso anno.2 Queste stime rappresentano le misure più recenti e pubblicamente disponibili a livello nazionale dell’OMS per il carico di malattia di questi agenti patogeni. Stime regionali aggiornate sulla mortalità sono state pubblicate dall’OMS per il 2008, stimando 541.000 decessi per pneumococco e 203.000 decessi per Hib in quell’anno.3
Ricerca nel contestoEvidenza prima di questo studio Abbiamo precedentemente condotto una revisione sistematica della malattia invasiva causata da Streptococcus pneumoniae (pneumococco) e Haemophilus influenzae tipo b (Hib). Sulla base di questa revisione e utilizzando dati provenienti da altre fonti, lo pneumococco è stato stimato responsabile di 735000 decessi e l’Hib di 363000 decessi in bambini non infetti da HIV nel 2000. Stime aggiornate pubblicate in seguito online per l’anno 2008 hanno stimato che lo pneumococco è stato responsabile di 541.000 decessi e l’Hib di 203.000 decessi in quell’anno. L’Institute for Health Metrics and Evaluation ha stimato che il pneumococco è stato responsabile di 393.000 decessi per polmonite e Hib di 59.000 decessi per polmonite in bambini di età inferiore ai 5 anni nel 2015.Valore aggiunto di questo studio Presentiamo stime nazionali aggiornate della mortalità e della morbilità per pneumococco e Hib dovute a tutte le sindromi associate a questi agenti patogeni (cioè, polmonite, meningite e altre malattie invasive) dal 2000 al 2015. Queste stime incorporano i nuovi dati di 67 studi pubblicati tra il 2006 e il 2014 che riportano la mortalità dei casi di meningite specifica del patogeno e la distribuzione dei casi di meningite per eziologia. Sono stati aggiornati i metodi per la stima della morbilità e della mortalità di pneumococco e della meningite Hib. Per tener conto delle notevoli disparità di rischio di malattia all’interno del paese, abbiamo sviluppato per la prima volta in India modelli di carico di malattia subnazionali specifici per tutte le sindromi associate a questi agenti patogeni. Implicazioni di tutte le prove disponibili A nostra conoscenza, i risultati qui presentati sono le stime più aggiornate disponibili sulla mortalità e la morbilità del pneumococco e dell’Hib attribuibili a tutte le sindromi. Queste stime evidenziano i progressi globali verso la riduzione della morbilità e della mortalità associate a questi due agenti patogeni e indicano i paesi e le regioni in cui è necessario intensificare gli sforzi di prevenzione e trattamento. Possono essere utilizzate per informare le strategie nazionali di intervento sulla salute dei bambini.
Dal 2000 si sono verificati diversi importanti sviluppi del vaccino. I vaccini Hib coniugati proteina-polisaccaride sono ora inclusi nel programma di immunizzazione di routine di quasi tutti i paesi del mondo. Entro la fine del 2015, 129 paesi, tra cui 54 paesi a basso e medio reddito ammissibili al finanziamento del vaccino da parte di Gavi, la Vaccine Alliance, hanno introdotto il vaccino coniugato pneumococcico (PCV); questo numero è aumentato a 141 paesi entro settembre 2017.4 Laddove il vaccino Hib è usato abitualmente con un’alta copertura, si è verificata l’eliminazione virtuale della malattia invasiva Hib nei bambini. 5, 6, 7 Allo stesso modo, il PCV ha ridotto sostanzialmente la malattia pneumococcica invasiva di tipo vaccino nei bambini. 8, 9, 10
Per misurare i progressi verso la riduzione del carico di pneumococco e della malattia di Hib e per informare l’introduzione e l’uso sostenuto di politiche di prevenzione e trattamento nell’era dei vaccini coniugati, abbiamo preparato stime annuali modellate per paese della morbilità e della mortalità di pneumococco e Hib dal 2000 al 2015 nei bambini di età compresa tra 1 e 59 mesi, utilizzando, ove possibile, dati specifici per paese.
Metodi
Modelli concettuali e ingressi
Abbiamo stimato i decessi annuali per pneumococco e Hib, i casi, i tassi di mortalità e i tassi di incidenza per ogni paese dal 2000 al 2015 per ciascuna delle tre sindromi primarie associate a questi agenti patogeni: polmonite, meningite e non polmonite invasiva, non meningite (NPNM). Abbiamo sviluppato modelli concettuali per ciascuna sindrome (figura 1). Per i modelli di polmonite, abbiamo identificato gli studi sui vaccini PCV e Hib e gli studi di efficacia a partire da una revisione sistematica della letteratura (vedi appendice pagg. 4-8 per la strategia di ricerca) e da una revisione Cochrane dell’efficacia del PCV.11 Abbiamo anche aggiornato una revisione sistematica12 di pneumococco e di malattia invasiva Hib dal 1980 al 2005 con dati pubblicati e non pubblicati fino al 2014 compreso per la meningite specifica del patogeno e i modelli NPNM. Abbiamo cercato in sei database globali (ad esempio, PubMed, Embase, Biosis, Cochrane, Global Health e Pascal) e cinque database regionali (ad esempio, IMEMR, IMSEAR, LILACS, WHOLIS e WPRIM) e abbiamo seguito gli stessi criteri di valutazione della qualità descritti nella revisione della letteratura pubblicata in precedenza.12 Abbiamo anche utilizzato dati non pubblicati dello strumento di valutazione rapida Hib e della rete di sorveglianza delle malattie batteriche invasive dell’OMS.13 Altri valori dei parametri del modello sono stati ottenuti da fonti pubblicamente disponibili o da comunicazioni personali. Abbiamo usato valori di input specifici per l’India ogni volta che è stato possibile e abbiamo sviluppato modelli subnazionali per tenere conto delle ampie disparità tra gli stati del paese.Figura 1Patogen-specific pneumonia, meningite, e modelli concettuali di morbilità e mortalità NPNMCEE=Stimolazione dell’epidemiologia materna e infantile. NPNM=non polmonite, non meningite. CFR=rapporto tra casi e mortalità. *Vedi Metodi per la descrizione degli aggiustamenti del vaccino. †Casi di NPNM non pneumococcici sono stratificati da casi gravi e non gravi. ‡Abbiamo ipotizzato che i casi di NPNM non gravi di pneumococco abbiano un CFR dello 0%; tutti i decessi di NPNM pneumococcici sono ipotizzati essere gravi.
Un comitato di esperti indipendenti e il Comitato consultivo per la ricerca sull’attuazione delle vaccinazioni e dei vaccini dell’OMS ha esaminato i modelli concettuali e gli input (appendice pagg. 33-34). L’OMS ha intrapreso una consultazione a livello nazionale per verificare con i rappresentanti dei paesi la metodologia e gli input dei modelli specifici del paese. Laddove le prove non erano disponibili o contraddittorie, abbiamo scelto l’approccio più conservativo che avrebbe potuto sottovalutare la malattia. La nostra motivazione era quella di ridurre al minimo la probabilità che le decisioni politiche utilizzassero stime di oneri sovrastimate.
Per ogni sindrome riportiamo casi e decessi specifici di agenti patogeni modellati. I risultati a livello nazionale sono disponibili nell’appendice (pagg. 36-145). I decessi e i casi specifici per eziologia, comprese le stime specifiche per paese presentate nell’appendice, sono modellati e non si basano sulla segnalazione diretta a livello nazionale. Abbiamo utilizzato stime della popolazione mondiale per calcolare i tassi di mortalità e di incidenza riportati come casi o decessi per 100.000 bambini di età compresa tra 1 e 59 mesi. I numeri della popolazione sono stati ottenuti dalla Divisione Popolazione delle Nazioni Unite.14 I risultati globali e regionali sono la somma delle stime specifiche per paese. I risultati per i decessi e i casi sono stati arrotondati e riportati con tre cifre significative o meno; la precisione non è stata fornita per meno di 100 casi o decessi. I tassi di incidenza e di mortalità sono stati arrotondati al numero intero più vicino.
Tutte le analisi sono state effettuate utilizzando Stata 14 (College Station, TX, USA). Questa analisi è conforme alle Linee guida per la comunicazione accurata e trasparente delle stime sanitarie (appendice p. 35).15
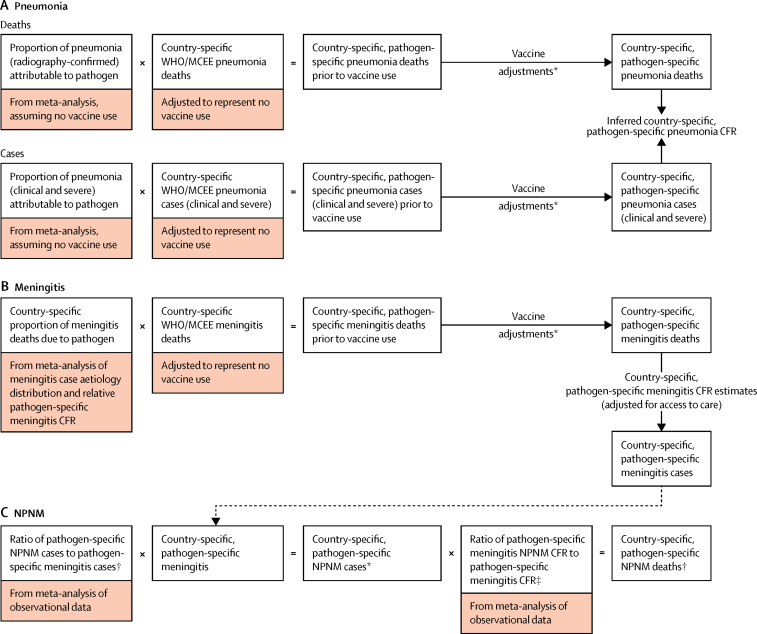
Figura 1.Polmonite patogena specifica, meningite e modelli concettuali di morbilità e mortalità NPNMMCEE=Stimolazione dell’epidemiologia materna e infantile. NPNM=Non polmonite, non meningite. CFR=rapporto tra casi di malattia. *Vedi Metodi per la descrizione degli aggiustamenti del vaccino. †Casi di NPNM non pneumococcici sono stratificati da casi gravi e non gravi. ‡Abbiamo ipotizzato che i casi di NPNM non gravi di pneumococco abbiano un CFR dello 0%; tutti i decessi di NPNM pneumococcici sono ipotizzati essere gravi.
Polmonite patogena specifica
Per stimare i decessi e i casi di polmonite specifici per eziologia, abbiamo applicato le frazioni eziologiche ai decessi e ai casi annuali, specifici per ogni paese, preparati dall’OMS e dalla collaborazione dell’Organizzazione Mondiale della Sanità e della Stima epidemiologica materno-infantile (MCEE) (figura 1A).16 Le stime di tutte le cause di polmonite pubblicate dalla collaborazione OMS/MCEE tengono già conto dell’immunizzazione con PCV e vaccino Hib. Per evitare di sopravvalutare l’effetto del vaccino, abbiamo modificato le morti per polmonite e i casi di polmonite totale per rappresentare l’onere della polmonite che si sarebbe verificato se non fossero stati introdotti il PCV e il vaccino Hib. Abbiamo ipotizzato che i decessi e i casi di polmonite da Hib si siano verificati solo in bambini di 1-23 mesi, come descritto nell’appendice (p. 30).
Abbiamo determinato la proporzione della mortalità e della morbilità di tutti i casi di polmonite attribuibili a pneumococco e Hib utilizzando l’approccio della sonda che abbiamo sviluppato e descritto in precedenza. 1, 2 In breve, abbiamo meta-analizzato i risultati dell’efficacia e dell’efficienza di sei studi controllati randomizzati con PCV e quattro studi controllati con vaccino Hib e studi caso-controllo con assegnazione casuale o sistematica del trattamento con PCV17, 18, 19, 20, 20, 21, 22, 23, 23, 24, 25 e vaccino Hib26, 27, 28, 29, 30 e definizioni di casi di polmonite tutte le cause. 31, 32, 33 Poiché gli studi e gli studi sul vaccino non hanno valutato l’efficacia contro la mortalità da polmonite, abbiamo utilizzato valori di efficacia e di efficacia contro la polmonite endpoint primaria confermata dalla radiografia (cioè il consolidamento),33 con i relativi aggiustamenti, per approssimare la percentuale di morti per polmonite causate da ciascun agente patogeno. Abbiamo utilizzato i valori di efficacia ed efficacia del vaccino PCV e del vaccino Hib contro la polmonite clinica e grave definita dall’OMS30, 32 per stimare il contributo di ciascun agente patogeno a queste definizioni di casi. I valori di efficacia e di efficacia sono stati corretti per tener conto dell’efficacia incompleta contro la polmonite di tipo vaccino. Poiché non sono noti i veri valori di efficacia per la polmonite di tipo vaccino nei bambini, abbiamo utilizzato l’efficacia osservata contro la malattia invasiva di tipo vaccino per ogni studio come proxy. Per il pneumococco, abbiamo stimato il grado di polarizzazione di questa misura proxy introdotta utilizzando due analisi di sensibilità descritte in dettaglio nell’appendice (pagg. 27-29): (1) l’efficacia dell’otite media acuta di tipo vaccino (AOM) e (2) il rapporto tra l’efficacia del vaccino contro la malattia pneumococcica invasiva di tipo vaccino e quella della polmonite pneumococcica non batterica di tipo vaccino rilevata da un nuovo dosaggio dell’antigene urinario specifico del sierotipo in uno studio PCV34 fatto in olandese per adulti olandesi di età superiore ai 65 anni. I valori di efficacia del PCV sono stati corretti anche in base alla proporzione di malattia che era di tipo vaccino utilizzando la distribuzione del sierotipo di malattia pneumococcica invasiva nel gruppo di controllo e in base alla proporzione di casi di polmonite causata dall’Hib, perché tutti gli studi sul PCV sono stati effettuati nel contesto del vaccino Hib.
Meningite patogena specifica
Il modello concettuale utilizzato per stimare i decessi per meningite specifica del patogeno era lo stesso utilizzato per i decessi per polmonite specifica del patogeno (figura 1B). Per calcolare i casi di meningite specifica dell’agente patogeno, abbiamo diviso i decessi per meningite specifica dell’agente patogeno per le stime del rapporto tra i casi di meningite specifica del paese e quelli di meningite specifica dell’agente patogeno (CFR).
Non sono stati identificati studi che riportassero la distribuzione dei decessi per meningite da agenti patogeni. Abbiamo quindi utilizzato studi che riportavano la distribuzione dei casi di meningite e abbiamo corretto queste stime in base alla relativa meningite CFR specifica del patogeno per calcolare la percentuale di decessi per meningite dovuti a pneumococco e Hib, come descritto nell’appendice (p 31). Per stimare la proporzione di casi di meningite dovuta a ciascun agente patogeno, abbiamo utilizzato dati provenienti da studi osservazionali, poiché il rendimento diagnostico eziologico derivante dalle indagini sui casi di meningite è elevato se effettuato con metodi clinici e microbiologici appropriati. I dati di 98 studi che riportano casi di meningite batterica eziologicamente confermati attribuibili a cause comuni di meningite batterica sono stati combinati in meta-analisi di effetti casuali stratificati per regione.
Abbiamo stimato la meningite CFR specifica del patogeno utilizzando i dati della revisione sistematica della letteratura (53 stime per il pneumococco e 61 stime per l’Hib), stratificati in base all’impostazione della mortalità infantile come precedentemente definita: bassa (<30 decessi per 1000 nati vivi), media (da 30 a <75 decessi), alta (da 75 a <150 decessi) e molto alta (≥150 decessi). 1, 2 Poiché i valori CFR riportati riflettono la mortalità nei bambini che accedono alle cure presso un sito di studio o una struttura sanitaria, abbiamo corretto i valori CFR per tenere conto del CFR più alto (cioè il 90% per tutti gli agenti patogeni, come raccomandato dal comitato di esperti indipendenti) assunto per coloro che non hanno accesso alle cure. Non esiste una misura della ricerca di cure per i bambini affetti da meningite nelle indagini standardizzate; pertanto, abbiamo utilizzato come proxy la percentuale di bambini che cercano cure per i sintomi della polmonite dalle indagini a grappolo con indicatori multipli e dalle indagini demografiche e sanitarie. Abbiamo ipotizzato il 100% di accesso all’assistenza nei paesi con una bassa mortalità infantile. Abbiamo ipotizzato una relazione lineare tra l’accesso alle cure nel tempo per stimare per anni i dati mancanti. Nei tre paesi senza dati sull’accesso all’assistenza o nei 24 paesi con solo 1 anno di dati sull’accesso all’assistenza da questi set di dati, abbiamo sviluppato un modello lineare generalizzato per spiegare la relazione tra la mortalità infantile e l’accesso all’assistenza in modo da poter estrapolare dai paesi con dati sull’accesso all’assistenza.
NPNM invasivo specifico per gli agenti patogeni
I casi patogeno-specifici dovuti ad altre sindromi invasive (ad esempio, la sepsi) sono stati stimati utilizzando meta-analisi di effetti casuali del rapporto tra i casi di NPNM specifici all’agente patogeno e i casi di meningite specifici all’agente patogeno riportati da 46 studi per il pneumococco e 28 studi per gli studi di Hib (figura 1C). Le analisi sono state stratificate in base alla mortalità infantile e, per lo pneumococco, in base ai casi gravi e non gravi. Abbiamo stimato i decessi NPNM moltiplicando i casi NPNM per NPNM CFR. Quest’ultimo è stato derivato per ciascun agente patogeno stimando il rapporto tra NPNM CFR e meningite CFR in base alla mortalità infantile e applicando il rapporto alle stime della meningite CFR.
Prevalenza dell’HIV
I bambini infettati dall’HIV che muoiono per qualsiasi causa, incluso lo pneumococco o l’Hib, sono considerati nella stima dei decessi da HIV.16 Abbiamo quindi stimato i decessi per pneumococco e Hib per ogni sindrome nei bambini sieropositivi utilizzando le stime annuali della prevalenza dell’HIV nei bambini di età inferiore ai 59 mesi fornite dall’UNAIDS (comunicazione personale con il BW) e le stime del rischio relativo per la malattia pneumococcica invasiva e la malattia invasiva Hib nei bambini sieropositivi dal materiale supplementare per le stime pubblicate in precedenza. 1, 2 Abbiamo ipotizzato che i bambini sottoposti a terapia antiretrovirale altamente attiva (HAART) avessero lo stesso rischio di pneumococco e di malattia di Hib dei bambini sieropositivi. L’UNAIDS e il Piano di emergenza per l’AIDS del Presidente degli Stati Uniti hanno fornito il numero di bambini in terapia antiretrovirale HAART per 35 Paesi nel 2015 (comunicazione personale con BW). Abbiamo ipotizzato che non ci sia copertura HAART in altri Paesi.
Immunizzazione
Abbiamo calcolato l’impatto del vaccino sottraendo il numero di decessi e di casi di bambini che si stima siano stati protetti direttamente e indirettamente dalla vaccinazione dal numero totale di decessi e di casi specifici di agenti patogeni. Stime della copertura vaccinale Hib dell’OMS e dell’UNICEF specifiche per paese35 sono stati adeguati per rappresentare la percentuale annuale di bambini di età compresa tra 1-23 mesi a rischio di malattia sulla base del numero di anni dopo l’introduzione del vaccino e supponendo che non vi siano campagne di recupero. Per il PCV, abbiamo stratificato le stime della malattia da pneumococco per età sulla base di una revisione della sua distribuzione per età36 e applicato la copertura vaccinale per ogni coorte di nascita alla stima corrispondente di malattia pneumococcica per quell’età. Le stime della copertura vaccinale sono state combinate con le stime dell’efficacia del vaccino e, nel caso del PCV, le stime regionali della copertura del sierotipo della malattia mediante la formulazione del vaccino prima dell’introduzione del vaccino4, 37 per stimare la percentuale di bambini direttamente protetti dalla vaccinazione. Abbiamo utilizzato l’efficacia della malattia da pneumococco invasivo di tipo vaccinale e la copertura dei sierotipi come proxy dell’efficacia della polmonite da pneumococco di tipo vaccinale e della distribuzione dei sierotipi che causano la polmonite da pneumococco, rispettivamente. 11, 37
Per stimare la protezione della mandria associata al vaccino Hib nei bambini, abbiamo utilizzato i dati di studi sui vaccini che misurano l’impatto del vaccino Hib sulla malattia Hib invasiva e abbiamo modellato la percentuale di bambini protetti sulla base delle stime di copertura dell’OMS e dell’UNICEF utilizzando gli stessi metodi precedentemente riportati con input di modello aggiornati. 1, 2 Sebbene non siamo stati in grado di fare ipotesi sull’immunità del gregge negli anni successivi all’introduzione del PCV allo stesso modo a causa di un numero troppo limitato di dati, abbiamo ipotizzato che il 95% dei bambini fosse protetto da una malattia pneumococcica di tipo vaccinale 5 anni o più dopo l’introduzione del PCV se la copertura vaccinale riportata superava il 65%.38 Abbiamo anche considerato un aumento della malattia causata da sierotipi non vaccinali nei paesi in cui è stato utilizzato il prodotto PCV a sette valenti (PCV7) (cioè la sostituzione del sierotipo). Per questo abbiamo utilizzato i dati di una revisione sistematica38 segnalando ogni anno il rischio relativo di malattia pneumococcica invasiva di tipo non vaccinico a seguito dell’introduzione del PCV7. Poiché la sostituzione del sierotipo nella malattia pneumococcica invasiva potrebbe sottovalutare l’entità della sostituzione osservata per la polmonite da pneumococco, abbiamo fatto un’analisi di sensibilità ipotizzando una sostituzione completa con sierotipi non-PCV7 per la polmonite da pneumococco. Stime riassuntive non sono ancora disponibili per i prodotti PCV a più alta valenza e quindi non abbiamo tenuto conto della sostituzione dei sierotipi quando e dove questi vaccini sono stati utilizzati.
Incertezza
Abbiamo stimato l’incertezza intorno alle nostre stime utilizzando metodi simili alle analisi precedenti. 1, 2 Per le stime della polmonite specifica del patogeno, gli intervalli di incertezza sono stati basati su un approccio di tipo “jack-knife, leave-one-study-out” per i limiti superiori e inferiori delle frazioni di polmonite da pneumococco e di Hib. Per le stime dell’eziologia della meningite, abbiamo determinato le stime di incertezza più prudenti (cioè, ampie) per le proporzioni eziologiche sulla base di un’analisi di tipo jack-knife leave-one-study-out e abbiamo riportato intervalli di confidenza da meta-analisi. Gli intervalli di incertezza della morbilità e della mortalità di NPNM specifici per il patogeno erano basati sull’incertezza dei modelli di meningite specifici per il patogeno. Non abbiamo tenuto conto dell’incertezza in altri valori dei parametri del modello (ad esempio, la copertura del vaccino o l’accesso alle cure) o le stime della mortalità per tutte le cause.
Ruolo della fonte di finanziamento
Lo sponsor di questo studio non ha avuto alcun ruolo nella progettazione dello studio, nella raccolta dei dati, nell’analisi dei dati, nell’interpretazione dei dati, nella stesura del rapporto o nella decisione di presentare il rapporto per la pubblicazione. Tutti gli autori hanno avuto pieno accesso a tutti i dati utilizzati nello studio e l’autore corrispondente ha avuto la responsabilità finale per la decisione di presentare il rapporto per la pubblicazione.
Risultati
Abbiamo stimato che il pneumococco è stato responsabile di 294000 decessi (intervallo di incertezza [UR] 192000-366000) in bambini non infetti da HIV nel 2015 (tabella 1). Altri 23300 (15300-28300-28700) decessi per pneumococco stimati in quell’anno si sono verificati in bambini affetti da HIV/AIDS. I decessi per pneumococco nel 2015 riflettono un calo del 51% (7-74) rispetto ai 600000 (396000-733000) decessi per pneumococco stimati nei bambini non infetti da HIV di età compresa tra 1 e 59 mesi nel 2000 (figura 2). I decessi per pneumococco nei bambini infetti da HIV sono diminuiti del 75% rispetto al 2000, quando ci sono stati circa 95200 decessi (61200-114000). Di tutti i decessi per pneumococco nei bambini non infetti da HIV nel 2015, la polmonite ha rappresentato l’81%, la meningite il 12% e il NPNM il 7% (tabella 1). Il tasso di mortalità globale per il pneumococco nel 2015 è stato di 45 decessi (29-56) su 100.000 bambini di età compresa tra 1-59 mesi.I decessi dovuti a pneumococco e Hib nei bambini di 1-59 mesi di etàPneumococco e Hib nei bambini di 1-59 mesi dal 2000 al 2015 sono solo decessi HIV-negativi. Le stime della copertura vaccinale dell’OMS/UNICEF sono state adeguate per rappresentare la proporzione di bambini di 1-59 mesi che hanno ricevuto il vaccino PCV e Hib. Le barre verticali indicano intervalli di incertezza. Pneumococco=Streptococco polmonare. Hib=Haemophilus influenzae tipo b.Tabella 1Morbilità e mortalità del pneumococco nel 2015, per sindrome e regione OMSGlobalAfricaAfricaAmericaMediterraneo orientaleEuropaEuropaSud-Est asiatico-Pacifico occidentaleParametri di input della popolazioneBambini di età compresa tra 1 e 59 mesi*6571271273991571674867355155116167787833130665568102717517579529111661919363Morti 326026073111183583531510623142879160540664465165165389Morti di polmonite ‡ 7611933953954311956011111895104545318822936243Morti di meningite‡ 1151736573527527561380115151526269554388Totale carico pneumococcico Tasso di incidenza1419 (1197-1737)1603 (1337-1997)358 (301-441)1261 (1066-1542)207 (170-261)2509 (2132-3048)881 (745-1067)Severo559 (411-658)619 (452–739)142 (104–169)491 (362–576)129 (94–154)986 (729–1154)347 (256–404)Casi9180000 (7870000-11400000)2440000 (2100100100000–3 140 000)259 000 (221 000–325 000)968 000 (835 000–1 210 000)111 000 (94 800–145 000)4 400 000 (3 750 000–5 360 000)1010000 (868000-1240000)Severo3670000 (270000000-4 320 000)973 000 (710 000–1 160 000)104 000 (76 300–124 000)385 000 (284 000–451 000)72 100 (52 600–85 800)1730 000 (1 280000-2030000)404000 (298000-472000)Tasso di mortalità45 (29-56)92 (60-114)8 (5-10)47 (31-57)9 (6-11)50 (32-62)13 (9-16)Morti318000 (207000-395 000)166 000 (109 000–205 000)5700 (3600–7800)37 100 (24 300–45 300)4900 (3100–6100)88 500 (57 200–111 000)15 300 (10 100–18 700)HIV non infetto294000 (192000-366000)145000 (94500-179000)5700 (3500-7700)36 700 (24 100–44 800)4800 (3100–6100)87 200 (56 400–110 000)15 200 (10.000-18.600)Infettati da HIV23300 (15.300-28.700)21400 (14.100-26.300)<100400 (200-500)<1001300 (800-1600)<100Pneumonia da Pneumococco Tasso di incidenza1356 (1170-1612)1504 (1298–1788)342 (295–406)1214 (1047–1443)187 (161–222)2432 (2098–2891)831 (717–987)Severe535 (401-609)585 (438-667)135 (101-154)475 (356-541)121 (91-138)954 (715-1089)326 (244-372)Casi8910000 (769000000-10600000)2360000 (2 040 000–2 810 000)251 000 (217 000–299 000)951 000 (820 000–1 130 000)104 000 (89 600–123 000)4 280 000 (3 690 000–5080000)969000 (836000-150000-150000)Severo3520700 (2640640000–4 010 000)919 000 (689 000–1 050 000)99 400 (74 500–113 000)372 000 (278 000–424 000)67 300 (50 400–76 800)1 680 000 (1260000-1910000)380000 (285000-433000)CFR3% (2-3)6% (46)2% (1-2)3% (2-3)4% (3-4)2% (1-2)1% (1-1)Grave7% (5-7)15% (11-15)5% (3-5)8% (6-9)6% (4-6)4% (3-4)3% (2-3)Tasso di mortalità36 (26-38)76 (54-79)6 (4-6)39 (28-41)7 (5-7)39 (28-40)10 (7-10)Morti257000 (182000-268000)137000 (96900–142 000)4600 (3200–4800)31 000 (22 000–32 300)3800 (2700–4000)69 200 (49100-72100)11600 (8200-12100)HIV non infetto238000 (169000-248 000)119 000 (84 300–124 000)4500 (3200–4700)30 700 (21 800–32 000)3800 (2700-4000)68200 (48400-71100)11600 (8200-12000)HIV19300 (13 700–20 100)17 800 (12 600–18 600)<100300 (200–300)<1001000 (700–1000)<100Meningite da pneumococco Tasso di incidenza13 (5-26)21 (9-45)3 (1-7)10 (4-21)4 (2-8)15 (6-31)10 (5-15)Casi83900 (36100-169000)29400 (11800-6262300)2300 (900–5000)7900 (3200–16 500)2200 (1000–4200)26 100 (11 200–52 900)11400 (6300-18000)CFR44%(18-93)61%(24-100)27%(8-70)52%(21-100)25%(10-50)39%(16-79)17%(8-30)Tasso di mortalità5 (2-11)13 (5-28)1 (0-2)5 (2-11)1 (0-2)6 (2-12)2 (1-3)Morti37900 (15400-79700)20400 (8000-43700)600 (200-1600)4200 (1600-8900)600 (200-1100)10200 (4300-20800)1900 (1000-3500)HIV non infetto35200 (14 300–73 800)17 900 (7000–38 300)600 (200–1600)4100 (1600–8800)550 (200–1100)10100 (4300-20500)1900 (1000-3500)Infetto da HIV2700 (1100-5900)2500 (1000-5400)<100<100<100200 (100-300)<100Pneumococco NPNMIncidenza50 (22-100)77 (31-164)13 (5-28)37 (15-78)17 (7-32)62 (27-127)41 (22-64)Severe11 (5-22)13 (5-27)4 (1-8)6 (2-13)5 (2-9)17 (7-35)11 (6-18)Non grave39 (17-78)64 (26-137)9 (4-21)31 (12-64)12 (5-23)45 (19-92)30 (16-47)Casi326000 (14200000-653000)122000 (49000-257 000)9500 (3600–21 000)29 000 (12 000–60 900)9300 (4200–18 000)110 000 (47100-223000)47500 (26000-75000)Severo73400 (32400-145 000)20 500 (8400–42 800)2600 (1000–5700)4900 (1900–10 400)2500 (1100–4800)29900 (12800-60700)13000 (7100-20500)Non grave253000 (109000–510 000)101 000 (41 000–215 000)6900 (2600–15 000)24 000 (9600–50 500)6700 (3000–13 000)79 900 (34 300–162 000)34 500 (19 000–54 500)CFR§ 31%(13-63)44%(17-94)21%(6-55)38%(14-82)19%(8-39)30%(13-62)13%(7-24)Tasso di mortalità3 (1-7)5 (2-11)1 (0-2)2 (1-5)1 (0-2)5 (2-10)1 (1-3)Morti22700 (9400–47 200)9000 (3600–19 100)600 (200–1400)1900 (700–4100)500 (200–1000)9100 (3800-18400)1700 (900-3100)HIV non infetto21500 (8800-44500)7900 (3100-16800)600 (200-1400)1900 (700-4000)500 (200-1000)8900 (3800-18100)1700 (900-3100)HIV infetto1300 (500-2700)1100 (400-2300)<100<100<100100 (100-300)<100I dati sono stime (intervallo di incertezza). I tassi di mortalità e di incidenza sono per 100000 bambini. Le stime di morbilità (cioè i tassi di incidenza e i casi) includono i bambini indipendentemente dall’infezione da HIV. Le stime di mortalità (cioè, tassi di mortalità, decessi e CFR) non includono i bambini affetti da HIV, salvo dove specificato. CFR = rapporto tra casi e mortalità. Pneumococco=Streptococco polmonare. NPNM=non polmonite non polmonare, non meningite.*Derivato da UN World Population Prospect 2015.†Dati del Gruppo interagenzie ONU per la stima della mortalità infantile 2015.‡Dalla stima dell’epidemiologia materno-infantile / stime di collaborazione OMS.14§Solo per il NPNM.
Alla fine del 2015, 129 paesi utilizzavano PCV. I decessi per pneumococco sono diminuiti in modo più marcato tra il 2010 e il 2015, quando la riduzione media annua è stata dell’8%, rispetto a solo il 3% dal 2000 al 2010. Dopo il 2010, 52 Paesi idonei al Gavi – molti dei quali con il più alto carico di malattie da pneumococco – hanno introdotto il PCV nei loro programmi nazionali di immunizzazione. Abbiamo stimato che il PCV ha evitato 250.000 decessi cumulativi dovuti a pneumococco dal 2000 al 2015, con oltre il 95% di essi evitati dopo il 2010. Un’analisi di sensibilità suggerisce che il nostro aggiustamento per la sostituzione del sierotipo per il PCV7 potrebbe sopravvalutare i decessi evitati di 3100 decessi. Tuttavia, il totale dei decessi per pneumococco tra i bambini non infetti da HIV di età compresa tra 1-59 mesi è rimasto sostanziale nel 2015, rappresentando almeno l’11% (UR 7-13) di tutta la mortalità in quella fascia d’età.
La percentuale aggiornata della polmonite confermata dalla radiografia attribuibile al pneumococco prima di contabilizzare la vaccinazione, che comprendeva i dati di due studi aggiuntivi24, 25 è stata stimata al 34% (UR 24-36). La nostra analisi di sensibilità utilizzando l’efficacia del vaccino di AOM ha rilevato che la percentuale potrebbe arrivare al 51% (15-87). Ciò presuppone che l’efficacia del PCV contro la polmonite da pneumococco di tipo vaccino sia bassa quanto l’efficacia del PCV contro lo pneumococco di tipo vaccino AOM. Inoltre, la nostra seconda analisi di sensibilità ha mostrato che la percentuale di polmonite confermata dalla radiografia causata da pneumococco potrebbe essere del 65% (16-86) se il rapporto tra l’efficacia del PCV contro la polmonite da pneumococco di tipo vaccino e quella della malattia da pneumococco invasiva di tipo vaccino nei bambini è simile a quello osservato tra la popolazione anziana olandese.34 Forniamo stime della mortalità per polmonite da pneumococco specifiche per ogni paese utilizzando questi parametri di sensibilità in appendice (pp 146-174).
India (68700 morti, UR 44600-86100), Nigeria (49000 morti, 32400-59000), Repubblica Democratica del Congo (14500 morti, 9300-18700), e il Pakistan (14400 morti, 9700-17000) ha avuto il maggior numero e ha rappresentato la metà di tutti i decessi per pneumococco nei bambini sieropositivi nel 2015 (figura 3), ma solo il 29% della popolazione mondiale di età compresa tra 1 e 59 mesi. Tra i Paesi a basso e medio reddito, il Ruanda (93%), il Perù (90%), El Salvador (89%) e il Brasile (88%) hanno avuto le maggiori riduzioni relative di decessi per pneumococco dal 2000 al 2015 (appendice pp. 36-71). Il Ruanda e il Perù hanno introdotto il PCV nel 2009 e El Salvador e il Brasile hanno introdotto il PCV nel 2010. Il Ciad (296, UR 193-367), la Somalia (294, 184-386) e l’Angola (216, 148-248) hanno avuto i tassi di mortalità da pneumococco più alti per 100.000 bambini di età compresa tra 1 e 59 mesi.Grafico 3Tassi di mortalità specifici per paese e decessi attribuibili al pneumococco nel 2015I tassi di mortalità e i decessi nei bambini di età compresa tra 1 e 59 mesi sono solo decessi HIV-negativi. I tassi di mortalità sono i decessi per 100.000 bambini di età compresa tra 1 e 59 mesi. Pneumococco=Streptococco polmonare.
Abbiamo stimato 8-9 milioni di casi (UR 7-7 milioni-10-6 milioni) di polmonite clinica da pneumococco, indipendentemente dallo stato dell’HIV, nel 2015 – una riduzione del 37% da 14-2 milioni di casi (12-3 milioni-16-9 milioni) nel 2000. Abbiamo anche stimato 3-5 milioni di casi (2-6 milioni-4-0 milioni) di polmonite da pneumococco grave nel 2015, una riduzione da 5-6 milioni di casi (4-2 milioni-6-4 milioni) nel 2000. Abbiamo anche stimato 83900 casi (36100-169000) di meningite da pneumococco nel 2015 nei bambini indipendentemente dallo stato HIV, fornendo un tasso di incidenza globale di 13 casi (5-26) ogni 100000 bambini di età compresa tra 1 e 59 mesi. I casi di meningite da pneumococco e i decessi stimati per il 2000 utilizzando i nostri modelli aggiornati erano molto simili alle stime pubblicate in precedenza.1 Lo pneumococco NPNM ha contribuito a 326000 casi (142000-653000) nel 2015, di cui il 22% gravi (tabella 1).
Per quanto riguarda l’Hib, abbiamo stimato che ci sono stati 29500 (UR 18400-40700) decessi per Hib in bambini sieropositivi di età compresa tra 1-59 mesi nel 2015, tutti stimati in bambini di età compresa tra 1-23 mesi. Si stima che l’Hib abbia contribuito a meno di 1000 ulteriori decessi in bambini infettati dall’HIV (tabella 2). Dei decessi di Hib nei bambini non infetti da HIV nel 2015, il 76% era dovuto a polmonite, il 24% a meningite e meno dell’1% a NPNM (tabella 2). I decessi per Hib sono diminuiti del 90% (78-96) rispetto al 2000, quando si stimavano 299000 decessi (186000-412000) nei bambini sieropositivi (grafico 2). La sostanziale diminuzione della mortalità per Hib corrisponde ad un aumento del numero di paesi che utilizzano il vaccino Hib tra il 2000 (n=60) e il 2015 (n=192). Abbiamo stimato che il vaccino Hib ha evitato circa 1-2 milioni di decessi totali dal 2000 al 2015, senza contare i decessi Hib evitati nei bambini sieropositivi.Tabella 2Morbilità e mortalità dell’Hib nel 2015, per sindrome e regione dell’OMSGlobalAfricaAfricaAmericaMediterraneo orientaleEuropaEuropaSud-Est asiatico-Pacifico occidentaleParametrie della popolazioneBambini di età 1-59 mesi*6571271273991571671674867355116778313313066556810271757952911166191919363Morti† 3260731183533151062314282879160540664465165165389Morti di polmonite ‡ 7611933953954311956011111895104545318822936243Morti di meningite‡ 11517365735275613801151515269554388Totale Hib onere Tasso di incidenza148 (132-242)75 (67-122)8 (7-12)41 (37-67)58 (51-95)238 (212-388)317 (283-518)Grave52 (30-102)16 (9-31)2 (1-3)8 (5-16)20 (12-40)121 (70-240)71 (41-138)Casi975000 (870000-1590000)117000 (105 000–192 000)5500 (4900–9100)32 000 (28 800–52 200)32 100 (28 400–52 900)418 000 (372000-682000)370000 (33100000-605000)Severo340000 (196000-669000)24800 (13900-48 600)1200 (700–2400)6500 (3700–12 900)11 300 (6500–22 400)213 000 (124 000–422 000)82 800 (47900-161000)Tasso di mortalità4 (3-6)5 (3-7)0 (0-0)1 (1-2)1 (0-1)1 (0-1)9 (6-13)3 (2-4)Morti29800 (18600–41 100)8000 (4900–11 000)200 (100–200)1000 (600–1500)300 (200–500)16 500 (10 300–22 700)3800 (2500–5200)HIV non infetto29500 (18400-40700)7700 (4700-10700)200 (100-200)1000 (1000-1500)300 (200-500)16500 (10300-22600)3800 (2500-5200)HIV infetto300 (200-400)200 (100-300)<100<100<100<100<100<100<100Hib pneumonia Tasso di incidenza142 (130-232)72 (66-118)7 (7-12)40 (37-65)54 (50-89)228 (208-372)302 (276-494)Severe45 (27-92)13 (8-27)1 (1-3)8 (4-15)17 (10-34)111 (67-224)56 (34-114)Casi934000 (852000-1530000)114000 (100000-186 000)5300 (4900–8700)31 000 (29 000–51 200)30 000 (28 000–49 000)400 000 (366 000–654 000)353000 (320000-576000)Severo298000 (17900000-602000)21000 (13000-42500)1000 (600-2000)5900 (3500-11900)9400 (5600-19000)195000 (117000-395000)65700 (39000-133000)CFR2% (2-3)5% (4-7)2% (2-3)2% (2-3)1% (1-1)3% (2-4)1% (1-1)Grave8% (5-10)28% (20-37)12% (9-16)13% (9-17)3% (2-3)6% (4-8)5% (3-6)Tasso di mortalità3 (2-4)4 (3-5)0 (0-0)1 (1-1)0 (0-1)0 (0-1)7 (5-9)3 (2-4)Morti22600 (15900–29 700)6000 (4200–7900)100 (100–200)800 (500–1000)200 (200–300)12 300 (8700–16 200)3100 (2200–4100)HIV non infetto22400 (15700-29400)5800 (4100-7600)100 (100-200)800 (500-1000)200 (200-300)12300 (8700-1616200)3100 (2200-4100)HIV infetto200 (100-300)200 (100-200)<100<100<100<100<100<100<100Hib tasso di incidenza della meningite5 (2-8)2 (1-3)0 (0-0)1 (0-1)3 (1-5)8 (3-12)11 (6-18)Casi31400 (13400-50800)3200 (1100-5200)200 (100-300)500 (100-800)1400 (600-2600)13200 (5100-20500)12900 (6400-21500)CFR19%(7-29)61%(20-98)30%(7-51)54%(16-89)5%(2-9)32%(12-49)5%(2-8)Tasso di mortalità1 (0-2)1 (0-2)0 (0-2)0 (0-0)0 (0-1)0 (0-0)2 (1-4)1 (0-1)Morti7200 (2700-11300)2000 (600-3100)<100300 (100-400)<1004200 (1600-6500)700 (300-1100)HIV non infetto7100 (2700-11200)1900 (600-3100)<100300 (100-400)<1004200 (1600-6400)700 (300-1100)HIV infetto<100<100<100<100<100<100<100<100<100<100<100Hib NPNMIncidence rate§ 2 (1-2)0 (0-1)0 (0-0)0 (0-0)0 (0-0)1 (0-2)3 (1-4)4 (2-6)Casi10000 (4300-16200)600 (200-1000)<100100 (0-200)500 (200-900)4400 (1700-6800)4300 (2200-7300)CFR0% (0-1)1% (1-2)0% (0-2)0% (0-2)1% (0-2)0% (0-0)1% (0-1)0% (0-0)Tasso di mortalità0 (0-0)0 (0-0)0 (0-0)0 (0-0)0 (0-0)0 (0-0)0 (0-0)0 (0-0)0 (0-0)0 Morti<100<100<100<100<100<100<100<100<100<100<100100<100HIV non infetto<100<100<100<100<100<100<100<100<100<100<100HIV infetto<100<100<100<100<100<100<100<100<100Dati sono stime (intervallo di incertezza). I tassi di mortalità e di incidenza sono per 100000 bambini. Le stime di morbilità (cioè i tassi di incidenza e i casi) includono i bambini indipendentemente dall’infezione da HIV. Le stime di mortalità (cioè, tassi di mortalità, decessi e CFR) includono solo i bambini affetti da HIV, a meno che non sia specificato. CFR = rapporto tra casi e mortalità. NPNM=non polmonite, non meningite. Hib=Haemophilus influenzae tipo b.*Derivato da UN World Population Prospect 2015.†Dati del gruppo interagenzie ONU per la stima della mortalità infantile 2015.‡Dalla stima dell’epidemiologia infantile materna/stime di collaborazione con l’OMS.14
Circa l’82% di tutti i decessi per Hib in bambini non infetti da HIV nel 2015 (24200 morti, UR 15000-33400) si è verificato nelle regioni dell’Africa e del Sud-Est asiatico (grafico 4), che insieme rappresentavano il 51% della popolazione infantile in quell’anno. Le maggiori riduzioni dei decessi di Hib dal 2000 al 2015 sono state osservate nel Mediterraneo orientale (97%) e nelle Americhe (96%; appendice pp 72-107). I Paesi con il maggior numero di decessi totali di Hib (esclusi quelli dei bambini sieropositivi) nel 2015 sono stati l’India (15600 morti, 9800-21500), la Nigeria (3600 morti, 2200-5100), la Cina (3400 morti, 2300-4600) e il Sud Sudan (1000 morti, 600-1400). I tassi di mortalità Hib più elevati stimati per 100.000 bambini di età compresa tra 1 e 59 mesi nel 2015 sono stati registrati in Sud Sudan (54, UR 33-75), Guinea Equatoriale (43, 28-58) e Somalia (26, 14-37) (grafico 4).Grafico 4Tassi di mortalità e decessi specifici per paese e decessi attribuibili all’Hib nel 2015I tassi di mortalità e i decessi nei bambini di età compresa tra 1 e 59 mesi sono solo decessi HIV-negativi. I tassi di mortalità sono i decessi per 100.000 bambini di età compresa tra 1 e 59 mesi. Hib=Haemophilus influenzae tipo b.
Ci sono stati 0-9 milioni di casi stimati (UR 0-9 milioni-1-5 milioni) di polmonite clinica da Hib nel 2015, indipendentemente dallo stato dell’HIV. Di questi, 298000 casi (179000-602000) sono stati stimati come polmonite grave. Supponendo che tutti i decessi per polmonite da Hib siano stati tra i casi gravi, il CFR globale dedotto è stato dell’8% (5-10) nel 2015 per i bambini non infetti da HIV. Abbiamo stimato 31400 casi (13400-50800) di meningite Hib nei bambini nel 2015, inclusi tutti i bambini indipendentemente dallo stato HIV, corrispondenti a un’incidenza globale di 5 casi (2-8) di meningite Hib su 100000 bambini di età compresa tra 1 e 59 mesi. La meningite globale Hib CFR, solo tra i bambini non infetti da HIV, è diminuita di quasi la metà tra il 2000 e il 2015, passando dal 44% (18-68) nel 2000 al 23% (9-36) nel 2015. Abbiamo anche stimato 10.000 casi gravi (4300-16200) di Hib NPNM nel 2015.

Figura 2.Decessi dovuti a pneumococco e Hib nei bambini di età compresa tra 1 e 59 mesiI decessi per pneumococco e Hib nei bambini di età compresa tra 1 e 59 mesi dal 2000 al 2015 sono solo decessi HIV-negativi. Le stime della copertura vaccinale dell’OMS/UNICEF sono state adeguate per rappresentare la percentuale di bambini di 1-59 mesi che hanno ricevuto il vaccino PCV e Hib. Le barre verticali indicano intervalli di incertezza. Pneumococco=Streptococco polmonare. Hib=Haemophilus influenzae tipo b.
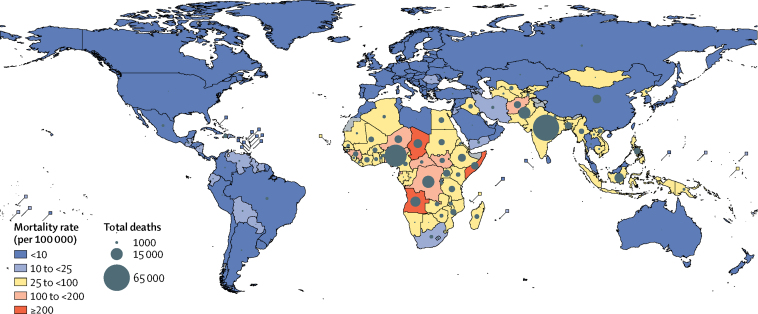
Figura 3.Tassi di mortalità specifici per paese e decessi attribuibili allo pneumococco nel 2015I tassi di mortalità e i decessi nei bambini di età compresa tra 1 e 59 mesi sono solo decessi HIV-negativi. I tassi di mortalità sono i decessi per 100.000 bambini di età compresa tra 1 e 59 mesi. Pneumococco=Streptococco polmonare.
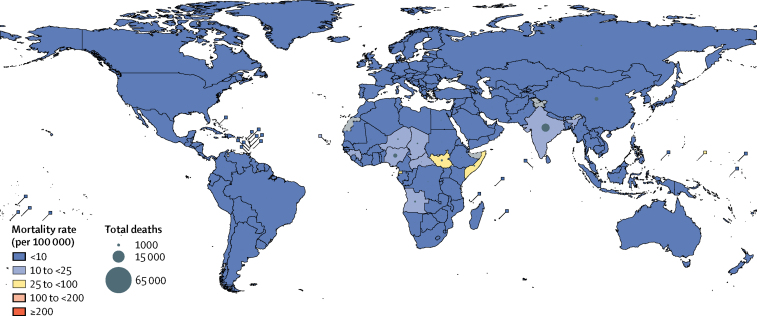
Figura 4.Tassi di mortalità e decessi specifici per paese attribuibili a Hib nel 2015I tassi di mortalità e i decessi nei bambini di età compresa tra 1 e 59 mesi sono solo decessi HIV-negativi. I tassi di mortalità sono i decessi per 100.000 bambini di età compresa tra 1 e 59 mesi. Hib=Haemophilus influenzae tipo b.
Discussione
A nostra conoscenza, presentiamo le prime stime complete (cioè, polmonite, meningite e NPNM) a livello nazionale del carico di pneumococco e della malattia di Hib a partire dalle stime1, 2 per l’anno 2000 pubblicate nel 2009, nonché le prime stime complete a livello regionale e globale del carico di questi agenti patogeni da quando sono state aggiornate per il 2008.3 Abbiamo stimato che i decessi per pneumococco e Hib nei bambini sono diminuiti sostanzialmente nell’era dei vaccini coniugati.
La maggior parte dei decessi per pneumococco e Hib nel 2015 è stata limitata a pochi paesi in Africa e in Asia. Abbiamo stimato che quattro Paesi (India, Nigeria, Cina e Sud Sudan) hanno avuto più di 1000 morti per Hib nel 2015. L’India e la Nigeria hanno introdotto il vaccino Hib rispettivamente nel 2011 e nel 2012; tuttavia, la copertura nazionale stimata in entrambi i Paesi è stata relativamente bassa (cioè <50%) in seguito. Il Sud Sudan ha introdotto il vaccino Hib nel 2014. I decessi per Hib in questi Paesi probabilmente diminuiranno con l’aumento della copertura del vaccino Hib. La Cina è rimasta uno dei tre paesi che non hanno introdotto il vaccino Hib entro il 2015, insieme alla Thailandia e alla Russia. Allo stesso modo, la metà dei decessi per pneumococco nel 2015 sono stati limitati a soli quattro paesi in Africa e Asia (India, Nigeria, Repubblica Democratica del Congo e Pakistan). Il Pakistan e la Repubblica Democratica del Congo hanno introdotto il PCV nel 2012. La Nigeria ha iniziato l’immunizzazione di routine con il PCV nel 2014 e l’India ha iniziato l’uso di routine in tre Stati nel 2017. I progressi verso la prevenzione dei decessi da pneumococco in questi Paesi accelereranno la riduzione globale dei decessi da pneumococco.
La distribuzione sindromica dei decessi per pneumococco e Hib è stata dominata dalla polmonite, sottolineando che le stime del carico di malattia per questi agenti patogeni sono altamente sensibili ai cambiamenti nei decessi per polmonite di tutte le cause, che sono un valore di input indipendente nei nostri modelli specifici per gli agenti patogeni. Data la bassa sensibilità dei test diagnostici per determinare le cause batteriche della polmonite, abbiamo continuato a utilizzare l’approccio della sonda per determinare la frazione di casi di polmonite causata da pneumococco e Hib. 1, 2 La nostra stima aggiornata dei casi di polmonite confermata dalla radiografia attribuibili a pneumococco è simile ai valori stimati nei modelli precedenti. L’utilizzo di questo valore come proxy della percentuale di decessi per polmonite attribuibili a ciascun agente patogeno implica intrinsecamente che il CFR per la polmonite da pneumococco confermato dalla radiografia è equivalente al CFR per la polmonite Hib confermata dalla radiografia e che sono uguali al CFR per le altre cause di polmonite confermata dalla radiografia. A livello globale, si stima che la maggior parte (81%) dei decessi per polmonite si verifichi nella comunità,39 presumibilmente con scarso accesso ad antibiotici efficaci. In tali contesti, è probabile che il CFR della polmonite batterica sia sostanzialmente superiore a quello della polmonite non batterica, rivelando che il nostro metodo proxy contribuisce a sottovalutare i decessi per pneumococco e polmonite Hib in contesti di basso accesso alle cure – gli stessi contesti che rappresentano il maggior carico di decessi per polmonite.
Abbiamo usato l’efficacia della malattia da pneumococco invasivo di tipo vaccino come proxy dell’efficacia della polmonite da pneumococco di tipo vaccino quando abbiamo determinato la proporzione di morti per polmonite causate da pneumococco nell’approccio della sonda. Questa scelta porta probabilmente a sottovalutare il contributo dello pneumococco ai decessi da polmonite e quindi abbiamo considerato diverse alternative. Sulla base dell’analisi di sensibilità che utilizza l’efficacia dell’AOM di tipo vaccino come valore di riferimento per l’efficacia della polmonite da pneumococco di tipo vaccino, i decessi da polmonite da pneumococco potrebbero essere fino al 51% superiori a quelli stimati dal modello di base. Tuttavia, questi risultati devono essere affrontati con cautela, poiché è improbabile che l’efficacia contro la polmonite da vaccino di tipo AOM rifletta l’efficacia contro la polmonite da pneumococco di tipo vaccino. Uso dell’efficacia contro la polmonite da pneumococco non batterica di tipo vaccino in una popolazione olandese anziana34 come relativa proxy, la stima dei decessi per polmonite da pneumococco nei bambini è il doppio di quella stimata dal nostro modello di base. Questo metodo presuppone che l’efficacia relativa del vaccino contro la polmonite da pneumococco batterica e non batterica nelle persone anziane rifletta lo stesso rapporto nei bambini. Tuttavia, ci sono poche prove a sostegno di questa affermazione. Inoltre, se il test dell’antigene delle urine utilizzato per identificare i casi di polmonite da pneumococco non battericaemica nello studio olandese rileva anche l’antigenuria sulla base della colonizzazione nasofaringea da pneumococco di tipo vaccino, il valore di efficacia osservato in tale studio potrebbe riflettere un contributo dell’efficacia del vaccino contro la colonizzazione nasofaringea con pneumococco di tipo vaccino, che sarebbe probabilmente inferiore alla stima dell’efficacia della polmonite da pneumococco di tipo vaccino vero e proprio.34 I limiti associati a queste analisi di sensibilità hanno contribuito alla nostra decisione di utilizzare l’efficacia della malattia pneumococco invasiva di tipo vaccino nel modello di base.
Fino a quando non saranno disponibili approcci diagnostici altamente specifici per la polmonite da pneumococco non batterica di tipo vaccino nei bambini, la validità di queste analisi di sensibilità rimarrà poco chiara. Ciononostante, esse sottolineano che le nostre stime di base-case sono molto probabilmente sottovalutate, probabilmente anche del 100%. La nostra decisione in merito a quale analisi di base-case utilizzare è stata informata anche attraverso la consultazione di esperti esterni e una revisione degli studi sull’impatto del PCV con i risultati della polmonite clinica in diversi contesti ad alto e medio reddito (appendice pagg. 22-23). Laddove la selezione dei parametri non poteva essere basata su prove chiare, abbiamo errato sul lato dell’essere conservatori nel nostro approccio (cioè, prendere decisioni che avrebbero portato ad una sottostima del carico di malattia). Man mano che le prove continuano ad accumularsi, rivisiteremo le ipotesi del modello di base. Abbiamo fornito i risultati delle stime della polmonite da pneumococco a livello nazionale utilizzando le analisi di sensibilità in appendice (pagg. 146-74) per fornire un accesso completo alla gamma di possibili stime del carico di malattia per ciascun Paese. Le stime del carico di malattia da polmonite da pneumococco recentemente riportate per il 2015 dall’Institute for Health Metrics and Evaluation (IHME) Global Burden of Disease collaboration utilizzano il valore di efficacia della polmonite da pneumococco di tipo vaccino nelle persone anziane nel loro modello di base.40 Di conseguenza, i decessi per polmonite da pneumococco stimati dall’IHME circa 393000 nei bambini di età compresa tra 1 e 59 mesi sono superiori a quelli qui presentati.
Abbiamo preparato stime annuali del carico di pneumococco e della malattia di Hib dal 2000 al 2015, consentendoci di fare confronti con le stime pubblicate in precedenza. In precedenza abbiamo stimato 735000 decessi per pneumococco1 e 363000 decessi per Hib nel 2000 in bambini non infetti da HIV.2 A titolo di confronto, abbiamo stimato 600.000 decessi per pneumococco e 299.000 decessi per Hib nel 2000, esclusi i bambini sieropositivi, utilizzando metodi aggiornati e nuovi dati. Abbiamo osservato differenze simili confrontando le attuali stime di mortalità con quelle del 2008,3 che sono stati generati utilizzando il modello originale con valori di input aggiornati. Le UR specifiche del patogeno per le stime del carico di malattia per gli anni 2000 e 2008, provenienti dai metodi attuali e da quelli pubblicati in precedenza, si sovrappongono in modo sostanziale. Inoltre, la nostra convalida per le malattie da pneumococco (appendice p 177) suggerisce che le nostre stime del carico di malattia da pneumococco sono probabilmente sottostimate, ma entro i limiti della fiducia. Non siamo stati in grado di convalidare la plausibilità dei nostri casi di Hib e dei decessi perché non abbiamo trovato nessun altro studio che quantificasse in modo indipendente il carico di lavoro per la scarsa sensibilità diagnostica.
La mortalità infantile è diminuita in quasi tutti i paesi a basso e medio reddito a seguito di interventi vaccinali e non vaccinali. 41, 42 Mentre questa tendenza continua, la morbilità associata alle malattie infantili, che è meno colpita dagli interventi non vaccinali, avrà un ruolo sempre più importante nella pianificazione dei programmi e nella definizione delle politiche. Abbiamo preparato stime specifiche per paese di malattie gravi e non gravi associate a pneumococco e Hib, che possono essere utilizzate per questi scopi.
La disponibilità di stime di mortalità per meningite a causa di tutte le cause ci ha permesso di passare da un modello basato sull’incidenza a un modello proporzionale. La motivazione di questo spostamento era di assicurare che qualsiasi stima della mortalità per meningite specifica del patogeno fosse intrinsecamente legata alla mortalità totale della meningite. La somma delle stime della mortalità specifica del patogeno derivata dai dati di incidenza potrebbe teoricamente superare il numero totale di morti per meningite. Inoltre, se la sensibilità dei test diagnostici della meningite è ragionevolmente simile per ciascun agente patogeno, utilizzando una distribuzione relativa degli agenti patogeni (cioè il nostro metodo basato sulle proporzioni) potrebbe essere meno probabile sottovalutare il carico specifico della meningite. Non siamo stati in grado di spiegare i focolai di meningite da pneumococco, che potrebbero portare a sottostimare il carico della malattia, in particolare nei paesi dell’Africa subsahariana. Per fornire il contesto della morte per meningite specifica per eziologia e le stime dei casi derivate dal metodo basato sulle proporzioni, abbiamo anche stimato la mortalità e la morbilità della meningite da pneumococco e da Hib utilizzando il modello basato sull’incidenza (appendice pagg. 175-76).
I nostri modelli di meningite specifica del patogeno e NPNM si basano sui dati di una revisione sistematica della letteratura degli studi pubblicati tra il 1990 e il 2014. Per l’approccio basato sulle proporzioni, abbiamo utilizzato studi che sono stati condotti prima dell’introduzione di qualsiasi vaccino coniugato. Poiché la maggior parte dei Paesi (n=192) utilizzava il vaccino Hib alla fine del 2015, abbiamo previsto che pochissimi studi aggiuntivi avrebbero fornito dati. Per valutare il peso del pneumococco e della malattia di Hib in futuro saranno necessari metodi che non si basano su dati dell’era precedente all’introduzione del vaccino Hib.
Il nostro modello potrebbe aver sovrastimato l’impatto della vaccinazione nei bambini, in particolare per il PCV, a causa della limitata disponibilità di dati. Utilizziamo i dati di copertura vaccinale specifici per paese dell’OMS e dell’UNICEF. I dati di copertura riportati sono stati osservati per sottostimare e sovrastimare la copertura. Quest’ultima è più probabile che si verifichi quando le stime sono basate su dati amministrativi.43 Di conseguenza, il nostro modello potrebbe aver sovrastimato l’impatto della vaccinazione. Le stime della copertura vaccinale nazionale possono anche mascherare le disparità di copertura regionali e locali. Se le persone a rischio di malattia, indipendentemente dal fatto che abbiano ricevuto il vaccino, vengono raggiunte in modo differenziato dai programmi di vaccinazione, il nostro modello sovrastimerà l’effetto della vaccinazione. Abbiamo anche ipotizzato che la sostituzione del sierotipo per la polmonite da pneumococco si verifichi con la stessa frequenza della malattia da pneumococco invasiva. Non siamo stati in grado di rendere conto della sostituzione del sierotipo anche nei paesi in cui il PCV10 o il PCV13 sono stati usati abitualmente. Probabilmente abbiamo sovrastimato l’impatto del vaccino in entrambi i casi. Tuttavia, la misura in cui l’impatto del vaccino è sopravvalutato in uno di questi casi rimane sconosciuta. È importante notare che il vaccino PCV e il vaccino Hib probabilmente forniscono protezione ad altre fasce d’età non incluse in questa analisi.
Queste stime non devono essere interpretate come una fonte primaria di dati sull’impatto del vaccino e non possono essere utilizzate per convalidare l’impatto del vaccino misurato direttamente sul campo, poiché i nostri modelli si basano su ipotesi di efficacia ed efficacia del vaccino per stimare l’impatto del vaccino. Tuttavia, i nostri risultati possono essere utilizzati per sottolineare gli sforzi di diverse organizzazioni che lavorano per ampliare l’accesso a questi vaccini. Le nostre stime modellate suggeriscono una riduzione accelerata del carico di pneumococco negli anni successivi al 2010, quando Gavi ha lanciato l’Advanced Market Commitment per PCV, un meccanismo di finanziamento per lo sviluppo di nuovi vaccini.44 La disponibilità di finanziamenti per il PCV nei Paesi a basso e medio reddito con il più alto carico di malattia ne ha accelerato l’adozione e quindi la riduzione dei decessi per pneumococco.
La polmonite specifica del patogeno e i decessi per meningite sono limitati dalle stime di tutti i casi di polmonite e meningite prodotte dalla collaborazione OMS/MCEE.16 Dato che pochi decessi si verificano in paesi con adeguati sistemi di registrazione vitale, queste stime si basano in gran parte sui dati dell’autopsia verbale. Il potenziale di errori di classificazione e altre sfide associate agli studi sull’autopsia verbale, in particolare per sindromi non specifiche come la polmonite, sono state ampiamente descritte. 45, 46 Data la dipendenza delle attuali stime della mortalità specifica per agente patogeno dalle morti per polmonite e meningite, i progressi nel migliorare la fiducia nelle stime delle cause di morte in contesti di elevata mortalità infantile influirebbero positivamente anche sulle stime specifiche per agente patogeno.
Anche se abbiamo tenuto conto dell’aumento del rischio di pneumococco e della malattia di Hib nei bambini infettati dall’HIV, abbiamo tenuto conto solo dell’uso della HAART tra i bambini infettati dall’HIV in 35 Paesi nel 2015. Gli studi hanno mostrato una marcata riduzione della malattia da pneumococco nei bambini di età inferiore ai 18 anni dopo l’uso diffuso della HAART.47 La mancata considerazione dell’uso di HAART in tutti i paesi porta probabilmente a una sovrastima del carico di pneumococco e della malattia di Hib nei bambini affetti da HIV. Inoltre, non siamo stati in grado di tenere conto dei bambini sieropositivi ma non infetti che sono a maggior rischio di morbilità e di mortalità a causa di una malattia pneumococcica invasiva.48 Oltre all’HIV, non siamo stati in grado di tenere conto di altri fattori di rischio sottostanti per le malattie batteriche invasive, tra cui l’infezione da malaria.49 e anemia falciforme.50 Abbiamo ipotizzato una copertura dello 0% di vaccino Hib per la Cina: il vaccino non è utilizzato nel programma nazionale di immunizzazione; tuttavia, in alcune città è stata segnalata una copertura relativamente alta di immunizzazione attraverso il settore privato. 51, 52 Non siamo riusciti a individuare una fonte affidabile di copertura vaccinale Hib per il paese. Anche se questo porterebbe a una sopravvalutazione della malattia, crediamo che coloro che avrebbero accesso al vaccino attraverso il settore privato sarebbero a minor rischio complessivo di malattia rispetto a coloro che non hanno accesso al vaccino. Nonostante queste limitazioni, crediamo che l’effetto netto delle nostre stime rimanga una sottostima del carico di malattia.
L’onere della malattia di Hib è in gran parte limitato a una manciata di paesi che non hanno iniziato, o hanno iniziato solo di recente, l’uso di routine del vaccino Hib. La malattia da pneumococco sta cominciando a diminuire in modo sostanziale in tutto il mondo, ma causa ancora un gran numero di morti e di casi. Il rimanente carico di malattia associato a questi due agenti patogeni giustifica sforzi sostenuti e intensificati, compresa l’introduzione del vaccino nei paesi che non l’hanno ancora introdotto e sforzi dedicati per migliorare la copertura, in particolare tra i bambini la cui situazione socio-economica li mette a rischio di un aumento del rischio di malattia.
References
- O’Brien KL, Wolfson LJ, Watt JP. Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: global estimates. Lancet. 2009; 374:893-902. PubMed
- Watt JP, Wolfson LJ, O’Brien KL. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years: global estimates. Lancet. 2009; 374:903-911. PubMed
- Publisher Full Text
- Publisher Full Text
- Murphy TV, White KE, Pastor P. Declining incidence of Haemophilus influenzae type b disease since introduction of vaccination. JAMA. 1993; 269:246-248. PubMed
- Adegbola RA, Secka O, Lahai G. Elimination of Haemophilus influenzae type b (Hib) disease from The Gambia after the introduction of routine immunisation with a Hib conjugate vaccine: a prospective study. Lancet. 2005; 366:144-150. PubMed
- Hammitt LL, Crane RJ, Karani A. Effect of Haemophilus influenzae type b vaccination without a booster dose on invasive H influenzae type b disease, nasopharyngeal carriage, and population immunity in Kilifi, Kenya: a 15-year regional surveillance study. Lancet Glob Health. 2016; 4:e185-e194. PubMed
- Pilishvili T, Lexau C, Farley MM. Sustained reductions in invasive pneumococcal disease in the era of conjugate vaccine. J Infect Dis. 2010; 201:32-41. PubMed
- Waight PA, Andrews NJ, Ladhani NJ, Sheppard CL, Slack MP, Miller E. Effect of the 13-valent pneumococcal conjugate vaccine on invasive pneumococcal disease in England and Wales 4 years after its introduction: an observational cohort study. Lancet Infect Dis. 2015; 15:629.
- von Gottberg A, de Gouveia L, Tempia S. Effects of vaccination on invasive pneumococcal disease in South Africa. N Engl J Med. 2014; 371:1889-1899. PubMed
- Lucero MG, Dulalia VE, Nillos LT. Pneumococcal conjugate vaccines for preventing vaccine-type invasive pneumococcal disease and X-ray defined pneumonia in children less than two years of age. Cochrane Database Syst Rev. 2009; 4
- Knoll M, O’Brien K, Henkle E. World Health Organization: Geneva; 2009.
- Feikin DR, Nelson CB, Watt JP, Mohsni E, Wenger JD, Levine OS. Rapid assessment tool for Haemophilus influenzae type b disease in developing countries. Emerg infect Dis. 2004; 10:1270-1276. PubMed
- United Nations Department of Economic and Social Affairs Population Division. United Nations: New York, NY; 2015.
- Stevens GA, Alkema L, Black RE. Guidelines for accurate and transparent health estimates reporting: the GATHER statement. PLoS Med. 2016; 13:e1002056. PubMed
- Liu L, Oza S, Hogan D. Global, regional, and national causes of under-5 mortality in 2000–15: an updated systematic analysis with implications for the Sustainable Development Goals. Lancet. 2016; 388:3027-3035. PubMed
- Black SB, Shinefield HR, Ling S. Effectiveness of heptavalent pneumococcal conjugate vaccine in children younger than five years of age for prevention of pneumonia. Pediatr Infect Dis J. 2002; 21:810-815. PubMed
- Black S, Shinefield H, Fireman B. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Pediatr Infect Dis J. 2000; 19:187-195. PubMed
- Hansen J, Black S, Shinefield H. Effectiveness of heptavalent pneumococcal conjugate vaccine in children younger than 5 years of age for prevention of pneumonia: updated analysis using World Health Organization standardized interpretation of chest radiographs. Pediatr Infect Dis J. 2006; 25:779-781. PubMed
- Madhi SA, Kuwanda L, Cutland C, Klugman KP. The impact of a 9-valent pneumococcal conjugate vaccine on the public health burden of pneumonia in HIV-infected and -uninfected children. Clin Infect Dis. 2005; 40:1511-1518. PubMed
- Klugman KP, Madhi SA, Huebner RE. A trial of a 9-valent pneumococcal conjugate vaccine in children with and those without HIV infection. N Engl J Med. 2003; 349:1341-1348. PubMed
- Cutts FT, Zaman SM, Enwere G. Efficacy of nine-valent pneumococcal conjugate vaccine against pneumonia and invasive pneumococcal disease in The Gambia: randomised, double-blind, placebo-controlled trial. Lancet. 2005; 365:1139-1146. PubMed
- Lucero MG, Nohynek H, Williams G. Efficacy of an 11-valent pneumococcal conjugate vaccine against radiologically confirmed pneumonia among children less than 2 years of age in the Philippines: a randomized, double-blind, placebo-controlled trial. Pediatr Infect Dis J. 2009; 28:455-462. PubMed
- Tregnaghi MW, Saez-Llorens X, Lopez P. Efficacy of pneumococcal nontypable Haemophilus influenzae protein D conjugate vaccine (PHiD-CV) in young Latin American children: a double-blind randomized controlled trial. PLoS Med. 2014; 11:e1001657. PubMed
- protein d conjugate vaccine against radiologically confirmed pneumonia. Interscience Conference on Antimicrobial Agents and Chemotherapy; Washington, DC, USA; Sept 5–9, 2014. G-295b (abstr).
- Mulholland K, Hilton S, Adegbola R. Randomised trial of Haemophilus influenzae type-b tetanus protein conjugate vaccine for prevention of pneumonia and meningitis in Gambian infants. Lancet. 1997; 349:1191-1217. PubMed
- Gessner BD, Sutanto A, Linehan M. Incidences of vaccine-preventable Haemophilus influenzae type b pneumonia and meningitis in Indonesian children: hamlet-randomised vaccine-probe trial. Lancet. 2005; 365:43-52. PubMed
- Baqui AH, El Arifeen S, Saha SK. Effectiveness of Haemophilus influenzae type B conjugate vaccine on prevention of pneumonia and meningitis in Bangladeshi children: a case-control study. Pediatr Infect Dis J. 2007; 26:565-571. PubMed
- Levine OS, Lagos R, Munoz A. Defining the burden of pneumonia in children preventable by vaccination against Haemophilus influenzae type b. Pediatr Infect Dis J. 1999; 18:1060-1064. PubMed
- Lagos R, Horwitz I, Toro J. Large scale, postlicensure, selective vaccination of Chilean infants with PRP-T conjugate vaccine: practicality and effectiveness in preventing invasive Haemophilus influenzae type b infections. Pediatr Infect Dis J. 1996; 15:216-222. PubMed
- WHO. World Health Organization: Geneva; 1991.
- WHO. World Health Organization: Geneva; 2005.
- Cherian T, Mulholland EK, Carlin JB. Standardized interpretation of paediatric chest radiographs for the diagnosis of pneumonia in epidemiological studies. Bull World Health Organ. 2005; 83:353-359. PubMed
- Bonten MJ, Huijts SM, Bolkenbaas M. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. N Engl J Med. 2015; 372:1114-1125. PubMed
- Publisher Full Text
- Russell F, Sanderson C, Temple B, Mulholland K. World Health Organization: Geneva; 2011.
- Johnson HL, Deloria-Knoll M, Levine OS. Systematic evaluation of serotypes causing invasive pneumococcal disease among children under five: the pneumococcal global serotype project. PLoS Med. 2010; 7:e1000348. PubMed
- Feikin DR, Kagucia EW, Loo JD. Serotype-specific changes in invasive pneumococcal disease after pneumococcal conjugate vaccine introduction: a pooled analysis of multiple surveillance sites. PLoS Med. 2013; 10:e1001517. PubMed
- Nair H, Simoes EA, Rudan I. Global and regional burden of hospital admissions for severe acute lower respiratory infections in young children in 2010: a systematic analysis. Lancet. 2013; 381:1380-1390. PubMed
- GBD LRI Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory tract infections in 195 countries: a systematic analysis for the Global Burden of Disease Study 2015. Lancet Infect Dis. 2017; 17:1133-1161. PubMed
- You D, Hug L, Ejdemyr S. Global, regional, and national levels and trends in under-5 mortality between 1990 and 2015, with scenario-based projections to 2030: a systematic analysis by the UN Inter-agency Group for Child Mortality Estimation. Lancet. 2015; 386:2275-2286. PubMed
- Walker CL, Rudan I, Liu L. Global burden of childhood pneumonia and diarrhoea. Lancet. 2013; 381:1405-1416. PubMed
- Murray CJ, Shengelia B, Gupta N, Moussavi S, Tandon A, Thieren M. Validity of reported vaccination coverage in 45 countries. Lancet. 2003; 362:1022-1027. PubMed
- Cernuschi T, Furrer E, Schwalbe N, Jones A, Berndt ER, McAdams S. Advance market commitment for pneumococcal vaccines: putting theory into practice. Bull World Health Organ. 2011; 89:913-918. PubMed
- Soleman N, Chandramohan D, Shibuya K. Verbal autopsy: current practices and challenges. Bull World Health Organ. 2006; 84:239-245. PubMed
- Chandramohan D, Setel P, Quigley M. Effect of misclassification of causes of death in verbal autopsy: can it be adjusted?. Int J Epidemiol. 2001; 30:509-514. PubMed
- Nunes MC, von Gottberg A, de Gouveia L. The impact of antiretroviral treatment on the burden of invasive pneumococcal disease in South African children: a time series analysis. AIDS. 2011; 25:453-462. PubMed
- von Mollendorf C, von Gottberg A, Tempia S. Increased risk for and mortality from invasive pneumococcal disease in hiv-exposed but uninfected infants aged <1 year in South Africa, 2009–2013. Clin Infect Dis. 2015; 60:1346-1356. PubMed
- Scott JA, Berkley JA, Mwangi I. Relation between falciparum malaria and bacteraemia in Kenyan children: a population-based, case-control study and a longitudinal study. Lancet. 2011; 378:1316-1323. PubMed
- Ramakrishnan M, Moisi JC, Klugman KP. Increased risk of invasive bacterial infections in African people with sickle-cell disease: a systematic review and meta-analysis. Lancet Infect Dis. 2010; 10:329-337. PubMed
- Lin T. 0–2 age children 2nd type vaccination rate analysis. Chinese Clinical Doctor. 2013; 5:43-45.
- Qing F, Gang WY, Lin C. District local and mobile children 1st and 2nd type vaccination situation survey and analysis. Applied Preventive Healthcare. 2015; 22:322-323.
Fonte
Wahl B, O’Brien KL, Greenbaum A, Majumder A, Liu L, et al. (2018) Burden of . The Lancet. Global Health 6(7): . https://doi.org/10.1016/S2214-109X(18)30247-X





