Dichiarazione di rilevanza
La percezione e l’azione riflettono il culmine di molteplici fasi di elaborazione. In gustazione, questi stadi e la loro sequenza sono sottovalutati. Mostriamo forti corrispondenze tra l’insorgenza della decodifica neurale e i tempi di risposta comportamentale, dimostrando che le differenze tra i giudizi gustativi si riflettono precocemente durante la codifica chemio-sensoriale, invece di essere il risultato di un’elaborazione cognitiva di livello superiore. Inoltre, troviamo che la sequenza di elaborazione della rilevazione e della discriminazione varia con il contrasto del gusto: la rilevazione precede la discriminazione per l’agro-salato, mentre entrambi i processi si verificano senza ritardo per l’agro-dolce, che varia nell’edonismo. Suggeriamo che le caratteristiche edoniche siano elaborate in parallelo ai calcoli puramente sensoriali con il potenziale di facilitare l’identificazione degli stimoli nella percezione del gusto, sostenendo il concetto di una sequenza flessibile di stati di codifica gustativa.
Introduzione
L’innata capacità di discriminare tra le categorie gustative di base (Cowart, 1981; Steiner et al., 2001) riflette l’imperativo ecologico del senso del gusto dei mammiferi e sottolinea il suo ruolo nel rilevamento dei nutrienti e nell’evitare sostanze nocive. Infatti, il gusto dolce indica la disponibilità di carboidrati, il gusto salato permette il rilevamento degli elettroliti, il gusto umami serve il riconoscimento delle proteine, mentre il gusto acido e amaro ci avvertono rispettivamente degli acidi e delle sostanze potenzialmente nocive come gli alcaloidi (Breslin, 2013).
Ogni categoria gustativa viene rilevata da specifici recettori, per lo più sulla lingua (Roper e Chaudhari, 2017), e le informazioni specifiche del gusto vengono trasdotte al tronco encefalico, arrivando infine a rappresentazioni corticali dissociabili (Katz et al., 2002; Schoenfeld et al., 2004; Pavao et al., 2014; Crouzet et al., 2015; Wallroth et al., 2018). Nonostante le descrizioni dettagliate dei siti periferici e centrali di elaborazione delle informazioni gustative, l’emergere della cascata di elaborazione del gusto, come l’individuazione e la discriminazione dei gusti, non è ancora compreso.
Le prime indagini sul comportamento del gusto umano hanno dimostrato che i gusti possono essere rilevati entro soli 200 ms (Lester e Halpern, 1979; Yamamoto e Kawamura, 1981), e che i giudizi gustativi più complessi come l’identificazione e la discriminazione richiedono 100-200 ms in più (per una panoramica, vedi Halpern, 1986). È interessante notare che Kuznicki e Turner (1986) hanno ipotizzato che i tempi di discriminazione del gusto sono intimamente legati al tempo necessario per individuare i singoli assaggi (definita “strategia del criterio del tempo”). Di conseguenza, durante la discriminazione dei gusti con latenze di rilevamento diverse, il gusto più veloce serve come spunto che fa scattare la risposta, il che si traduce in un’apparente accelerazione della decisione discriminatoria per il gusto più lento. Al contrario, quando si devono discriminare gusti con latenze di rilevazione simili, l’assenza di tale stecca di risposta rallenta notevolmente la decisione discriminatoria rispetto ai loro tempi di rilevazione individuali (Kuznicki e Turner, 1986).
In generale, la temporizzazione differenziale tra valutazioni semplici e più complesse (ad esempio, la rilevazione di un sapore o il giudizio della sua intensità) è stata in gran parte attribuita all’elaborazione centrale, in quanto né le correlazioni delle proprietà temporali della periferia del gusto né le proprietà chimiche degli assaggiatori potrebbero spiegare l’entità delle differenze osservate (Halpern, 1986; Kelling e Halpern, 1986). Tuttavia, dato che i risultati comportamentali riflettono il culmine di diverse fasi di elaborazione, il lavoro precedente non è stato in grado di stabilire se le differenze temporali osservate tra i giudizi gustativi, in particolare la rilevazione e l’identificazione del gusto, siano una conseguenza di un’elaborazione centrale precoce associata alla codifica chemio-sensoriale o di un’elaborazione centrale successiva associata a una cognizione di livello superiore, come il processo decisionale. A tal fine, l’investigazione del verificarsi di risposte legate al gusto nell’attività neurale in corso (ad esempio, attraverso registrazioni elettrofisiologiche) fornisce uno strumento ideale per affrontare se la modulazione attenzionale influisce sull’elaborazione sensoriale precoce o sulla cognizione di livello superiore, come la memoria, la selezione della risposta, ecc. (Luck and Hillyard, 1999). Finora, la nostra comprensione meccanicistica della sequenza di elaborazione del gusto si basa sui roditori, dove le registrazioni di singoli neuroni nella corteccia gustativa hanno rivelato stadi separabili di potenziali scoppi di azione non specifica del gusto, che probabilmente rappresentano la somatosensazione orale, e più complesse, risposte gusto-specifiche (Katz et al., 2001; Baez-Santiago et al., 2016), anche se questi risultati non possono essere facilmente trasferiti agli esseri umani date le differenze tra specie e protocolli sperimentali. Ulteriori risultati suggeriscono che le risposte gustative non sono rappresentate da codici sensoriali stazionari, ma sono soggette a modulazioni contestuali come l’attenzione e l’aspettativa (Fontanini e Katz, 2006, 2009; Samuelsen et al., 2012).
In confronto ad altri sistemi sensoriali, il senso olfattivo può offrire le intuizioni più simili, poiché i principali calcoli percettivi si concludono in un arco di tempo simile a quello del senso gustativo (cfr. Crouzet et al., 2015; Jiang et al., 2017), con un vantaggio temporale per il rilevamento rispetto a prestazioni di discriminazione di entità comparabile (∼200 ms; cfr. Halpern, 1986; Olofsson et al., 2013). Nell’olfatto, i dati relativi ai tempi di risposta suggeriscono una cascata con fasi di elaborazione distinte per il rilevamento, l’identificazione e la commestibilità, che si svolgono in modo causale e sequenziale, mentre i calcoli di valenza possono anche essere eseguiti, almeno in parte, in parallelo all’identificazione (Olofsson et al., 2013). Al contrario, il rilevamento e la categorizzazione di oggetti visivi (come “uccelli” o “auto”) possono in realtà avvenire simultaneamente (Grill-Spector e Kanwisher, 2005), anche se è stato anche suggerito che il rilevamento e l’identificazione non sono intrinsecamente legati, ma sono piuttosto condizionati da una varietà di fattori di compito (Mack et al., 2008).
Qui, abbiamo studiato la sequenza di elaborazione di due distinti giudizi di gusto: il rilevamento e la discriminazione. In particolare, abbiamo verificato se le differenze temporali tra il rilevamento del gusto e la discriminazione si riflettono già nelle prime fasi della codifica sensoriale o si manifestano solo durante le fasi successive relative all’elaborazione cognitiva di livello superiore, utilizzando l’analisi multivariata del modello di elettroencefalografia gustativa (EEG) e tempi di risposta psicomotoria (RTs).
Materiali e metodi
Partecipanti
Ventuno individui sani e di peso normale hanno partecipato all’esperimento e hanno ricevuto una compensazione monetaria o crediti di classe. I criteri di esclusione erano il fumo pesante, la gravidanza, il senso del gusto alterato, l’apparecchio acustico e i disturbi neurologici o psicologici passati o attuali; le informazioni erano basate sull’autodenuncia. Un soggetto è stato escluso da tutte le analisi a causa di difficoltà tecniche durante la raccolta dei dati. Un partecipante ha completato solo la parte EEG e non ha partecipato alla procedura di valutazione; abbiamo conservato questa serie parziale di dati. Di conseguenza, i dati di 20 partecipanti, 16 donne, 18-34 anni (età media 25,27 ± 4,04 SD; BMI 21,82 ± 2,66 SD medio), sono riportati per i dati EEG e comportamentali, e i dati di 19 partecipanti, 15 donne, 18-34 anni (età media 25,40 ± 4,10 SD; BMI 21,97 ± 2,64 SD medio), sono riportati per le valutazioni. Lo studio è conforme alla versione rivista della Dichiarazione di Helsinki ed è stato approvato dal comitato etico della Società Psicologica Tedesca. I partecipanti hanno fornito il consenso informato scritto prima della partecipazione.
Materiale
Ai partecipanti sono state presentate quattro soluzioni con un gusto chiaro: 0,684 M di cloruro di sodio (salato; supermercato locale, REWE, Colonia, purezza >97%), 0,052 M di acido citrico (acido acido; SAFC, CAS#77-92-9, Sigma-Aldrich, Inc.), 0,003 M di chinino monoidrato (amaro; CAS#207671-44-1, Sigma-Aldrich, Inc.), e 0,075 M di splenda (dolce; Tate & Lyle*). Le soluzioni sono state preparate ogni giorno sciogliendo la sostanza chimica in acqua distillata.
Le soluzioni per il gusto e il risciacquo sono state fornite con il gustometro GU002 (Burghart Messtechnik GmbH), che conserva le soluzioni in bottiglie separate che forniscono ciascuna una pompa a siringa con valvola di non ritorno (Iannilli et al., 2015). Da lì, le soluzioni vengono trasportate attraverso tubi separati in teflon lunghi 5 m ad un’uscita a collettore dove vengono montate insieme ad aria compressa ad un ugello di spruzzatura che atomizza i liquidi fino ad arrivare ad uno spray uniforme. L’ugello di spruzzatura è posizionato 1-1,5 cm sopra la linguetta leggermente estesa in modo che lo spray copra un’ampia area della superficie anteriore della linguetta leggermente estesa. Tutti i tubi corrono all’interno di un tubo riempito d’acqua a 38°C fino al collettore per mantenere le soluzioni ad una temperatura costante e per ridurre al minimo le sensazioni termiche. Durante l’esperimento, il partecipante si è comodamente appoggiato ad un supporto per la fronte, che ha stabilizzato la testa e ha tenuto l’ugello di spruzzatura in posizione. In questa posizione, i liquidi sono stati applicati sulla lingua leggermente estesa e non inghiottiti, ma raccolti in una ciotola sotto il mento. La posizione è stata monitorata online tramite telecamera per monitorare il posizionamento della lingua e i movimenti.
Il gustometro è stato impostato per applicare impulsi di spray regolari e distinti. Durante ogni impulso sono stati erogati 70 µl di liquido durante 100 ms; questo periodo è stato seguito da una pausa di 200 ms, che è servita a separare gli impulsi di spruzzo consecutivi. Ogni stimolo del gusto consisteva di tre di questi impulsi e ammontava ad un bolo di 210 µl erogato per un periodo di 900 ms (portata: 233 µl/s). I tempi e la portata sono stati ottimizzati per ridurre al minimo la miscelazione dei singoli impulsi di spruzzo e per suscitare l’esperienza di un flusso continuo di liquido alla lingua. Gli impulsi di spruzzo distinti permettono di incorporare un sapore nel “flusso” di controllo o di stimoli di acqua senza spunto tattile. In particolare, i partecipanti sperimentano un “pulsare” tattile solo per alcuni secondi fino a quando il sistema somatosensoriale linguale è abituato. Durante lo sviluppo di questa procedura, abbiamo determinato il tempo necessario per l’assuefazione linguale; abbiamo misurato il tempo necessario per l’abolizione della risposta somatosensoriale linguale stabile e abbiamo confermato le nostre scoperte con rapporti verbali di intorpidimento della lingua. La risposta allo stato stazionario è stata abolita entro <10 s. Come risultato, presentiamo impulsi d’acqua per almeno 10 s all’inizio di ogni blocco sperimentale o esperimento (Tzieropoulos et al., 2013; Crouzet et al., 2015). Il tempo tra gli impulsi TTL che controllano gli stantuffi delle siringhe, che spingono i liquidi attraverso i tubi e l’ugello di spruzzo, fino a quando l’aerosol raggiunge la superficie della lingua, è stato misurato dal fornitore per l’impostazione sperimentale qui descritta a seguito di una misura di conducibilità precedentemente proposta (Kelling e Halpern, 1986). Essa ha rivelato un ritardo di 36 ms (SD = 2 ms), per il quale è stato corretto l’inizio dello stimolo nei dati EEG.
Design
I partecipanti hanno completato due compiti RT a scelta forzata, che si sono alternati a blocchi e ciascuno ripetuto quattro volte per un totale di otto blocchi (vedi Figura 1). Nel compito “rilevamento”, ai partecipanti è stato chiesto di decidere se hanno ricevuto un assaggio (uno qualsiasi dei quattro) o acqua, e di rispondere con l’apposito pulsante premuto il più rapidamente possibile. Ci sono state 160 prove di assaggio (40 per ogni assaggio) e 160 prove sull’acqua, per un totale di 320 prove di rilevamento. Nel compito di “discriminazione”, ai partecipanti è stato chiesto di decidere tra due coppie di gusti. Ci sono state 160 prove di discriminazione in totale (40 per ogni gusto). La discriminazione è stata eseguita per due coppie: salato contro acido e dolce contro amaro. Le coppie di sapori sono state selezionate in base a tre criteri: (1) stesso tipo di recettori del gusto: il gusto salato e quello acido sono segnalati tramite canali ionici, e per il dolce e l’amaro tramite i recettori accoppiati alle proteine G (GPCR), che trasmettono informazioni a velocità diverse (Pfaffmann, 1955); (2) velocità di risposta comportamentale simile: le risposte di rilevamento del gusto sono più veloci per il salato e l’acido che per il dolce e l’amaro (Yamamoto e Kawamura, 1981; Kuznicki e Turner, 1986), che, secondo l’ipotesi del criterio temporale, porterebbe al gusto più veloce che serve come spunto di risposta in una discriminazione; (3) latenze di risposta corticale simili: in modo simile ai tempi di reazione, il salato e l’acido evocati prima delle risposte corticali del dolce e dell’amaro (Kobayakawa et al., 1999; Crouzet et al., 2015).
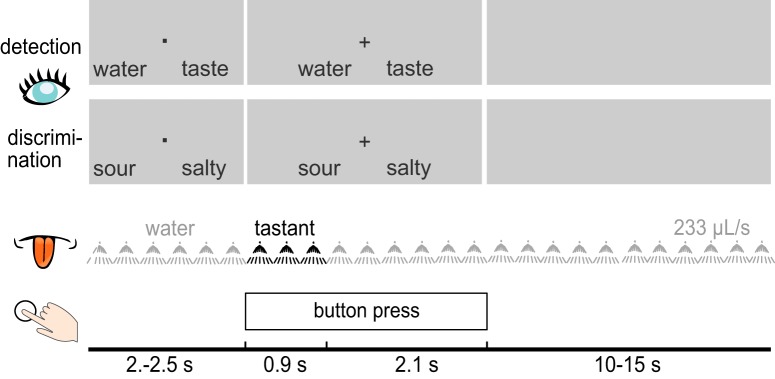
Figura 1.
Illustrazione schematica del disegno sperimentale durante le attività di rilevazione e discriminazione. Le prime due righe rappresentano esempi di spunti visivi visualizzati ai partecipanti durante le prove di rilevazione e discriminazione. Durante ogni prova, è stato incorporato un liquido di assaggio (nero) in una sequenza di impulsi d’acqua. I partecipanti dovevano rispondere velocemente premendo un pulsante durante entrambe le prove.
All’inizio di ogni prova, un punto di fissazione è stato visualizzato insieme a due opzioni di risposta, con l’opzione a sinistra corrispondente al pulsante più a sinistra sulla casella dei pulsanti, e l’opzione a destra corrispondente al pulsante più a destra. Le mappature delle risposte erano pseudo-casuali tra le prove ed equiprobabili. Una croce di fissazione ha sostituito il punto di fissazione dopo 2-2,5 s per indicare che lo stimolo gustativo (gusto o acqua) veniva somministrato, e che i partecipanti dovevano rispondere con la rispettiva pressione del pulsante. Dopo 3 s, è stata visualizzata una schermata grigia fino alla prova successiva. Il periodo di risciacquo tra una prova e l’altra era di 15 s per la discriminazione, ed è stato ridotto a 10 nel compito di rilevazione, a causa dell’inclusione di prove con acqua. Il risciacquo è iniziato subito dopo la presentazione dell’assaggio ed è continuato fino al successivo assaggio. Dopo gli otto blocchi di compiti, i partecipanti hanno completato un breve blocco di valutazione, in cui ogni assaggio è stato presentato ancora una volta in ordine pseudo casuale e i partecipanti dovevano valutare l’intensità e la gradevolezza su una scala analogica visiva orizzontale a 101 punti ancorata con 0 (corrispondente a nessuna sensazione) e 100 (estremamente intenso) e con -50 (estremamente sgradevole) e 50 (estremamente piacevole), rispettivamente. L’esperimento è durato ∼120 min, comprese le pause.

Figura 1.
Illustrazione schematica del progetto sperimentale durante le attività di rilevazione e discriminazione. Le prime due righe rappresentano esempi di spunti visivi visualizzati ai partecipanti durante le prove di rilevamento e discriminazione. Durante ogni prova, è stato incorporato un liquido di assaggio (nero) in una sequenza di impulsi d’acqua. I partecipanti dovevano rispondere velocemente premendo un pulsante durante entrambe le prove.
Acquisizione dati EEG
I partecipanti erano seduti in una cabina di registrazione insonorizzata (Studiobox GmbH) con il gustometro posizionato all’esterno. L’EEG è stato registrato con un sistema di amplificazione activCHamp (Brain Products GmbH) ad una frequenza di campionamento di 500 Hz con filtri passa-alto analogici 0,01-Hz e 200-Hz passa-basso utilizzando PyCorder (Brain Vision LLC) con 64 elettrodi attivi Ag/AgCl posizionati in un cappuccio elastico secondo il sistema esteso 10/10.
Pre-elaborazione dei dati EEG
I dati EEG sono stati elaborati offline utilizzando script personalizzati basati su MATLAB e Python con funzioni rispettivamente di EEGLAB (Delorme e Makeig, 2004) e Autoreject (Jas et al., 2017). I dati sono stati prima campionati a 200 Hz per migliorare il rapporto segnale/rumore e la velocità di calcolo. Le derive lente sono state corrette con il de-trending lineare e il rumore di linea (50 Hz) è stato rimosso con un set di multi-tapers su finestre temporali scorrevoli. I dati continui sono stati poi segmentati in epoche che vanno da -0,5 a 3 s rispetto all’inizio dello stimolo e l’Autoreject è stato applicato per interpolare i canali rumorosi all’interno delle epoche. Successivamente, è stata calcolata un’analisi estesa dei componenti indipendenti Infomax (ICA; Makeig et al., 1997) per identificare i componenti artificiali con ispezione manuale guidata da ADJUST (Mognon et al., 2011), che utilizza le caratteristiche temporali e spaziali dei componenti indipendenti (ICs) per rilevare i valori anomali. I CI che rappresentano gli artefatti comuni sono stati sottratti dai dati. I dati sono stati poi riferiti alla media di tutti gli elettrodi. Infine, abbiamo applicato filtri di risposta all’impulso finiti sinculari di Hamming-windowed a fase zero (cutoff: -6 dB, massima deviazione della banda passante: 0,2%, attenuazione della banda passante: -53 dB) per isolare lo spettro di frequenza al di sotto di 6 ± 2 Hz (ordine: 330) e al di sopra di 0,5 ± 1 Hz (ordine: 660), e successivamente abbiamo ridotto le epoche a -,2 s a 1,5 s. Il taglio di frequenza è stato basato su recenti scoperte che mostrano che le informazioni sulla qualità del gusto sono codificate all’interno delle informazioni di potenza e fase delle bande di frequenza δ e θ inferiori (approssimativamente fino a 6 Hz; Hardikar et al., 2018; Wallroth et al., 2018; vedi anche Pavao et al., 2014). Le prove sono state poi normalizzate sottraendo la media del periodo di riferimento di ciascun elettrodo (-200 ms all’inizio dello stimolo) prima dell’analisi di decodifica. Nessuna prova è stata esclusa dai dati.
Analisi descrittiva EEG
Per quantificare la forza del segnale elettrofisiologico per ogni condizione sperimentale, abbiamo calcolato la potenza globale di campo (GFP), un indice senza riferimento di forza del campo elettrico, per compito e gusto. La GFP è una misura della varianza (cioè la media delle deviazioni standard delle deviazioni standard dei potenziali relativi all’evento in ciascuno dei 64 elettrodi) ed esprime quanta attività elettrica (mediata tra i partecipanti) si verifica in risposta ad un evento (Fig. 2A). Per illustrare le distribuzioni dei campi elettrici, abbiamo calcolato mappe topografiche di tensione per ogni gusto e compito. Ogni mappa rappresenta la media grand-media della tensione media da 150 a 200 ms e 50 ms che circonda il tempo medio di decodifica relativo all’acqua (Fig. 2).B). Le mappe delle differenze sono state calcolate per rimuovere la risposta visiva evocata dalla visualizzazione della croce di fissazione.
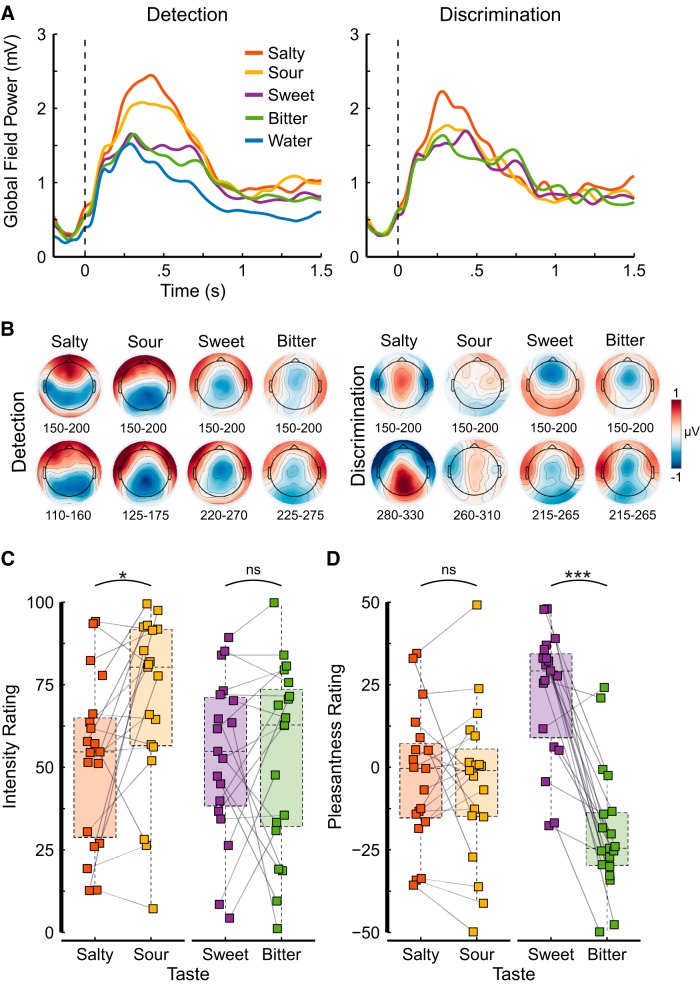
Figura 2.AL’intensità del segnale è stata quantificata come la media delle GFP calcolate all’interno dei soggetti come deviazione standard dei potenziali relativi all’evento su 64 elettrodi per ciascuna delle prove di rilevamento degli assaggi e dell’acqua (a sinistra) e delle prove di discriminazione (a destra). I sapori salati e acidi mostrano un segnale più forte rispetto ai sapori dolci e amari, ma meno forte per le prove di discriminazione. Si noti che l’inizio della stimolazione liquida (per tutti i gusti e per l’acqua) ha coinciso con la presentazione della croce di fissazione, con il risultato di una chiara risposta GFP anche per l’acqua. BLe mappe topografiche di tensione per ogni gusto e compito rappresentano la media grand-media su una finestra di tempo di 50 ms, all’inizio durante l’elaborazione (riga superiore) e che circonda l’inizio della decodifica (riga inferiore) mostrata nella Tabella 2 e nella Figura 3.C rispetto all’acqua. Intensità (0-100; C) e gradevolezza (-50-50; D) per le due coppie di sapori, salato-acidulo e dolce-amaro. I quadrati colorati mostrano le valutazioni dei singoli partecipanti, le linee grigie tra i due quadrati indicano che queste valutazioni sono state date dallo stesso partecipante. I boxplots semitrasparenti e colorati comportano le valutazioni di tutti i partecipanti (N = 19); la linea tratteggiata orizzontale all’interno di ogni casella rappresenta la mediana, la parte inferiore e superiore della casella rappresentano rispettivamente il primo e il terzo quartile; i baffi mostrano 1,5 volte la gamma interquartile. I colori rappresentano il gusto. Il significato è indicato sopra l’area del grafico: ns p > 0,05; *p < 0,05; ***p < 0,001.

Figura 2.AL’intensità del segnale è quantificata come la media delle GFP calcolate all’interno dei soggetti come deviazione standard dei potenziali relativi all’evento su 64 elettrodi per ciascuno dei test di rilevamento dei sapori e dell’acqua (a sinistra) e dei test di discriminazione (a destra). I sapori salati e acidi mostrano un segnale più forte rispetto ai sapori dolci e amari, ma meno forte per le prove di discriminazione. Si noti che l’inizio della stimolazione liquida (per tutti i gusti e per l’acqua) ha coinciso con la presentazione della croce di fissazione, con il risultato di una chiara risposta GFP anche per l’acqua. BLe mappe topografiche di tensione per ogni gusto e compito rappresentano la media grand-media su una finestra di tempo di 50 ms, all’inizio durante l’elaborazione (riga superiore) e che circonda l’inizio della decodifica (riga inferiore) mostrata nella Tabella 2 e nella Figura 3.C rispetto all’acqua. Intensità (0-100; C) e gradevolezza (-50-50; D) per le due coppie di sapori, salato-acidulo e dolce-amaro. I quadrati colorati mostrano le valutazioni dei singoli partecipanti, le linee grigie tra i due quadrati indicano che queste valutazioni sono state date dallo stesso partecipante. I boxplots semitrasparenti e colorati comportano le valutazioni di tutti i partecipanti (N = 19); la linea tratteggiata orizzontale all’interno di ogni casella rappresenta la mediana, la parte inferiore e superiore della casella rappresentano rispettivamente il primo e il terzo quartile; i baffi mostrano 1,5 volte la gamma interquartile. I colori rappresentano il gusto. Il significato è indicato sopra l’area del grafico: ns p > 0,05; *p < 0,05; ***p < 0,001.
Analisi di decodifica
Per determinare il punto temporale in cui le informazioni relative alla rilevazione e alla discriminazione dei gusti sono rappresentate a livello di prova singola, abbiamo eseguito un’analisi di pattern multivariati risolti nel tempo sulle ampiezze di tutti i 64 elettrodi (MVPA; Kriegeskorte, 2011) incorporati in un metodo di generalizzazione temporale (King e Dehaene, 2014). Per ogni partecipante, l’MVPA è stata implementata con classificatori di regressione logistica a regressione binaria multipla L2-regolarizzata (Fan et al., 2008). Per imitare i compiti comportamentali, quattro classificatori sono stati addestrati a rilevare uno dei sapori in contrasto con l’acqua (utilizzando prove dal compito di rilevamento), e due classificatori sono stati addestrati a discriminare le due coppie di sapori (salato-acidulo e dolce-amaro, utilizzando prove dal compito di discriminazione). La procedura è stata implementata con una convalida incrociata stratificata lasciata una sola prova (cioè, ad ogni iterazione, viene tralasciata una prova di ogni gusto). Le prove con risposte comportamentali errate sono state escluse dalla decodifica.
Utilizzando il metodo della generalizzazione temporale, un modello di attività legata al gusto appreso in un determinato momento a livello di popolazione (che riflette una media) viene generalizzato in avanti e indietro nel tempo, data la serie temporale di una singola prova. La performance di classificazione risultante riflette la corrispondenza tra attività di prova singola e media nel tempo. A differenza dell’approccio comune MVPA con l’apprendimento dei modelli e i test eseguiti esclusivamente in punti temporali identici, questo approccio di generalizzazione è più adatto a determinare le serie di attività a livello di singolo trial tenendo pienamente conto della variabilità da trial a trial degli stati di elaborazione gustativa (cfr. Jones et al., 2007). Quindi, a livello di prova, è ancora possibile rilevare modelli di attivazione legati al gusto prima o dopo la risposta media del gusto.
Per determinare l’insorgenza del segnale di gusto a livello di prova singola, abbiamo utilizzato un approccio basato su una luce di ricerca in linea con la statistica dell'”area massima di cluster” (cioè, un numero predefinito di punti temporali vicini supera una soglia statistica; cfr. Bullmore et al., 1999). Dato che la funzione sigmoide della regressione logistica quantifica naturalmente la certezza con cui un classificatore prende la sua decisione, abbiamo definito una classificazione come accurata quando la scelta corretta è stata fatta con una certezza che supera l’intervallo di confidenza del 95% della soglia binomiale (una statistica comune nell’analisi di classificazione perché adatta il livello di probabilità alla dimensione del campione; cfr. Combrisson e Jerbi, 2015). Poiché la certezza decisionale è fortemente influenzata dall’iperparametro C (la costante di regolarizzazione), con un’influenza trascurabile sulla performance complessiva, abbiamo fissato il parametro a C = 0,005, che riduce sostanzialmente la deviazione standard della normale distribuzione dei valori decisionali (rispetto al default di C = 1) per stime di insorgenza più robuste. La dimensione del cluster è un parametro libero che è stato definito come 50 ms di una media di pattern stabile (direzione x) e 100 ms di generalizzazione del 95% di successo (direzione y). Questa asimmetria dei cluster riflette la nostra prioritizzazione delle stime stabili a livello di prova singola rispetto alla stabilità media del pattern. L’insorgenza del gusto-segnale è stata definita come il primo punto di generalizzazione nel primo cluster di prestazioni significative di decodifica.
In particolare, questo tipo di raggruppamento temporale è più liberale rispetto all’aggiustamento per il test di ipotesi nulle multiple rispetto all’approccio alternativo basato sulla permutazione (cfr. Maris e Oostenveld, 2007). Tuttavia, quest’ultima procedura (più rigorosa) è più adatta per identificare se un effetto è presente o meno, piuttosto che quando si verifica per la prima volta. Considerate le precedenti scoperte che le qualità del gusto possono essere decodificate con successo dalle registrazioni EEG (cfr. Crouzet et al., 2015; Hardikar et al., 2018; Wallroth et al., 2018), la nostra principale preoccupazione è stata quella di trovare una procedura di aggiustamento che bilanciasse i tassi di errore di tipo I e II in modo da identificare l’insorgenza del segnale di gusto nel modo più accurato possibile (cioè con un numero minimo di falsi allarmi ma anche con poche mancanze del segnale vero). Per riassumere, la nostra motivazione attuale è stata quella di esplorare esattamente quando un segnale di gusto emerge a livello di prova singola, piuttosto che indagare se un segnale di gusto si verifica.
La performance del classificatore è stata riassunta per la visualizzazione della grand-media come area sotto la curva caratteristica di funzionamento del ricevitore (AUC), e per l’analisi statistica dei risultati delle singole prove la precisione è stata definita come la percentuale di prove per le quali è stato determinato con successo un esordio.
Analisi statistica
Le analisi statistiche sono state effettuate con R (R Core Team, 2017). Le valutazioni sono state analizzate utilizzando i test t di Student’s t per confrontare i gusti all’interno di una coppia, acido con il salato e dolce con l’amaro e il grado di gradevolezza (positivo, neutro o negativo) è stato testato utilizzando un campione t test contro un’ipotesi nulla di zero, con zero corrispondente a neutro sulla scala di valutazione. Per ciascuna delle variabili dipendenti RT, l’accuratezza, l’inizio della decodifica e l’accuratezza della decodifica e per ciascuna coppia di gusti (agro-salato o dolce-amaro), è stata calcolata una misura ripetuta a due vie ANOVA con i fattori TASK (rilevamento, discriminazione) e TASTE. I test degli studenti sulla differenza tra discriminazione e rilevazione sono stati utilizzati per risolvere le interazioni GUSTO e TASK. Le correlazioni di Pearson su un lato sono state calcolate dei valori di differenza tra l’insorgenza della discriminazione e la decodifica della discriminazione e le RT per verificare la corrispondenza tra gli effetti neurali e comportamentali. Il livello α è stato a priori impostato a 0,05; per le violazioni della sfericità è stata applicata ai gradi di libertà la correzione Greenhouse-Geisser. Riportiamo i gradi di libertà non corretti e i valori assoluti delle stime delle dimensioni dell’effetto di Cohen.
Risultati
Valutazioni
Le concentrazioni degli stimoli sono state scelte sulla base di studi precedenti, in modo che tutti gli assaggi siano chiaramente percepibili, che gli assaggi all’interno di una coppia siano altrettanto intensi e che gli assaggi siano accettabili (Fig. 2C,D). Nel complesso, tutti i gusti sono stati moderatamente intensi (intervallo di intensità media, 52,35-69,97; Fig. 2A). Amaro e dolce erano iso-intensi (t(18) = 0,03, p = 0,978, d = 0,01); eppure l’amaro era più intenso del salato (t(18) = -2,83, p = 0,022, d = 0,43). Come previsto, salato e acido erano neutri nella gradevolezza (t test contro zero; salato: t(18) = -0,67, p = 0,680, d = 0,22; acido: t(18) = -0,92, p = 0,594, d = 0,30), ed entrambi erano altrettanto piacevoli (t(18) = 0,41, p = 0,784, d = 0,05). Amaro e dolce, invece, variavano fortemente nella piacevolezza (t(18) = -7,13, p < 0,001, p < 0,001, d = 0,99) tanto che l’amaro era chiaramente sgradevole (t(18) = -4,44, p < 0,001, d = 1,44) e il dolce era chiaramente piacevole (t(18) = 5,00, p < 0,001, d = 1,62), il che era prevedibile (Fig. 2D).
Dati comportamentali
In linea con il disegno dello studio, le analisi statistiche sono state condotte separatamente per le coppie di sapori “agro-salato” e “dolce-amaro”. le RT e l’accuratezza sono riassunte nella Tabella 1 e mostrate nella Figura 3B.
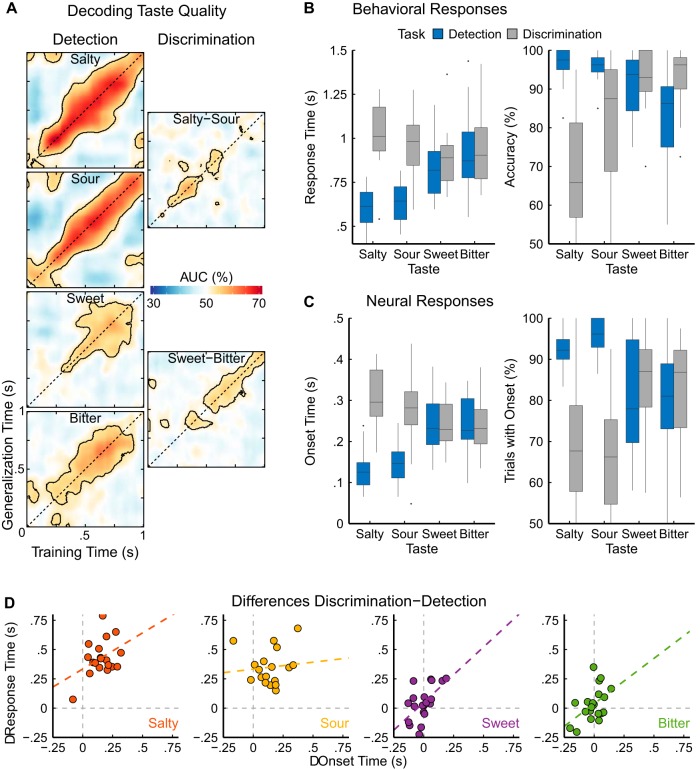
Figura 3.A, Media di generalizzazione della decodifica all’interno del soggetto nel tempo per ognuno dei quattro gusti per compito. La prestazione di rilevamento si ottiene per la classificazione di un assaggiatore contro l’acqua (prove di rilevamento delle attività); la prestazione di discriminazione si ottiene per la classificazione tra due assaggiatori (prove di discriminazione delle attività). Le diagonali delle matrici (identico tempo di formazione e di prova) corrispondono all’approccio di decodifica comune. L’asse x mostra i tempi di allenamento che rappresentano la stabilità di un modello di gusto medio. L’asse y mostra i tempi di generalizzazione o di test che rappresentano l’emergere del pattern medio (asse x) all’interno delle singole prove. I colori caldi riflettono gli aumenti delle prestazioni medie rispetto al livello di casualità (50%), i colori freddi riflettono le diminuzioni; le linee di contorno nere indicano la significatività statistica della grande media come valutata attraverso test binomiali a un lato (p < 0,05). Il salato e l’acido mostrano prestazioni di rilevamento più precoci e migliori rispetto al dolce e all’amaro, mentre le prestazioni di discriminazione sono meno pronunciate rispetto alle prestazioni di rilevamento in entrambi i casi. B, I dati comportamentali del pulsante premere RTs di risposte corrette e la precisione (media per partecipante, N = 20) colore codificato per le attività (blu che indica prove di rilevamento, prove di discriminazione grigio). La linea orizzontale in ogni boxplot rappresenta la mediana, la parte inferiore e superiore della scatola rappresentano rispettivamente il primo e il terzo quartile; i baffi mostrano 1,5 volte l’intervallo interquartile, i punti indicano i valori anomali. I partecipanti sono più veloci e più precisi nel rilevare il salato e l’acido di quanto non lo siano nel discriminare i due sapori. Il dolce e l’amaro non mostrano alcuna differenza nelle RT, ma una maggiore precisione nel discriminare i due rispetto al rilevamento dall’acqua. CI dati neurali dei tempi di insorgenza delle prestazioni sopra la media per partecipante; N = 20 per i gusti dolce e amaro e N = 18 per i gusti salato e amaro) e dell’accuratezza che indica la percentuale di prove per le quali tale insorgenza è stata determinabile (parametri boxplot come in B). I risultati neurali corrispondono strettamente ai dati comportamentali in quanto il salato e l’acido sono classificati più velocemente e più accuratamente nelle prove di rilevamento. Il dolce e l’amaro non mostrano alcuna differenza significativa tra i due compiti. D, Correlazioni dei valori di differenza tra la discriminazione media e i tempi di insorgenza neurale di rilevamento e premere il pulsante RTs (ogni punto in un grafico rappresenta un partecipante). Le linee tratteggiate con codice colore rappresentano modelli di regressione lineare; le linee tratteggiate grigie orizzontali e verticali indicano i punti di nessuna differenza tra la discriminazione e le latenze di rilevamento sul rispettivo asse. Gli effetti osservati sono stati significativamente correlati positivamente per tre dei quattro gusti, in modo tale che una differenza neurale precoce (o la sua mancanza) corrispondeva allo stesso effetto comportamentale.
| Rilevamento | Discriminazione | |||||||
|---|---|---|---|---|---|---|---|---|
| RT (ms) | Precisione (%) | RT (ms) | Precisione (%) | |||||
| Gusto | M | SEM | M | SEM | M | SEM | M | SEM |
| Salato | 609 | 24 | 96.1 | 1.1 | 1029 | 39 | 67.6 | 4.3 |
| Sour | 642 | 24 | 95.9 | 0.8 | 964 | 38 | 80.6 | 4.3 |
| Amaro | 905 | 51 | 81.9 | 3.2 | 938 | 45 | 93.3 | 1.7 |
| Dolce | 835 | 37 | 91.1 | 1.8 | 881 | 36 | 92.0 | 2.0 |
| Acqua | 906 | 38 | 95.6 | 1.0 | – | – | – | – |
Per il contrasto salato e acido, le RT di rilevazione erano significativamente più veloci delle RT di discriminazione (F(1,19) = 119,61, p < 0,001, η 2 = 0,64), e le RT erano simili per entrambi i gusti (F(1,19) = 1,08, p = 0,310, η 2 = 0,003). Un compito × interazione gusto è stato osservato (F(1,19) = 18,70, p < 0,001, p < 0,001, η 2 = 0,03), e il confronto della differenza tra la rilevazione e la discriminazione ha rivelato che l’effetto era più grande per il salato che per l’acido (t(19) = 4,32, p < 0,001, d = 0,45). L’accuratezza è stata significativamente più alta nel rilevamento rispetto al compito di discriminazione (F(1,19) = 38,24, p < 0,001, η 2 = 0,39) e anche più alta per il salato (F(1,19) = 6,91, p = 0,020, η 2 = 0,05). Anche in questo caso, è stata osservata un’interazione compito × gusto (F(1,19) = 6,26, p = 0,020, η 2 = 0,06), e il confronto della differenza tra il rilevamento e la discriminazione ha rivelato che l’effetto era maggiore per il salato che per l’acido (t(19) = -2,50, p = 0,022, d = 0,79).
Per il contrasto dolce e amaro, le RT erano simili per i compiti di rilevazione e discriminazione (F(1,19) = 1,62, p = 0,219, η 2 = 0,01), e le RT erano più veloci per il dolce che per l’amaro (F(1,19) = 12,07, p = 0,003, η 2 = 0,03). La precisione è stata significativamente più alta nella discriminazione rispetto al compito di rilevamento (F(1,19) = 7,10, p = 0,020, η 2 = 0,09), e anche più alta per il dolce che per l’amaro (F(1,19) = 7,54, p = 0,010, η 2 = 0,04). Un compito × interazione gusto è stato osservato (F(1,19) = 8,67, p = 0,008, p = 0,008, η 2 = 0,07) e un confronto della differenza di precisione tra la rilevazione e la discriminazione ha rivelato che l’effetto era maggiore per l’amaro che per il dolce (t(19) = -2,94, p = 0,008, d = 0,56).

Figura 3.ALa media della generalizzazione della decodifica all’interno del soggetto nel tempo per ciascuno dei quattro gusti per compito. La prestazione di rilevazione si ottiene per la classificazione di un assaggiatore contro l’acqua (prove di rilevazione delle attività); la prestazione di discriminazione si ottiene per la classificazione tra due assaggiatori (prove di discriminazione delle attività). Le diagonali delle matrici (identico tempo di formazione e di prova) corrispondono all’approccio di decodifica comune. L’asse x mostra i tempi di allenamento che rappresentano la stabilità di un modello di gusto medio. L’asse y mostra i tempi di generalizzazione o di test che rappresentano l’emergere del pattern medio (asse x) all’interno delle singole prove. I colori caldi riflettono gli aumenti delle prestazioni medie rispetto al livello di casualità (50%), i colori freddi riflettono le diminuzioni; le linee di contorno nere indicano la significatività statistica della grande media come valutata attraverso test binomiali a un lato (p < 0,05). Il salato e l’acido mostrano prestazioni di rilevamento più precoci e migliori rispetto al dolce e all’amaro, mentre le prestazioni di discriminazione sono meno pronunciate rispetto alle prestazioni di rilevamento in entrambi i casi. B, I dati comportamentali del pulsante premere RTs di risposte corrette e la precisione (media per partecipante, N = 20) colore codificato per le attività (blu che indica prove di rilevamento, prove di discriminazione grigio). La linea orizzontale in ogni boxplot rappresenta la mediana, la parte inferiore e superiore della scatola rappresentano rispettivamente il primo e il terzo quartile; i baffi mostrano 1,5 volte l’intervallo interquartile, i punti indicano i valori anomali. I partecipanti sono più veloci e più precisi nel rilevare il salato e l’acido di quanto non lo siano nel discriminare i due sapori. Il dolce e l’amaro non mostrano alcuna differenza nelle RT, ma una maggiore precisione nel discriminare i due rispetto al rilevamento dall’acqua. CI dati neurali dei tempi di insorgenza delle prestazioni sopra la media per partecipante; N = 20 per i gusti dolce e amaro e N = 18 per i gusti salato e amaro) e dell’accuratezza che indica la percentuale di prove per le quali tale insorgenza è stata determinabile (parametri boxplot come in B). I risultati neurali corrispondono strettamente ai dati comportamentali in quanto il salato e l’acido sono classificati più velocemente e più accuratamente nelle prove di rilevamento. Il dolce e l’amaro non mostrano alcuna differenza significativa tra i due compiti. D, Correlazioni dei valori di differenza tra la discriminazione media e i tempi di insorgenza neurale di rilevamento e premere il pulsante RTs (ogni punto in un grafico rappresenta un partecipante). Le linee tratteggiate con codice colore rappresentano modelli di regressione lineare; le linee tratteggiate grigie orizzontali e verticali indicano i punti di nessuna differenza tra le latenze di discriminazione e di rilevazione sul rispettivo asse. Gli effetti osservati sono stati significativamente correlati positivamente per tre dei quattro gusti, in modo tale che una differenza neurale precoce (o la sua mancanza) corrispondeva allo stesso effetto comportamentale.
Classificatore
Le analisi statistiche sono state eseguite su risultati di decodifica all’interno del soggetto che sono visualizzati come la grande media delle prestazioni in Figura 3A. I tempi di decodifica dell’insorgenza e l’accuratezza del classificatore, che è stata definita come la percentuale di prove per le quali è stata determinata un’insorgenza (cioè, ad un certo punto il gusto è stato correttamente identificato per il periodo di cluster predefinito) sono riassunti nella Tabella 2 e mostrati nella Figura 3C. I contrasti hanno separato le analisi per le coppie di sapori agro-salato e dolce-amaro in linea con il progetto di studio come prima. Poiché due partecipanti si sono comportati male durante la discriminazione comportamentale di salato e acido, sono rimaste troppo poche prove perché il decoder potesse imparare i rispettivi modelli di gusto. Quindi, le analisi che coinvolgono i sapori salato e acido sono state calcolate su campioni di dimensioni inferiori (indicati dal minor numero di gradi di libertà).
| Rilevamento | Discriminazione | |||||||
|---|---|---|---|---|---|---|---|---|
| Inizio (ms) | Precisione (%) | Inizio (ms) | Precisione (%) | |||||
| M | SEM | M | SEM | M | SEM | M | SEM | |
| Salato | 136 | 12 | 92.2 | 1.2 | 304 | 18 | 66.8 | 5.1 |
| Sour | 147 | 11 | 95.4 | 1.1 | 285 | 25 | 61.7 | 4.7 |
| Amaro | 250 | 22 | 80.6 | 3.0 | 242 | 12 | 79.5 | 4.6 |
| Dolce | 245 | 17 | 80.8 | 3.1 | 242 | 15 | 80.0 | 4.7 |
Per il contrasto salato e acido, gli avviamenti di decodifica durante il rilevamento sono stati significativamente più veloci che durante la discriminazione (F(1,17) = 44,75, p < 0,001, η 2 = 0,53), e i tempi di avvio sono stati simili per entrambi i gusti (F(1,17) = 0,16, p = 0,692, η 2 = 0,001). Allo stesso modo, l’accuratezza del classificatore era significativamente più alta durante la rilevazione rispetto alla discriminazione (F(1,17) = 35,01, p < 0,001, η 2 = 0,50), e simile per entrambi i gusti (F(1,17) = 0,87, p = 0,365, η 2 = 0,001).
Per il contrasto dolce e amaro, gli insiemi di decodifica erano simili per entrambi i compiti (F(1,19) = 0,13, p = 0,723, η 2 = 0,001) e per entrambi i gusti (F(1,19) = 0,04, p = 0,851, η 2 = 0,00). Allo stesso modo, la precisione del classificatore non differisce tra i compiti (F(1,19) = 0,07, p = 0,794, η 2 = 0,001) e per i gusti (F(1,19) = 0,03, p = 0,865, η 2 = 0,00).
Corrispondenza neurale-comportamentale
Per verificare la corrispondenza tra gli effetti specifici del compito osservati per gli onset di decodifica e le RT, abbiamo calcolato le correlazioni di Pearson dei valori di differenza del gusto e del soggetto tra le latenze di rilevazione e di discriminazione per gli onset di decodifica e per le RT (Figura 3D). Abbiamo osservato significative correlazioni positive per il salato (r17 = 0,40, p = 0,045), il dolce (r18 = 0,57, p = 0,004), l’amaro (r18 = 0,47, p = 0,017), ma nessuna correlazione significativa per l’acido (r17 = 0,10, p = 0,343).
Discussione
In questo studio, abbiamo indagato la sequenza di elaborazione di decisioni percettive gustative semplici e complesse, utilizzando modelli elettrofisiologici e risposte comportamentali suscitate da sapori salati, acidi, dolci e amari. Basandoci sulle recenti scoperte che le informazioni sulle categorie di gusto sono disponibili nel periodo di tempo della prima risposta evocata, abbiamo esaminato se la rilevazione e la discriminazione di un gusto sono fasi di elaborazione simultanee o distinte, e se le differenze potenziali sono rappresentate all’inizio o alla fine della cascata di elaborazione gustativa. Per la prima volta, abbiamo dimostrato non solo una stretta corrispondenza tra le prime risposte neurali e comportamentali, ma abbiamo anche dimostrato che le differenze temporali tra le decisioni semplici e complesse relative al gusto si stabiliscono precocemente durante la codifica chemiosensoriale, piuttosto che successivamente durante la cognizione di livello superiore. È interessante notare, tuttavia, che le latenze di rilevazione e discriminazione sono state condizionate dal confronto specifico del gusto, in modo tale che la sequenza temporale variava con il contrasto edonico, suggerendo che le caratteristiche gustative possono essere elaborate parzialmente in parallelo.
Per il salato e l’acido, i tempi di rilevazione sono stati significativamente più veloci dei tempi di discriminazione, con una differenza di ∼100-ms nelle loro impostazioni neurali, e una differenza di 300-400ms tra le risposte comportamentali, suggerendo che le caratteristiche gustative richieste per la mera rilevazione e per la discriminazione delle categorie gustative sono elaborate in sequenza, in modo che la profondità di elaborazione aumenti con il tempo. Questa osservazione è coerente con precedenti studi RT che hanno dimostrato che i giudizi di gusto semplici come la rilevazione del gusto sono 100-200 ms più veloci rispetto a giudizi più complessi come la discriminazione del gusto (Yamamoto e Kawamura, 1981; Halpern, 1986), e in particolare che la discriminazione del salato e dell’acido richiede ancora più tempo (altri 400-600 ms) rispetto alla loro rilevazione del gusto individuale (Kuznicki e Turner, 1986). Gli autori hanno attribuito questo aumento del tempo di discriminazione specifico per il gusto al fallimento della strategia del criterio del tempo, il che suggerisce che la performance di discriminazione è controllata dalla latenza di rilevamento del più veloce dei due gusti che può essere usato come uno spunto di risposta (essenzialmente riducendo la profondità di elaborazione necessaria per l’identificazione effettiva). Di conseguenza, la differenza tra il rilevamento del gusto e l’identificazione verrebbe sottovalutata regolarmente, dato che la velocità con cui viene risolto un compito di discriminazione trae vantaggio dalle diverse latenze di rilevamento tra i gusti, mentre i gusti discriminanti con latenze di rilevamento simili rifletterebbero i tempi effettivi di discriminazione. Tuttavia, sondare questa ipotesi nella gustazione non è banale, perché i tempi di rilevazione corrispondenti sono tipicamente osservati solo per la giustapposizione di salato e acido.
A differenza del lavoro precedente, non abbiamo osservato alcuna differenza neurale e solo una minuscola differenza comportamentale nelle latenze di rilevamento per l’amaro e il dolce, in modo che il probabile fallimento della strategia del criterio temporale avrebbe dovuto prevedere un aumento del tempo di discriminazione. Fondamentalmente, tuttavia, abbiamo osservato tempi di elaborazione simili per il rilevamento del dolce e dell’amaro e la loro discriminazione, sia a livello neurale che comportamentale. L’assenza di una dipendenza dal compito quando si confrontano il dolce e l’amaro suggerisce che un meccanismo diverso, non disponibile nel contrasto tra il salato e l’acido, ha diminuito lo scarto temporale tra la rilevazione del gusto e la discriminazione. Pertanto, sosteniamo che le caratteristiche del gusto che facilitano il processo di identificazione erano disponibili già in fase iniziale durante l’elaborazione del gusto, in linea con l’idea che la cascata di elaborazione gustativa non costituisce semplicemente una sequenza invariante di stati di codifica (Fontanini e Katz, 2006, 2009; Samuelsen et al., 2012).
Un’apparente differenza tra i due contrasti di discriminazione del gusto sta nella valenza associata ai singoli assaggi. Mentre il salato e l’acido erano praticamente identici rispetto al loro valore edonico neutro, il dolce e l’amaro mostravano una marcata differenza, tendendo rispettivamente verso gli estremi positivi e negativi della scala di gradevolezza. Mentre i rapporti precedenti suggerivano che simili latenze di rilevazione causavano l’aumento dei tempi di discriminazione (Kuznicki e Turner, 1986), forse è stata invece la somiglianza edonica a ridurre la distintività dello stimolo. Ciò sarebbe anche coerente con i tassi di errore relativamente alti nella discriminazione salina e suggerisce che la difficoltà del compito è aumentata in concomitanza con i tempi di elaborazione. Osservazioni simili sono state fatte nell’olfatto, dove la discriminazione di odori simili richiedeva tempi di elaborazione aggiuntivi (Abraham et al., 2004). Allo stesso modo, per la discriminazione dolce-amaro, la valenza può essere servita come spunto di risposta decisivo per il compito di discriminazione, sostituendo essenzialmente il presunto ruolo della latenza di rilevamento individuale, e compensando così la necessità di tempi di elaborazione aggiuntivi e potenziali danni alle prestazioni. Pertanto, il ruolo presunto dell’edonismo nell’identificazione del gusto sottolinea che la cascata di elaborazione gustativa non si svolge in modo puramente seriale, ma piuttosto che la rilevazione del gusto, l’identificazione e l’appetibilità vengono elaborate in parallelo o con una notevole sovrapposizione, come è stato dimostrato nei roditori (Perez et al., 2013).
Le prove anatomiche e fisiologiche dei primati suggeriscono che le caratteristiche sensoriali ed edoniche di un evento gustativo sono effettivamente elaborate in gran parte in parallelo (Sewards and Sewards, 2002). Al contrario, gli studi sui roditori hanno rivelato adattamenti nella prima risposta gustativa dei neuroni dell’amigdala ad un gusto avverso rispetto ad un gusto non avverso, che ha portato ad un ulteriore aumento della connettività funzionale, il che implica un maggiore flusso di informazioni tra l’amigdala e la corteccia gustativa (Grossman et al., 2008). Dato un adeguato cross-talk all’interno della rete gustativa (cfr. Katz et al., 2002), e data una più rapida conclusione dell’edonismo rispetto ai calcoli chemio-sensoriali, la discriminazione di uno qualsiasi dei due gusti potrebbe beneficiare di informazioni edoniche divergenti, modificando così il compito in un riconoscimento della palatabilità del gusto piuttosto che della categoria (o, in alternativa, facilitando l’identificazione sensoriale stessa). Evolutivamente, gli esseri umani potevano beneficiare di un sistema di gusto che comanda un meccanismo di codifica flessibile con la capacità di incorporare rapidamente informazioni edonicamente rilevanti. Infatti, poiché lo scopo ultimo dell’assaggio è quello di determinare se un organismo debba ingerire o rifiutare una sostanza, è plausibile ipotizzare che questo processo valutativo si basi considerevolmente su valutazioni edoniche, che possono avere la precedenza sulla categorizzazione sensoriale o sul recupero semantico. Pertanto, il funzionamento del sistema gustativo sembra essere correlato a quanto riportato nel sistema olfattivo (che coincide in larga misura nella sua funzione di determinare l’approccio e l’evitamento), tanto che le valutazioni edoniche sono elaborate in parallelo all’identificazione (Olofsson et al., 2013), e spesso precedono la denominazione degli odori (Lawless e Engen, 1977).
Un’alternativa, anche se speculativa, la spiegazione della specificità del gusto-contrasto può essere trovata in diversi meccanismi di trasduzione del gusto a partire dal sistema gustativo periferico. Il gusto amaro e dolce sono mediati da GPCR specializzati, specifici per il gusto, che sono espressi in cellule recettoriali del gusto di tipo II distinte (Chandrashekar et al., 2006), e che convergono su un comune percorso di segnalazione intracellulare che culmina con il rilascio di ATP (Roper e Chaudhari, 2017). È interessante notare che i composti amari attivano tipicamente numerosi recettori del gusto amaro, possibilmente per garantire il rilevamento di sostanze potenzialmente tossiche dal sapore amaro attraverso l’attivazione ridondante (Meyerhof et al., 2010). Inoltre, l’amaro e il dolce sono legati a comportamenti specifici: rispettivamente evitamento e approccio. Pertanto, è plausibile ipotizzare che la separazione dei percorsi di trasduzione dolce e amaro, insieme alla codifica differenziale della palatabilità (sia che il gusto sia piacevole o sgradevole), contribuiscano probabilmente alla superiore discriminabilità di questi due gusti, consentendo la loro discriminazione non appena vengono assaggiati.
Il salato e l’acido, invece, sono mediati da specifici canali ionici espressi in cellule neuronali di tipo III (Lewandowski et al., 2016). Questi sono depolarizzati come risultato dell’acidificazione intracellulare per l’acido e possibilmente anche per il salato, e trasmettono informazioni sul gusto attraverso i potenziali d’azione (Roper e Chaudhari, 2017), che possono, almeno in parte, contribuire alla trasduzione del gusto complessivamente più veloce (e più veloci risposte comportamentali risultanti) rispetto alle categorie di gusto GPCR-mediate. Inoltre, poiché le attivazioni indotte dal gusto si sovrappongono per il salato e l’acido, in particolare a concentrazioni più elevate (Lewandowski et al., 2016), e poiché i neuroni del gusto sono più ampiamente sintonizzati con concentrazioni crescenti (Wu et al., 2015), le risposte a valle di questi gusti possono essere un po’ più ambigue e richiedono un’ulteriore elaborazione per districarsi tra gli input sensoriali, aumentando così il tempo di elaborazione per la discriminazione salso-acida. Naturalmente, anche le differenze nella distribuzione delle cellule recettoriali specifiche della qualità possono aver contribuito ai risultati attuali.
In conclusione, i nostri risultati mostrano una stretta corrispondenza tra i modelli di gusto-correlati psicomotori e le prime risposte elettrofisiologiche, suggerendo che gli effetti comportamentali sono stabiliti all’inizio della cascata di elaborazione gustativa durante le fasi associate con la codifica chemio-sensoriale piuttosto che la cognizione di livello superiore come il processo decisionale (Wallroth et al., 2018). Mentre il rilevamento e la discriminazione degli stimoli gustativi si verificano probabilmente in modo sequenziale, i calcoli edonici che corrono in parallelo ai calcoli puramente sensoriali possono facilitare l’identificazione del gusto. Quindi, la cascata di elaborazione gustativa (compresi gli stadi percettivi o “pietre miliari” della rilevazione e della discriminazione) sembra essere una sequenza variabile di stati di codifica sensoriale dipendente dai gusti specifici e potenzialmente da altri fattori contestuali.
References
- Maintaining accuracy at the expense of speed: stimulus similarity defines odor discrimination time in mice. Neuron. 2004; 44:865-876. DOI | PubMed
- Dynamic taste responses of parabrachial pontine neurons in awake rats. J Neurophysiol. 2016; 115:1314-1323. DOI | PubMed
- An evolutionary perspective on food and human taste. Curr Biol. 2013; 23:R409-R418. DOI | PubMed
- Le temps de reaction aux excitations gustatives d’intensite differente. Cr Soc Biol. 1935; 119:1360-1362.
- Global, voxel, and cluster tests, by theory and permutation, for a difference between two groups of structural MR images of the brain. IEEE Trans Med Imaging. 1999; 18:32-42. PubMed
- The receptors and cells for mammalian taste. Nature. 2006; 444:288-294. DOI | PubMed
- Exceeding chance level by chance: the caveat of theoretical chance levels in brain signal classification and statistical assessment of decoding accuracy. J Neurosci Methods. 2015; 250:126-136. DOI | PubMed
- Development of taste perception in humans: sensitivity and preference throughout the life span. Psychol Bull. 1981; 90:43-73. PubMed
- Taste quality decoding parallels taste sensations. Curr Biol. 2015; 25:890-896. DOI | PubMed
- EEGLAB: an open source toolbox for analysis of single-trial EEG dynamics including independent component analysis. J Neurosci Methods. 2004; 134:9-21. DOI | PubMed
- LIBLINEAR: a library for large linear classification. J Mach Learn Res. 2008; 9:1871-1874.
- State-dependent modulation of time-varying gustatory responses. J Neurophysiol. 2006; 96:3183-3193. DOI | PubMed
- Behavioral modulation of gustatory cortical activity. Ann NY Acad Sci. 2009; 1170:403-406. DOI | PubMed
- Visual recognition: as soon as you know it is there, you know what it is. Psychol Sci. 2005; 16:152-160. DOI | PubMed
- Learning-related plasticity of temporal coding in simultaneously recorded amygdala-cortical ensembles. J Neurosci. 2008; 28:2864-2873. DOI | PubMed
- Constraints imposed on taste physiology by human taste reaction time data. Neurosci Biobehav Rev. 1986; 10:135-151. PubMed
- Shorter-lived neural taste representations in obese compared to lean individuals. Sci Rep. 2018; 8:11027. DOI | PubMed
- A gustatory stimulator. J Neurosci Methods. 2015; 255:12-16. DOI | PubMed
- Autoreject: automated artifact rejection for MEG and EEG data. Neuroimage. 2017; 159:417-429. DOI | PubMed
- Theta oscillations rapidly convey odor-specific content in human piriform cortex. Neuron. 2017; 94:207-219.e4. DOI | PubMed
- Natural stimuli evoke dynamic sequences of states in sensory cortical ensembles. Proc Natl Acad Sci USA. 2007; 104:18772-18777. DOI | PubMed
- Dynamic and multimodal responses of gustatory cortical neurons in awake rats. J Neurosci. 2001; 21:4478-4489. DOI | PubMed
- Gustatory processing is dynamic and distributed. Curr Opin Neurobiol. 2002; 12:448-454. PubMed
- The physical characteristics of open flow and closed flow taste delivery apparatus. Chem Senses. 1986; 11:89-104. DOI
- Characterizing the dynamics of mental representations: the temporal generalization method. Trends Cogn Sci. 2014; 18:203-210. PubMed
- Spatio-temporal analysis of cortical activity evoked by gustatory stimulation in humans. Chem Senses. 1999; 24:201-209. PubMed
- Pattern-information analysis: from stimulus decoding to computational-model testing. Neuroimage. 2011; 56:411-421. DOI | PubMed
- Reaction-time in the perceptual processing of taste quality. Chem Senses. 1986; 11:183-201. DOI
- Associations to odors: interference, mnemonics, and verbal labeling. J Exp Psychol Hum Learn. 1977; 3:52-59. PubMed
- Effect of stimulus presentation duration on gustatory reaction time. Physiol Behav. 1979; 22:319-324. PubMed
- Amiloride-insensitive salt taste is mediated by two populations of type III taste cells with distinct transduction mechanisms. J Neurosci. 2016; 36:1942-1953. DOI | PubMed
- The new cognitive neurosciences. MIT Press: Cambridge, MA; 1999.
- Object detection and basic-level categorization: sometimes you know it is there before you know what it is. Psychon Bull Rev. 2008; 15:28-35. PubMed
- Blind separation of auditory event-related brain responses into independent components. Proc Natl Acad Sci USA. 1997; 94:10979-10984. PubMed
- Nonparametric statistical testing of EEG- and MEG-data. J Neurosci Methods. 2007; 164:177-190. DOI | PubMed
- The molecular receptive ranges of human TAS2R bitter taste receptors. Chem Senses. 2010; 35:157-170. DOI | PubMed
- ADJUST: an automatic EEG artifact detector based on the joint use of spatial and temporal features. Psychophysiology. 2011; 48:229-240. DOI | PubMed
- High and low roads to odor valence? A choice response-time study. J Exp Psychol Hum Percept Perform. 2013; 39:1205-1211. DOI | PubMed
- Local field potentials in the gustatory cortex carry taste information. J Neurosci. 2014; 34:8778-8787. DOI | PubMed
- Speed and accuracy of taste identification and palatability: impact of learning, reward expectancy, and consummatory licking. Am J Physiol Regul Integr Comp Physiol. 2013; 305:R252-R270. DOI | PubMed
- Gustatory nerve impulses in rat, cat and rabbit. J Neurophysiol. 1955; 18:429-440. DOI | PubMed
- R Core Team (2017). R: A language and environment for statistical computing. R Foundation for Statistical Computing: Vienna, Austria.
- Taste buds: cells, signals and synapses. Nat Rev Neurosci. 2017; 18:485-497. DOI | PubMed
- Effects of cue-triggered expectation on cortical processing of taste. Neuron. 2012; 74:410-422. DOI | PubMed
- Functional magnetic resonance tomography correlates of taste perception in the human primary taste cortex. Neuroscience. 2004; 127:347-353. DOI | PubMed
- Separate, parallel sensory and hedonic pathways in the mammalian somatosensory system. Brain Res Bull. 2002; 58:243-260. PubMed
- Comparative expression of hedonic impact: affective reactions to taste by human infants and other primates. Neurosci Biobehav Rev. 2001; 25:53-74. PubMed
- Dietary fat induces sustained reward response in the human brain without primary taste cortex discrimination. Front Hum Neurosci. 2013; 7:36. DOI | PubMed
- Delta activity encodes taste information in the human brain. Neuroimage. 2018; 181:471-479. DOI | PubMed
- Breadth of tuning in taste afferent neurons varies with stimulus strength. Nat Commun. 2015; 6:8171. DOI | PubMed
- Gustatory reaction time in human adults. Physiol Behav. 1981; 26:715-719. PubMed
Fonte
Wallroth R, Ohla K (2018) As Soon as You Taste It: Evidence for Sequential and Parallel Processing of Gustatory Information. eNeuro 5(5): ENEURO.0269-18.2018. https://doi.org/10.1523/ENEURO.0269-18.2018





