Abstract
Introduzione
La malaria rimane una delle principali sfide sanitarie globali, con circa 216 milioni di nuovi casi e 445.000 decessi nel 2016 (Organizzazione Mondialedella Sanità, 2017). Mentre gli strumenti attuali hanno ridotto sostanzialmente il carico globale della malattia, nuovi strumenti saranno necessari per ottenere l’eliminazione della malaria (Walker etal., 2016). Lo sviluppo precoce di vaccini contro la malaria si è concentrato sul vaccino in fase pre-eritrocitica (PEV) – che ha suscitato una risposta immunitaria per evitare che gli sporozoiti in entrata stabilissero un’infezione brevettata – o in fase ematica – che ha potenziato le risposte naturali alle proteine di superficie sugli eritrociti infetti (Schwartz etal., 2012). Il primo vaccino antimalarico RTS,S/AS01 a completare gli studi di Fase III è un vaccino PEV e si è dimostrato parzialmente efficace, riducendo l’incidenza clinica nei bambini di 5-17 mesi del 36,3% (95%CI: 31,8 – 40,5%) nel follow-up di 40 mesi (RTSSClinical Trials Partnership, 2015). Altri candidati vaccini PEV includono quelli che raggiungono l’immunità protettiva attraverso gli sporozoiti di Plasmodium falciparum falciparum irradiato/attenuato per via endovenosa (ad esempio i vaccini PfSPZ[Seder et al., 2013]), quelli che utilizzano vettori virali per indurre risposte delle cellule T per fornire protezione(de Barra et al., 2014; MVVCgroup et al., 2015) e il promettente vaccino di nuova generazione RTS,S-like, R21 (Collins et al.,2017). Sono in fase di sviluppo anche una serie di vaccini che mirano alla trasmissione da uomo a zanzara attaccando antigeni sessuali, sporogonici e/o antigeni di zanzara (vaccini che bloccano la trasmissione, TBV) (Talaatet al., 2016; Wu et al., 2008). Le indagini precliniche hanno identificato diversi antigeni (ad esempio Pfs25, P230, P48/45) come bersagli per i candidati al TBV che, se somministrati, possono ridurre la trasmissione alle zanzare (Hoffman et al.,2015; Sauerwein e Richie, 2015), ma la traduzione completa o riproducibile alla clinica non è stata finora raggiunta (Talaat et al.,2016; Hoffman et al., 2015; Sauerwein e Richie, 2015).
Una delle maggiori sfide incontrate nello sviluppo di vaccini antimalarici PEV è la parziale protezione ottenuta contro ogni esposizione, nonostante gli elevati livelli di titoli anticorpali indotti. È stato ipotizzato che ciò possa essere in parte dovuto alla distribuzione eccessiva di sporozoiti in ogni morso infettivo, in modo tale che, nonostante l’induzione di un’elevata efficacia di uccisione per parassita, la probabilità che almeno un parassita raggiunga il fegato e progredisca fino all’infezione allo stadio ematico rimane alta(White et al., 2013; Bejon et al., 2005). L’approccio classico per superare questo problema è tentare di aumentare ulteriormente la quantità, l’ampiezza o la qualità della risposta immunitaria(Remarque et al., 2012; Courtin et al., 2009; Chaudhury et al., 2016). Abbiamo ipotizzato che un meccanismo alternativo sarebbe stato quello di combinare un PEV con approcci che riducano il numero di sporozoiti nelle ghiandole salivari delle zanzare. È stato dimostrato che i TBV agiscono in questo modo, riducendo la densità di ookinete e di sporozoite(Bompard et al., 2017; Blagborough et al., 2013). Abbiamo quindi cercato di identificare se questo meccanismo potesse portare a interazioni sinergiche tra PEV e TBV co-somministrato all’interno di una popolazione.
Per testare questa ipotesi, abbiamo utilizzato un test sulla popolazione murina per indagare l’eliminazione della malaria per più generazioni in un ambiente di laboratorio controllato(Blagborough et al., 2013). Qui, il parassita della malaria roditore Plasmodium berghei viene passato tra le popolazioni di topi attraverso l’alimentazione diretta delle zanzare Anopheles stephensi. Per simulare la risposta anticorpale a un PEV, un anticorpo monoclonale (mAb-3D11) – che prende di mira la stessa proteina circumsporozoite parassita corrispondente (CSP) come RTS,S – è stato trasferito passivamente (per via endovenosa) nei topi. Per agire come un PEV parzialmente efficace (ampiamente paragonabile a RTS,S), è stata selezionata una dose di mAb-3D11 che riduce la probabilità di trasmissione da zanzara a topo di ~50% (come valutato in popolazioni di topi ingenui, trasfuso con dosi diverse di 3D11, sfidato con cinque punture di zanzara, vedi Materiali e metodi). L’immunità sterilizzante del 47,2% è stata titolata su più sfide. Le azioni complementari di una risposta anticorpale TBV sono state simulate utilizzando un anticorpo monoclonale 4B7 (mAb-4B7) anti-Pfs25, somministrato per trasferimento passivo, che agisce sugli stessi stadi parassitari del candidato umano più avanzato al TBV, Pfs25(Talaat et al., 2016). Questo anticorpo monoclonale a blocco della trasmissione è stato utilizzato in combinazione con un parassita transgenico P. berghei(PbPfs25DR3) che esprime Pfs25 al posto del suo omologo roditore. PbPfs25DR3è fenotipicamente indistinguibile dal WT P. berghei, esprime Pfs25 sulla superficie dello zigote/ookinete, ed è stato usato in precedenza per saggiare una serie di TBV(Goodman et al., 2011; Kapulu et al., 2015). Una serie di dosi di mAb-4B7 trasfuso sono state testate in più (n = 6) saggi di alimentazione diretta per titolare le dosi appropriate per generare una riduzione del 50%, 65% e 85% nella trasmissione alla zanzara (misurata come riduzione della prevalenza di oocisti) (vedi Materiali e metodi).
Abbiamo intrapreso una serie di esperimenti con il solo PEV, con il solo TBV a tre diverse efficienze (50%, 65% e 85%), o con combinazioni dei due attraverso quattro generazioni di trasmissione. Per ogni esperimento i topi sono stati esposti a 1, 2, 5 o 10 punture di zanzara infettiva per consentire la stima di efficacia combinate di trasmissione-bloccanti tra il 20% e il 100% (Materiali e metodi).
Risultati
A livelli di esposizione alla dose di anticorpi TBV più bassi (50% e 65%), la probabilità di eliminare tutti i parassiti dalle popolazioni di topo e zanzare era maggiore quando gli anticorpi PEV e TBV venivano somministrati insieme rispetto ai singoli, indipendentemente dalla dose dell’anticorpo TBV somministrato(Figura 1). Utilizzando metodi statistici che catturano esplicitamente la densità dei parassiti e tengono conto dell’impatto degli interventi sia sulla prevalenza che sulla densità dell’infezione(Sherrard-Smith et al., 2017), abbiamo stimato che l’anticorpo PEV da solo riduce la prevalenza dell’infezione del 48,0% (intervallo credibile al 95%, CrI, 36,6-58,0%). Analogamente, l’uso del solo anticorpo TBV ha ridotto la prevalenza dell’infezione del 33,9% (95% CrI: 18,2-47,4%), 74,3% (65,7%-82,4%) e 95,8% (90,2%-100%) per i titoli di efficacia individuale del 50%, 65% e 85%, rispettivamente. Se le azioni dei due tipi di anticorpi dovessero agire indipendentemente, l’efficacia combinata prevista sarebbe dell’83,3% (79,1-87,0%). Un’efficacia sostanzialmente maggiore del 90,8% (86,7-94,2%) (p=0,0035) è stata osservata nel gruppo di anticorpi PEV +TBV, indicando un’interazione sinergica (Tabella 1). In questo caso, gli Intervalli Credibili al 95% non si sono sovrapposti alle stime mediane, dimostrando una differenza significativa tra i due trattamenti. La stessa relazione è stata osservata quando si è esaminata l’efficacia del vaccino contro la densità dei parassiti (p=0,0025)(Tabella 1).
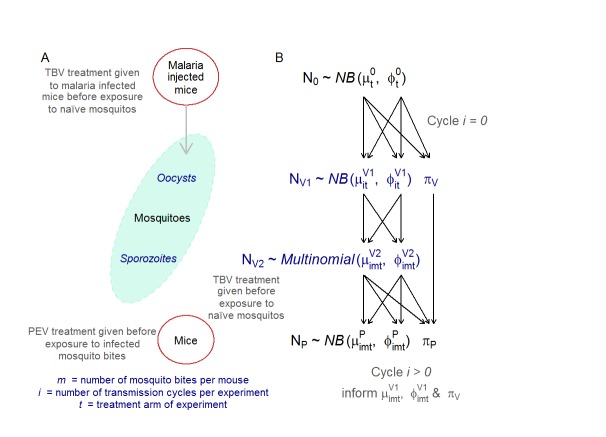
Figura 1-figure supplement 1.Adattamento da Malaria Journal (Sherrard-Smithet al., 2017) Uno schema grafico dell’esperimento di trasmissione multigenerazionale (A) e la sua rappresentazione matematica (B).Il numero in ogni casella (e il colore) mostra la percentuale di topi infettati per ogni braccio di trattamento dell’esperimento per ciclo di trasmissione e tasso di morso (il numero di punture di zanzare potenzialmente infettive ricevute per ogni topo). Nel ciclo di trasmissione 0, tutti i topi sono infetti (non mostrati), dove viene somministrato un anticorpo TBV (riga in alto: viola e blu) le infezioni nei topi sono progressivamente ridotte. L’anticorpo funziona meglio a dosi più elevate (TBV 85%) e a tassi di morso più bassi. L’anticorpo PEV (riga inferiore: giallo e verde) è efficace a tassi di puntura più bassi (dove ogni topo ha ricevuto una o due punture di zanzara potenzialmente infettive per ciclo di trasmissione), ma non è in grado di ridurre l’infezione a tassi di puntura più elevati. In combinazione, a qualsiasi tasso di morso, gli anticorpi combinati (riga inferiore: arancione) hanno sempre eliminato le infezioni per ciclo di trasmissione 2.(A) Il sistema del modello del topo zanzara. Cinque topi femmina (TO) (6-8 settimane, Harlan, Regno Unito) sono stati trattati con fenilidrazina e, 3 giorni dopo, sono stati infettati con 106P.berghei PbPfs25DR3(Goodmanet al., 2011). Tre giorni dopo, gruppi di topi infetti sono stati trattati con l’anticorpo TBV. Dopo 1 ora, i topi sono stati anestetizzati e 500 An. zanzare stefensi (linea SD 500, affamati per 24 ore) sono stati nutriti in modo casuale sui cinque topi infetti all’interno di ciascun gruppo. Le zanzare sono state mantenute come descritto in(Blagborough et al., 2013). Dopo 10 giorni, un sottocampione di 50 zanzare è stato esaminato al microscopio per misurare l’intensità e la prevalenza delle oocisti. Dopo 21 giorni dopo l’allattamento, gli sporozoiti sono presenti nelle ghiandole salivari e sono massimamente infettivi per l’ospite vertebrato(Blagborough et al., 2013). A questo punto, un numero predefinito di zanzare (per simulare un tasso di punture di zanzara di 1, 2, 5 e 10 punture di zanzara per topo) è stato poi selezionato a caso tra le zanzare rimanenti e nutrito, per 20 minuti, con topi anestetizzati di una coorte ingenua. Ogni gruppo di topi (cinque topi per gruppo) ha ricevuto l’anticorpo PEV o nessun intervento (controllo negativo). Le zanzare ingorgate sono state esaminate al microscopio subito dopo l’alimentazione per determinare il numero di sporozoite nelle ghiandole salivari. Dopo 10 giorni, gli strisci di sangue di ogni topo sono stati esaminati al microscopio per determinare la percentuale di parassitemia. A questi cinque topi è stato quindi somministrato l’anticorpo TBV alla dose desiderata per ottenere una riduzione del 50%, 65% o 85% della prevalenza delle oocisti, a seconda delle necessità, oppure nessun intervento/controllo (in accordo con il rispettivo braccio di trattamento). Una nuova coorte di 500 zanzare ingenue è stata quindi autorizzata ad alimentarsi di sangue sui topi. Questo ciclo di trasmissione da topo a topo è stato ripetuto fino a un massimo di quattro cicli dopo la semina della popolazione di topi o fino a quando non è stato rilevato alcun parassita nel sistema per due cicli di trasmissione successivi.(B) Il modello statistico rispecchiava l’impostazione sperimentale. La densità parassita iniziale generata dall’iniezione di topi N0L’intensità O’ dell’oocisti e la densità parassita nei topi trasmessa dalle punture di zanzara N, sono modellate ipotizzando distribuzioni binomiali negative negative a zero. I dati del conteggio degli sporozoiti S per le zanzare che mordono sono stati censurati, il che significa che i dati sono modellati come distribuzione multinomiale. Queste distribuzioni sono definite dalla media(µ , o, s per la densità dei parassiti nei topi, conteggio delle oocisti e conteggio degli sporozoiti nelle zanzare) e dalla dispersione (φ, τ, σ per la densità dei parassiti nei topi, conteggio delle oocisti e conteggio degli sporozoiti nelle zanzare) e da un’inflazione zero (πP, πV) parametri. I parametri della fase di vita precedente vengono utilizzati per informare la successiva (il rispettivo parametro che informa la fase di vita successiva è indicato dalle frecce). L’effetto m è modellato quando gli sporozoiti nelle zanzare propagano le infezioni parassitarie nei topi per ogni ciclo di trasmissione i e braccio di trattamento t. Tutte le cure e la manipolazione degli animali hanno seguito rigorosamente le Linee guida per la cura e l’uso degli animali preparate dall’Imperial College di Londra e sono state eseguite secondo la UK Home Office Licence 70/7185. Informazioni supplementari Tabella 1 – dati fonte 1 ( file excel separato). File dei dati grezzi relativi alla densità dei parassiti nei topi e nelle zanzare.
| Braccio d’intervento | Efficacia | Sinergia | ||||
|---|---|---|---|---|---|---|
| Riduzione della prevalenza (intervalli credibili al 95%) | Riduzione della densità (95% di intervalli credibili) | Prevalenza | p-valore | Densità | p-valore | |
| Efficacia dei singoli vaccini | ||||||
| Tutti i TBV combinati | 68.0 (61.1–74.1) | 51.5 (6.8–72.9) | ||||
| TBV: MAb-4B7 (50%) | 33.9 (18.2–47.4) | 13.6 (0–47.5) | ||||
| TBV: MAb-4B7 (65%) | 74.3 (65.7–82.4) | 69.3 (47.8–84.8) | ||||
| TBV: MAb-4B7 (85%) | 95.8 (90.2–100) | 94.2 (79.1–100) | ||||
| ΠεV: Mab-3D11 (50%) | 48.0 (36.6–58.0) | 2.8 (0–25.2) | ||||
| Efficacia combinata dei vaccini | ||||||
| ■PEV e tutti i TBV combinati | 90.8 (86.9–94.2) | 90.9 (79.0–96.4) | 1.09 (1.02–1.18) | p<0.0035 | 2.08 (1.20–5.02) | p<0.0025 |
| ΠεV (50%) e MAb-4B7 (50%) | 82.2 (74.6–88.9) | 85.8 (75.6–92.8) | 1.27 (1.07–1.60) | p<0.0015 | 19.04 (1.56–75.16) | p<0.0001 |
| PEV (50%) e MAb-4B7 (65%) | 92.8 (86.1 – 98.6) | 93.2 (75.4 – 99.7) | 1.07 (0.98 – 1.17) | p<0.0675 | 1.36 (1.02 – 1.97) | p<0.02 |
| ΠEV (50%) e MAb-4B7 (85%) | 96.9 (91.2 – 100) | 94.8 (74.4 – 100) | 0.99 (0.93 – 1.04) | p<0.5435 | 1.01 (0.78 – 1.22) | p<0.3755 |
Suddividendo i dati per dose di anticorpi TBV, il maggiore miglioramento sinergico dell’efficacia contro la prevalenza dei parassiti è stato osservato a dosi più basse di anticorpi funzionali TBV(Figura 2). Una dose di anticorpi TBV che riduce la trasmissione da topo a zanzara del 50% ha aumentato l’efficacia della prevalenza degli anticorpi PEV all’82,2% (74,6-88,9%) rispetto ad un’efficacia attesa del 65% (57,7-73,2%) se i vaccini hanno agito in modo indipendente, una forte indicazione di sinergia (p=0,0015). Simili effetti sinergici contro la densità dei parassiti sono stati osservati(Figura 2, p <0,0001). Effetti sinergici più deboli sono stati osservati contro la prevalenza e la densità dei parassiti per l’anticorpo PEV +TBV alla dose del 65% (Figura 2, p=0,0675, 0,02, rispettivamente) (Tabella1). Alla massima dose di anticorpo TBV (85%), il TBV da solo ha già ridotto i parassiti nella popolazione a bassi livelli, quindi non c’è stata una potenza sufficiente per rilevare un’ulteriore sinergia tra gli interventi in quanto tutti i parassiti sono stati eliminati dalla popolazione sperimentale(Figura 1).
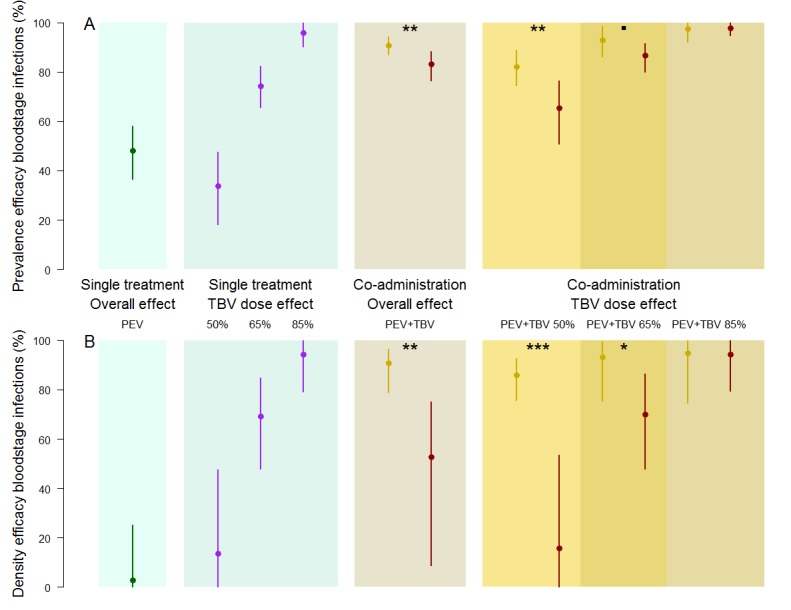
Figura 2.L’efficacia delle combinazioni di anticorpi del vaccino contro la prevalenza dei parassiti (la proporzione di ospiti infetti)(A) e la densità (la densità media di parassiti per ospite, misurata come numero di globuli rossi infetti su un sottocampione totale di 1200 eritrociti)(B) nei topi.L’efficacia osservata dell’anticorpo monoclonale PEV mAb-3D11 ad una dose precedentemente indicata per ridurre la trasmissione ai topi di ~50% quando esposti a cinque punture di zanzara infettiva. L’efficacia del TBV mAb-4B7 a dosi precedentemente mostrate per ridurre la trasmissione alle zanzare del 50%, 65% e 85% (sezione blu, linee viola). L’efficacia degli anticorpi somministrati insieme (sezioni auree) che sono stati osservati (oro) o attesi (rosso) sono stati efficacia per ogni anticorpo che agisce in modo indipendente (media (punto) e 95% intervalli credibili (linee) mostrati). Gli asterischi indicano livelli crescenti di sostegno della sinergia (p<0,1-•p<0,05*, p<0,01**, p<0,001***).
L’impatto della circolazione dell’anticorpo TBV sulla riduzione dei parassiti all’interno della zanzara spiega la maggiore efficacia dell’anticorpo PEV nei gruppi di trattamento combinato. La presenza dell’anticorpo TBV (mAb-4B7) ha ridotto il numero di oocisti nelle zanzare infette (ANOVA: F1,1525= 75.3, p<0.0001). Analogamente, la presenza di anticorpi TBV ha ridotto la densità di sporozoite nelle zanzare infette (ANOVA: F1,707= 163.9, p<0.0001). La Figura 3A,B e C illustrano ulteriormente l’effetto che i TBV hanno sulla distribuzione della densità di sporozoite per i gruppi di trattamento singolo TBV-50%, 65% e 85% rispettivamente. Ad ogni dose, la coda della distribuzione degli sporozoiti è ridotta progressivamente attraverso i cicli di trasmissione. La figura 3D illustra che l’efficacia del PEV è dipendente dalla densità, con una maggiore efficacia ottenuta quando le zanzare hanno una minore densità di sporozoite.
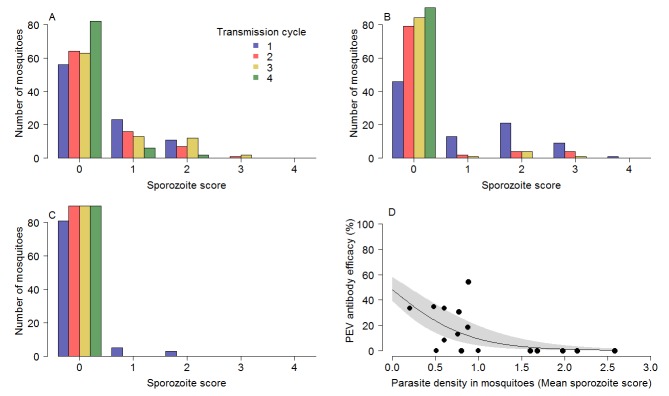
Figura 3.L’impatto dell’anticorpo monoclonale TBV mAb-4b7 sull’efficacia del PEV mAb-3D11.L’anticorpo TBV da solo riduce la coda della distribuzione della sporozoite nelle zanzare attraverso i cicli di trasmissione per la(A) dose del 50%,(B) dose del 65% e(C) dose dell’85%.(A-C) dimostrano che i punteggi degli sporozoiti (misurati su una scala log; 0 indica l’assenza di sporozoiti; 1 = 1-10 sporozoiti; 2 = 11-100 sporozoiti; 3 = 101-1000 sporozoiti e; 4 =>1000 sporozoiti per zanzara) tendono verso lo zero per i successivi cicli di trasmissione.(D) L’efficacia degli anticorpi PEV per prevenire la trasmissione da zanzara a topo a zanzara (una riduzione percentuale delle infezioni da sporozoite nelle zanzare) è maggiore a basse densità di parassiti di zanzara (come valutato dal punteggio di sporozoite dopo l’alimentazione del sangue).

Figura 1-figure supplement 1.Adattamento da Malaria Journal (Sherrard-Smithet al., 2017) Uno schema grafico dell’esperimento di trasmissione multigenerazionale (A) e la sua rappresentazione matematica (B).Il numero in ogni casella (e il colore) mostra la percentuale di topi infettati per ogni braccio di trattamento dell’esperimento per ciclo di trasmissione e tasso di morso (il numero di punture di zanzare potenzialmente infettive ricevute per ogni topo). Nel ciclo di trasmissione 0, tutti i topi sono infetti (non mostrati), dove viene somministrato un anticorpo TBV (riga in alto: viola e blu) le infezioni nei topi sono progressivamente ridotte. L’anticorpo funziona meglio a dosi più elevate (TBV 85%) e a tassi di morso più bassi. L’anticorpo PEV (riga inferiore: giallo e verde) è efficace a tassi di puntura più bassi (dove ogni topo ha ricevuto una o due punture di zanzara potenzialmente infettive per ciclo di trasmissione), ma non è in grado di ridurre l’infezione a tassi di puntura più elevati. In combinazione, a qualsiasi tasso di morso, gli anticorpi combinati (riga inferiore: arancione) hanno sempre eliminato le infezioni per ciclo di trasmissione 2.(A) Il sistema del modello del topo zanzara. Cinque topi femmina (TO) (6-8 settimane, Harlan, Regno Unito) sono stati trattati con fenilidrazina e, 3 giorni dopo, sono stati infettati con 106P.berghei PbPfs25DR3(Goodmanet al., 2011). Tre giorni dopo, gruppi di topi infetti sono stati trattati con l’anticorpo TBV. Dopo 1 ora, i topi sono stati anestetizzati e 500 An. zanzare stefensi (linea SD 500, affamati per 24 ore) sono stati nutriti in modo casuale sui cinque topi infetti all’interno di ciascun gruppo. Le zanzare sono state mantenute come descritto in(Blagborough et al., 2013). Dopo 10 giorni, un sottocampione di 50 zanzare è stato esaminato al microscopio per misurare l’intensità e la prevalenza delle oocisti. Dopo 21 giorni dopo l’allattamento, gli sporozoiti sono presenti nelle ghiandole salivari e sono massimamente infettivi per l’ospite vertebrato(Blagborough et al., 2013). A questo punto, un numero predefinito di zanzare (per simulare un tasso di punture di zanzara di 1, 2, 5 e 10 punture di zanzara per topo) è stato poi selezionato a caso tra le zanzare rimanenti e nutrito, per 20 minuti, con topi anestetizzati di una coorte ingenua. Ogni gruppo di topi (cinque topi per gruppo) ha ricevuto l’anticorpo PEV o nessun intervento (controllo negativo). Le zanzare ingorgate sono state esaminate al microscopio subito dopo l’alimentazione per determinare il numero di sporozoite nelle ghiandole salivari. Dopo 10 giorni, gli strisci di sangue di ogni topo sono stati esaminati al microscopio per determinare la percentuale di parassitemia. A questi cinque topi è stato quindi somministrato l’anticorpo TBV alla dose desiderata per ottenere una riduzione del 50%, 65% o 85% della prevalenza delle oocisti, a seconda delle necessità, oppure nessun intervento/controllo (in accordo con il rispettivo braccio di trattamento). Una nuova coorte di 500 zanzare ingenue è stata quindi autorizzata ad alimentarsi di sangue sui topi. Questo ciclo di trasmissione da topo a topo è stato ripetuto fino a un massimo di quattro cicli dopo la semina della popolazione di topi o fino a quando non è stato rilevato alcun parassita nel sistema per due cicli di trasmissione successivi.(B) Il modello statistico rispecchiava l’impostazione sperimentale. La densità parassita iniziale generata dall’iniezione di topi N0L’intensità O’ dell’oocisti e la densità parassita nei topi trasmessa dalle punture di zanzara N, sono modellate ipotizzando distribuzioni binomiali negative negative a zero. I dati del conteggio degli sporozoiti S per le zanzare che mordono sono stati censurati, il che significa che i dati sono modellati come distribuzione multinomiale. Queste distribuzioni sono definite dalla media(µ , o, s per la densità dei parassiti nei topi, conteggio delle oocisti e conteggio degli sporozoiti nelle zanzare) e dalla dispersione (φ, τ, σ per la densità dei parassiti nei topi, conteggio delle oocisti e conteggio degli sporozoiti nelle zanzare) e da un’inflazione zero (πP, πV) parametri. I parametri della fase di vita precedente vengono utilizzati per informare la successiva (il rispettivo parametro che informa la fase di vita successiva è indicato dalle frecce). L’effetto m è modellato quando gli sporozoiti nelle zanzare propagano le infezioni parassitarie nei topi per ogni ciclo di trasmissione i e braccio di trattamento t. Tutte le cure e la manipolazione degli animali hanno seguito rigorosamente le Linee guida per la cura e l’uso degli animali preparate dall’Imperial College di Londra e sono state eseguite secondo la UK Home Office Licence 70/7185. Informazioni supplementari Tabella 1 – dati fonte 1 ( file excel separato). File dei dati grezzi relativi alla densità dei parassiti nei topi e nelle zanzare.

Figura 1-figure supplement 1.Adattato da Malaria Journal (Sherrard-Smithet al., 2017) Uno schema grafico dell’esperimento di trasmissione multigenerazionale (A) e la sua rappresentazione matematica (B).(A) Il sistema del modello del topo zanzara. Cinque topi femmina (TO) (6-8 settimane, Harlan, Regno Unito) sono stati trattati con fenilidrazina e, 3 giorni dopo, sono stati infettati con 106P.berghei PbPfs25DR3(Goodmanet al., 2011). Tre giorni dopo, gruppi di topi infetti sono stati trattati con l’anticorpo TBV. Dopo 1 ora, i topi sono stati anestetizzati e 500 An. zanzare stefensi (linea SD 500, affamati per 24 ore) sono stati nutriti in modo casuale sui cinque topi infetti all’interno di ciascun gruppo. Le zanzare sono state mantenute come descritto in(Blagborough et al., 2013). Dopo 10 giorni, un sottocampione di 50 zanzare è stato esaminato al microscopio per misurare l’intensità e la prevalenza delle oocisti. Dopo 21 giorni dopo l’allattamento, gli sporozoiti sono presenti nelle ghiandole salivari e sono massimamente infettivi per l’ospite vertebrato(Blagborough et al., 2013). A questo punto, un numero predefinito di zanzare (per simulare un tasso di punture di zanzara di 1, 2, 5 e 10 punture di zanzara per topo) è stato poi selezionato a caso tra le zanzare rimanenti e nutrito, per 20 minuti, con topi anestetizzati di una coorte ingenua. Ogni gruppo di topi (cinque topi per gruppo) ha ricevuto l’anticorpo PEV o nessun intervento (controllo negativo). Le zanzare ingorgate sono state esaminate al microscopio immediatamente dopo l’alimentazione per determinare il numero di sporozoite nelle ghiandole salivari. Dopo 10 giorni, gli strisci di sangue di ogni topo sono stati esaminati al microscopio per determinare la percentuale di parassitemia. A questi cinque topi è stato quindi somministrato l’anticorpo TBV alla dose desiderata per ottenere una riduzione del 50%, 65% o 85% della prevalenza delle oocisti, a seconda delle necessità, oppure nessun intervento/controllo (in accordo con il rispettivo braccio di trattamento). Una nuova coorte di 500 zanzare ingenue è stata quindi autorizzata ad alimentarsi di sangue sui topi. Questo ciclo di trasmissione da topo a topo è stato ripetuto fino a un massimo di quattro cicli dopo la semina della popolazione di topi o fino a quando non è stato rilevato alcun parassita nel sistema per due cicli di trasmissione successivi.(B) Il modello statistico rispecchiava l’impostazione sperimentale. La densità parassita iniziale generata dall’iniezione di topi N0L’intensità O’ dell’oocisti e la densità parassita nei topi trasmessa dalle punture di zanzara N, sono modellate ipotizzando distribuzioni binomiali negative negative a zero. I dati del conteggio degli sporozoiti S per le zanzare che mordono sono stati censurati, il che significa che i dati sono modellati come distribuzione multinomiale. Queste distribuzioni sono definite dalla media(µ , o, s per la densità dei parassiti nei topi, conteggio delle oocisti e conteggio degli sporozoiti nelle zanzare) e dalla dispersione (φ, τ, σ per la densità dei parassiti nei topi, conteggio delle oocisti e conteggio degli sporozoiti nelle zanzare) e da un’inflazione zero (πP, πV) parametri. I parametri della fase di vita precedente vengono utilizzati per informare la successiva (il rispettivo parametro che informa la fase di vita successiva è indicato dalle frecce). L’effetto m è modellato quando gli sporozoiti nelle zanzare propagano le infezioni parassitarie nei topi per ogni ciclo di trasmissione i e braccio di trattamento t. Tutte le cure e la manipolazione degli animali hanno seguito rigorosamente le Linee guida per la cura e l’uso degli animali preparate dall’Imperial College di Londra e sono state eseguite secondo la UK Home Office Licence 70/7185. Informazioni supplementari Tabella 1 – dati fonte 1 ( file excel separato). File dei dati grezzi relativi alla densità dei parassiti nei topi e nelle zanzare.

Figura 2.Figura 2. L’efficacia delle combinazioni di anticorpi del vaccino contro la prevalenza dei parassiti (la proporzione di ospiti infetti) (A) e la densità (la densità media di parassiti per ospite, misurata come numero di globuli rossi infetti su un sottocampione totale di 1200 eritrociti)(B) nei topi.L’efficacia osservata dell’anticorpo monoclonale PEV mAb-3D11 ad una dose precedentemente indicata per ridurre la trasmissione ai topi di ~50% quando esposti a cinque punture di zanzara infettiva. L’efficacia del TBV mAb-4B7 a dosi precedentemente mostrate per ridurre la trasmissione alle zanzare del 50%, 65% e 85% (sezione blu, linee viola). L’efficacia degli anticorpi somministrati insieme (sezioni auree) che sono stati osservati (oro) o attesi (rosso) sono stati efficacia per ogni anticorpo che agisce in modo indipendente (media (punto) e 95% intervalli credibili (linee) mostrati). Gli asterischi indicano livelli crescenti di sostegno della sinergia (p<0,1-•p<0,05*, p<0,01**, p<0,001***).

Figura 3.L’impatto dell’anticorpo monoclonale TBV mAb-4b7 sull’efficacia di PEV mAb-3D11.L’anticorpo TBV da solo riduce la coda della distribuzione di sporozoite nelle zanzare attraverso i cicli di trasmissione per la(A) dose del 50%,(B) dose del 65% e(C) dose dell’85%.(A-C) dimostrano che i punteggi degli sporozoiti (misurati su una scala log; 0 indica l’assenza di sporozoiti; 1 = 1-10 sporozoiti; 2 = 11-100 sporozoiti; 3 = 101-1000 sporozoiti e; 4 =>1000 sporozoiti per zanzara) tendono verso lo zero per i successivi cicli di trasmissione.(D) L’efficacia degli anticorpi PEV per prevenire la trasmissione da zanzara a topo a zanzara (una riduzione percentuale delle infezioni da sporozoite nelle zanzare) è maggiore a basse densità di parassiti di zanzara (come valutato dal punteggio di sporozoite dopo l’alimentazione del sangue).
Discussione
È stato dimostrato che l’efficacia di più candidati PEV e TBV contro i roditori e i parassiti umani dipende dalla densità dei parassiti; l’efficacia del TBV (anti-Pfs25, anti-Pfs48/45 e siero immuno-bloccante) diminuisce con l’aumento della dose di parassiti(Churcher et al., 2012; Miura et al., 2016) e un rappresentante PEV (RTS,S) fornisce solo l’immunità sterilizzante nei volontari contro le zanzare leggermente infette(Churcher et al., 2017). Questo suggerisce che entrambi i tipi di vaccino possono arrestare la trasmissione contro una quantità definita (ma attualmente sconosciuta) di parassiti, che è sufficiente a prevenire l’infezione successiva in zanzare/umani leggermente infetti, ma che la trasmissione successiva è ancora possibile da zanzare o individui fortemente infetti.
In questo caso, un anticorpo TBV parzialmente efficace ha ridotto il numero di parassiti nelle zanzare infette, garantendo che gli anticorpi PEV incontrino meno parassiti di quanto ci si aspetterebbe se fosse somministrato solo un singolo anticorpo/vaccino in isolamento. Così, la conseguente riduzione del carico di parassiti ha aumentato l’efficacia del PEV quando è stato somministrato insieme a un TBV. Potenzialmente, una risposta sinergica potrebbe essere indotta da una non specificata interazione biochimica o immunologica tra i due vaccini. Questa spiegazione può essere esclusa all’interno di questo sistema in quanto il progetto sperimentale porta a misurare la trasmissione da zanzara a topo prima della somministrazione di un intervento di blocco della trasmissione (trasferimento passivo di mAb-4B7 1 ora prima dell’alimentazione del sangue) in quanto un nuovo, ingenuo lotto di topi è stato infettato in ogni generazione.
La sinergia maggiore è stata osservata nel gruppo di dosaggio più basso del TBV, anche se è probabile che operi in tutte le dosi di TBV e PEV quando il vaccino riduce la densità del parassita ma non riesce a cancellare l’infezione dall’ospite o dal vettore. La dose di TBV dell’85% somministrata da sola ha eliminato il parassita in una singola generazione senza l’azione del PEV, quindi non c’è stata l’opportunità di dimostrare la sinergia. Un PEV o TBV efficace al 100% non richiederebbe l’aumento con un vaccino alternativo, anche se la loro efficacia è ancora probabile che diminuisca nel tempo con il decadimento degli anticorpi, quindi la combinazione di un vaccino altamente efficace può essere ancora vantaggiosa a seconda dei tassi relativi di perdita di anticorpi.
Mentre la traducibilità diretta degli esperimenti sui roditori alla salute umana è variabile, questo approccio è inestimabile per dimostrare inequivocabilmente che il meccanismo alla base della sinergia osservata è il risultato diretto della riduzione della densità parassitaria dell’anticorpo TBV nei topi infetti e quindi permette all’anticorpo PEV dipendente dalla densità di essere ottimale(Figura 3). Questo meccanismo è molto probabile che rispecchi quello dell’uomo, che non può essere testato direttamente a causa di considerazioni etiche e di complesse variazioni ambientali. Mentre il sistema murino utilizza P. berghei, il meccanismo d’azione degli anticorpi PEV somministrati è abbinato al meccanismo anticorpale del vaccino RTS,S; cioè l’invasione di sporozoite del fegato è inibita dalla presenza di anticorpi mirati CSP nei topi sia in vivo che ex vivo (Grüneret al., 2003). Il ceppo P. berghei qui utilizzato è geneticamente modificato per esprimere il candidato umano TBV, P. falciparum P25 (Pfs25) al posto della sua controparte P. berghei. Così, un provato anti-falciparum TBV mAb (4B7) può essere usato direttamente all’interno del modello (Goodmanet al., 2011). L’evidenza che la co-somministrazione di anticorpi TBV e PEV può accelerare il controllo della trasmissione della malaria è un primo passo verso la sperimentazione di tali combinazioni in combinazioni e ambienti più naturali parassito-vettore-ospite. Ci sono buone ragioni per credere che le dinamiche di popolazione dei parassiti e dei vaccini parzialmente efficaci possano essere simili nella malaria umana. Si ritiene che la trasmissione della malaria umana da umana a zanzara e da zanzara a umana dipenda anche dalla densità del parassita(Churcher et al., 2013; Sinden et al., 2007). Il numero medio di oocisti nelle zanzare selvatiche catturate è probabilmente sostanzialmente inferiore ai numeri osservati nel sistema dei roditori(Rosenberg, 2008), ma la distribuzione delle oocisti è altamente dispersa(Medley et al., 1993), il che significa che alcune zanzare hanno infezioni ad alta densità. Queste zanzare altamente infette sono probabilmente più contagiose, quindi la riduzione della loro frequenza con l’aggiunta di un TBV potrebbe avere un ulteriore impatto sulla trasmissione complessiva. L’importanza epidemiologica di qualsiasi interazione sinergica tra i tipi di vaccino sul campo è difficile da prevedere e dipenderà da molti fattori di confusione come l’immunità umana, il trattamento farmacologico, la suscettibilità ai vettori, la fuga dell’antigene, tra gli altri. La trasmissione è probabile che sia altamente eterogenea, causata da fattori come i non-risponditori del vaccino e gli ospiti super-trasmettitori. L’impatto dei diversi tipi di eterogeneità può essere indagato in scenari di laboratorio controllati utilizzando il saggio della popolazione murina, variando la copertura vaccinata, la dose di anticorpi e cambiando l’eterogeneità del morso all’interno di una popolazione. Questo potrebbe aiutare a comprendere l’importanza relativa di queste diverse eterogeneità e potrebbe essere utilizzato per supportare la progettazione di studi di Fase III opportunamente potenziati (o progetti di studi alternativi) per valutare appieno l’impatto della combinazione dei componenti del vaccino con meccanismi d’azione alternativi.
Non esiste un intervento “magic bullet” contro la malaria e l’attuale strategia globale è quella di combinare il controllo dei vettori e gli strumenti di trattamento farmacologico in modo tempestivo per procedere verso l’eliminazione della malaria. I nostri risultati suggeriscono che lo stesso approccio potrebbe essere adottato per l’uso dei vaccini e comprendono la prima dimostrazione pratica che la combinazione di TBV e PEV può avere benefici ausiliari. La sinergia tra PEV e TBV potrebbe potenzialmente migliorare l’efficacia degli attuali vaccini PEV, con conseguente riduzione del carico e potenziale eliminazione in aree dove prima non era possibile. Lo sviluppo di nuovi vaccini antimalarici è costoso e richiede tempo. La combinazione di vaccini parzialmente efficaci di diverse classi antiparassitarie può quindi essere un modo pragmatico e potente per accelerare gli sforzi di eliminazione della malaria. La sinergia tra PEV, TBV e potenzialmente un vaccino in fase ematica (somministrato separatamente o come vaccino multicomponente) potrebbe potenzialmente migliorare l’efficacia dei singoli vaccini, con conseguente riduzione del carico e potenziale eliminazione in aree dove prima non era possibile.
Materiali e metodi
| Tipo di risorsa (specie) o risorsa | Designazione | Riferimento | Identificatori |
|---|---|---|---|
| Anticorpo | mAb-4b7 | (Stura et al., 1994) | RRID:AB_272828658 |
| Anticorpo | mAb-3D11 | (Mishra et al., 2012) | RRID:AB_272828657 |
Surrogato del vaccino che blocca la trasmissione: anticorpo monoclonale 4B7 (mAb-4B7)
Il TBV mAb-4B7 neutralizza la proteina Pfs25 nelle fasi sessuali della malaria umana P. falciparum e riduce la trasmissione del parassita da ospite a zanzara(Stura et al., 1994). Il parassita transgenico della malaria murina, P. berghei PbPfs25DR3, che esprime il Pfs25 nativo al posto del suo omologo roditore, è stato utilizzato in modo da poter esaminare lo stesso candidato all’anticorpo TBV all’interno di un modello murino(Goodman et al., 2011). MAb-4B7 è stato somministrato ed esaminato a concentrazioni subottimali titolate per ridurre la prevalenza di oocisti nel midgut della zanzara (come valutato utilizzando un test di alimentazione diretta) del 50, 65 o 85%. Data la gravità della malaria, l’OMS, lo Strategic Advisory Group of Experts (SAGE) on Immunization e il Malaria Policy Advisory Committee (MPAC) hanno raccomandato che il vaccino RTS,S possa essere implementato nei paesi pilota nell’ottobre 2015(http://www.malariavaccine.org/malaria-and-vaccines/first-generation-vaccine/rtss, visitato il 04/04/2018) quando il vaccino ha dimostrato un’efficacia relativamente bassa di appena il 36,3% nei bambini di età compresa tra i 5 e i 17 mesi(RTSS Clinical Trials Partnership, 2015). Queste dosi di TBV sono state scelte per colmare una gamma di efficacia del vaccino contro la malaria che potrebbe essere accettabile per l’OMS, SAGE e MPAC. In breve, per titolare la dose appropriata, le femmine di topi Tuck Ordinary (TO) (6-8 settimane, Harlan, Regno Unito) sono state trattate con fenilidrazina, e tre giorni dopo, infettate con 106P.berghei PbPfs25DR3(Goodmanet al., 2011). Tre giorni dopo, i topi infetti sono stati iniettati per via endovenosa(i.v.) con 200 µl di mAb-4B7 purificato in una gamma di dosi. Topi di controllo negativo sono stati trasfusi con 200 µl di tampone fosfato salino (PBS). Dopo 1 ora, i topi sono stati anestetizzati e 50 Anopheles zanzare stefensi (linea SD 500, precedentemente affamati per 24 ore) sono stati autorizzati a nutrirsi di ogni singolo topo. Le zanzare sono state mantenute come descritto in(Blagborough et al., 2013), e dopo 10 giorni, 50 zanzare sono state sezionate ed esaminate al microscopio per misurare l’intensità e la prevalenza delle oocisti. Questo è stato ripetuto cinque volte, con dosi di mAb-4B7 somministrate per via endovenosa che vanno da 0 µg a 750 µg. L’efficacia della prevalenza è stata stimata in funzione della concentrazione di mAb-4B7 utilizzando un modello lineare generalizzato(Bolker et al., 2009) in cui il replicato sperimentale è stato trattato come un effetto casuale. Una funzione di Gompertz(Churcher et al., 2013) è stata inserita nei dati utilizzando metodi di massima probabilità. Le concentrazioni medie sono state stimate utilizzando il modello più adatto (determinato da test di log-likelihood) con intervalli di confidenza del 95% ottenuti dalla probabilità del profilo. Abbiamo stimato che è stata necessaria una dose di mAb-4B7 di 284,2 µg i.v (244,7-337,3 µg) per ottenere una riduzione della prevalenza del 50%, una dose di 371.8 µg i.v (319,8-442,8 µg) per una riduzione del 65% e una dose di 629,5 µg i.v (525-777,1 µg ) per una riduzione dell’85%. Queste dosi calcolate sono state poi utilizzate nel sistema del modello di topo zanzara come descritto di seguito.
Surrogato del vaccino preeritrocitario: anticorpo monoclonale 3D11 (mAb-3D11)
L’anti-P. berghei CSP mAb-3D11(Mishra et al., 2012) è meccanicamente simile al vaccino RTS,S per la malaria umana recentemente registrato, in quanto la presenza di anticorpi mirati CSP nei topi inibisce l’invasione di sporozoite nel fegato sia in vivo che ex vivo(Grüner et al., 2003). Una dose appropriata per mAb-3D11 è stata stimata da 40 trasferimenti passivi individuali, somministrando una gamma di dosi di mAb-3D11 (0-150 µg i.v.) ai topi (da 5 a 10 topi per esperimento) e determinando l’efficacia di prevalenza alla dose data. Una funzione logistica è stata inserita in questi dati utilizzando RStan(Stan Development Team, 2017) per determinare la dose media e il 95% di intervalli credibili che produce una riduzione del ~50% della probabilità di infezione. Di conseguenza, l’anticorpo mAb-3D11 è stato somministrato a una singola dose non ottimale (50 µg i.v.) che ha impedito il 47,2% (38,0-62,0% 95%CI) di trasmissione ai topi che hanno ricevuto ciascuno 5 punture di zanzara potenzialmente infettive. Questa dose è stata selezionata per corrispondere alla protezione approssimativa osservata da RTS,S negli studi clinici sull’uomo.
Il sistema del modello di zanzara topo
Il modello di trasmissione da mouse a mouse è stato descritto in dettaglio in precedenza(Upton et al., 2015; Blagborough et al., 2013)(Figura 1-figure supplement 1). In breve, cinque topi femmina (TO) (6-8 settimane, Harlan, Regno Unito) sono stati trattati con fenilidrazina, e, 3 giorni dopo, sono stati infettati con 106P.berghei PbPfs25DR3(Goodmanet al., 2011). Tre giorni dopo, gruppi di topi infetti sono stati trattati con l’anticorpo TBV. Dopo 1 ora, i topi sono stati anestetizzati e 500 An. zanzare stefensi (linea SD 500, affamati per 24 ore) sono stati nutriti in modo casuale sui cinque topi infetti all’interno di ciascun gruppo. Le zanzare sono state mantenute come descritto in Blagborough et al., 2013. Dopo 10 giorni, un sottocampione di 50 zanzare è stato esaminato al microscopio per misurare l’intensità e la prevalenza delle oocisti. Dopo 21 giorni dopo l’allattamento, gli sporozoiti sono presenti nelle ghiandole salivari e sono massimamente infettivi per l’ospite vertebrato(Blagborough et al., 2013). A questo punto, un numero predefinito di zanzare (per simulare un tasso di punture di zanzara di 1, 2, 5 e 10 punture di zanzara per topo) è stato poi selezionato a caso tra le zanzare rimanenti e nutrito, per 20 minuti, con topi anestetizzati di una coorte ingenua. Il tasso di punture di zanzara è un aspetto del disegno sperimentale che può essere variato per poter stimare con maggiore precisione la dimensione dell’effetto. Se il tasso di puntura di zanzara è piccolo (diciamo 1 o 2), la probabilità che l’infezione venga eliminata rapidamente nel braccio di intervento dell’esperimento è alta (>80%) per TBD/TBV con efficacia superiore al 40%. Quindi, non possiamo discriminare a un basso tasso di punture di zanzara tra un TBD/TBV con un’efficacia del 60% e uno con un’efficacia dell’80% (entrambi eliminano). Tuttavia, otteniamo un alto grado di discriminazione tra un’efficacia del 20% e una del 40%. Pertanto, è necessario un piccolo tasso di punture di zanzara per ottenere una stima precisa della dimensione dell’effetto di un TBD/TBV con un’efficacia inferiore. Anche il contrario vale, quindi è necessario un alto tasso di punture di zanzara (fino a circa 10 in base al nostro esperimento iniziale) per ottenere una stima precisa di un TBV/TBD con un’efficacia >80%. L’utilizzo di tassi di puntura di zanzara multipli aumenta la precisione complessiva della nostra stima dell’efficacia della prevalenza.
Ogni gruppo di topi (cinque topi per gruppo) ha ricevuto l’anticorpo PEV o nessun intervento (controllo negativo). Le zanzare ingerite sono state esaminate al microscopio immediatamente dopo l’alimentazione per determinare il numero di sporozoiti nelle ghiandole salivari. Dopo 10 giorni, gli strisci di sangue di ogni topo sono stati esaminati al microscopio per determinare la percentuale di parassitemia. A questi cinque topi è stato quindi somministrato l’anticorpo TBV alla dose desiderata per ottenere una riduzione del 50%, 65% o 85% della prevalenza delle oocisti, a seconda delle necessità, oppure nessun intervento/controllo (in accordo con il rispettivo braccio di trattamento). Una nuova coorte di 500 zanzare ingenue è stata quindi autorizzata ad alimentarsi di sangue sui topi. Questo ciclo di trasmissione da topo a topo è stato ripetuto fino a un massimo di quattro cicli dopo la semina della popolazione di topi o fino a quando non è stato rilevato alcun parassita nel sistema per due cicli di trasmissione successivi. Gli anticorpi PEV e TBV ad ogni dose (corrispondente ad una riduzione della trasmissione alle zanzare del 50%, 65% e 85%) sono stati testati singolarmente e in combinazione.
La densità iniziale dei parassiti è stata misurata contando il numero di globuli rossi infetti (su un sottocampione totale di 1200 eritrociti). Il numero di sporozoiti nelle ghiandole salivari dopo l’alimentazione del sangue è stato contato sulla scala logaritmica (punteggi di 0-4 che rappresentano rispettivamente 0, 1-10, 11-100, 101-1000, 1000 + sporozoiti). I dati sono forniti nella tabella 1 – dati fonte 1.
1. Dichiarazione etica
Tutte le procedure relative agli animali sono state eseguite in conformità con i termini della legge britannica sulle procedure scientifiche (PPL 70/8788) e sono state approvate dall’Imperial College Animal Welfare and Ethical Review Body (AWERB) Le linee guida LASA dell’Imperial College sono state rispettate in tutti i punti. L’Office of Laboratory Animal Welfare Assurance for Imperial College copre tutte le attività sostenute dal servizio sanitario pubblico che coinvolgono vertebrati vivi negli Stati Uniti (n. A5634-01).
Analisi statistiche
La complessità del dosaggio della popolazione richiede metodi non standard di analisi statistiche che possano tenere conto delle dinamiche non lineari di trasmissione e delle fluttuazioni stocastiche viste dal numero relativamente piccolo di topi utilizzati in ogni generazione e braccio di trattamento. Questi metodi devono essere in grado di determinare se l’interazione tra i diversi anticorpi, che simulano gli anticorpi innescati dal vaccino, è inferiore a quanto ci si aspetterebbe se gli effetti del vaccino fossero meno forti di quanto ci si aspetterebbe se gli effetti fossero moltiplicati (sub-moltiplicativi), indipendentemente dalla presenza dell’altro vaccino (moltiplicativi) o sinergici, in quanto gli effetti sono potenziati per uno o entrambi i tipi di vaccino (super-moltiplicativi).
Un modello di densità è stato sviluppato appositamente per questo scopo (descritto per intero,[Sherrard-Smith et al., 2017], Figura 1-figure supplement 1). La struttura del modello cattura l’impostazione sperimentale e si adatta esplicitamente alle densità dei parassiti durante le successive fasi di vita per generare stime più precise dell’efficacia del vaccino simulato rispetto al confronto diretto dei soli dati grezzi, che possono fluttuare ampiamente a causa del caso (in quanto ogni generazione ha solo cinque topi)(Tabella 1 – dati fonte 1). L’eliminazione stocastica (o rinascita) è possibile nel sistema murino, data la necessità etica di mantenere piccole le popolazioni di topi in ogni generazione; poiché vengono utilizzati solo cinque topi, la trasmissione potrebbe essere interrotta o potenziata dalla variabilità naturale della risposta fisiologica di ogni singolo topo. La modalità statistica, tuttavia, affronta esplicitamente questa variazione modellando la distribuzione degli agenti patogeni in ogni fase della trasmissione per ogni singolo topo. Incorporando esplicitamente l’eterogeneità nel carico patogeno del topo, il modello evita distorsioni nell’inferenza del processo di trasmissione stesso. Tutti i parametri sono stati montati congiuntamente utilizzando una distribuzione posteriore bayesiana in RStan (versione 2.13.1,[Stan Development Team, 2017]). Per garantire un adattamento robusto, è stato utilizzato un metodo di parametrizzazione non centrato(Papaspiliopoulos et al., 2007; Betancourt e Girolami, 2015). L’adattamento dei parametri del modello è stato ottenuto utilizzando un metodo hamiltoniano di Montecarlo(Stan Development Team, 2017), il riscaldamento è stato di 500 e i successivi 500 campioni di ogni catena (n = 4) sono stati utilizzati per i controlli predittivi posteriori (Sherrard-Smithet al., 2017). Il modello è stato convalidato visualizzando le misurazioni dei dati grezzi osservati della densità dei parassiti nei topi, i conteggi delle oocisti e i conteggi logaritmici degli sporozoiti nelle zanzare rispetto alle previsioni del modello. I dati sono stati analizzati a scale diverse, prendendo prima tutti i dati insieme prima di scomporre l’impatto per la dose dell’anticorpo TBV.
L’efficacia della prevalenza contro le infezioni nei topi è la differenza percentuale nella proporzione di ospiti infetti tra i bracci di controllo e di trattamento dell’esperimento. L’efficacia della densità parassita contro le infezioni nei topi è la differenza percentuale nella densità parassita media per ospite tra il braccio di controllo e quello di trattamento dell’esperimento. (Allo stesso modo, l’efficacia può essere calcolata per la riduzione delle oocisti o degli sporozoiti nelle popolazioni di zanzare).
Le stime di efficacia sono state generate per ogni braccio dell’esperimento, per ogni disegno posteriore del modello (2000 disegni posteriori). Questo permette di calcolare intervalli medi e credibili al 95% per ogni gruppo di trattamento(c) e per ogni tasso di puntura di zanzara(m) e cicli di trasmissione(i). Lasciamo che Pc,m,ijindicare la prevalenza di topi infetti(j= 1) o la densità asessuata media dei parassiti nella popolazione di topi (j = 2). Il braccio di trattamento 0 rappresenta i dati di controllo, e c indica i trattamenti da 1 a 7 (anticorpo TBV al 50%, 65%, 85% dose singola, anticorpo PEV singola, PEV e anticorpo TBV al 50%, 65% e 85% dose singola), in modo tale che,(1)Ec,m,ij=P0,m,ij-Pc,m,ijP0,m,ij×100 dove Ec,m,ij è l’efficacia della prevalenza del parassita (j = 1) o l’efficacia della densità (j = 2) contro le infezioni nei topi, come stimato dalle previsioni posteriori del modello di densità (Tabella 1).
Per valutare statisticamente se l’interazione tra anticorpi PEV e TBV è antagonista, indipendente o sinergica, le stime di efficacia contro le infezioni nei topi per i trattamenti con anticorpi combinati sono state confrontate con le stime previste se gli anticorpi hanno un impatto indipendente (efficacia prevista). Per stimare questa efficacia prevista, i singoli gruppi di trattamento con anticorpi sono stati combinati come segue(VanderWeele e Knol, 2014): (2) Efficacia prevista=Epev*(1-Etbv,d)+Etbv,ddove Etbv,d è la prevalenza o l’efficacia della densità per il solo trattamento con anticorpi anti TBV (alla dose specificata di TBV di d = 50%, 65% o 85% ), ed Epev è la prevalenza o l’efficacia della densità per il solo PEV. Il rapporto tra l’efficacia per i trattamenti combinati e l’efficacia prevista per i trattamenti abbinati è stato utilizzato per valutare la sinergia. Un’interazione sinergica è indicata quando questo rapporto è maggiore di 1, un’interazione indipendente quando è uguale a 1 e un impatto antagonista se inferiore a 1(Figura 4). Gli intervalli credibili al 95% sono stati calcolati per dare un supporto statistico. L’evidenza statistica di una differenza negli esperimenti di trattamento e di controllo (p-valore) è stata definita come uno meno la proporzione di iterazioni dalle simulazioni del modello che erano maggiori di 1.
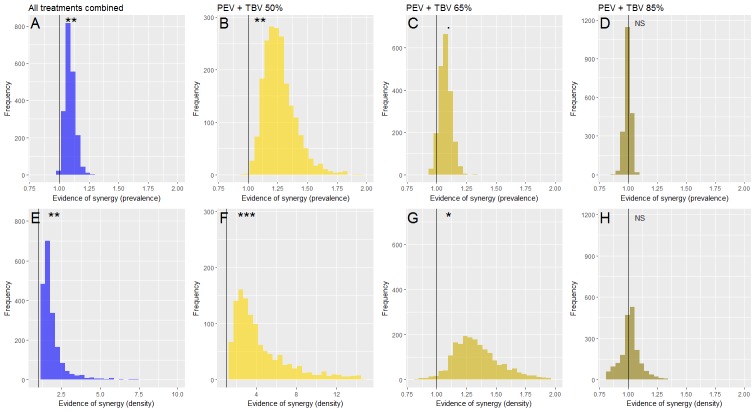
Figura 4.Evidenza di un effetto sinergico di prevalenza parassita(A-D) o densità parassita (E-H) della combinazione dell’anticorpo monoclonale TBV (mAb-4B7) con PEV mAb-3D11.Gli istogrammi di frequenza mostrano la probabilità che gli anticorpi somministrati insieme abbiano un’efficacia maggiore che se agissero indipendentemente. In tutti i pannelli, la linea nera verticale evidenzia il valore 1, al di sopra di questa linea indica la sinergia, al di sotto denota un’interazione antagonista e cadendo a uno indica che gli anticorpi agiscono in modo indipendente (evidenza della sinergia p<0.1., p<0.05*, p<0.01**, p<0.001***). Prendendo tutti i dati insieme(A ed E), c’è un effetto sinergico della combinazione degli anticorpi del vaccino, dato che la maggior parte delle iterazioni sono superiori a 1. Questo effetto è più forte a dosi più basse di mAb-4B7 (B, C, F e G, notare i diversi valori degli assi x che indicano un supporto più forte per le dosi più basse di anticorpi anti TBV), e più forte contro la densità del parassita(E-H) rispetto alla prevalenza del parassita.
La sinergia osservata può essere spiegata perché la presenza dell’anticorpo TBV riduce il punteggio di sporozoite (come misura della densità parassita nella popolazione di zanzare) che permette agli anticorpi PEV di raggiungere una maggiore efficienza. Per capire se i trattamenti combinati con gli anticorpi TBV hanno migliorato l’azione del PEV a densità parassitarie più elevate, i dati grezzi che registrano i punteggi di sporozoite di ogni topo nei gruppi di anticorpi TBV del singolo trattamento sono stati tracciati per ogni dose e attraverso i cicli di trasmissione per dimostrare che ci sono progressivamente più zanzare senza infezione e progressivamente meno zanzare con infezioni pesanti(Figura 3). Questo evidenzia che il PEV nei gruppi di trattamento combinato sta agendo contro un numero progressivamente inferiore di parassiti in ogni ciclo di trasmissione a causa dell’azione iniziale dell’anticorpo TBV. È stata eseguita una semplice analisi della varianza per confermare che la presenza del rispettivo tipo di anticorpo (PEV che agisce contro le infezioni nei topi, TBV che agisce contro gli sporozoiti nelle zanzare), come covariata binaria, potrebbe spiegare la riduzione del numero di parassiti nelle zanzare o nei topi. Per dimostrare che l’anticorpo PEV ha un impatto dipendente dalla densità, sono state inserite curve di regressione logistica binomiale per determinare la relazione tra l’efficacia della prevalenza dell’anticorpo PEV e la densità parassita nelle zanzare (misurata come punteggio medio di sporozoite per ogni tasso di morso di zanzara e ciclo di trasmissione, n = 16). I parametri che descrivono le curve di regressione sono stati montati utilizzando una distribuzione posteriore bayesiana in RStan (versione 2.13.1,[Stan Development Team, 2017]). L’adattamento dei parametri del modello è stato realizzato utilizzando un metodo Hamiltoniano Monte Carlo(Stan Development Team, 2017), il warmup è stato di 1000 e i successivi 1000 campioni di ogni catena (n = 4) sono stati utilizzati per i controlli predittivi posteriori (StanDevelopment Team, 2017). Tutte le analisi dei dati sono state condotte utilizzando il software statistico R (versione 3.2.2;[Core Team, 2014]).

Figura 4.Figura 4. Prova di un effetto sinergico della prevalenza parassitaria(A-D) o della densità parassitaria (E-H) della combinazione dell’anticorpo monoclonale TBV (mAb-4B7) con PEV mAb-3D11.Gli istogrammi di frequenza mostrano la probabilità che gli anticorpi somministrati insieme abbiano un’efficacia maggiore che se agissero indipendentemente. In tutti i pannelli, la linea nera verticale evidenzia il valore 1, al di sopra di questa linea indica la sinergia, al di sotto denota un’interazione antagonista e cadendo a uno indica che gli anticorpi agiscono in modo indipendente (evidenza della sinergia p<0.1., p<0.05*, p<0.01**, p<0.001***). Prendendo tutti i dati insieme(A ed E), c’è un effetto sinergico della combinazione degli anticorpi del vaccino, dato che la maggior parte delle iterazioni sono superiori a 1. Questo effetto è più forte a dosi più basse di mAb-4B7 (B, C, F e G, notare i diversi valori degli assi x che indicano un supporto più forte per le dosi più basse di anticorpi anti TBV), e più forte contro la densità del parassita(E-H) rispetto alla prevalenza del parassita.
References
- Bejon P, Andrews L, Andersen RF, Dunachie S, Webster D, Walther M, Gilbert SC, Peto T, Hill AV. Calculation of liver-to-blood inocula, parasite growth rates, and preerythrocytic vaccine efficacy, from serial quantitative polymerase chain reaction studies of volunteers challenged with malaria sporozoites. The Journal of Infectious Diseases. 2005; 191:619-626. DOI | PubMed
- Betancourt M, Girolami M. Current Trends in Bayesian Methodology with Applications. Chapman and Hall CRC Press Taylor & Francis Group: Boca Raton London New York; 2015. DOI
- Blagborough AM, Churcher TS, Upton LM, Ghani AC, Gething PW, Sinden RE. Transmission-blocking interventions eliminate malaria from laboratory populations. Nature Communications. 2013; 4DOI | PubMed
- Bolker BM, Brooks ME, Clark CJ, Geange SW, Poulsen JR, Stevens MH, White JS. Generalized linear mixed models: a practical guide for ecology and evolution. Trends in Ecology & Evolution. 2009; 24:127-135. DOI | PubMed
- Bompard A, Da DF, Yerbanga RS, Biswas S, Kapulu M, Bousema T, Lefèvre T, Cohuet A, Churcher TS. Evaluation of two lead malaria transmission blocking vaccine candidate antibodies in natural parasite-vector combinations. Scientific Reports. 2017; 7DOI | PubMed
- Chaudhury S, Ockenhouse CF, Regules JA, Dutta S, Wallqvist A, Jongert E, Waters NC, Lemiale F, Bergmann-Leitner E. The biological function of antibodies induced by the RTS,S/AS01 malaria vaccine candidate is determined by their fine specificity. Malaria Journal. 2016; 15DOI | PubMed
- Churcher TS, Blagborough AM, Delves M, Ramakrishnan C, Kapulu MC, Williams AR, Biswas S, Da DF, Cohuet A, Sinden RE. Measuring the blockade of malaria transmission–an analysis of the standard membrane feeding assay. International Journal for Parasitology. 2012; 42:1037-1044. DOI | PubMed
- Churcher TS, Bousema T, Walker M, Drakeley C, Schneider P, Ouédraogo AL, Basáñez MG. Predicting mosquito infection from Plasmodium falciparum gametocyte density and estimating the reservoir of infection. eLife. 2013; 2DOI | PubMed
- Churcher TS, Sinden RE, Edwards NJ, Poulton ID, Rampling TW, Brock PM, Griffin JT, Upton LM, Zakutansky SE, Sala KA, Angrisano F, Hill AV, Blagborough AM. Probability of transmission of malaria from mosquito to human is regulated by mosquito parasite density in naïve and vaccinated hosts. PLoS Pathogens. 2017; 13DOI | PubMed
- Collins KA, Snaith R, Cottingham MG, Gilbert SC, Hill AVS. Enhancing protective immunity to malaria with a highly immunogenic virus-like particle vaccine. Scientific Reports. 2017; 7DOI | PubMed
- Core Team R. R Foundation for Statistical Computing: Vienna, Austria; 2014. Publisher Full Text
- Courtin D, Oesterholt M, Huismans H, Kusi K, Milet J, Badaut C, Gaye O, Roeffen W, Remarque EJ, Sauerwein R, Garcia A, Luty AJ. The quantity and quality of African children’s IgG responses to merozoite surface antigens reflect protection against Plasmodium falciparum malaria. PLoS One. 2009; 4DOI | PubMed
- de Barra E, Hodgson SH, Ewer KJ, Bliss CM, Hennigan K, Collins A, Berrie E, Lawrie AM, Gilbert SC, Nicosia A, McConkey SJ, Hill AV. A phase Ia study to assess the safety and immunogenicity of new malaria vaccine candidates ChAd63 CS administered alone and with MVA CS. PLoS One. 2014; 9DOI | PubMed
- Goodman AL, Blagborough AM, Biswas S, Wu Y, Hill AV, Sinden RE, Draper SJ. A viral vectored prime-boost immunization regime targeting the malaria Pfs25 antigen induces transmission-blocking activity. PLoS ONE. 2011; 6DOI | PubMed
- Grüner AC, Snounou G, Brahimi K, Letourneur F, Rénia L, Druilhe P. Pre-erythrocytic antigens of plasmodium falciparum: from rags to riches?. Trends in Parasitology. 2003; 19:74-78. DOI | PubMed
- Hoffman SL, Vekemans J, Richie TL, Duffy PE. The march toward malaria vaccines. Vaccine. 2015; 33:D13-D23. DOI | PubMed
- Kapulu MC, Da DF, Miura K, Li Y, Blagborough AM, Churcher TS, Nikolaeva D, Williams AR, Goodman AL, Sangare I, Turner AV, Cottingham MG, Nicosia A, Straschil U, Tsuboi T, Gilbert SC, Long CA, Sinden RE, Draper SJ, Hill AV, Cohuet A, Biswas S. Comparative assessment of transmission-blocking vaccine candidates against plasmodium falciparum. Scientific Reports. 2015; 5DOI | PubMed
- Medley GF, Sinden RE, Fleck S, Billingsley PF, Tirawanchai N, Rodriguez MH. Heterogeneity in patterns of malarial oocyst infections in the mosquito vector. Parasitology. 1993; 106DOI | PubMed
- Mishra S, Nussenzweig RS, Nussenzweig V. Antibodies to Plasmodium circumsporozoite protein (CSP) inhibit sporozoite’s cell traversal activity. Journal of Immunological Methods. 2012; 377:47-52. DOI | PubMed
- Miura K, Stone WJ, Koolen KM, Deng B, Zhou L, van Gemert GJ, Locke E, Morin M, Bousema T, Sauerwein RW, Long CA, Dechering KJ. An inter-laboratory comparison of standard membrane-feeding assays for evaluation of malaria transmission-blocking vaccines. Malaria Journal. 2016; 15DOI | PubMed
- Ogwang C, Kimani D, Edwards NJ, Roberts R, Mwacharo J, Bowyer G, Bliss C, Hodgson SH, Njuguna P, Viebig NK, Nicosia A, Gitau E, Douglas S, Illingworth J, Marsh K, Lawrie A, Imoukhuede EB, Ewer K, Urban BC, Hill AVS, Bejon P, MVVC group. Prime-boost vaccination with chimpanzee adenovirus and modified vaccinia ankara encoding TRAP provides partial protection against Plasmodium falciparum infection in Kenyan adults. Science Translational Medicine. 2015; 7DOI | PubMed
- N’Guessan R, Ngufor C, Kudom AA, Boko P, Odjo A, Malone D, Rowland M. Mosquito nets treated with a mixture of chlorfenapyr and alphacypermethrin control pyrethroid resistant Anopheles gambiae and Culex quinquefasciatus mosquitoes in West Africa. PLoS One. 2014; 9DOI | PubMed
- Papaspiliopoulos O, Roberts GO, Sköld M. A general framework for the parametrization of hierarchical models. Statistical Science. 2007; 22:59-73. DOI
- Remarque EJ, Roestenberg M, Younis S, Walraven V, van der Werff N, Faber BW, Leroy O, Sauerwein R, Kocken CH, Thomas AW. Humoral immune responses to a single allele PfAMA1 vaccine in healthy malaria-naïve adults. PLoS One. 2012; 7DOI | PubMed
- Rosenberg R. Malaria: some considerations regarding parasite productivity. Trends in Parasitology. 2008; 24:487-491. DOI | PubMed
- RTSS Clinical Trials Partnership. Efficacy and safety of RTS,S/AS01 malaria vaccine with or without a booster dose in infants and children in africa: final results of a phase 3, individually randomised, controlled trial. The Lancet. 2015; 386:31-45. DOI
- Sauerwein RW, Richie TL. Malaria vaccines getting close to clinical reality. Vaccine. 2015; 33:7423-7424. DOI | PubMed
- Schwartz L, Brown GV, Genton B, Moorthy VS. A review of malaria vaccine clinical projects based on the WHO rainbow table. Malaria Journal. 2012; 11DOI | PubMed
- Seder RA, Chang LJ, Enama ME, Zephir KL, Sarwar UN, Gordon IJ, Holman LA, James ER, Billingsley PF, Gunasekera A, Richman A, Chakravarty S, Manoj A, Velmurugan S, Li M, Ruben AJ, Li T, Eappen AG, Stafford RE, Plummer SH, Hendel CS, Novik L, Costner PJ, Mendoza FH, Saunders JG, Nason MC, Richardson JH, Murphy J, Davidson SA, Richie TL, Sedegah M, Sutamihardja A, Fahle GA, Lyke KE, Laurens MB, Roederer M, Tewari K, Epstein JE, Sim BK, Ledgerwood JE, Graham BS, Hoffman SL, VRC 312 Study Team. Protection against malaria by intravenous immunization with a nonreplicating sporozoite vaccine. Science. 2013; 341:1359-1365. DOI | PubMed
- Sherrard-Smith E, Churcher TS, Upton LM, Sala KA, Zakutansky SE, Slater HC, Blagborough AM, Betancourt M. A novel model fitted to multiple life stages of malaria for assessing efficacy of transmission-blocking interventions. Malaria Journal. 2017; 16DOI | PubMed
- Sinden RE, Dawes EJ, Alavi Y, Waldock J, Finney O, Mendoza J, Butcher GA, Andrews L, Hill AV, Gilbert SC, Basáñez MG. Progression of plasmodium berghei through anopheles stephensi is density-dependent. PLoS Pathogens. 2007; 3:e195-16. DOI | PubMed
- Singh SK, Thrane S, Janitzek CM, Theander TG, Theisen M, Salanti A, Sander AF, Sander AF. Improving the malaria transmission-blocking activity of a Plasmodium falciparum 48/45 based vaccine antigen by SpyTag/SpyCatcher mediated virus-like display. Vaccine. 2017; 35:3726-3732. DOI | PubMed
- Stura EA, Satterthwait AC, Calvo JC, Stefanko RS, Langeveld JP, Kaslow DC. Crystallization of an intact monoclonal antibody (4B7) against plasmodium falciparum malaria with peptides from the Pfs25 protein antigen. Acta Crystallographica Section D Biological Crystallography. 1994; 50:556-562. DOI | PubMed
- Talaat KR, Ellis RD, Hurd J, Hentrich A, Gabriel E, Hynes NA, Rausch KM, Zhu D, Muratova O, Herrera R, Anderson C, Jones D, Aebig J, Brockley S, MacDonald NJ, Wang X, Fay MP, Healy SA, Durbin AP, Narum DL, Wu Y, Duffy PE. Safety and immunogenicity of Pfs25-EPA/Alhydrogel, a transmission blocking vaccine against plasmodium falciparum: an open label study in malaria naïve adults. PLoS One. 2016; 11DOI | PubMed
- Stan Development Team Stan Development Team; 2017. Publisher Full Text
- Tiono AB, Pinder M, N’Fale S, Faragher B, Smith T, Silkey M, Ranson H, Lindsay SW. The AvecNet trial to assess whether addition of Pyriproxyfen, an insect juvenile hormone mimic, to long-lasting insecticidal mosquito nets provides additional protection against clinical malaria over current best practice in an area with pyrethroid-resistant vectors in rural burkina faso: study protocol for a randomised controlled trial. Trials. 2015; 16DOI | PubMed
- Tran TM, Portugal S, Draper SJ, Crompton PD. Malaria vaccines: moving forward after encouraging first steps. Current Tropical Medicine Reports. 2015; 2:1-3. DOI | PubMed
- Upton LM, Brock PM, Churcher TS, Ghani AC, Gething PW, Delves MJ, Sala KA, Leroy D, Sinden RE, Blagborough AM. Lead clinical and preclinical antimalarial drugs can significantly reduce sporozoite transmission to vertebrate populations. Antimicrobial Agents and Chemotherapy. 2015; 59:490-497. DOI | PubMed
- VanderWeele TJ, Knol MJ. A tutorial on interaction. Epidemiologic Methods. 2014; 3:33-72. DOI
- Walker PG, Griffin JT, Ferguson NM, Ghani AC. Estimating the most efficient allocation of interventions to achieve reductions in Plasmodium falciparum malaria burden and transmission in Africa: a modelling study. The Lancet Global Health. 2016; 4:e474-e484. DOI | PubMed
- White MT, Bejon P, Olotu A, Griffin JT, Riley EM, Kester KE, Ockenhouse CF, Ghani AC. The relationship between RTS,S vaccine-induced antibodies, CD4⁺ T cell responses and protection against plasmodium falciparum infection. PLoS ONE. 2013; 8DOI | PubMed
- World Health Organization. World malaria report 2017. Geneva. 2017. Publisher Full Text
- Wu Y, Ellis RD, Shaffer D, Fontes E, Malkin EM, Mahanty S, Fay MP, Narum D, Rausch K, Miles AP, Aebig J, Orcutt A, Muratova O, Song G, Lambert L, Zhu D, Miura K, Long C, Saul A, Miller LH, Durbin AP. Phase 1 trial of malaria transmission blocking vaccine candidates Pfs25 and Pvs25 formulated with montanide ISA 51. PLoS ONE. 2008; 3DOI | PubMed
Fonte
Sherrard-Smith E, Sala KA, Betancourt M, Upton LM, Angrisano F, et al. () Synergy in anti-malarial pre-erythrocytic and transmission-blocking antibodies is achieved by reducing parasite density. eLife 7e35213. https://doi.org/10.7554/eLife.35213





