Abstract
Cosa c’è di nuovo?
- Il rapporto tra l’indice di massa corporea (IMC) e le misure cardiovascolari dettagliate non è stato esplorato nei giovani adulti.
- Abbiamo triangolato i risultati di 3 diversi approcci analitici con diverse fonti chiave di bias: regressione multivariabile convenzionale, randomizzazione mendeliana, e un disegno di studio Recall-by-Genotype.
- Quest’ultimo è nuovo e sfrutta l’assortimento casuale di alleli attraverso la divisione cellulare meiotica al momento del concepimento per informare il richiamo su base genetica e permette la raccolta di fenotipi cardiovascolari estremamente precisi che sarebbero altrimenti impraticabili su scala.
- Questo studio ha illustrato il potenziale di risoluzione fenotipica con il mantenimento del potere analitico e la capacità di trarre inferenze causali utilizzando il richiamo per genotipo.
Quali sono le implicazioni cliniche?
- I risultati hanno suggerito che un IMC più elevato provoca un aumento della pressione sanguigna (pressione sanguigna sistolica e diastolica, pressione del polso e pressione arteriosa media) e dell’indice di massa ventricolare sinistra, l’ultimo che suggerisce effetti avversi sulla struttura cardiaca, anche nei giovani adulti.
- Richiamo per analisi genotipica ha anche suggerito che l’IMC più alto aumentato la produzione cardiaca, che sembrava essere guidato esclusivamente dal volume di ictus, in quanto né la randomizzazione mendeliana né le analisi Richiamo per analisi genotipica suggerito un effetto causale di IMC sulla frequenza cardiaca.
- I nostri risultati supportano gli sforzi per ridurre l’IMC sin dalla giovane età per prevenire lo sviluppo di precursori di salute cardiovascolare avversa a lungo termine.
Un indice di massa corporea (IMC) più elevato in età adulta può causare numerosi fattori di rischio cardiovascolare avversi ed esiti di malattia.1–5 Queste relazioni possono riflettere l’esposizione a lungo termine a un’elevata adiposità e ad altre comorbidità, che si traducono poi in cambiamenti cardiovascolari strutturali e funzionali avversi, diversi dagli adattamenti riscontrati in precedenza nell’evoluzione della malattia. Infatti, i recenti risultati ottenuti da pazienti adulti affetti da chirurgia bariatrica forniscono prove a sostegno di un ruolo causale di una maggiore adiposità sul rischio di eventi cardiovascolari importanti.3 Tuttavia, la natura di queste relazioni è stata valutata prevalentemente in popolazioni di adulti e nessun grande studio ha valutato esplicitamente l’impatto causale dell’IMC su fenotipi cardiovascolari dettagliati nei primi anni di vita, dove il rischio può emergere. Studi osservazionali hanno riportato associazioni tra un IMC più elevato e la presenza di vari marcatori subclinici di malattie cardiovascolari6–8Tuttavia, questi possono fare fatica a distinguere tra correlazione e causalità a causa di questioni come la confusione o la causalità inversa.
Un metodo per stabilire le prove della causalità nelle associazioni tra un’esposizione e l’esito di un interesse è la randomizzazione mendeliana (MR). Questa tecnica utilizza varianti genetiche come variabili strumentali (o misure proxy) in studi epidemiologici altrimenti osservazionali.9 L’applicazione della metodologia MR ha finora fornito prove a sostegno di un ruolo causale di IMC più elevato sull’aumento del rischio di varie malattie cardiometaboliche, soprattutto in grandi popolazioni di adulti.2,4,5 Tuttavia, a causa del requisito della tecnica di grandi dimensioni del campione per fornire un’adeguata potenza statistica, gli studi MR utilizzano tradizionalmente misure cliniche raccolte di routine o dati generati da tecnologie ad alta produttività. Per esaminare questo problema potenzialmente grave nel caso dell’IMC e della salute cardiovascolare dei giovani, sono necessarie misure subcliniche dettagliate e precise di adattamenti vascolari strutturali e funzionali precoci per aiutare a chiarire la fisiopatologia e l’eziologia della malattia. Tuttavia, questi non sono comunemente effettuati in studi sulla popolazione di grandi dimensioni, in quanto sono costosi, richiedono tempo e richiedono operatori altamente qualificati. Pertanto, tali misure sono limitate nella loro disponibilità per le analisi di risonanza magnetica, in particolare nei campioni di popolazione giovane e sana.
Gli studi RbG (Recall-by-Genotype-by-Genotype) sono un’estensione innovativa della metodologia MR, progettata per migliorare l’efficienza dello studio, consentire la fenotipizzazione profonda guidata dal genotipo e migliorare le inferenze causali.10 Questo si ottiene attraverso il richiamo dei partecipanti sulla base di genotipi già disponibili che sono noti per essere attendibilmente correlati con le esposizioni di interesse (ad esempio, BMI). Come la RM e quindi gli studi randomizzati e controllati, l’allocazione casuale degli alleli al momento del concepimento produce gruppi di genotipi che sono teoricamente indipendenti dai confonditori e da quelli che sfuggono ai problemi di causalità inversa. Richiamando specifici sottogruppi di un campione totale con esposizione nota, la tecnica permette di raccogliere in modo efficiente dati fenotipici precisi che potrebbero essere altrimenti impraticabili alla scala necessaria per raggiungere la potenza statistica nelle analisi MR.10
Utilizzando i dati dell’ALSPAC (Avon Longitudinal Study of Parents and Children – Studio longitudinale di genitori e figli), abbiamo mirato ad utilizzare sia la risonanza magnetica integrale che il sottocampione RbG, accanto alle analisi di regressione multivariabile convenzionale, per testare l’ipotesi che l’IMC influenzi in modo causale le variazioni di molteplici misure clinicamente rilevanti della struttura e della funzione cardiovascolare nell’adolescenza e nella prima età adulta.
Metodi
Descrizione della coorte
ALSPAC è uno studio di coorte di nascita prospettico che indaga i fattori che influenzano il normale sviluppo e la crescita dell’infanzia. La coorte e il disegno dello studio sono stati descritti in dettaglio in precedenza11,12 e sono disponibili sul sito web dell’ALSPAC(http://www.alspac.bris.ac.uk). Il sito web dello studio contiene i dettagli di tutti i dati disponibili attraverso un dizionario dei dati completamente ricercabile(http://www.bris.ac.uk/alspac/researchers/data-access/data-dictionary). In breve, sono state iscritte alla coorte 14 541 donne in gravidanza residenti in una zona definita del Sud Ovest dell’Inghilterra, con data di parto prevista dal 1° aprile 1991 al 31 dicembre 1992. Di queste, 13 988 bambini nati vivi che erano ancora in vita un anno dopo sono stati aggiornati con questionari regolari e misure cliniche, fornendo dati comportamentali, di stile di vita e biologici. L’approvazione etica dello studio è stata ottenuta dal Comitato etico e giuridico dell’ALSPAC e dal Comitato locale di etica della ricerca. Il consenso informato scritto è stato ottenuto dal genitore/tutore e, dopo i 16 anni di età, i bambini hanno fornito un consenso scritto.
Studio Design
MR e RbG sono stati utilizzati per testare l’ipotesi che l’IMC influenzi in modo causale le variazioni di molteplici misure clinicamente rilevanti della struttura e della funzione cardiovascolare nell’adolescenza e nella prima età adulta (Figura 1). In primo luogo, abbiamo usato un punteggio di rischio genetico (GRS) composto da 97 BMI-associati polimorfismi nucleotidici singoli polimorfismi (SNPs) ha dimostrato di essere fortemente associato con BMI nel più recente studio di associazione a livello genomico (GWAS),13 costruito utilizzando una ponderazione esterna. Questo GRS è stato utilizzato come variabile strumentale (IV) all’interno di un quadro MR per indagare l’effetto causale del BMI su una serie di misure vascolari raccolte da coloro che hanno frequentato la clinica di 17 anni e sono stati sottoposti a ecocardiografia (come parte dello studio GRACE).13 Le stime sono state confrontate con i risultati ottenuti attraverso l’analisi osservazionale delle stesse associazioni. In secondo luogo, abbiamo utilizzato i dati raccolti in un quadro RbG per riprodurre questi risultati ed esplorare ulteriormente i loro meccanismi di base attraverso l’estesa fenotipizzazione di un gruppo più piccolo di individui indipendenti, richiamati specificamente su una distribuzione GRS a livello genomico, costruita a partire dai risultati del più grande GWAS di BMI disponibile condotto da Speliotes et al.14 (all’inizio del reclutamento nello studio RbG) per spiegare la massima percentuale possibile di variazione dell’IMC (vedi Metodi nel supplemento ai dati online).

Figura 1.Metodologie mendeliane di randomizzazione e di richiamo per tipo di genotipo. Inalto a sinistra, In un’analisi di randomizzazione mendeliana (MR), l’intera distribuzione di un punteggio di rischio genetico (GRS, in rosa) è utilizzata come variabile strumentale (IV) per l’indice di massa corporea (BMI; osservazioni in blu e associazione con GRS rappresentato con linea nera) per valutare la natura causale dell’associazione tra BMI e fenotipi cardiovascolari (ad esempio, indice di massa ventricolare sinistra [LVMI]). In basso a sinistra, confronto tra la regressione multivariabile osservazionale (blu) e le stime derivate dalla RM (rosa), che mostra un’associazione positiva tra IMC e LVMI utilizzando entrambe le metodologie. In alto a destra, invece di utilizzare l’intera distribuzione di un GRS, il metodo Recall-by-Genotype (RbG) crea campioni geneticamente richiamati dalle code di una distribuzione GRS (verde), che sono associati al BMI (osservazioni in blu e associazione con GRS rappresentata con la linea nera). In basso a destra, i gruppi RbG mostrano una differenza di IMC medio tra i gruppi; tuttavia, non ci sono differenze nei fattori di confondimento (fattori di stile di vita di uguali dimensioni tra i gruppi). Il metodo RbG permette quindi di valutare la variazione delle misure cardiovascolari dettagliate, ottenute con tecniche precise, tra i gruppi richiamati. Qui, il volume dell’ictus (SV) è maggiore in quelli nella coda superiore contro la coda inferiore e la resistenza vascolare sistemica (SVR) è maggiore nella coda inferiore contro la coda superiore, entrambi i fenotipi dei quali sono stati ottenuti attraverso la risonanza magnetica (RM), che non sarebbe altrimenti fattibile in studi abbastanza grandi necessari per la metodologia MR.
Di quelli con dati genetici completi e consenso (N=8350), gli individui sono stati invitati allo studio RbG sulla base del ≈30% della distribuzione GRS a livello genomico.14 Di quelli invitati (N=2071), 419 individui sono stati richiamati con successo all’età media di 21 anni (vedi Metodi e figure I-III nel supplemento di dati online).
Abbiamo escluso i dati di tutte le femmine che erano incinte o che avevano il diabete mellito sia nella clinica a 17 anni (N=7 gravidanze e 15 diabetici) sia nel richiamo a 21 anni (N=1 gravidanza e 0 diabetici). Dopo queste esclusioni, 418 individui sono stati utilizzati nelle analisi RbG a 21 anni e, di questi, tutti avevano misurato l’IMC, e le dimensioni del campione di quelli con misure cardiovascolari variavano tra 386 e 418 (Figura 2). Nel campione indipendente di 7909 individui che è stato utilizzato per le analisi MR all’età di 17 anni, 3404 aveva dati sul BMI e, di questi, le dimensioni del campione di quelli con misure cardiovascolari variava tra 1420 a 3108 (Figura 2).
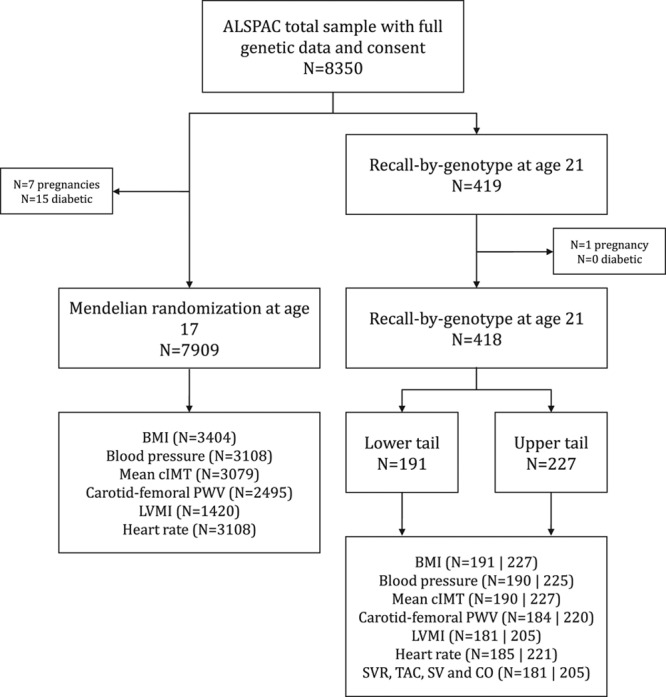
Figura 2.Flusso di campioni utilizzati per gli studi di randomizzazione mendeliana e di richiamo per tipo di genotipo. Il numero totale di individui nell’ALSPAC con dati genetici completi e consenso è stato di 8350. Di questi, 418 individui sono stati utilizzati nello studio Recall-by-Genotype (RbG), basato sul ≈30% di una distribuzione continua del punteggio di rischio genetico a livello genomico (GRS) per l’indice di massa corporea (BMI), costruito sulla base dei risultati di uno studio di associazione a livello genomico (GWAS) del BMI.14 Un totale di 191 erano all’interno della coda inferiore e 227 erano nella coda superiore. Il campione indipendente di 7909 individui è stato utilizzato nelle analisi MR all’età di 17 anni, che ha utilizzato un GRS composto da 97 SNPs (e costruito utilizzando la ponderazione esterna) ha dimostrato di essere associato con BMI da un GWAS su larga scala.13 Viene inoltre presentato il numero di individui con dati disponibili sull’esposizione (BMI) e sugli esiti sia BMI che cardiovascolari (con numeri nella coda inferiore e superiore del campione RbG separati da “|”). ALSPAC indica lo studio Avon Longitudinal Study of Parents and Children; BMI, indice di massa corporea; cIMT, spessore intima-media carotideo; CO, uscita cardiaca; LVMI, indice di massa ventricolare sinistra; PWV, velocità dell’onda di polso; SV, volume dell’ictus; SVR, resistenza vascolare sistemica; e TAC, compliance arteriosa totale.

Figura 1.Metodologie mendeliane di randomizzazione e di richiamo per tipo di genotipo. Inalto a sinistra, In un’analisi di randomizzazione mendeliana (MR), l’intera distribuzione di un punteggio di rischio genetico (GRS, in rosa) è utilizzata come variabile strumentale (IV) per l’indice di massa corporea (BMI; osservazioni in blu e associazione con GRS rappresentato con linea nera) per valutare la natura causale dell’associazione tra BMI e fenotipi cardiovascolari (ad esempio, indice di massa ventricolare sinistra [LVMI]). In basso a sinistra, confronto tra la regressione multivariabile osservazionale (blu) e le stime derivate dalla RM (rosa), che mostra un’associazione positiva tra IMC e LVMI utilizzando entrambe le metodologie. In alto a destra, invece di utilizzare l’intera distribuzione di un GRS, il metodo Recall-by-Genotype (RbG) crea campioni geneticamente richiamati dalle code di una distribuzione GRS (verde), che sono associati al BMI (osservazioni in blu e associazione con GRS rappresentata con la linea nera). In basso a destra, i gruppi RbG mostrano una differenza di IMC medio tra i gruppi; tuttavia, non ci sono differenze nei fattori di confondimento (fattori di stile di vita di uguali dimensioni tra i gruppi). Il metodo RbG permette quindi di valutare la variazione delle misure cardiovascolari dettagliate, ottenute con tecniche precise, tra i gruppi richiamati. Qui, il volume dell’ictus (SV) è maggiore in quelli nella coda superiore contro la coda inferiore e la resistenza vascolare sistemica (SVR) è maggiore nella coda inferiore contro la coda superiore, entrambi i fenotipi dei quali sono stati ottenuti attraverso la risonanza magnetica (RM), che non sarebbe altrimenti fattibile in studi abbastanza grandi necessari per la metodologia MR.

Figura 2.Flusso di campioni utilizzati per la randomizzazione mendeliana e gli studi Recall-by-Genotype. Il numero totale di individui in ALSPAC con dati genetici completi e consenso è stato di 8350. Di questi, 418 individui sono stati utilizzati nello studio Recall-by-Genotype (RbG), basato sul ≈30% di una distribuzione continua del punteggio di rischio genetico a livello genomico (GRS) per l’indice di massa corporea (BMI), costruito sulla base dei risultati di uno studio di associazione a livello genomico (GWAS) del BMI.14 Un totale di 191 erano all’interno della coda inferiore e 227 erano nella coda superiore. Il campione indipendente di 7909 individui è stato utilizzato nelle analisi MR all’età di 17 anni, che ha utilizzato un GRS composto da 97 SNPs (e costruito utilizzando la ponderazione esterna) ha dimostrato di essere associato con BMI da un GWAS su larga scala.13 Viene inoltre presentato il numero di individui con dati disponibili sull’esposizione (BMI) e sugli esiti sia BMI che cardiovascolari (con numeri nella coda inferiore e superiore del campione RbG separati da “|”). ALSPAC indica lo studio Avon Longitudinal Study of Parents and Children; BMI, indice di massa corporea; cIMT, spessore intima-media carotideo; CO, uscita cardiaca; LVMI, indice di massa ventricolare sinistra; PWV, velocità dell’onda di polso; SV, volume dell’ictus; SVR, resistenza vascolare sistemica; e TAC, compliance arteriosa totale.
Misure di adiposità a 17 e 21 anni
In entrambe le età, l’altezza è stata misurata al centimetro più vicino utilizzando uno stadiometro (SECA 213, Birmingham, UK) e il peso al chilogrammo più vicino a 0,1 kg, non calzato e in abiti leggeri, utilizzando bilance elettroniche di pesatura (Marsden M-110, Rotherham, UK). L’IMC è stato calcolato come peso (kg) diviso per l’altezza al quadrato (m2).
Fenotipi cardiovascolari all’età di 17 anni
I seguenti fenotipi cardiovascolari sono stati utilizzati nelle analisi di risonanza magnetica per valutare il ruolo causale del BMI sulla salute cardiovascolare all’età di 17 anni: pressione sanguigna e frequenza cardiaca, velocità dell’onda di polso carotide-femorale (PWV), spessore intima-media carotideo (cIMT) e indice di massa ventricolare sinistra (LVMI). Inoltre, fenotipi dettagliati sono stati misurati utilizzando la risonanza magnetica (RM) all’età di 21 anni (studio RbG), tra cui LVMI, volume dell’ictus (SV), uscita cardiaca (CO), resistenza vascolare sistemica, e la compliance arteriosa totale. Vedere Metodi nel supplemento di dati solo on-line per i dettagli sulla misurazione fenotipica.
Confonditori
A causa di effetti potenzialmente confondenti, le seguenti variabili sono state aggiunte come covariate nelle analisi osservazionali: l’educazione materna e l’occupazione domestica, più lo stato attuale del fumo e le più recenti registrazioni dell’attività fisica e, se disponibili, l’assunzione di cibo. Per i dettagli sulle misure di queste covariate, vedere Metodi nel supplemento ai dati online.
Analisi statistiche
Trasformazioni e aggiustamenti di preanalisi
Poiché la distribuzione dei residui della regressione lineare dell’IMC sulla PWV carotide-femorale è risultata positivamente deviata, i valori di queste variabili sono stati trasformati in log per le analisi. Per l’interpretazione, le differenze e gli IC sono stati retrotrasformati in tutte le tabelle e le cifre e presentati come la differenza percentuale media nella PWV carotide-femorale. La massa ventricolare sinistra misurata ad ogni età è stata indicizzata in altezza alla potenza di 2,7 (LVMI).15 Per valutare l’impatto dell’adiposità sulle misure vascolari centrali oltre a quello causato dalla statura,16 La resistenza vascolare sistemica e la compliance arteriosa totale sono state regolate per l’altezza utilizzando la resistenza vascolare sistemica×altezza1,83, la compliance arteriosa totale/altezza1,83,ed entrambe le misure di CO e SV sono state indicizzate all’altezza dividendo CO per l’altezza1,83e SV per l’altezza2,04.17 Per valutare l’impatto della mancanza nei nostri dati, abbiamo confrontato le distribuzioni delle variabili in coloro che avevano dati completi (cioè, nessun dato mancante in nessuna variabile) rispetto a quelli inclusi nelle nostre analisi primarie. L’entità della differenza in tutte le variabili è stata trascurabile(Tabella I nel supplemento di dati solo on-line); pertanto, presentiamo i risultati basati sul campione di individui che avevano dati su tutte le variabili necessarie per ogni analisi. A priori, abbiamo pianificato di trarre conclusioni basate sulle stime degli effetti e sui loro IC, piuttosto che su test statistici utilizzando un cut-off arbitrario del valore P.18,19 Per esempio, dati 2 effetti con lo stesso punto di stima – uno con IC stretti, l’altro con IC più ampi che possono anche includere il nullo – li descriviamo entrambi come se mostrassero lo stesso effetto, ma si noti che uno è più impreciso e deve essere trattato con più cautela fino a quando non viene replicato in un campione più grande. Non abbiamo tenuto conto di test multipli data l’elevata correlazione tra le nostre variabili di esito. L’uso di “positivo” e “inverso” in tutto il testo si riferisce all’associazione direzionale piuttosto che all’implicazione clinica. Per tutte le analisi sono stati utilizzati gli Stata 14 (Stata Corp) e R(https://cran.r-project.org/).
Regressione multivariabile
Le associazioni osservazionali tra IMC e ciascun fenotipo cardiovascolare all’età di 17 anni sono state valutate utilizzando la regressione lineare multivariabile in 3 modelli: (1) non regolato, (2) regolato per l’età, il sesso, lo stato di fumo e l’assunzione di cibo da parte del partecipante, la classe sociale della famiglia e l’educazione materna, e (3) ulteriormente regolato per l’attività fisica (aggiunto come modello separato a causa delle dimensioni del campione). Le associazioni dei confonditori con l’IMC, ogni misura cardiovascolare e il GRS ponderato all’età di 17 anni sono stati testati utilizzando la regressione lineare.
Randomizzazione mendeliana
Il GRS pesato esternamente usato come IV per l’IMC nelle analisi MR è stato generato dai 97 SNPs che si sono dimostrati essere associati in modo affidabile con l’IMC nel più recente GWAS condotto dal consorzio Genetic Investigation of ANthropometric Traits (GIANT).13 Per generare il GRS, il dosaggio di ogni allele che aumenta l’IMC in ogni locus in ALSPAC è stato ponderato in base alla dimensione dell’effetto esterno della variante nei risultati del GWAS.20 Le dosi sono state poi sommate e moltiplicate per la dimensione media dell’effetto esterno di tutti gli SNP su BMI per riflettere il numero di alleli medi ad incremento dell’IMC trasportati da ogni individuo.
L’analisi dei minimi quadrati in due fasi è stata eseguita utilizzando il GRS come IV per l’IMC all’età di 17 anni per stimare gli errori β-coefficienti e gli errori standard della metodologia MR (comando ivreg2 in Stata). Le statistiche F per la regressione del primo stadio tra il GRS e il BMI sono state esaminate per verificare la validità dello strumento, soddisfacendo l’ipotesi che il GRS fosse sufficientemente associato all’esposizione.21 Il test di Durbin-Wu-Hausman per l’endogeneità è stato utilizzato per confrontare la regressione multivariabile e le stime dell’effetto IV( comandoivendog in Stata).22
Recall-by-Genotype
La regressione lineare è stata utilizzata per valutare l’associazione dell’allocazione del gruppo RbG (superiore contro inferiore ≈30% della distribuzione GRS a livello genomico, come descritto sopra) con l’IMC e ciascuno dei fenotipi cardiovascolari misurati all’età di 21 anni. Ogni stima rappresenta quindi la differenza media di ogni variabile con la corrispondente differenza media dell’IMC tra i gruppi RbG (equivalente a un test t ). Le associazioni dei confonditori con il BMI, ogni misura cardiovascolare all’età di 21 anni e l’assegnazione del gruppo RbG sono state testate utilizzando la regressione lineare e logistica, ove opportuno.
Analisi della sensibilità
Sia la pressione sanguigna (BP) che la frequenza cardiaca sono correlate con altre misure cardiovascolari, ovvero PWV carotide-femorale, cIMT e LVMI.23–25 Per valutare l’associazione causale tra l’IMC e queste misure cardiovascolari, tenendo conto della BP e della frequenza cardiaca, abbiamo preso i residui della regressione tra ciascuna di queste variabili e sia la BP sistolica (SBP) che la frequenza cardiaca, e abbiamo ripetuto le analisi principali MR e RbG utilizzando questi residui.
Analisi MR
Inoltre, l’evidenza suggerisce che alcuni dei fenotipi cardiovascolari utilizzati in queste analisi non sono indipendenti dall’altezza.15,26,27 Per tenere conto di questo e della correlazione residua incoerente tra IMC e altezza durante l’intero arco di vita,28 abbiamo valutato l’associazione tra il GRS ponderato sull’altezza all’età di 17 anni e abbiamo esplorato l’impatto della regolazione per l’altezza e l’altezza squadrata sull’associazione tra il GRS ponderato e l’IMC. Abbiamo anche regolato sia la regressione multivariabile che le analisi MR per l’altezza e l’altezza quadrettata e le abbiamo confrontate con le analisi principali.
L’uso di alleli multipli nelle analisi MR aumenta il potenziale di effetti pleiotropici sbilanciati (dove l’inclusione di strumenti genetici non validi ha un effetto aggregato in una particolare direzione).9,20,29 Laddove la pleiotropia è perfettamente bilanciata, un GRS informativo è sufficiente in un’analisi MR, ma questo metodo è meno in grado di far fronte ad effetti pleiotropici sbilanciati. Per indagare sulla validità del GRS ponderato come IV, è stato utilizzato l’approccio MR-Egger per individuare e accogliere le violazioni delle ipotesi di MR.29 L’intercettazione del test MR-Egger può essere interpretata come una stima dell’effetto pleiotropico medio attraverso le varianti genetiche, con un termine di intercettazione non zero che indica la pleiotropia complessiva sbilanciata o direzionale. Le stime di MR-Egger sono state confrontate con quelle ottenute con i metodi della variante inversa ponderata e della mediana ponderata,29,30 che forniscono stime dell’effetto causale dell’IMC sui fenotipi cardiovascolari sotto diverse ipotesi di validità dello strumento. Come nelle analisi principali, le stime dell’associazione tra ogni SNP e IMC sono state ottenute da una fonte esterna indipendente, in modo da non indurre un debole bias strumentale in un’impostazione MR a 2 campioni.31
Studi precedenti hanno suggerito che i 97 SNP utilizzati per costruire il GRS ponderato possono avere proprietà diverse nelle popolazioni non europee.32 Pertanto, abbiamo eseguito un’analisi di sensibilità utilizzando un GRS ponderato che è stato limitato alle varianti genetiche che erano associate con l’IMC nell’analisi di sole persone di discendenza europea ed escluso quelle che hanno raggiunto una significatività genomica solo in 1 sesso o strato (n=77) nel consorzio GIANT.13 Inoltre, un precedente studio su un ampio campione basato nel Regno Unito ha suggerito l’esclusione di 3 varianti a causa della pleiotropia (rs11030104, rs13107325, e rs3888190) e 3 SNP che non sono in equilibrio Hardy-Weinberg(P<1×10-6; rs17001654, rs2075650, e rs9925964).32 Pertanto, come analisi di sensibilità, abbiamo escluso questi SNP aggiuntivi, ottenendo un IV costituito da 71 SNP.
Inoltre, per valutare la validità del GRS a livello genomico (utilizzato per reclutare individui per lo studio RbG, basato sugli Speliotes et al.14 GWAS), le analisi MR sono state condotte utilizzando lo stesso GRS a livello genomico di un IV per l’IMC, scalato per rappresentare la stessa differenza di incremento medio dell’IMC per unità rispetto al Locke et al13 GRS, composto da 97 SNP, utilizzato nelle principali analisi MR.
Risultati
La coorte MR aveva 17,8 anni (SD = 0,4), era composta per il 47,8% da femmine, e aveva un IMC medio di 22,7 kg/m2 (SD = 4; Tabella 1). Nello studio RbG, gli individui avevano 21,5 anni (SD = 0,9) e un IMC medio di 24,5 kg/m2 (SD = 5,7), mentre il 65,8% erano femmine (Tabella 2).
Regressione multivariabile
Le analisi di regressione multivariabile hanno fornito prove di associazioni positive di BMI misurato con SBP, BP diastolica (DBP), pressione del polso, pressione arteriosa media (MAP), LVMI, e frequenza cardiaca all’età di 17 anni, così come un’associazione inversa con PWV carotide-femorale (Tabella 3).
Analisi del cofondatore
L’IMC e tutti i fenotipi cardiovascolari sono stati associati alla maggior parte dei fattori di confusione, tra cui la classe sociale più alta della famiglia, l’educazione materna, l’età, il sesso, lo stato del fumo e l’assunzione di cibo(Tabella II-X nel supplemento di dati online). A differenza della misura diretta dell’IMC e dei fenotipi cardiovascolari, il GRS non è stato associato alla maggior parte dei fattori di confusione(Tabella XI nel supplemento di dati solo online). Tuttavia, vi erano prove di un’associazione tra il GRS e l’assunzione con la dieta.
Randomizzazione mendeliana
Ogni aumento dell’allele del GRS ponderato (composto da 97 SNP) è stato associato ad un BMI superiore di 0,12 kg/m2 (95% CI, 0,10-0,14; P=9 ,53×10-28), il che spiega il 3% della varianza (Figura Inel supplemento di dati online). Ci sono state prove di un effetto positivo di ogni kg/m2 BMI più alto su SBP (differenza: 0,79 mm Hg; 95% CI, 0,30-1,28; P=0,002), DBP (differenza: 0,29 mm Hg; 95% CI, 0.0002-0,59; P=0 ,05), pressione di impulso (differenza: 0,49 mm Hg; 95% CI, 0,03-0,96; P=0,04), MAP (differenza: 0,46 mm Hg; 95% CI, 0,16-0,75; P=0,002), e LVMI (differenza: 1,07 g/m2,7; 95% CI, 0,62-1,52; P=3 ,87×10-06; Tabella 4). Le statistiche F per queste analisi variavano da 36 a 123, suggerendo una ragionevole robustezza dello strumento. Non c’era una forte evidenza che i risultati delle analisi MR fossero diversi da quelli delle analisi di regressione multivariabile (tutti i valori P per il confronto >0,12).
Richiamo per tipo di genotipo su BMI
La differenza di IMC medio tra i gruppi RbG era di 3,58 kg/m2 (95% CI, 2,53-4,63; P=6 ,09×10-11; Tabella 5, Figura II nel supplemento di dati online).
Analisi del cofondatore
Le misure sia dell’IMC che dei risultati cardiovascolari all’età di 21 anni sono state associate alla maggior parte dei fattori di confusione, tra cui la classe sociale più alta della famiglia, l’educazione materna, l’età, il sesso, lo stato del fumo, l’attività fisica e l’assunzione di cibo(Tabelle XII-XXIV nel supplemento di dati online). Non vi erano prove concrete che l’assegnazione del gruppo RbG fosse associata ai confonditori(Tabella XXV nel supplemento ai dati solo online).
Richiamo per tipo di genotipo e fenotipi cardiovascolari
Delle misure cardiovascolari che si sovrappongono tra i 2 metodi (MR e RbG), i gruppi RbG sono associati a SBP più alti (differenza in media tra i gruppi RbG superiori e inferiori: 3,70 mm Hg; 95% CI, 1,74-5,66; P=0.0002), DBP (differenza: 2,25 mm Hg; 95% CI, 0,98-3,52; P=0,001), MAP (differenza: 2,73 mm Hg; 95% CI, 1,47-3,99; P=0,00003), e PWV carotide-femorale (differenza: 3,28%; 95% CI, 0,73-5,90%; P=0,01; Tabella 5).
Scalando le stime dell’effetto per rappresentare ogni kg/m2 di BMI più alto, come nelle analisi MR, questi risultati sono equivalenti ad un SBP più alto di 1,03 mm Hg, un DBP più alto di 0,63 mm Hg, un MAP più alto di 0,76 mm Hg e un PWV carotide-femorale più alto dello 0,91% (Figura 3). C’era quindi coerenza tra le stime degli effetti sui fenotipi sovrapposti in entrambe le età (cioè, ogni 1 kg/m2 BMI superiore aveva un effetto causale di magnitudo simile su SBP, DBP, e MAP), pur non mostrando alcuna associazione con la frequenza cardiaca o cIMT (Figura 3). Tuttavia, c’erano prove di un effetto causale positivo del BMI sulla PWV carotide-femorale nelle analisi RbG all’età di 21 anni che non era evidente nelle analisi MR a 17 anni.
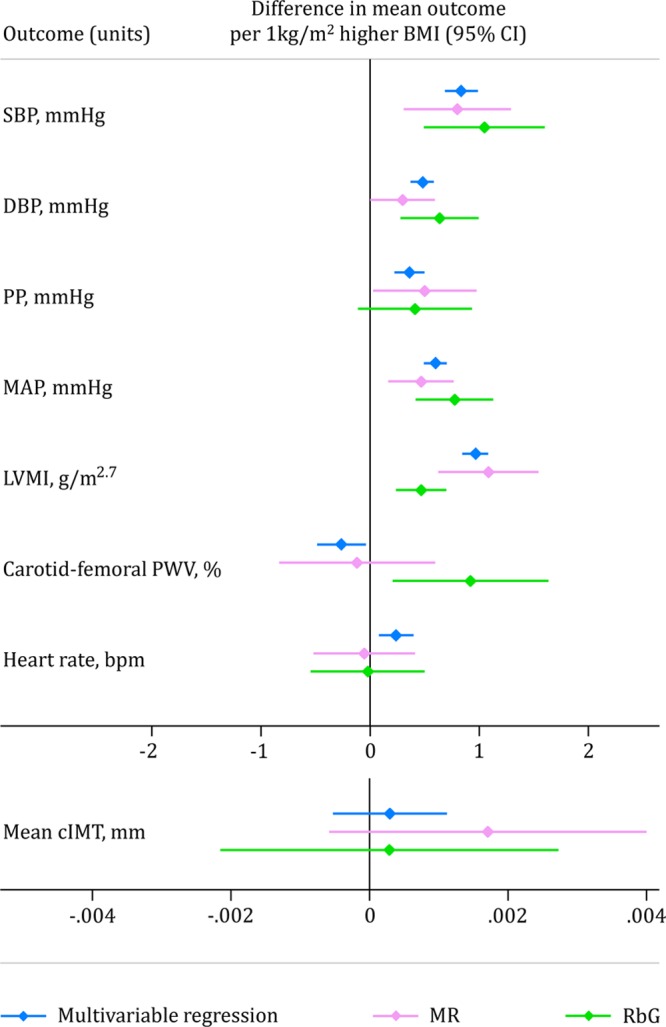
Figura 3.Figura 3. Confronto delle stime di tutti i fenotipi cardiovascolari sovrapposti disponibili ad entrambe le età. Le stime rappresentano la differenza di risultato medio per 1 kg/m2 di indice di massa corporea superiore (IMC; i grafici sono separati da scale simili) dalle metodologie di regressione multivariabile (blu), di randomizzazione mendeliana (RM; rosa) e di richiamo per tipo di genotipo (RbG; verde). cIMT indica lo spessore intima-media carotideo; DBP, pressione sanguigna diastolica; LVMI, indice di massa ventricolare sinistra; MAP, pressione arteriosa media; PP, pressione di polso; PWV, velocità delle onde di polso; e SBP, pressione sanguigna sistolica.
Oltre a queste misure cardiovascolari, il quadro RbG ha permesso la raccolta di fenotipi cardiovascolari più precisi. Di quelli specificamente raccolti nel braccio RbG di questo lavoro, c’erano prove di un ruolo causale di BMI più elevato sul LVMI derivato dalla RMN (differenza in media tra gruppi RbG superiori e inferiori: 1,65 g/m2,7; 95% CI, 0,83-2,47; P=0 ,0001), SV (differenza: 1,49 mL/m2,04; 95% CI, 0,62-2,35; P=0,001) , e CO (differenza: 0,11 L-min-1-m-1,83; 95% CI, 0,03-0,20; P=0,01), senza una forte evidenza di una differenza nella resistenza vascolare sistemica o nella compliance arteriosa totale (Tabella 5).

Figura 3.Figura 3. Confronto delle stime di tutti i fenotipi cardiovascolari sovrapposti disponibili in entrambe le età. Le stime rappresentano la differenza di risultato medio per 1 kg/m2 di indice di massa corporea superiore (IMC; i grafici sono separati da scale simili) dalle metodologie di regressione multivariabile (blu), di randomizzazione mendeliana (MR; rosa) e di richiamo per tipo di genotipo (RbG; verde). cIMT indica lo spessore intima-media carotideo; DBP, pressione sanguigna diastolica; LVMI, indice di massa ventricolare sinistra; MAP, pressione arteriosa media; PP, pressione di polso; PWV, velocità delle onde di polso; e SBP, pressione sanguigna sistolica.
Analisi della sensibilità
Dopo l’aggiustamento per l’SBP e la frequenza cardiaca, sia i risultati di MR e RbG per l’effetto del BMI su cIMT, PWV carotide-femorale e LVMI sono stati per lo più coerenti con l’analisi principale(Tabella XXVI nel supplemento dati solo on-line). L’1 eccezione è stata l’effetto positivo del BMI sul PWV carotide-femorale mostrato nell’analisi RbG, che si è attenuato allo zero dopo l’aggiustamento per SBP e frequenza cardiaca (differenza: 1,56%; 95% CI, da -0,71 a 3,89%; P=0 ,18).
Analisi MR
Il GRS ponderato (composto da 97 SNP) utilizzato nelle analisi MR non è stato associato all’altezza o all’altezza squadrata all’età di 17 anni. L’adeguamento sia per l’altezza che per l’altezza quadrettata non ha fatto differenza per l’associazione tra il GRS e il BMI all’età di 17 anni(Tabella XXVII nel supplemento di dati solo on-line), le analisi di regressione multivariabile(Tabella XXVIII nel supplemento di dati solo on-line), o le analisi MR(Tabella XXIX nel supplemento di dati solo on-line).
Il test MR-Egger non ha fornito forti prove di effetti pleiotropici sbilanciati per qualsiasi variante genetica inclusa nel GRS su qualsiasi risultato cardiovascolare (tutti i valori P per l’intercetta ≥0,24; Tabella XXX nel supplemento di dati solo online). Le stime dell’effetto MR provenienti da analisi ponderate a variazione inversa, MR-Egger e mediana ponderata per l’effetto causale dell’IMC sui fenotipi cardiovascolari erano in gran parte coerenti con le analisi principali, anche se la stima dell’effetto dell’IMC sull’SBP non concordava per le analisi mediane ponderate rispetto alle principali stime MR, ponderate a variazione inversa, e MR-Egger, anche se con IC molto ampi(Tabella XXX nel supplemento ai dati solo online e Figure III-VII nel supplemento ai dati solo online).
Sia l’IV contenente 77 SNPs(Figura VIII nel supplemento di dati solo on-line) che 71 SNPs(Figura IX nel supplemento di dati solo on-line) sono stati associati al BMI in misura paragonabile al GRS, che comprende l’insieme completo di 97 SNPs basato sul Locke et al.13 GWAS(Tabella XXXI nel supplemento dati solo on-line) e ha prodotto risultati simili alle analisi principali(Tabelle XXXII e XXXIII nel supplemento dati solo on-line, rispettivamente). Allo stesso modo, quando il GRS a livello genomico (inizialmente utilizzato per richiamare gli individui allo studio RbG e basato sugli Speliotes et al GWAS14) è stato implementato nelle analisi MR, il GRS è stato associato ad un cambiamento comparabile nel BMI(Tabella XXXI nel supplemento dati solo on-line, Figura X nel supplemento dati solo on-line) e ha prodotto risultati simili alle principali analisi MR(Tabella XXXIV nel supplemento dati solo on-line).
Discussione
In una vasta coorte di giovani adulti, abbiamo utilizzato 2 analisi complementari (MR e RbG) per indagare l’effetto causale di un IMC più elevato sulle misure della struttura e della funzione cardiovascolare e li abbiamo confrontati con i risultati di regressione multivariabile regolata. Oltre alle analisi MR, RbG sfrutta l’assortimento casuale di alleli attraverso la divisione cellulare meiotica al momento del concepimento per informare il richiamo su base genetica e consente inoltre la raccolta di fenotipi cardiovascolari estremamente precisi che sarebbero altrimenti impraticabili a una scala necessaria per dedurre la causalità utilizzando le analisi MR. I risultati suggeriscono che un IMC più elevato provoca una maggiore BP (SBP, DBP, PP e MAP) e LVMI, l’ultima che suggerisce una struttura cardiaca avversa, anche nei giovani adulti.
Per quanto riguarda i fenotipi cardiovascolari che sono stati utilizzati attraverso MR, RbG, e le analisi di regressione multivariabile nello studio attuale, i nostri risultati sono coerenti con i precedenti studi osservazionali nei bambini e negli adulti.33–35 Ad esempio, un recente studio che utilizza la metodologia MR ha fornito la prova che l’aumento dell’IMC e dell’adiposità centrale (misurata dal rapporto vita-cintura corretto per l’IMC) ha aumentato il rischio di malattie coronariche, diabete mellito di tipo 2, e misure ecocardiografiche indicative di ipertrofia ventricolare sinistra (come il prodotto log Cornell36). Ciò evidenzia non solo la coerenza delle nostre attuali scoperte, ma anche il modo in cui le nostre analisi si basano sulla letteratura attuale per quanto riguarda i fenotipi misurati e i metodi utilizzati.35 La somiglianza dei risultati tra questi metodi, date le diverse fonti di polarizzazione tra MR e RbG da un lato29 e regressione multivariabile dall’altro,9 sostiene fortemente la causalità in questo caso. Se sostenuti ulteriormente in età adulta, questi effetti di un IMC più elevato sono suscettibili di aumentare il rischio di malattie cardiovascolari e la mortalità specifica per malattia cardiovascolare in età avanzata.37–40
Precedenti risultati di regressione multivariabile da studi osservazionali più piccoli in bambini e adolescenti hanno trovato che l’IMC più alto è associato a PWV carotide-femorale più veloce e cIMT più spesso.41–44 In contrasto con questo, i nostri 3 metodi hanno dato risultati che non hanno supportato un effetto causale per il cIMT. Questo suggerisce che gli studi precedenti possono essere stati influenzati da confusione residua o bias, per i quali siamo stati meglio in grado di controllare qui. Questa conclusione è anche supportata in qualche misura dall’analisi delle stesse variabili in un’età più giovane in un contesto osservazionale.33 Con risultati meno coerenti nei nostri approcci, un IMC più alto è stato associato ad un PWV carotide-femorale più lento all’età di 17 anni (cioè, PWV più sano) nell’analisi di regressione multivariabile e un PWV carotide-femorale più veloce (cioè, PWV peggiore) nell’analisi RbG, con l’analisi MR che mostra un’associazione nulla (Figura 3). Infatti, uno studio precedente suggeriva che la relazione tra IMC e PWV può essere inversa in gioventù e diventare positiva in età più avanzata.45 Questa discrepanza potrebbe infatti riflettere un ruolo variabile nel tempo del BMI sul PWV, ma potrebbe anche essere il risultato di tecniche di misurazione differenziale carotide-femorale del PWV utilizzate tra le 2 età (un dispositivo Vicorder utilizzato all’età di 17 anni contro il dispositivo SphygmoCor Vx all’età di 21 anni) o il caso.
Come ci si potrebbe aspettare, un IMC più elevato ha portato ad un aumento di CO nel nostro studio RbG e, anche se in contrasto con altri studi osservazionali a questa età,46,47 questo sembrava essere esclusivamente guidato da SV, in quanto né le nostre analisi MR o RbG suggerivano un effetto causale dell’IMC sulla frequenza cardiaca. È possibile che le associazioni precedentemente segnalate tra IMC e frequenza cardiaca possano essere il risultato di una confusione non misurata. Il cambiamento mediato dall’IMC nella SV (e di conseguenza nella CO) osservato all’età di 21 anni è quindi probabile che rappresenti almeno in parte l’ipertrofia cardiaca e l’aumento della BP che vediamo nei dati qui analizzati.
Un punto di forza fondamentale di questo lavoro è il confronto dei risultati della regressione multivariabile e della risonanza magnetica, ma anche la capacità di utilizzare il framework RbG per estendere questa analisi e utilizzare la fenotipizzazione cardiovascolare dettagliata per esplorare le associazioni causali. Questo è il primo uso di RbG per la BP e la struttura cardiaca, dove possiamo confrontare i risultati direttamente con la regressione multivariabile e la RM all’interno della stessa popolazione generale. La coerenza per i fenotipi condivisi tra i risultati trovati da RbG (con 386-418 partecipanti) e quelli da MR (con 1420-3108 partecipanti) suggerisce che questo approccio è valido e statisticamente efficiente. Inoltre, il metodo RbG ha permesso la raccolta di fenotipi cardiovascolari precisi che altrimenti non sarebbero stati possibili nelle dimensioni del campione richieste per la risonanza magnetica, pur consentendo l’inferenza causale. Ad esempio, siamo stati in grado di esplorare l’impatto dell’IMC sulla SV e sulla CO derivata dalla RM, misure che sono proibitivamente costose da intraprendere e quindi spesso stimate in modo impreciso in diverse migliaia di partecipanti. A differenza di altri metodi, il design dello studio RbG utilizzato in questo caso ha offerto la possibilità di raccogliere fenotipi cardiovascolari derivati dalla risonanza magnetica più precisi, che hanno maggiori probabilità di catturare accuratamente le variazioni clinicamente rilevanti della salute cardiovascolare.
A differenza di questi punti di forza, è naturalmente possibile che sia l’analisi MR che l’analisi RbG siano influenzate se le ipotesi dell’analisi IV vengono violate.9 Queste richiedono, in primo luogo, che gli strumenti genetici devono essere strettamente correlati all’esposizione (in questo caso, l’IMC). Abbiamo usato varianti sia nella RM che nella RbG che hanno dimostrato di essere significative a livello genomico e replicate; le statistiche F del primo stadio, una misura della forza dello strumento, sono state elevate per tutte le analisi MR. In secondo luogo, si presume che i confonditori dell’associazione osservazionale BMI-cardiovascolare di esito non sono correlati allo strumento genetico. Ci sono prove empiriche che questo è improbabile che questo sia il caso e, per i confonditori osservati, lo abbiamo dimostrato nelle nostre analisi qui.48 In terzo luogo, si presume che non vi sia un percorso indipendente dallo strumento genetico verso gli esiti, se non attraverso l’IMC, che può derivare dalla pleiotropia orizzontale. Anche se abbiamo cercato di utilizzare al meglio tutti i dati disponibili, le nostre analisi principali hanno incluso l’uso di un GRS aggregato che comprende tutti i 97 SNP associati all’IMC, che può aumentare la possibilità di pleiotropia orizzontale. Pertanto, abbiamo utilizzato i migliori metodi disponibili per le analisi MR con più IV per testare e, in una certa misura, tenere conto della pleiotropia. In tutta questa gamma di analisi di sensibilità (compresi gli approcci MR-Egger e mediana ponderata, oltre a limitare il GRS a diversi sottoinsiemi di strumenti genetici), i risultati sono stati ampiamente simili alle analisi principali, dando più fiducia alle stime causali e alla direzione dell’effetto con un IMC più elevato, suggerendo che questi non erano in gran parte guidati dalla pleiotropia orizzontale.
Sebbene l’approccio RbG abbia permesso il campionamento dal ≈30% inferiore e superiore di un GRS a livello genomico, che ha prodotto una differenza di ≈3,5 kg/m2 nel BMI, la natura genomica del punteggio potrebbe essere considerata meno raffinata rispetto al GRS utilizzato nelle analisi MR, che comprende 97 SNPs che si sono dimostrati solidamente associati al BMI in una grande meta-analisi di GWAS.13 Nonostante ciò, le analisi di sensibilità effettuate hanno mostrato che il GRS a livello genomico ha fornito risultati comparabili con le analisi MR. Di coloro che hanno partecipato allo studio RbG, 386 individui avevano dati completi sui fenotipi cardiovascolari derivati dalla RM. Sebbene queste misure non fossero presenti nel campione completo (N=418), si tratta di una delle più grandi raccolte di fenotipi derivati dalla RM in individui di questa età che sono stati raccolti in modo da consentire l’inferenza causale dell’effetto dell’IMC su questi fenotipi. In secondo luogo, abbiamo usato fenotipi sovrapposti (come la pressione sanguigna, la frequenza cardiaca e la PWV carotide-femorale) in entrambe le analisi MR e RbG principalmente per il confronto delle stime causali tra le 2 età. Così, lo studio attuale fornisce sia fenotipi cardiovascolari comparativi e romanzo nel contesto di adiposità.
Una complicazione in alcune delle analisi di sensibilità eseguite (in particolare, la regolazione per le variabili tra cui BP, frequenza cardiaca, e l’altezza nelle analisi multivariabili e MR) è il potenziale per indurre collisione o bias di selezione.49,50 Tuttavia, a causa della coerenza complessiva delle stime degli effetti generati dalle varie analisi di sensibilità, è improbabile che ciò avvenga. Inoltre, è possibile che alcune delle differenze nelle dimensioni degli effetti dell’IMC sugli esiti cardiovascolari (ad esempio, PWV carotide-femorale) tra le varie età possano essere correlate sia alla differenza di età in cui sono state effettuate le analisi, sia ai metodi fenotipici utilizzati a queste età. Data la ridotta gamma di alcuni degli esiti cardiovascolari (ad esempio, cIMT) in questi giovani individui e le dimensioni potenzialmente ridotte dell’IMC, il potere di rilevare tali piccole dimensioni di effetto in questo contesto può essere limitato. Inoltre, ci siamo adattati a una serie di fattori potenzialmente confondenti nelle analisi di regressione multivariabile, ma anche in una coorte longitudinale così completa può essere difficile misurare o osservare con precisione (e quindi tener conto in modo appropriato) tutti i fattori confondenti. In effetti, ciò illustra la necessità di metodi migliori (come la RM e la RbG qui utilizzate) per valutare la natura causale dell’associazione tra IMC e salute cardiovascolare, che mirano a superare tali limiti. Infine, in tutte le analisi, abbiamo incluso solo i partecipanti con dati completi su tutte le variabili utilizzate nel modello specifico (cioè, dati completi sull’IMC, sull’esito e su tutti i confonditori nelle analisi multivariabili e sugli strumenti genetici, sull’IMC e sull’esito nella randomizzazione mendeliana). Ciò presuppone che i dati mancanti siano mancanti a caso. La somiglianza di caratteristiche tra quelli con dati completi e quelli con dati mancanti ha suggerito che questa ipotesi è improbabile che venga violata.
Con questo innovativo progetto di studio, che utilizza la regressione multivariabile complementare, le analisi MR e RbG, insieme a una serie di analisi di sensibilità, i risultati suggeriscono che un IMC più elevato può causare livelli avversi di BP e LVMI, il che implica una struttura cardiaca avversa, anche in gioventù. Le analisi RbG suggeriscono inoltre che un IMC più elevato si traduce in un aumento della CO, che sembrava essere guidato esclusivamente dalla SV, in quanto né le analisi MR né quelle RbG suggerivano un effetto causale dell’IMC sulla frequenza cardiaca. Questi risultati supportano gli sforzi per ridurre l’IMC sin dalla giovane età, con l’obiettivo di attenuare lo sviluppo di precursori di risultati cardiovascolari avversi a lungo termine. Tali sforzi possono contribuire a prevenire lo sviluppo di ulteriori danni vascolari cardiaci e periferici non ancora evidenti in questa fase iniziale della vita.
Riconoscimenti
Siamo estremamente grati a tutte le famiglie che hanno partecipato a questo studio, alle ostetriche per il loro aiuto nel reclutamento, e a tutto il team di ALSPAC, che comprende intervistatori, tecnici informatici e di laboratorio, impiegati, ricercatori, volontari, dirigenti, receptionist e infermieri. Ringraziamo anche Frank Dudbridge per le continue conversazioni sui punteggi di rischio genetico utilizzati nelle metodologie di randomizzazione mendeliane.
Fonti di finanziamento
Il professor Timpson è un investigatore del Wellcome Trust Investigator (202802/Z/16/Z), è responsabile del programma dell’Unità di Epidemiologia Integrativa del Medical Research Council (MC_UUU_12013/3) e lavora all’interno del Centro di Ricerca Biomedica dell’Università di Bristol National Institute for Health Research. Il Medical Research Council del Regno Unito e il Wellcome Trust (102215/2/13/2) e l’Università di Bristol forniscono il supporto fondamentale all’ALSPAC. Questa pubblicazione è opera degli autori, e il dottor Wade e il professor Timpson fungono da garanti per il contenuto di questo documento. Questa ricerca è stata specificamente finanziata attraverso sovvenzioni della British Heart Foundation (RG/10/004/28240, PG/06/145, e CS/15/6/31468) e del UK Medical Research Council, University of Bristol, e Wellcome Trust (MC_UUU_12013/1-9 e 096989/Z11/Z al Dr Wade, 086676/7/08/Z al Professor Hughes e MR/M009351/1 al Dr Fraser, e MR/M020894/1 al Dr Howe). I dati GWAS sono stati generati dalle strutture di Sample Logistics e di genotipizzazione del Wellcome Sanger Institute e LabCorp (Laboratory Corporation of America) con il supporto di 23andMe.
Informativa
Nessuna.
Materiale supplementare


References
- Prospective Studies Collaboration. Body-mass index and cause-specific mortality in 900,000 adults: collaborative analyses of 57 prospective studies.. Lancet. 2009; 373:1083-1096. PubMed
- Nordestgaard BG, Palmer TM, Benn M, Zacho J, Tybjaerg-Hansen A, Davey Smith G, Timpson NJ. The effect of elevated body mass index on ischemic heart disease risk: causal estimates from a Mendelian randomisation approach.. PLoS Med. 2012; 9:e1001212. PubMed
- Adams TD, Gress RE, Smith SC, Halverson RC, Simper SC, Rosamond WD, Lamonte MJ, Stroup AM, Hunt SC. Long-term mortality after gastric bypass surgery.. N Engl J Med. 2007; 357:753-761. PubMed
- Hägg S, Fall T, Ploner A, Mägi R, Fischer K, Draisma HH, Kals M, de Vries PS, Dehghan A, Willems SM, Sarin AP, Kristiansson K, Nuotio ML, Havulinna AS, de Bruijn RF, Ikram MA, Kuningas M, Stricker BH, Franco OH, Benyamin B, Gieger C, Hall AS, Huikari V, Jula A, Järvelin MR, Kaakinen M, Kaprio J, Kobl M, Mangino M, Nelson CP, Palotie A, Samani NJ, Spector TD, Strachan DP, Tobin MD, Whitfield JB, Uitterlinden AG, Salomaa V, Syvänen AC, Kuulasmaa K, Magnusson PK, Esko T, Hofman A, de Geus EJ, Lind L, Giedraitis V, Perola M, Evans A, Ferrières J, Virtamo J, Kee F, Tregouet DA, Arveiler D, Amouyel P, Gianfagna F, Brambilla P, Ripatti S, van Duijn CM, Metspalu A, Prokopenko I, McCarthy MI, Pedersen NL, Ingelsson E, European Network for Genetic and Genomic Epidemiology Consortium. Adiposity as a cause of cardiovascular disease: a Mendelian randomization study.. Int J Epidemiol. 2015; 44:578-586. PubMed
- Lyall DM, Celis-Morales C, Ward J, Iliodromiti S, Anderson JJ, Gill JMR, Smith DJ, Ntuk UE, Mackay DF, Holmes MV, Sattar N, Pell JP. Association of body mass index with cardiometabolic disease in the UK biobank: A Mendelian randomization study.. JAMA Cardiol. 2017; 2:882-889. PubMed
- Halcox JP, Deanfield JE. Childhood origins of endothelial dysfunction.. Heart. 2005; 91:1272-1274. PubMed
- Oren A, Vos LE, Uiterwaal CS, Grobbee DE, Bots ML. Cardiovascular risk factors and increased carotid intima-media thickness in healthy young adults: the Atherosclerosis Risk in Young Adults (ARYA) Study.. Arch Intern Med. 2003; 163:1787-1792. PubMed
- Wildman RP, Mackey RH, Bostom A, Thompson T, Sutton-Tyrrell K. Measures of obesity are associated with vascular stiffness in young and older adults.. Hypertension. 2003; 42:468-473. PubMed
- Davey Smith G, Hemani G. Mendelian randomization: genetic anchors for causal inference in epidemiological studies.. Hum Mol Genet. 2014; 23:R89-R98. PubMed
- Corbin LJ, Tan VY, Hughes DA, Wade KH, Paul DS, Tansey KE, Butcher F, Dudbridge F, Howson JM, Jallow MW, John C, Kingston N, Lindgren CM, O’Donavan M, O’Rahilly S, Owen MJ, Palmer CNA, Pearson ER, Scott RA, van Heel DA, Whittaker J, Frayling T, Tobin MD, Wain LV, Smith GD, Evans DM, Karpe F, McCarthy MI, Danesh J, Franks PW, Timpson NJ. Formalising recall by genotype as an efficient approach to detailed phenotyping and causal inference.. Nat Commun. 2018; 9:711. PubMed
- Boyd A, Golding J, Macleod J, Lawlor DA, Fraser A, Henderson J, Molloy L, Ness A, Ring S, Davey Smith G. Cohort profile: the ‘children of the 90s’–the index offspring of the Avon Longitudinal Study of Parents and Children.. Int J Epidemiol. 2013; 42:111-127. PubMed
- Fraser A, Macdonald-Wallis C, Tilling K, Boyd A, Golding J, Davey Smith G, Henderson J, Macleod J, Molloy L, Ness A, Ring S, Nelson SM, Lawlor DA. Cohort profile: the Avon Longitudinal Study of Parents and Children: ALSPAC mothers cohort.. Int J Epidemiol. 2013; 42:97-110. PubMed
- Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, Powell C, Vedantam S, Buchkovich ML, Yang J, Croteau-Chonka DC, Esko T, Fall T, Ferreira T, Gustafsson S, Kutalik Z, Luan J, Mägi R, Randall JC, Winkler TW, Wood AR, Workalemahu T, Faul JD, Smith JA, Zhao JH, Zhao W, Chen J, Fehrmann R, Hedman ÅK, Karjalainen J, Schmidt EM, Absher D, Amin N, Anderson D, Beekman M, Bolton JL, Bragg-Gresham JL, Buyske S, Demirkan A, Deng G, Ehret GB, Feenstra B, Feitosa MF, Fischer K, Goel A, Gong J, Jackson AU, Kanoni S, Kleber ME, Kristiansson K, Lim U, Lotay V, Mangino M, Leach IM, Medina-Gomez C, Medland SE, Nalls MA, Palmer CD, Pasko D, Pechlivanis S, Peters MJ, Prokopenko I, Shungin D, Stančáková A, Strawbridge RJ, Sung YJ, Tanaka T, Teumer A, Trompet S, van der Laan SW, van Setten J, Van Vliet-Ostaptchouk JV, Wang Z, Yengo L, Zhang W, Isaacs A, Albrecht E, Ärnlöv J, Arscott GM, Attwood AP, Bandinelli S, Barrett A, Bas IN, Bellis C, Bennett AJ, Berne C, Blagieva R, Blüher M, Böhringer S, Bonnycastle LL, Böttcher Y, Boyd HA, Bruinenberg M, Caspersen IH, Chen YI, Clarke R, Daw EW, de Craen AJM, Delgado G, Dimitriou M, Doney ASF, Eklund N, Estrada K, Eury E, Folkersen L, Fraser RM, Garcia ME, Geller F, Giedraitis V, Gigante B, Go AS, Golay A, Goodall AH, Gordon SD, Gorski M, Grabe HJ, Grallert H, Grammer TB, Gräßler J, Grönberg H, Groves CJ, Gusto G, Haessler J, Hall P, Haller T, Hallmans G, Hartman CA, Hassinen M, Hayward C, Heard-Costa NL, Helmer Q, Hengstenberg C, Holmen O, Hottenga JJ, James AL, Jeff JM, Johansson Å, Jolley J, Juliusdottir T, Kinnunen L, Koenig W, Koskenvuo M, Kratzer W, Laitinen J, Lamina C, Leander K, Lee NR, Lichtner P, Lind L, Lindström J, Lo KS, Lobbens S, Lorbeer R, Lu Y, Mach F, Magnusson PKE, Mahajan A, McArdle WL, McLachlan S, Menni C, Merger S, Mihailov E, Milani L, Moayyeri A, Monda KL, Morken MA, Mulas A, Müller G, Müller-Nurasyid M, Musk AW, Nagaraja R, Nöthen MM, Nolte IM, Pilz S, Rayner NW, Renstrom F, Rettig R, Ried JS, Ripke S, Robertson NR, Rose LM, Sanna S, Scharnagl H, Scholtens S, Schumacher FR, Scott WR, Seufferlein T, Shi J, Smith AV, Smolonska J, Stanton AV, Steinthorsdottir V, Stirrups K, Stringham HM, Sundström J, Swertz MA, Swift AJ, Syvänen AC, Tan ST, Tayo BO, Thorand B, Thorleifsson G, Tyrer JP, Uh HW, Vandenput L, Verhulst FC, Vermeulen SH, Verweij N, Vonk JM, Waite LL, Warren HR, Waterworth D, Weedon MN, Wilkens LR, Willenborg C, Wilsgaard T, Wojczynski MK, Wong A, Wright AF, Zhang Q, Brennan EP, Choi M, Dastani Z, Drong AW, Eriksson P, Franco-Cereceda A, Gådin JR, Gharavi AG, Goddard ME, Handsaker RE, Huang J, Karpe F, Kathiresan S, Keildson S, Kiryluk K, Kubo M, Lee JY, Liang L, Lifton RP, Ma B, McCarroll SA, McKnight AJ, Min JL, Moffatt MF, Montgomery GW, Murabito JM, Nicholson G, Nyholt DR, Okada Y, Perry JRB, Dorajoo R, Reinmaa E, Salem RM, Sandholm N, Scott RA, Stolk L, Takahashi A, Tanaka T, van ‘t Hooft FM, Vinkhuyzen AAE, Westra HJ, Zheng W, Zondervan KT, Heath AC, Arveiler D, Bakker SJL, Beilby J, Bergman RN, Blangero J, Bovet P, Campbell H, Caulfield MJ, Cesana G, Chakravarti A, Chasman DI, Chines PS, Collins FS, Crawford DC, Cupples LA, Cusi D, Danesh J, de Faire U, den Ruijter HM, Dominiczak AF, Erbel R, Erdmann J, Eriksson JG, Farrall M, Felix SB, Ferrannini E, Ferrières J, Ford I, Forouhi NG, Forrester T, Franco OH, Gansevoort RT, Gejman PV, Gieger C, Gottesman O, Gudnason V, Gyllensten U, Hall AS, Harris TB, Hattersley AT, Hicks AA, Hindorff LA, Hingorani AD, Hofman A, Homuth G, Hovingh GK, Humphries SE, Hunt SC, Hyppönen E, Illig T, Jacobs KB, Jarvelin MR, Jöckel KH, Johansen B, Jousilahti P, Jukema JW, Jula AM, Kaprio J, Kastelein JJP, Keinanen-Kiukaanniemi SM, Kiemeney LA, Knekt P, Kooner JS, Kooperberg C, Kovacs P, Kraja AT, Kumari M, Kuusisto J, Lakka TA, Langenberg C, Marchand LL, Lehtimäki T, Lyssenko V, Männistö S, Marette A, Matise TC, McKenzie CA, McKnight B, Moll FL, Morris AD, Morris AP, Murray JC, Nelis M, Ohlsson C, Oldehinkel AJ, Ong KK, Madden PAF, Pasterkamp G, Peden JF, Peters A, Postma DS, Pramstaller PP, Price JF, Qi L, Raitakari OT, Rankinen T, Rao DC, Rice TK, Ridker PM, Rioux JD, Ritchie MD, Rudan I, Salomaa V, Samani NJ, Saramies J, Sarzynski MA, Schunkert H, Schwarz PEH, Sever P, Shuldiner AR, Sinisalo J, Stolk RP, Strauch K, Tönjes A, Trégouët DA, Tremblay A, Tremoli E, Virtamo J, Vohl MC, Völker U, Waeber G, Willemsen G, Witteman JC, Zillikens MC, Adair LS, Amouyel P, Asselbergs FW, Assimes TL, Bochud M, Boehm BO, Boerwinkle E, Bornstein SR, Bottinger EP, Bouchard C, Cauchi S, Chambers JC, Chanock SJ, Cooper RS, de Bakker PIW, Dedoussis G, Ferrucci L, Franks PW, Froguel P, Groop LC, Haiman CA, Hamsten A, Hui J, Hunter DJ, Hveem K, Kaplan RC, Kivimaki M, Kuh D, Laakso M, Liu Y, Martin NG, März W, Melbye M, Metspalu A, Moebus S, Munroe PB, Njølstad I, Oostra BA, Palmer CNA, Pedersen NL, Perola M, Pérusse L, Peters U, Power C, Quertermous T, Rauramaa R, Rivadeneira F, Saaristo TE, Saleheen D, Sattar N, Schadt EE, Schlessinger D, Slagboom PE, Snieder H, Spector TD, Thorsteinsdottir U, Stumvoll M, Tuomilehto J, Uitterlinden AG, Uusitupa M, van der Harst P, Walker M, Wallaschofski H, Wareham NJ, Watkins H, Weir DR, Wichmann HE, Wilson JF, Zanen P, Borecki IB, Deloukas P, Fox CS, Heid IM, O’Connell JR, Strachan DP, Stefansson K, van Duijn CM, Abecasis GR, Franke L, Frayling TM, McCarthy MI, Visscher PM, Scherag A, Willer CJ, Boehnke M, Mohlke KL, Lindgren CM, Beckmann JS, Barroso I, North KE, Ingelsson E, Hirschhorn JN, Loos RJF, Speliotes EK, LifeLines Cohort Study; ADIPOGen Consortium; AGEN-BMI Working Group; CARDIOGRAMplusC4D Consortium; CKDGen Consortium; GLGC; ICBP; MAGIC Investigators; MuTHER Consortium; MIGen Consortium; PAGE Consortium; ReproGen Consortium; GENIE Consortium; International Endogene Consortium. Genetic studies of body mass index yield new insights for obesity biology.. Nature. 2015; 518:197-206. PubMed
- Speliotes EK, Willer CJ, Berndt SI, Monda KL, Thorleifsson G, Jackson AU, Lango Allen H, Lindgren CM, Luan J, Mägi R, Randall JC, Vedantam S, Winkler TW, Qi L, Workalemahu T, Heid IM, Steinthorsdottir V, Stringham HM, Weedon MN, Wheeler E, Wood AR, Ferreira T, Weyant RJ, Segrè AV, Estrada K, Liang L, Nemesh J, Park JH, Gustafsson S, Kilpeläinen TO, Yang J, Bouatia-Naji N, Esko T, Feitosa MF, Kutalik Z, Mangino M, Raychaudhuri S, Scherag A, Smith AV, Welch R, Zhao JH, Aben KK, Absher DM, Amin N, Dixon AL, Fisher E, Glazer NL, Goddard ME, Heard-Costa NL, Hoesel V, Hottenga JJ, Johansson A, Johnson T, Ketkar S, Lamina C, Li S, Moffatt MF, Myers RH, Narisu N, Perry JR, Peters MJ, Preuss M, Ripatti S, Rivadeneira F, Sandholt C, Scott LJ, Timpson NJ, Tyrer JP, van Wingerden S, Watanabe RM, White CC, Wiklund F, Barlassina C, Chasman DI, Cooper MN, Jansson JO, Lawrence RW, Pellikka N, Prokopenko I, Shi J, Thiering E, Alavere H, Alibrandi MT, Almgren P, Arnold AM, Aspelund T, Atwood LD, Balkau B, Balmforth AJ, Bennett AJ, Ben-Shlomo Y, Bergman RN, Bergmann S, Biebermann H, Blakemore AI, Boes T, Bonnycastle LL, Bornstein SR, Brown MJ, Buchanan TA, Busonero F, Campbell H, Cappuccio FP, Cavalcanti-Proença C, Chen YD, Chen CM, Chines PS, Clarke R, Coin L, Connell J, Day IN, den Heijer M, Duan J, Ebrahim S, Elliott P, Elosua R, Eiriksdottir G, Erdos MR, Eriksson JG, Facheris MF, Felix SB, Fischer-Posovszky P, Folsom AR, Friedrich N, Freimer NB, Fu M, Gaget S, Gejman PV, Geus EJ, Gieger C, Gjesing AP, Goel A, Goyette P, Grallert H, Grässler J, Greenawalt DM, Groves CJ, Gudnason V, Guiducci C, Hartikainen AL, Hassanali N, Hall AS, Havulinna AS, Hayward C, Heath AC, Hengstenberg C, Hicks AA, Hinney A, Hofman A, Homuth G, Hui J, Igl W, Iribarren C, Isomaa B, Jacobs KB, Jarick I, Jewell E, John U, Jørgensen T, Jousilahti P, Jula A, Kaakinen M, Kajantie E, Kaplan LM, Kathiresan S, Kettunen J, Kinnunen L, Knowles JW, Kolcic I, König IR, Koskinen S, Kovacs P, Kuusisto J, Kraft P, Kvaløy K, Laitinen J, Lantieri O, Lanzani C, Launer LJ, Lecoeur C, Lehtimäki T, Lettre G, Liu J, Lokki ML, Lorentzon M, Luben RN, Ludwig B, Manunta P, Marek D, Marre M, Martin NG, McArdle WL, McCarthy A, McKnight B, Meitinger T, Melander O, Meyre D, Midthjell K, Montgomery GW, Morken MA, Morris AP, Mulic R, Ngwa JS, Nelis M, Neville MJ, Nyholt DR, O’Donnell CJ, O’Rahilly S, Ong KK, Oostra B, Paré G, Parker AN, Perola M, Pichler I, Pietiläinen KH, Platou CG, Polasek O, Pouta A, Rafelt S, Raitakari O, Rayner NW, Ridderstråle M, Rief W, Ruokonen A, Robertson NR, Rzehak P, Salomaa V, Sanders AR, Sandhu MS, Sanna S, Saramies J, Savolainen MJ, Scherag S, Schipf S, Schreiber S, Schunkert H, Silander K, Sinisalo J, Siscovick DS, Smit JH, Soranzo N, Sovio U, Stephens J, Surakka I, Swift AJ, Tammesoo ML, Tardif JC, Teder-Laving M, Teslovich TM, Thompson JR, Thomson B, Tönjes A, Tuomi T, van Meurs JB, van Ommen GJ, Vatin V, Viikari J, Visvikis-Siest S, Vitart V, Vogel CI, Voight BF, Waite LL, Wallaschofski H, Walters GB, Widen E, Wiegand S, Wild SH, Willemsen G, Witte DR, Witteman JC, Xu J, Zhang Q, Zgaga L, Ziegler A, Zitting P, Beilby JP, Farooqi IS, Hebebrand J, Huikuri HV, James AL, Kähönen M, Levinson DF, Macciardi F, Nieminen MS, Ohlsson C, Palmer LJ, Ridker PM, Stumvoll M, Beckmann JS, Boeing H, Boerwinkle E, Boomsma DI, Caulfield MJ, Chanock SJ, Collins FS, Cupples LA, Smith GD, Erdmann J, Froguel P, Grönberg H, Gyllensten U, Hall P, Hansen T, Harris TB, Hattersley AT, Hayes RB, Heinrich J, Hu FB, Hveem K, Illig T, Jarvelin MR, Kaprio J, Karpe F, Khaw KT, Kiemeney LA, Krude H, Laakso M, Lawlor DA, Metspalu A, Munroe PB, Ouwehand WH, Pedersen O, Penninx BW, Peters A, Pramstaller PP, Quertermous T, Reinehr T, Rissanen A, Rudan I, Samani NJ, Schwarz PE, Shuldiner AR, Spector TD, Tuomilehto J, Uda M, Uitterlinden A, Valle TT, Wabitsch M, Waeber G, Wareham NJ, Watkins H, Wilson JF, Wright AF, Zillikens MC, Chatterjee N, McCarroll SA, Purcell S, Schadt EE, Visscher PM, Assimes TL, Borecki IB, Deloukas P, Fox CS, Groop LC, Haritunians T, Hunter DJ, Kaplan RC, Mohlke KL, O’Connell JR, Peltonen L, Schlessinger D, Strachan DP, van Duijn CM, Wichmann HE, Frayling TM, Thorsteinsdottir U, Abecasis GR, Barroso I, Boehnke M, Stefansson K, North KE, McCarthy MI, Hirschhorn JN, Ingelsson E, Loos RJ, MAGIC; Procardis Consortium. Association analyses of 249,796 individuals reveal 18 new loci associated with body mass index.. Nat Genet. 2010; 42:937-948. PubMed
- Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA, Picard MH, Roman MJ, Seward J, Shanewise JS, Solomon SD, Spencer KT, Sutton MS, Stewart WJ, Chamber Quantification Writing Group; American Society of Echocardiography’s Guidelines and Standards Committee; European Association of Echocardiography. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology.. J Am Soc Echocardiogr. 2005; 18:1440-1463. PubMed
- Palmieri V, de Simone G, Arnett DK, Bella JN, Kitzman DW, Oberman A, Hopkins PN, Province MA, Devereux RB. Relation of various degrees of body mass index in patients with systemic hypertension to left ventricular mass, cardiac output, and peripheral resistance (The Hypertension Genetic Epidemiology Network Study).. Am J Cardiol. 2001; 88:1163-1168. PubMed
- Chinali M, Devereux RB, Howard BV, Roman MJ, Bella JN, Liu JE, Resnick HE, Lee ET, Best LG, de Simone G. Comparison of cardiac structure and function in American Indians with and without the metabolic syndrome (the Strong Heart Study).. Am J Cardiol. 2004; 93:40-44. PubMed
- Sterne JA, Davey Smith G. Sifting the evidence-what’s wrong with significance tests?. BMJ. 2001; 322:226-231. PubMed
- Wasserstein RL, Lazar NA. The ASA’s statement on p-values: context, process, and purpose.. Am Stat. 2016; 70:129-133.
- Richmond RC, Davey Smith G, Ness AR, den Hoed M, McMahon G, Timpson NJ. Assessing causality in the association between child adiposity and physical activity levels: a Mendelian randomization analysis.. PLoS Med. 2014; 11:e1001618. PubMed
- Staiger D, Stock JH. Instrumental variables regression with weak instruments.. Econometrica. 1997; 65:557-586.
- Baum C, Schaffer ME, Stillman S. In: S494401 SSC [computer program]. Boston College Department of Economics: Boston; 2007.
- Ferreira JP, Girerd N, Bozec E, Machu JL, Boivin JM, London GM, Zannad F, Rossignol P. Intima–media thickness is linearly and continuously associated with systolic blood pressure in a population-based cohort (STANISLAS Cohort Study).. J Am Heart Assoc. 2016; 5:e003529. PubMed
- Kim EJ, Park CG, Park JS, Suh SY, Choi CU, Kim JW, Kim SH, Lim HE, Rha SW, Seo HS, Oh DJ. Relationship between blood pressure parameters and pulse wave velocity in normotensive and hypertensive subjects: invasive study.. J Hum Hypertens. 2007; 21:141-148. PubMed
- Malcolm DD, Burns TL, Mahoney LT, Lauer RM. Factors affecting left ventricular mass in childhood: the Muscatine Study.. Pediatrics. 1993; 92:703-709. PubMed
- Johnson W, Kuh D, Tikhonoff V, Charakida M, Woodside J, Whincup P, Hughes AD, Deanfield JE, Hardy R, NSHD Scientific and Data Collection Teams. Body mass index and height from infancy to adulthood and carotid intima-media thickness at 60 to 64 years in the 1946 British Birth Cohort Study.. Arterioscler Thromb Vasc Biol. 2014; 34:654-660. PubMed
- de Simone G, Devereux RB, Daniels SR, Koren MJ, Meyer RA, Laragh JH. Effect of growth on variability of left ventricular mass: assessment of allometric signals in adults and children and their capacity to predict cardiovascular risk.. J Am Coll Cardiol. 1995; 25:1056-1062. PubMed
- Stergiakouli E, Gaillard R, Tavaré JM, Balthasar N, Loos RJ, Taal HR, Evans DM, Rivadeneira F, St Pourcain B, Uitterlinden AG, Kemp JP, Hofman A, Ring SM, Cole TJ, Jaddoe VW, Davey Smith G, Timpson NJ. Genome-wide association study of height-adjusted BMI in childhood identifies functional variant in ADCY3.. Obesity (Silver Spring). 2014; 22:2252-2259. PubMed
- Bowden J, Davey Smith G, Burgess S. Mendelian randomization with invalid instruments: effect estimation and bias detection through Egger regression.. Int J Epidemiol. 2015; 44:512-525. PubMed
- Bowden J, Davey Smith G, Haycock PC, Burgess S. Consistent estimation in Mendelian randomization with some invalid instruments using a weighted median estimator.. Genet Epidemiol. 2016; 40:304-314. PubMed
- Hartwig FP, Davies NM. Why internal weights should be avoided (not only) in MR-Egger regression.. Int J Epidemiol. 2016; 45:1676-1678. PubMed
- Yaghootkar H, Lotta LA, Tyrrell J, Smit RA, Jones SE, Donnelly L, Beaumont R, Campbell A, Tuke MA, Hayward C, Ruth KS, Padmanabhan S, Jukema JW, Palmer CC, Hattersley A, Freathy RM, Langenberg C, Wareham NJ, Wood AR, Murray A, Weedon MN, Sattar N, Pearson E, Scott RA, Frayling TM. Genetic evidence for a link between favorable adiposity and lower risk of type 2 diabetes, hypertension, and heart disease.. Diabetes. 2016; 65:2448-2460. PubMed
- Charakida M, Jones A, Falaschetti E, Khan T, Finer N, Sattar N, Hingorani A, Lawlor DA, Smith GD, Deanfield JE. Childhood obesity and vascular phenotypes: a population study.. J Am Coll Cardiol. 2012; 60:2643-2650. PubMed
- Vaziri SM, Larson MG, Lauer MS, Benjamin EJ, Levy D. Influence of blood pressure on left atrial size. The Framingham Heart Study.. Hypertension. 1995; 25:1155-1160. PubMed
- Dale CE, Fatemifar G, Palmer TM, White J, Prieto-Merino D, Zabaneh D, Engmann JEL, Shah T, Wong A, Warren HR, McLachlan S, Trompet S, Moldovan M, Morris RW, Sofat R, Kumari M, Hyppönen E, Jefferis BJ, Gaunt TR, Ben-Shlomo Y, Zhou A, Gentry-Maharaj A, Ryan A, Mutsert R, Noordam R, Caulfield MJ, Jukema JW, Worrall BB, Munroe PB, Menon U, Power C, Kuh D, Lawlor DA, Humphries SE, Mook-Kanamori DO, Sattar N, Kivimaki M, Price JF, Davey Smith G, Dudbridge F, Hingorani AD, Holmes MV, Casas JP, UCLEB Consortium; METASTROKE Consortium. Causal associations of adiposity and body fat distribution with coronary heart disease, stroke subtypes, and type 2 diabetes mellitus: a Mendelian randomization analysis.. Circulation. 2017; 135:2373-2388. PubMed
- Truong QA, Ptaszek LM, Charipar EM, Taylor C, Fontes JD, Kriegel M, Irlbeck T, Toepker M, Schlett CL, Bamberg F, Blankstein R, Brady TJ, Nagurney JT, Hoffmann U. Performance of electrocardiographic criteria for left ventricular hypertrophy as compared with cardiac computed tomography: from the Rule Out Myocardial Infarction Using Computer Assisted Tomography trial.. J Hypertens. 2010; 28:1959-1967. PubMed
- Gray L, Lee IM, Sesso HD, Batty GD. Blood pressure in early adulthood, hypertension in middle age, and future cardiovascular disease mortality: HAHS (Harvard Alumni Health Study).. J Am Coll Cardiol. 2011; 58:2396-2403. PubMed
- Levy D, Garrison RJ, Savage DD, Kannel WB, Castelli WP. Prognostic implications of echocardiographically determined left ventricular mass in the Framingham Heart Study.. N Engl J Med. 1990; 322:1561-1566. PubMed
- Dhuper S, Abdullah RA, Weichbrod L, Mahdi E, Cohen HW. Association of obesity and hypertension with left ventricular geometry and function in children and adolescents.. Obesity (Silver Spring). 2011; 19:128-133. PubMed
- Bogers RP, Bemelmans WJ, Hoogenveen RT, Boshuizen HC, Woodward M, Knekt P, van Dam RM, Hu FB, Visscher TL, Menotti A, Thorpe RJ, Jamrozik K, Calling S, Strand BH, Shipley MJ, BMI-CHD Collaboration Investigators. Association of overweight with increased risk of coronary heart disease partly independent of blood pressure and cholesterol levels: a meta-analysis of 21 cohort studies including more than 300 000 persons.. Arch Intern Med. 2007; 167:1720-1728. PubMed
- Meyer AA, Kundt G, Steiner M, Schuff-Werner P, Kienast W. Impaired flow-mediated vasodilation, carotid artery intima-media thickening, and elevated endothelial plasma markers in obese children: the impact of cardiovascular risk factors.. Pediatrics. 2006; 117:1560-1567. PubMed
- Woo KS, Chook P, Yu CW, Sung RY, Qiao M, Leung SS, Lam CW, Metreweli C, Celermajer DS. Overweight in children is associated with arterial endothelial dysfunction and intima-media thickening.. Int J Obes Relat Metab Disord. 2004; 28:852-857. PubMed
- Iannuzzi A, Licenziati MR, Acampora C, Salvatore V, Auriemma L, Romano ML, Panico S, Rubba P, Trevisan M. Increased carotid intima-media thickness and stiffness in obese children.. Diabetes Care. 2004; 27:2506-2508. PubMed
- Urbina EM, Kimball TR, Khoury PR, Daniels SR, Dolan LM. Increased arterial stiffness is found in adolescents with obesity or obesity-related type 2 diabetes mellitus.. J Hypertens. 2010; 28:1692-1698. PubMed
- Corden B, Keenan NG, de Marvao AS, Dawes TJ, Decesare A, Diamond T, Durighel G, Hughes AD, Cook SA, O’Regan DP. Body fat is associated with reduced aortic stiffness until middle age.. Hypertension. 2013; 61:1322-1327. PubMed
- Sorof JM, Poffenbarger T, Franco K, Bernard L, Portman RJ. Isolated systolic hypertension, obesity, and hyperkinetic hemodynamic states in children.. J Pediatr. 2002; 140:660-666. PubMed
- Jiang X, Srinivasan SR, Urbina E, Berenson GS. Hyperdynamic circulation and cardiovascular risk in children and adolescents. The Bogalusa Heart Study.. Circulation. 1995; 91:1101-1106. PubMed
- Davey Smith G, Lawlor DA, Harbord R, Timpson N, Day I, Ebrahim S. Clustered environments and randomized genes: a fundamental distinction between conventional and genetic epidemiology.. PLOS Medicine. 2007; 4:e352. PubMed
- Cole SR, Platt RW, Schisterman EF, Chu H, Westreich D, Richardson D, Poole C. Illustrating bias due to conditioning on a collider.. Int J Epidemiol. 2010; 39:417-420. PubMed
- Aschard H, Vilhjálmsson Bjarni J, Joshi Amit D, Price Alkes L, Kraft P. Adjusting for heritable covariates can bias effect estimates in genome-wide association studies.. Am J Hum Genet. 2015; 96:329-339. PubMed
Fonte
Wade KH, Chiesa ST, Hughes AD, Chaturvedi N, Charakida M, et al. (2018) Assessing the Causal Role of Body Mass Index on Cardiovascular Health in Young Adults. Circulation 138(20): . https://doi.org/10.1161/CIRCULATIONAHA.117.033278





