Abstract
Introduzione
Il Progetto Riproducibilità: Cancer Biology (RP:CB) è una collaborazione tra il Center for Open Science and Science Exchange che cerca di affrontare le preoccupazioni sulla riproducibilità nella ricerca scientifica conducendo repliche di esperimenti selezionati da una serie di documenti di alto profilo nel campo della biologia del cancro(Errington et al., 2014). Per ciascuno di questi lavori è stato pubblicato un rapporto registrato che descrive in dettaglio i progetti sperimentali e i protocolli proposti per le repliche, che è stato sottoposto a revisione tra pari e pubblicato prima della raccolta dei dati. Il presente documento è uno studio di replicazione che riporta i risultati degli esperimenti di replicazione dettagliati nel Registered Report(Chroscinski et al., 2015) per un documento di Willingham et al., e utilizza una serie di approcci per confrontare i risultati degli esperimenti originali e le repliche.
Nel 2012, Willingham et al. hanno riportato che il blocco dell’interazione tra la proteina alfa regolatrice del segnale (SIRPa)/CD47 e un anticorpo anti-CD47 che bloccava l’anticorpo promuoveva la fagocitosi delle cellule tumorali solide in vitro e la riduzione della crescita dei tumori solidi in vivo, indicando che la terapia con anticorpi anti-CD47 può essere un trattamento efficace per una varietà di tumori solidi. Utilizzando un modello di cancro al seno singenico, il trattamento con anticorpi anti-CD47 del topo ha portato a una diminuzione statisticamente significativa del peso finale del tumore rispetto al controllo dell’isotipo IgG(Willingham et al., 2012). Il trattamento anti-CD47 ha anche aumentato l’infiltrazione linfocitica nel sito tumorale senza una tossicità inaccettabile, ad eccezione dell’anemia a breve termine osservata immediatamente dopo il dosaggio.
Il Registered Report per l’articolo di Willingham et al. ha descritto gli esperimenti da replicare (Figura 6A-C e Tabella S4), e ha riassunto le prove attuali di questi risultati (Chroscinskiet al., 2015). Da quella pubblicazione ci sono stati ulteriori studi che hanno esaminato la sicurezza e l’efficacia del CD47 come terapia antitumorale. Il trattamento anti-CD47 è stato segnalato per aumentare la fagocitosi dei macrofagi, diminuire il peso del tumore e inibire le metastasi spontanee in un modello di xenotrapianto di osteosarcoma(Xu et al., 2015). Allo stesso modo, il blocco CD47 è stato segnalato per migliorare la fagocitosi delle cellule tumorali da parte dei macrofagi, ridurre il carico tumorale e aumentare la sopravvivenza nei modelli di xenotrapianto di glioblastoma(Zhang et al., 2016), di cancro gastrico (Yoshida et al., 2015) e di tumore neuroendocrino del pancreas(Krampitz et al., 2016). Cioffi e colleghi hanno testato l’effetto dell’inibizione del CD47 nell’adenocarcinoma duttale pancreatico (PDAC) e hanno riportato che, mentre gli anticorpi anti-CD47 aumentavano la fagocitosi in vitro, ciò non comportava un cambiamento statisticamente significativo nella crescita tumorale in un modello di xenotrapianto derivato da paziente PDAC (PDX), a meno che non fosse somministrato in combinazione con un agente chemioterapico (Cioffi et al., 2015). Inoltre, un anticorpo umanizzato anti-CD47 è stato testato per la sicurezza e l’efficacia nei modelli di malattia della leucemia mieloide acuta (LAM) ed è stato riportato per diminuire il carico tumorale e aumentare la sopravvivenza in un modello PDX di LAM(Liu et al., 2015). Uno studio tossicocinetico pre-clinico su primati non umani non ha riportato effetti avversi associati all’anticorpo umanizzato(Liu et al., 2015) e i pazienti con LAM e tumori solidi sono stati reclutati per studi clinici di fase uno (identificatori ClinicalTrials.gov: NCT02678338 e NCT02216409).
Le misure di risultato riportate in questo Studio di Replica saranno aggregate con quelle degli altri Studi di Replica per creare un set di dati che sarà esaminato per fornire prove sulla riproducibilità della ricerca di biologia del cancro e per identificare i fattori che influenzano la riproducibilità più in generale.
Risultati e discussione
Inserimento di cellule tumorali del seno di topo e trattamento con CD47 per la ricerca di anticorpi
Abbiamo cercato di replicare in modo indipendente la sicurezza e l’efficacia dell’individuazione del CD47 nei topi immunocompetenti utilizzando un modello singenetico di cancro al seno. Questo esperimento è simile a quanto riportato nella Figura 6A-C di Willingham et al. (2012). Le cellule del tumore al seno del topo MT1A2(Addison et al., 1995) sono state impiantate nel cuscinetto di grasso mammario dei topi FVB singenici e monitorate fino alla formazione di tumori palpabili. I topi con tumori palpabili sono stati randomizzati per ricevere iniezioni di 400 µg di controllo dell’isotipo IgG di topo (IgG) o 400 µg di anticorpi anti-topo CD47 (anti-CD47) ogni due giorni nel cuscinetto di grasso mammario prossimale al tumore. Mentre lo studio originale includeva due cloni di anti-CD47 (MIAP410[Han et al., 2000] e MIAP301[Lindberg et al., 1993]), questo tentativo di replicazione è stato limitato ad un solo clone, MIAP410, che aveva la dimensione di effetto più grande riportato dei due cloni nell’esperimento originale(Willingham et al., 2012).
Per testare la potenziale tossicità del trattamento anticorpale, l’analisi ematologica è stata effettuata su sangue raccolto per emorragia retro-orbitale 5 giorni dopo l’inizio delle iniezioni di anticorpi. Per determinare la lettura della linea di base sono stati utilizzati topi FVB non trattati. Questo differisce dallo studio originale, che analizzava la tossicità in diversi ceppi di topo e regimi di trattamento. Nello studio originale, i topi BALB/c sono stati analizzati per la tossicità nel sangue 5 giorni dopo due iniezioni di anticorpi da 500 µg (Tabella S4) e i topi C57BL/6 sono stati analizzati per i parametri ematologici specifici 1, 3 e 6 giorni dopo una singola iniezione intraperitoneale di 250 µg di anticorpi IgG o anti-CD47 (Figura supplementare 6) (Willinghamet al., 2012). Simile a quanto riportato per i topi C57BL/6 nel documento originale, i topi FVB trattati con anticorpi anti-CD47 hanno provocato un’anemia a breve termine(Figura 1; Figura 1-figure supplement 1). Conteggio dei globuli rossi(Figura 1G; ANOVA unidirezionale; F(2,17) = 424,9, non corretto p = 3,07×10-15 con livello alfa= 0,0033; (Bonferroni corretto p= 4.)60×10-14)), emoglobina(Figura 1H; ANOVAunidirezionale; F(2,17) = 502.1, non corretto p=7,61×10-16 con livello alfa = 0.0033; (Bonferroni corretto p=1,14×10-14)), e l’ematocrito (Figura 1I; ANOVAunidirezionale; F(2,17) = 283,0, non corretto p=8,93×10-14 con livello alfa = 0.0033; (Bonferroni corretto p=1,34×10-12)) sono stati tutti leggermente ridotti nei topi trattati con anti-CD47 rispetto a quelli non trattati e trattati con IgG. Ciò è coerente con la funzione precedentemente descritta del CD47 nella normale fagocitosi dei globuli rossi anziani(Oldenborg et al., 2000; Oldenborg et al., 2001; Oldenborg, 2004) ed è stato osservato in altri studi che esaminano il trattamento con anticorpi anti-CD47(Liu et al., 2015). Inoltre, tre animali trattati con anti-CD47 hanno mostrato una lieve monocitosi(Figura 1D; Figura 1-figure supplement 1).10.7554/eLife.18173.002Figure 1.Blood toxicity analysis.I tumori del seno di topi femmine portatrici di FVB con tumore ortotopico MT1A2 sono stati randomizzati per ricevere il controllo dell’isotipo IgG (IgG) (n = 7) o gli anticorpi anti-topo CD47 (CD47) (n = 7). I topi con tumori piccoli o non rilevabili sono stati designati per la lettura della linea di base (NT) (n = 6). Cinque giorni dopo l’inizio del trattamento i campioni di sangue raccolti tramite emorragia retro-orbitale sono stati analizzati su un analizzatore ematologico. Trame a punti con mezzi riportati come barre incrociate per ogni parametro ematologico. Per ogni parametro è stata eseguita una ANOVA unidirezionale e il livello alfa o il valore p è stato regolato con la correzione Bonferroni.(A) Globuli bianchi (WBC), ANOVA unidirezionale; F(2,17) = 15,09, non corretto p=0,00017 con livello alfa = 0,0033; (Bonferroni corretto p=0,0026).(B) Neutrofili (NE), a senso unico ANOVA; F(2,17) = 1,02, non corretto p=0,381 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(C) Linfociti (LY), unidirezionali ANOVA; F(2,17) = 20,84, non corretto p=2,67×10-5 con livello alfa= 0,0033; (Bonferroni corretto p=0,00040).(D) Monociti (MO), ANOVA di Welch a senso unico; F(2,8,52) = 9,98, non corretto p=0,0058 con livello alfa = 0,0033; (Bonferroni corretto p=0,0877).(E) Eosinofili (EO), a senso unico ANOVA; F(2,17) = 0,06, non corretto p=0,942 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(F) Basofili (BA), a senso unico ANOVA; F(2,17) = 4,20, non corretto p=0,0330 con livello alfa = 0,0033; (Bonferroni corretto p=0,495).(G) Globuli rossi (RBC), unidirezionali ANOVA; F(2,17) = 424,9, non corretto p=3,07×10-15 con livello alfa= 0,0033; (Bonferroni corretto p=4,60×10-14).(H) Emoglobina (Hb), unidirezionale ANOVA; F(2,17) = 502,1, non corretto p=7,61×10-16 con livello alfa= 0,0033; (Bonferroni corretto p=1,14×10-14).(I) Ematocrito (HCT), unidirezionale ANOVA; F(2,17) = 283,0, non corretto p=8,93×10-14 con livello alfa= 0,0033; (Bonferroni corretto p=1,34×10-12).(J) Volume corpuscolare medio (MCV), a senso unico ANOVA; F(2,17) = 11,81, non corretto p=0,00061 con livello alfa = 0,0033; (Bonferroni corretto p=0,0091).(K) Emoglobina corpuscolare media (MCH), a senso unico ANOVA; F(2,17) = 10,64, non corretto p=0,00101 con livello alfa = 0,0033; (Bonferroni corretto p=0,0151).(L) Concentrazione media di emoglobina corpuscolare (MCHC), unidirezionale ANOVA; F(2,17) = 0,61, non corretto p=0,552 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(M) Larghezza di distribuzione dei globuli rossi (RDW), ANOVA di Welch a senso unico; F(2,10,46) = 30,62, non corretto p=4,25×10-5 con livello alfa= 0,0033; (Bonferroni corretto p=0,00064).(N) Piastrine (PLT), unidirezionale ANOVA; F(2,17) = 0,62, non corretto p=0,548 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(O) Volume medio delle piastrine (MPV), unidirezionale ANOVA; F(2,17) = 6,98, non corretto p=0,0061 con livello alfa = 0,0033; (Bonferroni corretto p=0,092). Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:http://dx.doi.org/10.7554/eLife.18173.00210.7554/eLife.18173.003Figure1-figure supplemento supplemento 1.Analisi della tossicità del sangue 1.Blood toxicity.I tumori al seno di topi femmine FVB portanti ortotopici MT1A2 sono stati randomizzati per ricevere il controllo dell’isotipo IgG (IgG) (n = 7) o anti-topo CD47 (CD47) (n = 7) anticorpi. I topi con tumori piccoli o non rilevabili sono stati designati per la lettura della linea di base (NT) (n = 6). Cinque giorni dopo l’inizio del trattamento i campioni di sangue raccolti tramite emorragia retro-orbitale sono stati analizzati su un analizzatore ematologico. Intervalli di riferimento normali (Range) per ogni parametro sono da Drew Scientific Hemavet 950FS. WBC = globuli bianchi; NE = Neutrofili; LY = Linfociti; MO = Monociti; EO = Eosinofili; BA = Basofili; RBC = Globuli rossi; Hb = Emoglobina; HCT = Ematocrito; MCV = Volume corpuscolare medio; MCH = emoglobina corpuscolare media; MCHC = concentrazione media di emoglobina corpuscolare; RDW = larghezza di distribuzione dei globuli rossi; PLT = piastrine; MPV = volume piastrinico medio. Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:http://dx.doi.org/10.7554/eLife.18173.003
Dopo 30 giorni di trattamento anticorpale, i tumori sono stati asportati e pesati(Figura 2). I tumori trattati con IgG sono cresciuti fino a una media di 0,075 grammi [n = 7, SD = 0,078 ], mentre i tumori trattati con anti-CD47 hanno portato a un peso medio di 0,163 grammi [n = 6, SD = 0,096]. Il confronto di questi due gruppi non è stato statisticamente significativo ( test di Welch; t(9,66) = 1,796, p=0,104). Ciò è in confronto allo studio originale, che ha riportato un peso medio di 0,144 grammi [n = 5, SD = 0,052 ] per i tumori trattati con IgG e una media di 0,012 grammi [n = 5, SD = 0,002] nei tumori trattati con anti-CD47. Il range dei pesi tumorali osservati nello studio originale variava da 9 a 198 mg, con i tumori trattati con IgG che rappresentano i pesi più alti osservati (60-198 mg) mentre i tumori trattati con anti-CD47 sono stati riportati tra 9 e 14 mg. Questo si confronta con questo tentativo di replicazione che ha osservato pesi tumorali che vanno da 5 a 257 mg, con tumori trattati con IgG (5-203 mg) e tumori trattati con anti-CD47 (41-257 mg) che hanno distribuzioni ampie abbastanza simili. Infatti, la deviazione standard relativa (RSD) associata a questo tentativo di replicazione (IgG trattato =104%; anti-CD47 trattato =59%) era maggiore della RSD riportata nello studio originale (IgG trattato =36%; anti-CD47 trattato =18%). La RSD dei tumori trattati con IgG riportata in Willingham et al. (2012) è simile alle RSD stimate (~30%) nelle condizioni di controllo da altri due studi pubblicati che utilizzavano cellule MT1A2(Ahn e Brown, 2008; Noblitt et al., 2005), hanno concesso a questi studi di iniettare più cellule e in siti diversi rispetto allo studio originale e a questo tentativo di replicazione. È interessante notare che un articolo più recente ha brevemente dichiarato di non utilizzare di proposito la linea cellulare MT1A2 nel loro studio a causa di un’elevata prevalenza di regressione tumorale spontanea, confondendo i risultati(Desilva et al., 2012). Una valutazione della crescita tumorale ha rivelato che questo si è verificato anche in questo tentativo di replicazione con tre tumori che regrediscono alla fine dello studio rispetto all’ultima misurazione del volume tumorale effettuata 14 giorni dopo l’inizio del trattamento(Figura 2-figure supplement 1). Mentre queste osservazioni confondono i risultati di questo tentativo di replicazione, abbiamo ulteriormente esplorato i dati sul peso del tumore conducendo la stessa analisi di cui sopra, ma con i tre tumori che sono regrediti durante il corso dello studio rimossi. Anche questo non era statisticamente significativo ( test di Welch; t(7,94) = 0,745, p=0,478, Glass’Δ = -0,58, 95% CI [-1,88, 0,80]).10.7554/eLife.18173Alla fine del periodo di studio predefinito (31° giorno), sono stati asportati e pesati i tumori di topi portatori di tumori del seno ortotopici MT1A2 trattati a giorni alterni con il controllo dell’isotipo IgG (IgG) (n = 7) o anti-topo CD47 (anti-CD47) (n = 6) e gli anticorpi anti-topo CD47 (anti-CD47) (n = 6). Il diagramma a punti con i mezzi riportati come barre trasversali e barre di errore rappresenta s.e.m. Il t-test di Welch a due code tra le IgG e i tumori trattati con anti-CD47; t(9 ,66) = 1,796, p=0,104. Ulteriori dettagli per questo esperimento sono disponibili sul sito https://osf.io/g57ch/.DOI:http://dx.doi.org/10.7554/eLife.18173.00410.7554/eLife.18173.005Figure2-figure supplement 1.Tumor volumi 1.Tumor di ospiti immunocompetenti trattati con controllo o anticorpi bersaglio CD47.This è lo stesso esperimento come in Figura 2. A seguito di iniezione ortotopica di cellule MT1A2 topi topi sono stati monitorati per lo sviluppo di tumori. Le misure del calibro sono state prese a 9, 11, 18 e 25 giorni dopo l’iniezione delle cellule per calcolare il volume del tumore. Quattordici topi con tumori rilevabili sono stati assegnati in modo casuale al trattamento a 11 giorni dopo l’inoculazione delle cellule (linea tratteggiata). Alla fine del periodo di studio predefinito, i tumori dei topi trattati con il controllo dell’isotipo IgG (IgG) (n = 7) o anti-topo CD47 (anti-CD47) (n = 6) sono stati asportati e pesati. Il volume del tumore al giorno 42 è stato calcolato in base al peso e alla densità (1,05 g/ml). Analisi esplorativa sui pesi tumorali escludendo tre tumori che sono regrediti durante il corso dello studio (indicato da un asterisco): t-test di Welch a due code tra IgG e anti-CD47 tumori trattati; t (7 ,94) = 0,745, p = 0,478, Glass ‘=Δ -0,58, 95% CI [-1,88, 0,80]. Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:http://dx.doi.org/10.7554/eLife.18173.005
I tumori sezionati sono stati ulteriormente elaborati e le sezioni istologiche colorate con H&E sono state analizzate alla cieca per verificare l’entità dell’infiltrazione linfocitica. Questo è simile allo studio originale, tuttavia questo tentativo di replica ha utilizzato un sistema di punteggio predefinito per valutare il grado di infiltrazione linfocitaria(Demaria et al., 2001). Sia i tumori trattati con IgG che quelli trattati con anti-CD47 hanno dato come risultato un infiltrato linfocitario da minimo a moderato(Tabella 1). Anche se non pianificati, i tumori sono stati analizzati anche per l’estensione dell’infiltrazione neutrofila. L’infiltrazione neutrofila nei tumori trattati con IgG era minima in 4 e moderata in 3 tumori. L’infiltrato neutrofilo nei tumori trattati anti-CD47 era minimo in 1, moderato in 3, e vivace in 2 tumori(Tabella 1).10.7554/eLife.18173.006Table 1.Severity di infiltrazione delle cellule infiammatorie dei tumori. I tumori asportati sono stati fissati, sezionati e macchiati di ematossilina ed eosina e sono stati valutati alla cieca da un patologo certificato dal Board Certified che ha utilizzato il punteggio di gravità per le infiltrazioni di cellule infiammatorie(Demaria et al., 2001). I linfociti e i neutrofili infiltranti il tumore dei linfociti e i neutrofili sono stati valutati per i tumori dei topi portatori di tumori del seno ortotopici MT1A2 trattati a giorni alterni con anticorpi IgG (IgG) (n = 7) o anti-topo CD47 (CD47) (n = 6). Ulteriori dettagli per questo esperimento sono disponibili sul sito https://osf.io/g57ch/.DOI:http://dx.doi.org/10.7554/eLife.18173.006LymphocyticinfiltrateNeutrophilic infiltrateTreatmentAbsentMinimalModerateBriskAbsentMinimalModerateBriskIgG06100430CD4705100132
Ci sono una serie di fattori che possono influenzare la crescita tumorale. Mentre la crescita tumorale è esponenziale in uno scenario ideale, fattori come la disponibilità di nutrienti, ossigeno e spazio influenzano e alterano la crescita del tumore inizialmente rispetto alla crescita continua del tumore(Cornelis et al., 2013; Talkington e Durrett, 2015). Contemporaneamente, altri modelli di tumore immunogenico murino sono noti per regredire spontaneamente(Penichet et al., 2001; Robinson et al., 2009; Vince et al., 2004), che è un fenomeno noto per essere naturalmente presente nei pazienti affetti da cancro(Jessy, 2011; Saleh et al., 2005; Salman, 2016).
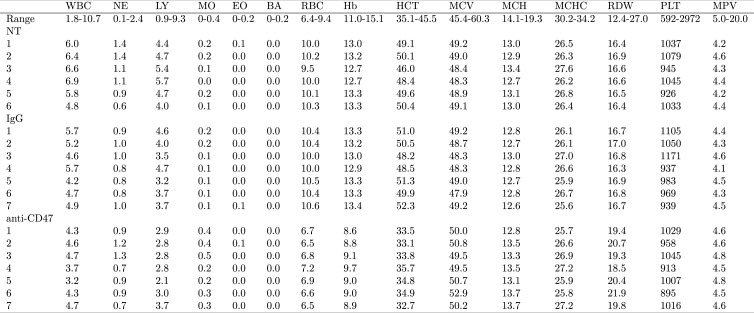
Figura 1-figure supplement 1.Analisi della tossicità del sangue.analisi della tossicità del sangue.I topi femmina FVB portatori di tumore al seno ortotopico MT1A2 sono stati randomizzati per ricevere gli anticorpi IgG di controllo dell’isotipo (IgG) (n = 7) o anti-topo CD47 (CD47) (n = 7). I topi con tumori piccoli o non rilevabili sono stati designati per la lettura della linea di base (NT) (n = 6). Cinque giorni dopo l’inizio del trattamento i campioni di sangue raccolti tramite emorragia retro-orbitale sono stati analizzati su un analizzatore ematologico. Trame a punti con mezzi riportati come barre incrociate per ogni parametro ematologico. Per ogni parametro è stata eseguita una ANOVA unidirezionale e il livello alfa o il valore p è stato regolato con la correzione Bonferroni.(A) Globuli bianchi (WBC), ANOVA unidirezionale; F(2,17) = 15,09, non corretto p=0,00017 con livello alfa = 0,0033; (Bonferroni corretto p=0,0026).(B) Neutrofili (NE), a senso unico ANOVA; F(2,17) = 1,02, non corretto p=0,381 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(C) Linfociti (LY), unidirezionali ANOVA; F(2,17) = 20,84, non corretto p=2,67×10-5 con livello alfa= 0,0033; (Bonferroni corretto p=0,00040).(D) Monociti (MO), ANOVA di Welch a senso unico; F(2,8,52) = 9,98, non corretto p=0,0058 con livello alfa = 0,0033; (Bonferroni corretto p=0,0877).(E) Eosinofili (EO), a senso unico ANOVA; F(2,17) = 0,06, non corretto p=0,942 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(F) Basofili (BA), a senso unico ANOVA; F(2,17) = 4,20, non corretto p=0,0330 con livello alfa = 0,0033; (Bonferroni corretto p=0,495).(G) Globuli rossi (RBC), unidirezionali ANOVA; F(2,17) = 424,9, non corretto p=3,07×10-15 con livello alfa= 0,0033; (Bonferroni corretto p=4,60×10-14).(H) Emoglobina (Hb), unidirezionale ANOVA; F(2,17) = 502,1, non corretto p=7,61×10-16 con livello alfa= 0,0033; (Bonferroni corretto p=1,14×10-14).(I) Ematocrito (HCT), unidirezionale ANOVA; F(2,17) = 283,0, non corretto p=8,93×10-14 con livello alfa= 0,0033; (Bonferroni corretto p=1,34×10-12).(J) Volume corpuscolare medio (MCV), a senso unico ANOVA; F(2,17) = 11,81, non corretto p=0,00061 con livello alfa = 0,0033; (Bonferroni corretto p=0,0091).(K) Emoglobina corpuscolare media (MCH), a senso unico ANOVA; F(2,17) = 10,64, non corretto p=0,00101 con livello alfa = 0,0033; (Bonferroni corretto p=0,0151).(L) Concentrazione media di emoglobina corpuscolare (MCHC), unidirezionale ANOVA; F(2,17) = 0,61, non corretto p=0,552 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(M) Larghezza di distribuzione dei globuli rossi (RDW), ANOVA di Welch a senso unico; F(2,10,46) = 30,62, non corretto p=4,25×10-5 con livello alfa= 0,0033; (Bonferroni corretto p=0,00064).(N) Piastrine (PLT), unidirezionale ANOVA; F(2,17) = 0,62, non corretto p=0,548 con livello alfa = 0,0033; (Bonferroni corretto p>0,99).(O) Volume medio delle piastrine (MPV), unidirezionale ANOVA; F(2,17) = 6,98, non corretto p=0,0061 con livello alfa = 0,0033; (Bonferroni corretto p=0,092). Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:
http://dx.doi.org/10.7554/eLife.18173.002I topi femmina FVB portatori di tumore al seno ortotopico MT1A2 sono stati randomizzati per ricevere gli anticorpi IgG di controllo dell’isotipo (IgG) (n = 7) o anti-topo CD47 (CD47) (n = 7). I topi con tumori piccoli o non rilevabili sono stati designati per la lettura della linea di base (NT) (n = 6). Cinque giorni dopo l’inizio del trattamento i campioni di sangue raccolti tramite emorragia retro-orbitale sono stati analizzati su un analizzatore ematologico. Intervalli di riferimento normali (Range) per ogni parametro sono da Drew Scientific Hemavet 950FS. WBC = globuli bianchi; NE = Neutrofili; LY = Linfociti; MO = Monociti; EO = Eosinofili; BA = Basofili; RBC = Globuli rossi; Hb = Emoglobina; HCT = Ematocrito; MCV = Volume corpuscolare medio; MCH = emoglobina corpuscolare media; MCHC = concentrazione media di emoglobina corpuscolare; RDW = larghezza di distribuzione dei globuli rossi; PLT = piastrine; MPV = volume piastrinico medio. Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:
http://dx.doi.org/10.7554/eLife.18173.003

Figura 1-figure supplement 1.Analisi della tossicità del sangue.I topi femmina FVB portatori di tumore al seno ortotopico MT1A2 sono stati randomizzati per ricevere il controllo dell’isotipo IgG (IgG) (n = 7) o gli anticorpi anti-topo CD47 (CD47) (n = 7). I topi con tumori piccoli o non rilevabili sono stati designati per la lettura della linea di base (NT) (n = 6). Cinque giorni dopo l’inizio del trattamento i campioni di sangue raccolti tramite emorragia retro-orbitale sono stati analizzati su un analizzatore ematologico. Intervalli di riferimento normali (Range) per ogni parametro sono da Drew Scientific Hemavet 950FS. WBC = globuli bianchi; NE = Neutrofili; LY = Linfociti; MO = Monociti; EO = Eosinofili; BA = Basofili; RBC = Globuli rossi; Hb = Emoglobina; HCT = Ematocrito; MCV = Volume corpuscolare medio; MCH = emoglobina corpuscolare media; MCHC = concentrazione media di emoglobina corpuscolare; RDW = larghezza di distribuzione dei globuli rossi; PLT = piastrine; MPV = volume piastrinico medio. Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:
http://dx.doi.org/10.7554/eLife.18173.003
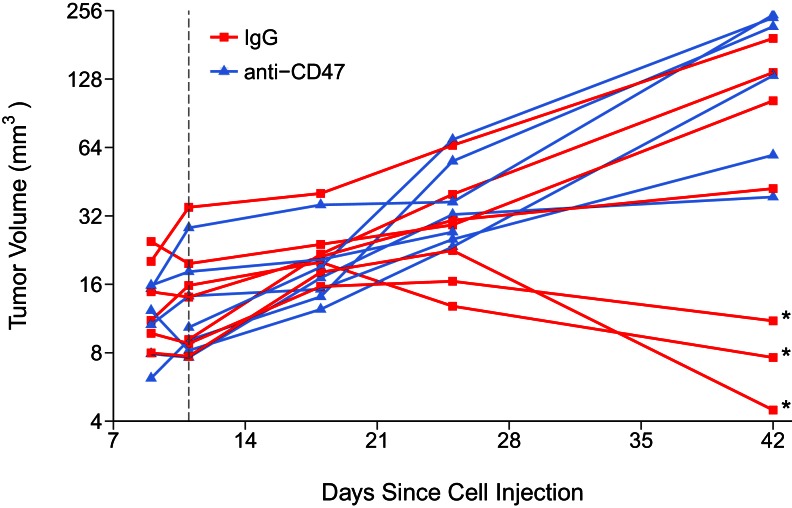
Figura 2-figure supplement 1.Pesi tumorali finali di ospiti immunocompetenti trattati con anticorpi di controllo o con anticorpi bersaglio CD47.Volumi tumorali di ospiti immunocompetenti trattati con anticorpi di controllo o con anticorpi bersaglio CD47.Al termine del periodo di studio predefinito (Giorno 31), sono stati asportati e pesati gli anticorpi dei tumori del seno di topi portatori di tumori ortotopici MT1A2 trattati a giorni alterni con controllo dell’isotipo IgG (IgG) (n = 7) o anti-topo CD47 (anti-CD47) (n = 6). Il diagramma a punti con i mezzi riportati come barre trasversali e barre di errore rappresenta s.e.m. Il t-test di Welch a due code tra le IgG e i tumori trattati con anti-CD47; t(9 ,66) = 1,796, p=0,104. Ulteriori dettagli per questo esperimento sono disponibili sul sito https://osf.io/g57ch/.DOI:
http://dx.doi.org/10.7554/eLife.18173.004Questo è lo stesso esperimento della Figura 2. A seguito di iniezione ortotopica di cellule MT1A2 topi topi sono stati monitorati per lo sviluppo di tumori. Misure del calibro sono state prese a 9, 11, 18, e 25 giorni dopo l’iniezione delle cellule per calcolare il volume del tumore. Quattordici topi con tumori rilevabili sono stati assegnati in modo casuale al trattamento a 11 giorni dopo l’inoculazione delle cellule (linea tratteggiata). Alla fine del periodo di studio predefinito, i tumori dei topi trattati con il controllo dell’isotipo IgG (IgG) (n = 7) o anti-topo CD47 (anti-CD47) (n = 6) sono stati asportati e pesati. Il volume del tumore al giorno 42 è stato calcolato in base al peso e alla densità (1,05 g/ml). Analisi esplorativa sui pesi tumorali escludendo tre tumori che sono regrediti durante il corso dello studio (indicato da un asterisco): t-test di Welch a due code tra IgG e anti-CD47 tumori trattati; t (7 ,94) = 0,745, p = 0,478, Glass ‘=Δ -0,58, 95% CI [-1,88, 0,80]. Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:
http://dx.doi.org/10.7554/eLife.18173.005

Figura 2-figure supplement 1.2. Volumi tumorali di ospiti immunocompetenti trattati con anticorpi di controllo o con anticorpi mirati CD47.Questo è lo stesso esperimento della Figura 2. A seguito di iniezione ortotopica di cellule MT1A2 topi topi sono stati monitorati per lo sviluppo di tumori. Misure del calibro sono state prese a 9, 11, 18, e 25 giorni dopo l’iniezione delle cellule per calcolare il volume del tumore. Quattordici topi con tumori rilevabili sono stati assegnati in modo casuale al trattamento a 11 giorni dopo l’inoculazione delle cellule (linea tratteggiata). Alla fine del periodo di studio predefinito, i tumori dei topi trattati con il controllo dell’isotipo IgG (IgG) (n = 7) o anti-topo CD47 (anti-CD47) (n = 6) sono stati asportati e pesati. Il volume del tumore al giorno 42 è stato calcolato in base al peso e alla densità (1,05 g/ml). Analisi esplorativa sui pesi tumorali escludendo tre tumori che sono regrediti durante il corso dello studio (indicato da un asterisco): t-test di Welch a due code tra IgG e anti-CD47 tumori trattati; t (7 ,94) = 0,745, p = 0,478, Glass ‘=Δ -0,58, 95% CI [-1,88, 0,80]. Ulteriori dettagli per questo esperimento possono essere trovati su https://osf.io/g57ch/.DOI:
http://dx.doi.org/10.7554/eLife.18173.005
Meta-analisi degli effetti originali e replicati
Abbiamo eseguito una meta-analisi utilizzando un modello di effetti casuali per l’effetto descritto in precedenza come pre-specificato nel piano di analisi di conferma(Chroscinski et al., 2015). Per fornire una misura standardizzata dell’effetto, è stata calcolata una dimensione comune dell’effetto Glass’ Δ per lo studio originale e di replica. Glass’ Δ è la differenza standardizzata tra due mezzi che utilizzano la deviazione standard del solo gruppo di controllo. Viene utilizzata in questo caso a causa della disuguale scostamento tra le condizioni di controllo e di trattamento nello studio originale.
Il confronto dei tumori trattati con IgG rispetto ai tumori trattati con anti-CD47 ha portato a Glass’ Δ = 2,54, 95% CI [0,40, 4,60] per i dati riportati nella Figura 6B dello studio originale (Willingham et al.,2012). Questo confronto con Glass’Δ = -1,13, 95% CI [-2,35, 0,16] riportati in questo studio. Una meta-analisi(Figura 3) di questi due effetti ha portato a Glass’Δ = 0,60, 95% CI [-3,00, 4,19], p=0,745. Gli effetti per ogni studio sono in direzioni opposte e la stima puntuale della dimensione dell’effetto di replica non rientra nell’intervallo di confidenza del risultato originale, o viceversa. La meta-analisi degli effetti casuali non ha prodotto un effetto statisticamente significativo. Inoltre, il test Q di Cochran per l’eterogeneità è stato statisticamente significativo(p=0,0039), che insieme a un ampio intervallo di confidenza intorno alla dimensione media ponderata dell’effetto della meta-analisi suggerisce un’eterogeneità tra lo studio originale e quello di replicazione.10.7554/eLife.18173.007Figure 3.Meta-analisi dell’effetto.La dimensione dell’effetto (Glass’ Δ) e l’intervallo di confidenza del 95% sono presentati per Willingham et al. (2012), questo tentativo di replicazione (RP:CB) , e una meta-analisi per combinare i due effetti del confronto del peso del tumore. Le dimensioni dei campioni utilizzati in Willingham et al. (2012) e questo tentativo di replicazione sono riportati sotto il nome dello studio. Meta-analisi degli effetti casuali dei tumori trattati con IgG rispetto all’anti-CD47 (meta-analisi p=0,745). Ulteriori dettagli per questa meta-analisi sono disponibili all’indirizzo https://osf.io/ha2bx/.DOI:http://dx.doi.org/10.7554/eLife.18173.007
Questa replica diretta offre l’opportunità di comprendere le prove attuali di questi effetti. Tutte le differenze note, comprese quelle relative ai reagenti e ai protocolli, sono state identificate prima di condurre il lavoro sperimentale e descritte nel Registered Report(Chroscinski et al., 2015). Tuttavia, questo si limita a quanto ottenibile dal documento originale e attraverso la comunicazione con gli autori originali, il che significa che ci potrebbero essere caratteristiche particolari del protocollo sperimentale originale che potrebbero essere critiche, ma non identificate. Così, mentre alcuni aspetti, come la linea cellulare, il ceppo e il sesso dei topi, il numero di cellule iniettate e il sito di iniezione del trattamento anticorpale sono stati mantenuti, altri erano sconosciuti o non facilmente controllabili. Questi includono variabili come la deriva genetica della linea cellulare(Hughes et al., 2007; Kleensang et al., 2016), le risposte biologiche circadiane alla terapia(Fu e Kettner, 2013), i ceppi di topo(Clayton e Collins, 2014), la temperatura di alloggiamento nelle strutture per topi (Kokolus et al., 2013), e l’obesità e il microbioma dei topi riceventi(Klevorn e Teague, 2016; Macpherson e McCoy, 2015). Inoltre, una risposta differenziale all’immunoterapia può verificarsi a causa dell’eterogeneità dei microambienti tumorali individuali(Grosso e Jure-Kunkel, 2013), che è stata osservata anche in ambito clinico(Ascierto e Marincola, 2014; Stevenson, 2014). Se questi o altri fattori influenzano i risultati di questo studio è possibile ipotizzare e approfondire le indagini, il che è facilitato da repliche dirette e da una reportistica trasparente.
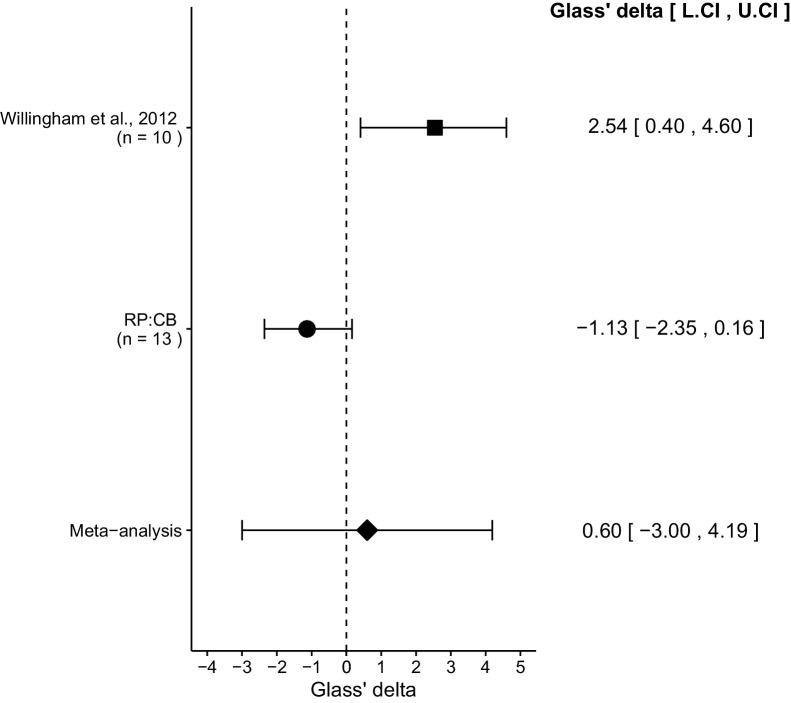
Figura 3.Meta-analisi dell’effetto.La dimensione dell’effetto (Glass’ Δ) e l’intervallo di confidenza del 95% sono presentati per Willingham et al. (2012), questo tentativo di replicazione (RP:CB) , e una meta-analisi per combinare i due effetti del confronto del peso del tumore. Le dimensioni dei campioni utilizzati in Willingham et al. (2012) e questo tentativo di replicazione sono riportati sotto il nome dello studio. Meta-analisi degli effetti casuali dei tumori trattati con IgG rispetto all’anti-CD47 (meta-analisi p=0,745). Ulteriori dettagli per questa meta-analisi sono disponibili all’indirizzo https://osf.io/ha2bx/.DOI:
http://dx.doi.org/10.7554/eLife.18173.007
Materiali e metodi
Come descritto nel Registered Report(Chroscinski et al., 2015), abbiamo tentato una replica degli esperimenti riportati nella Figura 6A-C e nella Supplemental Table S4 di Willingham et al. (2012). Una descrizione dettagliata di tutti i protocolli si trova nel Registered Report(Chroscinski et al., 2015). Ulteriori note sperimentali dettagliate, dati e analisi sono disponibili su Open Science Framework (OSF) (RRID: SCR_003238)(https://osf.io/9pbos/; Horrigan et al., 2016).
Coltura cellulare
Le cellule MT1A2 (condivise dal laboratorio Weissman, Stanford University) sono state mantenute in Dulbecco Modified Eagle’s Medium (DMEM) integrato con 4 mM L-glutammina, 10% siero bovino fetale (FBS) (Sigma-Aldrich, gatto # F0392), 100 U / ml penicillina, e 100 µg / ml streptomicina. Tutte le cellule sono state coltivate a 37 ° C in un’atmosfera umidificata al 5% di CO2.
I dati di controllo di qualità per la linea di cellule MT1A2 sono disponibili sul OSF(https://osf.io/9r5hy/). Questo include i risultati che confermano che la linea cellulare era esente da contaminazione da micoplasma e patogeni comuni del topo. Inoltre, è stata eseguita la profilazione del DNA STR della linea cellulare.
Anticorpi terapeutici
Mouse anti-CD47, anticorpo MIAP410 (laboratorio Weissman, Università di Stanford) e topo IgG endotossina impoverita Proteina A purificata (Ricerca Innovativa, cat # IR-MS-GF-ED, lotto # 111214DG, RRID: AB_1501657) sono stati diluiti con PBS ghiacciato ad una concentrazione finale di 4,0 mg/ml e aliquotati in 18 fiale da 0,8 ml ciascuna e conservati a 4°C. Una fiala è stata usata per ogni giorno di iniezione ed ogni residuo è stato scartato. Un test di immunosorbimento enzimatico (ELISA) è stato eseguito con l’anticorpo di topo anti-CD47, MIAP410 su piastre rivestite con CD47-Fc umano o CD47-Fc di topo (condiviso dal laboratorio Weissman dell’Università di Stanford). I dettagli del protocollo ELISA e i dati sono disponibili all’indirizzo https://osf.io/werk5/.
Animali
Tutte le procedure relative agli animali sono state approvate dalla Noble Life Sciences IACUC# 15-05-001SCI e sono conformi alle politiche della Noble Life Sciences sulla cura, il benessere e il trattamento degli animali da laboratorio, che aderiscono ai regolamenti delineati nell’USDA Animal Welfare Act (9 CFR Parti 1,2 e 3) e alle condizioni specificate nella Guida per la cura e l’uso degli animali da laboratorio(Comitato del National Research Council (US) per l’aggiornamento della Guida per la cura e l’uso degli animali da laboratorio, 2011).
Ai topi è stata offerta una dieta certificata per roditori (Harlan Teklad, gatto # 2018) ad libitum. La stanza degli animali è stata impostata per mantenere tra i 19-22°C, un’umidità relativa del 40-65% e un ciclo luce/buio di 12 ore, che è stato interrotto per attività legate allo studio.
Un totale di 20, sei-otto settimane topi femmina FVB (Charles River, codice ceppo 207) sono stati inoculati ortopedicamente con 50.000 cellule MT1A2 ad una densità di 5 × 104 cellule in 100 µl di tampone FACS con 25% vol / vol Matrigel alta concentrazione (BD / Corning, gatto # 354262, lotto # 4090005) nella mammaria addominale sinistra addominale # 4 cuscinetto di grasso. I topi sono stati monitorati a giorni alterni per verificare la presenza di segni di crescita tumorale. Una volta che la crescita tumorale è stata rilevata in qualsiasi animale, i tumori sono stati misurati utilizzando un calibro digitale e i pesi corporei sono stati registrati. Al momento della randomizzazione, 17 animali avevano tumori palpabili, con i 14 animali che avevano i tumori più grandi sono entrati nello studio. I topi sono stati classificati in base al volume del tumore dal più alto al più basso e i 14 animali con i tumori più grandi sono stati assegnati a un gruppo utilizzando un metodo a serpentina alternata. La designazione di IgG o anti-CD47 al gruppo 1 o 2 è stata fatta assegnando casualmente i due gruppi di trattamento in un unico blocco usando www.randomization.com (numero di seme = 21473) con variabilità delle misurazioni del volume tumorale distribuita uniformemente tra le due condizioni (t-test dello studente; t(12) = 0,44, p=0,67). I restanti sei topi non randomizzati al trattamento sono stati utilizzati per generare letture di base per l’analisi ematologica con uno di questi animali che sviluppano un tumore prima che l’analisi del sangue è stata eseguita, il che significa che dei 20 topi inoculati, 18 tumori sviluppati. Un primo tentativo con 14 topi inoculati con cellule MT1A2 è stato terminato perché troppo pochi animali (10 su 14 animali) avevano stabilito tumori. Ulteriori dettagli possono essere trovati nella sezione ‘Deviazioni dal Registered Report’ e all’indirizzo https://osf.io/zch4n/.
A partire dal giorno della randomizzazione e ogni due giorni per 30 giorni, 400 µg di anti-CD47 o IgG in un volume di 100 µl sono stati iniettati nel pad grasso mammario circa 2 mm prossimale al tumore con un ago da 30 e una siringa da 0,5 ml. Un animale che riceveva l’anticorpo anti-CD47 del topo è stato trovato morto, senza alcuna causa di morte visibile, prima della fine dello studio. Nessuna perdita di peso corporeo o cambiamenti comportamentali sono stati osservati in nessun animale. Alla fine del periodo di trattamento, il giorno di studio 31, gli animali sono stati anestetizzati con isoflurano, sacrificati, e tumori sono stati asportati, puliti dal tessuto adiposo circostante e pesati. Il volume del tumore è stato calcolato in base alle misurazioni del calibro usando la formula (volume = 1/2 (lunghezza*larghezza2) o calcolato in base al peso dei tumori asportati e alla densità (1,05 g/ml) (Jensen etal., 2008).
Analisi ematologica
Cinque giorni dopo l’inizio delle iniezioni i topi sono stati anestetizzati con isoflurano e 0,1-0,2 ml di sangue sono stati raccolti dal seno retro-orbitale con una pipetta microcapillare in un tubo di raccolta contenente kEDTA. I campioni sono stati cullati delicatamente e analizzati entro 2 ore con un Hemavet 950FS (Drew Scientific, Miami Lakes, Florida) utilizzando il programma del mouse incorporato per determinare i parametri completi dell’emocromo (15 parametri totali riportati). I profili ematologici sono disponibili su https://osf.io/ucxwj/.
Istopatologia
I tumori asportati sono stati fissati in formalina, bloccati con paraffina, sezionati (due sezioni spesse 5 micron di ogni tumore) e macchiati con ematossilina ed eosina come descritto nel Registered Report(Chroscinski et al., 2015). Le sezioni sono state esaminate al microscopio alla cieca da Alexander DePaoli, DVM, PhD (IDEXX Laboratories, Inc.) utilizzando il punteggio di gravità per gli infiltrati delle cellule infiammatorie(Demaria et al., 2001) dove: assente = 0, minimo = 1, moderato = 2, vivace = 3. Il rapporto istopatologico è disponibile su https://osf.io/xky96/. Le sezioni tumorali colorate con H&E sono disponibili su https://osf.io/43jau/. Le sezioni tumorali rimanenti sono disponibili su richiesta.
Analisi statistica
L’analisi statistica è stata effettuata con il software R (RRID: SCR_001905), versione 3.3.1 ( R Core Team, 2016). Tutti i dati, i file csv e gli script di analisi sono disponibili su OSF(https://osf.io/9pbos/). L’analisi statistica di conferma è stata pre-registrata(https://osf.io/9gykv/) prima dell’inizio del lavoro sperimentale, come indicato nel Registered Report(Chroscinski et al., 2015). I dati sono stati controllati per garantire il rispetto delle ipotesi di test statistici. I parametri ematologici sono stati analizzati da più ANOVA monodirezionali; uno per ciascuno dei 15 parametri analizzati. La correzione Bonferroni, per tener conto di test multipli, è stata applicata all’errore alfa o al valore p. Il valore corretto di Bonferroni è stato determinato dividendo il valore non corretto per il numero di test eseguiti. Per l’errore alfa questo risultato è stato ottenuto. 0033 (.05/15). È stata eseguita una meta-analisi delle dimensioni di un comune effetto originale e di replica con un modello di effetti casuali e il pacchetto metafor R(Viechtbauer, 2010) (disponibile su https://osf.io/ha2bx/). I dati dello studio originale sono stati condivisi a priori dagli autori originali durante la preparazione del disegno sperimentale. I dati sono stati pubblicati nel Registered Report(Chroscinski et al., 2015) e sono stati utilizzati nei calcoli di potenza per determinare la dimensione del campione per questo studio.
Deviazioni dal rapporto registrato
Il tipo di Matrigel ad alta concentrazione era diverso da quello elencato nel Registered Report. Il Registered Report elencava il Matrigel ad alta concentrazione (BD/Corning, gatto # 354248) mentre l’esperimento di replicazione utilizzava il Matrigel ad alta concentrazione, Phenol Red-Free Matrigel (BD/Corning, gatto # 354262). Il tipo di Matrigel utilizzato nell’esperimento originale non è stato specificato. La proteina IgG del topo Una proteina purificata utilizzata in questo esperimento di replicazione è stata impoverita di endotossina, mentre il Registered Report non indicava questa metodologia di purificazione. Questo è stato chiarito durante la comunicazione con gli autori originali prima di eseguire l’esperimento. Sono elencati anche materiali e strumentazione aggiuntivi non elencati nel Registered Report, ma necessari durante la sperimentazione.
Un primo tentativo di inoculare 14 animali con cellule MT1A2 come indicato nella relazione registrata ha portato solo 10 animali con tumori stabiliti. Questo è stato interrotto perché non è stato raggiunto il numero predefinito di animali (7 per gruppo) con tumori accertati. Per il secondo tentativo, qui riportato, il numero di animali da inoculare con cellule MT1A2 è stato aumentato a 20, in base al tasso di innesto osservato nel primo tentativo. Questo tentativo ha portato a 17 animali con tumori rilevabili al momento della randomizzazione, con i 14 animali che hanno i tumori più grandi assegnati al trattamento IgG o anti-CD47. I rimanenti 6 animali sono stati utilizzati per generare letture di base per l’analisi ematologica con uno di questi animali che sviluppava un tumore prima dell’analisi del sangue, il che significa che 18 dei 20 topi inoculati hanno sviluppato tumori.
Il Registered Report ha descritto 13 parametri ematologici, simili a quanto riportato in Willingham et al. (2012) (Tabella S4), mentre questo tentativo di replica ha riportato 15 parametri. La differenza deriva da una misura inclusiva dei granulociti utilizzati nello studio originale, mentre questo tentativo di replicazione ha misurato il numero dei tre principali tipi di granulociti: neutrofili, basofili ed eosinofili.
References
- Addison CL, Braciak T, Ralston R, Muller WJ, Gauldie J, Graham FL. Intratumoral injection of an adenovirus expressing interleukin 2 induces regression and immunity in a murine breast cancer model. PNAS. 1995; 92:8522-8526. DOI | PubMed
- Ahn GO, Brown JM. Matrix metalloproteinase-9 is required for tumor vasculogenesis but not for angiogenesis: role of bone marrow-derived myelomonocytic cells. Cancer Cell. 2008; 13:193-205. DOI | PubMed
- Ascierto PA, Marincola FM. What have we learned from cancer immunotherapy in the last 3 years?. Journal of Translational Medicine. 2014; 12:141. DOI | PubMed
- Chroscinski D, Maherali N, Griner E, Reproducibility Project: Cancer Biology. Registered report: The CD47-signal regulated protein alpha (SIRPa) interaction is a therapeutic target for human solid tumors. eLife. 2015; 4DOI
- Cioffi M, Trabulo S, Hidalgo M, Costello E, Greenhalf W, Erkan M, Kleeff J, Sainz B, Heeschen C. Inhibition of CD47 effectively targets pancreatic Cancer Stem Cells via dual Mechanisms. Clinical Cancer Research. 2015; 21:2325-2337. DOI | PubMed
- Clayton JA, Collins FS. Policy: NIH to balance sex in cell and animal studies. Nature. 2014; 509:282-283. DOI | PubMed
- Cornelis F, Saut O, Cumsille P, Lombardi D, Iollo A, Palussiere J, Colin T. In vivo mathematical modeling of tumor growth from imaging data: soon to come in the future?. Diagnostic and Interventional Imaging. 2013; 94:593-600. DOI | PubMed
- Demaria S, Volm MD, Shapiro RL, Yee HT, Oratz R, Formenti SC, Muggia F, Symmans WF. Development of tumor-infiltrating lymphocytes in breast cancer after neoadjuvant paclitaxel chemotherapy. Clinical Cancer Research. 2001; 7:3025-3030. PubMed
- Desilva A, Wuest M, Wang M, Hummel J, Mossman K, Wuest F, Hitt MM. Comparative functional evaluation of immunocompetent mouse breast cancer models established from PyMT-tumors using small animal PET with [(18)F]FDG and [(18)F]FLT. American Journal of Nuclear Medicine and Molecular Imaging. 2012; 2:88-98. PubMed
- Errington TM, Iorns E, Gunn W, Tan FE, Lomax J, Nosek BA. An open investigation of the reproducibility of cancer biology research. eLife. 2014; 3DOI
- Fu L, Kettner NM. The circadian clock in cancer development and therapy. Progress in Molecular Biology and Translational Science. 2013; 119:221-282. DOI | PubMed
- Grosso JF, Jure-Kunkel MN. CTLA-4 blockade in tumor models: an overview of preclinical and translational research. Cancer Immunity. 2013; 13PubMed
- Han X, Sterling H, Chen Y, Saginario C, Brown EJ, Frazier WA, Lindberg FP, Vignery A. CD47, a ligand for the macrophage fusion receptor, participates in macrophage multinucleation. Journal of Biological Chemistry. 2000; 275:37984-37992. DOI | PubMed
- Horrigan S, Iorns E, Williams SR, Perfito N, Errington TM. Study 39: Replication of Willingham, et al., 2012 (PNAS). Open Science Framework. 2016. DOI
- Hughes P, Marshall D, Reid Y, Parkes H, Gelber C. The costs of using unauthenticated, over-passaged cell lines: how much more data do we need?. BioTechniques. 2007; 43:575-586. DOI | PubMed
- Jensen MM, Jørgensen JT, Binderup T, Kjaer A, Kjær A. Tumor volume in subcutaneous mouse xenografts measured by microCT is more accurate and reproducible than determined by 18F-FDG-microPET or external caliper. BMC Medical Imaging. 2008; 8DOI | PubMed
- Jessy T. Immunity over inability: The spontaneous regression of cancer. Journal of Natural Science, Biology and Medicine. 2011; 2:43. DOI | PubMed
- Kleensang A, Vantangoli MM, Odwin-DaCosta S, Andersen ME, Boekelheide K, Bouhifd M, Fornace AJ, Li HH, Livi CB, Madnick S, Maertens A, Rosenberg M, Yager JD, Zhaog L, Hartung T. Genetic variability in a frozen batch of MCF-7 cells invisible in routine authentication affecting cell function. Scientific Reports. 2016; 6DOI | PubMed
- Klevorn LE, Teague RM. Adapting Cancer Immunotherapy Models for the real World. Trends in Immunology. 2016; 37:354-363. DOI | PubMed
- Kokolus KM, Capitano ML, Lee CT, Eng JW, Waight JD, Hylander BL, Sexton S, Hong CC, Gordon CJ, Abrams SI, Repasky EA. Baseline tumor growth and immune control in laboratory mice are significantly influenced by subthermoneutral housing temperature. PNAS. 2013; 110:20176-20181. DOI | PubMed
- Krampitz GW, George BM, Willingham SB, Volkmer JP, Weiskopf K, Jahchan N, Newman AM, Sahoo D, Zemek AJ, Yanovsky RL, Nguyen JK, Schnorr PJ, Mazur PK, Sage J, Longacre TA, Visser BC, Poultsides GA, Norton JA, Weissman IL. Identification of tumorigenic cells and therapeutic targets in pancreatic neuroendocrine tumors. PNAS. 2016; 113:4464-4469. DOI | PubMed
- Lindberg FP, Gresham HD, Schwarz E, Brown EJ. Molecular cloning of integrin-associated protein: an immunoglobulin family member with multiple membrane-spanning domains implicated in alpha v beta 3-dependent ligand binding. The Journal of Cell Biology. 1993; 123:485-496. DOI | PubMed
- Liu J, Wang L, Zhao F, Tseng S, Narayanan C, Shura L, Willingham S, Howard M, Prohaska S, Volkmer J, Chao M, Weissman IL, Majeti R. Pre-clinical Development of a Humanized Anti-CD47 Antibody with Anti-Cancer therapeutic potential. PLoS One. 2015; 10DOI | PubMed
- Macpherson AJ, McCoy KD. Standardised animal models of host microbial mutualism. Mucosal Immunology. 2015; 8:476-486. DOI | PubMed
- National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. The National Academies Collection: Reports Funded by National Institutes of Health. National Academies Press: Washington; 2011.
- Noblitt LW, Bangari DS, Shukla S, Mohammed S, Mittal SK. Immunocompetent mouse model of breast cancer for preclinical testing of EphA2-targeted therapy. Cancer Gene Therapy. 2005; 12:46-53. DOI | PubMed
- Oldenborg PA. Role of CD47 in erythroid cells and in autoimmunity. Leukemia & Lymphoma. 2004; 45:1319-1327. DOI | PubMed
- Oldenborg P-A, Gresham HD, Lindberg FP. Cd47-Signal Regulatory Protein α (Sirpα) regulates Fcγ and Complement Receptor–mediated Phagocytosis. The Journal of Experimental Medicine. 2001; 193:855-862. DOI | PubMed
- Oldenborg PA, Zheleznyak A, Fang YF, Lagenaur CF, Gresham HD, Lindberg FP. Role of CD47 as a marker of self on red blood cells. Science. 2000; 288:2051-2054. DOI | PubMed
- Penichet ML, Dela Cruz JS, Challita-Eid PM, Rosenblatt JD, Morrison SL. A murine B cell lymphoma expressing human HER2/ neu undergoes spontaneous tumor regression and elicits antitumor immunity. Cancer Immunology, Immunotherapy. 2001; 49:649-662. DOI | PubMed
- R Core Team. R Foundation for Statistical Computing. Vienna: Austria; 2016.
- Robinson M, Li B, Ge Y, Ko D, Yendluri S, Harding T, VanRoey M, Spindler KR, Jooss K. Novel immunocompetent murine tumor model for evaluation of conditionally replication-competent (oncolytic) murine adenoviral vectors. Journal of Virology. 2009; 83:3450-3462. DOI | PubMed
- Saleh F, Renno W, Klepacek I, Ibrahim G, Dashti H, Asfar S, Behbehani A, Al-Sayer H, Dashti A, Kerry C, Dashti A. Direct evidence on the immune-mediated spontaneous regression of human cancer: an incentive for pharmaceutical companies to develop a novel anti-cancer vaccine. Current Pharmaceutical Design. 2005; 11:3531-3543. DOI | PubMed
- Salman T. Spontaneous tumor regression. Journal of Oncological Science. 2016; 2:1-4. DOI
- Stevenson GT. Three major uncertainties in the antibody therapy of cancer. Haematologica. 2014; 99:1538-1546. DOI | PubMed
- Talkington A, Durrett R. Estimating tumor growth rates in vivo. Bulletin of Mathematical Biology. 2015; 77:1934-1954. DOI | PubMed
- Viechtbauer W. Conducting Meta-Analyses in R with the metafor Package. Journal of Statistical Software. 2010; 36DOI
- Vince GH, Bendszus M, Schweitzer T, Goldbrunner RH, Hildebrandt S, Tilgner J, Klein R, Solymosi L, Christian Tonn J, Roosen K. Spontaneous regression of experimental gliomas–an immunohistochemical and MRI study of the C6 glioma spheroid implantation model. Experimental Neurology. 2004; 190:478-485. DOI | PubMed
- Willingham SB, Volkmer JP, Gentles AJ, Sahoo D, Dalerba P, Mitra SS, Wang J, Contreras-Trujillo H, Martin R, Cohen JD, Lovelace P, Scheeren FA, Chao MP, Weiskopf K, Tang C, Volkmer AK, Naik TJ, Storm TA, Mosley AR, Edris B, Schmid SM, Sun CK, Chua MS, Murillo O, Rajendran P, Cha AC, Chin RK, Kim D, Adorno M, Raveh T, Tseng D, Jaiswal S, Enger PØ, Steinberg GK, Li G, So SK, Majeti R, Harsh GR, van de Rijn M, Teng NN, Sunwoo JB, Alizadeh AA, Clarke MF, Weissman IL. The CD47-signal regulatory protein alpha (SIRPa) interaction is a therapeutic target for human solid tumors. PNAS. 2012; 109:6662-6667. DOI | PubMed
- Xu JF, Pan XH, Zhang SJ, Zhao C, Qiu BS, Gu HF, Hong JF, Cao L, Chen Y, Xia B, Bi Q, Wang YP. CD47 blockade inhibits tumor progression human osteosarcoma in xenograft models. Oncotarget. 2015; 6:23662-23670. DOI | PubMed
- Yoshida K, Tsujimoto H, Matsumura K, Kinoshita M, Takahata R, Matsumoto Y, Hiraki S, Ono S, Seki S, Yamamoto J, Hase K. CD47 is an adverse prognostic factor and a therapeutic target in gastric cancer. Cancer Medicine. 2015; 4:1322-1333. DOI | PubMed
- Zhang M, Hutter G, Kahn SA, Azad TD, Gholamin S, Xu CY, Liu J, Achrol AS, Richard C, Sommerkamp P, Schoen MK, McCracken MN, Majeti R, Weissman I, Mitra SS, Cheshier SH. Anti-CD47 Treatment stimulates Phagocytosis of Glioblastoma by M1 and M2 polarized Macrophages and promotes M1 polarized Macrophages in Vivo. PLoS One. 2016; 11DOI | PubMed
Fonte
Horrigan SK, Massagué J () Replication Study: The CD47-signal regulatory protein alpha (SIRPa) interaction is a therapeutic target for human solid tumors. eLife 6e18173. https://doi.org/10.7554/eLife.18173





