Introduzione
Gli antibiotici macrolidi (tra cui l’eritromicina, la claritromicina e l’azitromicina) sono tra gli antibiotici più frequentemente prescritti durante la gravidanza nei paesi occidentali.123 La politica di consulenza sull’uso dei macrolidi in gravidanza varia. Un avvertimento contro l’uso di eritromicina durante il primo trimestre è stato emesso in Svezia nel 2005, dopo che è stata segnalata un’associazione tra macrolidi e malformazioni cardiache.45 La United Kingdom Medicines and Healthcare products Regulatory Agency consiglia di prescrivere alternative alla claritromicina e all’azitromicina durante la gravidanza.6 Negli Stati Uniti e nel Regno Unito sono state emesse avvertenze contro l’uso di azitromicina e claritromicina negli adulti con un alto rischio di complicanze cardiovascolari,78 sulla base dell’evidenza di un aumento del rischio di aritmie cardiache e di mortalità cardiaca (due revisioni sistematiche, 19 studi controllati randomizzati).910Una recente revisione sistematica sull’uso dei macrolidi durante la gravidanza ha mostrato una consistente evidenza di un aumento del rischio di aborto spontaneo, ma prove meno consistenti di malformazioni congenite, paralisi cerebrale ed epilessia.11
Abbiamo condotto un ampio studio di coorte retrospettivo con dati provenienti da un database di assistenza primaria rappresentativo del Regno Unito per affrontare queste incertezze. Abbiamo confrontato i bambini nati da madri a cui sono stati prescritti antibiotici macrolidi durante la gravidanza con quelli a cui sono state prescritte penicilline per ridurre al minimo gli effetti di confusione a causa dell’infezione. I macrolidi sono spesso utilizzati come alternative per i pazienti allergici alla penicillina; le penicilline hanno una lunga tradizione di sicurezza durante la gravidanza.2612Abbiamo ipotizzato che i macrolidi potrebbero indurre aritmia cardiaca fetale e ipossia fetale a breve termine,131415e quindi abbiamo confrontato le principali malformazioni e i disturbi dello sviluppo neurologico nei bambini che potrebbero derivare da ipossia fetale a breve termine.
Metodi
Popolazione studiata
Abbiamo utilizzato i dati del Clinical Practice Research Datalink (CPRD), un grande database di cure primarie anonime che copre il 6,9% della popolazione del Regno Unito.16 Il CPRD è ampiamente rappresentativo della popolazione nazionale in termini di età, sesso ed etnia. La banca dati comprende registrazioni di consultazioni, diagnosi e sintomi, test, riferimenti e feedback da cure secondarie, comportamenti relativi alla salute e cure aggiuntive somministrate come parte della pratica generale di routine. I dati relativi alle prescrizioni vengono registrati automaticamente al momento dell’emissione delle prescrizioni.16 Nel Regno Unito, le pratiche generali sono il principale punto di contatto per le cure mediche non urgenti, inclusa la gravidanza, e la RCPR è stata ampiamente utilizzata negli studi di farmacoepidemiologia in gravidanza.17181920Riportiamo i nostri risultati secondo la linea guida “REporting of studies Conducted using Observational Routinely collected Data (RECORD)” (tabella supplementare S1).21
Abbiamo usato il link madre-bambino sul CPRD per creare una coorte di tutti i bambini nati vivi nel Regno Unito dal gennaio 1990 al giugno 2016,22 e abbiamo stimato la data dell’ultimo periodo mestruale per tutte le madri (testo supplementare S1). Abbiamo incluso i bambini registrati presso la clinica generale entro 6 mesi dalla nascita le cui madri avevano un’età compresa tra i 14 e i 50 anni e registrati presso una clinica RCPD da almeno 50 settimane prima dell’ultimo periodo mestruale stimato. Abbiamo escluso i bambini con anomalie cromosomiche note e i bambini alle cui madri è stato prescritto un farmaco teratogeno noto durante la gravidanza (warfarin, inibitori dell’enzima di conversione dell’angiotensina, agenti antineoplastici, isotretinoina, misoprostolo o talidomide). I bambini sono stati seguiti dalla nascita a 14 anni, la morte, o la fine del follow-up (giugno 2016), a seconda di quale dei due casi è venuto prima.
Il Comitato Scientifico Consultivo Indipendente per i Medicinali e i prodotti sanitari Regulatory Agency Database Research ha approvato il protocollo di studio (19_038R2). Abbiamo registrato lo studio su ClinicalTrials.gov (NCT03948620).
Prescrizioni
Abbiamo incluso i bambini alle cui madri è stato prescritto un episodio di monoterapia macrolidea o un episodio di monoterapia con penicillina tra quattro settimane gestazionali e il parto (di seguito, ogni trimestre). Un episodio di monoterapia si riferisce a una o più prescrizioni consecutive per un singolo antibiotico separate da non più di 30 giorni e ininterrotte da prescrizioni di altri farmaci antibiotici. Abbiamo iniziato la finestra temporale a quattro settimane gestazionali per valutare tutte le prescrizioni a partire da cinque settimane gestazionali, l’inizio dell’organogenesi, e abbiamo permesso una tipica prescrizione di una settimana. Abbiamo ulteriormente diviso la finestra temporale in quattro settimane gestazionali a 13 settimane gestazionali (primo trimestre), il periodo critico per la maggior parte delle principali malformazioni, e 14 settimane gestazionali alla nascita (dal secondo al terzo trimestre).23 Abbiamo creato due coorti di controllo negativo: in primo luogo, i figli di madri hanno prescritto una monoterapia con macrolidi o penicillina 50-10 settimane prima dell’ultimo periodo mestruale e non sono stati inclusi nella coorte di studio; in secondo luogo, i fratelli dei bambini nella coorte di studio. Le prescrizioni di macrolidi e penicilline sono state identificate utilizzando un elenco di codici farmaceutici basato sul British National Formulary (capitoli 5.1.5 e 5.1.1). La data indice di esposizione è la data della prima prescrizione della monoterapia(fig. 1).
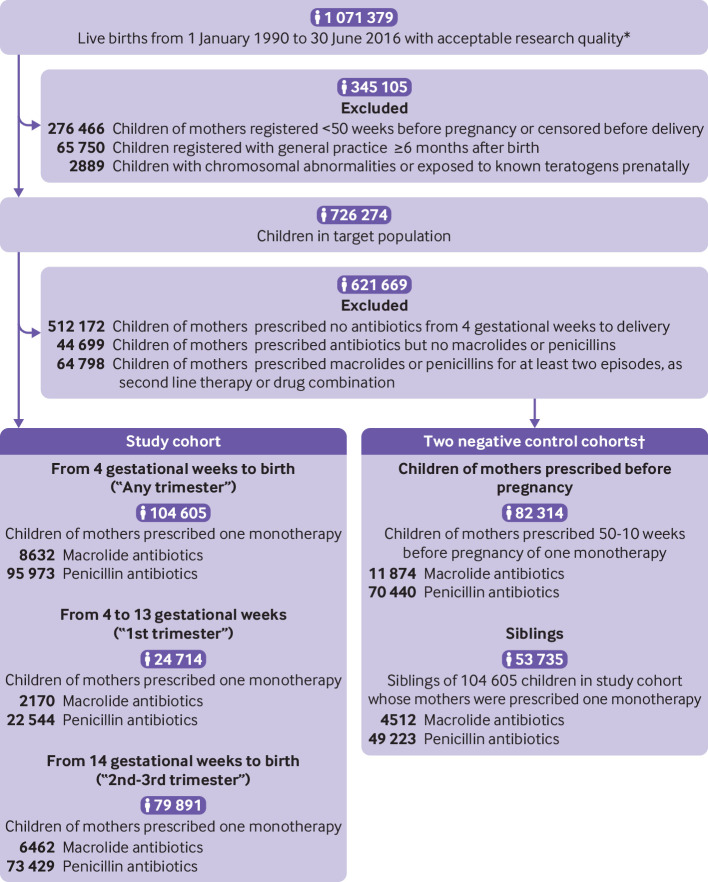
Fig 1.Diagramma di flusso della coorte di studio. Le madri potrebbero aver avuto più di una gravidanza. *Pazienti accettabili erano quelli che soddisfacevano la soglia di qualità dei dati del Clinical Practice Research Datalink (CPRD) nelle pratiche generali definite come contribuenti fino ai dati standard. †9484 bambini sono stati inclusi in entrambe le coorti di controllo negativo

Fig. 1.Diagramma di flusso della coorte di studio. Le madri avrebbero potuto avere più di una gravidanza. *Pazienti accettabili erano quelli che soddisfacevano la soglia di qualità dei dati del Clinical Practice Research Datalink (CPRD) nelle pratiche generali definite come contributo ai dati standard. †9484 bambini sono stati inclusi in entrambe le coorti di controllo negativo.
Risultati
I principali risultati sono stati le principali malformazioni (qualsiasi e specifiche del sistema) e quattro disturbi dello sviluppo neurologico. Le malformazioni maggiori sono state identificate da 11 malformazioni specifiche del sistema definite dalla Sorveglianza Europea delle Anomalie Congenite (EUROCAT).24 Abbiamo incluso cinque malformazioni specifiche del sistema (nervose, cardiovascolari, gastrointestinali, genitali e urinarie) che soddisfano i criteri di potenza predefiniti utilizzando la tabella di prevalenza EUROCAT.25 La tabella supplementare S2 e il testo S2 riportano ulteriori dettagli. Nella tabella supplementare S3 sono riportati i codici più frequenti registrati per ciascuna malformazione specifica del sistema.
I disturbi dello sviluppo neurologico (paralisi cerebrale, epilessia, disturbo da deficit di attenzione e iperattività e disturbo dello spettro autistico) sono stati definiti come il tempo del primo codice diagnostico o di trattamento che indicava il risultato a 14 anni. Abbiamo usato l’approccio della foresta casuale per identificare i bambini che potenzialmente avevano paralisi cerebrale sulla base di prescrizione informativa o codici di lettura, come descritto in precedenza.26 Un neurologo pediatrico (FOC) che era cieco all’esposizione prenatale agli antibiotici ha convalidato questi potenziali casi. Abbiamo identificato altri disturbi dello sviluppo neurologico (epilessia, disturbo da deficit di attenzione e iperattività e disturbo dello spettro autistico) utilizzando criteri precedentemente convalidati e codici diagnostici o prescrizioni (tabella supplementare S2).
Covariates
I macrolidi sono ampiamente utilizzati come alternative per le donne con sospetta allergia allepenicilline6 , pertanto il confronto con le penicilline potrebbe ridurre al minimo la confusione a causa dell’infezione. Tuttavia, la confusione residua potrebbe esistere se i macrolidi fossero prescritti per indicazioni specifiche (ad esempio, clamidia), o quando i potenziali fattori di rischio per malformazioni o esiti dello sviluppo neurologico differiscono tra i vari gruppi di trattamento.
Abbiamo incluso le seguenti covariate: caratteristiche materne al momento del concepimento e fattori di rischio cronici (età al parto, anno di calendario del parto, abuso di alcol, uso di droghe illecite, uso di tabacco, obesità, ipertensione, diabete, ansia, depressione ed epilessia); e variabili correlate alla gravidanza (parità, parto multiplo, trattamenti medici cronici, infezioni del tratto genitourinario e infezioni sessualmente trasmesse durante la gravidanza). Le infezioni del tratto genitourinario e le infezioni sessualmente trasmissibili sono potenzialmente associate al travaglio pretermine (o a malformazioni congenite) e ci siamo adattati a questi eventi come fattori di confusione (definiti nella tabella supplementare S4).27
Analisi statistica
Abbiamo derivato la differenza standardizzata (>0,1 come squilibri significativi) per valutare l’equilibrio covariato tra il gruppo dei macrolidi e quello delle penicilline.28 Per le malformazioni, abbiamo calcolato i rischi assoluti (per 1000 bambini) e i rapporti di rischio con intervalli di confidenza del 95% utilizzando modelli binomiali log. Per i disturbi dello sviluppo neurologico per i quali il tempo di follow-up potrebbe essere censurato, abbiamo stimato i tassi assoluti (per 1000 anni per persona) e i rapporti di rischio con intervalli di confidenza del 95% utilizzando modelli di rischio proporzionali di Cox. Abbiamo testato l’ipotesi di pericolo proporzionale utilizzando i residui di Schoenfeld dopo aver calcolato tutti i modelli di pericolo proporzionali di Cox. Sono stati stimati robusti errori standard che tengono conto del raggruppamento di fratelli e sorelle e delle nascite multiple nelle madri.
Abbiamo corretto i modelli per le covariate utilizzando il seguente metodo. Abbiamo ricavato il punteggio di propensione (probabilità prevista di macrolidi v penicilline) con regressione logistica, abbiamo diviso il punteggio di propensione del gruppo di macrolidi in 50 strati, e abbiamo pesato i bambini del gruppo di penicilline in ogni strato secondo la distribuzione del punteggio di propensione del gruppo di macrolidi.29
L’analisi primaria ha confrontato i figli di madri che hanno prescritto una monoterapia macrolide o una monoterapia con penicillina nel primo trimestre, nel secondo e nel terzo trimestre e in qualsiasi trimestre. Abbiamo eseguito analisi di sottogruppo per sottotipo di macrolidi perché studi in adulti non gravidi suggeriscono che la claritromicina e l’azitromicina potrebbero avere un effetto aritmico più forte dell’eritromicina,78 e l’azitromicina è più indicata per le infezioni sessualmente trasmissibili. Abbiamo anche analizzato la durata del trattamento (meno di sette giorni e sette giorni o più, macrolidi v penicilline) per valutare un effetto dose-dipendente dei macrolidi.
Analisi della sensibilità
Abbiamo valutato le potenziali confusioni dovute a caratteristiche familiari non misurate. In primo luogo, abbiamo condotto un’analisi di controllo negativo nelle madri che hanno prescritto macrolidi o penicilline 50-10 settimane prima dell’ultimo ciclo mestruale. In secondo luogo, abbiamo eseguito un’analisi di controllo negativo tra fratelli e sorelle. Abbiamo confrontato i rischi di esiti negativi tra fratelli e sorelle dei bambini della coorte di studio alle cui madri sono stati prescritti macrolidi e fratelli e sorelle dei bambini della coorte di studio alle cui madri sono state prescritte penicilline. Un risultato nullo in queste due analisi fornirebbe una prova indiretta dell’assenza di sostanziali confusioni residue dovute a differenze di fattori familiari tra le madri cui sono stati prescritti macrolidi e quelle cui sono state prescritte penicilline (ad esempio, lo stato socioeconomico materno e i fattori genetici).
In terzo luogo, per attenuare le confusioni dovute all’infezione, abbiamo limitato le analisi ai bambini alle cui madri sono stati prescritti antibiotici per le infezioni delle vie respiratorie (prescritti entro sei giorni dalla diagnosi); ci aspettavamo effetti comparabili o di dimensioni maggiori rispetto a quelli ottenuti nell’analisi primaria. Le infezioni delle vie respiratorie sono una delle indicazioni più comuni per le prescrizioni di antibiotici. Quando queste infezioni vengono diagnosticate nelle cure primarie, di solito si autolimitano con cause virali. Pertanto, qualsiasi beneficio (in termini di riduzione del rischio di esiti negativi nei bambini) derivante dal trattamento antibiotico delle infezioni batteriche delle vie respiratorie sarebbe piccolo o trascurabile e la possibilità di individuare potenziali effetti negativi del trattamento antibiotico aumenterebbe. In quarto luogo, abbiamo eseguito analisi probabilistiche di polarizzazione multipla per quantificare la potenziale polarizzazione causata da errori di classificazione degli esiti e polarizzazione dei nati vivi. Il bias del parto vivo potrebbe verificarsi perché non abbiamo incluso gravidanze nella coorte che hanno portato alla morte del feto, che potrebbe verificarsi in modo sproporzionato nelle donne cui sono stati prescritti macrolidi e nelle penicilline prescritte.
Come analisi post hoc, abbiamo valutato se le malformazioni specifiche comuni erano associate alla prescrizione materna di macrolidi contro le penicilline. Abbiamo analizzato i risultati solo quando almeno cinque bambini sono stati colpiti nel gruppo dei macrolidi. Tutte le analisi sono state condotte in RStudio versione 3.5.1.
3.5.1. Coinvolgimento del paziente e del pubblico
Questo studio si è basato su analisi secondarie di una banca dati amministrativa e non ha coinvolto direttamente i partecipanti dei pazienti. Non abbiamo coinvolto i pazienti nella progettazione della domanda di ricerca, delle misure di esito, né nell’interpretazione o nella stesura dei risultati di questo studio.
Risultati
Alle madri del 31% dei bambini della popolazione target è stato prescritto almeno un antibiotico durante la gravidanza. Le penicilline e i macrolidi hanno rappresentato rispettivamente circa il 69% e il 10% delle prescrizioni, con una media del 62% come monoterapia singola durante la gravidanza(fig 1 e fig 2).
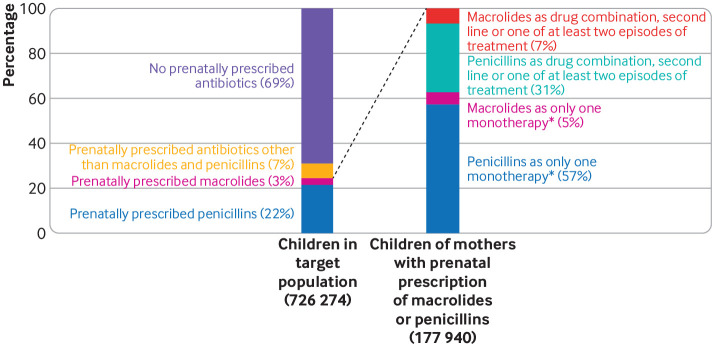
Fig 2.Prescrizioni di antibiotici durante la gravidanza in questo studio. *9698 e 101-969 bambini sono stati esposti prenatalmente ad una sola monoterapia di macrolidi e penicilline, rispettivamente. La coorte di studio comprendeva 8632 e 95/973 bambini esposti agli antibiotici tra le quattro settimane gestazionali e il parto (fig. 1).
La coorte di studio comprendeva 104 605 bambini, di cui 8632 (8,3%) nati da madri che hanno prescritto una monoterapia macrolide e 95973 (91,7%) nati da madri che hanno prescritto una monoterapia con penicillina durante la gravidanza. I bambini sono stati seguiti per una mediana di 5,8 anni (intervallo interquartile 2,4-12,1 anni) dopo la nascita. In una coorte di controllo negativo, 82-314 bambini sono nati da madri che hanno prescritto macrolidi (n=11-874) o penicilline (n=70-440) prima del concepimento. Nella seconda coorte di controllo negativo, 53-735 bambini sono stati identificati come fratelli di bambini della coorte di studio che sono stati esposti prenatalmente a macrolidi (n=4512) o penicilline (n=49-223; fig. 1).
Le caratteristiche materne erano simili nel gruppo degli antibiotici macrolidi e nel gruppo degli antibiotici penicillinici. Le caratteristiche erano simili anche secondo il tempo di prescrizione: durante il primo trimestre, dal secondo al terzo trimestre, o 50-10 settimane prima della gravidanza, con differenze bilanciate dopo l’aggiustamento del punteggio di propensione(tabella 1 e tabelle supplementari S5-S7).
| Caratteristiche | Non regolato | Punteggio di propensione corretto* | |||||
|---|---|---|---|---|---|---|---|
| Macrolidi | Penicilline | St.diff | Macrolidi | Penicilline | St.diff | ||
| Numero di bambini | 2170 | 22 544 | — | 2170 | 22 509.8 | — | |
| Caratteristiche materne di base | |||||||
| Età alla consegna: | — | — | 0.108 | — | — | 0.008 | |
| 13-19 | 130 (6.0) | 986 (4.4) | — | 130 (6.0) | 1372.2 (6.1) | — | |
| 20-24 | 377 (17.4) | 3510 (15.6) | — | 377 (17.4) | 3881.9 (17.2) | — | |
| 25-29 | 524 (24.1) | 6223 (27.6) | — | 524 (24.1) | 5437.1 (24.2) | — | |
| 30-34 | 664 (30.6) | 6892 (30.6) | — | 664 (30.6) | 6941.3 (30.8) | — | |
| 35-50 | 475 (21.9) | 4933 (21.9) | — | 475 (21.9) | 4877.3 (21.7) | — | |
| Anno civile di consegna: | — | — | 0.115 | — | — | 0.016 | |
| 1990-94 | 170 (7.8) | 2225 (9.9) | — | 170 (7.8) | 1843.0 (8.2) | — | |
| 1995-99 | 318 (14.7) | 3746 (16.6) | — | 318 (14.7) | 3323.8 (14.8) | — | |
| 2000-04 | 496 (22.9) | 4404 (19.5) | — | 496 (22.9) | 5175.9 (23.0) | — | |
| 2005-09 | 568 (26.2) | 5594 (24.8) | — | 568 (26.2) | 5781.4 (25.7) | — | |
| 2010-16 | 618 (28.5) | 6575 (29.2) | — | 618 (28.5) | 6385.8 (28.4) | — | |
| Abuso di alcolici | 129 (5.9) | 1047 (4.6) | 0.058 | 129 (5.9) | 1353.6 (6.0) | 0.003 | |
| Uso illecito di droghe | 31 (1.4) | 243 (1.1) | 0.032 | 31 (1.4) | 323.6 (1.4) | 0.001 | |
| Uso del tabacco | 790 (36.4) | 7412 (32.9) | 0.074 | 790 (36.4) | 8168.1 (36.3) | 0.002 | |
| Obesità | 262 (12.1) | 2578 (11.4) | 0.020 | 262 (12.1) | 2742.7 (12.2) | 0.003 | |
| Ipertensione | 161 (7.4) | 1623 (7.2) | 0.008 | 161 (7.4) | 1655.9 (7.4) | 0.002 | |
| Diabete | 68 (3.1) | 782 (3.5) | 0.019 | 68 (3.1) | 710.3 (3.2) | 0.001 | |
| Ansia | 74 (3.4) | 556 (2.5) | 0.056 | 74 (3.4) | 763.1 (3.4) | 0.001 | |
| Depressione | 227 (10.5) | 2288 (10.1) | 0.01 | 227 (10.5) | 2381.0 (10.6) | 0.004 | |
| Epilessia | 25 (1.2) | 155 (0.7) | 0.049 | 25 (1.2) | 238.4 (1.1) | 0.009 | |
| Caratteristiche relative alla gravidanza | |||||||
| Parità ≥1 | 782 (36.0) | 8080 (35.8) | 0.004 | 782 (36.0) | 8070.8 (35.9) | 0.004 | |
| Nascite multiple | 52 (2.4) | 535 (2.4) | 0.002 | 52 (2.4) | 564.5 (2.5) | 0.007 | |
| Infezione del tratto genitourinario | 90 (4.1) | 2796 (12.4) | 0.303 | 90 (4.1) | 889.2 (4.0) | 0.010 | |
| Infezione sessualmente trasmissibile | 102 (4.7) | 301 (1.3) | 0.198 | 102 (4.7) | 978.2 (4.3) | 0.017 | |
| Trattamento di malattie croniche | 422 (19.4) | 4066 (18.0) | 0.036 | 422 (19.4) | 4388.4 (19.5) | 0.001 | |

Fig. 2.Prescrizioni di antibiotici durante la gravidanza in questo studio. *9698 e 101-969 bambini sono stati esposti prenatalmente ad una sola monoterapia di macrolidi e penicilline, rispettivamente. La coorte di studio comprendeva 8632 e 95973 bambini esposti agli antibiotici tra le quattro settimane gestazionali e il parto (fig 1)
Analisi primaria
La prevalenza di malformazioni maggiori è stata del 27,7 per 1000 nati vivi nelle madri che hanno prescritto macrolidi nel primo trimestre, e del 19,5 per 1000 nati vivi nelle madri che hanno prescritto macrolidi nel secondo-terzo trimestre. I tassi equivalenti nel gruppo delle penicilline erano stabili (17,7 e 17,3 per 1000 nati vivi, rispettivamente). La prescrizione di macrolidi nel primo trimestre è stata associata ad un aumento del rischio di eventuali malformazioni (rapporto di rischio corretto 1,55, intervallo di confidenza del 95% da 1,19 a 2,03), e in particolare, malformazioni cardiovascolari (10,6 v 6,6 per 1000 nati vivi; rapporto di rischio corretto 1,62, intervallo di confidenza del 95% da 1,05 a 2,51; fig. 3).
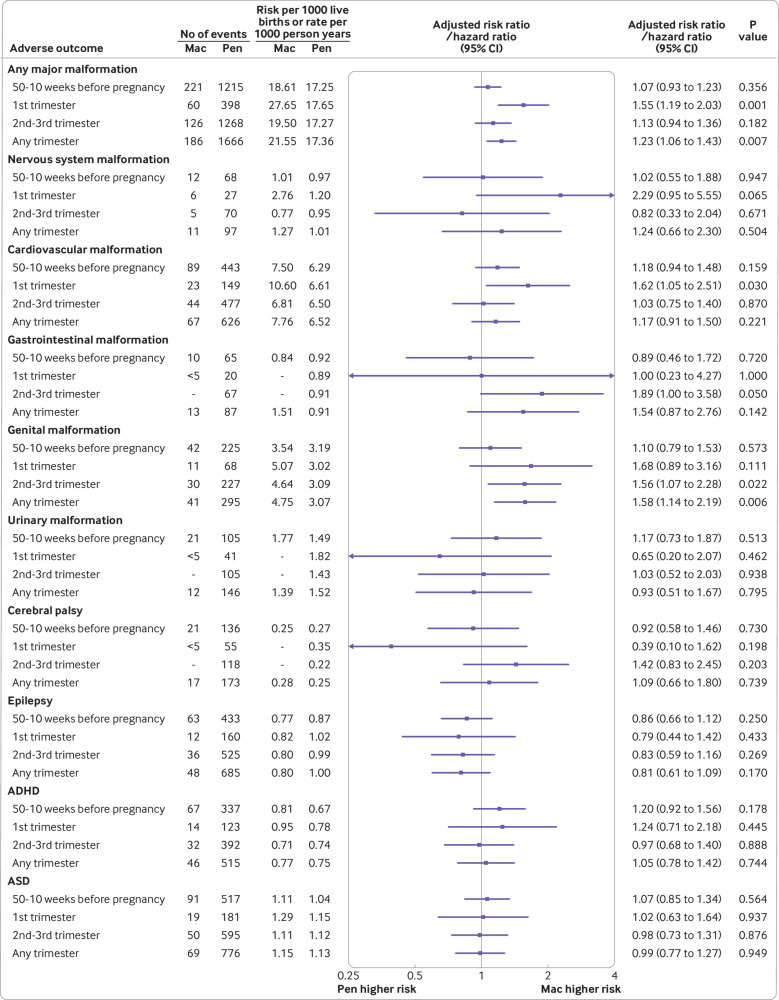
Fig 3.Fig. 3. Associazione tra esiti infantili avversi e antibiotici macrolidi(v penicillina) che si prescrivono prima o durante la gravidanza in base ai tempi di prescrizione: 50-10 settimane prima della gravidanza; durante il primo trimestre (da quattro a 13 settimane gestazionali); durante il secondo e il terzo trimestre (da 14 settimane gestazionali al parto); e durante qualsiasi trimestre (da quattro settimane gestazionali al parto). Per proteggere la riservatezza dei dati dei pazienti, per meno di cinque eventi viene dato un valore <5, e – è dato per evitare detrazioni. ADHD=disordine da deficit di attenzione e iperattività; ASD=disordine dello spettro autistico; Mac=macrolide; Pen=penicillina
La prescrizione di macrolidi durante il secondo e terzo trimestre non ha mostrato un aumento del rischio di malformazioni importanti (rapporto di rischio corretto 1,13, intervallo di confidenza del 95% da 0,94 a 1,36). Tuttavia, abbiamo osservato un’associazione borderline con le malformazioni gastrointestinali (1,89, da 1,00 a 3,58). La prescrizione di macrolidi in qualsiasi trimestre è stata associata ad un aumento del rischio di malformazioni genitali (1,58, da 1,14 a 2,19; principalmente ipospadia, come mostrato nelle analisi post hoc nella tabella supplementare S12). Non abbiamo trovato alcuna associazione tra i quattro disturbi dello sviluppo neurologico e la prescrizione di macrolidi durante la gravidanza(fig. 3).
Le analisi dei sottotipi di macrolidi sono state limitate a causa di pochi eventi. La prescrizione di eritromicina durante il primo trimestre è stata associata ad un aumento del rischio di qualsiasi malformazione importante(v penicilline; rapporto di rischio corretto 1,50, intervallo di confidenza del 95% da 1,13 a 1,99). I risultati per la claritromicina avevano ampi intervalli di confidenza e le analisi per l’azitromicina sono state precluse a causa di pochi eventi (tabella supplementare S8). Le analisi per sottogruppi di prescrizioni per meno di una settimana non sono state informative, perché il 94,7% delle prescrizioni di macrolidi erano per 5-7 giorni (tabella supplementare S9). Poiché non è stata applicata alcuna correzione per i test multipli, ci si aspetterebbe che tre dei 62 test di sottogruppo siano statisticamente significativi (a α=0,05) solo per caso.

Fig 3.Fig. 3. Associazione tra esiti infantili avversi e antibiotici macrolidi(v penicillina) che si prescrivono prima o durante la gravidanza in base ai tempi di prescrizione: 50-10 settimane prima della gravidanza; durante il primo trimestre (da quattro a 13 settimane gestazionali); durante il secondo e il terzo trimestre (da 14 settimane gestazionali al parto); e durante qualsiasi trimestre (da quattro settimane gestazionali al parto). Per proteggere la riservatezza dei dati dei pazienti, per meno di cinque eventi viene dato un valore <5, e – è dato per evitare detrazioni. ADHD=disordine da deficit di attenzione e iperattività; ASD=disordine dello spettro autistico; Mac=macrolide; Pen=penicillina
Analisi della sensibilità
Non abbiamo trovato alcuna associazione tra esiti infantili avversi e macrolidi(v penicilline) prescritti prima del concepimento(fig. 3). Non abbiamo trovato alcuna associazione tra le principali malformazioni, malformazioni cardiovascolari, o malformazioni genitali e avere fratelli che erano prenatalmente esposti a macrolidi contro le penicilline; tuttavia, i numeri sono stati limitati per molti esiti per trimestre (tabella supplementare S10). Le analisi di sensibilità limitate alle madri a cui sono stati prescritti macrolidi o penicilline per le infezioni delle vie respiratorie durante la gravidanza non hanno modificato i risultati delle analisi primarie, anche se le analisi sono state insufficienti per molti esiti(fig. 4 e tabella supplementare S11). Dopo aver corretto per potenziali distorsioni dovute a errori di classificazione degli esiti e distorsioni del parto dal vivo, il rapporto di rischio stimato per qualsiasi malformazione importante di macrolidi(v penicillina) prescritti durante il primo trimestre è aumentato a 1,58 (intervallo di confidenza del 95% da 1,22 a 2,08); il rapporto di rischio stimato per le malformazioni cardiovascolari è aumentato a 1,78 (da 1,12 a 2,80; testo supplementare S3).
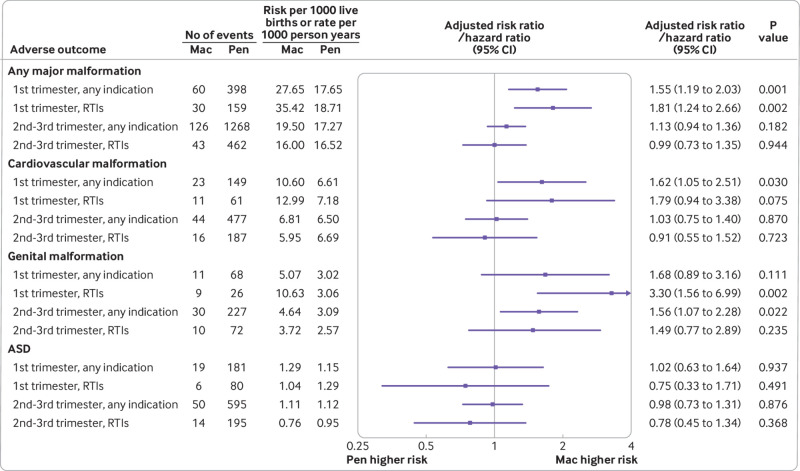
Fig. 4.Associazione tra esiti infantili avversi e macrolidi(v penicillina) che si prescrivono durante la gravidanza per qualsiasi indicazione (analisi principali) e limitata alle madri a cui sono stati prescritti antibiotici per le infezioni delle vie respiratorie in base ai tempi di prescrizione: durante il primo trimestre (da quattro a 13 settimane gestazionali); e durante il secondo e il terzo trimestre (da 14 settimane gestazionali al parto). Per tutelare la riservatezza dei dati dei pazienti e per essere concisi, i risultati vengono forniti solo quando tutte e quattro le analisi hanno avuto almeno cinque eventi nel gruppo dei macrolidi. ASD=disordine dello spettro autistico; Mac=macrolide; Pen=penicillina; RTI=infezione del tratto respiratorio
Le analisi esplorative post hoc delle associazioni tra la prescrizione di macrolidi durante il primo trimestre e sei malformazioni specifiche comuni erano di potenza limitata e non hanno rivelato risultati statisticamente significativi. Tuttavia, abbiamo trovato un aumento del rischio di ipospadia e craniosinostosi nei bambini di madri che hanno prescritto macrolidi durante il secondo o terzo trimestre (tabella supplementare S12).

Fig. 4.Associazione tra esiti infantili avversi e macrolidi(v penicillina) che si prescrivono durante la gravidanza per qualsiasi indicazione (analisi principali) e limitata alle madri a cui sono stati prescritti antibiotici per le infezioni delle vie respiratorie in base alla tempistica della prescrizione: durante il primo trimestre (da quattro a 13 settimane gestazionali); e durante il secondo e il terzo trimestre (da 14 settimane gestazionali al parto). Per tutelare la riservatezza dei dati dei pazienti e per essere concisi, i risultati vengono forniti solo quando tutte e quattro le analisi hanno avuto almeno cinque eventi nel gruppo dei macrolidi. ASD=disordine dello spettro autistico; Mac=macrolide; Pen=penicillina; RTI=infezione del tratto respiratorio
Discussione
I figli di madri che hanno prescritto antibiotici macrolidi durante il primo trimestre di gravidanza hanno avuto un aumento del rischio di qualsiasi malformazione importante e in particolare malformazioni cardiovascolari rispetto ai figli di madri che hanno prescritto antibiotici penicillina. Queste associazioni non erano significative per le prescrizioni durante il secondo o terzo trimestre. Il rischio di malformazioni genitali è stato aumentato nei bambini di madri che hanno prescritto macrolidi rispetto alle penicilline in qualsiasi trimestre, anche se le associazioni non erano statisticamente significative quando la prescrizione era limitata al primo trimestre. Non abbiamo trovato associazioni statisticamente significative tra la prescrizione di macrolidi e i disturbi dello sviluppo neurologico. Supponendo che le associazioni siano causali, stimiamo che per ogni 1000 madri che hanno prescritto macrolidi al posto delle penicilline durante il primo trimestre, un ulteriore 4,1 (95% di intervallo di confidenza da 0,4 a 9,4) bambini avrebbero malformazioni cardiovascolari; le cifre corrispondenti per le prescrizioni durante qualsiasi trimestre e le malformazioni genitali sarebbero 1,7 (da 0,4 a 3,5). Le analisi di sottogruppo e di sensibilità non hanno modificato questi risultati.
Punti di forza e di debolezza dello studio
I punti di forza del nostro studio includono l’ampio campione, basato sulla popolazione, di madri e bambini registrati con l’assistenza primaria nel Regno Unito. La sfida principale dell’utilizzo di studi osservazionali è quella di separare i potenziali effetti avversi della prescrizione di antibiotici dagli effetti dell’infezione sul feto. Abbiamo affrontato questa sfida confrontando i figli di madri a cui sono stati prescritti macrolidi con quelli a cui sono state prescritte penicilline perché le indicazioni per questi trattamenti si sovrappongono ampiamente (tabella supplementare S13). Abbiamo anche limitato le analisi alle madri che hanno prescritto una monoterapia di macrolidi o penicilline per ridurre il rischio di confusione a causa di infezioni gravi o ricorrenti. Abbiamo anche eseguito analisi di sensibilità che sono state limitate alle madri con infezioni delle vie respiratorie, che sono in gran parte causate da infezioni virali, per ridurre al minimo i benefici terapeutici degli antibiotici. Abbiamo corretto i fattori di confusione misurati utilizzando la corrispondenza del punteggio di propensione e abbiamo valutato gli effetti delle caratteristiche materne non misurate utilizzando due coorti di controllo negative: i figli di madri che hanno prescritto macrolidi o penicilline prima della gravidanza e i fratelli di bambini esposti prenatalmente a macrolidi o penicilline nella coorte di studio.
L’aumento del rischio di qualsiasi malformazione maggiore associata alla prescrizione di macrolidi nel primo trimestre, ma non più tardi in gravidanza, è coerente con il periodo critico di organogenesi fetale, cioè da cinque a 13 settimane gestazionali per la maggior parte delle malformazioni maggiori, comprese le malformazioni cardiovascolari. L’aumento del rischio di malformazioni genitali (principalmente ipospadia) persiste dopo il primo trimestre, il che corrisponde all’evidenza di studi su animali che lo sviluppo degli organi genitali potrebbe essere suscettibile di insulti dopo una gravidanza precoce.303132Questa specificità dei tempi di esposizione indica anche gli effetti negativi dei macrolidi piuttosto che gli effetti causati da differenze sistematiche non misurate tra i gruppi (ad esempio, stato socioeconomico o fattori genetici).
Un punto debole chiave dello studio è il limitato potere di esaminare l’esposizione al trattamento durante i periodi critici noti per specifiche malformazioni e disturbi dello sviluppo neurologico, inducendo così una potenziale distorsione della diluizione verso il nulla. Per evitare numerosi confronti, poco potenti, abbiamo raggruppato la prescrizione secondo trimestri, periodi critici non noti (ad esempio, 5-10 settimane gestazionali per malformazioni cardiovascolari),33 e abbiamo categorizzato le malformazioni in base al sistema degli organi. Jenkins e colleghi hanno evidenziato la possibile diluizione dell’effetto negli studi epidemiologici quando fenotipi con diverse suscettibilità intrinseche sono raggruppati insieme.34
Un’ulteriore limitazione è che abbiamo analizzato la prescrizione di antibiotici come nostra esposizione principale, non la somministrazione o l’uso, che non sono stati registrati nel database. Inoltre, i tassi di conformità con il trattamento con l’eritromicina potrebbero essere inferiori a quelli della penicillina a causa dei suoi effetti collaterali gastrointestinali. Tuttavia, è improbabile che le infezioni materne non trattate nel gruppo dei macrolidi spieghino i nostri risultati, poiché un’analisi di sensibilità limitata alle infezioni delle vie respiratorie ha mostrato risultati simili.35 Abbiamo anche quantificato la potenziale sottovalutazione dei nostri risultati a causa di un’errata classificazione dei risultati e di un’errata polarizzazione dei nati vivi. Sebbene esistano confonditori non misurati, le analisi di controllo negativo basate sulla prescrizione prima del concepimento e sugli esiti nei fratelli non hanno cambiato i nostri risultati. Il nostro algoritmo per stimare la data di inizio della gravidanza probabilmente ha sovrastimato la durata della gravidanza in una piccola percentuale di gravidanze (testo supplementare S1).
Confronto con altri studi
Uno studio che ha utilizzato il registro svedese delle nascite ha trovato una simile entità di effetto tra la prescrizione di eritromicina del primo trimestre (rispetto a tutti i nati vivi) e le principali malformazioni cardiovascolari.36 Tuttavia, la maggior parte degli altri studi non ha riportato alcuna associazione tra l’uso di macrolidi durante il primo trimestre o durante l’intera gravidanza e le malformazioni maggiori (tabella supplementare S14). Uno dei motivi potrebbe essere un effetto di diluizione dovuto alla prescrizione di macrolidi al di fuori del periodo di organogenesi.23 Questo risultato è particolarmente preoccupante quando una parte considerevole (più di un terzo nel nostro studio, il 36%) dei macrolidi del primo trimestre è stata prescritta molto presto in gravidanza (prima di quattro settimane gestazionali), probabilmente prima che la gravidanza fosse stata individuata nella maggior parte dei casi.36 Un’altra spiegazione è la mancanza di potenza; cinque dei nove studi precedenti hanno riportato fino a 15 malformazioni in gruppi di macrolidi.
Implicazioni
Dopo la pubblicazione dei risultati dello studio ORACLE II sono stati discussi i potenziali meccanismi per l’associazione tra esiti infantili avversi e trattamento prenatale dei macrolidi.37 Uno dei percorsi ipotizzati era l’effetto aritmico dei macrolidi, che si pensa induca un aumento del rischio di eventi cardiovascolari e di mortalità negli adulti ad alto rischio.78 Sperimentalmente, l’effetto aritmico di alcuni farmaci può portare all’ipossia fetale e potrebbe essere alla base dell’associazione tra la prescrizione di macrolidi durante la gravidanza e l’aumento del rischio di malformazioni.1338Studi su animali con claritromicina e azitromicina hanno riportato un elevato rischio di embriotossicità (compresa la restrizione della crescita fetale e la morte) e teratogenicità che erano dose dipendente.2
14
39
Non abbiamo trovato alcuna prova di un’associazione tra i disturbi dello sviluppo neurologico e la prescrizione di macrolidi durante la gravidanza, a differenza degli studi precedenti.3740La nostra scoperta di nessuna associazione potrebbe essere dovuta alle cause multifattoriali dei disturbi dello sviluppo neurologico. Per esempio, il 70% dei casi di paralisi cerebrale sono considerati cause non genetiche, mentre il 60-70% dei casi di epilessia, disturbo da deficit di attenzione e iperattività e disturbi dello spettro autistico sono attribuibili a fattori genetici.41424344Anche il periodo critico per la paralisi cerebrale potrebbe essere limitato (ad esempio, terzo trimestre per la paralisi cerebrale spastica).45 Nello studio ORACLE II è stato riscontrato un aumento del rischio di paralisi cerebrale nei figli di madri con parto pretermine spontaneo, in cui è stata prescritta l’eritromicina a una mediana di 31 settimane gestazionali.37
I maggiori rischi di gravi malformazioni riscontrati in questo studio e nello studio di Källén e colleghi36 forniscono la prova che la prescrizione di macrolidi durante la gravidanza giustifica la cautela. Se le associazioni sono causali, si stima che un ulteriore 4,1 (95% intervallo di confidenza da 0,4 a 9,4) bambini con malformazioni cardiovascolari e 1,7 (95% CI: da 0,4 a 3,5) bambini con malformazioni genitali si verificherebbero per ogni 1000 bambini esposti a macrolidi invece che a penicilline nel primo trimestre o in qualsiasi trimestre, rispettivamente. I foglietti illustrativi sulla sicurezza dei farmaci dovrebbero riportare l’incertezza sulla sicurezza dei macrolidi, inclusa l’eritromicina, e raccomandare l’uso di antibiotici alternativi quando possibile fino a quando non saranno disponibili ulteriori ricerche. Dato l’uso diffuso di macrolidi durante la gravidanza, esiste un’urgente necessità di collaborazione internazionale. Dobbiamo riunire i set di dati esistenti per analisi su larga scala di studi di alta qualità e coorti osservazionali che abbiano misurazioni accurate dei trattamenti e dei risultati del bambino. Le analisi dovrebbero prespecificare i periodi di esposizione al trattamento in base ai giorni gestazionali, quando è probabile che i rischi abbiano un impatto sull’organogenesi per malformazioni specifiche o sugli esiti dello sviluppo neurologico.
Conclusioni
Questa analisi basata sulla popolazione ha mostrato che la prescrizione di antibiotici macrolidi piuttosto che di penicillina durante il primo trimestre di gravidanza era associata ad un aumento del rischio di qualsiasi malformazione importante e in particolare di malformazioni cardiovascolari. Abbiamo anche trovato un aumento del rischio di malformazioni genitali associate alla prescrizione di macrolidi in qualsiasi trimestre. Questi risultati richiedono un uso prudente dei macrolidi durante la gravidanza. I foglietti illustrativi sulla sicurezza dei farmaci dovrebbero segnalare che ci sono preoccupazioni circa la sicurezza dei macrolidi, inclusa l’eritromicina, e raccomandare l’uso di antibiotici alternativi quando possibile fino a quando non saranno disponibili ulteriori ricerche.
Ciò che è già noto su questo argomento
- Una recente revisione sistematica sulla prescrizione di macrolidi durante la gravidanza ha mostrato prove coerenti per un aumento del rischio di aborto spontaneo, ma prove meno coerenti per un aumento del rischio di malformazioni congenite, paralisi cerebrale, e l’epilessia
- I consigli politici sull’uso dei macrolidi durante la gravidanza variano da un paese all’altro
Cosa aggiunge questo studio
- La prescrizione di antibiotici macrolidi durante il primo trimestre di gravidanza è stata associata ad un aumento del rischio di qualsiasi malformazione importante e in particolare di malformazioni cardiovascolari rispetto agli antibiotici penicillinici
- La prescrizione di antibiotici macrolidi in qualsiasi trimestre è stata associata ad un aumento del rischio di malformazioni genitali
- Gli antibiotici macrolidi devono essere usati con cautela durante la gravidanza e, se possibile, devono essere prescritti antibiotici alternativi fino a quando non saranno disponibili ulteriori ricerche.
References
- Petersen I, Gilbert R, Evans S, Ridolfi A, Nazareth I. Oral antibiotic prescribing during pregnancy in primary care: UK population-based study. J Antimicrob Chemother. 2010; 65:2238-46. DOI | PubMed
- Briggs GG, Freeman RK. Drugs in Pregnancy and Lactation.. Wolters Kluwer; 2017.
- Crider KS, Cleves MA, Reefhuis J, Berry RJ, Hobbs CA, Hu DJ. Antibacterial medication use during pregnancy and risk of birth defects: National Birth Defects Prevention Study. Arch Pediatr Adolesc Med. 2009; 163:978-85. DOI | PubMed
- Publisher Full Text
- The Swedish Medical Products Agency. Public Assessment Report Scientific discussion: Erythromycin ELC (SE/H/1486/01/DC).. The Swedish Medical Products Agency; 2015.
- Joint Formulary Committee Great Britain. British National Formulary.. Pharmaceutical Press; 2019.
- Publisher Full Text
- Publisher Full Text
- Wong AYS, Chan EW, Anand S, Worsley AJ, Wong ICK. Managing cardiovascular risk of macrolides: systematic review and meta-analysis. Drug Saf. 2017; 40:663-77. DOI | PubMed
- Cheng YJ, Nie XY, Chen XM. The role of macrolide antibiotics in increasing cardiovascular risk. J Am Coll Cardiol. 2015; 66:2173-84. DOI | PubMed
- Fan H, Li L, Wijlaars L, Gilbert RE. Associations between use of macrolide antibiotics during pregnancy and adverse child outcomes: a systematic review and meta-analysis. PLoS One. 2019; 14DOI | PubMed
- Källén BA, Otterblad Olausson P, Danielsson BR. Is erythromycin therapy teratogenic in humans?. Reprod Toxicol. 2005; 20:209-14. DOI | PubMed
- Danielsson BR, Danielsson C, Nilsson MF. Embryonic cardiac arrhythmia and generation of reactive oxygen species: common teratogenic mechanism for IKr blocking drugs. Reprod Toxicol. 2007; 24:42-56. DOI | PubMed
- Karabulut AK, Uysal II, Acar H, Fazliogullari Z. Investigation of developmental toxicity and teratogenicity of macrolide antibiotics in cultured rat embryos. Anat Histol Embryol. 2008; 37:369-75. DOI | PubMed
- Rumajogee P, Bregman T, Miller SP, Yager JY, Fehlings MG. Rodent hypoxia-ischemia models for cerebral palsy research: a systematic review. Front Neurol. 2016; 7:57. DOI | PubMed
- Herrett E, Gallagher AM, Bhaskaran K. Data Resource Profile: Clinical Practice Research Datalink (CPRD). Int J Epidemiol. 2015; 44:827-36. DOI | PubMed
- Minassian C, Williams R, Meeraus WH, Smeeth L, Campbell OMR, Thomas SL. Methods to generate and validate a Pregnancy Register in the UK Clinical Practice Research Datalink primary care database. Pharmacoepidemiol Drug Saf. 2019; 28:923-33. DOI | PubMed
- Donegan K, King B, Bryan P. Safety of pertussis vaccination in pregnant women in UK: observational study. BMJ. 2014; 349:g4219. DOI | PubMed
- Margulis AV, Abou-Ali A, Strazzeri MM. Use of selective serotonin reuptake inhibitors in pregnancy and cardiac malformations: a propensity-score matched cohort in CPRD. Pharmacoepidemiol Drug Saf. 2013; 22:942-51. DOI | PubMed
- Hagberg KW, Robijn AL, Jick S. Maternal depression and antidepressant use during pregnancy and the risk of autism spectrum disorder in offspring. Clin Epidemiol. 2018; 10:1599-612. DOI | PubMed
- Benchimol EI, Smeeth L, Guttmann A, RECORD Working Committee. The REporting of studies Conducted using Observational Routinely-collected health Data (RECORD) statement. PLoS Med. 2015; 12DOI | PubMed
- Medicines and Healthcare Products Regulatory Agency. CPRD Mother Baby Link Documentation.. CPRD; 2017.
- Czeizel AE. Specified critical period of different congenital abnormalities: a new approach for human teratological studies. Congenit Anom (Kyoto). 2008; 48:103-9. DOI | PubMed
- Publisher Full Text
- Publisher Full Text
- Fan H, Li L, Gilbert R, O’Callaghan F, Wijlaars L. A machine learning approach to identify cases of cerebral palsy using the UK primary care database. Lancet. 2018; 392:S33. DOI
- Goldenberg RL, Culhane JF, Iams JD, Romero R. Epidemiology and causes of preterm birth. Lancet. 2008; 371:75-84. DOI | PubMed
- Austin PC. Balance diagnostics for comparing the distribution of baseline covariates between treatment groups in propensity-score matched samples. Stat Med. 2009; 28:3083-107. DOI | PubMed
- Desai RJ, Rothman KJ, Bateman BT, Hernandez-Diaz S, Huybrechts KF. A propensity-score-based fine stratification approach for confounding adjustment when exposure is infrequent. Epidemiology. 2017; 28:249-57. DOI | PubMed
- Cunha GR, Sinclair A, Risbridger G, Hutson J, Baskin LS. Current understanding of hypospadias: relevance of animal models. Nat Rev Urol. 2015; 12:271-80. DOI | PubMed
- Mahawong P, Sinclair A, Li Y. Comparative effects of neonatal diethylstilbestrol on external genitalia development in adult males of two mouse strains with differential estrogen sensitivity. Differentiation. 2014; 88:70-83. DOI | PubMed
- Govers LC, Phillips TR, Mattiske DM. A critical role for estrogen signaling in penis development. FASEB J. 2019; 33:10383-92. DOI | PubMed
- Sadler TW. Langman’s Medical Embryology.. Lippincott Williams and Wilkins; 2014.
- Jenkins KJ, Correa A, Feinstein JA, American Heart Association Council on Cardiovascular Disease in the Young. Noninherited risk factors and congenital cardiovascular defects: current knowledge: a scientific statement from the American Heart Association Council on Cardiovascular Disease in the Young: endorsed by the American Academy of Pediatrics. Circulation. 2007; 115:2995-3014. DOI | PubMed
- Del Mar C. Antibiotics for acute respiratory tract infections in primary care. BMJ. 2016; 354:i3482. DOI | PubMed
- Källén B, Danielsson BR. Fetal safety of erythromycin. An update of Swedish data. Eur J Clin Pharmacol. 2014; 70:355-60. DOI | PubMed
- Kenyon S, Pike K, Jones DR. Childhood outcomes after prescription of antibiotics to pregnant women with spontaneous preterm labour: 7-year follow-up of the ORACLE II trial. Lancet. 2008; 372:1319-27. DOI | PubMed
- Nilsson MF, Danielsson C, Sköld AC. Improved methodology for identifying the teratogenic potential in early drug development of hERG channel blocking drugs. Reprod Toxicol. 2010; 29:156-63. DOI | PubMed
- Meeraus WH, Petersen I, Gilbert R. Association between antibiotic prescribing in pregnancy and cerebral palsy or epilepsy in children born at term: a cohort study using the health improvement network. PLoS One. 2015; 10DOI | PubMed
- Lim WH. Cerebral palsy: causes, pathways, and the role of genetic variants. Am J Obstet Gynecol. 2016; 214:670-1. DOI | PubMed
- Faraone SV, Asherson P, Banaschewski T. Attention-deficit/hyperactivity disorder. Nat Rev Dis Primers. 2015; 1:15020. DOI | PubMed
- Muhle R, Trentacoste SV, Rapin I. The genetics of autism. Pediatrics. 2004; 113:e472-86. DOI | PubMed
- Hildebrand MS, Dahl H-HM, Damiano JA, Smith RJH, Scheffer IE, Berkovic SF. Recent advances in the molecular genetics of epilepsy. J Med Genet. 2013; 50:271-9. DOI | PubMed
- Rumajogee P, Bregman T, Miller SP, Yager JY, Fehlings MG. Rodent hypoxia-ischemia models for cerebral palsy research: a systematic review. Front Neurol. 2016; 7:57. DOI | PubMed
Fonte
Fan H, Gilbert R, O’Callaghan F, Li L (2020) Associations between macrolide antibiotics prescribing during pregnancy and adverse child outcomes in the UK: population based cohort study. The BMJ 368m331. https://doi.org/10.1136/bmj.m331





