Introduzione
L’emorragia intracerebrale (ICH) rappresenta circa il 10-20% di tutti gli ictus ed è associata a una maggiore morbilità e mortalità rispetto agli ictus ischemici.1. Molti fattori di rischio modificabili, tra cui i farmaci su prescrizione, sono stati identificati per l’ICH. La tomografia computerizzata cranica (TAC) è la modalità di imaging di scelta per la diagnosi di ICH acuta. Diversi parametri della TAC possono prevedere l’espansione dell’ematoma e il peggioramento neurologico. Questi parametri della TAC, insieme ai criteri clinici, sono stati utilizzati per creare uno schema di punteggio pratico per prevedere l’espansione dell’ematoma. Nonostante l’elevata morbilità e mortalità, non ci sono interventi specifici che abbiano dimostrato di migliorare il risultato clinico dopo l’ICH. Negli ultimi tre anni, sono state condotte importanti ricerche sull’inversione dell’ICH associata all’antiaggregante piastrinico e all’anticoagulante orale (OAC), sull’abbassamento acuto della pressione sanguigna, sulla clearance dell’emorragia intraventricolare (IVH) con somministrazione intraventricolare di alteplasi e sulla craniectomia decompressiva.
Fattori di rischio per l’emorragia intracerebrale
Fattori di rischio modificabili per ICH includono l’ipertensione arteriosa (Figura 1), il consumo eccessivo di alcol, la diminuzione del colesterolo lipoproteico a bassa densità, i bassi livelli sierici di trigliceridi, i farmaci su prescrizione, il fumo di sigaretta corrente, e le droghe di abuso (per esempio, cocaina, eroina, anfetamine ed efedrina)1. L’ipertensione arteriosa è uno dei più importanti fattori di rischio modificabili in quanto la prevalenza grezza tra gli adulti negli Stati Uniti è stata stimata al 45,6%; si tratta di un aumento dal 31,9% in base alle precedenti definizioni di ipertensione arteriosa2. Alcuni farmaci su prescrizione, come gli inibitori della cicloossigenasi (COX), gli inibitori della P2Y12, gli OAC, gli inibitori selettivi della ricaptazione della serotonina (SSRI) e le statine, sono stati associati ad un aumento del rischio di ICH.
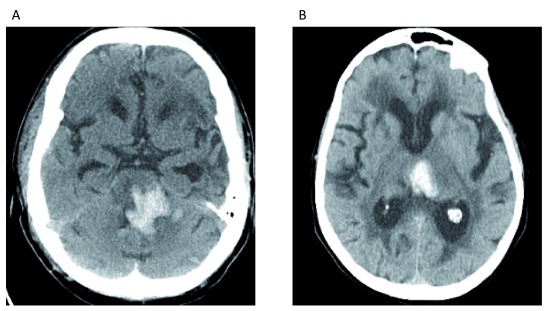
Figura 1.Figura 1. Emorragia intracerebrale dovuta a ipertensione arteriosa.(A) Emorragia iperattenuante visualizzato nel pons. (B) Emorragia iperattenuante iperattenuante centrata nel talamo mediale sinistro. Entrambe le posizioni sono tipiche per l’emorragia legata a lungo termine arteriopatia ipertensiva. Queste immagini costituiscono dati originali e inediti ottenuti dagli autori.
L’inibizione piastrinica correlata agli inibitori dell’enzima COX-1 (per esempio, l’aspirina) e agli antagonisti del purinorecettore P2Y12 (per esempio, clopidogrel, ticagrelor, prasugrel e cangrelor) è associata ad un aumento della crescita del volume della ICH e ad un peggioramento dell’esito clinico.3. In uno studio retrospettivo su 82.576 pazienti, la mortalità in ospedale è risultata più elevata tra i pazienti con ICH in terapia con doppia antiaggregante piastrinica rispetto all’assenza di terapia antiaggregante.3.
È stata fatta una debole associazione tra SSRI/statins e ICH. Gli SSRI causano effetti antipiastrine inibendo la ricaptazione della serotonina nelle piastrine4. In un ampio studio di coorte retrospettivo, l’uso dell’SSRI è stato associato a un aumento del rischio di ICH. Questo effetto è stato più evidente nei primi 30 giorni di utilizzo e quando è stato utilizzato in concomitanza con l’OAC4.
Lo studio “Stroke Prevention by Aggressive Reduction in Cholesterol Levels” (SPARCL) ha suggerito che le statine potenzialmente aumentano il rischio di ICH in futuro tra i pazienti con precedente ictus ischemico o ICH5. Dalla pubblicazione dello studio SPARCL, i dati derivati principalmente da studi retrospettivi non hanno confermato che l’uso di statina sia un fattore di rischio per l’ICH, e alcuni hanno suggerito che l’uso di statina sia associato ad un miglioramento della mortalità.5. In una meta-analisi di pazienti con precedente ictus ischemico o ICH, c’è stata una riduzione statisticamente significativa del rischio di scarsi risultati funzionali e di mortalità totale in entrambi i gruppi.6. La localizzazione lobare della ICI, le emorragie multiple o le microemorragie multiple possono comportare un rischio elevato per l’uso di statina nei pazienti affetti da ICI. Tuttavia, l’associazione posposta tra statina/SSRI e ICH richiede una valutazione prospettica più solida.
L’ICH è la complicazione più temuta dell’uso dell’OAC. Lo studio CROMIS-2 (“Cerebral microbleeds and intracranial hemorrhage risk in patients anticoagulated for atrial fibrillation after acute ischemic stroke or transient ischemic attack”) è stato un recente studio prospettico osservazionale multicentrico su 1409 pazienti che hanno iniziato l’OAC dopo un attacco ischemico transitorio o un ictus ischemico e hanno identificato i fattori di rischio per l’OAC-ICH7. La presenza di microcarenze cerebrali e quella del diabete mellito sono state le uniche due variabili associate all’ICH durante il periodo di follow-up. Gli autori hanno notato che i microbleed cerebrali possono essere un biomarcatore di neuroimmagini di un’arteriopatia emorragica. È interessante notare che il punteggio comunemente usato “HAS-BLED” (ipertensione, funzione renale/livello anormale, ictus, storia o predisposizione al sanguinamento, labile rapporto internazionale normalizzato [INR], anziani [età di almeno 65 anni] e farmaci/alcool in concomitanza) non distingueva in modo indipendente i pazienti con ICH da quelli senza ICH. L’identificazione precisa di questi fattori di rischio e la loro entità favorirà una gestione su misura del paziente per la prevenzione dell’ictus ischemico secondario nell’ambito della fibrillazione atriale. Per esempio, l’isolamento dell’appendice atriale sinistra può essere un’opzione per i pazienti per i quali il rischio di ICH supera il rischio di ictus ischemico8. L’angiopatia amiloide cerebrale (CAA) è un fattore di rischio non modificabile per l’ICH ed è associata ad un rischio più elevato di ICH ricorrente rispetto all’ICH associata all’ipertensione arteriosa. Gli alleli dell’apolipoproteina E (ApoE) sono importanti fattori di rischio genetico per lo sviluppo di CAA sporadiche9. Ad esempio, il numero di alleli ε4 si riferisce alla gravità clinica della lobare lobare ICH correlata alla CAA9. L’ε2 è anche associato ad un aumento del rischio di lobar ICH legato al CAA9.
Nei pazienti con ICH lobare, la CAA di grado patologico moderato o grave è stata associata in modo indipendente ai risultati della TAC di emorragia subaracnoidea e di proiezioni “a forma di dito” e di un genotipo ApoE. Questi criteri diagnostici possono essere utili per determinare l’ICH associata alla CAA10.

Figura 1.Figura 1. Emorragia intracerebrale dovuta a ipertensione arteriosa.(A) Emorragia iperattenuante visualizzato nel pons. (B) Emorragia iperattenuante iperattenuante centrata nel talamo mediale sinistro. Entrambe le posizioni sono tipiche per l’emorragia legata a lungo termine arteriopatia ipertensiva. Queste immagini costituiscono dati originali e inediti ottenuti dagli autori.
I predittori di immagini dell’ingrandimento dell’ematoma
L’allargamento dell’ematoma è un noto fattore di rischio per gli scarsi risultati nei pazienti con ICH11,12. Pertanto, i predittori di immagini dell’espansione dell’ematoma continuano ad essere un’importante area di ricerca. L’angiografia tomografica computerizzata (CTA) “spot sign” è stata descritta come un predittore di espansione dell’ematoma e di scarso risultato funzionale.13. Un limite dell’affidarsi al CTA per prevedere l’espansione dell’ematoma è la generalizzabilità ai centri medici dove il CTA precoce non è facilmente disponibile. È importante notare che il “segno di spot” del CTA è inversamente correlato al tempo di insorgenza dell’ICH.14. Inoltre, in una grande meta-analisi a livello di paziente, la presenza di un segno di spot CTA non ha aggiunto in modo significativo ad un modello di previsione dell’espansione dell’ematoma basato su predittori stabiliti.15.
Diversi studi recenti hanno esaminato parametri specifici di TC per prevedere l’espansione dell’ematoma. Lietal. ha descritto un risultato di TC chiamato “blend sign” per prevedere l’espansione dell’ematoma16. Il “segno di fusione” è stato definito come la fusione di un’area ipo-attenuante all’interno dell’ICH iperattenuata con un margine ben definito. Nella loro coorte, il tempo di scansione CT linea di base, il volume iniziale dell’ematoma, e la presenza di “segno di miscela” sulla CT linea di base erano predittori indipendenti di crescita dell’ematoma16. Il “segno di miscela” ha anche un valore predittivo comparativo positivo rispetto al segno spot per la previsione del deterioramento neurologico, che lo rende un utile marcatore CT quando il CTA non è disponibile.17.
Analogamente al “segno di fusione”, il “segno del buco nero” è un altro segno della TAC per prevedere l’espansione dell’ematoma. Il “segno del buco nero” è definito come un’area ipo-attenuante incapsulata all’interno dell’ICH iperattenuante con un bordo chiaramente definito (Figura 2). Simile al “segno di miscela”, il tempo di scansione CT linea di base, il volume iniziale dell’ematoma, e la presenza di un “segno di buco nero” sulla CT linea di base erano predittori indipendenti di crescita dell’ematoma12. In particolare, entrambi i segni sono riflessi di eterogeneità all’interno del letto ICH. La presenza di questi segni può rappresentare il sanguinamento in due periodi di tempo distinti5. Inoltre, Morottietal. hanno dimostrato che l’utilizzo di una combinazione del segno del punto CTA e l’identificazione di qualsiasi ipodensità all’interno dell’ematoma alla TAC è superiore alla previsione dell’espansione dell’ematoma rispetto ad entrambi i soli segni.18.
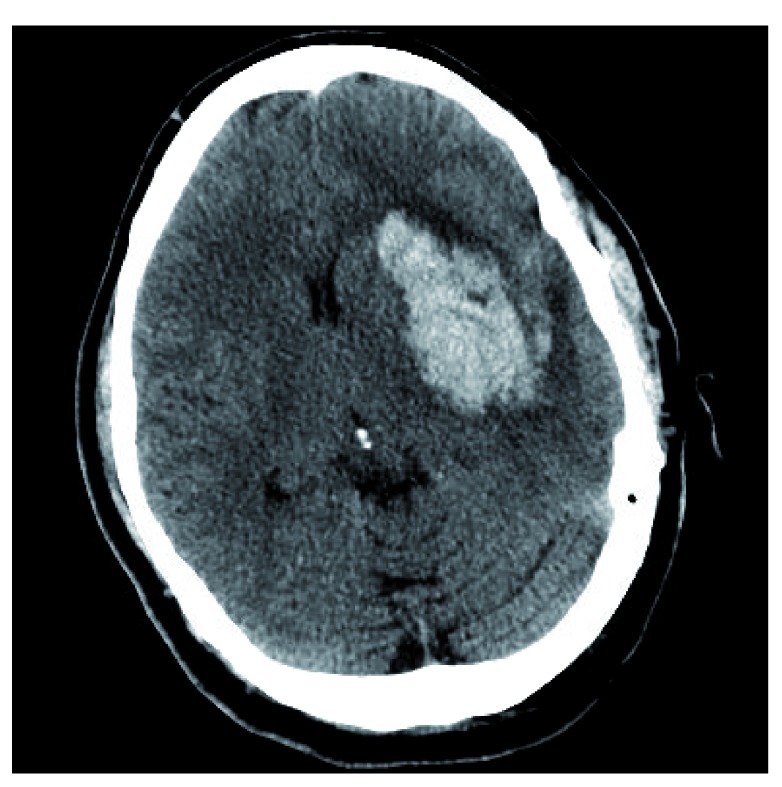
Figura 2.Emorragia putaminale sinistra con “segno di buco nero” positivo.Un margine ben delineato è apprezzato tra l’ipo-attenuante, foro nero rotondo e l’emorragia iper-attenuante. Questa immagine costituisce un dato originale e inedito ottenuto dagli autori.

Figura 2.Emorragia putaminale sinistra con “segno di buco nero” positivo.Un margine ben delineato è apprezzato tra l’ipo-attenuante, foro nero rotondo e l’emorragia iperattenuante. Questa immagine costituisce un dato originale e inedito ottenuto dagli autori.
Punteggi per prevedere l’espansione dell’ematoma
Gli schemi di punteggio che possono prevedere con precisione l’espansione dell’ematoma sono strumenti pratici per la ricerca futura. Gli interventi che non mostrano efficacia in un campione indiscriminato di pazienti con ICH possono mostrare efficacia in pazienti ad alto rischio di espansione dell’ematoma. Studi precedenti19,20 non ha discriminato l’iscrizione per l’alto e basso rischio di espansione dell’ICH; pertanto, questo può essere una fonte importante di confusione residua nonostante la randomizzazione. Un punteggio di base pratico può alleviare questa fonte di confusione o consentire un’analisi post-hoc corretta. Tre sistemi di punteggio che sono stati introdotti per prevedere l’espansione dell’ematoma sono il punteggio “BRAIN”.21 (Tabella 1), il punteggio “BAT18 (Tabella 2), e un punteggio di 9 punti di previsione di Brouwersetal.22 (Tabella 3).
| Componenti | Punti |
|---|---|
| Volume di base dell’intracerebralemorragia intracerebrale (ICH) | Millilitri per punteggio: ≤10 = 0;10-20 = 5; >20 = 7 |
| ICH ricorrente | Sì = 4 |
| Anticoagulazione con warfarin all’inizio | Sì = 6 |
| Estensione intraventricolare | No = 0; Sì = 2 |
| Numero di ore di tobaselina computazione-tomografia | ≤1 = 5; 1–2 = 4; 2–3 = 3; 3–4 = 2; 4–5 = 1; >5 = 0 |
| Punteggio totale | 0–24 |
| Componenti | Punti |
|---|---|
| Segno di fusione | Sì = 1 |
| Qualsiasi ipodensità | Sì = 2 |
| Tempo dall’inizio della misurazione del contrasto tonone-contrasto (<2,5 ore,≥2,5 ore) | <2,5 ore = 2 |
| Punteggio totale | 0–5 |
| Componenti | Punti |
|---|---|
| Uso del Warfarin | Sì = 2 |
| Tempo al calcolotomografico iniziale (TC) | ≤6 ore = 2 |
| Volume di base dell’intracerebralemorragia intracerebrale | <30 mL = 0; 30-60 mL = 1; >60 mL = 2 |
| Segno del punto di angiografia TC | Assente = 0; presente = 3;non disponibile = 1 |
| Punteggio totale | 0–9 |
Il punteggio “BRAIN” è un punteggio di 24 punti basato sul volume ICH basale, ICH ricorrente, anticoagulazione con warfarin all’esordio del sintomo, estensione intraventricolare e numero di ore alla TAC basale dall’esordio del sintomo. Il punteggio massimo, 24, prevedeva retrospettivamente l’espansione dell’ematoma con una probabilità dell’85,8% in uno studio pilota randomizzato controllato21. Il punteggio “BAT” è composto da tre componenti: la presenza di un segno di miscela, l’eventuale ipodensità all’interno dell’ematoma iperattenuante e il tempo dall’insorgenza alla TAC non contrastata. Un punteggio dicotomizzato (di 3 o più di 3) prevede un’espansione dell’ematoma con una sensibilità del 50% e una specificità dell’89%.18. Brouwersetal. ha proposto un punteggio di 9 punti derivato da un’analisi multivariata basata su variabili di un’ampia coorte retrospettiva22. I componenti associati all’espansione dell’ematoma includono l’uso di warfarin, il tempo fino alla TAC iniziale, il volume ICH di base e la presenza del segno del punto CTA. Un punteggio dicotomizzato ha mostrato una forte associazione con l’espansione dell’ematoma22.
Terapie emostatiche
Dati gli scarsi risultati associati all’espansione dell’ematoma, una notevole quantità di ricerca è stata dedicata alle terapie emostatiche farmacologiche. È importante notare che le terapie farmacologiche che riducono la crescita dell’ematoma non sempre si traducono in un miglioramento dell’esito funzionale o della sopravvivenza. Ad esempio, il fattore VII ricombinante attivato (rFVIIa) è uno di questi agenti23.
Recentemente, l’acido tranexamico (TXA) è stato valutato come terapia emostatica in uno studio controllato randomizzato di fase 3 in pazienti con ICH spontanea. La premessa di questo studio si basava su dati favorevoli per l’uso di TXA in pazienti con emorragia intracranica traumatica. C’è stato un minore aumento medio del volume dell’ematoma nel gruppo TXA rispetto al gruppo placebo. Analogamente alla rFVIIa, non vi è stato alcun miglioramento dello stato funzionale o della mortalità a 90 giorni24.
Rispetto ai pazienti con ICI spontanea, quelli sottoposti a terapia antitrombotica hanno una maggiore probabilità di espansione dell’ematoma secondario e un maggiore rischio di morte o di scarso esito funzionale. Gli agenti invertitori svolgono un ruolo importante nella gestione di questi pazienti25.
La trasfusione di piastrine rispetto al placebo dopo la ICH primaria in pazienti con agenti antipiastrinici è stata valutata nel PATCH (“Trasfusione di piastrine rispetto alla cura standard dopo un ictus acuto dovuto a un’emorragia cerebrale spontanea associata alla terapia antipiastrinica”) studio controllato randomizzato di fase 326. La maggior parte dei pazienti arruolati nello studio ha utilizzato solo inibitori COX. Le probabilità di morte o di dipendenza a 3 mesi erano più alte nel gruppo delle trasfusioni piastriniche rispetto al gruppo di cura standard. Gli autori hanno ipotizzato che la perfusione collaterale intorno alla ICH possa essere compromessa e che la trasfusione piastrinica possa aumentare il rischio di trombosi e la conseguente espansione della lesione. Inoltre, le trasfusioni piastriniche hanno effetti pro-infiammatori e possono aumentare la permeabilità vascolare associata all’infiammazione e al consumo di piastrine.26. I risultati di questo studio potrebbero non essere generalizzabili per i pazienti che assumono inibitori del P2Y12, poiché solo 5 di questi pazienti sono stati arruolati nello studio.
L’inversione degli anticoagulanti è il pilastro della terapia per i pazienti con OAC-ICH25,27,28. In un grande studio retrospettivo composto da 16 registri, i pazienti con antagonista della vitamina K (VKA)-associati ICH (VKA-ICH) che non hanno subito l’inversione hanno avuto il più alto tasso di mortalità dei casi grezzi rispetto a quelli che hanno ricevuto agenti invertitori28. Le VKA esauriscono i fattori di coagulazione II, VII, IX e X. La replica dei fattori può essere realizzata utilizzando plasma fresco congelato (FFP) o concentrato di complesso di protrombina (PCC). Lo studio INCH (“Fresh frozen plasma versus prothrombin complex concentrate in pazienti con emorragia intracranica legata agli antagonisti della vitamina K”) ha confrontato la sicurezza e l’efficacia di FFP versus PCC in pazienti con VKA-ICH26. Il 9% dei pazienti del gruppo FFP rispetto al 67% dei pazienti del braccio PCC ha raggiunto l’endpoint primario di un INR non superiore a 1,2 entro 3 ore dall’inizio del trattamento. Il PCC è stato superiore anche per gli endpoint secondari di imaging, compresa l’espansione dell’ematoma. Gli eventi tromboembolici si sono verificati in sette pazienti nel braccio PCC rispetto a un paziente nel braccio FFP. È importante notare che lo studio non ha trovato alcuna differenza statistica tra gli endpoint clinici, anche se questi sono stati considerati endpoint secondari e questo studio non è stato adeguatamente potenziato per rilevare differenze negli endpoint clinici. Questo studio evidenzia l’importanza di studi futuri adeguatamente potenziati per confrontare i risultati clinici di PCC e FFP.
Gli anticoagulanti diretti per via orale (DOAC) sono sempre più utilizzati nei pazienti con fibrillazione atriale non valvolare (NVAF) a causa di un migliore rapporto efficacia/sicurezza e di una minore interazione tra alimenti e farmaci rispetto ai VKA. Inoltre, le DOAC hanno un rischio sostanzialmente inferiore di ICH rispetto alle VKA; l’apixaban è associato al rischio più basso di ICH tra le DOAC29. In uno studio osservazionale prospettico, DOAC-ICH è stato analogo a VKA-ICH per quanto riguarda il volume dell’ematoma di base e l’estensione intraventricolare (Figura 3)30. Tre antidoti sono stati studiati per l’inversione del DOAC-ICH: idarucizumab, andexanet alfa, e ciraparantag.
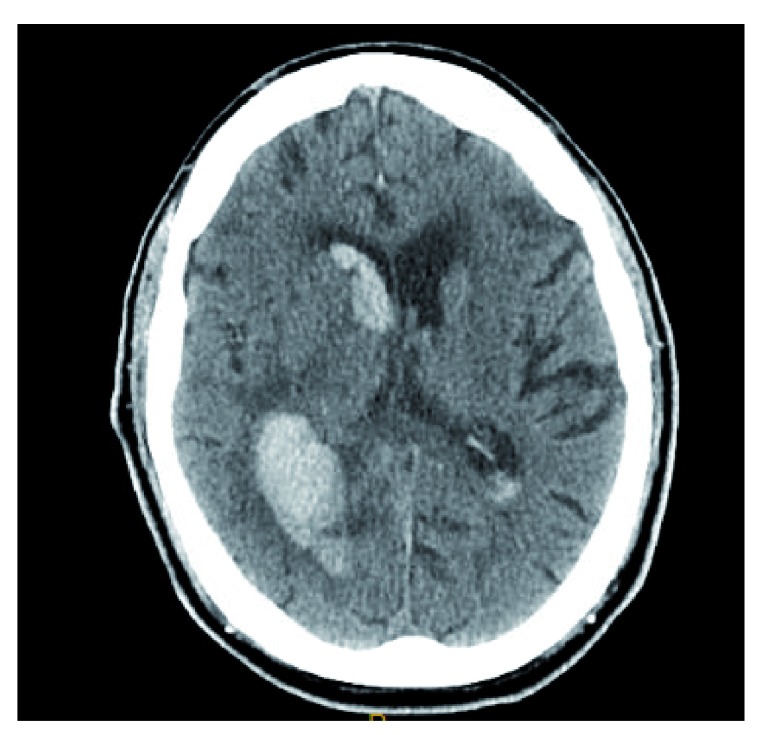
Figura 3.Emorragia intracerebrale dovuta a Rivaroxaban.L’emorragia iperattenuante è visualizzata nella regione temporale posteriore sinistra-parietale con estensione intraventricolare. Questa immagine costituisce un dato originale e inedito ottenuto dagli autori.
Uno studio prospettico di coorte ha valutato l’efficacia di idarucizumab, un frammento di anticorpo monoclonale che lega il dabigatran, in pazienti con gravi emorragie legate al dabigatran e in quelli che devono essere sottoposti a una procedura d’urgenza. Questo studio ha arruolato 18 pazienti con ICH. Questo studio ha mostrato un promettente effetto di inversione. Nel gruppo di pazienti con emorragie gravi, il tempo di trombina diluita si è normalizzato nel 98% dei pazienti31. Questo studio non ha confrontato idarucizumab con agenti di inversione alternativi e non si sa se questo agente di inversione migliora i risultati clinici. È interessante notare che il 34% dei pazienti arruolati aveva un tempo di trombina diluita normale al momento dell’arruolamento, evidenziando l’importanza di studi randomizzati controllati ben progettati per determinare l’efficacia clinica.
Andexanet alfa è stato valutato anche in pazienti con emorragia acuta maggiore32. In totale, 20 pazienti con ICH sono stati arruolati nella popolazione di efficacia dello studio. A seguito del bolo di andexanet, l’attività anti-fattore Xa mediana è diminuita dell’89% rispetto al basale. Tuttavia, l’attività anti-fattore Xa mediana è salita al 39% della linea di base nel gruppo rivaroxaban e al 30% della linea di base nel gruppo apixaban 4 ore dopo un’infusione di alfa andexanet. È importante notare che gli eventi trombotici si sono verificati nel 18% dei pazienti; l’ictus e la trombosi venosa profonda sono stati gli eventi trombotici più comuni32.
Ciraparantag è una piccola entità molecolare sintetica solubile in acqua che si lega all’eparina e agli inibitori diretti orali del fattore Xa e del fattore II per interazione della carica e disaccoppia questi farmaci dai loro bersagli. In uno studio di fase 1 su soggetti sani, una singola dose endovenosa di ciraparantag dopo 60 mg di edoxaban ha dimostrato l’inversione completa dell’anticoagulazione entro 10 minuti; l’inversione è stata sostenuta per 24 ore.33.

Figura 3.Emorragia intracerebrale dovuta a Rivaroxaban.L’emorragia iperattenuante è visualizzata nella regione temporale posteriore sinistra-parietale con estensione intraventricolare. Questa immagine costituisce un dato originale e inedito ottenuto dagli autori.
Abbassamento acuto della pressione sanguigna
L’abbassamento della pressione sanguigna è un altro potenziale obiettivo per prevenire la crescita dell’ematoma. L’aumento acuto della pressione sanguigna dopo l’ICH è comune ed è un fattore predittivo dell’esito.34. L’espansione dell’ematoma può essere il mezzo attraverso il quale l’aumento della pressione sanguigna preannuncia una mortalità precoce e uno scarso risultato clinico.34. Lo studio “Abbassamento Intensivo della Pressione Arteriosa nei Pazienti con Emorragia Cerebrale Acuta” (ATACH-2) era uno studio controllato randomizzato che confrontava l’abbassamento intensivo della pressione arteriosa (definito come un obiettivo di pressione arteriosa sistolica da 110 a 139 mm Hg) con il trattamento standard (definito come un obiettivo di pressione arteriosa sistolica da 140 a 179 mm Hg) entro 4,5 ore dall’insorgenza del sintomo utilizzando nicardipina endovenosa19. L’abbassamento intensivo della pressione sanguigna non ha comportato un tasso di mortalità o di invalidità inferiore rispetto al braccio di trattamento standard. È importante notare che c’è stato un tasso statisticamente significativo di eventi avversi renali più elevato nei pazienti che sono stati assegnati in modo casuale al gruppo di trattamento intensivo. Lo studio ATACH-2 è stato coerente con un precedente studio randomizzato controllato di Andersonetal. che non ha trovato una riduzione del tasso di morte o di disabilità nei pazienti che hanno subito un abbassamento della pressione arteriosa intensivo.20. Inoltre, nessuno dei due studi ha mostrato una significativa riduzione dell’espansione dell’ematoma – il presunto meccanismo con cui l’abbassamento acuto della pressione sanguigna esercita la sua azione terapeutica.
Sono stati valutati anche i sottogruppi dello studio ATACH-2 con i predittori di imaging dell’espansione dell’ematoma. In un’analisi pre-programmata dello studio ATACH-2, i pazienti che avevano un segno di spot non hanno beneficiato di una riduzione intensiva della pressione sanguigna simile a quella dell’intera popolazione dello studio.35. Un’ulteriore analisi post-hoc di sottogruppo dello stesso studio non ha rilevato alcun beneficio di un abbassamento intensivo della pressione sanguigna in pazienti con diversi marker TC di espansione dell’ematoma36.
In uno studio prospettico multicentrico su 600 pazienti con ICH e risonanza magnetica di base, gli autori hanno trovato che i cambiamenti nella pressione arteriosa media di 10 mm Hg sono stati associati a lesioni di imaging ponderato per diffusione (DWI)37. Questi risultati sono coerenti con uno studio precedente di Gargetal., che ha trovato un’associazione tra lesioni DWI e una maggiore riduzione della pressione arteriosa acuta.38. Gli autori notano che i pazienti con un carico maggiore di malattia di piccola imbarcazione possono essere carenti di normale autoregolazione cerebrale al momento della ICH e che l’abbassamento acuto della pressione sanguigna può precipitare l’ischemia di piccola imbarcazione.37. È importante notare che c’è stata un’associazione indipendente tra le lesioni da DWI e gli esiti di 90 giorni.37.
I dati sull’efficacia dell’abbassamento combinato della pressione sanguigna e dell’inversione anticoagulante per i pazienti con OAC-ICH rimangono scarsi. Uno studio retrospettivo su 1176 pazienti ha rilevato che la combinazione di un’inversione INR target inferiore a 1,3 e di un abbassamento della pressione arteriosa sistolica a meno di 160 mm Hg era associata a tassi più bassi di allargamento dell’ematoma e di mortalità in ospedale.11. Sebbene i loro dati siano biologicamente plausibili, le conclusioni sono limitate dai confini dell’analisi retrospettiva senza una conferma prospettica. In sintesi, la gestione ottimale dell’ipertensione acuta in pazienti con ICH spontanea non traumatica rimane un dilemma terapeutico e un’importante area di ricerca futura.
Alteplasi intraventricolare per emorragia intraventricolare
Nei pazienti con ICI spontanea, la presenza di IVH preannuncia una mortalità più elevata rispetto a quelli senza IVH. L’interruzione dell’IVH può alleviare l’idrocefalo acuto ostruttivo e la neurotossicità associata all’emorragia. Il CLEAR III (“Lisi del coagulo: Evaluating Accelerated Resolution of Intraventricular Hemorrhage”) è stato uno studio controllato randomizzato che ha valutato se l’interruzione farmacologica dell’IVH attraverso l’alteplasi intraventricolare migliora i risultati.39. La stragrande maggioranza dei pazienti rappresentati nello studio erano pazienti con emorragie talamiche con rottura intraventricolare secondaria. I pazienti che hanno ricevuto l’alteplasi avevano volumi IVH più piccoli e una durata più breve per pervietà ventricolare. Nonostante questi miglioramenti radiografici, non vi è stato alcun miglioramento dei risultati funzionali a 90 giorni nei pazienti che hanno ricevuto l’alteplasi intraventricolare.
Staykovetal. hanno studiato il drenaggio lombare adiuvante nei pazienti con IVH trattati con alteplasi intraventricolare40. In uno studio di gruppo aperto e parallelo, i pazienti sono stati assegnati in modo casuale a un drenaggio lombare adiuvante o non lombare dopo la risoluzione dell’IVH attraverso l’alteplasi intraventricolare. C’è stata una riduzione statisticamente significativa della dipendenza da shunt nel braccio di drenaggio lombare40. Questo studio pilota supporta un’ulteriore valutazione prospettica di questo intervento in un più ampio studio randomizzato controllato che utilizza endpoint clinici centrati sul paziente.
Terapie chirurgiche per emorragia intracerebrale
Due importanti studi randomizzati controllati non hanno dimostrato il beneficio dell’intervento chirurgico rispetto alla gestione medica nei pazienti con ICH. I pazienti con ICH di grandi dimensioni possono sviluppare un significativo edema ritardato e questo può causare lesioni neurologiche secondarie dovute all’effetto massa. La craniectomia decompressiva può mitigare gli effetti dell’edema ritardato. In uno studio retrospettivo su 73 pazienti affetti da ICH sottoposti a craniectomia decompressiva, il 29% dei pazienti ha avuto un esito neurologico favorevole. Questo è stato notato per essere superiore a una coorte storica con gravità ICH inferiore. Le conclusioni significative, tuttavia, si limitano all’analisi retrospettiva e sostengono la necessità di ulteriori dati prospettici41. Lo studio SWITCH (“Swiss Trial of Decompressive Craniectomy Versus Best Medical Treatment of Spontaneous Supratentorial Intracerebral Hemorrhage”) è uno studio controllato randomizzato in corso che cercherà di definire ulteriormente il ruolo dell’emicraniectomia decompressiva nei pazienti con ICH supratentoriale.
Sono in corso studi su tecniche chirurgiche minimamente invasive per alleviare il trauma chirurgico che possono compensare il beneficio dell’evacuazione dell’ematoma. Lo studio MISTIE (“Sicurezza ed efficacia della chirurgia mininvasiva più alteplasi nell’evacuazione dell’emorragia intracerebrale”) è stato uno studio di fase 2, a marchio aperto, che ha valutato la rimozione con catetere dell’ICH in pazienti con ICH spontanea, non traumatica e supratentoriale.42. I cateteri sono stati posti sotto guida diretta di imaging ed è stata eseguita l’aspirazione dei coaguli; l’alteplasi è stata poi somministrata attraverso i cateteri, lasciata abitare, e poi riaperta per il drenaggio gravitazionale. La chirurgia mini-invasiva (MIS)-con-alteplasi gruppo aveva volumi di emorragia significativamente più piccoli rispetto ai bracci di gestione medica. Da notare, per un punto finale di sicurezza composito di qualsiasi sanguinamento cranico (sintomatico o asintomatico) di oltre 5 ml 72 ore dopo l’ultima dose di alteplasi, ci sono stati eventi significativamente più eventi nel gruppo MIS-con-alteplasi. Lo studio di fase 3, recentemente pubblicato online, non ha mostrato alcun beneficio nell’endpoint di efficacia primaria (mRS 0-3 a 365 giorni)43.
In una meta-analisi di 14 studi, il MIS è stato significativamente associato a una riduzione del decesso o a una significativa compromissione funzionale rispetto sia al trattamento medico che alla craniotomia convenzionale. Questa meta-analisi includeva diversi tipi di MIS e aveva un’eterogeneità relativamente bassa44.
Indicazioni e conclusioni per il futuro
L’ICH rimane una causa importante di morbilità e mortalità. Ad oggi, non è stato dimostrato che terapie specifiche dirette alla ICH migliorino il risultato funzionale sulla base di studi controllati randomizzati. Nonostante ciò, i pazienti che sono stati sottoposti a una gestione medica e chirurgica massima hanno risultati migliori di quelli che sarebbero stati previsti sulla base degli attuali punteggi prognostici.45,46.
La mancanza di terapie specifiche può riflettere sia le terapie attualmente inefficaci che quelle efficaci, che possono essere benefiche solo in alcuni sottogruppi di pazienti affetti da ICH. Pertanto, ulteriori ricerche sull’identificazione di questi sottogruppi possono essere un importante passo avanti. Ad esempio, possono essere utili gruppi di studio composti solo da pazienti con un alto rischio di espansione dell’ematoma o l’esclusione di pazienti con un basso rischio di espansione dell’ematoma. L’uso di parametri clinici e radiografici stabiliti può permettere questo.
Un’ulteriore enfasi su una maggiore ricerca traslazionale per le terapie ICH acute può essere garantita. Ad esempio, il pioglitazone, la deferoxamina e la sostituzione delle cellule staminali sono stati valutati in contesti di ricerca traslazionale e hanno portato a studi clinici sulla sicurezza.47. L’edema periematomico (PHE) è associato ad un risultato funzionale a breve termine e ad un potenziale obiettivo terapeutico.48. Studi precedenti che utilizzavano desametasone e ipotermia terapeutica per ridurre la PHE hanno rivelato un eccesso di danno, e uno studio in corso che utilizza deferoxamina, un chelante di ferro, ha sospeso l’arruolamento a causa di una maggiore incidenza di sindrome da distress respiratorio acuto.49.
A complemento della ricerca per le terapie ICH acute, ulteriori ricerche sui fattori di rischio per l’ICH possono essere necessarie per abbassare la prevalenza di questo sottotipo di ictus devastante. Poiché le prescrizioni per gli inibitori COX-1, gli antagonisti del purinorecettore P2Y12, gli SSRI, le statine, i VKA e i DOAC sono comuni, una conoscenza più precisa del rapporto rischio-beneficio di questi farmaci e l’ICH è garantita per una cura su misura del paziente. Inoltre, la selezione ottimale dei pazienti per l’OAC per la prevenzione secondaria dell’ictus sarà probabilmente ulteriormente modificata, poiché ulteriori ricerche vengono effettuate su pazienti con caratteristiche ad alto rischio per l’ICH.
References
- An SJ, Kim TJ, Yoon BW. Epidemiology, Risk Factors, and Clinical Features of Intracerebral Hemorrhage: An Update.. J Stroke.. 2017; 19(1):3-10. Publisher Full Text | DOI | PubMed
- Muntner P, Carey RM, Gidding S. Potential US Population Impact of the 2017 ACC/AHA High Blood Pressure Guideline.. Circulation.. 2018; 137(2):109-18. Publisher Full Text | DOI | PubMed
- Khan NI, Siddiqui FM, Goldstein JN. Association Between Previous Use of Antiplatelet Therapy and Intracerebral Hemorrhage Outcomes.. Stroke.. 2017; 48(7):1810-7. Publisher Full Text | DOI | PubMed
- Renoux C, Vahey S, Dell’Aniello S. Association of Selective Serotonin Reuptake Inhibitors With the Risk for Spontaneous Intracranial Hemorrhage.. JAMA Neurol.. 2017; 74(2):173-180. Publisher Full Text | DOI | PubMed
- Endres M, Nolte CH, Scheitz JF. Statin Treatment in Patients With Intracerebral Hemorrhage.. Stroke.. 2018; 49(1):240-6. Publisher Full Text | DOI | PubMed
- Ziff OJ, Banerjee G, Ambler G. Statins and the risk of intracerebral haemorrhage in patients with stroke: systematic review and meta-analysis.. J Neurol Neurosurg Psychiatry.. 2019; 90(1):75-83. Publisher Full Text | DOI | PubMed
- Wilson D, Ambler G, Shakeshaft C. Cerebral microbleeds and intracranial haemorrhage risk in patients anticoagulated for atrial fibrillation after acute ischaemic stroke or transient ischaemic attack (CROMIS-2): a multicentre observational cohort study.. Lancet Neurol.. 2018; 17(6):539-47. Publisher Full Text | DOI | PubMed
- Holmes DR, Reddy VY, Turi ZG. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised non-inferiority trial.. Lancet.. 2009; 374(9689):534-42. Publisher Full Text | DOI | PubMed
- Charidimou A, Gang Q, Werring DJ. Sporadic cerebral amyloid angiopathy revisited: recent insights into pathophysiology and clinical spectrum.. J Neurol Neurosurg Psychiatry.. 2012; 83(2):124-37. DOI | PubMed
- Rodrigues MA, Samarasekera N, Lerpiniere C. The Edinburgh CT and genetic diagnostic criteria for lobar intracerebral haemorrhage associated with cerebral amyloid angiopathy: model development and diagnostic test accuracy study.. Lancet Neurol.. 2018; 17(3):232-40. Publisher Full Text | DOI | PubMed
- Kuramatsu JB, Gerner ST, Schellinger PD. Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracerebral hemorrhage.. JAMA.. 2015; 313(8):824-36. Publisher Full Text | DOI | PubMed
- Li Q, Zhang G, Xiong X. Black Hole Sign: Novel Imaging Marker That Predicts Hematoma Growth in Patients With Intracerebral Hemorrhage.. Stroke.. 2016; 47(7):1777-81. Publisher Full Text | DOI | PubMed
- Demchuk AM, Dowlatshahi D, Rodriguez-Luna D. Prediction of haematoma growth and outcome in patients with intracerebral haemorrhage using the CT-angiography spot sign (PREDICT): a prospective observational study.. Lancet Neurol.. 2012; 11(4):307-14. Publisher Full Text | DOI | PubMed
- Dowlatshahi D, Brouwers HB, Demchuk AM. Predicting Intracerebral Hemorrhage Growth With the Spot Sign: The Effect of Onset-to-Scan Time.. Stroke.. 2016; 47(3):695-700. Publisher Full Text | DOI | PubMed
- Al-Shahi Salman R, Frantzias J, Lee RJ. Absolute risk and predictors of the growth of acute spontaneous intracerebral haemorrhage: a systematic review and meta-analysis of individual patient data.. Lancet Neurol.. 2018; 17(10):885-94. Publisher Full Text | DOI | PubMed
- Li Q, Zhang G, Huang YJ. Blend Sign on Computed Tomography: Novel and Reliable Predictor for Early Hematoma Growth in Patients With Intracerebral Hemorrhage.. Stroke.. 2015; 46(8):2119-23. Publisher Full Text | DOI | PubMed
- Sporns PB, Schwake M, Schmidt R. Computed Tomographic Blend Sign Is Associated With Computed Tomographic Angiography Spot Sign and Predicts Secondary Neurological Deterioration After Intracerebral Hemorrhage.. Stroke.. 2017; 48(1):131-5. Publisher Full Text | DOI | PubMed
- Morotti A, Dowlatshahi D, Boulouis G. Predicting Intracerebral Hemorrhage Expansion With Noncontrast Computed Tomography: The BAT Score.. Stroke.. 2018; 49(5):1163-9. Publisher Full Text | DOI | PubMed
- Qureshi AI, Palesch YY, Barsan WG. Intensive Blood-Pressure Lowering in Patients with Acute Cerebral Hemorrhage.. N Engl J Med.. 2016; 375(11):1033-43. Publisher Full Text | DOI | PubMed
- Anderson CS, Heeley E, Huang Y. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage.. N Engl J Med.. 2013; 368(25):2355-65. Publisher Full Text | DOI | PubMed
- Wang X, Arima H, Al-Shahi Salman R. Clinical prediction algorithm (BRAIN) to determine risk of hematoma growth in acute intracerebral hemorrhage.. Stroke.. 2015; 46(2):376-81. DOI | PubMed
- Brouwers HB, Chang Y, Falcone GJ. Predicting hematoma expansion after primary intracerebral hemorrhage.. JAMA Neurol.. 2014; 71(2):158-64. DOI | PubMed
- Mayer SA, Brun NC, Begtrup K. Efficacy and safety of recombinant activated factor VII for acute intracerebral hemorrhage.. N Engl J Med.. 2008; 358(20):2127-37. Publisher Full Text | DOI | PubMed
- Sprigg N, Flaherty K, Appleton JP. Tranexamic acid for hyperacute primary IntraCerebral Haemorrhage (TICH-2): an international randomised, placebo-controlled, phase 3 superiority trial.. Lancet.. 2018; 391(10135):2107-15. Publisher Full Text | DOI | PubMed
- Frontera JA, Lewin JJ, Rabinstein AA. Guideline for Reversal of Antithrombotics in Intracranial Hemorrhage: Executive Summary. A Statement for Healthcare Professionals From the Neurocritical Care Society and the Society of Critical Care Medicine.. Crit Care Med.. 2016; 44(12):2251-7. Publisher Full Text | DOI | PubMed
- Baharoglu MI, Cordonnier C, Al-Shahi Salman R. Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy (PATCH): a randomised, open-label, phase 3 trial.. Lancet.. 2016; 387(10038):2605-13. Publisher Full Text | DOI | PubMed
- Steiner T, Poli S, Griebe M. Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists (INCH): a randomised trial.. Lancet Neurol.. 2016; 15(6):566-73. Publisher Full Text | DOI | PubMed
- Parry-Jones AR, Di Napoli M, Goldstein JN. Reversal strategies for vitamin K antagonists in acute intracerebral hemorrhage.. Ann Neurol.. 2015; 78(1):54-62. Publisher Full Text | DOI | PubMed
- Granger CB, Alexander JH, McMurray JJ. Apixaban versus warfarin in patients with atrial fibrillation.. N Engl J Med.. 2011; 365(11):981-92. Publisher Full Text | DOI | PubMed
- Purrucker JC, Haas K, Rizos T. Early Clinical and Radiological Course, Management, and Outcome of Intracerebral Hemorrhage Related to New Oral Anticoagulants.. JAMA Neurol.. 2016; 73(2):169-77. Publisher Full Text | DOI | PubMed
- Pollack CV, Reilly PA, Eikelboom J. Idarucizumab for Dabigatran Reversal.. N Engl J Med.. 2015; 373(6):511-20. Publisher Full Text | DOI | PubMed
- Connolly SJ, Milling TJ, Eikelboom JW. Andexanet Alfa for Acute Major Bleeding Associated with Factor Xa Inhibitors.. N Engl J Med.. 2016; 375(12):1131-41. Publisher Full Text | DOI | PubMed
- Ansell JE, Bakhru SH, Laulicht BE. Single-dose ciraparantag safely and completely reverses anticoagulant effects of edoxaban.. Thromb Haemost.. 2017; 117(2):238-45. Publisher Full Text | DOI | PubMed
- Butcher KS, Jeerakathil T, Hill M. The Intracerebral Hemorrhage Acutely Decreasing Arterial Pressure Trial.. Stroke.. 2013; 44(3):620-6. Publisher Full Text | DOI | PubMed
- Morotti A, Brouwers HB, Romero JM. Intensive Blood Pressure Reduction and Spot Sign in Intracerebral Hemorrhage: A Secondary Analysis of a Randomized Clinical Trial.. JAMA Neurol.. 2017; 74(8):950-60. Publisher Full Text | DOI | PubMed
- Morotti A, Boulouis G, Romero JM. Blood pressure reduction and noncontrast CT markers of intracerebral hemorrhage expansion.. Neurology.. 2017; 89(6):548-54. Publisher Full Text | DOI | PubMed
- Kidwell CS, Rosand J, Norato G. Ischemic lesions, blood pressure dysregulation, and poor outcomes in intracerebral hemorrhage.. Neurology.. 2017; 88(8):782-8. Publisher Full Text | DOI | PubMed
- Garg RK, Liebling SM, Maas MB. Blood pressure reduction, decreased diffusion on MRI, and outcomes after intracerebral hemorrhage.. Stroke.. 2012; 43(1):67-71. DOI | PubMed
- Hanley DF, Lane K, McBee N. Thrombolytic removal of intraventricular haemorrhage in treatment of severe stroke: results of the randomised, multicentre, multiregion, placebo-controlled CLEAR III trial.. Lancet.. 2017; 389(10069):603-11. Publisher Full Text | DOI | PubMed
- Staykov D, Kuramatsu JB, Bardutzky J. Efficacy and safety of combined intraventricular fibrinolysis with lumbar drainage for prevention of permanent shunt dependency after intracerebral hemorrhage with severe ventricular involvement: A randomized trial and individual patient data meta-analysis.. Ann Neurol.. 2017; 81(1):93-103. Publisher Full Text | DOI | PubMed
- Esquenazi Y, Savitz SI, El Khoury R. Decompressive hemicraniectomy with or without clot evacuation for large spontaneous supratentorial intracerebral hemorrhages.. Clin Neurol Neurosurg.. 2015; 128:117-22. Publisher Full Text | DOI | PubMed
- Hanley DF, Thompson RE, Muschelli J. Safety and efficacy of minimally invasive surgery plus alteplase in intracerebral haemorrhage evacuation (MISTIE): a randomised, controlled, open-label, phase 2 trial.. Lancet Neurol.. 2016; 15(12):1228-37. Publisher Full Text | DOI | PubMed
- Hanley DF, Thompson RE, Rosenblum M. Efficacy and safety of minimally invasive surgery with thrombolysis in intracerebral haemorrhage evacuation (MISTIE III): a randomised, controlled, open-label, blinded endpoint phase 3 trial.. Lancet.. 2019; 393(10175):1021-1032. DOI | PubMed
- Scaggiante J, Zhang X, Mocco J. Minimally Invasive Surgery for Intracerebral Hemorrhage.. Stroke.. 2018; 49(11):2612-20. Publisher Full Text | DOI | PubMed
- Morgenstern LB, Zahuranec DB, Sánchez BN. Full medical support for intracerebral hemorrhage.. Neurology.. 2015; 84(17):1739-44. DOI | PubMed
- Sembill JA, Gerner ST, Volbers B. Severity assessment in maximally treated ICH patients: The max-ICH score.. Neurology.. 2017; 89(5):423-31. Publisher Full Text | DOI | PubMed
- Zhou Y, Wang Y, Wang J. Inflammation in intracerebral hemorrhage: from mechanisms to clinical translation.. Prog Neurobiol.. 2014; 115:25-44. DOI | PubMed
- Volbers B, Giede-Jeppe A, Gerner ST. Peak perihemorrhagic edema correlates with functional outcome in intracerebral hemorrhage.. Neurology.. 2018; 90(12):e1005-e1012. DOI | PubMed
- Kim H, Edwards NJ, Choi HA. Treatment Strategies to Attenuate Perihematomal Edema in Patients With Intracerebral Hemorrhage.. World Neurosurg.. 2016; 94:32-41. DOI | PubMed
Fonte
Garg R, Biller J (2019) Recent advances in spontaneous intracerebral hemorrhage. F1000Research 8F1000 Faculty Rev-302. https://doi.org/10.12688/f1000research.16357.1





