Introduzione
Il cancro è una delle principali cause di mortalità negli Stati Uniti.1 Anche se uno screening adeguato del cancro può aiutare a identificare il cancro in una fase precedente, è spesso sottoutilizzato, il che può portare a morti prevenibili.2,3,4,5,6 Le linee guida dell’US Preventive Services Task Force raccomandano che alle pazienti idonee venga offerto uno screening del cancro al seno e del colon-retto durante le visite di assistenza primaria.7,8 Tuttavia, i Centri per il controllo e la prevenzione delle malattie stimano che circa il 37% degli adulti non è stato sottoposto a screening per il cancro al colon-retto e il 28% delle donne non è stato sottoposto a screening per il cancro al seno.9
Le spinte sono sottili cambiamenti nell’architettura delle scelte che possono avere importanti influenze sul processo decisionale medico.10 Per esempio, un lavoro precedente ha rilevato che l’utilizzo di una scelta attiva, un metodo che richiede ai medici di accettare o rifiutare un ordine per i test di screening del cancro al seno o del colon-retto nella cartella clinica elettronica (EHR), ha aumentato significativamente i tassi di ordinazione dei test di screening del cancro in una pratica di assistenza primaria rispetto a un gruppo di pratiche di controllo.11 Questo metodo è stato utilizzato anche per aumentare la vaccinazione antinfluenzale e la prescrizione di statine.12,13 Tuttavia, questo tipo di approccio potrebbe portare all’affaticamento del clinico.14,15,16 Pertanto, prima di espandersi ad altri 3 studi presso la nostra istituzione, l’intervento di scelta attiva è stato reindirizzato agli assistenti medici che potevano informare i pazienti sull’idoneità per lo screening del cancro, e sono stati fatti degli ordini modello nella EHR per i medici da rivedere. L’obiettivo di questo studio era di valutare l’associazione dell’intervento di scelta attiva con l’ordine del medico e il completamento dei test di screening del cancro al seno e del colorettale da parte del paziente.
Metodi
L’Institutional Review Board della University of Pennsylvania ha approvato questo studio e ha rinunciato al consenso informato perché non era fattibile dato il disegno dello studio retrospettivo e perché lo studio presentava un rischio minimo. Questo studio ha seguito le linee guida per il reporting di eccellenza per il miglioramento della qualità(SQUIRE 2.0).
Impostazione e partecipanti
Il campione comprendeva visite di pazienti adulti provenienti da 25 centri di assistenza primaria della University of Pennsylvania Health System durante il periodo di studio di 3 anni, dal 1° settembre 2014 al 31 agosto 2017, che comprendeva 2 anni prima e 1 anno dopo l’attuazione dell’intervento di EHR. Queste sedi di studio si trovavano in Pennsylvania e nel New Jersey, comprendevano sia medici di medicina interna che di medicina di famiglia, e avevano almeno 100 pazienti da sottoporre a screening per il cancro al seno e al colon-retto in ciascuno dei 3 anni. I pazienti erano inclusi se avevano almeno 1 nuova visita in clinica o di ritorno con il loro medico di base (PCP) (medico curante o residente) durante il periodo di studio e dovevano sottoporsi allo screening del cancro al seno o del colon-retto in base alle linee guida della US Preventive Services Task Force.7,8 Per lo screening del cancro al seno, questo includeva le donne di età compresa tra i 50 e i 74 anni. Per lo screening del cancro colorettale, questo includeva gli adulti di età compresa tra i 50 e i 75 anni. Utilizzando le informazioni e i dati relativi al mantenimento della salute contenuti nella relazione sulla salute umana, abbiamo guardato indietro fino a 10 anni per valutare le precedenti interazioni con i pazienti e i test di screening per determinare l’idoneità. Simile al lavoro precedente,17,18 abbiamo escluso i pazienti che non dovevano sottoporsi allo screening del cancro o che hanno cambiato il PCP in qualsiasi momento durante il periodo di studio.
Dati
Simile al lavoro precedente,11,18 Clarity, un database EPIC, è stato utilizzato per ottenere dati sui pazienti, sulle visite in clinica e sui test di screening del cancro. I dati sui pazienti comprendevano le caratteristiche demografiche, l’assicurazione, le comorbidità, la PCP e la presenza di risultati di test di screening dei tumori. I dati sulle visite in clinica comprendevano la data, il sito di pratica, il tipo di visita e la presenza di un ordine per i test di screening dei tumori. Lo screening del cancro al seno può essere completato con la mammografia. Lo screening del cancro colorettale può essere completato con colonscopia, sigmoidoscopia, test immunochimico fecale, test del sangue occulto nelle feci o test del DNA delle feci. I codici delle cartelle cliniche elettroniche utilizzati per classificare i test di screening sono stati pubblicati in precedenza.18 Il livello di reddito familiare è stato ottenuto utilizzando i dati del censimento statunitense sul reddito familiare mediano basato sul codice postale. Per questo studio non erano disponibili dati sui sinistri dell’assicurazione sanitaria.
Intervento
Prima dell’intervento, i PCP dovevano ricordarsi di controllare manualmente l’EHR per determinare se un paziente doveva sottoporsi allo screening del cancro, discuterne con il paziente e poi ordinarlo nell’EHR. Dal 1° settembre 2016 al 31 agosto 2017, 3 pratiche di assistenza primaria del sistema sanitario dell’Università della Pennsylvania hanno implementato un intervento di scelta attiva nell’EHR utilizzando un avviso di best-practice in EPIC diretto agli assistenti medici. Prima dell’incontro con il medico, i pazienti si sono incontrati con un assistente medico per controllare i loro segni vitali e prepararsi alla visita. In quel momento, l’EHR ha verificato l’idoneità delle pazienti per lo screening del cancro al seno e del colon-retto e ha chiesto alle assistenti mediche di accettare o annullare un ordine. Se accettato, l’ordine sarebbe stato redatto in forma di modello (un ordine in sospeso viene fatto per consentire al medico di controllare e firmare durante la visita della paziente). Questo intervento era simile, nella progettazione, al lavoro precedente per la vaccinazione antinfluenzale.17
Principali misure di risultato
L’esito primario è stato l’ordine clinico del test di screening durante la visita di assistenza primaria. L’esito secondario è stato il completamento di un test di screening da parte del paziente (non necessariamente legato all’ordine della visita) entro 1 anno dalla visita per le cure primarie.
Analisi statistica
Per valutare l’associazione dei cambiamenti nei tassi di screening dei tumori con l’intervento di scelta attiva, abbiamo utilizzato un approccio basato sulle differenze.19,20 Simile al lavoro precedente,11,13,17 abbiamo confrontato i cambiamenti nello screening dei tumori all’intervento con le pratiche di controllo durante l’anno successivo all’intervento rispetto ai 2 anni di pre intervento. Abbiamo usato il paziente come unità di analisi e abbiamo incluso tutte le visite in clinica durante ogni anno.
Nell’analisi adattata, abbiamo utilizzato la procedura SAS PROC GENMOD per adattare il modello basato su equazioni di stima generalizzata con un link logit e una struttura di correlazione di indipendenza che utilizza il PCP come unità di clustering.21 Il modello è stato adattato per la demografia dei pazienti (età, sesso, razza/etnia e reddito familiare), assicurazioni, indice di comorbilità di Charlson,22 gruppo di studio (sito di intervento o di controllo), tipo di visita in clinica (nuova o di ritorno), effetti fissi per sito di studio, anno e mese di calendario. Per ottenere una differenza nelle differenze, abbiamo usato un termine di interazione per il gruppo di pratica (intervento vs. controllo) e l’anno 3. Per ottenere la differenza nella percentuale di pazienti con il 95% di IC, abbiamo usato la procedura bootstrap, ricampionando i pazienti 1000 volte.23,24 Il ricampionamento dei pazienti è stato effettuato tramite variabile PCP per mantenere il clustering a livello di PCP. È stata eseguita una prova di controllo per verificare l’ipotesi nulla di tendenze parallele tra l’intervento e le pratiche di controllo durante i 2 anni di pre intervento.25 I test delle ipotesi a due facce hanno utilizzato un livello di significatività di P==.05; tutte le analisi sono state condotte in SAS, versione 9.4 (SAS Institute Inc).
Risultati
Il campione idoneo per lo screening del tumore al seno comprendeva 26-269 donne con un’età media (SD) di 60,4 (6,9) anni; 15 873 (60,4%) erano bianche e 7715 (29,4%) nere (Tabella 1). Il campione idoneo per lo screening del cancro colorettale comprendeva 43-647 pazienti con un’età media (SD) di 59,4 (7,5) anni; 24-416 (55,9%) erano donne, 19-231 (44,1%) uomini, 29-29 (66,5%) bianchi e 9589 (22,0%) neri (Tabella 2).
| Caratteristica | Pazienti, n. (%) | ||||||
|---|---|---|---|---|---|---|---|
| 2014-2015 | 2015-2016 | 2016-2017 | Totale (N=26-269) | ||||
| Controllo (n=8628) | Intervento (n = 1505) | Controllo (n = 6911) | Intervento (n=1297) | Controllo (n=6584) | Intervento (n=1344) | ||
| Età, media (SD), y | 60.7 (7) | 61.1 (6.8) | 60.1 (6.9) | 60.8 (6.8) | 60.1 (7.0) | 60.9 (6.9) | 60.4 (6.9) |
| Sesso femminile | 8628 (100.0) | 1505 (100.0) | 6911 (100.0) | 1297 (100.0) | 6584 (100.0) | 1344 (100.0) | 26 269 (100.0) |
| Razza/etnicità | |||||||
| Bianco non ispanico | 5521 (64.0) | 728 (48.4) | 4254 (61.6) | 603 (46.5) | 4083 (62.0) | 684 (50.9) | 15 873 (60.4) |
| Nero non ispanico | 2330 (27.0) | 602 (40.0) | 1982 (28.7) | 536 (41.3) | 1741 (26.4) | 524 (39.0) | 7715 (29.4) |
| Asiatici non ispanici | 200 (2.3) | 66 (4.4) | 179 (2.6) | 58 (4.5) | 183 (2.8) | 54 (4.0) | 740 (2.8) |
| Ispanico | 135 (1.6) | 12 (0.8) | 124 (1.8) | 18 (1.4) | 126 (1.9) | 14 (1.0) | 429 (1.6) |
| Altro | 442 (5.1) | 97 (6.4) | 372 (5.4) | 82 (6.3) | 451 (6.8) | 68 (5.1) | 1512 (5.8) |
| Assicurazione | |||||||
| Commerciale | 5364 (62.2) | 869 (57.7) | 4330 (62.7) | 763 (58.8) | 4142 (62.9) | 720 (53.6) | 16 188 (61.6) |
| Medicare | 2753 (31.9) | 483 (32.1) | 2017 (29.2) | 391 (30.1) | 1952 (29.6) | 464 (34.5) | 8060 (30.7) |
| Medicaid | 511 (5.9) | 153 (10.2) | 564 (8.2) | 143 (11.0) | 490 (7.4) | 160 (11.9) | 2021 (7.7) |
| Reddito familiare annuo, $b | |||||||
| <50 000 | 2627 (30.4) | 663 (44.1) | 2203 (31.9) | 577 (44.5) | 1960 (29.8) | 612 (45.5) | 8642 (32.9) |
| 50 000-100 000 | 4720 (54.7) | 531 (35.3) | 3684 (53.3) | 469 (36.2) | 3644 (55.3) | 441 (32.8) | 13 489 (51.3) |
| >100 000 | 1191 (13.8) | 301 (20.0) | 945 (13.7) | 235 (18.1) | 924 (14.0) | 275 (20.5) | 3871 (14.7) |
| Manca | 90 (1.0) | 10 (0.7) | 79 (1.1) | 16 (1.2) | 56 (0.9) | 16 (1.2) | 267 (1.0) |
| Indice di comorbilità di Charlson, mediano (IQR) | 1 (0-2) | 1 (0-3) | 0 (0-2) | 1 (0-2) | 0 (0-2) | 1 (0-3) | 1 (0-2) |
| Caratteristica | Pazienti, n. (%) | ||||||
|---|---|---|---|---|---|---|---|
| 2014-2015 | 2015-2016 | 2016-2017 | Totale (N=43-647) | ||||
| Controllo (n = 17-231) | Intervento (n=2534) | Controllo (n = 10 730) | Intervento (n=1713) | Controllo (n==9820) | Intervento (n = 1619) | ||
| Età, media (SD), y | 60 (7.5) | 60.3 (7.7) | 58.8 (7.3) | 59.3 (7.6) | 58.7 (7.5) | 59.5 (7.7) | 59.4 (7.5) |
| Sesso femminile | 9693 (56.3) | 1449 (57.2) | 6004 (56) | 944 (55.1) | 5436 (55.4) | 890 (55.0) | 24 416 (55.9) |
| Gara/etnicità | |||||||
| Bianco non ispanico | 12 060 (70.0) | 1457 (57.5) | 7181 (66.9) | 955 (55.8) | 6482 (66) | 894 (55.2) | 29 029 (66.5) |
| Nero non ispanico | 3445 (20.0) | 746 (29.4) | 2303 (21.5) | 515 (30.1) | 2073 (21.1) | 507 (31.3) | 9589 (22.0) |
| Asiatici non ispanici | 465 (2.7) | 120 (4.7) | 305 (2.8) | 75 (4.4) | 301 (3.1) | 62 (3.8) | 1328 (3.0) |
| Ispanico | 284 (1.6) | 23 (0.9) | 184 (1.7) | 25 (1.5) | 192 (2.0) | 20 (1.2) | 728 (1.7) |
| Altro | 977 (5.7) | 188 (7.4) | 757 (7.1) | 143 (8.3) | 772 (7.9) | 136 (8.4) | 2973 (6.8) |
| Assicurazione | |||||||
| Commerciale | 11 282 (65.5) | 1559 (61.5) | 7451 (69.4) | 1104 (64.4) | 6823 (69.5) | 992 (61.3) | 29 211 (66.9) |
| Medicare | 5064 (29.4) | 767 (30.3) | 2529 (23.6) | 448 (26.2) | 2359 (24.0) | 442 (27.3) | 11 609 (26.6) |
| Medicaid | 885 (5.1) | 208 (8.2) | 750 (7.0) | 161 (9.4) | 638 (6.5) | 185 (11.4) | 2827 (6.5) |
| Reddito familiare annuo, $b | |||||||
| <50 000 | 4220 (24.5) | 932 (36.8) | 2710 (25.3) | 617 (36.0) | 2414 (24.6) | 604 (37.3) | 11 497 (26.3) |
| 50 000-100 000 | 10 188 (59.1) | 912 (36.0) | 6111 (57.0) | 649 (37.9) | 5675 (57.8) | 617 (38.1) | 24 152 (55.3) |
| >100 000 | 2639 (15.3) | 659 (26.0) | 1775 (16.5) | 426 (24.9) | 1645 (16.8) | 384 (23.7) | 7528 (17.2) |
| Manca | 184 (1.1) | 31 (1.2) | 134 (1.2) | 21 (1.2) | 86 (0.9) | 14 (0.9) | 470 (1.1) |
| Indice di comorbilità di Charlson, mediano (IQR) | 0 (0-2) | 1 (0-2) | 0 (0-1) | 1 (0-2) | 0 (0-1) | 1 (0-2) | 0 (0-0) |
Screening del cancro al seno
LaFigura 1Amostra il tasso non regolato di ordinazione dei test di screening del cancro al seno da parte del medico per i gruppi di controllo e di pratica di intervento per anno. L’ordinazione dei test di screening del cancro al seno da parte dei medici è stata del 53,5% nel 2014-2015, del 61,4% nel 2015-2016 e del 59,2% nel 2016-2017 per le pratiche di controllo e del 59,1% nel 2014-2015, del 68,8% nel 2015-2016 e dell’87,5% nel 2016-2017 per le pratiche di intervento. Le tendenze di pre intervento corrette durante i primi 2 anni per l’ordinazione dei test di screening del cancro al seno da parte dei medici non differivano tra i vari gruppi (odds ratio corretto, 1,06; 95% CI, 0,85-1,33; P==,61). Nelle analisi corrette, c’è stato un significativo aumento di 22,2 punti percentuali (95% di IC, 17,2-27,6 punti percentuali; P<<0,001) nell’ordine clinico dei test di screening del cancro al seno per le pratiche di intervento relative alle pratiche di controllo nel tempo (Tabella 3).
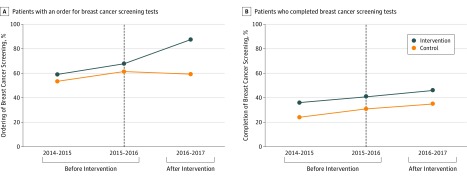
Figura 1.Tassi di screening del cancro al seno per gruppo di pratica e annoA, La percentuale di pazienti che sono state ammesse allo screening del tumore al seno e che hanno lasciato la loro visita di assistenza primaria con un ordine di screening. B, La percentuale di pazienti che hanno completato lo screening entro 1 anno dalla visita. L’intervento di scelta attiva è stato attuato presso il sito di intervento nel periodo dal 2016 al 2017. La linea nera tratteggiata verticale separa i 2 anni di pre intervento dall’anno successivo all’intervento.
| Screening | Differenza in Differenza rettificata (95% CI), Punti percentualia,b | P Valore |
|---|---|---|
| Test di screening del cancro al seno | ||
| Ordine del medico | 22,2 (da 17,2 a 27,6) | <.001 |
| Completamento del paziente | 0,1 (da -4,0 a 4,3) | .45 |
| Test di screening del cancro colorettale | ||
| Ordine del medico | 13,7 (da 8,0 a 18,9) | <.001 |
| Completamento del paziente | 1,0 (da -3,2 a 4,6) | .36 |
LaFigura 1Bmostra il tasso non aggiustato di completamento dei test di screening del cancro al seno per i gruppi di controllo e di pratica di intervento per anno. Il tasso di completamento dello screening del cancro al seno da parte delle pazienti è stato del 24,1% nel 2014-2015, del 31,0% nel 2015-2016 e del 34,8% nel 2016-2017 per le pratiche di controllo e del 36,0% nel 2014-2015, del 40,8% nel 2015-2016 e del 45,9% nel 2016-2017 per le pratiche di intervento. Gli andamenti rettificati della prevenzione degli interventi nei primi 2 anni per il completamento dei test di screening del cancro al seno da parte delle pazienti non differivano tra i vari gruppi (odds ratio rettificato, 0,87; 95% CI, 0,72-1,06; P==,16). Nelle analisi corrette, non c’è stata una differenza significativa (0,1 punti percentuali; 95% di IC, da -4,0 a 4,3 punti percentuali; P==,45) nel completamento dei test di screening del cancro al seno da parte delle pazienti per le pratiche di intervento relative alle pratiche di controllo nel tempo (Tabella 3). I tassi non corretti di ordinazione e di completamento dello screening del tumore al seno tra i sottogruppi di pazienti per età, razza/etnia e reddito nelle pratiche di intervento e di controllo prima e dopo l’intervento sono stati simili alle tendenze generali (eTabelle 1 e 2 nel Supplemento).

Figura 1.Tassi di screening del cancro al seno per gruppo di pratica e annoA, La percentuale di pazienti che sono state ammesse allo screening del tumore al seno e che hanno lasciato la loro visita di assistenza primaria con un ordine di screening. B, La percentuale di pazienti che hanno completato lo screening entro 1 anno dalla visita. L’intervento di scelta attiva è stato attuato presso il sito di intervento nel periodo dal 2016 al 2017. La linea nera tratteggiata verticale separa i 2 anni di pre intervento dall’anno successivo all’intervento.
Screening del cancro colorettale
LaFigura 2Amostra il tasso non regolato di ordinazione dei test di screening del cancro colorettale da parte del medico per i gruppi di controllo e di pratica di intervento per anno. L’ordine dei test di screening per il cancro colorettale è stato del 32,1% nel 2014-2015, del 49,0% nel 2015-2016 e del 50,0% nel 2016-2017 per le pratiche di controllo e del 51,4% nel 2014-2015, del 65,2% nel 2015-2016 e dell’82,0% nel 2016-2017 per le pratiche di intervento. Le tendenze di pre intervento corrette durante i primi 2 anni per l’ordinazione dei test di screening del cancro colorettale da parte dei medici non differivano tra i vari gruppi (odds ratio corretto, 0,83; 95% CI, 0,66-1,05; P==.12). Nelle analisi corrette, c’è stato un significativo aumento di 13,7 punti percentuali (95% CI, 8,0-18,9 punti percentuali; P<<1001) nell’ordine clinico dei test di screening del cancro colorettale per le pratiche di intervento relative alle pratiche di controllo nel tempo (Tabella 3).
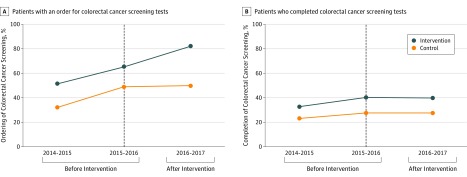
Figura 2.Tassi di screening del cancro colorettale per gruppo di pratica e annoA, La percentuale di pazienti che sono stati idonei per lo screening del cancro colorettale e hanno lasciato la loro visita di assistenza primaria con un ordine di screening. B, La percentuale di pazienti che hanno completato lo screening entro 1 anno dalla visita. L’intervento di scelta attiva è stato attuato presso il sito di intervento nel periodo dal 2016 al 2017. La linea nera tratteggiata verticale separa i 2 anni di pre intervento dall’anno successivo all’intervento.
LaFigura 2Bmostra il tasso non regolato di completamento dello screening del cancro colorettale da parte del paziente per i gruppi di controllo e di pratica di intervento per anno. I tassi di screening individuale del cancro colorettale sono stati simili tra i due gruppi e, nel complesso, sono stati condotti mediante colonscopia (88,6%), analisi del sangue occulto nelle feci (6,8%), test immunochimico nelle feci (4,1%), sigmoidoscopia (0,3%), e test del DNA delle feci a bersaglio multiplo (0,3%). Il completamento dei test di screening del cancro colorettale da parte dei pazienti è stato del 23,1% nel 2014-2015, del 27,6% nel 2015-2016 e del 27,7% nel 2016-2017 presso le pratiche di controllo e del 32,8% nel 2014-2015, del 40,4% nel 2015-2016 e del 39,7% nel 2016-2017 presso le pratiche di intervento. Gli andamenti rettificati di pre intervento durante i primi 2 anni per l’ordinazione dei test di screening colorettale da parte dei medici non differivano tra i gruppi (odds ratio rettificato, 1,10; 95% CI, 0,92-1,32, P==,27). Nelle analisi corrette, non c’è stata una differenza significativa (1,0 punti percentuali; 95% CI, da -3,2 a 4,6 punti percentuali; P==,36) nel completamento da parte del paziente dei test di screening del cancro colorettale per le pratiche di intervento relative alle pratiche di controllo nel tempo (Tabella 3). I tassi non corretti di ordinazione e di completamento dei test di screening del cancro colorettale tra i sottogruppi di pazienti per età, razza/etnia, reddito e sesso nelle pratiche di intervento e di controllo prima e dopo l’intervento sono stati simili alle tendenze generali (eTabelle 3 e 4 nel Supplemento).

Figura 2.Tassi di screening del cancro colorettale per gruppo di pratica e annoA, La percentuale di pazienti che sono stati idonei per lo screening del cancro colorettale e hanno lasciato la loro visita di assistenza primaria con un ordine di screening. B, La percentuale di pazienti che hanno completato lo screening entro 1 anno dalla visita. L’intervento di scelta attiva è stato attuato presso il sito di intervento nel periodo dal 2016 al 2017. La linea nera tratteggiata verticale separa i 2 anni di pre intervento dall’anno successivo all’intervento.
Discussione
Tra una rete di pratiche di assistenza primaria, abbiamo scoperto che un intervento di scelta attiva fornito alle assistenti mediche attraverso l’EHR era associato a un significativo aumento di 22 punti percentuali nell’ordinazione dei test di screening del cancro al seno da parte dei medici e a un significativo aumento di 14 punti percentuali nell’ordinazione dei test di screening del cancro colorettale, ciascuno relativo alle pratiche di controllo nel tempo. Tuttavia, durante un follow-up di 1 anno, l’intervento non è stato associato ad un cambiamento significativo nel completamento di questi test di screening da parte delle pazienti. Questi risultati dimostrano il potenziale dell’utilizzo dei nudge nell’EHR per migliorare il processo decisionale del clinico, ma evidenziano che potrebbero essere necessari ulteriori interventi mirati ai pazienti.
Questi risultati ampliano la nostra comprensione dell’associazione tra gli ambienti di pratica e le decisioni mediche relative allo screening del cancro. In primo luogo, l’entità dell’aumento dell’ordine dei medici è stata maggiore rispetto a uno studio pilota precedente in cui l’intervento è stato associato a un aumento del 12 per cento per lo screening di entrambi i tipi di cancro.11 Nello studio pilota, l’intervento di scelta attiva era rivolto sia ai clinici che agli assistenti medici. I clinici hanno riferito che questo disegno ha portato ad avvertire la stanchezza e la confusione in termini di quale persona fosse la principale responsabile dell’ordine per i test di screening. In questo studio, l’intervento è stato diretto solo agli assistenti medici, che hanno potuto creare dei modelli di ordine per i medici per rivedere e preparare i pazienti informandoli che erano idonei per lo screening del cancro e che avrebbero dovuto discutere lo screening con il loro medico. Questo disegno potrebbe aver spostato parte dell’onere sui medici e incoraggiato i pazienti a dare priorità a una discussione sullo screening dei tumori.
In secondo luogo, nonostante un forte aumento dell’ordine dei test di screening da parte dei medici, l’intervento non è stato associato a un cambiamento significativo nel completamento dei test di screening da parte dei pazienti. Questa constatazione è in contrasto con il lavoro precedente che utilizzava un intervento simile per la vaccinazione antinfluenzale, che ha rilevato che più del 99% degli ordini dei medici ha portato alla vaccinazione dei pazienti.13,17 Una differenza importante tra la vaccinazione antinfluenzale e i test di screening per il cancro è la tempistica e la quantità di sforzi legati al completamento dell’ordine. I pazienti in genere ricevono le vaccinazioni prima di lasciare la visita di assistenza primaria, spesso direttamente dal medico. I test di screening dei tumori comportano un processo più oneroso e complesso. I pazienti spesso devono fissare un altro appuntamento in gastroenterologia o in radiologia. La colonscopia, la forma più comune di screening del cancro colorettale nel nostro studio, richiede la preparazione dell’intestino e la sedazione. I pazienti di queste pratiche di assistenza primaria sono stati per lo più da soli a completare questi passaggi e non hanno ricevuto promemoria o assistenza per seguire la programmazione degli esami e il loro completamento. Gli studi futuri potrebbero valutare i modi per incentivare la programmazione e la partecipazione a questi appuntamenti, oltre a ridurre lo sforzo richiesto per farlo. Per esempio, uno studio clinico randomizzato nello stesso sistema sanitario ha scoperto che l’inquadramento dell’opt-out attraverso l’invio per posta ha portato ad un aumento di tre volte del completamento dei test di screening del cancro colorettale da parte dei pazienti rispetto ad un approccio opt-in.26 Diversi altri studi clinici randomizzati hanno scoperto che la diffusione diretta dello screening del cancro colorettale ai pazienti o ai loro medici ha portato a un piccolo aumento del completamento dei pazienti.27,28
Limitazioni
Questo studio è soggetto ad alcune limitazioni. In primo luogo, qualsiasi studio osservazionale è suscettibile di confusione non misurata. Tuttavia, l’intervento di scelta attiva è stato valutato utilizzando un approccio basato sulle differenze, che riduce i potenziali pregiudizi dei co-fondatori non misurati, confrontando i cambiamenti nello screening dei tumori nel tempo tra l’intervento e le pratiche di controllo. In secondo luogo, questo studio è stato condotto all’interno di un unico sistema sanitario, che può limitare la generalizzabilità. Tuttavia, abbiamo incluso 25 siti di pratica di 2 diversi stati in cliniche urbane e suburbane. Ciononostante, i risultati dovrebbero essere confermati in altri contesti. In terzo luogo, abbiamo valutato l’idoneità e il completamento dello screening del cancro utilizzando i dati acquisiti da un sistema sanitario, ed è possibile che alcuni pazienti abbiano completato questi test in altre località. Tuttavia, questo non influenzerebbe i risultati, a meno che non si verificasse in modo diverso tra i vari gruppi in altre occasioni.
Conclusioni
Un intervento di scelta attiva nell’EHR diretto alle assistenti mediche è stato associato ad un significativo aumento dell’ordine clinico dei test di screening per il cancro al seno e al colon-retto. Tuttavia, non è stato associato a un cambiamento significativo nel completamento di questi test da parte delle pazienti durante un follow-up di un anno. I nostri risultati indicano che gli stimoli facilitati dall’EHR possono aumentare l’ordinazione dei test di screening del cancro da parte dei medici, ma potrebbe essere necessario combinarli con altri interventi per migliorare il completamento dei pazienti.
References
- Publisher Full Text
- Screening for cancer: advice for high-value care from the American College of Physicians. Ann Intern Med. 2015; 162(10)DOI | PubMed
- Correlates of underutilization of colorectal cancer screening among U.S. adults, age 50 years and older. Prev Med. 2003; 36(1):85-91. DOI | PubMed
- Colorectal cancer deaths attributable to nonuse of screening in the United States. Ann Epidemiol. 2015; 25(3):208-213.e1. DOI | PubMed
- Explaining persistent under-use of colonoscopic cancer screening in African Americans: a systematic review. Prev Med. 2015; 71:40-48. DOI | PubMed
- Cervical cancer screening and prevention in 78 sexually transmitted disease clinics—United States, 2014-2015. Sex Transm Dis. 2017; 44(10):637-641. DOI | PubMed
- Publisher Full Text
- Publisher Full Text
- Cancer screening test use—United States, 2015. MMWR Morb Mortal Wkly Rep. 2017; 66(8):201-206. DOI | PubMed
- Nudge units to improve the delivery of health care. N Engl J Med. 2018; 378(3):214-216. DOI | PubMed
- Using active choice within the electronic health record to increase physician ordering and patient completion of high-value cancer screening tests. Healthc (Amst). 2016; 4(4):340-345. DOI | PubMed
- Effect of an automated patient dashboard using active choice and peer comparison performance feedback to physicians on statin prescribing: the PRESCRIBE cluster randomized clinical trial. JAMA Netw Open. 2018; 1(3)DOI | PubMed
- Using active choice within the electronic health record to increase influenza vaccination rates. J Gen Intern Med. 2017; 32(7):790-795. DOI | PubMed
- The impact of eHealth on the quality and safety of health care: a systematic overview. PLoS Med. 2011; 8(1)DOI | PubMed
- Overriding of drug safety alerts in computerized physician order entry. J Am Med Inform Assoc. 2006; 13(2):138-147. DOI | PubMed
- Identifying and establishing consensus on the most important safety features of GP computer systems: e-Delphi study. Inform Prim Care. 2005; 13(1):3-12. DOI | PubMed
- Variations in influenza vaccination by clinic appointment time and an active choice intervention in the electronic health record to increase influenza vaccination. JAMA Netw Open. 2018; 1(5)DOI | PubMed
- Association of primary care clinic appointment time with clinician ordering and patient completion of breast and colorectal cancer screening. JAMA Netw Open. 2019; 2(5):e193403-e193403. DOI | PubMed
- Methods for evaluating changes in health care policy: the difference-in-differences approach. JAMA. 2014; 312(22):2401-2402. DOI | PubMed
- Experimental and Quasi-Experimental Designs for Generalized Causal Inference. Houghton Mifflin: Boston, MA; 2001.
- Models for longitudinal data: a generalized estimating equation approach. Biometrics. 1988; 44(4):1049-1060. DOI | PubMed
- A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987; 40(5):373-383. DOI | PubMed
- An Introduction to the Bootstrap. Chapman & Hall: New York, NY; 1993. DOI
- Bootstrap Methods and Their Application. Cambridge University Press: New York, NY; 1997. DOI
- Natural and quasi-experiments in economics. J Bus Econ Stat. 1995; 13(2):151-161. DOI
- A randomized controlled trial of opt-in versus opt-out colorectal cancer screening outreach. Am J Gastroenterol. 2018; 113(12):1848-1854. DOI | PubMed
- Effect of physician notification regarding nonadherence to colorectal cancer screening on patient participation in fecal immunochemical test cancer screening: a randomized clinical trial. JAMA. 2017; 318(9):816-824. DOI | PubMed
- Effect of colonoscopy outreach vs fecal immunochemical test outreach on colorectal cancer screening completion: a randomized clinical trial. JAMA. 2017; 318(9):806-815. DOI | PubMed
Fonte
Hsiang EY, Mehta SJ, Small DS, Rareshide CAL, Snider CK, et al. (2019) Association of an Active Choice Intervention in the Electronic Health Record Directed to Medical Assistants With Clinician Ordering and Patient Completion of Breast and Colorectal Cancer Screening Tests. JAMA Network Open 2(11): e1915619. https://doi.org/10.1001/jamanetworkopen.2019.15619





