Abstract
Introduzione
Secondo le nuove linee guida per la gestione dei casi emanate dall’Organizzazione Mondiale della Sanità nel 2010, le persone che si presentano con la febbre in una clinica sanitaria nell’Africa subsahariana hanno maggiori possibilità di ricevere un test di diagnosi rapida (RDT) prima di ricevere un trattamento antimalarico(Organizzazione Mondiale della Sanità, 2015). Questo riduce l’eccessiva prescrizione di farmaci antimalarici ai pazienti non infetti, garantendo al contempo l’identificazione delle infezioni da brevetto e l’eliminazione dei parassiti attraverso il trattamento. Tuttavia, nelle aree altamente endemiche, le infezioni da malaria sono sia comuni che spesso asintomatiche(Bousema et al., 2014), il che significa che per molti pazienti che si presentano presso le strutture sanitarie, la loro febbre e la parassitemia non sono causalmente correlate.
L’ambiguità sulla causalità nei casi di febbre RDT-positiva è problematica sia dal punto di vista della sorveglianza della malattia che dal punto di vista del sistema sanitario. I sistemi di sorveglianza dei casi di routine riportano generalmente l’incidenza della malaria clinica in base ai conteggi di individui febbrili con una presunta o confermata infezione da malaria(Organizzazione Mondiale della Sanità, 2016). Se le infezioni malariche in molti di questi casi sono in realtà asintomatiche, allora le segnalazioni di casi che ne risultano rappresenteranno in modo eccessivo la malaria clinica, anche laddove i test RDT sono onnipresenti, portando a una sovrastima della morbilità dovuta alla malaria. Al contrario, le febbri causate da un altro agente patogeno, ma coincidenti con un’infezione di malaria, subiranno una sistematica sottovalutazione ai sensi di questo protocollo e di conseguenza il carico di malattia della malattia febbrile non malarica (NMFI) sarà sottovalutato. Nei casi in cui un individuo febbrile ha sia un’infezione di malaria che una NMFI, entrambe le infezioni possono essere contemporaneamente la causa della febbre. In effetti, è noto che le coinfezioni modulano sia il carico parassitario di entrambe le malattie sia la gravità della febbre dell’individuo (French et al., 2001; Hartgers e Yazdanbakhsh, 2006).
La diagnosi e la cura della NMFI è impegnativa, poiché i sintomi di molte di queste malattie possono essere non specifici e simili alla malaria, per esempio infezioni batteriche come la polmonite(Hildenwall et al., 2016; Källander et al., 2004) e la meningite (Gwer et al.,2007). Inoltre, i test diagnostici di routine non sono ancora stati sviluppati o non sono comuni per molte di queste malattie(Chappuis et al., 2013). Dal punto di vista dei sistemi sanitari, la gestione dei casi può essere inadeguata se gli individui che ricevono un risultato positivo di RDT ma che hanno una coinfezione con un altro agente patogeno non ricevono un trattamento efficace per la loro febbre. Per queste ragioni, c’è un’urgente necessità di comprendere il contributo della malaria alla malattia febbrile e come questa varia spazialmente e temporalmente nell’Africa endemica.
Stimare la prevalenza della febbre febbrile attribuibile alla malaria
Il tasso di febbre associato a (ma non necessariamente causato da) un’infezione malarica è stato dimostrato che è diminuito nel tempo in alcuni contesti, dimezzandosi tra il 1986 e il 2007 in una serie di studi sul campo(D’Acremont et al., 2010); una tendenza probabilmente guidata dalla diminuzione della prevalenza della malaria nell’ultima parte di quel periodo di tempo. La stima della frazione di queste febbri in cui l’infezione malarica è l’agente patogeno causale (cioè la frazione malaria-attribuibile) è impegnativa, e sono stati sviluppati vari metodi. Sono stati fatti tentativi per misurare la frazione attribuibile alla malaria in modo aritmetico usando prove caso-controllo, dove la differenza nel tasso di positività della malaria in individui febbrili e afebrili è usata per calcolare la frazione attribuibile(Ehrhardt et al., 2006; Schellenberg et al., 1994; Smith et al., 1994). In alternativa, sono stati sviluppati approcci di regressione logistica per stimare le frazioni causali sulla base di misurazioni della densità dei parassiti del sangue. Questo approccio è stato dimostrato in numerosi studi sul campo, compresi vari contesti in Kenya(Afrane et al., 2014; Bloland et al., 1999), in un’area di trasmissione stagionale in Burkina Faso(Bisoffi et al., 2010), e in un’indagine nazionale in Mozambico (Mabunda et al., 2009). Le simulazioni computazionali della trasmissione della malaria possono anche essere adattate per stimare un limite superiore sulla frazione di febbre attribuibile alla malaria a vari livelli di prevalenza del Plasmodium falciparum(PfPR), monitorando la proporzione di individui parassitosi positivi all’interno di una simulazione con un’infezione sintomatica (in questo caso, un’infezione sintomatica è sinonimo di febbre attribuibile alla malaria, poiché le coinfezioni con altri agenti patogeni non sono tipicamente simulate)(Griffin et al., 2010; Ross et al., 2006). Nessuno di questi approcci si avvale del ricco patrimonio di dati di indagini nazionali sulle famiglie che registrano lo stato di infezione da malaria e la storia della febbre che sono ora disponibili per diversi paesi e anni da fonti come il Programma DHS(DHS Program, 2017) e l’UNICEF Multiple Indicator Cluster Surveys(UNICEF,2017).
Uso dei dati delle indagini sulle famiglie per modellizzare la febbre imputabile alla malaria e la malattia febbrile non malaria
I dati dell’indagine casalinga sullo stato di infezione da malaria e l’anamnesi febbrile di due settimane non consentono di attribuire direttamente la causalità della malaria a livello individuale. Tuttavia, quando i dati di più individui sono combinati, allora il contributo causale delle infezioni da malaria alle febbri all’interno del gruppo può essere esplorato misurando la misura in cui le febbri sono più comuni negli individui infetti rispetto a quelli non infetti. Basandoci su questa logica intuitiva, abbiamo sviluppato un modello geospaziale multinazionale (descritto in dettaglio in Materiali e metodi) che utilizza i dati dell’indagine georeferenziata sulle infezioni malariche a livello individuale e sullo stato febbrile per dedurre la frazione a livello comunitario delle febbri positive alla malaria che sono causate da o coincidono con le infezioni malariche sottostanti, e successivamente per mappare queste quantità nell’Africa subsahariana. Questa raffinata comprensione del contributo della malaria rispetto ad altre cause alla malattia febbrile può migliorare la stima e l’interpretazione del carico di malattia e quindi informare la politica di gestione dei casi nell’Africa subsahariana.
Risultati
Panoramica dei modelli
Utilizzando un totale di 38 indagini sulle famiglie in 24 paesi dell’Africa sahariana raccolte tra il 2006 e il 2014, abbiamo raccolto 155.369 osservazioni di due settimane di prevalenza della febbre e di risultati diagnostici della RDT per P. falciparum nei bambini di 10.606 località con due variabili predittive modellate: prevalenza di P . fal ciparum nei bambini di età inferiore ai cinque anni(PfPR0-5); e idoneità alla febbre senza infezione da malaria. Il modello Bayesiano gerarchico finale ha previsto la proporzione di individui con febbre direttamente attribuibile alla malaria (di seguito Malaria Attributable Fever, MAF) e la proporzione di individui con febbre non attribuibile alla malaria (di seguito Non-Malarial Febrile Illness, NMFI) all’interno di ogni pixel 5 × 5 km attraverso le zone di trasmissione stabili di P. falciparum nel continente africano per ogni anno 2006-2014. Queste mappe sono state utilizzate per ricavare una serie di ulteriori metriche, come descritto di seguito. I dettagli della convalida del modello sono forniti in Materiali e metodi e nella Figura 1-figure supplement 1.
Prevalenza della febbre di tutte le cause
La prevalenza di tutte le cause della febbre è stata calcolata come la somma delle due metriche stimate dal modello: la prevalenza di P. falciparum malaria-attribuibile (MAF) e la malattia febbrile non malaria (NMFI). Nel 2014, la prevalenza della febbre di qualsiasi causa attraverso i limiti stabili della trasmissione di P. fal ciparum è stata del 31,0%, ed è aumentata leggermente nel periodo di studio, rispetto al 27,0% del 2006. I Paesi sono stati molto eterogenei nel loro carico febbrile complessivo, con il Niger (53,4%), il Gabon (44,9%) e la Nigeria (42,8%) che hanno avuto la più alta prevalenza di febbre per tutte le cause nel 2014. I Paesi con il carico febbrile più basso nello stesso anno sono stati lo Swaziland (4,60%), l’Eritrea (5,3%) e la Somalia (10,1%).
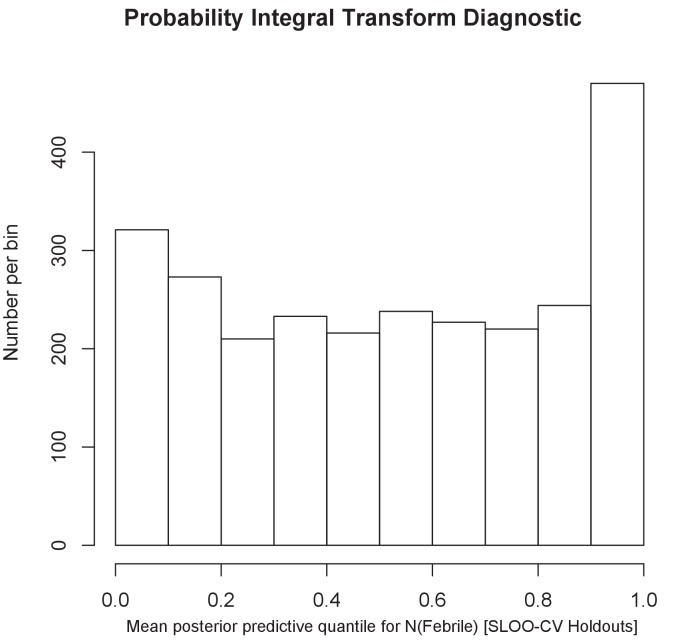
Figura 1-figure supplement 1.Figura 1—supplemento 1. Previsione della prevalenza della febbre di tutte le cause entro i limiti di una trasmissione stabile di P. falciparum nei bambini di età inferiore ai 5 anni nel 2014.l’istogramma dell’integrale di probabilità trasforma la diagnosi.La forma uniforme dell’istogramma mostra che le predizioni nei siti che hanno resistito al modello iniziale tratto dalla distribuzione posteriore prevista per la prevalenza della malattia febbrile hanno trovato un buon riscontro.

Figura 1-figura supplemento 1.Figura 1—supplemento alla figura 1. Previsione di una prevalenza della febbre a tutte le cause entro i limiti di una trasmissione stabile di P. falciparum nei bambini di età inferiore ai 5 anni nel 2014.l’istogramma dell’integrale di probabilità trasforma la diagnosi.La forma uniforme dell’istogramma mostra che le predizioni nei siti che hanno resistito al modello iniziale tratto dalla distribuzione posteriore prevista per la prevalenza della malattia febbrile hanno trovato un buon riscontro.

Figura 1-figura supplemento 1.L’istogramma della diagnostica di trasformazione integrale di probabilità.La forma uniforme dell’istogramma mostra che le predizioni nei siti che hanno resistito al modello iniziale disegnato dalla distribuzione posteriore prevista per la prevalenza della malattia febbrile corrispondevano bene.
Febbre malaria-attribuibile tra i bambini affetti da malaria
Nel 2014, si stima che meno di un terzo (28,0%) di tutte le febbri nei bambini di P. fal ciparum infetti da malaria al di sotto dei cinque anni sia attribuibile a P. falciparum in un dato periodo di due settimane. Questa frazione variava geograficamente, come mostrato nel grafico 2, con il maggiore contributo di MAF alle febbri positive alla malaria nel 2014 in Swaziland (86,9%), Eritrea (81,9%) e Somalia (69,9%) e il più basso in Niger (14,7%), Gabon (20,9%) e Nigeria (20,9%). Anche la frazione è variata nel tempo, passando dal 36,1% del 2006 al 28,0% del 2014. Le stime delle serie temporali per tutti i Paesi sono riportate nella Figura 3.
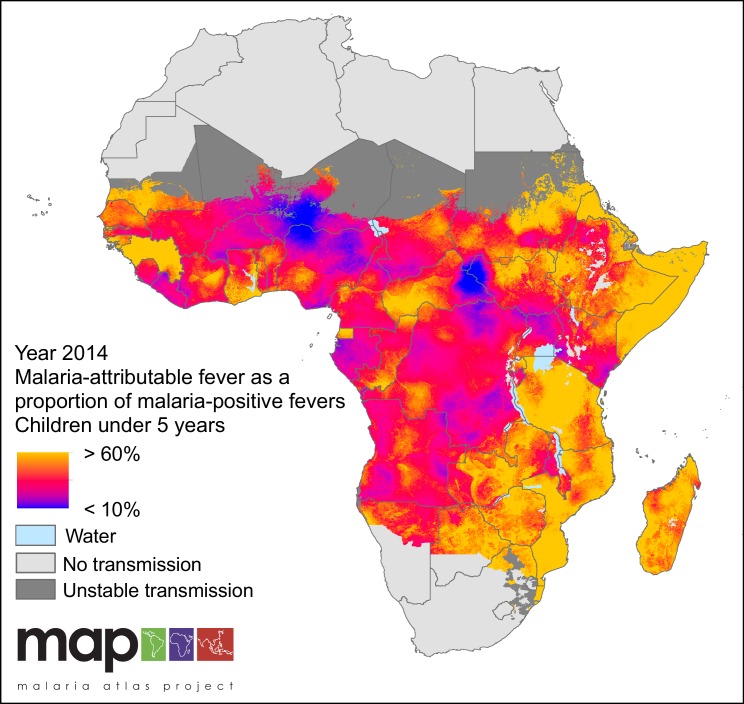
Figura 2.Previsione delle febbri attribuibili alla malaria in proporzione alle febbri positive alla malaria (bambini al di sotto dei 5 anni, 2014).Le previsioni sono mostrate entro i limiti della trasmissione stabile di P. falciparum.
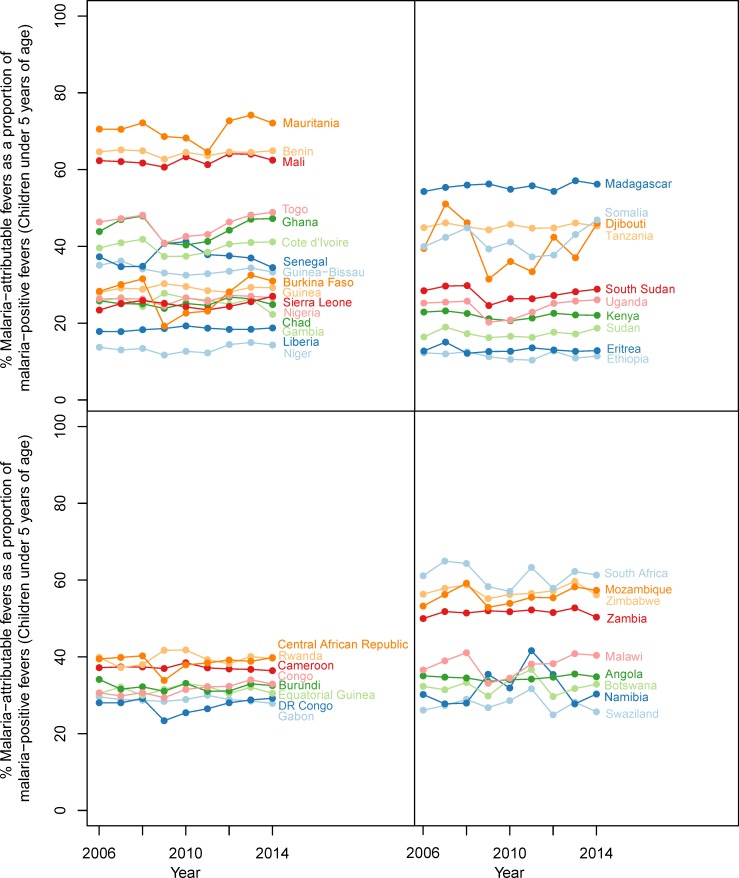
Figura 3.Febbre malaria-attribuibile come percentuale di febbri malariche positive (bambini < 5 anni, 2014).I valori riportati sono la media ponderata della popolazione di 43 paesi dell’Africa subsahariana nel periodo di studio 2006-2014. I paesi sono stati raggruppati per regione per migliorare la chiarezza.
È stato inoltre dimostrato che l’età del bambino ha un effetto sulla probabilità che un bambino sviluppi una febbre malarica. Il Grafico 4 mostra la relazione tra il PfPR0-5locale e la probabilità che nelle ultime due settimane si sviluppi una febbre malarica imputabile, per tutti i bambini di età inferiore ai cinque anni nel Grafico 4a e nei soggetti di età superiore e inferiore ai due anni nel Grafico 4b. Per tutti i bambini, la probabilità di una febbre attribuibile è cresciuta con il PfPR0-5, con un gradiente decrescente all’aumentare del PfPR0-5. Il Grafico 4b mostra che questa tendenza è vera anche per i bambini di età superiore ai due anni, ma la probabilità di una febbre attribuibile alla malaria aumenta linearmente con PfPR0-5per i bambini di età inferiore ai due anni.
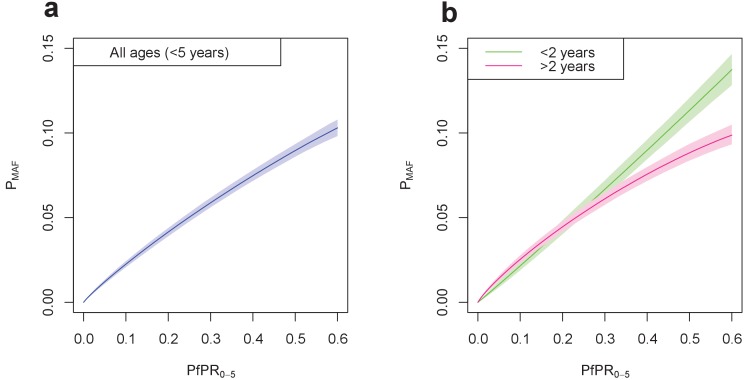
Grafico 4.Relazione finale tra PfPR0-5e probabilità di una febbre imputabile alla malaria (MAF) nelle ultime due settimane.(a) mostra questa relazione nei bambini di età inferiore ai cinque anni e(b) disaggregato in bambini di età inferiore ai due anni e bambini di età compresa tra i 2 e i 4 anni. La probabilità di MAF nelle ultime due settimane è maggiore per i bambini di età inferiore ai 2 anni rispetto ai bambini di età superiore ai 2 anni nelle aree con un PfPR0-5superiore a circa 0,3. Sono mostrati i valori mediani della distribuzione posteriore, con intervalli ombreggiati credibili al 95%.

Grafico 2.Febbre malarica prevedibile come percentuale di febbre malarica positiva (bambini sotto i 5 anni di età, 2014).Le previsioni sono mostrate entro i limiti della trasmissione stabile di P. falciparum.

Figura 3.Febbre malaria-attribuibile come percentuale di febbri malariche positive (bambini < 5 anni, 2014).I valori riportati sono la media ponderata della popolazione di 43 paesi dell’Africa subsahariana nel periodo di studio 2006-2014. I paesi sono stati raggruppati per regione per migliorare la chiarezza.

Figura 4.Figura 4. Relazione finale tra PfPR0-5e probabilità di febbre malarica (MAF) nelle ultime due settimane.(a) mostra questa relazione nei bambini di età inferiore ai cinque anni e(b) disaggregato in bambini di età inferiore ai 2 anni e bambini di età compresa tra i 2 e i 4 anni. La probabilità di MAF nelle ultime due settimane è maggiore per i bambini di età inferiore ai 2 anni rispetto ai bambini di età superiore ai 2 anni nelle aree con un PfPR0-5superiore a circa 0,3. Sono mostrati i valori mediani della distribuzione posteriore, con intervalli ombreggiati credibili al 95%.
Infezioni da malaria all’interno di tutte le febbri
Nel 2014, si stima che il 35,7% di tutte le febbri nei bambini sotto i cinque anni sia stato accompagnato da un’infezione da P. falciparum con brevetto RDT, e che questa frazione sia diminuita dal 48,5% del 2006. I Paesi con la più alta percentuale di febbri malariche positive nel 2014 sono stati la Repubblica Centrafricana (71,0%), la Guinea Equatoriale (66,2%) e la Guinea (65,7%) e i più bassi sono stati l’Etiopia (1,4%), il Botswana (1,6%) e lo Swaziland (2,9%). Il grafico 5 evidenzia la grande disparità tra la frazione di tutte le febbri positive alla malaria (35,7% a livello continentale nel 2014) e la frazione di tutte le febbri causalmente attribuibili alla malaria (10,0% a livello continentale nel 2014).
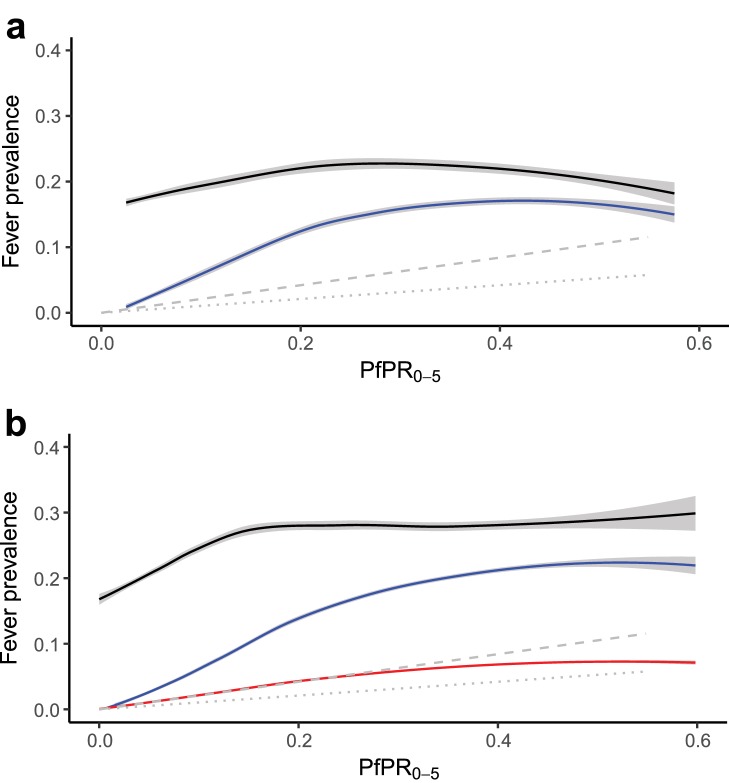
Figura 5-figure supplement 1.(a) Febbre prevista malaria positiva come proporzione di tutte le febbri;(b) febbre prevista malaria attribuibile alla malaria (MAF) come proporzione di tutte le febbri. Entrambe le mappe sono mostrate per l’anno 2014, per i bambini sotto i 5 anni di età e delimitate dai limiti di trasmissione stabile di P. falciparum.(a) Relazione dei dati di risposta tra le febbri all-cause (linea nera) e le febbri malariche positive (linea blu) e l’incidenza prevista (malattia sintomatica) per la durata delle ultime due o quattro settimane (linea tratteggiata grigia) e delle ultime zero o due settimane (linea tratteggiata grigia)* con PfPR0-5dai set di dati dell’indagine sulle famiglie; e(b) la relazione modellata tra febbre all-cause (linea nera), febbri positive alla malaria (linea blu) e febbri attribuibili alla malaria (linea rossa), e l’incidenza prevista nelle ultime due o quattro settimane (linea tratteggiata grigia) e nelle ultime zero o due settimane (linea tratteggiata grigia)* con PfPR0-5campionato da 10.000 pixel in strati raster previsti.Le linee medie sono state inserite utilizzando la regressione ponderata localmente e ombreggiate con intervalli di confidenza del 95%. *In entrambi i grafici, le linee di incidenza previste sono generate da un insieme di modelli di trasmissione che stimano la relazione tra la prevalenza e l’incidenza di P. falciparum, standardizzati per età da 0 a 4 anni(Cameron et al., 2015). La linea tratteggiata grigia rappresenta la percentuale stimata di bambini che nelle ultime due o quattro settimane hanno avuto un episodio clinico di malaria, mentre la linea tratteggiata grigia rappresenta la percentuale stimata di bambini che nelle ultime zero o due settimane hanno avuto un episodio clinico di malaria, ciascuno con una prevalenza crescente di P. fal ciparum. Una buona corrispondenza tra la MAF prevista e le stime del modello di trasmissione dell’incidenza clinica indica che il nostro modello ha una forte performance predittiva.

Figura 5-figure supplement 1.Entrambe le mappe sono mostrate per l’anno 2014,per i bambini al di sotto dei 5 anni di età e delimitate dai limiti di trasmissione stabile di P. falciparum.(a) Relazione dei dati di risposta tra le febbri all-cause (linea nera) e le febbri malariche positive (linea blu) e l’incidenza prevista (malattia sintomatica) per la durata delle ultime due o quattro settimane (linea tratteggiata grigia) e delle ultime zero o due settimane (linea tratteggiata grigia)* con PfPR0-5dai set di dati dell’indagine sulle famiglie; e(b) la relazione modellata tra febbre all-cause (linea nera), febbri positive alla malaria (linea blu) e febbri attribuibili alla malaria (linea rossa), e l’incidenza prevista nelle ultime due o quattro settimane (linea tratteggiata grigia) e nelle ultime zero o due settimane (linea tratteggiata grigia)* con PfPR0-5campionato da 10.000 pixel in strati raster previsti.Le linee medie sono state inserite utilizzando la regressione ponderata localmente e ombreggiate con intervalli di confidenza del 95%. *In entrambi i grafici, le linee di incidenza previste sono generate da un insieme di modelli di trasmissione che stimano la relazione tra la prevalenza e l’incidenza di P. falciparum, standardizzati per età da 0 a 4 anni(Cameron et al., 2015). La linea tratteggiata grigia rappresenta la percentuale stimata di bambini che nelle ultime due o quattro settimane hanno avuto un episodio clinico di malaria, mentre la linea tratteggiata grigia rappresenta la percentuale stimata di bambini che nelle ultime zero o due settimane hanno avuto un episodio clinico di malaria, ciascuno con una prevalenza crescente di P. fal ciparum. Una buona corrispondenza tra la MAF prevista e le stime del modello di trasmissione dell’incidenza clinica indica che il nostro modello ha una forte performance predittiva.

Figura 5-figure supplement 1.(a) Relazione dei dati di risposta tra febbre all-cause (linea nera) e febbri positive alla malaria (linea blu) e incidenza prevista (malattia sintomatica) per la durata delle ultime due-quattro settimane (linea tratteggiata grigia) e delle ultime zero-due settimane (linea tratteggiata grigia)* con PfPR0-5dai dataset di indagini casalinghe; e(b) la relazione modellata tra febbre all-cause (linea nera), febbri positive alla malaria (linea blu) e febbri attribuibili alla malaria (linea rossa), e l’incidenza prevista nelle ultime due o quattro settimane (linea tratteggiata grigia) e nelle ultime zero o due settimane (linea tratteggiata grigia)* con PfPR0-5campionato da 10.000 pixel in strati raster previsti.Le linee medie sono state inserite utilizzando la regressione ponderata localmente e ombreggiate con intervalli di confidenza del 95%. *In entrambi i grafici, le linee di incidenza previste sono generate da un insieme di modelli di trasmissione che stimano la relazione tra la prevalenza e l’incidenza di P. falciparum, standardizzati per età da 0 a 4 anni(Cameron et al., 2015). La linea tratteggiata grigia rappresenta la percentuale stimata di bambini che nelle ultime due o quattro settimane hanno avuto un episodio clinico di malaria, mentre la linea tratteggiata grigia rappresenta la percentuale stimata di bambini che nelle ultime zero o due settimane hanno avuto un episodio clinico di malaria, ciascuno con una prevalenza crescente di P. fal ciparum. Una buona corrispondenza tra la MAF prevista e le stime del modello di trasmissione dell’incidenza clinica indica che il nostro modello ha una forte performance predittiva.
Contributo della malattia febbrile non malaria a tutte le febbri
La malattia febbrile non malaria (IFN) si presenta in due forme: (i) febbre in individui negativi alla malaria e (ii) febbre in individui positivi alla malaria di P. falciparum dove la febbre coincide con ma non è causata dall’infezione malarica (di seguito denominata Febbre da Malaria-Coincidente, MCF). La somma di questi due tipi di malattia febbrile è qui indicata come NMFI e viene stimata direttamente dal modello. La frazione di tutte le febbri dovute all’IFN è aumentata nel periodo di studio, passando dall’82,5% nel 2006 al 90,0% nel 2014. I Paesi con la più grande frazione di IFN a tutte le febbri sono stati l’Etiopia (99,4%), il Botswana (99,2%) e il Gambia (98,5%), mentre i più piccoli sono stati la Guinea (58,2%), la Guinea Equatoriale (60,4%) e la Repubblica Centrafricana (64,6%).
La percentuale di MCF all’interno della NMFI è scesa nel periodo di studio, dal 37,6% nel 2006 al 28,6% nel 2014. I Paesi che hanno avuto la più alta prevalenza di MCF all’interno dell’IFNM sono stati la Repubblica Centrafricana (55,2%), il Burkina Faso (54,9%) e la Guinea Equatoriale (44,2%), e i Paesi con la più bassa prevalenza di MCF all’interno dell’IFNM sono stati lo Swaziland (0,4%), il Botswana (0,8%) e l’Etiopia (0,8%). Un corollario di ciò è che Swaziland, Botswana ed Etiopia sono stati anche i Paesi con la più bassa percentuale di individui positivi alla malaria all’interno dei casi nazionali di IFNM. La stima posteriore della prevalenza di IFN nei bambini di età inferiore ai cinque anni entro i limiti spaziali della trasmissione di P. falciparum è mostrata nel grafico 6.
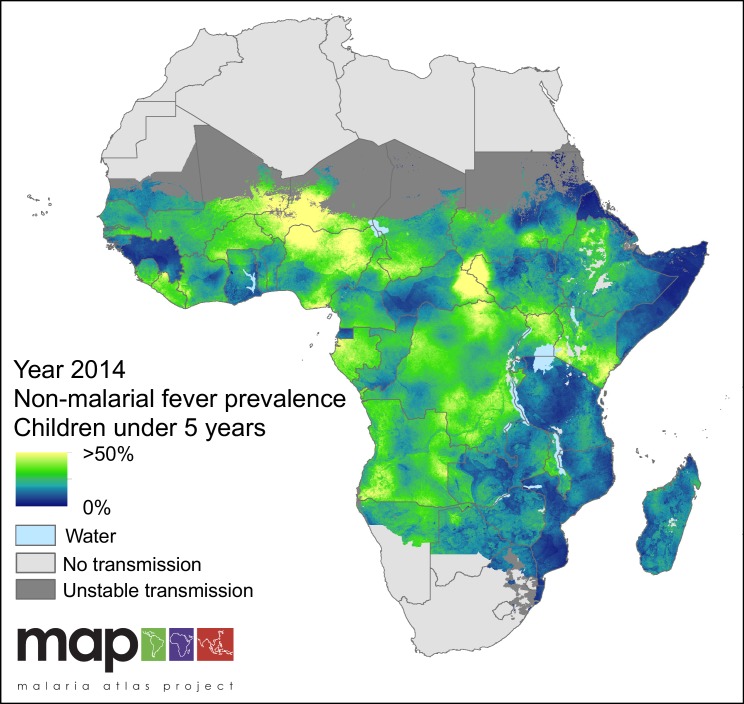
Grafico 6.Prevedibile prevalenza della malattia febbrile non malaria (IFN) nei bambini di età inferiore ai 5 anni.La prevalenza dell’IFNM è definita come la somma della prevalenza della malattia febbrile senza infezione da P. fal ciparum malaria e della prevalenza della malattia febbrile coincidente con, ma non causata da, un’infezione da P. falciparum malaria (MCF), per i bambini al di sotto dei 5 anni di età e delimitata entro i limiti spaziali di trasmissione stabile di P . fal ciparum nel 2014.
I dettagli completi delle stime a livello nazionale di MAF, MCF, febbri malariche positive e NMFI si trovano nel file supplementare 1. Un grafico che descrive in dettaglio la relazione tra febbre all-cause, febbri malariche positive e MAF con intensità di trasmissione di P. falciparum variabile sia nei dati di risposta che nelle previsioni si può trovare nella Figura 5-figure supplement 1. Questi grafici delle nostre stime sono mostrati con stime sovrapposte dell’incidenza clinica per la durata degli ultimi zero a due e da due a quattro settimane, con un aumento del PfPR0-5da un insieme di modelli di trasmissione(Cameron et al., 2015). La ripartizione del contributo dell’NMFI, delle febbri da malaria-coincidente e delle febbri senza un’infezione da malaria brevettata a tutte le cause della febbre varia considerevolmente da paese a paese; questa ripartizione è mostrata in dettaglio per il 2014 nel file supplementare 5.

Figura 6.Prevalenza prevista della malattia febbrile non malaria (NMFI) nei bambini di età inferiore ai 5 anni.La prevalenza dell’IFNM è definita come la somma della prevalenza della malattia febbrile senza infezione da malaria P. falciparum e della prevalenza della malattia febbrile coincidente con, ma non causata da, un’infezione da malaria P. falciparum (MCF), per i bambini di età inferiore ai 5 anni e delimitata entro i limiti spaziali di trasmissione stabile di P . fal ciparum nel 2014.
Discussione
L’analisi qui presentata mostra che, sebbene la percentuale di casi di febbre accompagnati da un’infezione da RDT-patente P. falciparum rimanga elevata, solo circa un terzo di queste febbri sono causalmente attribuibili alla malaria. La maggior parte delle malattie febbrili in Africa è causata da agenti patogeni diversi dalla malaria P. fal ciparum, anche in aree dove la malaria è altamente endemica, e la proporzione di tutte le febbri causate dalla NMFI è aumentata dal 2006. Stimiamo qui che in un tipico periodo di due settimane nel 2014 un bambino su quattro di età inferiore ai cinque anni che risiede nei limiti di una trasmissione stabile della malaria subirà una febbre non causata dalla malaria di P. fal ciparum, mentre solo un bambino su 32 soffrirà di febbre direttamente causata da P. falciparum. Mostriamo che le stime attuali del carico di malaria in Africa, basate su casi di febbre RDT-positivi, possono sovrastimare il carico fino a due terzi, e il livello di sovrastima è probabilmente molto eterogeneo tra i diversi Paesi(Figura 3). Ad esempio, paesi come il Niger, il Gabon e la Nigeria, dove meno del 21% dei casi di febbre malarica positiva sono causalmente attribuibili alla malaria, possono sovrastimare sostanzialmente la morbilità causata dalla malaria (e sottovalutare sistematicamente il peso di altre malattie che possono essere coinfezioni e causali). Inoltre, questi risultati hanno implicazioni per l’efficacia del trattamento ricevuto al punto di cura, poiché una parte sostanziale delle febbri RDT-positive è probabilmente coincidente e causata da una IFNM. Le nostre stime della prevalenza della MAF nelle ultime due settimane sono paragonabili alle stime dell’incidenza clinica di un insieme di modelli di trasmissione(Figura 5-figure supplement 1) (Cameronet al., 2015), anche se le nostre stime corrispondono più strettamente alle stime del modello di trasmissione della prevalenza della malattia febbrile della durata delle ultime due-quattro settimane, piuttosto che delle ultime zero-due. Per 13 delle 38 indagini sulle famiglie utilizzate in questa analisi è stato disponibile il numero di giorni dall’inizio della febbre del bambino. I bambini di queste indagini hanno avuto la febbre in media per 5,38 giorni (±3,85 giorni) prima dell’intervista. Questa disparità tra la durata della febbre nelle nostre stime e le stime dei modelli di trasmissione può forse essere spiegata dalla natura trasversale delle indagini; i modelli di trasmissione stimano l’intero decorso della febbre senza trattamento, mentre le indagini domestiche mirano a ridurre la febbre durante l’intervista somministrando ai bambini febbricitanti farmaci appropriati.
Il numero totale di casi di febbre accompagnati da un’infezione da P. falciparum da brevetto RDT (RDT-patent P. falciparum ) è diminuito sostanzialmente nel periodo di studio(dal 48,5% nel 2006 al 35,7% nel 2014), in relazione al calo del PfPR0-5nello stesso periodo(Bhatt et al.,2015; Smith et al., 2007). L’unico Paese con un notevole aumento delle febbri malariche positive nel periodo di studio è stato il Gabon, che ha anche registrato un aumento del PfPR0-5tra il 2006 e il 2014.
Questo approccio di modellazione utilizza in modo innovativo i dati di indagini casalinghe; non sono stati fatti tentativi precedenti di misurare la prevalenza della febbre infantile (e la causalità della malaria/non-malaria della febbre) da indagini che hanno registrato un’anamnesi febbrile di due settimane. Questo approccio presenta alcuni svantaggi: si basa sul richiamo di due settimane di febbre da parte di chi si prende cura del bambino, la cui accuratezza può essere soggetta a pregiudizi quali (i) il tempo trascorso dalla febbre; (ii) la frequenza degli episodi febbrili del bambino, (iii) lo stato economico della famiglia e (iv) anche il sesso del bambino (Das et al.,2012; Rockers e McConnell, 2017). Includiamo anche la febbre causata dalla malaria P. vivax come IFN per definizione, poiché non tutte le indagini sulle famiglie testate per P. vivax con RDT e quindi in questa analisi sono stati utilizzati solo i risultati di P. falciparum. È improbabile che ciò abbia un effetto rilevante sulla maggior parte dell’Africa a causa dell’elevata negatività di Duffy, con conseguente instabilità della trasmissione di P . viva x, e livelli molto bassi di trasmissione stabile in Madagascar e nel Corno d’Africa(Gething et al., 2012; Howes et al., 2011). Uno svantaggio dell’utilizzo dei dati dell’indagine sulle famiglie per generare previsioni come quelle qui presentate è che i dati dell’indagine intervistano i bambini in un giorno entro il periodo di tempo in cui viene condotta l’indagine (tipicamente da due a quattro mesi). Non è necessariamente il caso che i bambini che presentano un’infezione da malaria brevettata ma non hanno mai, o non avranno mai, una storia di infezione oltre due settimane prima della data dell’indagine non abbiano mai sviluppato, o non svilupperanno mai, una febbre malarica imputabile, e potrebbero averlo già fatto al di fuori del periodo di richiamo di due settimane dell’intervista dell’indagine. Inoltre, le coinfezioni possono portare a una febbre che non si sarebbe verificata se il bambino avesse avuto solo una monoinfezione da malaria o l’NMFI(French et al., 2001; Hartgers e Yazdanbakhsh, 2006). Questo studio non considera gli effetti della co-morbilità in questo senso, e le febbri che rientrano in questa categoria sono contabilizzate all’interno dell’NMFI. Inoltre, non includiamo variabili predittive a risoluzioni al di sotto del livello dei pixel (ad esempio, a livello individuale o domestico), che probabilmente sono significativamente predittive della prevalenza sia della MAF che dell’IFNM. I predittori, come il patrimonio delle famiglie e altri indicatori sanitari associati, sono disponibili all’interno degli insiemi di dati delle indagini sulle famiglie, ma a causa dell’eterogeneità delle variabili a livello individuale misurate in diverse indagini e della mancanza di un insieme comune di informazioni direttamente rappresentative di tali variabili al di fuori dei paesi oggetto di indagine, non le abbiamo incorporate nel modello attuale.
La bassa prevalenza di febbri malariche positive a tutti i livelli di endemicità di P. falciparum suggerisce che il solo rilevamento passivo dei casi potrebbe non essere sufficiente ad arrestare la trasmissione della malaria, in quanto molti bambini infetti sono afebri in qualsiasi momento (indipendentemente dal fatto che la loro febbre sia attribuibile o meno all’infezione malarica). Inoltre, questo studio stima la prevalenza della MAF nei bambini di età inferiore ai due anni e tra i due e i quattro anni. Troviamo che la relazione tra prevalenza di MAF e PfPRnon è equivalente in tutte le fasce d’età(Grafico 4), con bambini di età inferiore ai due anni che hanno una maggiore probabilità di sviluppare una febbre attribuibile alla malaria rispetto ai bambini di età superiore ai due anni nelle aree in cui il PfPR0-5è superiore al 30%. Per i bambini più grandi che vivono in zone con un alto livello di PfPR, una percentuale più alta della popolazione avrà acquisito l’immunità all’infezione da malaria(Doolan et al., 2009), e quindi potrebbe essere meno probabile che si presenti una febbre malarica attribuibile. Sebbene ci sia incertezza sulla durata dell’immunità alla malaria(Filipe et al., 2007; Wipasa et al., 2010), in aree di rapido declino della prevalenza della malaria che si stanno ora muovendo verso l’eliminazione, questa immunità residua acquisita può presentare problemi per l’eliminazione se i programmi si basano sulla rilevazione passiva dei casi e sul trattamento per arrestare la trasmissione. Anche in questo caso, la limitazione delle nostre stime che utilizzano una finestra di due settimane per la segnalazione dei sintomi significa che, per affermare con certezza che la rilevazione passiva dei casi sarebbe insufficiente ad arrestare la trasmissione, sarebbe necessaria anche l’evidenza di un’alta prevalenza di infezioni mai-sintomatiche.
Malgrado tutti i Paesi in cui la malaria è endemica adottino ora la politica ufficiale di diagnosi parassitaria dei casi sospetti di malaria prima di emettere antimalarici, un gran numero di casi sospetti di malaria non riceve ancora un test diagnostico prima del trattamento(Hertz et al., 2013; Organizzazione Mondiale della Sanità, 2015). Questa percentuale è diminuita nel corso del periodo di tempo di questo studio, passando dal 64% dei casi sospetti che non ricevono un test diagnostico nel 2005 ad appena il 35% nel 2014(World Health Organization, 2015). Le ragioni di questa alta percentuale di casi sospetti che non ricevono una diagnosi basata sul parassita risiedono principalmente nella limitazione delle risorse nelle cliniche sanitarie rurali dei Paesi endemici della malaria(Ghai et al., 2016). Questa percentuale rimanente di IFNM che si presume sia causata dalla malaria, e quindi trattata con un antimalarico, aggrava il problema dell’eccessiva prescrizione di antimalarici. Enumerando la proporzione di NMFI, questo studio fornisce la prova della necessità di testare gli individui febbrili per la parassitemia, ma può anche essere utilizzato per identificare diversi contesti geografici e di malaria dove la somministrazione di antimalarici in assenza di un test positivo per P. falciparum è meno giustificata.
Questa serie di mappe dimostra la necessità di migliori test diagnostici per altri agenti patogeni che causano la NMFI in Africa, che a loro volta porteranno a una migliore comprensione della gamma di malattie che costituiscono la frazione non malarica della prevalenza della febbre. Mentre la distribuzione spaziale degli agenti patogeni che causano la NMFI è in gran parte sconosciuta, i dati di occorrenza per queste malattie stanno diventando sempre più disponibili, in particolare nel contesto dell’identificazione di malattie con presentazioni sintomatiche simili alla malaria. Il Worldwide Antimalarial Resistance Network (WWARN) raccoglie ora le prove cliniche della malattia febbrile non malarica (NMFI) causata da malattie tropicali trascurate da studi di casi di diagnosi febbrili tra pari di tutto il mondo endemico della malaria(Worldwide Antimalarial Resistance Network, 2017). La raccolta di questi studi ha lo scopo di fornire una panoramica della presenza di agenti patogeni che causano la febbre in aree di endemicità sovrapposte alla malaria, ma attualmente non può essere utilizzata per quantificare la distribuzione spazio-temporale della NMFI, né può essere utilizzata per misurare il contributo individuale di ciascuna malattia come causa di fondo della malattia febbrile. Ad esempio, un’importante revisione di 146 studi di casi nella regione del Mekong nel Sud-Est asiatico(Acestor et al., 2012), ha mostrato che la diagnosi errata e il maltrattamento della febbre era un risultato comune per gli individui che erano coinfetti da malaria e altre malattie con sintomi sovrapposti (ad esempio, il virus della febbre dengue, le specie Orientia tsutsugamushi e Rickettsia ). Oltre a implicare una potenziale sopravvalutazione del peso della malaria in passato, i risultati di questo studio suggeriscono che le attuali linee guida dell’OMS per la gestione integrata delle malattie infantili (IMCI) non sono attualmente ottimali per il trattamento della febbre non malarica. Mentre il trattamento delle infezioni malariche positive è la strategia corretta per rallentare la trasmissione della malaria, rimuovere le febbri malariche dalla popolazione e ridurre il serbatoio di individui infetti che perpetuano la trasmissione; le procedure attuali possono portare a una cattiva gestione sistematica della NMFI. Questo studio mostra la necessità di aumentare gli sforzi per sviluppare e distribuire la diagnostica di routine per gli agenti patogeni che causano la NMFI.
Materiali e metodi
Dati dell’indagine sulle famiglie
Trentotto indagini georeferenziate, trasversali e rappresentative a livello nazionale, sulla prevalenza della malaria nei bambini di età inferiore ai cinque anni in 24 Paesi dell’Africa subsahariana sono state ottenute dal database del Progetto Atlante della malaria(Guerra et al., 2007; Progetto Atlante della malaria, 2017). Queste indagini provengono da una varietà di fonti come il Programma DHS, le Indagini a grappolo a indicatori multipli dell’UNICEF e i Ministeri della Sanità nazionali nei Paesi in cui la malaria è endemica. I dettagli completi delle indagini utilizzate si trovano nel file supplementare 2.
In queste indagini, è stato prelevato un campione di sangue da tutti i bambini presenti e testato per la ricerca di parassiti della malaria sia con una microscopia RDT che con una microscopia con colorazione Giemsa. In questo caso, abbiamo utilizzato il risultato diagnostico derivato dalla RDT come indicatore della positività della malaria nelle ultime due settimane, per ridurre la possibilità che un’infezione recente sia stata eliminata tramite la terapia combinata con artemisinina (ACT) (e quindi si presenti come risultato negativo al microscopio). Le RDT offrono una rappresentazione più accurata dell’infezione di due settimane rispetto alla microscopia a causa della persistenza della proteina II ricca di istidina nel sangue per un massimo di 14 giorni dopo l’eliminazione del parassita con ACT(Mayxay et al., 2001). Risultati della storia diagnostica e della febbre da un totale di 155.369 bambini che sono stati aggregati entro 5 × 5 km di cellule raster, per un totale di 10.606 punti di dati. Oltre agli esiti dell’anamnesi diagnostica e dell’anamnesi febbrile, è stato estratto anche il quintile di ricchezza (cioè più povero, più povero, medio, più ricco, più ricco, più ricco) del nucleo familiare dell’individuo per essere utilizzato come predittore di febbre a livello familiare nel modello multinomiale finale.
Covariates
Le previsioni spazio-temporali indipendenti, basate su un modello indipendente, sia per la prevalenza dell’infezione da P. falciparum(PfPR0-5) sia per l’idoneità ambientale per le febbri di fondo (non malariche) nei bambini di età inferiore ai cinque anni in tutta l’Africa per ogni anno nell’arco dei dati dell’indagine sulle famiglie (2006-2015) sono state costruite come covariate da utilizzare nel modello multinomiale finale.
La covariata PfPR0-5è stata generata per ogni anno utilizzando le previsioni modellate PfPR2-10di PfPRafricano brevettato dal Malaria Atlas Project(Bhatt et al.., 2015), standardizzata per età fino a 0-5 anni utilizzando il pacchetto “agestand” in R, basato su una procedura di standardizzazione dell’età precedentemente descritta per la PfPR (Smith etal., 2007), e trasformata per predire la prevalenza basata sulla RDT attraverso una relazione microscopia-to-RDT identificata in lavori precedenti (Mappin et al., 2015).
Prima di questo studio, non esistevano stime mappate dell’idoneità ambientale per la febbre di fondo per il continente africano, quindi è stata costruita una stima modellata dell’idoneità ambientale per la febbre di fondo utilizzando un modello ad albero di regressione potenziato (BRT). L’approccio BRT genera un modello di regressione flessibile in due fasi. Inizialmente, i dati di risposta sono divisi ricorsivamente per variabili predittive, dove le variabili predittive che massimizzano l’omogeneità dei dati di risposta divisi sono selezionate più frequentemente nelle fasi successive. Questo è seguito da un passo “boosting”, dove i modelli dell’albero di regressione sono combinati per ridurre la devianza predittiva complessiva del modello (Elith et al., 2008), e ad ogni passo iterativo viene effettuata una convalida incrociata con un sottoinsieme casuale per evitare l’overfitting (Bhatt et al., 2013).
In primo luogo, è stato costruito un set di dati di formazione, costituito da un sottoinsieme del set di dati dell’indagine sulle famiglie in cui sono state rimosse le celle di indagine con dieci o meno individui testati, al fine di aumentare l’affidabilità dei valori di prevalenza osservati. Questa procedura ha ridotto il numero finale di punti di dati del dataset di formazione a 5320. La prevalenza della febbre di fondo è stata ottenuta in ogni punto di dati attraverso l’aggregazione di individui con febbre nelle due settimane precedenti senza un’infezione da malaria brevettata.
È stata assemblata un’ampia serie di potenziali covariate ambientali e socio-demografiche, come descritto altrove(Weiss et al., 2015). In breve, superfici con risoluzione di 5 × 5 km in tutto il continente africano di diversi tipi di covariate ambientali e sociodemografiche: altitudine, copertura del suolo, densità di popolazione, precipitazioni, indice di vegetazione migliorata (EVI), temperatura della superficie del suolo (LST), indice di idoneità alla temperatura di P. falciparum (TSI) (Weiss et al.,2014), umidità del cappello tassellato (TCW), luminosità del cappello tassellato (TCB), luci notturne, Global Urban Footprint(Esch et al., 2012) e indicatori di povertà e qualità sanitaria a livello nazionale della Banca Mondiale(Banca Mondiale, 2017) sono stati ottenuti dal database del progetto Malaria Atlas Project e sfruttati attraverso la costruzione di sintesi spaziali a livello di pixel (massimo, medio, minimo, deviazione standard e intervallo). Queste sintesi hanno prodotto un totale di 986 covariate spaziali e temporali da cui abbiamo estratto i risultati per ciascuno dei 5320 punti di risposta georeferenziati.
Per ridurre il numero di covariate è stato costruito un modello esplorativo BRT utilizzando la prevalenza della febbre di fondo come variabile di risposta e le covariate come variabili predittrici utilizzando la funzione ‘gbm.step’ nel pacchetto ‘dismo’ in R(Elith et al., 2008). Il modello BRT è stato parametrizzato con una complessità ad albero di 5, un tasso di apprendimento di 0-05, una frazione di hold-out di 0-05 e una struttura di errore all’interno della famiglia ‘gaussiana’ dopo un’adeguata trasformazione inversa-sigmoide delle prevalenze di febbre di fondo osservate. Ciascuna delle 986 covariate è stata classificata in base ai loro contributi al modello esplorativo montato. Per ridurre la ridondanza, ogni variabile all’interno della suite assemblata di covariate è stata testata per la colliarità con ogni altra variabile. Le covariate sono state considerate collineariate se esisteva una correlazione superiore a 0,7 tra le due covariate, e quando è stata identificata la collinearità è stata mantenuta solo la covariata di rango superiore. Questo approccio ha lasciato un dataset finale di 174 variabili predittrici per ciascuno dei 5320 punti di dati di risposta.
Il modello finale, utilizzando il set ridotto di 174 variabili predittrici non lineari, è stato dotato di 2000 alberi, una complessità di 5 alberi e un tasso di apprendimento ridotto di 0,01 (la riduzione del tasso di apprendimento migliora le prestazioni del modello[Elith et al., 2008]). Un elenco delle 174 variabili predittrici e del contributo di ciascuna variabile al modello finale utilizzato si trova nel file supplementare 3. Le previsioni sull’idoneità ambientale per la febbre di fondo tra i bambini sotto i cinque anni per ogni mese tra gennaio 2006 e dicembre 2014 in tutta l’area di trasmissione stabile della malaria in Africa sono state generate utilizzando il modello BRT e le 174 variabili predittrici. Per una serie di variabili predittrici, i dati non erano disponibili a novembre e dicembre 2014, quindi sono stati utilizzati i dati dello stesso mese dell’anno precedente. Le previsioni annuali per il 2006-2014 sono state generate come media di ogni previsione mensile da utilizzare nel modello multinomiale. Le lacune negli strati di previsione risultanti, causate da piccoli vuoti negli strati covariariariani rilevati a distanza, sono state colmate mediante scansione ricorsiva attraverso ogni cella raster per cella, e riempiendo le celle senza dati con la media del primo strato di celle circostanti fino a quando non sono rimasti vuoti.
Modello multinomiale
È stato costruito un set di dati di formazione per il modello multinazionale a partire da tutti i 10.606 punti del set di dati dell’indagine sulle famiglie. Di questi punti, il 25% (2.652) è stato selezionato per il set di dati di holdout, dove la probabilità di selezione era direttamente proporzionale alla distanza del punto più vicino, per evitare il raggruppamento di punti di holdout in aree con una fitta copertura di dati. Il restante 75% dei punti (7.954) è stato utilizzato nel set di dati di formazione.
I dati osservati in ogni sito, i (un pixel di 5 × 5 km), con gli individui intervistati di Ntot.i possono essere rappresentati come una tabella categorica a due a due dei conteggi secondo lo stato febbrile (febbrile o afebrile) e lo stato del parassita P. falciparum basato su RDT (positivo o negativo). Il modello bayesiano gerarchico che costruiamo qui prende quindi una probabilità di alto livello con distribuzione multinomiale che ha quattro parametri sconosciuti, {q1i,q2i,q2i,q3i,q4i}, che descrivono la proporzione prevista di conteggi in ogni categoria; cioèNfeb. & pos.i,Nfeb. & neg.i,Nafeb. & pos.i,Nafeb. & pos.i,Nafeb. & neg.i] ∼ Multinomiale[{q1i,q2i,q3i,q4i}|Ntot.i].
Poiché ogni proporzione prevista deve essere compresa tra zero e uno, mentre la loro somma congiunta è strettamente unitaria, la dimensione effettiva dei parametri sconosciuti è qui tre, con vincolo al 3-semplice standard. La nostra parametrizzazione prende tre componenti di conseguenza, che definiamo sia per rispettare questi vincoli, sia per rappresentare gli obiettivi chiave della nostra inferenza, come mostrato nella Tabella 1.
| Pf pos. | Pf neg. | |
|---|---|---|
| Febrile |
q1i=ppos.i(rmafi(1-pbgi)+pbgi) |
q2i=(1-ppos.i)pbgi |
| Afebrile |
q3i=ppos.i(1-rmafi)(1-pbgi) |
q4i=(1-ppos.i)(1-pbgi) |
Qui ppos.i è la prevalenza prevista di parassiti della malaria nei bambini di età inferiore ai cinque anni, pbgi è la prevalenza prevista di febbre di fondo (entro una finestra di due settimane) nella stessa coorte, e rmafi fornisce la percentuale prevista di P. falciparum positivi che riportano una febbre attribuibile alla malaria. Per convenzione (e in linea con i nostri obiettivi) definiamo la prevalenza di queste ‘febbri attribuibili alla malaria’, pmafi, come pmafi=ppos.irmafi(1-pbgi) ; cioè escludendo le febbri causali ‘coesistenti’ con una febbre di fondo.
La nostra rappresentazione della prevalenza locale dei parassiti nei bambini al di sotto dei cinque anni di età assume la forma di un modello lineare generalizzato spaziale (GLM) in cui la trasformata di logit della prevalenza prevista dal cubo spazio-temporale MAP PfPR2-10(Bhatt et al., 2015), standardizzata per età fino a PfPR0-5(Smith et al., 2007), è utilizzata come un predittore lineare per la trasformazione di logit della prevalenza al di sotto dei cinque anni, aumentata con un campo casuale gaussiano latente (spaziale) gaussiano (GRF). Cioè,logit ppos.i=logit PfPRMAPi+fx(i),f ∼ GRFθ.
Un modello identico è usato per il tasso di febbre di fondo in questa coorte, tranne che la variabile predittrice è ora il logit dell’idoneità ambientale per le febbri di fondo previste dal modello BRT sopra delineato. Quindi,logit pbgi=logit FEVBRTi+gx(i),g ∼ GRFϕ.
Il nostro modello per la proporzione di parassiti positivi con febbre malarica causale è una semplice dipendenza quadratica dalla prevalenza locale, motivata dalla forma osservata in un modello di trasmissione precedentemente descritto(Maire et al., 2006; Ross et al., 2006; Smith et al., 2006a; Smith et al., 2006b). Vale a dire, logit rmafi=δ+ψ× logit ppos.i+ξ×(logit ppos.i)2.
Per la trattabilità computazionale adottiamo un’approssimazione Gaussiana Markov Random Field (GMRF) ai componenti GRF continui del nostro modello utilizzando la versione per i GRF Matern identificati da Lindgren et al.(Lindgren et al., 2011) dal pacchetto INLA(Rue et al., 2009). L’implementazione di questo modello richiede la costruzione di una tassellazione a maglie che racchiuda il continente africano (più il Madagascar) che eseguiamo anche con il pacchetto INLA utilizzando nodi a maglie 6280. Abbiamo fissato la scorrevolezza di entrambi i GMRF utilizzati nel nostro modello a ν=1 (α=2,d=2) e abbiamo impostato (debolmente informativo) i priori Normal sul logaritmo degli iperparametri per ciascuno, κ (cioè,22×inverso) e τ (cioè, varianza inversa). Infine, completiamo il nostro modello mettendo i priori sull’intercetta e due coefficienti di pendenza del modello logit rmafi:δ ∼ Normale[-2,1.02], ψ ∼ Normal[0,0.252], e ξ ∼ Normal[0,0.252].
L’adattamento del modello è stato eseguito con il pacchetto TMB(Kristensen et al., 2015) per la differenziazione automatica, che restituisce funzioni per la probabilità più gradiente e le matrici dell’Assia rispetto a tutti i parametri del nostro modello dopo la marginalizzazione (approssimativa) sui campi casuali tramite un’approssimazione Laplace. Queste vengono poi inserite nella funzione ‘nlminb’ in R e ottimizzate per trovare la soluzione empirica di Bayes con l’Assia locale usata per formare intervalli approssimativi credibili come riassunto nel file supplementare 4. Il modello supplementare si adatta ai dati di risposta disaggregati per età (bambini sopra e sotto i due anni di età) sono stati condotti per valutare l’effetto dell’età sulla probabilità di sviluppare MAF con PfPRvariabile.
La validazione del modello è stata effettuata tramite un adattamento iniziale del modello di cui sopra a un sottocampione (75%) dell’intero set di dati utilizzando una procedura di validazione incrociata di tipo spaziale(Le Rest et al., 2014). La diagnostica di trasformazione integrale di probabilità(Angus, 1994; Diebold et al., 1997) per le probabilità multinomiali nei siti di holdout stimate dai quantili empirici dei prelievi dalla predittiva posteriore è stata utilizzata come controllo qualitativo sulla calibrazione delle nostre incertezze posteriori(Figura 1-figure supplement 1). Tutti i codici del modello multinomiale e del modello BRT sono disponibili su GitHub(Dalrymple, 2017; una copia è disponibile su https://github.com/elifesciences-publications/MAF-NMFI).
References
- Acestor N, Cooksey R, Newton PN, Ménard D, Guerin PJ, Nakagawa J, Christophel E, González IJ, Bell D. Mapping the aetiology of non-malarial febrile illness in Southeast Asia through a systematic review–terra incognita impairing treatment policies. PLoS ONE. 2012; 7DOI | PubMed
- Afrane YA, Zhou G, Githeko AK, Yan G. Clinical malaria case definition and malaria attributable fraction in the highlands of western Kenya. Malaria Journal. 2014; 13DOI | PubMed
- Angus JE. The probability integral transform and related results. SIAM Review. 1994; 36:652-654. DOI
- Bhatt S, Gething PW, Brady OJ, Messina JP, Farlow AW, Moyes CL, Drake JM, Brownstein JS, Hoen AG, Sankoh O, Myers MF, George DB, Jaenisch T, Wint GR, Simmons CP, Scott TW, Farrar JJ, Hay SI. The global distribution and burden of dengue. Nature. 2013; 496:504-507. DOI | PubMed
- Bhatt S, Weiss DJ, Cameron E, Bisanzio D, Mappin B, Dalrymple U, Battle K, Moyes CL, Henry A, Eckhoff PA, Wenger EA, Briët O, Penny MA, Smith TA, Bennett A, Yukich J, Eisele TP, Griffin JT, Fergus CA, Lynch M, Lindgren F, Cohen JM, Murray CLJ, Smith DL, Hay SI, Cibulskis RE, Gething PW. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 2015; 526:207-211. DOI | PubMed
- Bisoffi Z, Sirima SB, Menten J, Pattaro C, Angheben A, Gobbi F, Tinto H, Lodesani C, Neya B, Gobbo M, Van den Ende J. Accuracy of a rapid diagnostic test on the diagnosis of malaria infection and of malaria-attributable fever during low and high transmission season in Burkina Faso. Malaria Journal. 2010; 9DOI | PubMed
- Bloland PB, Boriga DA, Ruebush TK, McCormick JB, Roberts JM, Oloo AJ, Hawley W, Lal A, Nahlen B, Campbell CC. Longitudinal cohort study of the epidemiology of malaria infections in an area of intense malaria transmission II. Descriptive epidemiology of malaria infection and disease among children. The American Journal of Tropical Medicine and Hygiene. 1999; 60:641-648. DOI | PubMed
- Bousema T, Okell L, Felger I, Drakeley C. Asymptomatic malaria infections: detectability, transmissibility and public health relevance. Nature Reviews Microbiology. 2014; 12:833-840. DOI | PubMed
- Cameron E, Battle KE, Bhatt S, Weiss DJ, Bisanzio D, Mappin B, Dalrymple U, Hay SI, Smith DL, Griffin JT, Wenger EA, Eckhoff PA, Smith TA, Penny MA, Gething PW. Defining the relationship between infection prevalence and clinical incidence of Plasmodium falciparum malaria. Nature Communications. 2015; 6DOI | PubMed
- Chappuis F, Alirol E, d’Acremont V, Bottieau E, Yansouni CP. Rapid diagnostic tests for non-malarial febrile illness in the tropics. Clinical Microbiology and Infection. 2013; 19:422-431. DOI | PubMed
- D’Acremont V, Lengeler C, Genton B. Reduction in the proportion of fevers associated with Plasmodium falciparum parasitaemia in Africa: a systematic review. Malaria Journal. 2010; 9DOI | PubMed
- Dalrymple. GitHub. 2017. Publisher Full Text
- Das J, Hammer J, Sánchez-Paramo C. The impact of recall periods on reported morbidity and health seeking behavior. Journal of Development Economics. 2012; 98:76-88. DOI
- DHS Program. Demographic and Health Surveys. 2017. Publisher Full Text
- Diebold F, Gunther TA, Tay AS. Evaluating density forecasts. International Economic Review. 1997; 39:863-883. DOI
- Doolan DL, Dobaño C, Baird JK. Acquired immunity to malaria. Clinical Microbiology Reviews. 2009; 22:13-36. DOI | PubMed
- Ehrhardt S, Burchard GD, Mantel C, Cramer JP, Kaiser S, Kubo M, Otchwemah RN, Bienzle U, Mockenhaupt FP. Malaria, anemia, and malnutrition in african children–defining intervention priorities. The Journal of Infectious Diseases. 2006; 194:108-114. DOI | PubMed
- Elith J, Leathwick JR, Hastie T. A working guide to boosted regression trees. Journal of Animal Ecology. 2008; 77:802-813. DOI | PubMed
- Esch T, Taubenböck H, Roth A, Heldens W, Felbier A, Thiel M, Schmidt M, Müller A, Dech S. TanDEM-X mission—new perspectives for the inventory and monitoring of global settlement patterns. Journal of Applied Remote Sensing. 2012; 6DOI
- Filipe JA, Riley EM, Drakeley CJ, Sutherland CJ, Ghani AC. Determination of the processes driving the acquisition of immunity to malaria using a mathematical transmission model. PLoS Computational Biology. 2007; 3DOI | PubMed
- French N, Nakiyingi J, Lugada E, Watera C, Whitworth JA, Gilks CF. Increasing rates of malarial fever with deteriorating immune status in HIV-1-infected Ugandan adults. AIDS. 2001; 15:899-906. DOI | PubMed
- Gething PW, Elyazar IR, Moyes CL, Smith DL, Battle KE, Guerra CA, Patil AP, Tatem AJ, Howes RE, Myers MF, George DB, Horby P, Wertheim HF, Price RN, Müeller I, Baird JK, Hay SI. A long neglected world malaria map: Plasmodium vivax endemicity in 2010. PLoS Neglected Tropical Diseases. 2012; 6DOI | PubMed
- Ghai RR, Thurber MI, El Bakry A, Chapman CA, Goldberg TL. Multi-method assessment of patients with febrile illness reveals over-diagnosis of malaria in rural Uganda. Malaria Journal. 2016; 15DOI | PubMed
- Griffin JT, Hollingsworth TD, Okell LC, Churcher TS, White M, Hinsley W, Bousema T, Drakeley CJ, Ferguson NM, Basáñez MG, Ghani AC. Reducing Plasmodium falciparum malaria transmission in Africa: a model-based evaluation of intervention strategies. PLoS Medicine. 2010; 7DOI | PubMed
- Guerra CA, Hay SI, Lucioparedes LS, Gikandi PW, Tatem AJ, Noor AM, Snow RW. Assembling a global database of malaria parasite prevalence for the malaria atlas project. Malaria Journal. 2007; 6DOI | PubMed
- Gwer S, Newton CR, Berkley JA. Over-diagnosis and co-morbidity of severe malaria in African children: a guide for clinicians. The American Journal of Tropical Medicine and Hygiene. 2007; 77:6-13. DOI | PubMed
- Hartgers FC, Yazdanbakhsh M. Co-infection of helminths and malaria: modulation of the immune responses to malaria. Parasite Immunology. 2006; 28:497-506. DOI | PubMed
- Hertz JT, Munishi OM, Sharp JP, Reddy EA, Crump JA. Comparing actual and perceived causes of fever among community members in a low malaria transmission setting in northern Tanzania. Tropical Medicine & International Health. 2013; 18:1406-1415. DOI | PubMed
- Hildenwall H, Amos B, Mtove G, Muro F, Cederlund K, Reyburn H. Causes of non-malarial febrile illness in outpatients in Tanzania. Tropical Medicine & International Health. 2016; 21:149-156. DOI | PubMed
- Howes RE, Patil AP, Piel FB, Nyangiri OA, Kabaria CW, Gething PW, Zimmerman PA, Barnadas C, Beall CM, Gebremedhin A, Ménard D, Williams TN, Weatherall DJ, Hay SI. The global distribution of the Duffy blood group. Nature Communications. 2011; 2DOI | PubMed
- Källander K, Nsungwa-Sabiiti J, Peterson S. Symptom overlap for malaria and pneumonia–policy implications for home management strategies. Acta Tropica. 2004; 90:211-214. DOI | PubMed
- Kristensen K, Nielsen A, Berg CW, Skaug H, Bell B. TMB: Automatic Differentiation and Laplace Approximation. Journal of Statistical Software. 2015; 70:1-21.
- Le Rest K, Pinaud D, Monestiez P, Chadoeuf J, Bretagnolle V. Spatial leave-one-out cross-validation for variable selection in the presence of spatial autocorrelation. Global Ecology and Biogeography. 2014; 23:811-820. DOI
- Lindgren F, Rue H, Lindström J. An explicit link between Gaussian fields and Gaussian Markov random fields: the stochastic partial differential equation approach. Journal of the Royal Statistical Society: Series B. 2011; 73:423-498. DOI
- Mabunda S, Aponte JJ, Tiago A, Alonso P. A country-wide malaria survey in Mozambique. II. Malaria attributable proportion of fever and establishment of malaria case definition in children across different epidemiological settings. Malaria Journal. 2009; 8DOI | PubMed
- Maire N, Smith T, Ross A, Owusu-Agyei S, Dietz K, Molineaux L. A model for natural immunity to asexual blood stages of Plasmodium falciparum malaria in endemic areas. The American Journal of Tropical Medicine and Hygiene. 2006; 75:19-31. DOI | PubMed
- Malaria Atlas Project. MAP – Malaria Atlas Projects. 2017. Publisher Full Text
- Mappin B, Cameron E, Dalrymple U, Weiss DJ, Bisanzio D, Bhatt S, Gething PW. Standardizing Plasmodium falciparum infection prevalence measured via microscopy versus rapid diagnostic test. Malaria Journal. 2015; 14DOI | PubMed
- Mayxay M, Pukrittayakamee S, Chotivanich K, Looareesuwan S, White NJ. Persistence of Plasmodium falciparum HRP-2 in successfully treated acute falciparum malaria. Transactions of the Royal Society of Tropical Medicine and Hygiene. 2001; 95:179-182. DOI | PubMed
- Rockers PC, McConnell M. Child gender and parental reporting of illness symptoms in sub-saharan Africa. The American Journal of Tropical Medicine and Hygiene. 2017; 96:994-1000. DOI | PubMed
- Ross A, Maire N, Molineaux L, Smith T. An epidemiologic model of severe morbidity and mortality caused by Plasmodium falciparum. The American Journal of Tropical Medicine and Hygiene. 2006; 75:63-73. DOI | PubMed
- Rue H, Martino S, Chopin N. Approximate Bayesian inference for latent Gaussian models by using integrated nested Laplace approximations. Journal of the Royal Statistical Society: Series B. 2009; 71:319-392. DOI
- Schellenberg JR, Smith T, Alonso PL, Hayes RJ. What is clinical malaria? Finding case definitions for field research in highly endemic areas. Parasitology Today. 1994; 10:439-442. DOI | PubMed
- Smith DL, Guerra CA, Snow RW, Hay SI. Standardizing estimates of the Plasmodium falciparum parasite rate. Malaria Journal. 2007; 6DOI | PubMed
- Smith T, Killeen GF, Maire N, Ross A, Molineaux L, Tediosi F, Hutton G, Utzinger J, Dietz K, Tanner M. Mathematical modeling of the impact of malaria vaccines on the clinical epidemiology and natural history of Plasmodium falciparum malaria: Overview. The American Journal of Tropical Medicine and Hygiene. 2006a; 75:1-10. DOI | PubMed
- Smith T, Ross A, Maire N, Rogier C, Trape JF, Molineaux L. An epidemiologic model of the incidence of acute illness in Plasmodium falciparum malaria. The American Journal of Tropical Medicine and Hygiene. 2006b; 75:56-62. DOI | PubMed
- Smith T, Schellenberg JA, Hayes R. Attributable fraction estimates and case definitions for malaria in endemic areas. Statistics in Medicine. 1994; 13:2345-2358. DOI | PubMed
- Swarthout TD, Counihan H, Senga RK, van den Broek I. Paracheck-Pf accuracy and recently treated Plasmodium falciparum infections: is there a risk of over-diagnosis?. Malaria Journal. 2007; 6DOI | PubMed
- UNICEF. UNICEF Multiple Indicator Cluster Surveys. 2017. Publisher Full Text
- Weiss DJ, Bhatt S, Mappin B, Van Boeckel TP, Smith DL, Hay SI, Gething PW. Air temperature suitability for Plasmodium falciparum malaria transmission in Africa 2000-2012: a high-resolution spatiotemporal prediction. Malaria Journal. 2014; 13DOI | PubMed
- Weiss DJ, Mappin B, Dalrymple U, Bhatt S, Cameron E, Hay SI, Gething PW. Re-examining environmental correlates of Plasmodium falciparum malaria endemicity: a data-intensive variable selection approach. Malaria Journal. 2015; 14DOI | PubMed
- Wipasa J, Suphavilai C, Okell LC, Cook J, Corran PH, Thaikla K, Liewsaree W, Riley EM, Hafalla JC. Long-lived antibody and B Cell memory responses to the human malaria parasites, Plasmodium falciparum and Plasmodium vivax. PLoS Pathogens. 2010; 6DOI | PubMed
- World Bank. World Bank Open Data. 2017. Publisher Full Text
- World Health Organization. World Malaria Report 2015. World Health Organization: Geneva, Switzerland; 2015.
- World Health Organization. World Malaria Report 2016. World Health Organization: Geneva, Switzerland; 2016.
- Worldwide Antimalarial Resistance Network. WWARN Non-Malarial Febrile Illness Map. 2017. Publisher Full Text
Fonte
Dalrymple U, Cameron E, Bhatt S, Weiss DJ, Gupta S, et al. () Quantifying the contribution of . eLife 6e29198. https://doi.org/10.7554/eLife.29198





