Introduzione
Nel 2015, gli adulti dai 60 anni in su costituivano il 12% della popolazione globale. Si stima che entro il 2050 gli adulti più anziani costituiranno il 22% della popolazione mondiale, pari a circa 2 miliardi di persone.1 Le donne hanno un’aspettativa di vita più lunga rispetto agli uomini, ma dopo i 45 anni di età soffrono di malattie croniche e non mortali.2 Una di queste condizioni è il declino della massa e della forza muscolare legato all’età, chiamata sarcopenia. Tassi elevati di sarcopenia sono stati osservati nelle donne di 60 anni e più, e si ipotizza che i cambiamenti ormonali che si verificano in menopausa (tra 49 e 52 anni) possano essere responsabili.3,4,5 Le persone affette da sarcopenia presentano un rischio maggiore per gli esiti negativi della salute, tra cui disabilità e disturbi funzionali, aumento del rischio di cadute, degenze ospedaliere più lunghe e aumento del rischio di mortalità.6,7,8,9,10,11,12 Poiché le donne vivono più a lungo degli uomini, le donne hanno maggiori probabilità di sperimentare i cambiamenti muscolari negativi che si verificano con l’invecchiamento che sono forti predittori della mobilità e della compromissione funzionale.
La perdita muscolare accelerata, come quella della sarcopenia, è stata associata alla transizione della menopausa e quindi legata al calo dei livelli di estrogeni.13,14,15,16 Pertanto, la terapia ormonale (HT) è stata suggerita come potenziale intervento.17 La terapia ormonale è un metodo di integrazione di estrogeni, con o senza progesterone, prescritto per gestire e trattare i sintomi della menopausa.18 Tuttavia, l’esatto meccanismo tra gli estrogeni e il mantenimento della massa muscolare è rimasto elusivo.14,19,20 Gli estrogeni possono essere direttamente coinvolti nel metabolismo muscolare attraverso i recettori degli estrogeni che si trovano sul muscolo scheletrico,14,20,21,22,23 così come indirettamente attraverso l’asse somatotropico alterando le secrezioni dell’ormone della crescita e del fattore di crescita dell’insulina 1.19,20,24,25 Inoltre, gli estrogeni svolgono un ruolo nella regolazione del metabolismo dei carboidrati e dei lipidi, alleviando il glicogeno muscolare e provocando l’ossidazione dei lipidi,20,26 che potrebbe influenzare la composizione del muscolo scheletrico nelle donne in menopausa.
Nonostante i potenziali benefici dell’HT, i dati dello studio Women’s Health Initiative (WHI) hanno suggerito che ci potrebbero essere maggiori rischi associati all’HT se iniziata in età avanzata (cioè dopo 60 anni), compreso un piccolo aumento del rischio di ictus e tromboembolia venosa.27 Dopo la pubblicazione iniziale dei risultati dell’WHI, un’ampia percentuale di donne ha interrotto l’HT e molti operatori sanitari erano ansiosi di prescrivere l’HT, nonostante la relativa sicurezza per le donne più giovani (in menopausa precoce). Durante la finestra di opportunità nei primi 10 anni dopo la menopausa, HT ha molteplici benefici per la salute, tra cui il sollievo dai sintomi della menopausa e la riduzione dei rischi di malattie coronariche e di mortalità per tutte le cause.18,28,29 Tuttavia, a nostra conoscenza, c’è una mancanza di consenso tra le revisioni per quanto riguarda il ruolo dell’HT nell’attenuare la perdita di massa muscolare. Diverse recensioni hanno studiato l’associazione tra l’uso di HT e la massa muscolare e la forza. Alcune di queste revisioni hanno incluso studi che esaminano gli interventi di allenamento della resistenza in aggiunta all’HT o la valutazione delle prestazioni muscolari piuttosto che la massa muscolare o la forza, mentre altre hanno incluso studi su animali per integrare i risultati nelle popolazioni umane.30,31,32 In generale, queste recensioni hanno rilevato che l’HT fornisce un piccolo, significativo beneficio nel preservare la forza muscolare (dimensione dell’effetto: 0,23; P<<<0,05),31 e che questi benefici possono essere amplificati quando l’HT viene usato in combinazione con l’allenamento.30 Ci sono anche alcune prove che suggeriscono che HT può avere effetti benefici sulla massa muscolare.32 Alcuni studi osservazionali e studi clinici randomizzati hanno dimostrato i benefici della terapia estrogenica sulla massa muscolare nelle donne in postmenopausa,16,33 mentre altri non l’hanno fatto.13,14,20,34 Tuttavia, a nostra conoscenza, non è stata pubblicata alcuna revisione sistematica che abbia valutato l’associazione indipendente tra l’uso di HT e la massa muscolare.
L’obiettivo di questa revisione sistematica e meta-analisi era quello di determinare se, nelle donne in post-menopausa, l’HT (solo estrogeni o una combinazione di estrogeni e progesterone) era associata ad una ridotta perdita di massa muscolare (misurata dalla massa corporea magra [LBM] o dalla massa senza grassi), rispetto al non ricevere HT, in relazione al tipo e alla dose di HT, alla durata del follow-up dello studio, all’età dei partecipanti alla menopausa e al tipo di misurazione della LBM.
Metodi
Questo studio ha seguito la linea guidaPRISMA (Preferred Reporting Items for Systematic Reviews and Meta-analyses).35 Questa revisione è stata registrata in PROSPERO(CRD42016052047), il registro internazionale delle revisioni sistematiche, il 30 novembre 2016. Per questa ricerca non è stata richiesta l’approvazione etica.
Fonti di dati e ricerche
È stata sviluppata una strategia di ricerca elettronica per identificare gli studi umani che indagano sull’associazione dell’uso dell’HT nelle donne in menopausa con la LBM. Il 25 aprile 2018, le seguenti banche dati elettroniche sono state ricercate dall’inizio al 25 aprile 2018: MEDLINE, Embase (Excerpta Medica Database), AgeLine, CINAHL (Cumulative Index to Nursing and Allied Health) e SportDiscus (eTable 1 nel supplemento). Sono stati esaminati anche gli elenchi di riferimento di tutti gli studi inclusi.
Criteri di inclusione e di esclusione
Sono stati inclusi studi se le partecipanti erano donne in postmenopausa di 50 anni o più che ricevevano HT a base di estrogeni o di estrogeni-progesterone. Sono stati esclusi gli studi con partecipanti provenienti da ospedali e strutture di assistenza a lungo termine, o con condizioni specifiche (cancro al seno o altri tipi di cancro, sindrome di Turner o anoressia). Non sono state poste restrizioni al contesto geografico, socioeconomico o etnico di nessuno dei partecipanti.
Tra i trattamenti ammissibili vi erano quelli a base di estrogeni o HT a base di estrogeni-progesterone. Non sono state poste altre restrizioni alla somministrazione di HT.
Solo gli studi clinici randomizzati, completi e pubblicati per intero, sono stati ammessi a questa revisione. Gli studi devono aver condotto ricerche primarie nelle popolazioni umane. Gli studi sugli animali sono stati esclusi. Non abbiamo posto alcuna restrizione alla data dello studio o della pubblicazione. Gli studi sono stati limitati ad articoli originali in lingua inglese.
Gli studi sono stati inclusi se la LBM o la massa senza grassi è stata misurata come risultato. I risultati relativi alla massa corporea magra comprendevano misure provenienti da apparecchiature per la scansione del corpo, tra cui l’assorbimento dei raggi X a doppia energia (DEXA, o DXA), l’analisi dell’impedenza bioelettrica, la risonanza magnetica, l’assorbimento dei fotoni a doppia fotoni o la tomografia computerizzata. Sono stati esclusi gli studi che utilizzano la circonferenza muscolare o i calibri cutanei per le misure di LBM.
Selezione dello studio
Due revisori indipendenti (A.A.J. e A.J.M.) hanno esaminato gli articoli in doppio al titolo e nelle fasi di abstract e testo completo della revisione. Lo screening degli studi è stato condotto utilizzando il software di revisione sistematica DistillerSR versione 2.0 (Evidence Partners).36
Eventuali conflitti potenziali tra i revisori sono stati risolti attraverso la discussione. Se dopo la discussione permangono discrepanze nel giudizio, è stato consultato un terzo revisore (P.R.) per risolvere il conflitto e fornire una decisione finale.
Estrazione dei dati
Un autore (A.A.J.) ha estratto autonomamente i dati dagli studi inclusi in DistillerSR, e il secondo autore (A.M.) ha effettuato la verifica. Sono state estratte informazioni sulle caratteristiche dello studio, tra cui la data dello studio, il paese di svolgimento, la dimensione del campione, l’età dei partecipanti, l’etnia, il tipo di menopausa (naturale o indotta), il tempo trascorso dalla menopausa, le informazioni HT (tipo, dose e durata), il tipo di gruppo di confronto e la durata del follow-up.
Sono stati estratti il tipo di apparecchiatura di scansione (nome, modello, coefficiente di variazione dello strumento, tempi di misurazione), nonché i valori di LBM alla linea di base, tutti i dati disponibili per il follow-up e tutti i dati relativi alla quantità di variazione dei valori di LBM e P per tale variazione. Eventuali conflitti sono stati risolti attraverso la discussione. Il terzo revisore (P.R.) è stato consultato se era necessaria una decisione finale in merito a tali disaccordi.
Valutazione del rischio di distorsione
I due revisori indipendenti (A.A.J. e A.J.M.) hanno valutato la qualità degli studi inclusi in doppio, utilizzando lo strumento della Cochrane Collaboration per la valutazione del rischio di distorsione negli studi randomizzati.37 Eventuali discrepanze tra i revisori indipendenti sono state risolte mediante discussione. Se i conflitti non sono stati adeguatamente risolti attraverso la discussione, è stato consultato un revisore terzo (P.R.) per risolvere tale disaccordo. La valutazione del rischio di distorsione è stata completata a livello di studio.
Valutazione, sviluppo e valutazione delle raccomandazioni
L’approccio Grading of Recommendations Assessment, Development and Evaluation (GRADE) è stato utilizzato per valutare la qualità delle prove in base al risultato.38,39 In GRADE, tutti gli studi clinici randomizzati iniziano con un grado di alto e vengono declassati in base alla presenza di rischio di parzialità, incoerenza, indiretto, imprecisione o parzialità di pubblicazione. La presenza di ogni fattore declassa la qualità dello studio di 1 livello. La valutazione è stata condotta su tutti gli studi e poi ulteriormente stratificata per sottogruppi. Le decisioni sulla qualità delle prove sono state riviste e concordate da entrambi i revisori (A.A.J. e A.J.M.).
La qualità delle prove è stata classificata in 4 livelli: molto bassa, bassa, moderata e alta. Le prove sono state declassate per il rischio di distorsione se c’erano prove di selezione, performance, logoramento, segnalazione o altre distorsioni. Le prove sono state declassate per incoerenza se la statistica I2per la stima della differenza media era superiore al 50%, per indiretto se esistevano differenze sostanziali tra la popolazione, l’intervento o l’esito o se si utilizzavano confronti indiretti per fare inferenze su interventi di interesse, e per imprecisione se la dimensione ottimale dell’informazione (400 casi in totale, con un minimo di 200 casi nel gruppo sperimentale e 200 nel gruppo di controllo) non era soddisfatta o se la dimensione ottimale dell’informazione era soddisfatta ma l’IC del 95% della differenza media superava lo zero. La valutazione della distorsione di pubblicazione è stata condotta mediante una valutazione visiva della simmetria del diagramma ad imbuto. La distorsione di pubblicazione è stata valutata quantitativamente con i test Egger e Begg, utilizzando il software statistico SPSS versione 23 (IBM).40,41
P < .10 è stata considerata prova di un pregiudizio di pubblicazione.
Sintesi e analisi dei dati
I risultati sono stati sintetizzati utilizzando una meta-analisi quantitativa DerSimoniana e Laird utilizzando Review Manager 5.3 (Cochrane).42 È stato utilizzato un modello a effetti fissi o casuali secondo l’eterogeneità, e quindi è stato utilizzato un modello a effetti fissi. Per ogni braccio di trattamento è stata riportata una variazione assoluta complessiva della LBM in chilogrammi. La significatività statistica è stata determinata ad un livello di .05 (2-coda). Per ogni meta-analisi è stata presentata una differenza media riassuntiva nella LBM (con il 95% di IC) e una statistica I2.
Sottogruppo Analisi
Il dosaggio della terapia ormonale è stato esaminato separatamente all’interno dei bracci di trattamento solo estrogeno e estrogeno-progesterone. I vari tipi di estrogeni utilizzati in HT non sono equivalenti; pertanto, tutti i dosaggi di estrogeni sono stati standardizzati utilizzando valori di riferimento (eTable 2 nel supplemento).43,44,45 Tutti i valori sono stati standardizzati a quelli degli estrogeni equini coniugati, il tipo di estrogeno più comunemente usato negli studi inclusi. Solo estrogeni e bracci estrogeno-progesterone sono stati stratificati da una dose di estrogeni di 0,625 mg o superiore (dosaggio standard o superiore) o inferiore a 0,625 mg (basso dosaggio). Il meccanismo d’azione proposto per HT sul mantenimento muscolare è attraverso gli estrogeni. Pertanto, le braccia di trattamento estrogeno-progesterone non sono stati stratificati dal dosaggio di progesterone.
Sottogruppi di durata di follow-up sono stati classificati come più lunghi (> 2 anni) o più brevi (≤ 2 anni). Queste soglie sono stati selezionati perché più uniformemente dicotomizzato lo studio e tipi di partecipanti e catturato la gamma di durata di follow-up. La durata del follow-up è stata utilizzata come proxy della durata totale di HT perché le durate di follow-up riportate erano simili o uguali alla durata dell’uso di HT nella maggior parte degli studi.46,47,48,49,50,51,52,53 È fondamentale esplorare la variabilità della durata del trattamento con estrogeni, perché l’esposizione prolungata agli estrogeni può essere necessaria per apportare benefici alla conservazione della LBM. L’età della menopausa è stata caratterizzata in base al tempo trascorso dall’inizio della menopausa dei partecipanti allo studio. Sono stati inclusi studi con partecipanti con l’inizio della menopausa negli ultimi 10 anni. In generale, si raccomanda alle donne in menopausa di iniziare l’uso di HT più vicino alla menopausa, in particolare entro i primi 10 anni.54,55 Anche i sottogruppi tempo-menopausa sono stati classificati come più brevi (<5 anni) o più lunghi (≥5 anni).
I sottogruppi della qualità dello studio sono stati classificati in base alla qualità giusta o buona contro la qualità scadente. I sottogruppi del tipo di misurazione della massa corporea magra sono stati classificati come DEXA o altro. L’assorbimento dei raggi X a doppia energia è considerato il criterio standard per la misurazione della composizione corporea; pertanto, tutti gli altri tipi sono stati combinati e confrontati con esso.56
Risultati
Flusso della letteratura
Tra i 21 studi, che includevano 4474 partecipanti, l’età media (SD) era di 59,0 (6,1) anni. I dati sull’etnia sono stati presentati in 2 dei 21 studi. La ricerca elettronica della letteratura ha prodotto 8961 articoli potenzialmente rilevanti, lasciando 219 dopo la selezione dei titoli e degli abstract e 21 articoli dopo la selezione del testo completo. Due studi sono stati esclusi a causa del metodo di misurazione del muscolo (spessore della piega della pelle e sezione trasversale del muscolo), e 1 è stato escluso perché la sua coorte si è sovrapposta a quella di un altro studio incluso. Entrambi questi studi hanno utilizzato i dati delle prove WHI, e lo studio con la più lunga durata dei dati di follow-up è stato utilizzato nelle analisi.46,57 Inoltre, lo studio WHI escluso non disponeva dei dati necessari per la messa in comune.57 Quattro studi sono stati esclusi perché hanno fornito descrizioni qualitative dei cambiamenti nella LBM e non avevano dati numerici disponibili per il pooling. Altri due studi sono stati esclusi perché non disponevano di dati disponibili per il pooling. Dodici studi46,47,48,49,50,51,52,53,58,59,60,61 sono rimasti e sono stati inclusi nell’analisi(Figura 1).
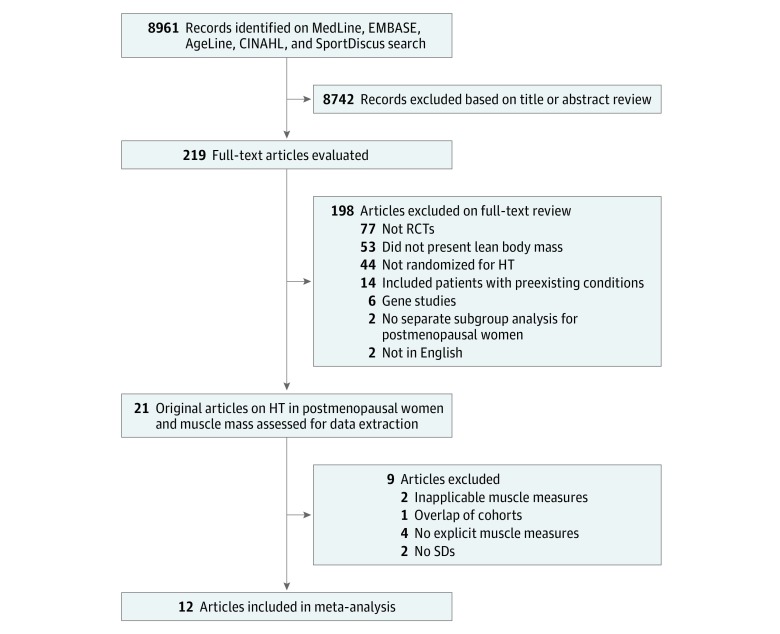
Figura 1.Diagramma di flusso del processo di vagliatura della letteraturaHT indica la terapia ormonale; RCT, studi clinici randomizzati e SD, deviazioni standard.

Figura 1.Diagramma di flusso del processo di screening della letteraturaHT indica la terapia ormonale; RCT, studi clinici randomizzati e SD, deviazioni standard.
Caratteristiche dello studio
Complessivamente, 6 studi sono stati condotti negli Stati Uniti e 6 in Europa. Il numero totale di partecipanti reclutati per tutti i 12 studi applicabili è stato di 4474, e la durata media del follow-up per gli studi è stata di 2 anni (intervallo, da 6 mesi a 6 anni). L’età dei partecipanti variava da 45 a 75 anni(tabella 1).62 Le caratteristiche complete dello studio sono presentate nelle tabelle da 3 a 5 del supplemento. Gli studi hanno avuto un totale di 22 bracci di trattamento HT, 15 dei quali hanno utilizzato la combinazione estrogeno-progesterone HT e 7 dei quali hanno utilizzato solo gli estrogeni HT. La durata del trattamento variava da 9 a 25 giorni al mese a più di 8 anni e variava nel dosaggio. I partecipanti al controllo non hanno ricevuto HT o placebo. Diciotto braccia di trattamento consisteva di dosaggio continuo, e 4 usato un regime di dosaggio ciclico. I bracci di trattamento degli studi inclusi hanno rappresentato vari impatti dell’HT, con 7 bracci associati a una perdita di LBM durante il periodo di trattamento e 14 bracci associati alla ritenzione di LBM.(Tabella 2). Per le meta-analisi sono stati considerati 21 bracci di trattamento, perché lo studio di Jensen et al.49 ha presentato i risultati con i 2 bracci di trattamento HT combinati. Inoltre, ci sono state discrepanze tra le dimensioni del campione nei bracci di trattamento e di controllo per molti degli studi. Questo può indicare un errore nella randomizzazione o la perdita di follow-up.
| Fonte: | Paese | Durata dello studio | Totale partecipanti reclutati, n./Totale in analisi, n. | Età, Media (SD), y | Tempo dalla menopausa, media (SD), y | HT | Quantità di attività fisica, media (SD) | ||
|---|---|---|---|---|---|---|---|---|---|
| Tipo | Dosaggio, mg/d | Periodo di follow-up/Durata di HT | |||||||
| Aloia et al,60 1995 | Stati Uniti | NA | 118/77 | 52.162 (5.7) | 2.27 (0.33) | E-P | E: 0.625 | E: 25 d/mo | Nessuno riportato |
| P: 10 | P: 9 d (giorni 16-25) | ||||||||
| Bea et al,46 2011 | Stati Uniti | 1993-2004 | 1)a 927/927 | 1) 63.35 (7.6) | 1) 22.21 (8.4) | 1) E | 0.625 | 7.7 (1.8) y | E: 10.1 (12.8)b |
| Controllo: 9.3 (11.4)c | |||||||||
| 2) 1014/1014 | 2) 63.29 (7.2) | 2) 13.53 (8.5) | 2) E-P | E: 0.625 | 6.3 (1.5) y | E: 11.4 (14.6) | |||
| P: 2.5 | Controllo: 11,9(14,6) | ||||||||
| Blackman et al,47 2002 | Stati Uniti | 1992-1998 | 28/28 | 71.5 (5.9) | NA | E-P | E: 100 per 6 mo | E: 6 mo | Nessuno riportato |
| P: 10 per gli ultimi 10 d di ogni ciclo di 28 d | P: ultimi 10 d di ogni ciclo di 28 d per 6 mo (circa 60-65 d) | ||||||||
| Chen et al,57 2005 | Stati Uniti | 1993-2001 | 835/835; Analisi di sensibilità: 511/256 (braccio placebo), 511/255 (braccio di trattamento) | 63.1 (7.2) | 13.8 (8.9) | E-P | E: 0.625 | 3 y | Nessuno riportato |
| P: 2.5 | |||||||||
| Evans et al,61 2001 | Stati Uniti | NA | 68/68 (Ma solo 34 nei gruppi HT e placebo combinati) | 67.7 (5.2) | Età media (SD) in menopausa: 49 (5) y; età media attuale (SD): 67,8 (5) y | E-P | E: 0.625 | 13 d ogni tre mesi | Nessuno riportato |
| P: 5 | |||||||||
| Haarbo et al,48 1991 | Danimarca | NA | 75/62 (19 HT) | 45-55 | 20,9 (8,4) mo | 1) E-P | E: 2 | 2 y | Nessuno riportato |
| P: 1 | |||||||||
| 75/62 (19 HT) | 22,4 (9,9) mo | 2) E-P | E: 2 | 2 y | |||||
| P: 75 | |||||||||
| Hassager e Christiansen,58 1989 | Danimarca | 1983-1985 | 133/65 | 1) 49.91 (2.36) | Criteri di inclusione: menopausa nel passato 0,5-3,0 | 1) E-P (orale) | E: 2 | In un ciclo di 28-d: E: giorni 1-11 | Nessuno riportato |
| P: | E-P: giorni 12-21 | ||||||||
| Nessuno: giorni 22-28 | |||||||||
| 133/45 | 2) 50.41 (2.29) | 2) E (percutanea) | E: 0.6 | In un ciclo di 28-d: | |||||
| E: giorni 1-24, 5 g | |||||||||
| Nessuno: giorni 25-28 | |||||||||
| Jensen et al,49 2003d | Danimarca | 1990-1993 | 1006/621 | 50.1 ( 2.8) | 0.7 (0.6) y | 1) E | 2 | 5 y | E: 0.98 (13.02)e |
| 2) E-P | E: 2 | In un ciclo di 28 d: | |||||||
| P: 1 | E: giorni 1-12 | Controllo: 1.187 (12.66) | |||||||
| E-P: giorni 13-22 E: giorni 23-28 | |||||||||
| Kenny et al,50 2005 | Stati Uniti | NA | 167/107 | 74.3 (6.2) | Età media (SD): 74,3 (0,6) | E | 0,25 (dose minima) | 36 mo | E: Linea di base: 120,9 (6,2)f |
| 36 mo: 104.8 (6.6) | |||||||||
| Placebo: linea di base: 99,8 (6.1) | |||||||||
| 36 mo: 84,7 (6,9) | |||||||||
| Pöllänen et al,51 2007 | Finlandia | NA | 20/15 | 53.6 (1.85) | 2.8 (3.6) | E-P | E: 2 | 1 y | Nessuno riportato |
| P: 1 | |||||||||
| Sipilä et al,52 2001 | Finlandia | NA | 80/52 (30 in gruppi HT e placebo combinati) | 50-55 | Criteri di inclusione: menopausa negli ultimi 5 anni | E-P | E: 2 | 1 y | Nessuno riportato |
| P: 1 | |||||||||
| Sørensen et al,59 2001 | Danimarca | NA | 16/14 | 55.5 (2.6) | 5.9 (3.9) | E-P | E: 4 | In un ciclo di 28-d; follow-up/durata non specificata | Nessuno riportato |
| P: 1 | E: 4 mg per 22 d e 1 mg per 6 d; P: 10 d; totale: 12 wk | ||||||||
| Thorneycroft et al,53 2007 | Stati Uniti | NA | 822/502 | 51.9 (3.3) | 2.2 (0.9) | 1) E | 1A) E: 0,625 | 2 y | Nessuno riportato |
| 51.5 (4.1) | 2.2 (0.9) | 1B) E: 0,45 | 2 y | ||||||
| 52.0 (3.7) | 2.5 (1.0) | 1C) E: 0,3 | 2 y | ||||||
| 51.5 (3.8) | 2.5 (0.9) | 2) E-P | 1A) E: 0,625 | 2 y | |||||
| P: 2.5 | |||||||||
| 51.1 (3.5) | 2.3 (0.9) | 1B) E: 0,45 | 2 y | ||||||
| P: 2.5 | |||||||||
| 52.3 (3.9) | 2.3 (1.0) | 1C) E: 0,45 | 2 y | ||||||
| P: 1.5 | |||||||||
| 51.3 (3.5) | 2.3 (1.0) | 1D) E: 0,3 | 2 y | ||||||
| P: 1.5 | |||||||||
| Fonte: | Attrezzatura | Tempi di misurazione | Misure LBM | P Valore | |||
|---|---|---|---|---|---|---|---|
| Tipo | Strumento | Coefficiente di Variazione, %. | Linea di base (kg), media (SD), % (SD) | Cambio post-trattamento (kg), media (SD), % (SD) | |||
| Aloia et al,60 1995 | DPA | Strumenti Lunari DP4;a Radiazioni lunari, software 1.3 | 2-3 | Linea di base, ogni anno | NA | Controllo: -2,2 (1,6), -5,5 (0,9); trattamento: -3,1 (1,6), -7,4% (0,8%) | >.05 |
| Bea et al,46 2011 | DEXA | QDR2000, 2000+, o 4500Wb | NA | Linea di base, anno 3, anno 6 | 1) Controlloc: 38,82 (5,77), 51,54 (6,31); trattamento: 38.49 (5.45), 51.26 (6.52) | 1) Controllo: -0,5 ( 2,45), -0,01 ( 0,06); trattamento: -0,44 (2,28), -0,01% (0,06) | P==.36 per la massa magra e .50 per la massa magra in %, oppure .72 per la variazione della massa magra e .98 per la variazione della massa magra in %; tra l’anno 1 e il 3, i gruppi placebo hanno perso molto di più rispetto ai gruppi di trattamento (<.05). |
| 2) Controllo: 38,23 (5,42), 53,58 (7,05); trattamento: 37.73 (5.17), 53.23 (7.06) | 2) Controllo: -0,4 (2,15), -0,01% (0,05%); trattamento: -0,29 (1,99), -0,01% (0,05%) | Tra i gruppi HT e placebo, linea di base LBM, kg, P = .13; linea di base % LBM, P = .43; variazione % LBM, kg, P = .46; variazione % LBM, P = .33 | |||||
| Blackman et al,47 2002 | DEXA | Modello lunare DPX-La | 1 | Linea di base, 6 mo | Controllo: 35,7 (3,7); trattamento: 36.7 (4.1) | Controllo: 36,1 (4,1); trattamento: 37.9 (3.7) | .09 (Cambiamento tra HTf e placebo) |
| Evans et al,61 2001 | DEXA | Strumento QDR-1000/W (versione 5.64, software avanzato per il corpo intero)b | NA | NA | Controllo: 38,6 (4,0); trattamento: 39.1 (5.0) | Controllo: 0,5 (1,4); trattamento: 1.1 (1.9) | NA |
| Haarbo et al,48 1991 | DPA baseline, follow-up DEXA | NA | DPA: 2.1, DEXA: 3.1 | DPA a Baseline, DEXA a 2 y | 1) Controllo: 44,7 (3,9); trattamento: 43.5 (5.6) | 1) Controllo: 44,0 (3,8); trattamento: 43.3 (4.8) | Nessuna differenza statisticamente significativa tra i gruppi, sembra essere determinata utilizzando un ANOVA a 1 via |
| 2) Controllo: 44,7 (3,9); trattamento: 43.3 (3.3) | 2) Controllo: 44,0 (3,8); trattamento: 43.9 (4.1) | ||||||
| Hassager e Christiansen,58 1989 | DPA | NA | 2.1 | Linea di base, 2 y | 1) Controllo: 41,5 (6.1); trattamento: 39.7 (5.1) | 1) Controllo: 0,33(2,1); trattamento: 0.19 (2.1) | NA |
| 2) Controllo: 39,2 (2,8); trattamento: 39.9 (3.5) | 2) Controllo: 0,33 (2,1); trattamento: 0.81 (1.7) | NA | |||||
| Jensen et al,49 2003d | DEXA | Linea di base: Scanner QDR a corpo intero; follow-up: QDR 2000b | 1.6 | Linea di base, dopo 1, 2 e 5 y | NA | Controllo: -0,02 (2,33); trattamento: 0.18 (1.77) | NA |
| Kenny et al,50 2005 | DEXA | Scanner DPX-IQe | NA | Linea di base, 36 mo | Controllo: 37,9 (3,7); trattamento: 38.1 (3.6) | Controllo: 37,4 (3,3); trattamento: 37.8 (3.4) | Non segnalato |
| Pöllänen et al,51 2007 | BIA | Spettro IIf | NA | Linea di base, 12 mo | Controllo: 49,8 (3,3); trattamento: 47.5 (4.0) | Controllo: 48,4(2,9); trattamento: 48.5 (4.0) | NA |
| Sipilä et al,52 2001 | BIA | Spettro IIf | <2 | Linea di base, 12 mo | Controllo: 47,4 (5,1 kg); trattamento: 45.8 (4.4) | Controllo: 47,1(4.2); trattamento: 46.9 (4.1) | NA |
| Sørensen et al,59 2001 | DEXA | Norland XR-36 whole body scannerg | NA | Linea di base, dopo il dilavamento, nella settimana 10 | Per tutti i partecipanti: 39.0 (4.10) | Controllo: -0,996 (1,58); trattamento: 0,347 (0,858) | t Test, la differenza tra il cambiamento durante il placebo e il cambiamento durante l’HT è stata significativa al livello .05. |
| Thorneycroft et al,53 2007 | DEXA | NA | NA | Linea di base, cicli 6, 13, 19, 26 (ogni ciclo è di 28 d) | Controllo: 38,3 (4,0) | Controllo: 0,19 (1,6), 0,5 (0,42) | Nessuno dei cambiamenti è stato statisticamente diverso dal gruppo dei placebo |
| 1A) Trattamento: 38.9 (4.3) | Trattamento: -0,12 (1,9), -0,32 (0,5) | ||||||
| 1B) Trattamento: 38.8 ( 4.1) | Trattamento: 0.26 (1.6), 0.71 (0.42) | ||||||
| 1C) Trattamento: 37.6 (3.5) | Trattamento: -0,04 (1,5), -0,08 (0,42) | ||||||
| 2A) Trattamento: 38.0 (4.0) | Trattamento: 0.55 (1.5) 1.47 (0.42) | ||||||
| 2B) Trattamento: 38.7 (4.3) | Trattamento: 0.10 (1.5), 0.27 (0.40) | ||||||
| 2C) Trattamento: 39.1 (4.2) | Trattamento: 0.13 (1.5), 0.4 (0.4) | ||||||
| 2D) Trattamento: 38.8 (4.4) | Trattamento: 0.16 (1.4), 0.56 (0.38) | ||||||
Rischio di distorsioni degli studi inclusi
Sei dei 12 studi (50%) erano ad alto rischio di distorsione, 4 (33%) non erano chiari e 2 (17%) erano a basso rischio di distorsione(Tabella 2; eTabella 6 nel supplemento). Principalmente, gli studi hanno evidenziato carenze di segnalazione, per le quali le informazioni non sono state dichiarate esplicitamente.
Meta-analisi
Analisi dell’effetto principale
In tutti gli studi, i partecipanti che hanno ricevuto HT hanno perso 0,06 kg in meno di LBM (95% CI, da -0,05 a 0,18; I2=0%) rispetto a quelli che non hanno ricevuto HT (Figura 2). Questi risultati non presentano un cambiamento statisticamente significativo nella LBM nelle donne che ricevono HT(P = .26).
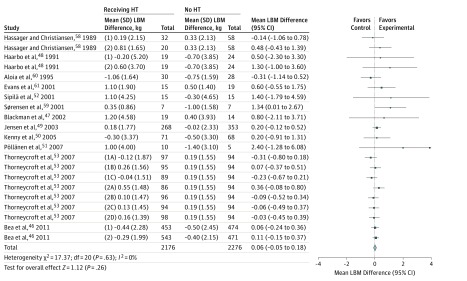
Figura 2.Sommario Meta-analisi dell’Associazione tra terapia ormonale (HT) Intervento e risultati di massa muscolare La trama forestale delle meta-analisi complessive di tutti gli studi inclusi presenta le differenze medie (95% CI) per la massa corporea magra tra le donne che ricevono HT e le donne che non ricevono HT. La dimensione del marcatore dei dati indica la ponderazione relativa dello studio.

Figura 2.Sommario Meta-analisi dell’Associazione tra l’intervento di terapia ormonale (HT) e i risultati della massa muscolare La trama forestale delle meta-analisi complessive di tutti gli studi inclusi presenta le differenze medie (95% CI) per la massa corporea magra tra le donne che ricevono HT e le donne che non ricevono HT. La dimensione del marcatore dei dati indica la ponderazione relativa dello studio.
Sottogruppo Analisi
Gli studi sono stati stratificati e analizzati dai seguenti sottogruppi: tipo di HT e dosaggio, durata del follow-up, tempo dalla menopausa, qualità dello studio e tipo di misurazione della LBM. Gli studi sono stati stratificati e analizzati dai seguenti sottogruppi: tipo HT e dosaggio (gli utenti HT hanno perso da 0,06 kg in più a 0,19 kg in meno di LBM rispetto ai non utenti), durata del follow-up (gli utenti HT hanno perso da 0,0 a 0.10 kg in meno di farine di carne e ossa rispetto ai non utenti), tempo trascorso dalla menopausa (gli utenti HT hanno perso da 0,01 a 0,13 kg in meno di farine di carne e ossa rispetto ai non utenti), qualità dello studio (gli utenti HT hanno perso da 0,04 a 0,20 kg in meno di farine di carne e ossa rispetto ai non utenti), e tipo di misura delle farine di carne e ossa (gli utenti HT hanno perso da 0,06 a 0,07 kg in meno di farine di carne e ossa rispetto ai non utenti). Non ci sono state differenze significative nel cambiamento di LBM tra donne che ricevono HT e non ricevono HT per qualsiasi gruppo (eTabelle 7-19 nel Supplemento).
Bias di pubblicazione
Un’ispezione visiva del diagramma ad imbuto delle dimensioni e della precisione dell’effetto presenta un’asimmetria che indica una potenziale distorsione della pubblicazione (eFigure nel supplemento). I test di Egger e Begg suggeriscono anche un’asimmetria di pubblicazione (Egger P=.02; Begg P=. 04).
Valutazione GRADO
In base a GRADE, la qualità complessiva delle prove era bassa. Nelle analisi del sottogruppo, i bracci di trattamento estrogeno-progesterone con dosaggio di estrogeni di 0,625 mg o superiore, studi con follow-up più lungo, tempo sempre più breve dalla menopausa, scarsa qualità, e altri tipi di misurazione LBM avevano una bassa qualità delle prove. I sottogruppi con bracci di trattamento solo per gli estrogeni di qualsiasi dosaggio, i bracci di trattamento estrogeno-progesterone con un dosaggio di estrogeni inferiore a 0,625 mg, una durata di follow-up più breve, una buona qualità e la misurazione DEXA hanno avuto una qualità moderata delle prove. L’imprecisione era un problema per quasi tutti i sottogruppi, e il rischio di distorsioni era un problema per la maggior parte. La valutazione GRADO della qualità delle prove è presentata nella eTabella 20 del Supplemento.
Discussione
Questa revisione sistematica e meta-analisi ha valutato 12 studi clinici randomizzati che esplorano il ruolo degli estrogeni HT sulla massa muscolare. Nel complesso, gli utenti HT hanno perso 0,06 kg (da -0,05 a 0,18) in meno di LBM rispetto ai partecipanti che non hanno ricevuto HT. Questo risultato non è stato statisticamente significativo ed è improbabile che sia clinicamente rilevante per la donna media in menopausa. È stato riferito che le donne di età superiore ai 50 anni perdono circa l’1% della massa muscolare ogni anno.63,64 Di questo passo, ci vorrebbero circa 66 anni per una donna di altezza media e LBM65,66 per diventare sarcopenica secondo il taglio di 7,4 kg/m2 raccomandato dal gruppo di lavoro europeo sulla Sarcopenia.67 Sulla base dei risultati di questa meta-analisi, l’uso di HT potrebbe aumentare la quantità di tempo senza sarcopenia fino a quasi 80 anni. Tuttavia, la maggior parte delle donne non vivrebbe abbastanza a lungo per sperimentare questi ulteriori anni senza sarcopenia. Il piccolo beneficio potenziale per il mantenimento della massa muscolare nella popolazione generale delle donne in postmenopausa non supera probabilmente i potenziali rischi di HT prolungata.18 Inoltre, la sarcopenia nelle donne in postmenopausa è associata soprattutto all’inattività fisica, alla riduzione dell’assunzione di proteine e allo stress ossidativo che si verifica al momento della menopausa,68 ma non direttamente con la menopausa stessa. È possibile che questo è il motivo per cui HT non sembra offrire alcun beneficio al mantenimento del muscolo dopo la menopausa, nonostante il declino della massa muscolare durante questo tempo.
La terapia ormonale potrebbe essere benefica per le donne con una massa muscolare inferiore alla linea di base; tuttavia, a nostra conoscenza, non è stata condotta alcuna ricerca in questa specifica popolazione. È stato anche ipotizzato che l’HT potrebbe essere efficace nel mantenere la massa muscolare se combinata con la terapia di esercizio. Tuttavia, gli studi hanno scoperto che, sebbene l’esercizio di resistenza abbia un’associazione statisticamente significativa con la protezione della massa muscolare,69,70 la combinazione di esercizio e HT non offre alcun beneficio significativo per il mantenimento della massa muscolare rispetto all’esercizio da solo.14,61,71
Questa revisione sistematica e meta-analisi migliora i limiti della letteratura esistente limitando il campo di applicazione all’uso di HT e alla massa muscolare. Abbiamo fornito una sintesi completa della letteratura disponibile su questo argomento e abbiamo condotto varie analisi di sottogruppo per determinare se l’associazione di HT con gli utilizzatori di LBM differisce in base alla dose di estrogeni, se il progesterone è stato incluso, la durata del follow-up, il tempo trascorso dalla menopausa, il metodo di misurazione della massa muscolare e la qualità dello studio. In tutti i sottogruppi, le donne che ricevono HT hanno perso tra 0,06 kg di massa muscolare in più e 0,20 kg di massa muscolare in meno rispetto ai gruppi di controllo, anche se nessuna di queste analisi di sottogruppo è stata statisticamente significativa.
I limiti di questa revisione includono l’impossibilità di esplorare sottogruppi come i regimi di dosaggio (ciclico vs. continuo), le caratteristiche del paziente (cioè l’etnia) o la quantità di attività fisica. In questa analisi, 4 bracci di trattamento hanno riferito di utilizzare un regime di dosaggio ciclico e di questi, 2 non hanno riportato la durata del follow-up. La maggior parte degli studi inclusi non ha riportato l’etnia o la quantità di esercizio fisico. A causa di questi fattori, non siamo stati in grado di effettuare queste analisi di sottogruppo. Anche se riteniamo improbabile che gli studi futuri trovino un’associazione tra l’uso di HT e l’attenuazione della perdita di LBM nelle donne in postmenopausa, gli studi potrebbero migliorare la letteratura attuale fornendo dati su questi sottogruppi e utilizzando un follow-up più lungo. Gli studi potrebbero anche prendere in considerazione la possibilità di concentrarsi sulle donne con una minore LBM al punto di partenza per valutare il potenziale beneficio in una popolazione a più alto rischio. Inoltre, la nostra analisi che esplora la finestra di opportunità per l’HT a meno di 10 anni dall’inizio della menopausa è stata limitata perché gli studi non sono stati progettati per includere le donne in menopausa molto precoce. Anche la nostra analisi dei sottogruppi di durata del follow-up è stata limitata perché abbiamo utilizzato la durata del follow-up come misura proxy per la durata totale dell’uso di HT, in quanto alcuni studi non riportavano esplicitamente quest’ultima.49,58,60,61
È inoltre necessario un ulteriore lavoro per determinare se l’HT è benefico per la forza muscolare o la funzione. La forza muscolare è più importante per la salute rispetto alla massa muscolare72Tuttavia, non siamo a conoscenza di alcun legame biologico tra HT e forza muscolare che non sarebbe mediata attraverso la massa muscolare, da qui la ragione per cui questa analisi si è concentrata su quest’ultima. Una precedente revisione sistematica e meta-analisi di 23 studi umani ha mostrato piccoli, significativi benefici di HT nel preservare la forza muscolare scheletrica, traducendosi in circa il 5% in più di forza negli utenti di HT rispetto ai partecipanti al controllo.31 Tuttavia, il tipo, il dosaggio e la durata di HT tra questi studi non erano coerenti e variavano molto da studio a studio. Pertanto, è necessario un ulteriore lavoro in questo settore.
Limitazioni
Questo studio aveva diversi limiti. Molti degli studi utilizzati nella nostra revisione sono stati considerati ad alto rischio di distorsione e la qualità complessiva delle prove era bassa sulla base di GRADE. La qualità delle prove è stata comunemente declassata a causa del rischio di distorsione dello studio, della pubblicazione o dell’imprecisione. L’imprecisione era presente quando gli studi non soddisfacevano la dimensione ottimale delle informazioni o se l’IC del 95% della differenza media superava lo zero. Tuttavia, questa definizione di imprecisione è difficile da interpretare se si suppone che vi sia un’associazione nulla e che l’IC debba includere lo zero. Inoltre, la presenza di un errore di pubblicazione dimostra che è più probabile che vengano pubblicati studi più piccoli con effetti più grandi e significativi. In una meta-analisi, questo può distorcere i risultati a favore del trattamento, indipendentemente dal fatto che esista o meno un vero effetto. Nonostante i limiti della letteratura, i risultati di questa revisione sono rimasti coerenti tra i sottogruppi, indicando che l’insieme della letteratura non ha mostrato un’associazione significativa tra HT e massa muscolare. Dei 12 studi inclusi, 1 ha avuto un risultato statisticamente significativo; tuttavia, è stato fortemente limitato da un campione di 14 partecipanti.
Conclusioni
Questa revisione sistematica e meta-analisi di 12 studi clinici randomizzati che esplorano la ritenzione della massa muscolare nelle donne in postmenopausa non ha mostrato una significativa associazione benefica o dannosa di HT con la massa muscolare. Mettendo in comune i dati di tutti gli studi, i partecipanti che hanno usato HT hanno perso 0,06 kg (95% CI, da -0,05 a 0,18 kg; P = 0,26) meno LBM rispetto ai partecipanti al controllo, ed è rimasta una significativa eterogeneità tra gli studi. Effetti studio individuale variava da -0,06 kg (-0,30 a 0,19 kg) a 0,20 kg (-0,08 a 0,48 kg). I risultati delle analisi dei sottogruppi in base alla durata del follow-up, al tempo trascorso dalla menopausa, alla qualità dello studio, al dosaggio degli estrogeni e al tipo di misurazione della LBM non erano statisticamente significativi. Nonostante i limiti della letteratura, questo studio evidenzia i risultati costantemente nulli negli studi che indagano l’HT e la ritenzione della massa muscolare. L’importanza della ritenzione muscolare nelle donne che invecchiano è fondamentale, ma questi risultati suggeriscono che gli interventi diversi da HT dovrebbero essere esplorati.
References
- 2018. Publisher Full Text
- Why women live longer than men: sex differences in longevity. Gend Med. 2006; 3(2)DOI | PubMed
- Gender and age differences in lean soft tissue mass and sarcopenia among healthy elderly. Anthropol Anz. 2009; 67(2):139-151. DOI | PubMed
- Prevalence of sarcopenia in the world: a systematic review and meta-analysis of general population studies. J Diabetes Metab Disord. 2017; 16(1):21. DOI | PubMed
- Menopause. Med Clin North Am. 2015; 99(3):521-534. DOI | PubMed
- Low relative skeletal muscle mass (sarcopenia) in older persons is associated with functional impairment and physical disability. J Am Geriatr Soc. 2002; 50(5):889-896. DOI | PubMed
- Operational definitions of sarcopenia and their associations with 5-year changes in falls risk in community-dwelling middle-aged and older adults. Osteoporos Int. 2014; 25(1):187-193. DOI | PubMed
- Sarcopenia as a risk factor for falls in elderly individuals: results from the ilSIRENTE study. Clin Nutr. 2012; 31(5):652-658. DOI | PubMed
- Sarcopenia and falls in community-dwelling elderly subjects in Japan: defining sarcopenia according to criteria of the European Working Group on Sarcopenia in Older People. Arch Gerontol Geriatr. 2014; 59(2):295-299. DOI | PubMed
- Sarcopenia: prevalence and prognostic significance in hospitalized patients. Clin Nutr. 2013; 32(5):772-776. DOI | PubMed
- Sarcopenia: an independent predictor of mortality in community-dwelling older Korean men. J Gerontol A Biol Sci Med Sci. 2014; 69(10):1244-1252. DOI | PubMed
- Sarcopenia and mortality risk in frail older persons aged 80 years and older: results from ilSIRENTE study. Age Ageing. 2013; 42(2):203-209. DOI | PubMed
- The effect of hormone replacement therapy on appendicular lean tissue mass in early postmenopausal women. Menopause. 2002; 9(2):117-121. DOI | PubMed
- Hormone replacement therapy does not augment gains in muscle strength or fat-free mass in response to weight-bearing exercise. J Gerontol A Biol Sci Med Sci. 1997; 52(3):B166-B170. DOI | PubMed
- Supplementation with DHEA: effect on muscle size, strength, quality of life, and lipids. J Womens Health (Larchmt). 2005; 14(5):391-400. DOI | PubMed
- Differential effects of oral estrogen versus oral estrogen-androgen replacement therapy on body composition in postmenopausal women. J Clin Endocrinol Metab. 2002; 87(4):1509-1516. DOI | PubMed
- Changes in muscle strength in women following the menopause: a longitudinal assessment of the efficacy of hormone replacement therapy. Clin Sci (Lond). 1999; 97(1):79-84. DOI | PubMed
- Publisher Full Text
- Relationship between estrogen use and musculoskeletal function in postmenopausal women. Maturitas. 2002; 42(2):119-127. DOI | PubMed
- Estrogen replacement, muscle composition, and physical function: The Health ABC Study. Med Sci Sports Exerc. 2005; 37(10):1741-1747. DOI | PubMed
- Estrogen receptor alpha mRNA in human skeletal muscles. Med Sci Sports Exerc. 2003; 35(3):439-443. DOI | PubMed
- Androgen and estrogen binding in rat skeletal and perineal muscles. Can J Biochem. 1976; 54(1):50-55. DOI | PubMed
- Preparation and evaluation of 17-ethynyl-substituted 16 α-[18F]fluoroestradiols: selective receptor-based PET imaging agents. Int J Rad Appl Instrum B. 1992; 19(3):363-374. DOI | PubMed
- Both oral and transdermal estrogen increase growth hormone release in postmenopausal women—a clinical research center study. J Clin Endocrinol Metab. 1996; 81(6):2250-2256. PubMed
- Sarcopenia and muscle function during menopause and hormone-replacement therapy. J Nutr Health Aging. 2000; 4(3):156-161. PubMed
- The roles of estrogen and progesterone in regulating carbohydrate and fat utilization at rest and during exercise. J Womens Health Gend Based Med. 2002; 11(3):225-237. DOI | PubMed
- Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002; 288(3):321-333. DOI | PubMed
- A “window of opportunity”: the reduction of coronary heart disease and total mortality with menopausal therapies is age- and time-dependent. Brain Res. 2011; 1379:244-252. DOI | PubMed
- The timing hypothesis for coronary heart disease prevention with hormone therapy: past, present and future in perspective. Climacteric. 2012; 15(3):217-228. DOI | PubMed
- Muscle performance, sex hormones and training in peri-menopausal and post-menopausal women. Scand J Med Sci Sports. 2003; 13(1):19-25. DOI | PubMed
- Hormone therapy and skeletal muscle strength: a meta-analysis. J Gerontol A Biol Sci Med Sci. 2009; 64(10):1071-1081. DOI | PubMed
- Benefits of estrogen replacement for skeletal muscle mass and function in post-menopausal females: evidence from human and animal studies. Eurasian J Med. 2011; 43(2):109-114. DOI | PubMed
- Prospective evaluation of body weight and body fat distribution in early postmenopausal women with and without hormonal replacement therapy. Maturitas. 2001; 39(2):125-132. DOI | PubMed
- Predictors of skeletal muscle mass in elderly men and women. Mech Ageing Dev. 1999; 107(2):123-136. DOI | PubMed
- The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009; 6(7):e1000100. DOI | PubMed
- 2011. Publisher Full Text
- The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011; 343(7829):d5928. DOI | PubMed
- GRADE guidelines: 1, introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011; 64(4):383-394. DOI | PubMed
- GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008; 336(7650):924-926. DOI | PubMed
- Bias in meta-analysis detected by a simple, graphical test: asymmetry detected in funnel plot was probably due to true heterogeneity. BMJ. 1998; 316(7129):469-471. DOI | PubMed
- Operating characteristics of a rank correlation test for publication bias. Biometrics. 1994; 50(4):1088-1101. DOI | PubMed
- .
- Hormone replacement therapy: the benefits in tailoring the regimen and dose. Maturitas. 2001; 40(3):195-201. DOI | PubMed
- The minimum effective dose of estrogen for prevention of postmenopausal bone loss. Obstet Gynecol. 1984; 63(6):759-763. PubMed
- Ultra-low-dose estradiol and norethisterone acetate: effective menopausal symptom relief. Climacteric. 2007; 10(2):120-131. DOI | PubMed
- Effect of hormone therapy on lean body mass, falls, and fractures: 6-year results from the Women’s Health Initiative hormone trials. Menopause. 2011; 18(1):44-52. DOI | PubMed
- Growth hormone and sex steroid administration in healthy aged women and men: a randomized controlled trial. JAMA. 2002; 288(18):2282-2292. DOI | PubMed
- Postmenopausal hormone replacement therapy prevents central distribution of body fat after menopause. Metabolism. 1991; 40(12):1323-1326. DOI | PubMed
- Hormone replacement therapy dissociates fat mass and bone mass, and tends to reduce weight gain in early postmenopausal women: a randomized controlled 5-year clinical trial of the Danish Osteoporosis Prevention Study. J Bone Miner Res. 2003; 18(2):333-342. DOI | PubMed
- Effects of ultra-low-dose estrogen therapy on muscle and physical function in older women. J Am Geriatr Soc. 2005; 53(11):1973-1977. DOI | PubMed
- Muscular transcriptome in postmenopausal women with or without hormone replacement. Rejuvenation Res. 2007; 10(4):485-500. DOI | PubMed
- Effects of hormone replacement therapy and high-impact physical exercise on skeletal muscle in post-menopausal women: a randomized placebo-controlled study. Clin Sci (Lond). 2001; 101(2):147-157. DOI | PubMed
- Body composition during treatment with conjugated estrogens with and without medroxyprogesterone acetate: analysis of the Women’s Health, Osteoporosis, Progestin, Estrogen (HOPE) trial. Am J Obstet Gynecol. 2007; 197(2):137.e1-137.e7. DOI | PubMed
- Updated 2013 International Menopause Society recommendations on menopausal hormone therapy and preventive strategies for midlife health. Climacteric. 2013; 16(3):316-337. DOI | PubMed
- Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab. 2010; 95(7):s1-s66. DOI | PubMed
- Measurement of body composition in burned children: is there a gold standard?. JPEN J Parenter Enteral Nutr. 2010; 34(1):55-63. DOI | PubMed
- Postmenopausal hormone therapy and body composition—a substudy of the estrogen plus progestin trial of the Women’s Health Initiative. Am J Clin Nutr. 2005; 82(3):651-656. DOI | PubMed
- Estrogen/gestagen therapy changes soft tissue body composition in postmenopausal women. Metabolism. 1989; 38(7):662-665. DOI | PubMed
- Obesity and sarcopenia after menopause are reversed by sex hormone replacement therapy. Obes Res. 2001; 9(10):622-626. DOI | PubMed
- The influence of menopause and hormonal replacement therapy on body cell mass and body fat mass. Am J Obstet Gynecol. 1995; 172(3):896-900. DOI | PubMed
- Effects of HRT and exercise training on insulin action, glucose tolerance, and body composition in older women. J Appl Physiol (1985). 2001; 90(6):2033-2040. DOI | PubMed
- The Physical Activity Scale for the Elderly (PASE): development and evaluation. J Clin Epidemiol. 1993; 46(2):153-162. DOI | PubMed
- The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. J Gerontol A Biol Sci Med Sci. 2006; 61(10):1059-1064. DOI | PubMed
- An overview of sarcopenia: facts and numbers on prevalence and clinical impact. J Cachexia Sarcopenia Muscle. 2010; 1(2):129-133. DOI | PubMed
- Risk of mortality according to body mass index and body composition among postmenopausal women. Am J Epidemiol. 2015; 182(7):585-596. DOI | PubMed
- Publisher Full Text
- Comment on “Cut-off points to identify sarcopenia according to European Working Group on Sarcopenia in Older People (EWGSOP) definition.”. Clin Nutr. 2016; 35(6):1568-1569. DOI | PubMed
- Changes in muscle mass and strength after menopause. J Musculoskelet Neuronal Interact. 2009; 9(4):186-197. PubMed
- Resistive training increases fat-free mass and maintains RMR despite weight loss in postmenopausal women. J Appl Physiol (1985). 1995; 79(3):818-823. DOI | PubMed
- No sustained effect of aerobic or resistance training on insulin sensitivity in nonobese, healthy older women. J Aging Phys Act. 2005; 13(3):314-326. DOI | PubMed
- Effects of exercise training and hormone replacement therapy on lean and fat mass in postmenopausal women. J Gerontol A Biol Sci Med Sci. 2003; 58(3):266-270. DOI | PubMed
- Strength, but not muscle mass, is associated with mortality in the health, aging and body composition study cohort. J Gerontol A Biol Sci Med Sci. 2006; 61(1):72-77. DOI | PubMed
Fonte
Javed AA, Mayhew AJ, Shea AK, Raina P (2019) Association Between Hormone Therapy and Muscle Mass in Postmenopausal Women. JAMA Network Open 2(8): e1910154. https://doi.org/10.1001/jamanetworkopen.2019.10154





