Abstract
Background
L’epilessia, la più comune condizione neurologica cronica, colpisce lo 0,6-1% della popolazione [1, 2]. L’epilessia nelle donne in gravidanza provoca frequenti crisi epilettiche, aumentando il rischio di complicazioni legate alla gravidanza[3, 4]. Gli antiepilettici (DAE) sono prescritti per ridurre la gravità dell’epilessia o per aiutare a gestire altre condizioni come il dolore, i disturbi psichiatrici e l’emicrania[5]. Le donne che assumono DAE hanno un rischio maggiore di aborto spontaneo e di teratogenicità, compresa una probabilità del 4-8% di partorire un bambino con una malformazione congenita maggiore (CM), perché questi agenti possono essere trasferiti al feto attraverso la placenta [3, 4, 6-8]. Fin dalla prima documentazione della teratogenicità dei DAE negli anni ’60[9, 10], l’uso di molti DAE di prima generazione (per esempio, il valproato) in donne gravide con epilessia è stato ampiamente studiato. Sono stati istituiti diversi registri di gravidanza su larga scala per valutare la sicurezza dei DAE di prima e nuova generazione (ad esempio, gabapentin)[11, 12]. Tuttavia, si sa poco sulla sicurezza “comparativa” dell’esposizione al DAE nell’utero, e gli studi precedenti che confrontano più DAE sono spesso piccoli e poco potenti. Come tale, abbiamo confrontato la sicurezza dei DAE nei neonati e nei bambini esposti in utero attraverso una revisione sistematica e una meta-analisi di rete (NMA).
Metodi
Il nostro protocollo è stato registrato con PROSPERO (CRD42014008925) e pubblicato in una rivista ad accesso aperto (file aggiuntivo 1)[13]. La nostra NMA è conforme alla guida ISPOR[14] e PRISMA-NMA (file aggiuntivo 2)[15].
Criteri di ammissibilità
Le donne incinte che assumono DAE per qualsiasi indicazione erano idonee. Sono stati inclusi studi sui seguenti DAE come monoterapia o politerapia di qualsiasi dose: di prima generazione (carbamazepina, clobazam, clonazepam, ethosuximide, fenobarbital, fenitoina, primidone, valproato) e di nuova generazione (commercializzati dopo il 1990; gabapentin, lamotrigina, levetiracetam, oxcarbazepina, topiramato, vigabatrin). I comparatori erano placebo, nessun trattamento DAE (donne non esposte a DAE ma con le stesse indicazioni per il loro uso), o altri DAE da soli o in combinazione. I documenti giudicati che includevano dati degli stessi pazienti sono stati esclusi dall’analisi per evitare il doppio conteggio. I rapporti dei colleghi degli studi inclusi sono stati utilizzati solo per informazioni supplementari.
I risultati primari sono stati l’incidenza di tipi generali e specifici di CM importanti, che sono stati definiti come malformazioni presenti sin dalla nascita con importanza chirurgica, medica, funzionale o cosmetica[16]. Quando gli studi hanno anche riportato casi di CM importanti che sono stati diagnosticati prima della nascita e che hanno portato a terminazioni elettive, questi sono stati inclusi nell’analisi della CM. Per specifici tipi di CM, sono stati selezionati i sei casi più frequenti in letteratura, ovvero cardiaco, labbro leporino/palato, piede torto, ipospadia, ernia inguinale e testicoli non discesi (solo per i maschi). I risultati secondari di interesse sono stati l’incidenza di perdite fetali combinate, ritardo di crescita prenatale, nascita pretermine e CMs minori (cioè, qualsiasi CM che non si qualifica come CM maggiore; File aggiuntivo 3: Appendice A). L’esito dei tipi di perdita fetale “combinata” comprende le perdite fetali totali riportate, nonché gli studi che riportano solo un tipo di perdita fetale (ad esempio, i nati morti). Sono stati inclusi studi clinici randomizzati (RCT), quasi-RCT e studi osservazionali con un gruppo di controllo che esamina gli effetti dei DAE su neonati e bambini (≤12 anni di età) che sono stati esposti a DAE in utero. Non sono state applicate restrizioni linguistiche o di altro tipo.
Fonti di informazione
Un bibliotecario esperto ha sviluppato le strategie di ricerca in MEDLINE, EMBASE e nel Registro CENTRALE di Cochrane dei processi controllati. La strategia di ricerca MEDLINE è stata sottoposta a peer review da un altro bibliotecario utilizzando la lista di controllo Peer Review of Electronic Search Strategies[17], e la versione finale è fornita nel nostro protocollo[13]. La ricerca della letteratura è stata inizialmente condotta dall’inizio fino al 18 marzo 2014, e un rapido aggiornamento è stato effettuato il 15 dicembre 2015. Sono state scansionate le liste di riferimento di tutti gli studi inclusi e le relative revisioni. Gli studi non pubblicati sono stati ricercati individuando gli abstract delle conferenze e contattando gli autori degli studi inclusi e i produttori di DAE.
Selezione degli studi e raccolta dei dati
Dopo che il team ha condotto due test pilota sui criteri di idoneità tra 10 revisori (12% di disaccordi), coppie di revisori hanno esaminato ciascun titolo/astratto in modo indipendente e i conflitti (6%) sono stati risolti attraverso la discussione. Successivamente, si sono verificati tre piloti di screening di livello 2 (26% di disaccordi) e tre piloti di astrazione dei dati. Lo stesso processo è stato seguito per gli articoli full-text potenzialmente rilevanti (16% di conflitti) e per l’astrazione dei dati. Gli autori sono stati contattati per gli studi pubblicati negli ultimi 10 anni per chiarire i dati non chiari o mancanti.
I bracci ‘no AED use’ sono stati inclusi solo se il gruppo di controllo aveva la stessa indicazione del braccio attivo nello studio (ad esempio, entrambi avevano l’epilessia). I tassi di malformazione sono stati espressi sulla base dei nati vivi più nati morti, in base al numero di donne incinte iscritte allo studio.
Valutazione della qualità metodologica e del rischio di pregiudizio
Due revisori hanno valutato la qualità in modo indipendente utilizzando lo strumento Cochrane risk of-bias[18] e la scala di Newcastle-Ottawa[19]. Il diagramma ad imbuto regolato per il confronto è stato utilizzato per valutare il bias di pubblicazione e gli effetti dei piccoli studi per i risultati di almeno 10 studi[20].
Nel diagramma ad imbuto regolato per il confronto, l’effetto complessivo del trattamento per ogni confronto è stato stimato secondo il modello di meta-analisi ad effetto fisso e la sua differenza rispetto all’effetto del trattamento specifico dello studio rispetto all’errore standard specifico dello studio. Tutti gli AED sono stati ordinati dai più vecchi ai più recenti in base alla data di approvazione sul mercato internazionale. Il grafico ad imbuto regolato per il confronto non tiene conto delle correlazioni indotte dagli studi multibraccio, che possono eventualmente causare una sovrastima e un’asimmetria del grafico ad imbuto della maschera. Per superare la maggior parte delle correlazioni negli studi multibraccio, sono stati tracciati solo i punti di dati corrispondenti ai parametri di base specifici dello studio (confronti di trattamento con un comune comparatore). Per questo, il gruppo di controllo è stato considerato il comparatore comune o, se questo mancava, il più vecchio comparatore di trattamento è stato utilizzato contro i rimanenti DAE dello studio corrispondente.
Sintesi degli studi inclusi
È stato applicato un modello di meta-analisi a effetti casuali perché gli studi differivano dal punto di vista metodologico e clinico. I dati sui risultati sono stati messi in comune utilizzando il rapporto di probabilità (OR) e, per due o più studi, l’OR è stato stimato utilizzando modelli gerarchici bayesiani e un algoritmo di Markov Chain Monte Carlo. Quando i confronti tra i trattamenti hanno formato una rete di prove collegate, è stata condotta una NMA a effetti casuali[21] utilizzando i nodi di trattamento predefiniti dall’équipe. Nei nodi sono state combinate dosi multiple, perché queste informazioni non sono state riportate in modo coerente in tutti gli studi. Sia nelle meta-analisi a coppie che nelle NMA, abbiamo ipotizzato una comune variazione tra i vari studi all’interno della rete(τ2)attraverso i confronti tra i trattamenti, dato che c’erano molti confronti tra i trattamenti, incluso un singolo studio in cui il (τ2)non era stimabile.
Prima di applicare una NMA, l’ipotesi di transitività è stata valutata utilizzando l’età, il rischio di base, l’indicazione del trattamento, i tempi di esposizione e il rischio di pregiudizio come potenziali modificatori dell’effetto del trattamento. La media di ciascun modificatore di effetto potenziale continuo e la modalità (cioè il valore più frequente) di ciascun modificatore di effetto potenziale categorico per ogni confronto e risultato sono stati presentati nelle tabelle[22]. Per ogni risultato, l’intera rete è stata valutata per incoerenza usando il modello di interazione design-by-treatment[23, 24]. Il modello degli effetti casuali è stato utilizzato quando erano disponibili più studi in ogni progetto nella rete; in alternativa, abbiamo applicato il modello degli effetti fissi. Se il test globale suggeriva l’incoerenza, l’incoerenza locale in percorsi di rete specifici è stata valutata utilizzando il metodo specifico del loop assumendo un comune all’interno del loop τ2[ 25, 26] . Questa era un’ipotesi clinicamente ragionevole, poiché i trattamenti erano della stessa natura. Quando sono state rilevate incoerenze statisticamente significative o importanti eterogeneità, i dati sono stati controllati per verificare la presenza di errori. Se non sono stati individuati errori, sono state condotte analisi di meta-regolazione, sottogruppi o sensibilità. Per il CM maggiore complessivo, le perdite fetali combinate e i risultati della crescita prenatale, la meta-reggressione di rete è stata eseguita per l’età e il rischio di base (cioè, utilizzando il gruppo di controllo), assumendo un coefficiente fisso comune tra i confronti. Per questi risultati, è stata condotta un’analisi di sottogruppo per la generazione di DAE (cioè, DAE più vecchi rispetto a quelli di nuova generazione), e progetti di studio (cioè, osservazionali rispetto a RCT). Le analisi di sensibilità sono state condotte sugli stessi risultati limitandosi agli studi con indicazione di trattamento (cioè, comprese solo le donne con epilessia), la tempistica di almeno il primo trimestre di esposizione, le dimensioni dello studio di grandi dimensioni (cioè, > 300 pazienti), l’assunzione di alcool da parte della madre e una qualità metodologica più elevata utilizzando due item della Scala di Newcastle-Ottawa per gli studi di coorte (adeguatezza del follow-up delle coorti, comparabilità delle coorti) e basso rischio complessivo per gli RCT (approccio per componenti utilizzando item di randomizzazione e di occultamento dell’allocazione) [27]. Per il risultato complessivo dei CM maggiori, sono state condotte analisi di sensibilità per gli studi di coorte, l’acido folico utilizzato da oltre il 50% delle donne e la storia familiare dei CM maggiori, compreso un grande studio di registro internazionale (EURAP)[28, 29] che non è stato incluso nell’analisi primaria a causa di una potenziale parziale sovrapposizione dei partecipanti con altri studi ed eliminando tre studi potenzialmente sovrapposti da Australia, Spagna e Argentina[30- 32]. Per le perdite fetali combinate e i risultati della crescita prenatale, è stata condotta un’analisi di sensibilità per l’uso materno del tabacco. Infine, per il CM complessivo maggiore, le perdite fetali combinate e gli esiti della crescita prenatale, è stato applicato il modello suggerito da Schmitz et al.[33] per diversi disegni di studio.
Nel modello di Schmitz et al.[33] non è stato introdotto l’aggiustamento del bias per tener conto della sovraprecisione o della sovra/sottostima, poiché non eravamo sicuri dell’entità del bias che avrebbe potuto essere introdotto includendo gli studi osservazionali. La bontà di adattamento è stata misurata utilizzando la media posteriore della devianza residua, il grado di eterogeneità tra gli studi e il criterio di informazione della devianza. In un modello ben adattato, la deviazione residua media posteriore dovrebbe essere vicina al numero di punti di dati[34, 35]. Una differenza di tre unità nel criterio di informazione della devianza è stata considerata importante e il valore più basso del criterio di informazione della devianza corrispondeva al modello con il miglior adattamento[34, 35].
La sicurezza dei farmaci DAE è stata classificata utilizzando la superficie sotto la curva di classificazione cumulativa (SUCRA)[36]. Più grande è il valore SUCRA per un trattamento, maggiore è il suo grado di sicurezza tra tutte le opzioni di trattamento disponibili. Idealmente, vorremmo osservare una ripida pendenza nella curva SUCRA che suggerisce che il trattamento corrispondente è molto probabilmente il più sicuro. Le curve SUCRA sono presentate insieme al 95% di CrIs. Per rappresentare i valori di SUCRA per tutti i risultati è stato utilizzato un diagramma del calore di rango(http://rh.ktss.ca/)[37].
Le meta-analisi e le NMA sono state eseguite all’interno di OpenBUGS[38], assumendo priori non informativi per tutti i parametri del modello e una distribuzione preliminare semianormale per la deviazione standard tra gli studi(τ τ N(0,1), ττ>>0). I modelli sono stati eseguiti per 100.000 iterazioni per garantire la convergenza del modello, che è stato controllato da un controllo visivo della miscelazione di due catene, dopo aver scartato le prime 10.000 iterazioni e diradamento di 10. Questi campioni sono stati utilizzati per calcolare la mediana e il 95% di intervalli credibili (CrI) per ogni valore di parametro. Le mediane sono state presentate al posto dei mezzi, poiché i mezzi possono essere eccessivamente influenzati da valori anomali. Il modello di interazione design-by-treatment è stato eseguito in Stata utilizzando il comando di rete[39]. Le meta-analisi e gli OR NMA sono stati presentati con il 95% di CrI per ogni coppia di trattamenti. Per le stime dell’effetto NMA, è stato presentato anche un intervallo predittivo del 95% (PrI), catturando la magnitudine di τ2e presentando l’intervallo entro il quale ci si aspetterebbe che l’effetto del trattamento di un futuro studio si trovi [40, 41] .
Nelle sezioni seguenti, i termini “più sicuro” e “dannoso” sono utilizzati per indicare quando un trattamento è associato a un rischio minore (più sicuro) o maggiore (dannoso) di avere un esito negativo rispetto all’alternativa (ad esempio, un altro DAE o un controllo).
Risultati
Ricerca della letteratura
Dopo aver esaminato 5305 titoli ed estratti, 642 articoli full-text potenzialmente rilevanti e 17 studi aggiuntivi identificati dalla scansione delle liste di riferimento, sono state incluse 154 pubblicazioni che descrivono 110 studi diversi (Fig. 1). Dei 110 studi inclusi, nove sono stati scritti in lingue diverse dall’inglese e tre erano abstract di conferenze o lettere all’editore con dati utilizzabili. La scansione delle liste di riferimento degli articoli inclusi e delle relative recensioni ha individuato 13 studi aggiuntivi. Complessivamente, il 48% (22/46) degli autori contattati ha risposto alla nostra richiesta, ma solo il 17% (8/46) è stato in grado di fornire dati aggiuntivi per la nostra analisi. Inoltre, il 29% (13/45) degli autori di abstract di conferenze ha risposto alla nostra richiesta, ma nessuno è stato in grado di fornire dati non pubblicati per la nostra analisi. Non siamo stati in grado di contattare 11 autori a causa di indirizzi e-mail non funzionanti. Un autore ha fornito un manoscritto e quattro autori hanno fornito dati non pubblicati che sono stati inclusi nell’analisi.
Diciassette degli studi idonei hanno riportato risultati neurologici che sono stati esclusi in questo documento e riportati in un altro documento (comunicazione personale con il Dr. Veroniki), lasciando 96 studi con 58.461 pazienti (riportati in 93 articoli) inclusi per l’analisi (File aggiuntivo 3: Appendice B). Una tabella degli studi chiave esclusi a causa della segnalazione di un solo braccio di trattamento con dati estraibili è fornita nel file aggiuntivo 3: Appendice C.
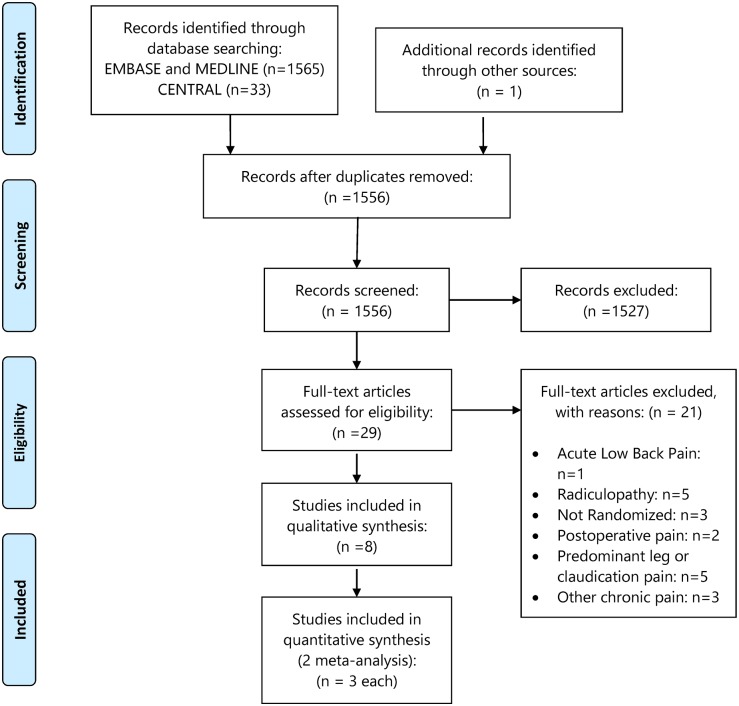
Fig. 1.Flusso degli studi
Caratteristiche dello studio e del paziente
Abbiamo incluso 92 studi di coorte, tre studi caso-controllo e un RCT (Tabella 1, File aggiuntivo 3: Appendici D ed E) pubblicati tra il 1964 e il 2015. Il numero di pazienti inclusi per studio variava da 18 a 7759. L’indicazione studio più comune era l’epilessia (93%), e quasi la metà degli studi (49%) comprendeva donne non curate con epilessia come gruppo di controllo. L’età materna media variava da 24 a 34 anni. La maggior parte degli studi (58%) è stata condotta in Europa, seguita dal Nord America (19%).Tabella 1Caratteristica delle caratteristiche principali degli studi inclusiNumero di studi(n = 96) Percentuale del totale Anno di pubblicazione 1964-198077.291981-19901919,791991-20002222,92 2001-200588,332006-20101212,502011-20152829,17ContinenteEuropa5658,33 Nord America181818.75 Asia1010.42Trans-Continental55.21Australia33.13Australia33.13Africa33.13Africa11.04Progettazione dello studio Coorte osservazionale9295.83Case-control33.13Studio clinico randomizzato11.04Studio del registro SI3031.25No6668.75Dimensione del campione 18-501616.6751-1002627.08101-3003233.33301-50088.33501-100022.081001-77591212.50Numero interventisa 2-44142.71 5-73031.25 8-101515.63 11-171010.42 Finanziamento pubblico2121.88 Privato77.29 Misto pubblico e privato161616.67 Non segnalato5254.17Indicazione Epilessia8992.71 Indicazioni miste11.04 Malattia mentale11.04 Non segnalato55.21Gruppo di controllo epiletticoSì4748.96 No/non segnalato/non applicabile4951.04Età materna, anni 24-26111111.46 27-292323.96 30-3477.29 Non segnalato5557.29Tempo di esposizione ai farmaci antiepilettici almeno nel 1° trimestre6466.67 No/non segnalato3233.33Consumo di acido folico dichiarato131313,54 Non dichiarato8386,46Consumo di alcolici dichiarato55,21 Non dichiarato9194,79Consumo di tabacco dichiarato1010,42 Non dichiarato8689,58aIncluso qualsiasi gruppo di controllo pertinente
Qualità metodologica / rischio di errore
L’RCT è stato valutato con lo strumento Cochrane risk of-bias e presentava un rischio di errore non chiaro per la segnalazione di errori e di “altri” errori (ad esempio, errori di finanziamento), nonché un alto rischio di errore per la generazione di sequenze casuali e l’occultamento di assegnazioni (file aggiuntivo 3: Appendice F). Con la Scala di Newcastle-Ottawa sono stati valutati tre studi caso-controllo e 92 studi di coorte. Gli studi caso-controllo avevano un’elevata qualità metodologica su tutti gli item, ad eccezione della comparabilità delle coorti sulla base del disegno/analisi (File aggiuntivo 3: Appendice G). Le carenze metodologiche negli studi di coorte (File aggiuntivo 3: Appendice H) includevano il non controllo per i confonditori (81%) o la segnalazione del numero di pazienti persi per il follow-up (59%). I grafici ad imbuto corretti per il confronto non hanno mostrato alcuna evidenza di distorsioni di pubblicazione e di effetti di piccoli studi su tutti gli esiti (File aggiuntivo 3: Appendice I).
Analisi statistica
L’ipotesi della transitività è stata mantenuta per l’età media, il rischio di base medio, l’indicazione del trattamento e la tempistica (file aggiuntivo 3: Appendice J). Tuttavia, l’adeguatezza del follow-up e la comparabilità delle voci di coorte variava a seconda del trattamento. Il modello di interazione design-by-treatment ha suggerito che non c’era evidenza di incoerenza statisticamente significativa per tutti gli esiti e le analisi aggiuntive (File aggiuntivo 3: Appendice J).
Nelle sezioni seguenti, vengono discussi i risultati complessivi delle analisi NMA, della meta regressione, del sottogruppo e della sensibilità per ogni risultato; i risultati della curva SUCRA sono presentati nella Fig. 2 e nel file aggiuntivo 3: Appendice K. Inoltre, le dimensioni del campione di DAE e i rischi assoluti per ogni DAE si trovano nel file aggiuntivo 3: Appendice K.Fig. 2Rank heat plot per le principali malformazioni congenite (CMs), le perdite fetali combinate, il ritardo di crescita prenatale e la nascita pretermine. Rank-heat plot di 49 trattamenti (presentati in 49 raggi) e quattro esiti (presentati in quattro cerchi concentrici). Ogni settore è colorato in base al valore SUCRA del trattamento e dell’esito corrispondente utilizzando la trasformazione di tre colori: rosso (0%), giallo (50%) e verde (100%). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno, fenitoina fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
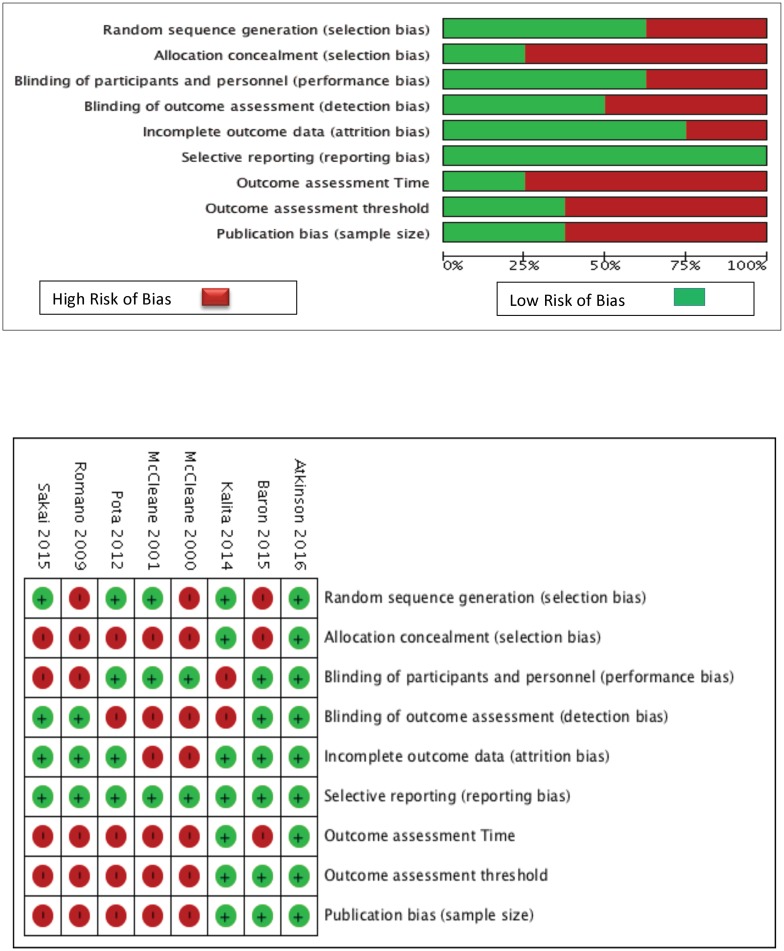
Fig. 2.Fig. 2. Grado di calore grafico per le principali malformazioni congenite complessive (CMs), perdite fetali combinate, ritardo di crescita prenatale, e la nascita pretermine. Fig. 3. Grafico del calore di 49 trattamenti (presentati in 49 raggi) e quattro risultati (presentati in quattro cerchi concentrici). Ogni settore è colorato in base al valore SUCRA del trattamento e dell’esito corrispondente utilizzando la trasformazione di tre colori: rosso (0%), giallo (50%) e verde (100%). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno, fenitoina fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
Complessivamente i principali CMs
Il rischio mediano di base del CM maggiore nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,026 (intervallo interquartile, 0,000-0,092; File aggiuntivo 3: Appendice K). La NMA sui CM maggiori complessivi comprendeva 75 studi di coorte, due studi caso-controllo e un RCT, 35.016 casi, 47 DAE più controllo, con il 15% di tutti i confronti a coppie che hanno raggiunto la significatività statistica (Fig. 3a File aggiuntivo 3: Appendici J e L). Le seguenti monoterapie sono state associate a un numero statisticamente significativamente maggiore di casi che sviluppano CMs principali rispetto al controllo: ethosuximide (OR, 3.04; 95% CrI, 1.23-7.07), valproato (OR, 2.93; 95% CrI, 2.36-3.69), topiramato (OR, 1,90; 95% CrI, 1,17-2,97), fenobarbital (OR, 1,83; 95% CrI, 1,35-2,47), fenitoina (OR, 1,67; 95% CrI, 1,30-2,17), e carbamazepina (OR, 1,37; 95% CrI, 1,10-1,71) (Fig. 4a). Gabapentin (OR, 1,00; 95% CrI, 0,47-1,89), lamotrigina (OR, 0,96; 95% CrI, 0,72-1,25), levetiracetam (OR, 0,72; 95% CrI, 0,43-1.16), e nove politerapie non avevano prove sufficienti per raggiungere la significatività statistica (Fig. 4a).Fig. 3 Trame di rete per le principali malformazioni congenite complessive, le perdite fetali combinate, il ritardo di crescita prenatale e la nascita pretermine. Ogni nodo di trattamento è ponderato in base al numero di pazienti che hanno ricevuto il particolare trattamento, e ogni margine è ponderato in base al numero di studi che confrontano i trattamenti che collega. carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno, fenitoina fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrinFig. 4Meta-analisi in rete delle trame forestali per ogni trattamento contro il controllo. Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala del odds ratio (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR1 suggerisce che il controllo è più sicuro, mentre un OR1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR==1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene anche presentata la dimensione totale del campione (n) inclusa in ogni trattamento. a Complessivamente le principali malformazioni congenite (78 studi, 35.016 casi, 48 trattamenti). b Perdite fetali combinate (31 studi, 13.487 casi, 28 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone, topir topiramato, valpro valproato, vigab vigabatrin
I risultati nel sottogruppo NMA quando si limitano agli studi osservazionali (2 studi caso-controllo e 75 studi di coorte, 34.966 casi, 48 trattamenti; τ2=0,03; 95% CrI, 0,00-0,13) erano d’accordo con la NMA. L’analisi di sensibilità limitata agli studi di coorte (75 studi, 34.667 casi, 48 trattamenti; τ2=0,02; 95% CrI, 0,00-0,11) ha trovato risultati comparabili con la NMA, ma il clonazepam più valproato era marginalmente non statisticamente significativo (OR, 12,780; 95% CrI, 0,974-68,810). Risultati simili sono stati osservati anche con il modello di Schmitz (1 RCT, 2 casi di controllo e 75 studi di coorte, 35.016 casi, 48 trattamenti; τ2= 0,30; 95% CrI, 0,00-3,95), ma la carbamazepina rispetto al controllo non era statisticamente significativa (OR, 1,34; 95% CrI, 0,27-5,02) simile ai risultati ottenuti con l’RCT (1 studio, 50 casi, 3 trattamenti).
Risultati simili alla NMA sono stati trovati con l’analisi di sensibilità che include lo studio EURAP (1 RCT, 2 casi di controllo e 73 studi di coorte, 48 trattamenti, 38.151 casi; τ2=0,04; 95% CrI, 0,00-0.13), dove il controllo aveva un rischio statisticamente significativamente più basso di CM maggiore rispetto al valproato combinato con carbamazepina e fenitoina (OR, 6,14; 95% CrI, 1,06-29,14) o con lamotrigina (OR, 2,94; 95% CrI, 1,61-5,05), ma non aveva un rischio significativamente più basso di CM maggiore rispetto all’etossimide (OR, 3,13; 95% CrI, 0,77-6,59). Il modello Schmitz per l’analisi di sensibilità che include l’EURAP (1 RCT, 2 studi di coorte e 73 studi di coorte, 38.151 casi, 48 trattamenti; τ2=0,31; 95% CrI, 0,00-3,58) ha suggerito un OR statisticamente significativo per il confronto lamotrigina più valproato rispetto al controllo (OR, 3.01; 95% CrI, 1,60-5,27), mentre il clonazepam più valproato (OR, 11,17; 95% CrI, 0,77-66,36) e la carbamazepina (OR, 1,32; 95% CrI, 0,26-4,64) non differivano statisticamente in modo significativo dal controllo.
I risultati dell’analisi di sensibilità per i tempi di esposizione al DAE nel primo trimestre (1 RCT e 49 studi di coorte, 25.329 casi, 46 trattamenti; τ2=0.04; 95% CrI, 0.00-0.17) per l’indicazione al trattamento dell’epilessia (1 RCT, 2 studi di coorte e 68 studi di coorte, 30.289 casi, 47 trattamenti; τ2=0,03; 95% CrI, 0,00-0,13) e per i DAE più vecchi (es, senza controllo, gabapentin, lamotrigina, levetiracetam, oxcarbazepina, topiramato e vigabatrin; 1 RCT, 2 casi di controllo e 50 studi di coorte, 6982 casi, 31 trattamenti; τ2=0,08; 95% CrI, 0,00-0,27) complessivamente concordato con la NMA. Tuttavia, nella tempistica, la poli-terapia carbamazepina più fenitoina più valproato è stata associata a un numero statisticamente significativamente maggiore di casi che sviluppano CMs principali rispetto al controllo (OR, 8,00; 95% CrI, 1,02-32,61), mentre il clonazepam più valproato (OR, 13,34; 95% CrI, 0,21-90,51) e l’ethosuximide (OR, 2,80; 95% CrI, 0,93-6,52) non differivano statisticamente dal controllo.
Cinque studi di coorte su 5212 donne con una storia di alcool a confronto di 16 trattamenti(τ2=0,20; 95% CrI, 0,00-1,49) e due studi di coorte a confronto di 11 trattamenti su 5057 donne hanno riportato una storia familiare di CMs (τ2=0,23; 95%CrI, 0,00-3,42), suggerendo che nessun DAE era statisticamente significativamente diverso dal controllo. Altri 5 studi di coorte che hanno riportato l’uso di acido folico in più del 50% dei 10.825 includevano donne che hanno confrontato 15 trattamenti e hanno mostrato che il valproato era statisticamente significativamente più dannoso del controllo (OR, 2,86; 95% CrI, 1,18-6,22; τ2= 0,09; 95% CrI, 0,00-0,72).
Per valutare l’impatto di piccoli studi, abbiamo condotto una NMA limitata a studi che includevano più di 300 casi. Abbiamo incluso 13 studi di coorte, 27.227 casi e 22 trattamenti(τ2 = 0,03; 95% CrI, 0,00-0,17), e l’analisi di sensibilità ha suggerito che la carbamazepina più fenitoina più valproato è stato associato con statisticamente significativamente più casi che sviluppano CMs principali rispetto al controllo (OR, 20.77; 95% CrI, 1,72-154,20), mentre il clonazepam più valproato (OR, 11,65; 95% CrI, 0,82-71,86) non differivano statisticamente dal controllo. L’analisi di sensibilità per il basso rischio di distorsioni nella comparabilità delle voci di coorte sulla Scala di Newcastle-Ottawa, compresi 10 studi osservazionali, 21.622 casi, e 31 trattamenti(τ2=0,03; 95% CrI, 0,00-0.21), ha suggerito che solo il fenobarbital (OR, 2,22; 95% CrI, 1,12-4,08), il topiramato (OR, 1,89; 95% CrI, 1,10-3,24), e il valproato (OR, 2,77; 95% CrI, 1,92-4,09) erano statisticamente significativamente diversi dal controllo. Quando si limita a basso rischio di pregiudizio per l’adeguatezza del follow-up delle coorti (k = 35, n = 20.122; τ2 = 0,05; 95% CrI,0,00-0,22), fenitoina più primidone (OR, 2.58; 95% CrI, 0,46-9,77), fenitoina più valproato (OR, 1,90; 95% CrI, 0,23-8,94), e topiramato (OR, 1,59; 95% CrI, 0,63-3,40) non erano più statisticamente significativamente diversi da zero.
La contabilizzazione del rischio di base in un modello di meta-regolazione di rete ha portato a un’associazione statisticamente non significativa con l’effetto del trattamento (1 RCT, 2 studi di coorte e 75 studi di coorte, 35.016 casi, 48 trattamenti, coefficiente di regressione stimato su scala OR, 1.02; 95% CrI, 0,93-1,10; τ2=0,03; 95% CrI, 0,00-0,14; devianza residua=411, punti dati=468, criterio di informazione della devianza=562). Allo stesso modo, un’associazione statisticamente significativa non è stata osservata nella nostra analisi di meta-regressione di rete condotta utilizzando l’età come covariata (32 studi di coorte, 15.948 casi, 43 trattamenti, coefficiente di regressione stimato su scala OR, 0.99; 95% CrI, 0,85-1,15; τ2=0,03; 95% CrI, 0,00-0,16; devianza residua= 180, punti dati=213, criterio di informazione della devianza=267). Per maggiori dettagli sul sottogruppo, sulla meta regressione e sull’analisi di sensibilità si veda il file aggiuntivo 3: Appendice M).
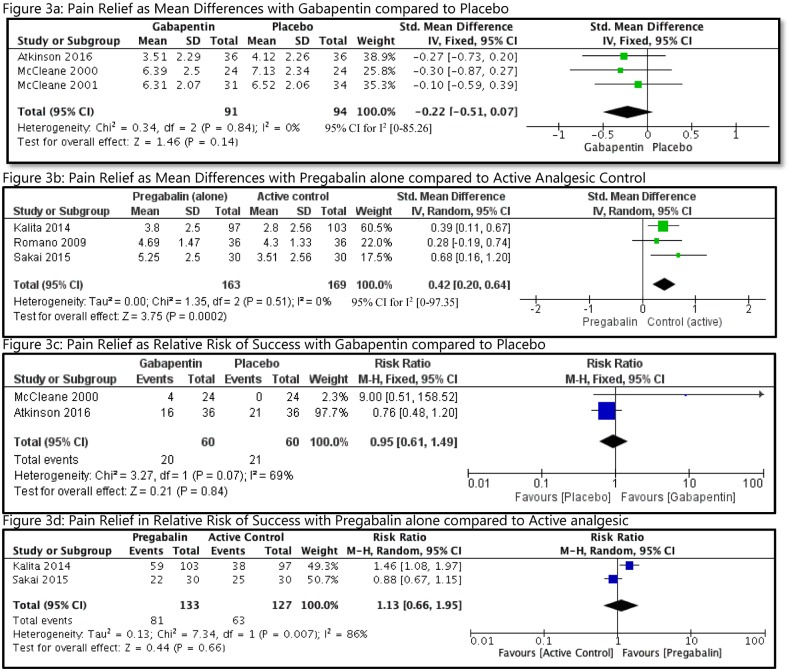
Fig. 3.Fig. 3. Trame di rete per le principali malformazioni congenite complessive, perdite fetali combinate, ritardo di crescita prenatale e nascita pretermine. Ogni nodo di trattamento è ponderato in base al numero di pazienti che hanno ricevuto il particolare trattamento, e ogni margine è ponderato in base al numero di studi che confrontano i trattamenti che collega. carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital fenobarbital, fenito fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
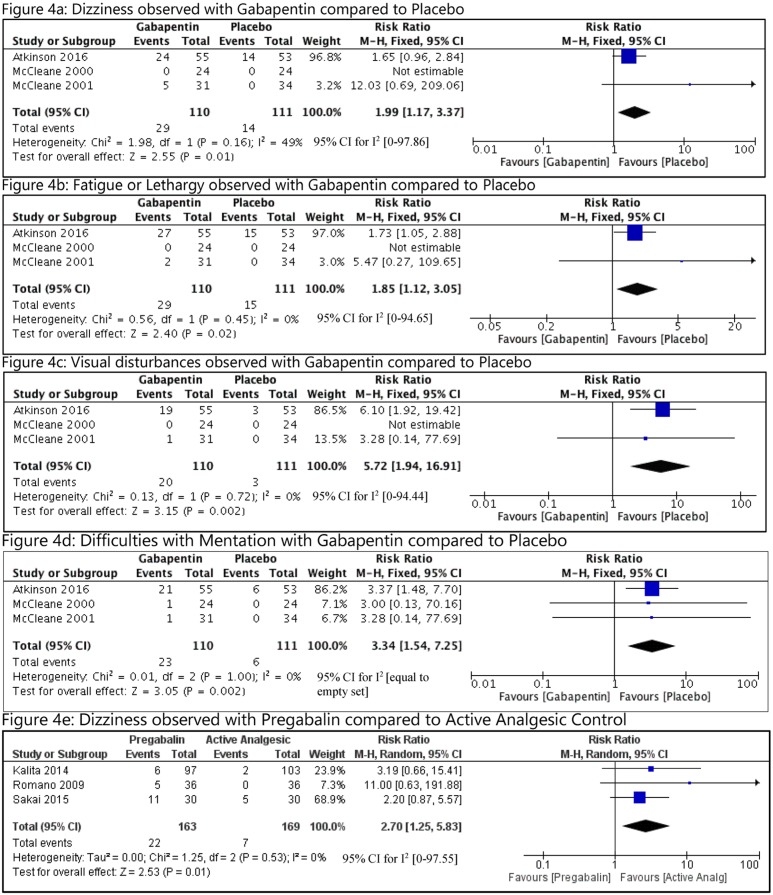
Fig. 4.Fig. 4. Meta-analisi in rete delle parcelle forestali di meta-analisi per ogni trattamento contro il controllo. Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle quote (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR1 suggerisce che il controllo è più sicuro, mentre un OR1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR==1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene anche presentata la dimensione totale del campione (n) inclusa in ogni trattamento. a Complessivamente le principali malformazioni congenite (78 studi, 35.016 casi, 48 trattamenti). b Perdite fetali combinate (31 studi, 13.487 casi, 28 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone, topir topiramato, valpro valproato, vigab vigabatrin
Perdite fetali combinate
Il rischio mediano di base di perdite fetali combinate nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile: 0,000-0,000; File aggiuntivo 3: Appendice K). La NMA per le perdite fetali combinate comprendeva 1 RCT, 1 studio caso-controllo e 29 studi di coorte, 13.487 gravidanze e 27 DAE più controllo, con il 5% dei confronti che hanno raggiunto la significatività statistica (Fig. 3b; File aggiuntivo 3: Appendici A, J e L). Topiramato (OR, 23,58; 95% CrI, 1,18-549,60), primidone (OR, 2,81; 95% CrI, 1,21-6,28), valproato (OR, 1,83; 95% CrI, 1,04-3,45), e due politerapie (carbamazepina più valproato: OR, 5,09; CrI 95%, 1,35-16,79; fenitoina più valproato: OR, 8,96; 95% CrI, 1,77-37,95) sono stati associati a perdite fetali statisticamente significativamente maggiori rispetto al controllo (Fig. 4b).
Risultati simili con le analisi NMA sono stati osservati nell’analisi dei sottogruppi, inclusi solo studi osservazionali (1 studio caso-controllo e 29 studi di coorte, 13.437 gravidanze; τ2=0,03; 95% CrI, 0,00-0,26) e nel modello di Schmitz (1 RCT, 1 studio caso-controllo e 29 studi di coorte, 13.487 gravidanze; τ2=0.36; 95% CrI, 0,00-4,17), dove il controllo è stato inoltre associato ad un rischio di perdita fetale marginalmente statisticamente molto più basso rispetto alla combinazione fenobarbital e fenitoina (OR, 3,04; 95% CrI, 1,07-7,18), ad eccezione del topiramato (OR, 13,06; 95% CrI, 0,77-365,50). I risultati dell’analisi di sensibilità per la tempistica di almeno il primo trimestre di esposizione al DAE (1 studio caso-controllo e 16 studi di coorte, 6970 gravidanze; τ2=0,04; 95% CrI, 0,00-0.17) erano in accordo con la NMA, e gli unici risultati statisticamente significativi di tutti i trattamenti rispetto al controllo sono stati per la carbamazepina combinata con valproato (OR, 7,83; 95% CrI, 1,62-32,08) o fenobarbital (OR, 4,73; 95% CrI, 1,24-17,24), con il controllo statisticamente più sicuro. Due studi di coorte con 318 donne con una storia di consumo di alcol durante la gravidanza hanno confrontato 10 trattamenti(τ2=0,31; 95% CrI, 0,00-3.87) e altri 3 studi di coorte con 4666 donne con un’anamnesi di fumo hanno confrontato 14 trattamenti(τ2=0,14; 95% CrI, 0,00-2,19), e hanno mostrato che solo la fenitoina più valproato era statisticamente significativamente diversa dal controllo (uso di alcolici: OR, 269,30; 95% CrI, 2,42-1,19×106, storia del fumo: OR, 180,30; 95% CrI, 6,10-4,17×105). La restrizione agli studi che mettono a confronto solo i DAE più vecchi (1 RCT, 1 caso di controllo e 20 studi di coorte, 3054 neonati; τ2=0,06; 95% CrI, 0,00-0.49) ha suggerito che il controllo era associato ad un rischio di perdita fetale marginalmente statisticamente significativamente più basso rispetto al fenobarbital più fenitoina (OR, 2,93; 95% CrI, 1,04-7,73), mentre il valproato (OR, 1,76; 95% CrI, 0,86-3,82) non era più statisticamente significativamente diverso dal controllo.
Le analisi di sensibilità si limitano a (1) studi con più di 300 gravidanze (4 studi di coorte, 10.224 donne, 10 trattamenti; τ2=0,25; 95% CrI, 0,00-2.05), (2) basso rischio di pregiudizio nella voce “comparabilità delle coorti” della Scala di Newcastle-Ottawa (2 studi di coorte, 5539 donne, 4 trattamenti; τ2==0 .75; 95% CrI, 0,00-5,42), e (3) basso rischio di pregiudizio per la voce “adeguatezza del follow-up delle coorti” (15 studi di coorte, 6236 donne, 23 trattamenti; τ2=0 ,07;95% CrI, 0,00-0,61) suggeriscono che nessun DAE differisce statisticamente in modo significativo dal controllo. Le analisi di meta-regressione della rete utilizzando il rischio di base (1 RCT, 1 studio caso-controllo, e 29 studi di coorte, 13.487 gravidanze, 28 trattamenti, coefficiente di regressione stimato su scala OR, 1,00; 95% CrI, 0,94-1,08; τ2=0,05; 95% CrI, 0.00-0.31; devianza residua=130, punti di dati=175, criterio di informazione della devianza=199) ed età (1 studio caso-controllo, 14 studi di coorte, 7152 gravidanze, 22 trattamenti, coefficiente di regressione stimato su scala OR, 0.92; 95% CrI, 0,67-1,33; τ2=0,09; 95% CrI, 0,00-0,58; devianza residua=74, punti dati=96, criterio di informazione della devianza=118) in quanto le covariate non suggeriscono alcuna associazione statisticamente significativa con l’effetto del trattamento (File aggiuntivo 3: Appendice M).
Ritardo della crescita prenatale
Il rischio mediano di ritardo della crescita prenatale nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,047 (intervallo interquartile, 0,024-0,100; File aggiuntivo 3: Appendice K). La NMA per il ritardo di crescita prenatale comprendeva 16 studi di coorte, 18.117 bambini, 22 DAE più controllo, con l’8% dei confronti che hanno raggiunto la significatività statistica (Fig. 3c; File aggiuntivo 3: Appendici A, J e L). Clobazam (OR, 4,47; 95% CrI, 1,60-11,18), topiramato (OR, 2,64; 95% CrI, 1,41-4,63), e fenobarbital (OR, 1,88; 95% CrI, 1,07-3,32) sono stati associati a un numero statisticamente significativo di bambini con ritardo di crescita prenatale rispetto al controllo (Fig. 5a). Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle probabilità (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) inclusa in ogni trattamento. a Ritardo della crescita prenatale (16 studi, 18.177 casi, 23 trattamenti). b Parto prematuro (17 studi, 17.133 casi, 23 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone, topir topiramato, valpro valproato, vigab vigabatrin
I risultati dell’analisi di sensibilità per la tempistica di almeno il primo trimestre di esposizione al DAE (6 coorti, 16.263 bambini, 14 trattamenti; τ2=0,09; 95% CrI, 0,00-0.55) e per l’indicazione al trattamento dell’epilessia (15 coorti, 18.099 bambini, 23 trattamenti; τ2=0,10; 95% CrI, 0,00-0,37) erano in accordo con la NMA, dove il controllo non era significativamente più sicuro del fenobarbital (tempistica: OR, 1.85; 95% CrI, 0.92-3.97; epilessia: OR, 1,79; 95% CrI, 1,00-3,10). Tuttavia, il controllo è stato associato ad un rischio statisticamente significativo inferiore di crescita prenatale rispetto alla carbamazepina per l’esposizione al primo trimestre (OR, 1.51; 95% CrI, 1.01-2.46). Il sottogruppo NMA per diverse generazioni di DAE ha mostrato che nessun DAE era statisticamente significativamente diverso dal controllo, mentre l’agente più sicuro quando si confrontano i più recenti DAE (topiramato e lamotrigina) era la lamotrigina (1 studio di coorte, 1928 bambini, 2 trattamenti; OR, 3,03; 95% CrI, 2,13-4,17). Uno studio di coorte con 308 donne con una storia di uso di alcool ha mostrato che la lamotrigina era statisticamente significativamente migliore della carbamazepina (OR, 0,29; 95% CrI, 0,09-0,93) e del valproato (OR, 0,25; 95% CrI, 0,07-0,85), ma non significativamente più sicura della fenitoina (OR, 0,89; 95% CrI, 0,16-5,00). Sei studi di coorte con 16.263 donne con un’anamnesi di fumo hanno confrontato 14 trattamenti(τ2=0,09; 95% CrI, 0,00-0,55) e hanno suggerito che solo clobazam (OR, 4,07; 95% CrI, 1.24-11,61) e topiramato (OR, 2,79; 95% CrI, 1,43-5,25) erano associati a un numero statisticamente molto maggiore di bambini con ritardo di crescita prenatale rispetto al controllo.
La restrizione agli studi di grandi dimensioni (>300 pazienti) comprendeva 7 studi di coorte, 16.899 bambini e 14 trattamenti (τ2=0,12; 95% CrI, 0,01-0,51), suggerendo che solo il clobazam (OR, 3,73; 95% CrI, 1,11-11,26) era associato a un numero statisticamente significativamente maggiore di bambini che soffrivano di ritardo di crescita prenatale rispetto al controllo. L’analisi di sensibilità per il basso rischio di pregiudizio nella voce “comparabilità delle coorti”, compresi 7 studi di coorte, 16.502 bambini, e 15 trattamenti (τ2 = 0,12; 95% CrI 0,00-0,57), ha suggerito che nessun DAE differivano statisticamente in modo significativo dal controllo. Quando si limita alla voce “adeguatezza del follow-up delle coorti” (11 studi di coorte, 15.200 bambini, 23 trattamenti; τ2=0 ,10; 95% CrI, 0,00-0.46) clobazam (OR, 4,09; 95% CrI, 1,26-11,82) e topiramato (OR, 2,88; 95% CrI, 1,34-5,88) sono stati associati a un numero statisticamente molto maggiore di bambini con ritardo di crescita prenatale rispetto al controllo.
È stata condotta un’analisi di meta-regressione di rete utilizzando il rischio di base come covariata e non è stata rilevata un’associazione statisticamente significativa con l’effetto del trattamento, nonostante un leggero calo della varianza tra gli studi (16 studi di coorte, 18.117 bambini, 23 trattamenti, coefficiente di regressione stimato su scala OR, 0.82; 95% CrI, 0,67-1,00; τ2=0,05; 95% CrI, 0,00-0,30; devianza residua=87, punti dati=89, criterio di informazione della devianza=135, file aggiuntivo 3: Appendice M).
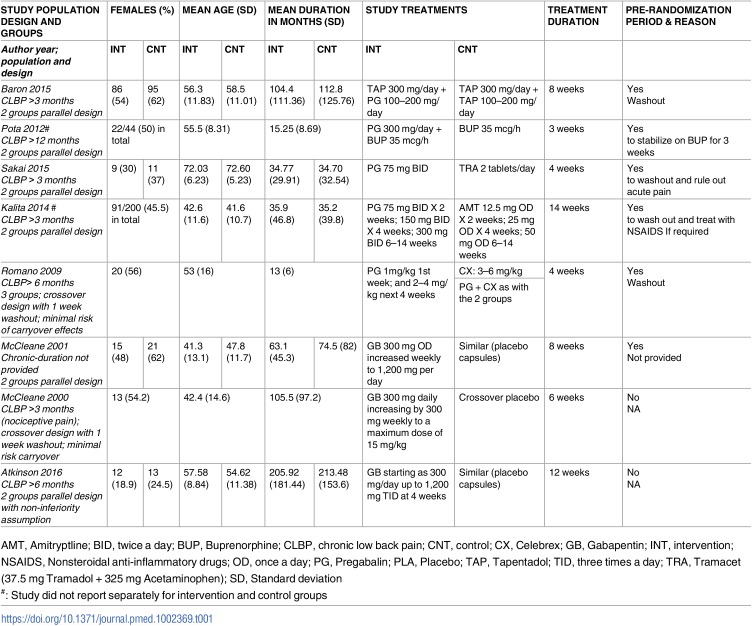
Fig. 5.Fig. 5. Meta-analisi in rete delle parcelle forestali di meta-analisi per ogni trattamento rispetto al controllo. Ogni losanga rappresenta l’effetto sintetico del trattamento stimato nella meta-analisi di rete sulla scala delle quote (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) inclusa in ogni trattamento. a Ritardo della crescita prenatale (16 studi, 18.177 casi, 23 trattamenti). b Parto prematuro (17 studi, 17.133 casi, 23 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone, topir topiramato, valpro valproato, vigab vigabatrin
Nascita pretermine
Il rischio mediano di base del parto pretermine nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,051 (intervallo interquartile, 0,025-0,072; File aggiuntivo 3: Appendice K). La NMA sulla nascita pretermine comprendeva 17 studi di coorte, 17.133 neonati e 22 DAE più controllo, con il 5% dei confronti che hanno raggiunto la significatività statistica (Fig. 3d, File aggiuntivo 3: Appendici A, J e L). Clobazam (OR, 3,42; 95% CrI, 1,41-7,92) e primidone (OR, 2,12; 95% CrI, 1,01-4,27) sono stati associati a nascite pretermine statisticamente più significative del controllo (Fig. 5b).
Malformazioni cardiache
Il rischio mediano di base di malformazioni cardiache nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile, 0,000-0,027; File aggiuntivo 3: Appendice K). La NMA sulle malformazioni cardiache comprendeva 1 RCT, 1 caso di controllo e 49 studi di coorte, 21.935 casi, 39 DAE più controllo, con l’11% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Levetiracetam (OR, 0,25; 95% CrI, 0,03-0,96) e lamotrigina (OR, 0,55; 95% CrI, 0,32-0,95) erano monoterapie statisticamente meno probabili di essere associate a casi con malformazioni cardiache rispetto al controllo. Al contrario, gabapentin (OR, 5,98; 95% CrI, 1,37-19,73), carbamazepina più fenitoina (OR, 6,58; 95% CrI, 2,25-18,97), fenobarbital più valproato (OR, 8,01; 95% CrI, 1,17-35,40), fenitoina più valproato (OR, 8,88; 95% CrI, 2,62-30).65), e carbamazepina più clonazepam (OR, 10,08; 95% CrI, 1,40-51,22) sono stati associati a un numero statisticamente significativamente maggiore di casi che sviluppano malformazioni cardiache rispetto al controllo (Fig.6a). Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle probabilità (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) incluso in ogni trattamento. a Malformazioni cardiache (51 studi, 21.935 casi, 40 trattamenti). b Ipospadia (31 studi, 12.365 casi, 32 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
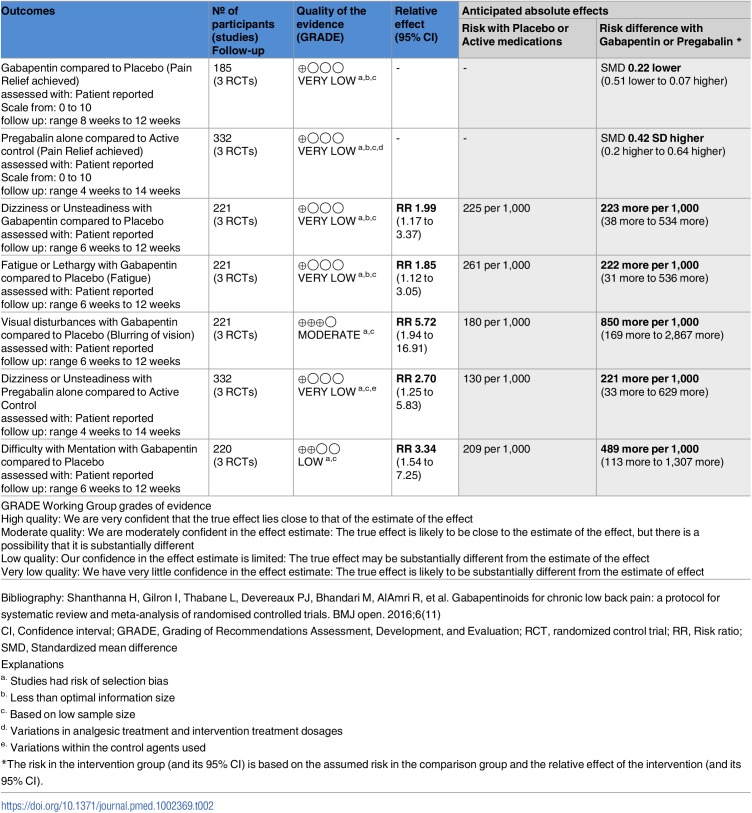
Fig. 6.Fig. 6. Meta-analisi in rete delle parcelle forestali di meta-analisi per ogni trattamento contro il controllo. Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle quote (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) incluso in ogni trattamento. a Malformazioni cardiache (51 studi, 21.935 casi, 40 trattamenti). b Ipospadia (31 studi, 12.365 casi, 32 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
Hypospadias
Il rischio mediano di ipospadia nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile, 0,000-0,015; File aggiuntivo 3: Appendice K). La NMA per l’ipospadia comprendeva 1 RCT, 1 caso-controllo e 29 studi di coorte, 12.365 casi e 31 DAE più controllo, con il 7% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Gabapentin (OR, 16,54; 95% CrI, 2,50-121,70), clonazepam (OR, 6,17; 95% CrI, 1,17-24,80), primidone (OR, 5,92; 95% CrI, 1,01-23,77), e valproato (OR, 2.58; 95% CrI, 1,24-5,76) sono stati associati a un numero statisticamente molto maggiore di casi di ipospadia in sviluppo rispetto al controllo (Fig. 6b).
Labiopalatoschisi
Il rischio mediano di base di labiopalatoschisi nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile, 0,000-0,000; File aggiuntivo 3: Appendice K). La NMA su labbro leporino/palato comprendeva 1 RCT, 1 caso di controllo e 27 studi di coorte, 18.987 casi e 32 DAE più controllo, con l’11% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Le seguenti monoterapie sono state associate a un numero statisticamente significativamente maggiore di casi che sviluppano labbro leporino/palato rispetto al controllo (Fig. 7a): ethosuximide (OR, 22,22; 95% CrI, 4,56-87,64), primidone (OR, 7,68; 95% CrI, 1.41-29,27), topiramato (OR, 6,12; 95% CrI, 1,89-19,05), fenobarbital (OR, 5,75; 95% CrI, 2,41-14,08), fenitoina (OR, 3,11; 95% CrI, 1,31-7,72), e valproato (OR, 3,26; 95% CrI, 1,38-5,58). Inoltre, le seguenti politerapie sono state associate a un numero statisticamente molto maggiore di casi di sviluppo di labbro leporino/palato rispetto al controllo: fenobarbital più fenitoina più primidone (OR, 11,50; 95% CrI, 1,70-63,48), fenitoina più primidone (OR, 16).75; 95% CrI, 3,02-77,19), carbamazepina più fenobarbital (OR, 18,51; 95% CrI, 3,34-94,21), e carbamazepina più valproato (OR, 19,12; 95% CrI, 3,74-88,68). Ogni losanga rappresenta l’effetto sommario del trattamento stimato nella meta-analisi di rete sulla scala delle quote (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) incluso in ogni trattamento. a Labiopalatoschisi (29 studi, 18.987 casi, 33 trattamenti). b Piede di clavicola (23 studi, 8836 casi 27 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone, topir topiramato, valpro valproato, vigab vigabatrin
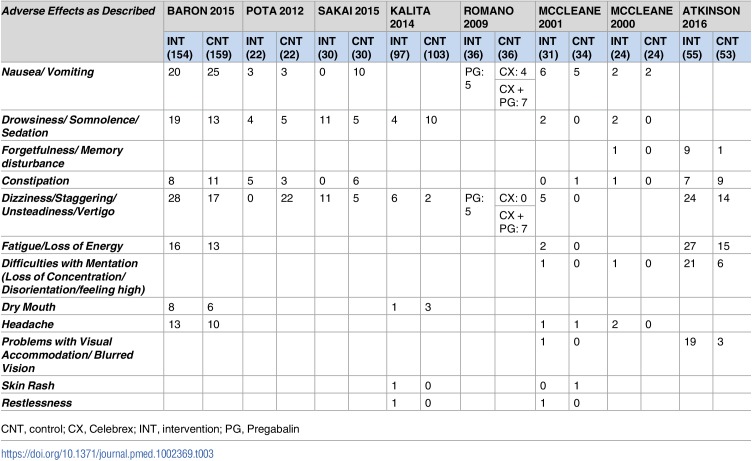
Fig. 7.Fig. 7. Meta-analisi in rete delle parcelle forestali di meta-analisi per ogni trattamento contro il controllo. Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle quote (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) incluso in ogni trattamento. a Labiopalatoschisi (29 studi, 18.987 casi, 33 trattamenti). b Piede di clavicola (23 studi, 8836 casi 27 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone, topir topiramato, valpro valproato, vigab vigabatrin
Piede di club
Il rischio mediano di base del piede di club nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (range interquartile, 0,000-0,000; File aggiuntivo 3: Appendice K). La NMA per il piede di bastone comprendeva 1 RCT, 1 caso-controllo e 21 studi di coorte, 8836 casi e 26 DAE più controllo, con il 7% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Fenitoina (OR, 2,73; 95% CrI, 1,13-6,18), valproato (OR, 3,26; 95% CrI, 1,43-8,25), primidone (OR, 4,71; 95% CrI, 1,11-17,24), etossimide (OR, 12,99; 95% CrI, 1,66-76,39), carbamazepina più fenobarbital (OR, 7).30; 95% CrI, 1,29-32,31), e fenobarbital più fenitoina più primidone (OR, 13,46; 95% CrI, 1,45-132,80) sono stati associati statisticamente a un numero significativamente maggiore di casi di sviluppo di piede bastonato rispetto al controllo (Fig. 7b).
Ernia inguinale
Il rischio mediano di ernia inguinale nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile, 0,000-0,000; File aggiuntivo 3: Appendice K). La NMA per l’ernia inguinale comprendeva 1 RCT, 1 caso di controllo e 11 studi di coorte, 12.216 casi e 28 DAE più controllo, con l’8% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Fenobarbital più fenitoina (OR, 5,51; 95% CrI, 1,25-34,61) e fenobarbital più primidone (OR, 534,20; 95% CrI, 14,39-1,31×105) sono stati associati statisticamente a un numero significativamente maggiore di casi che sviluppano ernia inguinale rispetto al controllo (Fig. 8a). Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle probabilità (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) incluso in ogni trattamento. a Ernia inguinale (13 studi, 12.216 casi, 29 trattamenti). b Testicoli non discendenti (10 studi, 6270 casi, 17 trattamenti). c Malformazioni congenite minori (9 studi, 614 casi, 17 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
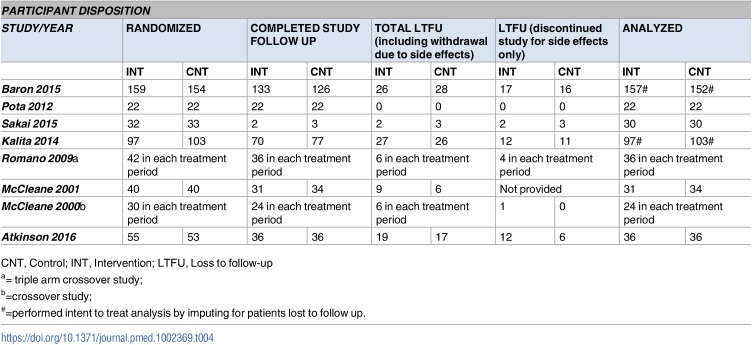
Fig. 8.Fig. 8. Meta-analisi in rete delle parcelle forestali di meta-analisi per ogni trattamento contro il controllo. Ogni losanga rappresenta l’effetto di trattamento sommario stimato nella meta-analisi di rete sulla scala delle quote (OR). Le linee orizzontali nere rappresentano gli intervalli credibili (CrI) per gli effetti del trattamento sommario, mentre le linee orizzontali rosse rappresentano i corrispondenti intervalli predittivi (PrI). In assenza di eterogeneità, i CrI e i PrI dovrebbero essere identici. Un OR > 1 suggerisce che il controllo è più sicuro, mentre un OR < 1 suggerisce che il trattamento attivo di confronto è più sicuro. La linea verticale blu corrisponde ad un OR = 1 (cioè i gruppi di trattamento confrontati sono ugualmente sicuri). Viene presentata anche la dimensione totale del campione (n) incluso in ogni trattamento. a Ernia inguinale (13 studi, 12.216 casi, 29 trattamenti). b Testicoli non discendenti (10 studi, 6270 casi, 17 trattamenti). c Malformazioni congenite minori (9 studi, 614 casi, 17 trattamenti). carbam carbamazepina, clobaz clobazam, clonaz clonazepam, ethos ethosuximide, gabap gabapentin, lamot lamotrigina, levet levetiracetam, oxcar oxcarbazepina, fenobarbital feno fenobarbital, fenito fenitoina, primid primidone primidone, topir topiramato, valpro valproato, vigab vigabatrin
Testicoli non scesi
Il rischio mediano di base di testicoli non discendenti nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile, 0,000-0,026; File aggiuntivo 3: Appendice K). La NMA per i testicoli non discendenti comprendeva 1 RCT, 1 caso di controllo e 8 studi di coorte, 6270 ragazzi e 16 DAE più controllo, con il 3% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Nulla era statisticamente significativo rispetto al controllo (Fig. 8b).
Qualsiasi CMs minore
Il rischio mediano di base di qualsiasi CM minore nel gruppo di controllo (nessuna esposizione al DAE) in tutti gli studi è stato di 0,000 (intervallo interquartile, 0,000-0,000; File aggiuntivo 3: Appendice K). La NMA per le CM minori comprendeva 1 RCT e 8 studi, 614 casi e 16 DAE più il controllo, con il 10% dei confronti che hanno raggiunto la significatività statistica (File aggiuntivo 3: Appendici J, L e N). Carbamazepina (OR, 10,81; 95% CrI, 1,40-373,90), carbamazepina pus fenitoina (OR, 12,46; 95% CrI, 1,17-438,90), valproato (OR, 17,76; 95% CrI, 1,60-633,30), fenobarbital più fenitoina (OR, 20,14; 95% CrI, 1.96-764,20), e carbamazepina più fenobarbital più valproato (OR, 122,20; 95% CrI, 2,09-9539,00) sono stati associati a un numero statisticamente molto maggiore di casi che sviluppano una CM minore rispetto al controllo (Fig. 8c).
Discussione
Si teme che la maggior parte dei DAE introducano il rischio di uno sviluppo fisico anormale o ritardato per i neonati esposti in utero. I nostri risultati mostrano che, tra i risultati principali e minori di CM, molti DAE sono stati associati a un rischio più elevato di CM rispetto al controllo. Le monoterapie associate al rischio statisticamente significativo di CMs e danni prenatali rispetto al controllo attraverso due o più NMA sono state la carbamazepina (CMs maggiore e minore), clobazam (ritardo di crescita prenatale, nascita pretermine), ethosuximide (CM maggiore, labbro leporino, piede torto), gabapentin (malformazioni cardiache, ipospadia), fenobarbital (CM maggiore complessivo, ritardo di crescita prenatale, labbro leporino/palato), fenitoina (CM maggiore complessivo, labbro leporino/palato, piede torto), topiramato (CM maggiore complessivo, perdite fetali combinate, ritardo di crescita prenatale, labbro leporino/palato) e valproato (CM maggiore e minore complessivo, perdite fetali combinate, ipospadia, labbro leporino/palato, piede torto). Di questi, solo il topiramato e il gabapentin sono DAE di nuova generazione. Il gabapentin non aveva prove sufficienti per raggiungere una significatività statistica nella CM maggiore complessiva e aveva un rischio complessivo di malformazioni equivalente al controllo. Questo risultato può essere dovuto all’inclusione di malformazioni maggiori che sono state rilevate solo alla nascita, il che può diminuire la possibilità che tutte le malformazioni cardiache siano state identificate, specialmente quelle che possono essere rilevate più tardi nell’infanzia (o in età adulta). I nostri risultati suggeriscono che esiste un’associazione significativa tra topiramato e aumento delle perdite fetali combinate. Tuttavia, l’effetto del trattamento del topiramato rispetto al controllo potrebbe essere stimato solo indirettamente con un’elevata incertezza. Nella rete, il topiramato è stato informato da un singolo, piccolo studio di coorte a cinque bracci[42], con solo due pazienti esposte in topiramato (dimensione totale del campione, n = 25) e bassa qualità metodologica per quanto riguarda la comparabilità delle coorti e l’adeguatezza del follow-up. I seguenti DAE di nuova generazione non sono stati associati a rischi statisticamente significativi per lo sviluppo fisico rispetto al controllo: lamotrigina(n=6290), levetiracetam (n=1015), oxcarbazepina (n=372) evigabatrina(n=23). Ciò non significa tuttavia che questi agenti non siano dannosi per la prole delle madri a cui sono stati somministrati (cioè che non sono stati esclusi rischi). Nel complesso, gli agenti DAE più recenti, tra cui il levetiracetam e la lamotrigina, sono stati associati a un minor rischio di CM e CM complessive maggiori per tipo specifico; tuttavia, per la lamotrigina erano disponibili dati relativi a un maggior numero di pazienti rispetto al levetiracetam (6290 contro 1015 neonati totali, rispettivamente), fornendo così una maggiore fiducia nel profilo di sicurezza della lamotrigina. Inoltre, la lamotrigina si è classificata come la seconda monoterapia più sicura per il ritardo di crescita prenatale, ed è stata paragonabile al controllo per la nascita pretermine. Il fenobarbital è stata la monoterapia DAE con il più basso rischio di perdita fetale, mentre la fenitoina è stata la monoterapia associata al più basso rischio di ritardo di crescita prenatale compromessa. Vigabatrin e oxcarbazepina erano le monoterapie meno probabili per aumentare il rischio di parto pretermine; tuttavia, vigabatrin comprendeva solo 13 neonati rispetto ai 1045 neonati in oxcarbazepina, il che ha contribuito alla minore precisione nella stima del valore della curva SUCRA di vigabatrin (Fig. 2 e file aggiuntivo 3: Appendice N) . Mentre gabapentin e clonazepam sono stati classificati come moderatamente sicuri, sono necessari ulteriori dati per chiarire la loro potenziale teratogenicità (329 e 375 neonati in totale, rispettivamente). In tutti i risultati, le seguenti politerapie sono state associate sia a CMs statisticamente significative che a danni prenatali rispetto al controllo su due o più delle nostre NMA: fenobarbital più fenitoina, carbamazepina più fenobarbital, carbamazepina più fenitoina, fenobarbital più valproato, fenitoina più primidone, fenitoina più valproato, carbamazepina più valproato, carbamazepina più clonazepam, fenobarbital più fenitoina più primidone, e fenobarbital più primidone. Non ci sono prove sufficienti per trarre conclusioni sulla politerapia con DAE di nuova generazione a causa della mancanza di studi che riportino queste combinazioni.
Il nostro studio ha diversi punti di forza. In primo luogo, abbiamo seguito le linee guida del Cochrane Handbook per le revisioni sistematiche e ISPOR per le NMA[14], e abbiamo riportato i nostri risultati secondo le raccomandazioni, inclusa la dichiarazione PRISMA-NMA[15]. In secondo luogo, utilizzando i metodi NMA, siamo stati in grado di confrontare i trattamenti che non sono stati confrontati in precedenti studi testa a testa, oltre a fornire una gerarchia dei trattamenti secondo la loro sicurezza (attraverso le curve SUCRA)[7]. Inoltre, la complessità delle evidenze identificate nella nostra revisione sistematica è, a differenza di un modello di meta-analisi a coppie, correttamente contabilizzata in un modello NMA, che modella le correlazioni all’interno delle prove indotte dagli studi multi-braccio[43]. In terzo luogo, i risultati dei nostri studi si basano su un numero maggiore di studi rispetto alle sintesi delle conoscenze precedenti[7]. Una precedente revisione sistematica[7], che comprendeva 59 studi e un totale di 65.553 donne incinte, ha esaminato il rischio di malformazioni nelle donne con epilessia e ha mostrato che le più comuni erano malformazioni cardiache. Il numero di gravidanze in questa revisione è stato superiore alla nostra revisione sistematica a causa dell’inclusione di studi che non analizzavano il rischio da DAE e utilizzavano una politerapia non specificata, che non poteva essere inclusa nella nostra NMA. A differenza di questa revisione, il nostro studio valuta ogni DAE separatamente per le malformazioni sia generali che specifiche, e quindi i nostri risultati non sono direttamente paragonabili a questa revisione. In quarto luogo, abbiamo tenuto conto dei diversi disegni dello studio applicando l’approccio di Schmitz et al.[33]. In questo modello gerarchico a tre livelli abbiamo considerato due diverse fonti di evidenza, ovvero gli studi osservazionali, compresi gli studi di coorte e i casi di controllo, e gli RCT. Per tener conto delle potenziali differenze tra gli studi di coorte e gli studi di caso-controllo, poiché gli approcci di queste due metodologie variano, abbiamo condotto un’analisi di sensibilità limitata agli studi di coorte (k=75) per il risultato primario, che comprendeva tutti i disegni di studio e il maggior numero di studi di caso-controllo (k=2) e gli RCT (k=1). Come previsto, poiché la maggior parte dei disegni di studio inclusi erano studi di coorte, tutti gli approcci suggerivano risultati comparabili. Per quanto a nostra conoscenza, il nostro studio è stato il primo a confrontare e classificare la sicurezza dei DAE utilizzando le curve SUCRA e i grafici del calore[36, 37].
Il nostro studio ha alcuni limiti degni di nota. In primo luogo, non abbiamo incorporato differenze nei dosaggi dei farmaci degli AED perché queste informazioni sono state raramente riportate negli studi inclusi, anche se per questi agenti è stata osservata una relazione dose-risposta. Ad esempio, una potenziale modifica degli effetti terapeutici stimati può verificarsi se le dosi variano considerevolmente tra le indicazioni del trattamento, e ciò spiega il fatto che alcuni DAE sono stati utilizzati più ampiamente in altre condizioni, mentre alcuni DAE sono quasi esclusivamente utilizzati per l’epilessia. In secondo luogo, la scarsità di dati disponibili è un limite; molte politerapie sono state informate solo da pochi studi e pazienti, e molti studi includevano eventi zero in tutti i bracci per le specifiche CM ed erano esclusi da queste analisi. Questo ha avuto un impatto sul rischio del gruppo di trattamento in tutti gli studi; ad esempio, il rischio mediano delle principali anomalie congenite per trattamento variava tra lo 0% e il 24%. La mancanza di un’adeguata conoscenza dei rischi per più DAE ha avuto un impatto sui risultati della NMA. Ciò ha influito sulle stime del SUCRA, che ha mostrato diverse politerapie con stime di OR elevate, ma con CrIs estremamente ampie. Ad esempio, nelle principali CM complessive, nove politerapie avevano stime della curva SUCRA superiori al 74%, ma tutte queste avevano un CrI ampio (95% CrI con lunghezza più corta, 28-96%; 95% CrI con lunghezza più ampia, 0-100%) potenzialmente dovuto al numero ridotto di pazienti (range, 3-21) e agli studi (range, 1-2) che hanno informato questi interventi (File aggiuntivo 3: Appendice K). Infatti, uno studio di simulazione[44] che valuta la probabilità di un trattamento di essere il migliore nella NMA con un numero diverso di studi per confronto, ha suggerito che la probabilità di essere il migliore può essere influenzata a favore di trattamenti con un numero inferiore di studi. Inoltre, un altro studio ha indicato che i valori della curva SUCRA potrebbero essere inaffidabili [45]. Come tale, i nostri valori della curva SUCRA devono essere interpretati insieme alle OR e al 95% di CrIs. In terzo luogo, la qualità della segnalazione degli studi osservazionali identificati potrebbe aver introdotto un pregiudizio[46]; l’81% non ha controllato per i co-fondatori importanti, come l’età materna e il tipo e la gravità dell’epilessia, e il 59% ha avuto grandi tassi di logoramento. Inoltre, alcuni registri hanno misurato i CMs e c’è un rischio che potrebbe non aver raccolto dati coerenti su diversi tipi di perdite fetali (ad esempio, i nati morti). Tuttavia, gli studi sono stati internamente coerenti tra le varie armi rispetto a quanto riportato. L’inclusione di studi osservazionali si aggiunge alla valutazione del profilo di sicurezza dei trattamenti DAE e offre l’opportunità di generalizzare le prove. In quarto luogo, nonostante non vi siano prove di incoerenza, la valutazione della transitività per la maggior parte dei modificatori dell’effetto del trattamento ha suggerito che vi era uno squilibrio nei diversi livelli di valutazione della qualità tra i vari trattamenti e la maggior parte degli esiti, che può influenzare i risultati della NMA. Un possibile approccio per affrontare questo problema in un futuro studio potrebbe essere l’uso dei dati dei singoli pazienti nella NMA, per consentire l’aggiustamento degli effetti relativi del trattamento dagli studi osservazionali che utilizzano covariate a livello del paziente. Ciò aiuterebbe anche il processo decisionale per consentire di adattare la gestione alle caratteristiche individuali dei pazienti[47]. In quinto luogo, anche se i grafici ad imbuto corretti non hanno suggerito alcuna evidenza di distorsioni di pubblicazione e di effetti di piccoli studi, l’asimmetria potrebbe essere stata mascherata a causa di diversi studi che hanno confrontato più bracci. Per ridurre la maggior parte delle correlazioni indotte dagli studi su più bracci, abbiamo tracciato i punti di dati corrispondenti ai parametri di base specifici dello studio. Inoltre, i neonati nati ogni giorno sono esposti a DAE e anche se abbiamo cercato a fondo la letteratura grigia (cioè difficile da individuare o non pubblicata), potremmo non aver trovato dati non pubblicati rilevanti per la nostra domanda di ricerca. In sesto luogo, la forza dell’evidenza nella maggior parte delle NMA può essere bassa a causa del numero ridotto di studi rispetto al numero di trattamenti inclusi in ogni rete. Tuttavia, gli intervalli predittivi suggeriscono che i nostri risultati sono solidi, nel complesso. Settimo, abbiamo combinato i dati attraverso i progetti di studio per determinare come si comportano gli AED nel “mondo reale”. Tuttavia, questo può aver introdotto l’eterogeneità nelle nostre analisi. Abbiamo usato l’approccio ingenuo e il modello di Schmitz et al. [33] per combinare diversi disegni di studio, così come le analisi di sensibilità su studi osservazionali e di coorte separatamente, e tutti gli approcci suggerito risultati simili. Sebbene gli RCT siano considerati il gold standard di prova, abbiamo incluso gli studi osservazionali nelle nostre analisi a causa della scarsità di RCT disponibili.
Va sottolineato che, anche se alcune delle malformazioni individuali in questa revisione hanno superato il numero di gravidanze che hanno prodotto malformazioni, l’unità di analisi del nostro studio è stato il numero di neonati con una malformazione alla nascita. Pertanto, la discussione sulla prevalenza di malformazioni multiple andrebbe oltre l’ambito dell’attuale articolo. Gli studi futuri dovrebbero valutare la sicurezza e l’efficacia dei DAE per le donne in gravidanza considerando i fattori che potrebbero influenzare i risultati, come l’uso di alcol e acido folico. Gli studi osservazionali dovrebbero seguire la guida STROBE per migliorare la qualità della segnalazione[48]. Nonostante i recenti registri su larga scala che valutano i danni rari[28, 49- 52], sono necessarie maggiori prove per concludere quale sia la politerapia più sicura, specialmente per i DAE di nuova generazione, e per consentire una migliore personalizzazione per i pazienti con caratteristiche diverse, come l’anamnesi dell’uso di alcol. I registri dovrebbero mirare ad includere un gruppo di controllo adeguato e raccogliere informazioni sui potenziali confonditori per informare quali agenti sono i più sicuri.
Conclusioni
L’ampio volume di prove in questa analisi suggerisce che i DAE di nuova generazione, lamotrigina e levetiracetam, non erano associati a rischi statisticamente significativi per le CM rispetto al controllo, ed erano statisticamente molto meno probabili di essere associati a bambini con malformazioni cardiache rispetto al controllo. Al contrario, il rischio di malformazioni è stato aumentato per etossimide, valproato, topiramato, fenobarbital, fenitoina, carbamazepina e 11 politerapie. Inoltre, è stata identificata un’associazione significativa tra topiramato e aumento delle perdite fetali combinate. Tuttavia, è necessaria una certa cautela, in quanto la scarsa qualità complessiva delle ricerche disponibili su questo argomento limita ciò che può essere definitivamente concluso e i DAE possono essere potenzialmente dannosi per i neonati e i bambini esposti in utero. La consulenza è consigliata per quanto riguarda i rischi teratogeni quando la prescrizione viene scritta per la prima volta per una donna con potenziale fertile e prima che le donne continuino con questi agenti quando si considera la gravidanza, come il passaggio dalla politerapia alle monoterapie con evidenza di rischio inferiore e l’evitare i DAE, come il valproato, che sono costantemente associati con le CM. Queste decisioni devono essere bilanciate con la necessità di un controllo delle crisi.
File aggiuntivi
File aggiuntivo 1:Protocollo. (PDF 190 kb)File aggiuntivo 2:Lista di controllo PRISMA NMA. (DOCX 25 kb)File aggiuntivo 3:Contenuto supplementare online (Appendici A-N). Appendice A. Descrizione dei risultati. Appendice B. Elenco degli articoli inclusi. Appendice C. Principali studi esclusi a causa di un solo braccio riportato con dati estraibili. Appendice D. Elenco degli studi e delle loro caratteristiche. Appendice E. Elenco degli studi e delle caratteristiche dei pazienti. Appendice F. Rischio di polarizzazione per gli studi controllati randomizzati – Strumento Cochrane per il rischio di polarizzazione. Appendice G. Qualità metodologica degli studi caso-controllo – Scala Newcastle-Ottawa. Appendice H. Qualità metodologica degli studi di coorte osservazionali – Scala Newcastle-Ottawa. Appendice I. Confronto tra i grafici ad imbuto corretti per ogni risultato. Appendice J. Risultati di meta-analisi di rete statisticamente significativi insieme a risultati di meta-analisi, transitività e valutazione della coerenza. Appendice K. Caratteristiche dei nodi di trattamento per ogni risultato insieme ai loro valori SUCRA. Appendice L. Caratteristiche della rete per ogni esito. Appendice M. Risultati delle analisi di meta-regressione, sottogruppo e sensibilità. Appendice N. Diagrammi di rete per le meta-analisi di rete di malformazioni congenite specifiche e minori. (DOCX 2016 kb)
References
- Hauser W, Hesdorffer D. Epilepsy: Frequency, Causes and Consequences. Demos Medical Pub: New York; 1990.
- Wiebe S, Bellhouse DR, Fallahay C, Eliasziw M. Burden of epilepsy: the Ontario Health Survey. Can J Neurol Sci. 1999; 26(4):263-70. DOI | PubMed
- Morrell MJ. Epilepsy in women. Am Fam Physician. 2002; 66(8):1489-94. PubMed
- Zahn CA, Morrell MJ, Collins SD, Labiner DM, Yerby MS. Management issues for women with epilepsy: a review of the literature. Neurology. 1998; 51(4):949-56. DOI | PubMed
- Spina E, Perugi G. Antiepileptic drugs: indications other than epilepsy. Epileptic Disord. 2004; 6(2):57-75. PubMed
- Harden CL, Pennell PB, Koppel BS, Hovinga CA, Gidal B, Meador KJ. Management issues for women with epilepsy–focus on pregnancy (an evidence-based review): III. vitamin K, folic acid, blood levels, and breast-feeding: report of the quality standards subcommittee and therapeutics and technology assessment subcommittee of the American Academy of Neurology and the American Epilepsy Society. Epilepsia. 2009; 50(5):1247-55. DOI | PubMed
- Meador K, Reynolds MW, Crean S, Fahrbach K, Probst C. Pregnancy outcomes in women with epilepsy: a systematic review and meta-analysis of published pregnancy registries and cohorts. Epilepsy Res. 2008; 81(1):1-13. DOI | PubMed
- Samren EB, van Duijn CM, Koch S, Hiilesmaa VK, Klepel H, Bardy AH. Maternal use of antiepileptic drugs and the risk of major congenital malformations: a joint European prospective study of human teratogenesis associated with maternal epilepsy. Epilepsia. 1997; 38(9):981-90. DOI | PubMed
- Janz D, Fuchs U. Are anti-epileptic drugs harmful during pregnancy?. Dtsch Med Wochenschr. 1964; 89:241-8. DOI | PubMed
- Meadow SR. Anticonvulsant drugs and congenital abnormalities. Lancet. 1968; 2(7581):1296. DOI | PubMed
- Shorvon SD. Drug treatment of epilepsy in the century of the ILAE: the second 50 years, 1959-2009. Epilepsia. 2009; 50(Suppl 3):93-130. DOI | PubMed
- Johannessen Landmark C, Patsalos PN. Drug interactions involving the new second- and third-generation antiepileptic drugs. Expert Rev Neurother. 2010; 10(1):119-40. DOI | PubMed
- Tricco AC, Cogo E, Veroniki AA, Soobiah C, Hutton B, Hemmelgarn BR. Comparative safety of anti-epileptic drugs among infants and children exposed in utero or during breastfeeding: protocol for a systematic review and network meta-analysis. Syst Rev. 2014; 3:68. DOI | PubMed
- Jansen JP, Trikalinos T, Cappelleri JC, Daw J, Andes S, Eldessouki R. Indirect treatment comparison/network meta-analysis study questionnaire to assess relevance and credibility to inform health care decision making: an ISPOR-AMCP-NPC Good Practice Task Force report. Value Health. 2014; 17(2):157-73. DOI | PubMed
- Hutton B, Salanti G, Caldwell DM, Chaimani A, Schmid CH, Cameron C. The PRISMA extension statement for reporting of systematic reviews incorporating network meta-analyses of health care interventions: checklist and explanations. Ann Intern Med. 2015; 162(11):777-84. DOI | PubMed
- Harden C, Thomas S, Tomson T. Epilepsy in Women. Wiley-Blackwell: West Sussex, UK; 2013.
- Sampson M, McGowan J, Cogo E, Grimshaw J, Moher D, Lefebvre C. An evidence-based practice guideline for the peer review of electronic search strategies. J Clin Epidemiol. 2009; 62(9):944-52. DOI | PubMed
- Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011; 343:d5928. DOI | PubMed
- . Accessed 6 Apr 2017.Publisher Full Text
- Chaimani A, Higgins JP, Mavridis D, Spyridonos P, Salanti G. Graphical tools for network meta-analysis in STATA. PLoS One. 2013; 8(10):e76654. DOI | PubMed
- Lu G, Ades AE. Combination of direct and indirect evidence in mixed treatment comparisons. Stat Med. 2004; 23(20):3105-24. DOI | PubMed
- Jansen JP, Naci H. Is network meta-analysis as valid as standard pairwise meta-analysis? It all depends on the distribution of effect modifiers. BMC Med. 2013; 11:159. DOI | PubMed
- White IR, Barrett JK, Jackson D, Higgins JPT. Consistency and inconsistency in network meta-analysis: model estimation using multivariate meta-regression. Res Synth Methods. 2012; 3(2):111-25. DOI | PubMed
- Higgins JP, Jackson D, Barrett JK, Lu G, Ades AE, White IR. Consistency and inconsistency in network meta-analysis: concepts and models for multi-arm studies. Res Synth Methods. 2012; 3(2):98-110. DOI | PubMed
- Song F, Altman DG, Glenny AM, Deeks JJ. Validity of indirect comparison for estimating efficacy of competing interventions: empirical evidence from published meta-analyses. BMJ. 2003; 326(7387):472. DOI | PubMed
- Veroniki AA, Vasiliadis HS, Higgins JP, Salanti G. Evaluation of inconsistency in networks of interventions. Int J Epidemiol. 2013; 42(1):332-45. DOI | PubMed
- . Accessed 6 Apr 2017.Publisher Full Text
- Tomson T, Battino D, Bonizzoni E, Craig J, Lindhout D, Sabers A. Dose-dependent risk of malformations with antiepileptic drugs: an analysis of data from the EURAP epilepsy and pregnancy registry. Lancet Neurol. 2011; 10(7):609-17. DOI | PubMed
- Tomson T, Battino D, Bonizzoni E, Craig J, Lindhout D, Perucca E. Dose-dependent teratogenicity of valproate in mono- and polytherapy: an observational study. Neurology. 2015; 85(10):866-72. DOI | PubMed
- Vajda FJ, O’Brien TJ, Lander CM, Graham J, Eadie MJ. The teratogenicity of the newer antiepileptic drugs – an update. Acta Neurol Scand. 2014; 130(4):234-8. DOI | PubMed
- Martinez Ferri M, Pena Mayor P, Perez Lopez-Fraile I, Castro Vilanova MD, Escartin Siquier A, Martin Moro M. Malformations and fetal death in the Spanish antiepileptic drug and pregnancy registry: results at 6 years. Neurologia. 2009; 24(6):360-5. PubMed
- Kochen S, Salera C, Seni J. Pregnant women with epilepsy in a developing country. Open Neurol J. 2011; 5:63-7. DOI | PubMed
- Schmitz S, Adams R, Walsh C. Incorporating data from various trial designs into a mixed treatment comparison model. Stat Med. 2013; 32(17):2935-49. DOI | PubMed
- Spiegelhalter DJ, Best NG, Carlin BP, Van Der Linde A. Bayesian measures of model complexity and fit. J R Stat Soc Ser B Stat Methodol. 2002; 64(4):583-639. DOI
- Welton NJ, Sutton AJ, Cooper N, Abrams KR, Ades A. Evidence synthesis for decision making in healthcare. Wiley: New York; 2012.
- Salanti G, Ades AE, Ioannidis JP. Graphical methods and numerical summaries for presenting results from multiple-treatment meta-analysis: an overview and tutorial. J Clin Epidemiol. 2011; 64(2):163-71. DOI | PubMed
- Veroniki AA, Straus SE, Fyraridis A, Tricco AC. The rank-heat plot is a novel way to present the results from a network meta-analysis including multiple outcomes. J Clin Epidemiol. 2016; 76:193-9. DOI | PubMed
- Lunn D, Spiegelhalter D, Thomas A, Best N. The BUGS project: evolution, critique and future directions. Stat Med. 2009; 28(25):3049-67. DOI | PubMed
- Palmer T, Sterne J. Meta-Analysis in Stata: An Updated Collection from the Stata Journal. Stata Press: Texas; 2016.
- Higgins JP, Thompson SG, Spiegelhalter DJ. A re-evaluation of random-effects meta-analysis. J R Stat Soc Ser A Stat Soc. 2009; 172(1):137-59. DOI | PubMed
- Riley RD, Higgins JP, Deeks JJ. Interpretation of random effects meta-analyses. BMJ. 2011; 342:d549. DOI | PubMed
- Babic M, Jovic N. European Congress on Epileptology. Epilepsia: Stockholm; 2014.
- Franchini AJ, Dias S, Ades AE, Jansen JP, Welton NJ. Accounting for correlation in network meta-analysis with multi-arm trials. Res Synth Methods. 2012; 3(2):142-60. DOI | PubMed
- Kibret T, Richer D, Beyene J. Bias in identification of the best treatment in a Bayesian network meta-analysis for binary outcome: a simulation study. Clin Epidemiol. 2014; 6:451-60. PubMed
- Trinquart L, Attiche N, Bafeta A, Porcher R, Ravaud P. Uncertainty in treatment rankings: reanalysis of network meta-analyses of randomized trials. Ann Intern Med. 2016; 164(10):666-73. DOI | PubMed
- Cameron C, Fireman B, Hutton B, Clifford T, Coyle D, Wells G. Network meta-analysis incorporating randomized controlled trials and non-randomized comparative cohort studies for assessing the safety and effectiveness of medical treatments: challenges and opportunities. Syst Rev. 2015; 4:147. DOI | PubMed
- Veroniki AA, Straus SE, Soobiah C, Elliott MJ, Tricco AC. A scoping review of indirect comparison methods and applications using individual patient data. BMC Med Res Methodol. 2016; 16(1):47. DOI | PubMed
- von Elm E, Altman DG, Egger M, Pocock SJ, Gotzsche PC, Vandenbroucke JP. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. PLoS Med. 2007; 4(10):e296. DOI | PubMed
- Campbell E, Kennedy F, Russell A, Smithson WH, Parsons L, Morrison PJ. Malformation risks of antiepileptic drug monotherapies in pregnancy: updated results from the UK and Ireland Epilepsy and Pregnancy Registers. J Neurol Neurosurg Psychiatry. 2014; 85(9):1029-34. DOI | PubMed
- Hernandez-Diaz S, Smith CR, Shen A, Mittendorf R, Hauser WA, Yerby M. Comparative safety of antiepileptic drugs during pregnancy. Neurology. 2012; 78(21):1692-9. DOI | PubMed
- Kallen B, Borg N, Reis M. The use of central nervous system active drugs during pregnancy. Pharmaceuticals (Basel). 2013; 6(10):1221-86. DOI | PubMed
- Veiby G, Daltveit AK, Engelsen BA, Gilhus NE. Fetal growth restriction and birth defects with newer and older antiepileptic drugs during pregnancy. J Neurol. 2014; 261(3):579-88. DOI | PubMed
Fonte
Veroniki AA, Cogo E, Rios P, Straus SE, Finkelstein Y, et al. (2017) Comparative safety of anti-epileptic drugs during pregnancy: a systematic review and network meta-analysis of congenital malformations and prenatal outcomes. BMC Medicine 1595. https://doi.org/10.1186/s12916-017-0845-1





