Abstract
Introduzione
La salute cognitiva è un fattore importante per garantire la qualità della vita degli anziani e preservare l’indipendenza. La salute cognitiva è lo sviluppo e la conservazione della struttura cognitiva multidimensionale che permette alle persone anziane di mantenere la connessione sociale, un continuo senso di finalità e le capacità di funzionare in modo indipendente, di permettere il recupero funzionale da malattie o lesioni e di far fronte a deficit funzionali residui[1]. Le componenti chiave della salute cognitiva sono le capacità mentali e le abilità acquisite, così come la capacità di applicarle in modo da impegnarsi in attività propositive[2].
La perdita della salute cognitiva non è una parte inevitabile dell’invecchiamento. Alcune influenze sulla salute cognitiva, come il genere, il profilo genetico, la storia delle malattie croniche, le esperienze di vita precoci, l’impatto delle avversità socioeconomiche e le limitate opportunità educative[3,4], non possono essere direttamente modificate. Tuttavia, la plasticità cognitiva – la capacità di migliorare le funzioni in risposta ad input o ambienti alterati – è mantenuta in una certa misura anche in età avanzata [5,6]. Inoltre, una valutazione sistematica delle prove relative ai fattori di rischio e ai fattori protettivi per la malattia di Alzheimer ha prodotto prove solide per diversi fattori di stile di vita potenzialmente modificabili associati al livello di rischio: attività cognitiva, impegno sociale, attività fisica, dieta, consumo di alcol e fumo[7]. Il contributo dei fattori di stile di vita modificabili alla salute cognitiva significa che ci può essere un potenziale per stabilizzare o migliorare le traiettorie di riduzione delle funzioni cognitive. L’individuazione di fattori di stile di vita potenzialmente modificabili potrebbe avere benefici positivi per la salute cognitiva in età avanzata e fare da contrappeso a un elevato rischio genetico[8].
Nel considerare il potenziale di riduzione del rischio, è importante considerare con quali meccanismi questi fattori di stile di vita influenzano la salute cognitiva. Pochi studi hanno esplorato i potenziali meccanismi coinvolti. Molti dei fattori identificati come rilevanti per aumentare (fumo ed elevato consumo di alcol) o ridurre (dieta sana ed esercizio fisico) il rischio di demenza sono ugualmente rilevanti per altre condizioni di salute, in particolare per il loro impatto sulla salute cardiovascolare[9]. L’impegno nell’attività cognitiva e sociale, tuttavia, appare più direttamente collegato alla salute cognitiva.
Il concetto di riserva cognitiva è stato proposto per tener conto delle differenze individuali nelle traiettorie della salute cognitiva e nei tassi di declino cognitivo[10]. La riserva cognitiva è stata definita come la capacità del cervello di ottimizzare o massimizzare le prestazioni attraverso il reclutamento differenziale delle reti cerebrali o l’uso di strategie alternative[10]. L’impegno nell’attività mentale – per esempio, attraverso l’intraprendere un’istruzione o il lavoro in occupazioni che comportano richieste complesse – è un fattore chiave del livello di riserva cognitiva [11,12]. La riserva cognitiva riflette la capacità di fornire un cuscinetto contro gli effetti della patologia cerebrale legata alla demenza, in modo che sia necessario un carico maggiore di patologia prima che i segni di declino cognitivo o i sintomi della demenza diventino evidenti. È possibile che i fattori legati allo stile di vita possano esercitare i loro effetti sul rischio aumentando l’efficienza delle reti neurali e quindi potenziando la riserva cognitiva, con conseguente maggiore resilienza contro gli effetti dello sviluppo della neuropatologia[13,14]. La riserva cognitiva è un costrutto latente che non può essere misurato direttamente, e la valutazione si basa quindi su indicatori proxy. Sebbene la riserva cognitiva sia spesso indicizzata da una singola misura proxy come l’istruzione o il QI, recentemente è stata posta l’enfasi sulla necessità di combinare più indicatori[15].
Questo potenziale percorso attraverso la riserva cognitiva può aiutare a spiegare l’associazione tra fattori di stile di vita e funzione cognitiva e quindi informare lo sviluppo di strategie di prevenzione della demenza o di riduzione del rischio. Un primo passo appropriato è quello di esplorare le relazioni tra questi costrutti in modo trasversale per determinare se la riserva cognitiva svolge effettivamente un ruolo di mediazione. Pochi studi empirici hanno indagato questo potenziale percorso di mediazione e, in particolare, è stato raramente esplorato in grandi coorti epidemiologiche di persone anziane. Inoltre, la maggior parte degli studi ha utilizzato un unico indicatore di riserva cognitiva, tipicamente l’istruzione; non abbiamo trovato finora alcuno studio precedente che abbia utilizzato una misura combinata di riserva cognitiva nell’esaminare la relazione tra fattori di stile di vita e cognizione[15]. Identificare un ruolo di mediazione della riserva cognitiva nella relazione tra i fattori dello stile di vita attuale e la cognizione è complesso perché è probabile che anche lo stile di vita passato abbia influenzato queste relazioni. Pertanto, è necessario prestare attenzione nella selezione di indici appropriati da includere in una misura proxy della riserva cognitiva. In questo studio, l’istruzione e la complessità occupazionale sono state incorporate in una misura proxy combinata.
In questa analisi trasversale, abbiamo voluto esplorare il potenziale effetto di mediazione della riserva cognitiva, indicizzato da una combinazione di livello educativo e complessità occupazionale, sull’associazione tra fattori di stile di vita e funzione cognitiva nella vita adulta, utilizzando i dati di una vasta coorte di anziani sani in Galles, Regno Unito, basata sulla popolazione. Abbiamo ipotizzato che la riserva cognitiva medierebbe l’associazione tra fattori potenzialmente modificabili dello stile di vita (attività cognitiva, impegno sociale, attività fisica, dieta, consumo di alcol e fumo) e funzione cognitiva.
Metodi
Popolazione studiata
L’approvazione etica è stata concessa dal North Wales Research Ethics Committee (West), numero di riferimento 10/WNo01/37. Il Cognitive Function and Ageing Study Wales (CFAS-Wales) è uno studio longitudinale basato sulla popolazione di persone di 65 anni e oltre nelle aree rurali (Gwynedd e Ynys Môn) e urbane (Neath Port Talbot) del Galles che mira a indagare la salute fisica e cognitiva in età avanzata ed esaminare le interazioni tra salute, reti sociali, attività e partecipazione. Gli individui di età pari o superiore ai 65 anni sono stati campionati a caso da liste di medicina generale tra il 2011 e il 2013, stratificate per età per garantire un numero uguale di persone in due gruppi di età, 65-74 anni e 75+ anni. Il tasso di risposta, in termini di percentuale di persone idonee e contattabili che hanno partecipato, è stato del 44%. Un ulteriore 13% non ha potuto partecipare per motivi di salute. Coloro che hanno fornito il consenso scritto a partecipare allo studio sono stati intervistati a casa propria da intervistatori formati e hanno potuto scegliere di far condurre l’intervista attraverso la lingua inglese o gallese. I partecipanti sono stati seguiti 2 anni dopo. In questo studio abbiamo condotto analisi trasversali con i dati della prima ondata di interviste (versione dati 2.0).
Mentre il CFAS-Wales è collegato al CFAS-II, che è stato condotto in tre siti in Inghilterra, ci sono alcune differenze tra i due studi in termini di misure utilizzate, e, importante per questo studio, il Galles ha avuto nel corso delle generazioni un sistema educativo un po’ diverso da quello inglese. Il CFAS originale comprendeva siti sia in Inghilterra che in Galles, e l’analisi ha cercato di compensare queste differenze, ma dato che si trattava già di un’analisi trasversale, si è ritenuto preferibile garantire una popolazione il più possibile omogenea, e quindi abbiamo limitato le nostre analisi ai dati CFAS-Galles.
Il campione di base era costituito da 3.593 individui. Per la presente analisi, è stato importante escludere le persone con deficit cognitivo per evitare una potenziale causalità inversa. Abbiamo escluso chiunque avesse un Mini-Mental State Examination (MMSE)[16] punteggio ≤ 25 (n = 908) o una classificazione AGECAT [17] di demenza (n = 185). Sono stati esclusi anche quelli con una classificazione AGECAT della depressione(n = 333), quelli che vivono in istituti( n = 95), quelli senza dati completi dell’intervista( n = 80), e quelli con punteggi di test cognitivi mancanti( n = 4). Il campione per questo studio comprendeva quindi 2.315 partecipanti del CFAS-Wales.
Misure
La funzione cognitiva è stata misurata dal Cambridge Cognitive Examination (CAMCOG), una breve batteria neuropsicologica progettata per valutare una serie di funzioni cognitive nella popolazione anziana, con possibili punteggi che vanno da 0-107 [18].
La riserva cognitiva è stata misurata combinando due indicatori proxy: il livello di istruzione (anni di istruzione a tempo pieno) e la complessità occupazionale. L’occupazione principale è stata ricodificata utilizzando i sistemi di classe sociale e di gruppi socioeconomici e poi riclassificata in 15 gruppi che riflettono diversi livelli di complessità occupazionale[19]. I pesi per ogni componente sono stati generati sulla base dell’intervallo interquartile per garantire contributi uguali al punteggio di riserva cognitiva combinata, ottenendo la seguente formula: Punteggio di riserva cognitiva=1,7×(anni di istruzione)+1×(livello di complessità occupazionale).
Il livello di attività fisica è stato determinato dalla frequenza di impegno riportata in 18 tipi di attività fisica lieve (giardinaggio leggero, bocce, lavori domestici leggeri e riparazioni domestiche), moderata (giardinaggio, falciatura elettrica del prato, pulizia dell’auto, camminare a un ritmo moderato, danza, esercizi per il pavimento o lo stretching e lavori domestici pesanti) e vigorosa (jogging, nuoto, ciclismo, aerobica o palestra, tennis, giardinaggio pesante e falciatura manuale del prato), e vigorosa (jogging, nuoto, bicicletta, aerobica o palestra, tennis, giardinaggio pesante e falciatura manuale del prato). Una scala continua è stata generata utilizzando i livelli di frequenza (0 = una volta all’anno o meno, 1 = più volte all’anno, 2 = più volte al mese, 3 = più volte alla settimana, e 4 = ogni giorno o quasi ogni giorno) moltiplicati per il rapporto di intensità (mite: moderata: vigorosa = 1:2:3), che era basato sul rapporto metabolico equivalente del compito (MET) suggerito in letteratura[20].
Gli attuali e gli ex-fumatori sono stati identificati utilizzando due domande: “Fumi?” e “Hai mai fumato?
Le informazioni autodenunciate sulla frequenza del consumo di alcol negli ultimi 12 mesi sono state utilizzate per classificare i partecipanti in quattro gruppi: quasi astinenti (per niente negli ultimi 12 mesi o una o due volte all’anno); bevitori poco frequenti (una o due volte al mese o una volta ogni due mesi); bevitori frequenti da leggeri a moderati (una o due volte alla settimana o tre o quattro volte alla settimana); e bevitori regolari da leggeri a moderati (cinque o sei volte alla settimana o quasi ogni giorno).
Per descrivere il modello dietetico generale, è stato generato un punteggio totale per la dieta sana. CFAS-Wales ha studiato la frequenza del consumo (mai, raramente, una volta alla settimana, 2-4 volte alla settimana, 5-6 volte alla settimana o al giorno) e il numero di porzioni al giorno di frutta fresca, verdura a foglia verde, altre verdure, pesce grasso, altro pesce e pane integrale/marrone e porzioni giornaliere di alimenti in amido, latticini e alimenti zuccherati. Questa analisi si è concentrata sulla frequenza dell’assunzione di alimenti “alla mediterranea”, tra cui frutta fresca, verdure a foglia verde, altre verdure, pesce grasso, altri pesci e pane integrale/marrone. La frequenza comprendeva sei livelli: mai, raramente, una volta alla settimana, 2-4 volte alla settimana, 5-6 volte alla settimana o al giorno. Sebbene l’evidenza ha suggerito che questi sono tutti componenti benefici per la riduzione del rischio di demenza, le quantità e i tagli selezionati variano considerevolmente tra gli studi ([21,22]). Per descrivere il modello dietetico generale, è stato generato un punteggio totale per la dieta sana basato sui sei livelli di frequenza. L’intervallo era compreso tra 2 (meno frequente) e 30 (più frequente), e la media era di 18,2 (deviazione standard [SD]: 4,4).
Un punteggio sommario per l’attività cognitiva e sociale è stato generato sulla base della frequenza di sette attività cognitive (ascoltare la radio, leggere un giornale, leggere una rivista, leggere un libro, giocare a giochi come le carte o gli scacchi, fare parole crociate e fare puzzle) e tre attività sociali (“Con quale frequenza vedete qualcuno dei vostri [bambini o altri] parenti con cui parlare?” “Partecipate alle riunioni o a qualche comunità o gruppo sociale?” e “Con quale frequenza vedete qualcuno dei vostri vicini per chiacchierare o fare qualcosa?) Abbiamo combinato i punteggi per l’attività cognitiva e sociale, poiché in molte attività gli elementi cognitivi e sociali sono strettamente interconnessi.
Covariates
L’intervista ha fornito informazioni sull’età, il sesso e la presenza di patologie croniche. Cinque condizioni croniche (ipertensione, diabete, ictus, infarto, infarto e trauma cranico) sono state considerate fattori di confusione che potrebbero influenzare sia lo stile di vita che le funzioni cognitive[7,23,24].
Analisi statistica
La percentuale di dati mancanti era piccola (4%); i casi di dati mancanti sono documentati nella tabella 1. Il confronto tra individui con dati completi e quelli con dati mancanti non ha mostrato alcuna differenza significativa nella funzione cognitiva. È stata condotta un’analisi di sensibilità per indagare le associazioni in serie di dati di imputazione multipla. Le distribuzioni sono state esaminate prima di finalizzare il piano di analisi. Ulteriori informazioni, compresi i risultati dell’analisi di sensibilità, si trovano nel file supplementare(S1 Text).
| Misure categoriali | n (%) | Misure continue | Media (SD) | Gamma | |
|---|---|---|---|---|---|
| Sesso | Uomini | 1,132 (48.9) | Età (anni) | 73.5 0(6.3) | (65–100) |
| Donne | 1,183 (51.1) | Anni di istruzione (mancanti = 6) (anni) | 12.0 0(2.8) | (1–30) | |
| Condizioni croniche (mancanti = 7) | Ipertensione | 1,102 (47.7) | Complessità professionale (mancante = 63) (livello) | 8.1 0(3.3) | (1–14) |
| Diabete | 384 (16.6) | Funzione cognitiva-CAMCOG (punteggio) | 93.4 0(5.4) | (63–105) | |
| Corsa | 124 0(5.4) | Attività fisica (mancante = 5) (punteggio composito) | 19.8 (14.0) | (0–87) | |
| Attacco di cuore | 196 0(8.5) | Dieta (mancante = 4) (punteggio composito) | 18.2 (4.4) | (2–30) | |
| Trauma cranico | 217 0(9.4) | Attività cognitiva e sociale (mancante = 12) (punteggio composito) | 32.1 (6.2) | (10–49) | |
| Fumo (mancante = 9) | Mai | 981 (42.5) | |||
| Fumatore corrente | 1,128 (48.9) | ||||
| Ex-fumatore | 197 0(8.5) | ||||
| Consumo di alcool (mancante = 10) | Quasi astinente | 606 (26.3) | |||
| Raramente | 418 (18.1) | ||||
| Frequente | 784 (34.0) | ||||
| Regolare | 497 (21.6) |
La modellizzazione della regressione lineare è stata utilizzata per indagare le associazioni complessive tra ciascun fattore di stile di vita e la funzione cognitiva che si adatta ai fattori demografici e alle condizioni croniche. Poiché i cinque fattori dello stile di vita erano probabilmente correlati, è stato testato un modello completo che comprendeva tutti i fattori dello stile di vita e le covariate.
L’analisi della mediazione è stata utilizzata per indagare i meccanismi alla base delle relazioni osservate tra esposizioni ed esiti e per esaminare ulteriori variabili ipotizzate sulla via causale[22, 23]. Sulla base dei risultati per le associazioni complessive, la misura del fumo è stata ricategorizzata in due gruppi (fumatori attuali contro ex-fumatori / mai fumatori) nell’analisi di mediazione. La frequenza del consumo di alcol è stata trattata come una variabile continua, e la “tendenza” (variazioni della funzione cognitiva per ogni aumento del livello di frequenza) è stata testata nell’analisi della mediazione. Per indagare il potenziale effetto mediatore della riserva cognitiva sull’associazione tra fattori di stile di vita e funzione cognitiva, sono stati stimati tre percorsi(a, b e c) utilizzando la modellazione della regressione lineare e l’adattamento per età, sesso e condizioni croniche(Fig 1)[25]. Per ogni fattore di stile di vita, gli effetti diretti e indiretti sono stati calcolati utilizzando la sintassi dell’analisi di mediazione STATA (sgmediation) con intervalli di confidenza di bootstrapping[26]. La percentuale di percorsi indiretti tra gli effetti totali è stata calcolata per indicare l’effetto di mediazione della riserva cognitiva sull’associazione tra fattori di stile di vita e funzione cognitiva. Tutti i fattori dello stile di vita sono stati inclusi in un modello di regressione per esplorare l’effetto indiretto complessivo della riserva cognitiva. È stato utilizzato il quadrettato R rettificato per indicare la proporzione della varianza spiegata dalle variabili indipendenti. Tutte le misure sono state standardizzate per fornire coefficienti comparabili tra i diversi fattori di stile di vita.
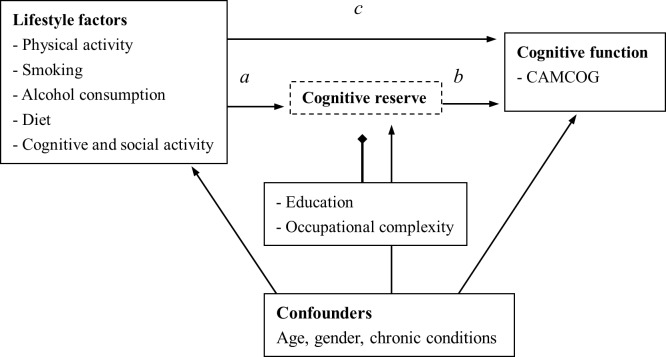
Fig. 1.Effetto mediatore della riserva cognitiva sull’associazione tra fattori di stile di vita e funzione cognitiva.

Fig 1.Effetto mediatore della riserva cognitiva sull’associazione tra fattori di stile di vita e funzione cognitiva.
Risultati
Le informazioni descrittive per i fattori sociodemografici, le funzioni cognitive, le condizioni croniche e i fattori legati allo stile di vita sono riportate nella Tabella 1. Tra i 2.315 partecipanti, l’età media era di 74 anni (SD: 6,3), e il 51% erano donne. Il punteggio medio di CAMCOG è stato di 93,4 (SD: 5,4; mediano: 94; intervallo interquartile (IQR): 7). Il punteggio medio per la riserva cognitiva è stato di 28,6 (SD: 6,8), con un range tra 9,7 e 62,0.
Latabella 2 riporta l’associazione complessiva tra la funzione cognitiva e i fattori potenzialmente modificabili dello stile di vita. A parte il fumo, tutti i fattori dello stile di vita sono stati significativamente associati alle funzioni cognitive dopo l’adattamento all’età, al sesso e alle condizioni croniche. Il fumo attuale ha avuto associazioni negative con le funzioni cognitive, ma le differenze non hanno raggiunto una significatività statistica. Come mostrato nel modello 3 della Tabella 2, le persone che hanno riportato livelli più alti di attività cognitiva e sociale (0,20; 95% IC 0,16-0,24), livelli più alti di attività fisica (0,11; 95% CI 0,07-0,15), e modelli dietetici più sani (0,13; 95% CI 0,09-0,17) hanno avuto punteggi CAMCOG più alti. C’è stata una relazione dose-risposta tra la funzione cognitiva e la frequenza del consumo di alcol, con i bevitori regolari da leggeri a moderati con punteggi CAMCOG media più alta (0,34; 95% CI 0,23-0,46) rispetto agli astenuti. Nel modello completo che include tutti i fattori dello stile di vita (Modello 4), le associazioni significative con l’attività cognitiva e sociale, l’attività fisica, la dieta sana e il consumo regolare di alcolici leggeri e moderati sono rimaste evidenti, ma le dimensioni dell’effetto sono state leggermente ridotte. La stima del R-squared corretto mostra che includendo tutti i fattori dello stile di vita si spiega circa il 5% della variazione della funzione cognitiva.
| Modello 1 | Modello 2 | Modello 3 | Modello 4 | |
|---|---|---|---|---|
| Coefficiente (95% CI) | Coefficiente (95% CI) | Coefficiente (95% CI) | Coefficiente (95% CI) | |
| Attività fisica | 0.20 (0.16–0.24) | 0.12 (0.08–0.16) | 0.11 (0.07–0.15) | 0.06 (0.01–0.10) |
| p-valore* | <0.01 | <0.01 | <0.01 | 0.01 |
| Fumo: Ex-fumatore contro mai | 0.11 (0.02–0.20) | 0,05 (da -0,04 a 0,13) | 0,05 (da -0,03 a 0,14) | 0,02 (da -0,06 a 0,10) |
| Fumo: Fumatore attuale contro mai | 0,09 (da -0,06 a 0,25) | -0,05 (da -0,19 a 0,10) | -0,03 (da -0,18 a 0,12) | 0,05 (da -0,09 a 0,20) |
| p-valore* | 0.04 | 0.32 | 0.30 | 0.77 |
| Alcool: poco frequente contro quasi astinente | 0.29 (0.16–0.41) | 0.19 (0.07–0.31) | 0.17 (0.05–0.29) | 0,11 (da -0,01 a 0,22) |
| L’alcool: Frequente contro quasi astinente | 0.41 (0.30–0.51) | 0.27 (0.16–0.36) | 0.24 (0.13–0.34) | 0.16 (0.06–0.27) |
| L’alcool: Regolare contro quasi astinente | 0.47 (0.35–0.58) | 0.37 (0.26–0.48) | 0.34 (0.23–0.46) | 0.26 (0.15–0.38) |
| p-valore* | <0.01 | <0.01 | <0.01 | <0.01 |
| Dieta | 0.14 (0.10–0.18) | 0.14 (0.10–0.17) | 0.13 (0.09–0.17) | 0.08 (0.04–0.12) |
| p-valore* | <0.01 | <0.01 | <0.01 | <0.01 |
| Attività cognitiva e sociale | 0.20 (0.16–0.24) | 0.20 (0.16–0.24) | 0.20 (0.16–0.24) | 0.17 (0.13–0.21) |
| p-valore* | <0.01 | <0.01 | <0.01 | <0.01 |
Latabella 3 riporta le stime per i tre percorsi a (associazione tra fattori di stile di vita e riserva cognitiva), b (associazione tra riserva cognitiva e funzione cognitiva), e c (associazione tra fattori di stile di vita e funzione cognitiva), così come la percentuale di effetto indiretto (da a a b) tra le associazioni complessive. Il modello alimentare ha avuto il più forte effetto indiretto (0,05; 95% CI 0,04-0,06) rispetto agli altri fattori di stile di vita; l’effetto indiretto identificato variava dal 36% per la dieta al 15% per l’attività cognitiva e sociale. Sebbene il fumo abbia mostrato un potenziale effetto indiretto (-0,05; 95% CI da -0,09 a -0,02), l’associazione tra fumo e funzione cognitiva non è stata significativa.
| Percorso a (Associazione tra fattore di stile di vita e riserva cognitiva) | Percorso b (Associazione tra riserva cognitiva e funzione cognitiva) | Percorso c (Associazione tra fattore di stile di vita e funzione cognitiva) | Effetto indiretto (da a a b) | % dell’effetto indiretto | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Modello 1 | Modello 2 | Modello 3 | Modello 1 | Modello 2 | Modello 3 | Modello 1 | Modello 2 | Modello 3 | |||
| Coefficiente | Coefficiente | Coefficiente | Coefficiente | Coefficiente | Coefficiente | Coefficiente | Coefficiente | Coefficiente | Coefficiente | ||
| (95% CI) | (95% CI) | (95% CI) | (95% CI) | (95% CI) | (95% CI) | (95% CI) | (95% CI) | (95% CI) | (95% CI) | ||
| Attività fisica | 0.11 | 0.11 | 0.09 | 0.25 | 0.24 | 0.24 | 0.17 | 0.09 | 0.08 | 0.02 | 21% |
| (0.07–0.16) | (0.06–0.15) | (0.05–0.14) | (0.21–0.29) | (0.20–0.28) | (0.20–0.28) | (0.13–0.21) | (0.05–0.13) | (0.04–0.12) | (0.01–0.03) | ||
| Fumo (attuale contro mai/ex-fumatori) | −0.20 | −0.22 | −0.20 | 0.27 | 0.25 | 0.25 | 0.08 | −0.02 | −0.01 | −0.05 | |
| (da -0,35 a -0,05) | (da -0,37 a -0,07) | (da -0,35 a -0,06) | (0.23–0.31) | (0.21–0.29) | (0.21–0.28) | (da -0,06 a 0,22) | (da -0,16 a 0,11) | (da -0,15 a 0,12) | (da -0,09 a -0,02) | ||
| Alcool (maggiore o minore frequenza) | 0.14 | 0.14 | 0.13 | 0.25 | 0.23 | 0.24 | 0.13 | 0.09 | 0.08 | 0.03 | 26% |
| (0.10–0.17) | (0.10–0.17) | (0.09–0.17) | (0.21–0.29) | (0.20–0.27) | (0.20–0.28) | (0.09–0.16) | (0.05–0.12) | (0.05–0.12) | (0.02–0.04) | ||
| Dieta | 0.21 | 0.21 | 0.21 | 0.25 | 0.23 | 0.23 | 0.09 | 0.09 | 0.08 | 0.05 | 36% |
| (0.17–0.25) | (0.17–0.26) | (0.16–0.25) | (0.21–0.29) | (0.19–0.27) | (0.19–0.27) | (0.05–0.13) | (0.05–0.13) | (0.05–0.12) | (0.04–0.06) | ||
| Attività cognitiva e sociale | 0.13 | 0.13 | 0.13 | 0.25 | 0.23 | 0.23 | 0.17 | 0.17 | 0.17 | 0.03 | 15% |
| (0.09–0.17) | (0.09–0.18) | (0.09–0.17) | (0.21–0.29) | (0.19–0.27) | (0.19–0.27) | (0.13–0.21) | (0.13–0.21) | (0.13–0.21) | (0.02–0.04) | ||
Quattro fattori di stile di vita – attività cognitiva e sociale, attività fisica, consumo regolare di alcool da leggero a moderato e dieta sana – hanno avuto sia associazioni dirette (0,30; 95% CI 0,24-0,37) che indirette (0,08; 95% CI 0,06-0,10) con le funzioni cognitive. La proporzione dell’effetto totale (diretto più indiretto) dei quattro fattori di stile di vita che è stata mediata dalla riserva cognitiva è stata del 21% (0,08; 95% CI 0,06-0,10) (Fig2A). Questo modello completo ha spiegato il 20% (rettificato R-quadrato = 0,21) della variazione della funzione cognitiva tra i partecipanti al CFAS-Wales. La Fig 2B e la Fig 2C mostrano gli effetti mediatori delle singole componenti della riserva cognitiva (anni di istruzione e complessità occupazionale) sulle associazioni tra la riserva cognitiva e i fattori dello stile di vita. Sebbene i risultati siano stati simili a quelli del punteggio della riserva cognitiva combinata, le dimensioni dell’effetto per i percorsi indiretti sono state più piccole in questi modelli. I risultati dell’analisi di sensibilità dei set di dati imputati erano simili a quelli dell’analisi principale(S1 Text), e quindi l’impatto dei dati mancanti era piccolo.
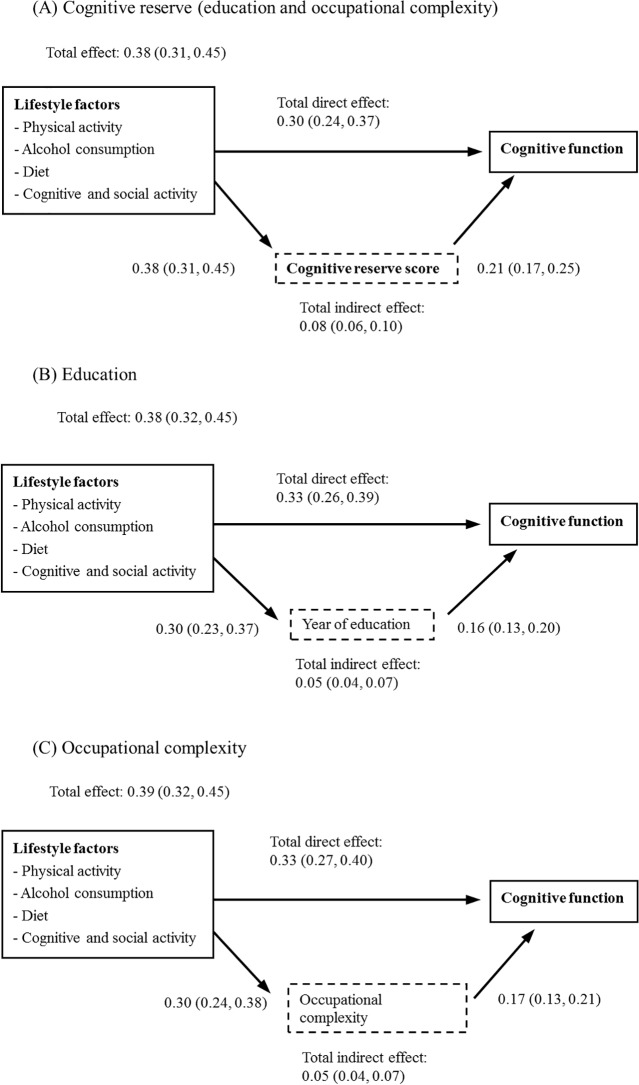
Fig. 2.Fig. 2. Associazioni tra fattori di stile di vita, riserva cognitiva e funzione cognitiva (adattate all’età, al sesso e alle condizioni croniche).

Fig 2.Fig. 2. Associazioni tra fattori dello stile di vita, riserva cognitiva e funzione cognitiva (adattate per età, genere e condizioni croniche).
Discussione
Questo studio ha indagato il potenziale effetto di mediazione della riserva cognitiva sull’associazione tra funzione cognitiva e fattori di stile di vita potenzialmente modificabili attraverso l’analisi trasversale dei dati di una coorte di anziani in Galles basata sulla popolazione. L’ipotesi che la riserva cognitiva svolga un ruolo di mediazione è stata ampiamente sostenuta. L’attività cognitiva e sociale, l’attività fisica, il consumo regolare di alcol da leggero a moderato e una dieta sana sono stati tutti associati positivamente alle funzioni cognitive e insieme hanno rappresentato il 20% della varianza dei punteggi dei test cognitivi. Il fumo, tuttavia, non è stato associato alle funzioni cognitive. I risultati dell’analisi di mediazione hanno mostrato che la riserva cognitiva, indicizzata in base all’istruzione e alla complessità occupazionale, è stata un importante mediatore dell’associazione tra i quattro fattori dello stile di vita e la cognizione, con effetti indiretti attraverso la riserva cognitiva che hanno contribuito al 21% dell’effetto complessivo.
Questo studio conferma la rilevanza dei fattori dello stile di vita potenzialmente modificabili per la cognizione in età avanzata e, in linea con altri rapporti, sottolinea le possibilità che ciò offre per sostenere il mantenimento della salute cognitiva[7,23,27]. I nostri risultati sono coerenti con i precedenti risultati trasversali e longitudinali sull’attività cognitiva e sociale. L’attività cognitiva può ridurre il rischio di demenza[28], mentre gli aspetti dell’impegno sociale sono associati a una migliore funzione cognitiva in età avanzata, e possibilmente a un ridotto rischio di demenza[29]. Analogamente, la maggior parte degli studi osservazionali sugli effetti dell’attività fisica sulla cognizione mostrano un’associazione tra livelli più alti di attività fisica e tassi più bassi di declino cognitivo o demenza[28,30]. La nostra misura della dieta sana comprendeva l’assunzione di frutta, verdura e pesce. La ricerca sulle diete sane sottolinea i benefici del consumo di verdura e l’adesione a una dieta di tipo mediterraneo[31-33]come protettiva della salute cognitiva, anche se solo il consumo di pesce oleoso è stato identificato come significativo in una revisione sistematica dei fattori di rischio [7]. I nostri risultati sull’assunzione di alcolici sono simili a quelli di studi che riportano che l’assunzione di alcolici da leggeri a moderati è associata a un rischio minore rispetto all’astinenza[34- 36], anche se una recente ricerca suggerisce che, mentre il consumo frequente di alcolici nelle prime fasi della vita è significativamente associato a un aumento del rischio rispetto al bere poco frequente, l’astinenza non lo è [37]. Il fumo, anche se comunemente identificato come fattore di rischio, non è stato associato in modo significativo con la funzione cognitiva nel presente studio dopo averlo adattato per possibili confusioni.
Questo studio fornisce anche l’evidenza che contribuisce a spiegare i meccanismi alla base dell’associazione tra questi fattori di stile di vita e la cognizione e sostiene l’opinione che la riserva cognitiva gioca un ruolo importante in questa relazione. La riserva cognitiva aumenta la resilienza contro gli effetti della neuropatologia e quindi supporta il mantenimento della funzione in età avanzata[11]. La riserva cognitiva non è una proprietà statica, ma si pensa piuttosto che si evolva nel corso della vita[12], e le scelte di stile di vita possono contribuire a proteggere le persone anziane dal declino cognitivo e dalla demenza sostenendo lo sviluppo, la connettività e il mantenimento delle reti cerebrali.
Lo studio ha diversi limiti che devono essere tenuti a mente. Si tratta di dati trasversali, e quindi non possiamo dedurre relazioni causali. Il follow-up longitudinale può fornire ulteriori informazioni, mentre il confronto di quelli con alta e bassa riserva cognitiva indicherebbe se ci sono differenze nello stile di vita che distinguono i due gruppi o, in alternativa, se la riserva cognitiva contrasta gli effetti di uno stile di vita cognitivo meno attivo. La valutazione di queste relazioni è particolarmente complessa perché fattori di stile di vita come l’impegno passato nell’attività cognitiva e sociale possono aver influenzato e contribuito agli attuali livelli di riserva cognitiva. In effetti, alcuni approcci per valutare la riserva cognitiva includono la valutazione non solo del passato ma anche dell’impegno attuale in tali attività come parte della misura della riserva cognitiva proxy[15]. Concettualmente, quindi, lo stile di vita cognitivo e la riserva cognitiva diventano difficili da distinguere, e questo crea sfide per la comprensione dei meccanismi alla base delle associazioni osservate. Abbiamo affrontato questa possibile circolarità utilizzando solo il livello di istruzione e la complessità occupazionale, due aspetti dell’esperienza passata che probabilmente saranno relativamente stabili, nella nostra misura combinata della riserva cognitiva. In quanto costrutto latente, la riserva cognitiva è difficile da valutare con precisione, e mentre l’evidenza suggerisce che le misure proxy combinate sono più appropriate di singoli indicatori come il livello di istruzione, non c’è ancora un consenso su un approccio ottimale alla misurazione. I due indicatori che abbiamo utilizzato potrebbero essere soggetti a distorsioni di segnalazione o di richiamo o, nel caso dell’occupazione, influenzati dal cambiamento delle circostanze. La nostra misura proxy è stata quindi una misura relativamente grezza. L’implicazione di ciò è che le nostre scoperte sono suscettibili, se non altro, di sottovalutare la relazione tra riserva cognitiva e funzione cognitiva e la misura in cui la riserva cognitiva media l’associazione tra stile di vita e funzione cognitiva. Tuttavia, c’è bisogno di una maggiore chiarezza e di un maggiore consenso sui contribuenti e sulla misurazione della riserva cognitiva e di progetti di studio migliorati che possano davvero stuzzicare la complessità delle associazioni tra fattori dello stile di vita, riserva cognitiva e cognizione.
Abbiamo escluso le persone con deficit cognitivo per ridurre il rischio di causalità inversa, ma è importante ricordare che le persone nelle primissime fasi del declino cognitivo possono ritirarsi dai contatti sociali e da altri tipi di attività e possono cambiare abitudini alimentari e di altro tipo. Pertanto, i potenziali effetti della causalità inversa non possono essere completamente esclusi. La valutazione dei fattori legati allo stile di vita si è basata sull’autodenuncia durante il colloquio e potrebbe essere soggetta a pregiudizi. In relazione al consumo di alcol, l’assenza di auto-rapporti sul consumo di alcolici, in particolare nel campione CFAS-Wales, potrebbe sollevare domande su possibili pregiudizi, ma è importante notare che solo tre partecipanti (0,1%) sono stati considerati dall’intervistatore come possibili problemi di alcolismo. La valutazione delle funzioni cognitive è stata limitata a un punteggio globale, e una valutazione neuropsicologica a grana più fine potrebbe rivelare associazioni più specifiche con particolari aspetti delle funzioni cognitive. C’erano alcuni dati mancanti, ma la portata di questi era piccola ed è improbabile che abbia influenzato i risultati. Nonostante questi limiti, il punto di forza particolare dello studio è che si basa su dati provenienti da una vasta coorte contemporanea di persone anziane nel Regno Unito.
Conclusioni
I risultati di questo studio sono coerenti con l’ipotesi che le associazioni significative tra quattro fattori potenzialmente modificabili dello stile di vita – l’attività cognitiva e sociale, l’attività fisica, una dieta sana e un consumo regolare di alcol da leggero a moderato – e la cognizione in età avanzata sono mediate dal livello di riserva cognitiva. Poiché questi risultati sono derivati da dati trasversali, sarà necessaria una conferma da analisi longitudinali. Tuttavia, questi risultati forniscono un supporto alla possibilità che il miglioramento della riserva cognitiva per tutta la durata della vita e l’incoraggiamento della partecipazione all’attività cognitiva, sociale e fisica e a una dieta sana, possano aiutare a mantenere la salute cognitiva in età avanzata.
Informazioni di supporto
References
- Hendrie HC, Albert MS, Butters MA, Gao S, Knopman DS, Launer LJ. The NIH cognitive and emotional health project: report of the critical evaluation study committee. Alzheimer’s & Dementia. 2006; 2(1):12-32.
- Centers for Disease Control and Prevention and the Alzheimer’s Association. The Healthy Brain Initiative: A National Public Health Road Map to Maintaining Cognitive Health. 2007.
- Polidori MC, Nelles G, Pientka L. Prevention of dementia: focus on lifestyle. International journal of Alzheimer’s disease. 2010; 2010
- Scazufca M, Almeida OP, Menezes PR. The role of literacy, occupation and income in dementia prevention: the São Paulo Ageing & Health Study (SPAH). International Psychogeriatrics. 2010; 22(08):1209-15. PubMed
- Hertzog C, Kramer AF, Wilson RS, Lindenberger U. Enrichment effects on adult cognitive development can the functional capacity of older adults be preserved and enhanced?. Psychological science in the public interest. 2008; 9(1):1-65. DOI | PubMed
- Van Muijden J, Band GP, Hommel B. Online games training aging brains: limited transfer to cognitive control functions. Frontiers in human neuroscience. 2012; 6:141-54. PubMed
- Anstey KJ, Cherbuin N, Herath PM. Development of a new method for assessing global risk of Alzheimer’s disease for use in population health approaches to prevention. Prevention Science. 2013; 14(4):411-21. DOI | PubMed
- Rovio S, Kåreholt I, Helkala E-L, Viitanen M, Winblad B, Tuomilehto J. Leisure-time physical activity at midlife and the risk of dementia and Alzheimer’s disease. The Lancet Neurology. 2005; 4(11):705-11. DOI | PubMed
- Blazer DG, Yaffe K, Liverman CT, Committee on the Public Health Dimensions of Cognitive Aging, Board on Health Sciences Policy, Institute of Medicine. Cognitive aging: Progress in understanding and opportunities for action. National Academies Press: Washington, D.C.; 2015.
- Stern Y. What is cognitive reserve? Theory and research application of the reserve concept. Journal of the International Neuropsychological Society. 2002; 8(03):448-60. PubMed
- Stern Y. The concept of cognitive reserve: a catalyst for research. Journal of clinical and experimental neuropsychology. 2003; 25(5):589-93. DOI | PubMed
- Valenzuela MJ, Sachdev P. Brain reserve and dementia: a systematic review. Psychological medicine. 2006; 36(04):441-54. PubMed
- Richards M, Deary IJ. A life course approach to cognitive reserve: a model for cognitive aging and development?. Annals of neurology. 2005; 58(4):617-22. DOI | PubMed
- Gómez-Pinilla F. Brain foods: the effects of nutrients on brain function. Nature Reviews Neuroscience. 2008; 9(7):568-78. DOI | PubMed
- Opdebeeck C, Martyr A, Clare L. Cognitive reserve and cognitive function in healthy older people: a meta-analysis. Aging, Neuropsychology, and Cognition. 2015; 23(1):40-60.
- Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”: a practical method for grading the cognitive state of patients for the clinician. Journal of psychiatric research. 1975; 12(3):189-98. PubMed
- Copeland J, Dewey ME, Griffiths-Jones H. A computerized psychiatric diagnostic system and case nomenclature for elderly subjects: GMS and AGECAT. Psychological Medicine. 1986; 16(01):89-99. PubMed
- Huppert FA, Brayne C, Gill C, Paykel E, Beardsall L. CAMCOG—A concise neuropsychological test to assist dementia diagnosis: Socio‐demographic determinants in an elderly population sample. British Journal of Clinical Psychology. 1995; 34(4):529-41. PubMed
- Valenzuela MJ, Brayne C, Sachdev P, Wilcock G. Cognitive lifestyle and long-term risk of dementia and survival after diagnosis in a multicenter population-based cohort. American journal of epidemiology. 2011; 173(9):1004-12. DOI | PubMed
- Aaron DJ, Dearwater SR, Anderson R, Olsen T, Kriska AM, Laporte RE. Physical activity and the initiation of high-risk health behaviors in adolescents. Medicine & Science in Sports & Exercise. 1995.
- Barberger-Gateau P, Letenneur L, Deschamps V, Pérès K, Dartigues J-F, Renaud S. Fish, meat, and risk of dementia: cohort study. BMJ. 2002; 325(7370):932-3. PubMed
- Albanese E, Dangour AD, Uauy R, Acosta D, Guerra M, Guerra SSG. Dietary fish and meat intake and dementia in Latin America, China, and India: a 10/66 Dementia Research Group population-based study. The American Journal of Clinical Nutrition. 2009; 90(2):392-400. DOI | PubMed
- Norton S, Matthews FE, Barnes DE, Yaffe K, Brayne C. Potential for primary prevention of Alzheimer’s disease: an analysis of population-based data. The Lancet Neurology. 2014; 13(8):788-94. DOI | PubMed
- Richard E, Van den Heuvel E, van Charante EPM, Achthoven L, Vermeulen M, Bindels PJ. Prevention of dementia by intensive vascular care (PreDIVA): a cluster-randomized trial in progress. Alzheimer Disease & Associated Disorders. 2009; 23(3):198-204. PubMed
- Zhao X, Lynch JG, Chen Q. Reconsidering Baron and Kenny: Myths and truths about mediation analysis. Journal of consumer research. 2010; 37(2):197-206.
- Preacher KJ, Hayes AF. SPSS and SAS procedures for estimating indirect effects in simple mediation models. Behavior research methods, instruments, & computers. 2004; 36(4):717-31.
- Jagger C, Gillies C, Moscone F, Cambois E, Van Oyen H, Nusselder W. Inequalities in healthy life years in the 25 countries of the European Union in 2005: a cross-national meta-regression analysis. The Lancet. 2009; 372(9656):2124-31.
- Plassman BL, Williams JW, Burke JR, Holsinger T, Benjamin S. Systematic review: factors associated with risk for and possible prevention of cognitive decline in later life. Annals of Internal Medicine. 2010; 153(3):182-93. DOI | PubMed
- Fratiglioni L, Paillard-Borg S, Winblad B. An active and socially integrated lifestyle in late life might protect against dementia. The Lancet Neurology. 2004; 3(6):343-53. DOI | PubMed
- Rolland Y, van Kan GA, Vellas B. Physical activity and Alzheimer’s disease: from prevention to therapeutic perspectives. Journal of the American Medical Directors Association. 2008; 9(6):390-405. DOI | PubMed
- Morris M, Evans D, Tangney C, Bienias J, Wilson R. Associations of vegetable and fruit consumption with age-related cognitive change. Neurology. 2006; 67(8):1370-6. DOI | PubMed
- Scarmeas N, Stern Y, Mayeux R, Luchsinger JA. Mediterranean diet, Alzheimer disease, and vascular mediation. Archives of neurology. 2006; 63(12):1709-17. DOI | PubMed
- Loef M, Walach H. Fruit, vegetables and prevention of cognitive decline or dementia: a systematic review of cohort studies. The journal of nutrition, health & aging. 2012; 16(7):626-30.
- Letenneur L. Risk of dementia and alcohol and wine consumption: a review of recent results. Biological research. 2004; 37(2):189-93. PubMed
- Luchsinger JA, Tang MX, Siddiqui M, Shea S, Mayeux R. Alcohol intake and risk of dementia. Journal of the American Geriatrics Society. 2004; 52(4):540-6. DOI | PubMed
- Neafsey EJ, Collins MA. Moderate alcohol consumption and cognitive risk. Neuropsychiatric disease and treatment. 2011; 7:465. DOI | PubMed
- Langballe EM, Ask H, Holmen J, Stordal E, Saltvedt I, Selbæk G. Alcohol consumption and risk of dementia up to 27 years later in a large, population-based sample: the HUNT study, Norway. European journal of epidemiology. 2015; 30(9):1049-56. DOI | PubMed
Fonte
Clare L, Wu Y, Teale JC, MacLeod C, Matthews F, et al. (2017) Potentially modifiable lifestyle factors, cognitive reserve, and cognitive function in later life: A cross-sectional study. PLoS Medicine 14(3): e1002259. https://doi.org/10.1371/journal.pmed.1002259





