Abstract
Introduzione
Il cancro ai polmoni è la principale causa di mortalità legata alcancro1 , con 1,7 milioni di morti in tutto il mondo ogni anno.2 L’esposizione al fumo di tabacco è nota per causare la maggior parte dei casi di cancro ai polmoni,1 ma una comprensione più profonda dei fattori intermedi che influenzano la patogenesi del cancro ai polmoni è limitata. In generale, l’infiammazione è stata proposta come un importante fattore di rischio per il cancro, ma non è chiaro fino a che punto l’infiammazione possa guidare il rischio di cancro ai polmoni.3
La proteina C reattiva (CRP) è una proteina infiammatoria in fase acuta che viene sintetizzata nel fegato in risposta ad un’infiammazione di basso grado.45 La CRP ad alta sensibilità (hsCRP) risponde come un biomarcatore sensibile ma non specifico per le infiammazioni sistemiche. Due studi indipendenti caso-controllo nidificati nella Prostata, nel Polmone, nel Colorettale e nello Screening Trial del Cancro Ovarico hanno mostrato un’associazione positiva tra le concentrazioni di CRP in circolazione e il rischio di cancro ai polmoni per i fumatori attuali e per gli ex-fumatori.6 Più recentemente, è stata riportata un’associazione inversa tra la CRP e il rischio di cancro ai polmoni per le donne che non hanno mai fumato, un sottogruppo importante che lo Screening Trial per il cancro alla prostata, al polmone, al colon-retto e alle ovaie non è stato adeguatamente valutato.7
Sia il basso costo che la maggiore disponibilità di test CRP presso il punto di cura nell’ambito delle cure primarie giustificano ulteriori indagini sul potenziale utilizzo del CRP come biomarcatore di rischio per lo sviluppo del cancro ai polmoni.8910L’obiettivo primario del nostro studio era quello di indagare in modo approfondito la relazione tra la concentrazione di hsCRP in circolazione e il rischio di cancro ai polmoni per i fumatori mai, ex e attuali. L’obiettivo secondario del nostro studio era quello di condurre un’analisi di discriminazione del rischio per valutare se la concentrazione di hsCRP in circolazione combinata con le informazioni sul fumo autosommerso potesse discriminare meglio tra gli attuali fumatori a basso e alto rischio di sviluppare il cancro ai polmoni, rispetto alle sole informazioni sul fumo autosommerso. Questo studio ha utilizzato campioni di siero o plasma prediagnostici provenienti da 5299 coppie individuali di controllo dell’incidenza e della densità di casi di cancro al polmone del Consorzio della coorte del cancro al polmone, che comprendeva 20 potenziali coorti provenienti dall’Asia, dall’Europa, dall’Australia e dagli Stati Uniti.
Metodi
Popolazione studiata
Tutte le coorti potenziali con campioni di plasma o siero di base congelati che nel 2009 erano membri del Consorzio della coorte del National Cancer Institute Cohort degli Stati Uniti sono state invitate a partecipare al Consorzio della coorte del cancro ai polmoni. Un totale di 20 coorti potenziali provenienti da Asia, Europa, Australia e Stati Uniti sono state invitate e hanno accettato di partecipare al Consorzio della coorte del cancro ai polmoni. Al momento del reclutamento, i partecipanti alla ricerca hanno fornito il consenso informato scritto alle rispettive coorti e il progetto del Lung Cancer Cohort Consortium è stato approvato dai comitati di revisione istituzionale di ogni istituzione partecipante. I partecipanti di ogni coorte sono stati seguiti per la diagnosi del cancro e lo stato vitale, principalmente attraverso il collegamento con i registri della popolazione. Ulteriori dettagli sul reclutamento della coorte del Consorzio per il cancro ai polmoni e sulle procedure di follow-up dei partecipanti sono statipubblicati11 e sono disponibili nel materiale supplementare.
Selezione dei casi e controlli
Abbiamo definito i casi di cancro ai polmoni come tutti i tumori invasivi con ICD-O-2 (classificazione internazionale delle malattie per l’oncologia, 2a edizione) codici da C34.0 a C34.9. Gli ex fumatori, e mai fumatori, sono stati intenzionalmente sovracampionati per migliorare la potenza statistica nelle analisi stratificate dal fumo. Abbiamo selezionato in modo casuale i controlli per ogni caso da set di rischio di pazienti vivi e liberi da cancro al momento della diagnosi del loro caso indice (corrispondenza della densità di incidenza). I casi e i controlli sono stati abbinati individualmente per coorte, sesso (maschile o femminile), età (inizialmente ±1 anno, rilassato a ±3 anni), gruppo etnico (solo coorti statunitensi), data del prelievo di sangue (inizialmente ±1 mese, rilassato a ±3 mesi) e numero di cicli di congelamento/disgelo del loro campione di sangue (0 o 1). Abbiamo inoltre abbinato i casi e i controlli in base allo stato di fumo in cinque categorie: mai fumatori, fumatori di breve e lunga durata tra gli ex-fumatori (<10 anni, ≥10 anni da quando hanno smesso), e fumatori leggeri e pesanti tra i fumatori attuali (<15 sigarette al giorno, ≥15 sigarette al giorno). Le nostre covariate del fumo (stato del fumo, durata del fumo e intensità del fumo) comprendono l’uso di tabacco da sigarette, sigari e pipe. Per convenzione, ci riferiamo all’intensità del fumo come sigarette al giorno, anche se le sigarette al giorno variabili nell’analisi attuale includono anche informazioni su sigari e pipe. Dopo le analisi di corrispondenza e biochimiche, nell’analisi attuale abbiamo utilizzato un totale di 5299 coppie di controllo caso per caso, comprese 2496 coppie di fumatori attuali, 1498 coppie di ex fumatori e 1305 coppie di non fumatori.
Analisi biochimiche
Analisi biochimiche centralizzate di siero o plasma hsCRP e di siero o plasma cotinina sono state eseguite presso il Laboratorio BEVITAL di Bergen, Norvegia. La quantificazione del siero o plasma hsCRP è stata condotta utilizzando Immuno-MALDI-MS.12 Per hsCRP, il limite inferiore di rilevazione era di 0,1 μg/mL, il coefficiente di variazione entro il giorno era del 3% al 6%, e il coefficiente di variazione tra i giorni era del 3% al 7%. La quantificazione del siero o della cotinina plasmatica è stata effettuata mediante cromatografia liquida – spettrometria di massa (LC-MS/MS).13 Per la cotinina, il limite inferiore di rilevazione era di 1 nmol/L, il coefficiente di variazione entro il giorno era compreso tra il 2% e il 3% e il coefficiente di variazione tra un giorno e l’altro era del 6%. Il coefficiente di correlazione intraclasse della cotinina era 0,89-0,95,14
Analisi statistiche
Abbiamo usato la regressione logistica condizionale per calcolare i rapporti di probabilità e gli intervalli di confidenza del 95% per il cancro polmonare incidente per ogni quarto di concentrazione di hsCRP. Abbiamo anche analizzato la concentrazione di hsCRP come variabile di esposizione continua utilizzando il logaritmo di base 2 di hsCRP (ORlog2CRP). Le stime di ORlog2CRP possono essere interpretate come il rischio relativo associato ad un raddoppio della concentrazione di hsCRP. Le stime dei modelli di regressione logistica condizionale sono state condizionate su un set di casi abbinati e regolate per i quarti della concentrazione di cotinina circolante. I valori P sono stati ricavati da test di likelihood ratio dei termini hsCRP.
Oltre al controllo dell’esposizione al fumo di tabacco tramite il design dello studio abbinato, abbiamo ulteriormente regolato i modelli per la concentrazione di cotinina circolante (in quarti). Tutte le analisi del rischio sono state condotte nel complesso, e stratificate in base allo stato del fumo (mai, prima e attuale, per avere una dimensione del campione sufficiente in ogni gruppo per le stime stratificate), e regione (Asia, Europa e Australia (combinate per garantire una dimensione del campione sufficiente), e gli Stati Uniti). Ulteriori analisi di rischio stratificate sono state condotte in base a variabili sociodemografiche e cliniche, tra cui: sesso, età alla linea di base (anni), indice di massa corporea (kg/m2) e tempo dal prelievo di sangue alla diagnosi (anni). Abbiamo anche stratificato per sottotipo istologico (cellula grande, cellula piccola, cellula squamosa, adenocarcinoma, altro, e sconosciuto o mancante). L’eterogeneità di queste stime stratificate è stata valutata utilizzando il test del likelihood ratio dei termini di interazione tra hsCRP e ogni covariata.
Per valutare se la concentrazione di hsCRP in circolazione combinata con le informazioni sul fumo autosommerso (modello CRP) potrebbe migliorare la discriminazione tra gli attuali fumatori ad alto e basso rischio di cancro ai polmoni rispetto alle sole informazioni sul fumo autosommerso (modello di base), abbiamo calcolato l’area sotto la curva caratteristica operativa del ricevitore (AUC) per ogni modello. I modelli di fumo autodichiarati comprendevano lo stato di fumo, il numero di sigarette, sigari e pipe al giorno e la durata del fumo (il numero di anni in cui il partecipante ha fumato regolarmente sigarette, pipe o sigari). Sia i sigari che la pipa al giorno e la durata del fumo sono stati modellati con l’utilizzo di spline cubiche ristrette con 3 gradi di libertà. Questi modelli sono stati adattati ai dati dei fumatori attuali. Abbiamo inoltre applicato questi modelli limitando l’analisi ai casi diagnosticati nei primi due anni di follow-up e ai controlli corrispondenti (dal prelievo di sangue alla diagnosi di due anni o meno).
Tutte le analisi statistiche sono state condotte utilizzando la versione R 3.4.2.15
Coinvolgimento del paziente e del pubblico
Nessun paziente è stato coinvolto nella definizione della domanda di ricerca o delle misure di esito, né è stato coinvolto nello sviluppo di piani per il reclutamento, la progettazione o la realizzazione dello studio. A nessun paziente è stato chiesto di dare consigli sull’interpretazione o di scrivere i risultati.
Risultati
Latabella 1 mostra che il nostro campione di studio comprendeva 5299 casi di tumore polmonare incidente e 5299 controlli abbinati individualmente. Nel complesso, un numero leggermente superiore di partecipanti è stato di sesso maschile (54%). Anche i partecipanti provenienti da coorti in Asia, Europa e Australia erano prevalentemente di sesso maschile (69% e 58%, rispettivamente). Gli attuali fumatori hanno rappresentato quasi la metà del campione complessivo dello studio (47%, 2496 coppie di controllo caso per caso), con ex fumatori e mai fumatori che hanno contribuito per circa un quarto ciascuno (ex 28%, 1498 coppie di controllo caso per caso; mai il 25%, 1305 coppie di controllo caso per caso). L’età media al momento del reclutamento della coorte era di 60 anni(tabella 1). I casi e i controlli avevano caratteristiche simili, in media, ad eccezione dell’indice di massa corporea, per il quale una percentuale minore di casi aveva un indice di massa corporea superiore a 25 kg/m2. La cotinina circolante ha mostrato una notevole variabilità tra gli attuali fumatori auto segnalati, mentre la maggior parte dei mai fumatori e degli ex fumatori non aveva concentrazioni di cotinina rilevabili (materiali supplementari, fig. 1).
| Caratteristica | Complessivamente | Asia | Europa e Australia | US | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Controllo | Caso | Controllo | Caso | Controllo | Caso | Controllo | Caso | |||||
| Totale | 5299 (100) | 5299 (100) | 1757 (100) | 1757 (100) | 1159 (100) | 1159 (100) | 2383 (100) | 2383 (100) | ||||
| Sesso: | ||||||||||||
| Uomini | 2873 (54) | 2873 (54) | 1218 (69) | 1218 (69) | 671 (58) | 671 (58) | 984 (41) | 984 (41) | ||||
| Le donne | 2426 (46) | 2426 (46) | 539 (31) | 539 (31) | 488 (42) | 488 (42) | 1399 (59) | 1399 (59) | ||||
| Stato del fumo: | ||||||||||||
| Mai | 1305 (25) | 1305 (25) | 592 (34) | 592 (34) | 147 (13) | 147 (13) | 566 (24) | 566 (24) | ||||
| Esordiente | 1498 (28) | 1498 (28) | 175 (10) | 175 (10) | 325 (28) | 325 (28) | 998 (42) | 998 (42) | ||||
| Corrente | 2496 (47) | 2496 (47) | 990 (56) | 990 (56) | 687 (59) | 687 (59) | 819 (34) | 819 (34) | ||||
| Età (anni) alla linea di base: | ||||||||||||
| 17-54 | 1539 (29) | 1519 (29) | 432 (25) | 428 (24) | 331 (29) | 334 (29) | 776 (33) | 757 (32) | ||||
| 55-59 | 997 (19) | 991 (19) | 377 (21) | 365 (21) | 251 (22) | 251 (22) | 369 (15) | 375 (16) | ||||
| 60-64 | 1238 (23) | 1256 (24) | 436 (25) | 464 (26) | 336 (29) | 327 (28) | 466 (20) | 465 (20) | ||||
| 65-86 | 1525 (29) | 1533 (29) | 512 (29) | 500 (28) | 241 (21) | 247 (21) | 772 (32) | 786 (33) | ||||
| Educazione: | ||||||||||||
| Meno del liceo | 1670 (32) | 1773 (33) | 877 (50) | 893 (51) | 578 (50) | 643 (55) | 215 (9) | 237 (10) | ||||
| Liceo completato | 774 (15) | 753 (14) | 228 (13) | 242 (14) | 175 (15) | 155 (13) | 371 (16) | 356 (15) | ||||
| Scuola professionale | 904 (17) | 878 (17) | 274 (16) | 285 (16) | 198 (17) | 177 (15) | 432 (18) | 416 (17) | ||||
| Qualche college | 707 (13) | 670 (13) | 192 (11) | 168 (10) | 127 (11) | 105 (9) | 388 (16) | 397 (17) | ||||
| Diplomato | 492 (9) | 518 (10) | 113 (6) | 102 (6) | 63 (5) | 61 (5) | 316 (13) | 355 (15) | ||||
| Studi universitari | 707 (13) | 640 (12) | 64 (4) | 59 (3) | 8 (1) | 10 (1) | 635 (27) | 571 (24) | ||||
| Mancanza | 45 (1) | 67 (1) | 9 (1) | 8 (0) | 10 (1) | 8 (1) | 26 (1) | 51 (2) | ||||
| Indice di massa corporea (kg/m2): | ||||||||||||
| 14.1-24.9 | 2769 (52) | 2973 (56) | 1291 (73) | 1347 (77) | 434 (37) | 519 (45) | 1044 (44) | 1107 (46) | ||||
| 25.0-29.9 | 1795 (34) | 1658 (31) | 420 (24) | 364 (21) | 524 (45) | 457 (39) | 851 (36) | 837 (35) | ||||
| 30.0-59.5 | 673 (13) | 604 (11) | 46 (3) | 46 (3) | 199 (17) | 182 (16) | 428 (18) | 376 (16) | ||||
| Mancanza | 62 (1) | 64 (1) | 0 (0) | 0 (0) | 2 (0) | 1 (0) | 60 (3) | 63 (3) | ||||
| hsCRP (µg/mL): | ||||||||||||
| 0.00388-0.731 | 1325 (25) | 1180 (22) | 610 (35) | 540 (31) | 275 (24) | 243 (21) | 440 (18) | 397 (17) | ||||
| 0.732-1.76 | 1320 (25) | 1242 (23) | 468 (27) | 455 (26) | 312 (27) | 280 (24) | 540 (23) | 507 (21) | ||||
| 1.77-4.13 | 1326 (25) | 1384 (26) | 372 (21) | 390 (22) | 304 (26) | 314 (27) | 650 (27) | 680 (29) | ||||
| 4.14-87.9 | 1328 (25) | 1493 (28) | 307 (17) | 372 (21) | 268 (23) | 322 (28) | 753 (32) | 799 (34) | ||||
Latabella 2 mostra che il tempo mediano tra il prelievo di sangue e la diagnosi di cancro ai polmoni per i casi è stato di 6,8 anni. La Tabella 2 mostra che la maggior parte dei casi di cancro ai polmoni, in generale e per regione, sono stati diagnosticati con adenocarcinoma, seguito da carcinomi a cellule squamose, a piccole cellule e a grandi cellule. Complessivamente, il 38% dei tumori nel campione erano adenocarcinomi (il 43% dei tumori diagnosticati negli Stati Uniti, contro il 35% per l’Asia e il 34% per l’Europa e l’Australia).
| Caratteristiche | Complessivamente | Asia | Europa e Australia | US |
|---|---|---|---|---|
| Tempo (anni) dal prelievo di sangue alla diagnosi: | ||||
| 0.0-1.9 | 583 (11) | 257 (15) | 82 (7) | 244 (10) |
| 2.0-4.9 | 1325 (25) | 463 (26) | 134 (12) | 728 (31) |
| 5.0-9.9 | 1631 (31) | 613 (35) | 362 (31) | 656 (28) |
| 10.0-35.6 | 1577 (30) | 424 (24) | 581 (50) | 572 (24) |
| Istologia: | ||||
| Grande cella | 173 (3) | 16 (1) | 46 (4) | 111 (5) |
| Cella piccola | 484 (9) | 98 (6) | 146 (13) | 240 (10) |
| Cella squamosa | 831 (16) | 319 (18) | 226 (19) | 286 (12) |
| Adenocarcinoma | 2030 (38) | 608 (35) | 398 (34) | 1024 (43) |
| Altro | 595 (11) | 124 (7) | 178 (15) | 293 (12) |
| Sconosciuto o mancante | 1186 (22) | 592 (34) | 165 (14) | 429 (18) |
Latabella 3 mostra che una maggiore concentrazione di hsCRP è stata associata positivamente al rischio complessivo di cancro ai polmoni (odds ratio 1,05, intervallo di confidenza del 95% da 1,03 a 1,08, P< 0,001 per il trend). Le associazioni tra la concentrazione di hsCRP e il rischio di cancro ai polmoni erano leggermente più forti nei modelli senza aggiustamento per la cotinina circolante (materiali supplementari, tabella 1). La figura 1 mostra che l’associazione era più evidente per gli attuali (odds ratio 1,09, intervallo di confidenza del 95% 1,05 a 1,13) e per gli ex fumatori (1,09, 1,04 a 1,14). Non abbiamo osservato un’associazione positiva per i non fumatori (0,95, 0,91 a 1,00; fig. 1). La figura 1 mostra che l’associazione positiva tra la concentrazione di hsCRP e il rischio di cancro ai polmoni era più forte per i pazienti che sono stati diagnosticati nei primi due anni di follow-up (odds ratio 1,21, intervallo di confidenza del 95% da 1,13 a 1,29, P< 0,01 per l’interazione). C’erano anche alcune indicazioni che l’associazione era più forte per i partecipanti del gruppo di istruzione inferiore a quella delle scuole superiori, anche se c’erano poche prove statistiche di eterogeneità, e questo è probabilmente dovuto alla maggiore proporzione di fumatori attuali in questo gruppo (materiali supplementari, tabella 2).
| hsCRP concentrazione | No dei controlli | N. di casi | Quoziente di probabilità (95% CI) | Valore P |
|---|---|---|---|---|
| Categorico (μg/mL): | ||||
| 0.00388-0.731 | 1325 | 1180 | 1,00 (rif) | <0.001 |
| 0.732-1.76 | 1320 | 1242 | 1,05 (da 0,93 a 1,17) | |
| 1.77-4.13 | 1326 | 1384 | 1,17 (1,04 a 1,31) | |
| 4.14-87.9 | 1328 | 1493 | 1,26 (1,12 a 1,41) | |
| Continuo: | ||||
| Raddoppio della concentrazione | 5299 | 5299 | 1,05 (dall’1.03 all’1.08) | <0.001 |
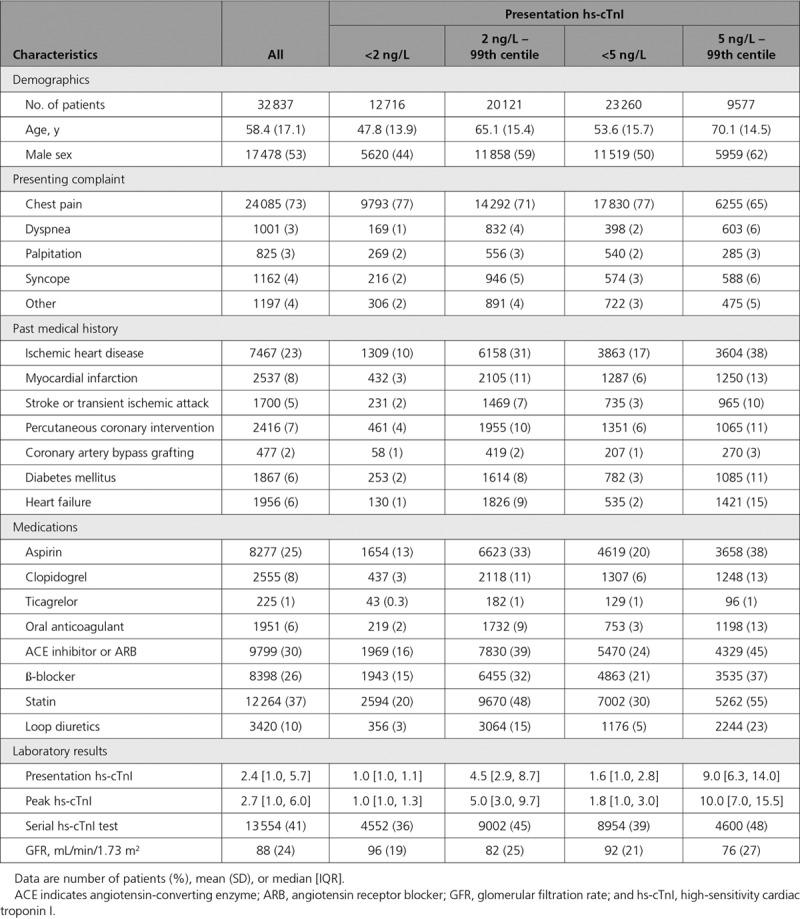
Fig. 1.Rapporti di probabilità per il raddoppio della concentrazione di proteina reattiva C ad alta sensibilità (hsCRP), nel complesso e per caratteristiche dei partecipanti. I valori di P sono da test di likelihood ratio dell’interazione tra hsCRP e ogni covariata
Ulteriori analisi di rischio stratificate hanno mostrato che l’associazione tra la concentrazione di hsCRP e il rischio di cancro ai polmoni differisce per sottotipo istologico (P<0.01 per l’interazione per il rischio complessivo di cancro ai polmoni, fig 1; P=0.15 per l’interazione per gli attuali fumatori, fig 2; e P<0.01 per gli ex fumatori, fig 3) . Per esempio, sebbene abbiamo osservato una forte e coerente associazione tra la concentrazione di hsCRP e il rischio di cancro ai polmoni a cellule squamose tra gli attuali (odds ratio 1,16, intervallo di confidenza del 95% da 1,08 a 1,24, fig 2) e gli ex fumatori (1,15, da 1,02 a 1,28, fig 3), non è stata osservata alcuna associazione corrispondente per l’adenocarcinoma tra gli attuali (1,03, da 0,96 a 1,10, fig 2) e gli ex (0,98, da 0,91 a 1,05, fig 3) fumatori.
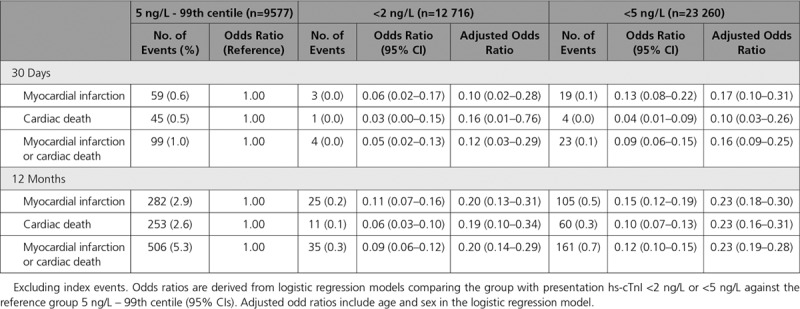
Fig 2.Rapporti di probabilità per il raddoppio della concentrazione di proteina reattiva C ad alta sensibilità (hsCRP) per i fumatori attuali in base alle caratteristiche dei partecipanti. I valori P sono ricavati da test di likelihood ratio dell’interazione tra hsCRP e ciascuna covariata

Fig. 3.Rapporti di probabilità per il raddoppio della concentrazione di proteina reattiva C ad alta sensibilità (hsCRP) per gli ex fumatori in base alle caratteristiche dei partecipanti. I valori di P sono ricavati da test di likelihood ratio dell’interazione tra hsCRP e ogni covariata
Lafigura 4A mostra che per gli attuali fumatori in generale, la combinazione della concentrazione di hsCRP e delle informazioni sul fumo autodenunciato in un modello integrato (modello CRP) non ha migliorato le prestazioni discriminanti rispetto al modello di base, che comprendeva solo le variabili del fumo autodenunciato (modello AUCCRP 0,68, intervallo di confidenza del 95% da 0,66 a 0,69;modello AUCBase 0,67, intervallo di confidenza del 95% da 0,66 a 0,69). La figura 4B mostra che per gli attuali fumatori con un tempo dal prelievo di sangue alla diagnosi di due anni o meno, il modello CRP ha fornito ulteriori informazioni discriminanti sul rischio (modello AUCCRP 0,80, intervallo di confidenza del 95% da 0,76 a 0,84) rispetto al solo fumo autodenunciato (modello AUCBase 0,76, intervallo di confidenza del 95% da 0,72 a 0,81).

Fig. 4.Fumatori attuali A in generale (n=2199 coppie di controllo del caso) e B con tempo dal prelievo di sangue alla diagnosi ≤2 anni (n=224 coppie di controllo del caso)

Fig. 1.Rapporti di probabilità per il raddoppio della concentrazione di proteina reattiva C ad alta sensibilità (hsCRP), nel complesso e per caratteristiche dei partecipanti. I valori di P sono da test di likelihood ratio dell’interazione tra hsCRP e ogni covariata

Fig. 2.Rapporti di probabilità per il raddoppio della concentrazione di proteina reattiva C ad alta sensibilità (hsCRP) per gli attuali fumatori in base alle caratteristiche dei partecipanti. I valori di P sono ricavati da test di likelihood ratio dell’interazione tra hsCRP e ogni covariata

Fig. 3.Rapporti di probabilità per il raddoppio della concentrazione di proteina reattiva C ad alta sensibilità (hsCRP) per gli ex fumatori in base alle caratteristiche dei partecipanti. I valori di P sono ricavati da test di likelihood ratio dell’interazione tra hsCRP e ogni covariata

Fig. 4.Fumatori attuali A in generale (n=2199 coppie di controllo del caso) e B con tempo dal prelievo di sangue alla diagnosi ≤2 anni (n=224 coppie di controllo del caso)
Discussione
Abbiamo condotto un’analisi completa della relazione tra la concentrazione di hsCRP in circolazione e il rischio di cancro ai polmoni utilizzando campioni prediagnostici di 20 coorti potenziali nel Consorzio della Coorte del Cancro al Polmone. I fumatori precedenti e attuali con concentrazioni di hsCRP più elevate avevano un rischio maggiore per alcuni sottotipi istologici di cancro al polmone, ma non per l’adenocarcinoma. Abbiamo osservato una sostanziale associazione tra la concentrazione di hsCRP e il rischio di cancro ai polmoni nei primi due anni di follow-up.
Interpretazione e implicazioni
L’infiammazione cronica non risolta può generare specie reattive dell’ossigeno e specie reattive dell’azoto che promuovono la crescita del tumore attraverso l’angiogenesi e la proliferazione cellulare.16 Data la nostra scoperta di una debole e incoerente associazione tra la concentrazione di hsCRP e il rischio di cancro ai polmoni a lungo termine (>2 anni dopo il prelievo di sangue), l’infiammazione sistemica non sembra essere una probabile causa di cancro ai polmoni allo stadio iniziale, o la concentrazione di hsCRP potrebbe non catturare il rischio, o entrambi. A sua volta, il ruolo eziologico dell’infiammazione nello sviluppo della carcinogenesi polmonare rimane dibattuto.17
18
Poiché l’infiammazione cronica potrebbe insorgere a causa di una risposta immunitaria all’esposizione al fumo ditabacco19 , e considerando la mancanza di associazione che abbiamo osservato per i non fumatori, la confusione residua dovuta all’esposizione al fumo potrebbe spiegare alcune delle associazioni che abbiamo osservato per il periodo superiore a due anni dal prelievo di sangue. Questa interpretazione sarebbe anche in linea con la nostra osservazione di una maggiore concentrazione di hsCRP associata ai sottotipi istologici più fortemente associati al fumo di tabacco, in contrasto con la mancanza di associazione che abbiamo osservato per l’adenocarcinoma. I sottotipi istologici che sono fortemente guidati dall’esposizione al fumo di tabacco saranno più suscettibili di confusione residua da fumo rispetto all’adenocarcinoma, per il quale l’aumento del rischio da fumo è minore.20
Nell’analisi stratificata per tempo dal prelievo di sangue, abbiamo osservato una più forte associazione positiva tra la concentrazione di hsCRP e il rischio di cancro ai polmoni nei primi due anni di follow-up, in particolare per i fumatori attuali. Questo risultato suggerisce che concentrazioni più elevate di hsCRP potrebbero essere indicative della presenza di stato di malattia preclinico, invece di essere un fattore di rischio causale per il cancro ai polmoni. Se la concentrazione di hsCRP è indicativa di uno stato di malattia preclinica, è naturale considerarla come un’aggiunta ai fattori di rischio basati sul fumo per l’ammissibilità allo screening. La nostra analisi della discriminazione del rischio – in cui non abbiamo trovato alcun miglioramento nella discriminazione in generale e un piccolo miglioramento per le diagnosi nei primi due anni di follow-up – suggerisce che la concentrazione di hsCRP da sola non è in grado di migliorare la selezione dei pazienti per lo screening del cancro ai polmoni. Inoltre, data la mancanza di associazione tra la concentrazione di hsCRP e il rischio di adenocarcinoma polmonare, non sarebbe opportuno utilizzare i test clinici CRP per escludere la presenza di tumore polmonare durante il work-up diagnostico dei pazienti sintomatici.
Punti di forza e di debolezza
Questo studio ha diversi punti di forza, tra cui l’uso di saggi prediagnostici di hsCRP da una vasta e diversificata popolazione di studio di coppie di controllo caso-controllo individualmente abbinate all’interno di 20 potenziali coorti provenienti da diverse regioni del mondo. L’ampio campione dello studio ha permesso di effettuare robuste analisi del rischio in tutte le categorie di fumatori, e siamo stati inoltre in grado di adeguarci alle concentrazioni di cotinina in circolazione, una misura obiettiva della recente esposizione al tabacco. Mai e gli ex fumatori sono stati sottoposti a sovracampionamento, consentendo di effettuare analisi del rischio ben calibrate sul fumo. Le nostre 1305 coppie di casi di controllo mai fumatori fanno di questo studio il più grande studio prospettico di biomarcatori di rischio per il cancro ai polmoni nei non fumatori. Questi pazienti che non sono mai stati fumatori rappresentano un sottogruppo sempre più importante che gli studi precedenti non sono stati in grado di valutare.6
21
22
Il nostro studio è stato limitato dall’uso di misurazioni hsCRP da un punto temporale per ogni paziente. I singoli campioni ripetuti sarebbero stati particolarmente utili per una migliore valutazione delle concentrazioni di hsCRP in circolazione negli anni precedenti la diagnosi di cancro ai polmoni.
Conclusioni
I fumatori precedenti e attuali con concentrazioni di hsCRP più elevate avevano un rischio maggiore di alcuni sottotipi istologici di cancro ai polmoni, ma non di adenocarcinoma. Abbiamo osservato una più forte associazione tra una maggiore concentrazione di hsCRP e il rischio di cancro ai polmoni nei primi due anni di follow-up, indicando che le concentrazioni di hsCRP in circolazione potrebbero riflettere uno stato di malattia prediagnostico rispetto ad un rischio causale di cancro ai polmoni.
Ciò che è già noto su questo argomento
- Studi precedenti hanno dimostrato che la proteina C reattiva (CRP), un marcatore di infiammazione sistemica, è associata al rischio di cancro ai polmoni.
- Gli studi non sono stati sufficientemente ampi da fornire stime precise sull’associazione per stato di fumo (mai, ex fumatori o fumatori attuali)
Cosa aggiunge questo studio
- La concentrazione di CRP ad alta sensibilità (hsCRP) è associata al rischio di cancro ai polmoni nei fumatori precedenti e attuali, ma non in quelli che non hanno mai fumato.
- L’associazione è più forte nei primi due anni dopo il prelievo di sangue
- la concentrazione di hsCRP non è associata al rischio di adenocarcinoma polmonare
References
- World Cancer Report 2014.. International Agency for Research on Cacner; 2014.
- Publisher Full Text
- Munn LL. Cancer and inflammation. Wiley Interdiscip Rev Syst Biol Med. 2017; 9:e1370. DOI | PubMed
- Kushner I, Rzewnicki D, Samols D. What does minor elevation of C-reactive protein signify. Am J Med. 2006; 119:166.e17-28.
- Leuzzi G, Galeone C, Gisabella M. Baseline C-reactive protein level predicts survival of early-stage lung cancer: evidence from a systematic review and meta-analysis. Tumori. 2016; 102:441-9. DOI | PubMed
- Shiels MS, Katki HA, Hildesheim A. Circulating Inflammation Markers, Risk of Lung Cancer, and Utility for Risk Stratification. J Natl Cancer Inst. 2015; 107:djv199. DOI | PubMed
- Shiels MS, Shu XO, Chaturvedi AK. A prospective study of immune and inflammation markers and risk of lung cancer among female never smokers in Shanghai. Carcinogenesis. 2017; 38:1004-10. DOI | PubMed
- Takemura Y, Ishida H, Inoue Y. Utilization of common inflammatory markers in new, symptomatic, primary care outpatients based on their cost-effectiveness. Clin Chem Lab Med. 2003; 41:668-74. DOI | PubMed
- Brouwer N, van Pelt J. Validation and evaluation of eight commercially available point of care CRP methods. Clin Chim Acta. 2015; 439:195-201. DOI | PubMed
- Rebnord IK, Hunskaar S, Gjesdal S, Hetlevik Ø. Point-of-care testing with CRP in primary care: a registry-based observational study from Norway. BMC Fam Pract. 2015; 16:170. DOI | PubMed
- Fanidi A. Circulating Folate, Vitamin B6 and Methionine in relation to Lung Cancer Risk in the Lung Cancer Cohort Consortium (LC3). J Natl Cancer Inst. 2017. PubMed
- Meyer K, Ueland PM. Targeted quantification of C-reactive protein and cystatin c and its variants by immuno-MALDI-MS. Anal Chem. 2014; 86:5807-14. DOI | PubMed
- Midttun Ø, Hustad S, Ueland PM. Quantitative profiling of biomarkers related to B-vitamin status, tryptophan metabolism and inflammation in human plasma by liquid chromatography/tandem mass spectrometry. Rapid Commun Mass Spectrom. 2009; 23:1371-9. DOI | PubMed
- Midttun O, Townsend MK, Nygård O. Most blood biomarkers related to vitamin status, one-carbon metabolism, and the kynurenine pathway show adequate preanalytical stability and within-person reproducibility to allow assessment of exposure or nutritional status in healthy women and cardiovascular patients. J Nutr. 2014; 144:784-90. DOI | PubMed
- R Core Team. R: A language and environment for statistical computing.. Foundation for Statistical Computing; 2017.
- Beatty PL, Cascio S, Finn OJ. Biomarkers in Cancer Screening and Early Detection.. John Wiley & Sons, Ltd; 2017. DOI
- Crusz SM, Balkwill FR. Inflammation and cancer: advances and new agents. Nat Rev Clin Oncol. 2015; 12:584-96. DOI | PubMed
- Kundu JK, Surh YJ. Inflammation: gearing the journey to cancer. Mutat Res. 2008; 659:15-30. DOI | PubMed
- Shiels MS, Katki HA, Freedman ND. Cigarette smoking and variations in systemic immune and inflammation markers. J Natl Cancer Inst. 2014; 106:dju294. DOI | PubMed
- Lin KF, Wu HF, Huang WC, Tang PL, Wu MT, Wu FZ. Propensity score analysis of lung cancer risk in a population with high prevalence of non-smoking related lung cancer. BMC Pulm Med. 2017; 17:120. DOI | PubMed
- Shiels MS, Pfeiffer RM, Hildesheim A. Circulating inflammation markers and prospective risk for lung cancer. J Natl Cancer Inst. 2013; 105:1871-80. DOI | PubMed
- Pine SR, Mechanic LE, Enewold L. Increased levels of circulating interleukin 6, interleukin 8, C-reactive protein, and risk of lung cancer. J Natl Cancer Inst. 2011; 103:1112-22. DOI | PubMed
Fonte
Muller DC, Larose TL, Hodge A, Guida F, Langhammer A, et al. (2019) Circulating high sensitivity C reactive protein concentrations and risk of lung cancer: nested case-control study within Lung Cancer Cohort Consortium. The BMJ 364k4981. https://doi.org/10.1136/bmj.k4981





