Introduzione
Studi randomizzati hanno dimostrato che lo screening cervicale per il papillomavirus umano ad alto rischio (hrHPV) raggiunge una maggiore sensibilità rispetto alla citologia nel rilevamento della neoplasia cervicale intraepiteliale e una maggiore protezione contro il cancro cervicale.12345Grazie alla maggiore sensibilità, gli intervalli di screening possono essere estesi in modo sicuro.56 Tuttavia, l’analisi dell’hrHPV ha ridotto la specificità rispetto alla citologia, a causa dell’elevata prevalenza dell’hrHPV.7 L’eccessivo rinvio per una colposcopia può essere mitigato dallo smistamento dei risultati positivi del test hrHPV utilizzando la citologia basata su liquido riflesso. La maggior parte delle donne che sono positive all’hrHPV e che si sottopongono a citologia riflessa avranno un risultato normale (citologia negativa), tuttavia, questo gruppo di donne rimane ad alto rischio sia a causa di una malattia sottostante non rilevata dalla citologia, sia a causa di un aumento del rischio di malattia incidente.58 Le strategie alternative per la gestione di questo gruppo sono o il rinvio per una colposcopia per le donne che sono a maggior rischio di malattia sottostante in virtù del fatto di essere un papillomavirus umano di genotipo 16/18 positivo, o il rinvio di una colposcopia che anticipa l’evidenza della clearance dell’infezione da hrHPV (che si verificherà in circa il 40% entro 12 mesi)9 , permettendo così a queste donne di essere riportate in modo sicuro al richiamo di routine.
Il National Screening Committee del Regno Unito ha raccomandato il passaggio allo screening primario dell’hrHPV nel gennaio 2016. Il NHS England e la Public Health England stanno ora lavorando per un’introduzione a livello nazionale entro la fine del 2019. A sostegno dell’introduzione prevista, nel 2013 è stato istituito un progetto pilota che coinvolge un gruppo di laboratori di screening del Programma di screening cervicale dell’NHS in Inghilterra.1011 La conversione all’hrHPV primario è stata parziale, il che ha permesso di effettuare un confronto con la citologia primaria basata su liquidi contemporanea. Ciò ha riconosciuto l’importanza di implementare lo screening dell’hrHPV primario in modo controllato, consentendo la valutazione di un protocollo rispetto alla praticabilità, all’accettabilità e al rapporto costo-efficacia. Il valore del pilota in termini di apprendimento è stato ulteriormente valorizzato da una variazione del protocollo prespecificata, in vista di un’introduzione a livello nazionale.
In questo caso, abbiamo studiato il referral di base per una colposcopia e l’entità di ulteriori referral di colposcopia come risultato del richiamo precoce di donne che erano hrHPV positive e citologiche negative; l’aderenza al richiamo precoce; la sensibilità del test hrHPV nel round di prevalenza e l’incidenza di neoplasia cervicale intraepiteliale di alto grado tra le donne che erano hrHPV negative a tre anni.
Metodi
Sei laboratori del NHS si sono parzialmente convertiti ai test primari di hrHPV tra maggio e agosto 2013. Questi laboratori di Bristol, Liverpool, Manchester, Norwich, Northwick Park (West London) e Sheffield rappresentano circa il 13% del programma di screening cervicale. La conversione, che ha coinvolto circa un terzo dei campioni di screening, era basata sulla popolazione. La distribuzione dei test primari di hrHPV si basava su cluster di pratiche generali e non era soggetta ad un’assegnazione casuale. Piuttosto, l’assegnazione ai test per la citologia basata su liquidi o per l’hrHPV era una conseguenza di considerazioni pratiche come il mantenimento di un protocollo di gestione per ogni unità di colposcopia, per cui le unità di colposcopia spesso servono cluster amministrativi definiti. I campioni provenienti da donne che sono stati sottoposti a screening dopo un invito di routine sono stati raccolti in cure primarie in mezzi citologici a base liquida ThinPrep (Hologic, Marlborough, MA) o SurePath (Beckton Dickinson, Sparks, MD), indipendentemente dal fatto che la citologia a base liquida o hrHPV fosse il test di screening primario. Il test hrHPV è stato eseguito con i test Cobas 4800 (Roche, Rotkreuz, Svizzera, o Branchburg, NJ), RealTime (Abbott, Wiesbaden, Germania), APTIMA (Hologic, Manchester, Regno Unito), o, in misura limitata, Hybrid Capture 2 (Qiagen, Gaithersburg, MD). Ogni laboratorio ha utilizzato una combinazione unica di mezzo citologico a base liquida e di test hrHPV. Tutti i test di screening sono stati approvati per l’uso nel programma di screening cervicale inglese secondo i protocolli di validazione ufficiali.
Il pilota ha aderito alla fascia di età raccomandata a livello nazionale (25-64 anni) e agli intervalli di screening (tre anni per le donne di età inferiore a 50 anni e cinque anni dopo) per entrambi i test di screening. Nelle donne sottoposte a screening con il test hrHPV, la citologia non è stata accecata dal risultato del test hrHPV. Le donne sono state immediatamente indirizzate per una colposcopia se il loro test hrHPV era positivo e la citologia ha mostrato un qualsiasi grado di anomalia. Alle donne che erano positive all’hrHPV con citologia negativa è stato raccomandato un richiamo precoce a 12 mesi, a quel punto sono state indirizzate per una colposcopia se sono rimaste persistentemente positive all’hrHPV e se hanno sviluppato anomalie citologiche. Tre laboratori hanno indirizzato le donne con citologia negativa persistente a 12 mesi se i loro campioni mostravano un’infezione persistente da HPV 16/18. Ad altre donne che erano hrHPV positive e citologiche negative è stato offerto un ulteriore richiamo precoce a 24 mesi, e sono stati inviati per una colposcopia se hanno mostrato un’infezione persistente hrHPV indipendentemente dalla loro citologia. Le donne sottoposte a citologia sono state raccomandate per una colposcopia se la loro citologia mostrava anomalie di alto grado coerenti con lesioni squamose intraepiteliali di alto grado nella terminologia di Bethesda 2001 o anomalie di basso grado coerenti con cellule squamose atipiche di significato indeterminato (ASCUS) o con lesioni squamose intraepiteliali di basso grado combinate con un test di riflesso positivo per hrHPV. Le anomalie ghiandolari citologiche sono state classificate tra le lesioni squamose intraepiteliali squamose di alto grado. Le donne non riferite alla colposcopia o al richiamo precoce sono state regolarmente richiamate a tre o cinque anni.
Lo screening è stato condotto in cure primarie, e la formazione in relazione allo screening basato su hrHPV è stata fornita. I laboratori monitoravano di routine la conformità con il richiamo per una colposcopia e c’era una rete di sicurezza per le donne che non partecipavano. La colposcopia è stata condotta secondo le linee guida della pratica clinica nazionale. Tutti i laboratori e le cliniche colposcopie hanno partecipato ai programmi nazionali di garanzia della qualità.
Fonti di dati e collegamento
Abbiamo recuperato le registrazioni per lo screening dei campioni prelevati dai medici generici e le informazioni sui referti associati per una colposcopia dai sistemi informativi dei laboratori pilota. I dati sono stati raccolti, elaborati e analizzati centralmente presso la Queen Mary University di Londra. Per il presente rapporto, i dati completi erano disponibili fino al 31 maggio 2017. Abbiamo collegato i test della stessa donna utilizzando i numeri unici del NHS inglese. Per il periodo che ha avuto inizio due anni prima del pilota, sono state raccolte la data del campione e la raccomandazione. Abbiamo escluso i campioni di indice che erano stati preceduti da un altro nei due anni precedenti, perché probabilmente non sono stati prelevati per lo screening primario. Abbiamo anche escluso i campioni di indice se il loro codice di gestione identificava il campione da prelevare come follow-up o al momento della colposcopia. Gli episodi sono iniziati con il primo test di screening (indice) e sono stati chiusi a seconda dell’esito di questo test e di eventuali test successivi (materiale supplementare). Se un test iniziale inadeguato (0,3% con test hrHPV e 2,3% con citologia a base liquida) è stato seguito da un test valido, abbiamo utilizzato il risultato di quest’ultimo per le analisi. Il primo episodio per ogni donna è stato considerato l’episodio di prevalenza rispetto all’inizio del pilota; gli episodi successivi sono stati episodi di incidenza.
Analisi statistica
Abbiamo incluso tutte le donne di età compresa tra i 24 e i 64 anni perché l’invito iniziale di screening viene inviato sei mesi prima che una donna compia 25 anni. Abbiamo basato le principali analisi sugli episodi di prevalenza iniziati entro il 31 dicembre 2014 per fornire dati cumulativi completi, compresi i risultati dei richiami precoci. Queste donne hanno avuto 29 mesi o più di follow-up nei dati disponibili. Un sottoinsieme di queste donne, quelle con campioni di screening elaborati in tre laboratori che hanno utilizzato la genotipizzazione del papillomavirus umano per la gestione delle donne al richiamo anticipato di 12 mesi, ha fornito dati di genotipizzazione del papillomavirus umano. Abbiamo incluso episodi di incidenza se le donne di età compresa tra i 24 e i 46 anni all’episodio di prevalenza erano state indirizzate al richiamo di routine in tre anni.
Abbiamo testato le differenze nella distribuzione delle caratteristiche del campione al test dell’indice del round di prevalenza con χ 2. Abbiamo definito un risultato positivo del test di screening come risultato con un risultato noto dello screening e del test di triage che richiedeva un’ulteriore gestione clinica secondo il protocollo raccomandato. Abbiamo calcolato i rapporti di probabilità e i loro intervalli di confidenza del 95% per le differenze tra hrHPV e lo screening citologico con regressione logistica, e regolato per l’età della donna, laboratorio di elaborazione, e decile di indice di deprivazione multipla. La robustezza dei risultati per i due risultati principali, il numero di colposcopie e la neoplasia cervicale intraepiteliale di grado 2 o peggio, è stata inoltre studiata applicando un test Mantel-Haenszel a 240 strati definiti dal laboratorio (sei siti), indice di deprivazione multipla (cinque quintili) e gruppo di età di cinque anni (otto gruppi: 24-29, 30-34, 35-39, 40-44, 45-49, 50-54, 55-59 e 60-64). Abbiamo basato l’indice di deprivazione multipla sul codice postale della donna al momento del suo campione di indice (materiale supplementare). Abbiamo escluso 9689 (1,6%) dal totale di 578-547 donne che sono entrate nel pilota fino al 31 dicembre 2014 per avere un codice postale sconosciuto.
Tutte le analisi statistiche e di gestione dei dati sono state effettuate con R versione 3.2.4 e Oracle SQL Developer versione 4.0.2.
Coinvolgimento del paziente e del pubblico
Né i pazienti né il pubblico sono stati coinvolti nella gestione di questo studio. Un’indagine parallela sulle conseguenze psicologiche del test hrHPV rispetto allo screening citologico a base liquida integrato nel pilota riporterà i risultati separatamente.12
Risultati
Round di screening di base (prevalenza) e conformità con il richiamo anticipato
Questo pilota in corso comprendeva 1.532.908 donne sottoposte a screening nel turno di prevalenza fino al 31 maggio 2017 (tabella supplementare 1). La distribuzione per età è stata: 297-843 (19%) erano di età compresa tra i 24 e i 29 anni, 850-88 (55%) 30-49, e 384977 (25%) 50-64. Di queste, 442-174 (29%) donne sono state sottoposte a screening con test hrHPV e 1 090-734 (71%) sono state sottoposte a citologia a base liquida. Il reclutamento complessivo tra i laboratori variava da 139-211 a 544-865, e 875-641 (57%) provenivano dalle aree più svantaggiate (decili 1-5 dell’indice di deprivazione multipla). La tabella 1 mostra che al 31 dicembre 2014 sono state esaminate 578-547 donne, con un’età e una distribuzione delle privazioni simile a quella dell’intero progetto pilota. Le donne sottoposte a screening con il test hrHPV avevano più probabilità di provenire da aree più ricche, ed erano marginalmente, ma statisticamente in modo significativo, più anziane (χ 2<0,0001). Inoltre, la percentuale di conversione allo screening con hrHPV variava a seconda del laboratorio (χ 2<0,0001).
| Caratteristica | hrHPV | LBC | Rapporto di probabilità per il test hrHPV v LBC (95% CI) | ||
|---|---|---|---|---|---|
| Non regolato | Aggiustato* | ||||
| Totale | 183 970 (100) | 394 577 (100) | NA | NA | |
| Età al momento dello screening (anni): | |||||
| 24-29 | 35 085 (19) | 75 847 (19) | NA | NA | |
| 30-49 | 105 365 (57) | 226 034 (57) | NA | NA | |
| 50-64 | 43 520 (24) | 92 696 (23) | NA | NA | |
| IMD decifra al vaglio: | |||||
| 1-5 (i più indigenti) | 93 001 (51) | 229 576 (58) | NA | NA | |
| 6-10 (meno poveri) | 90 969 (49) | 165 001 (42) | NA | NA | |
| Procedure (% schermate)† : | |||||
| Risultati dei test di screening positivi che richiedono ulteriori test | 23 331 (12.7)‡ | 15 121 (3.8)§ | 3,64 (3,57 a 3,72) | 3,90 (3,81 a 3,98) | |
| Rinvii immediati | 7724 (4.2) | 15 117 (3.8) | 1,10 (1,07 a 1,13) | 1,14 (da 1,11 a 1,17) | |
| ♪ Rinvii dopo ripetuti test ¶ | 5070 (2.8) | NR | NR | NR | |
| Totale rinvio** | 13 010 (7.1) | 18 205 (4.6) | 1,57 (1,54 a 1,61) | 1,61 (1,57 a 1,65) | |
| Totale colposcopie** | 12 559 (6.8) | 16 378 (4.2) | 1,69 (1,65 a 1,73) | 1,77 (1,73 a 1,82) | |
| Risultati istologici, dopo il rinvio immediato (% schermato)†¶ : | |||||
| CIN2+ | 3060 (1.7) | 5932 (1.5) | 1,11 (1,06 a 1,16) | 1,12 (1,07 a 1,17) | |
| ÇIN3+ | 1939 (1.1) | 3753 (1.0) | 1,11 (1,05 a 1,17) | 1,12 (1,06 a 1,19) | |
| Tumore del centro | 89 (0.1) | 167 (0.0) | 1,14 (0,88 a 1,48) | 1,14 (da 0,88 a 1,48) | |
| Risultati istologici che includono il rinvio immediato e il richiamo anticipato (% schermato)† † †††: | |||||
| biopsia normale | 6284 (3.4) | 7126 (1.8) | 1,92 (1,86 a 1,99) | 1,98 (1,91 a 2,05) | |
| CIN1 | 2039 (1.1) | 2780 (0.7) | 1,58 (1,49 a 1,67) | 1,71 (1,62 a 1,82) | |
| CIN2+ | 4156 (2.3) | 6113 (1.6) | 1,47 (1,41 a 1,53) | 1,49 (da 1,43 a 1,55) | |
| ÇIN3+ | 2521 (1.4) | 3833 (1.0) | 1,42 (1,35 a 1,49) | 1,44 (1,36 a 1,51) | |
| Tumore del centro | 101 (0.1) | 170 (0.0) | 1,27 (da 1,00 a 1,63) | 1,27 (da 0,99 a 1,63) | |
Le figure 1A e 1B mostrano, rispettivamente, il rilevamento per protocollo della neoplasia cervicale intraepiteliale lungo la via del protocollo, per l’hrHPV primario e la citologia primaria (i risultati dettagliati, compresi quelli al di fuori del protocollo, sono riportati nelle figure supplementari 1 e 2). La tabella 1 mostra che il test dell’hrHPV è risultato positivo nel 12,7% di tutte le donne sottoposte a screening; 28,0% sotto i 30 anni, 10,5% tra i 30 e i 49 anni e 5,6% tra i 50 e i 64 anni(tabella 2). La tabella 3 mostra che circa un terzo delle donne positive all’hrHPV era positivo all’HPV 16/18.
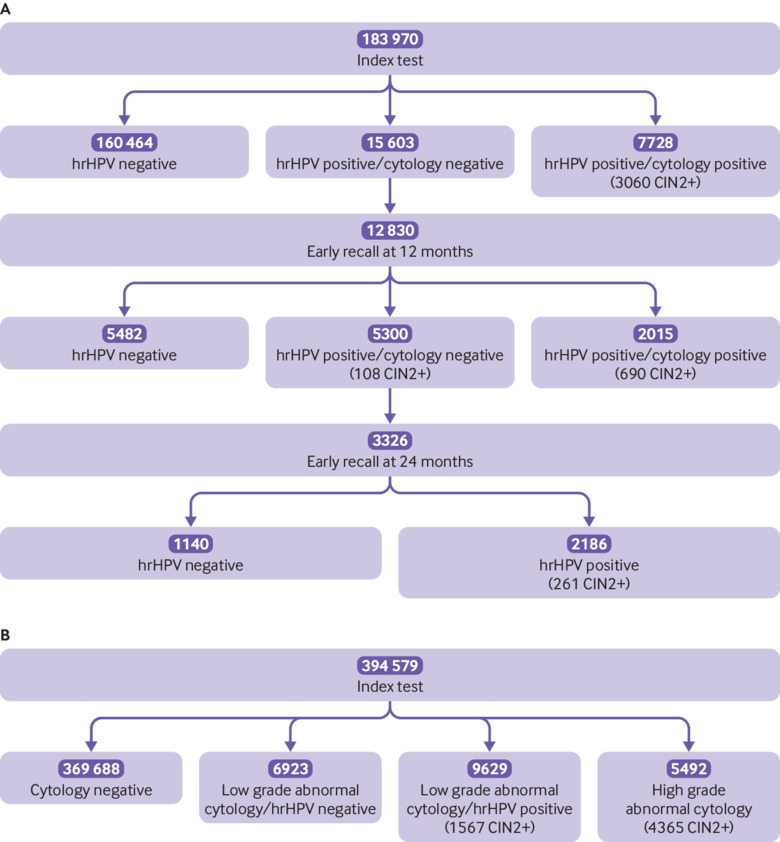
Fig. 1.Fig. 1. Diagramma di flusso per gli episodi di prevalenza iniziati entro il 31 dicembre 2014, inclusi i risultati del follow-up per protocollo fino al 31 maggio 2017 per le donne sottoposte a screening con papillomavirus umano ad alto rischio (hrHPV) (A) e citologia a base liquida (LBC) (B). CIN2+=neoplasia intraepiteliale cervicale di grado 2 o peggiore
| Risultato | Gruppo d’età (anni) | Totale | |||
|---|---|---|---|---|---|
| 24-29 | 30-49 | 50-64 | |||
| hrHPV (%) | |||||
| Numero | 35 085 (100) | 105 365 (100) | 43 520 (100) | 183 970 (100) | |
| Test di screening positivo | 9836 (28.0) | 11 047 (10.5) | 2448 (5.6) | 23 331 (12.7) | |
| Riferimento immediato per la colposcopia | 3795 (10.8) | 3340 (3.2) | 589 (1.4) | 7724 (4.2) | |
| Colposcopie | 5826 (16.6) | 5561 (5.3) | 1172 (2.7) | 12 559 (6.8) | |
| CIN2+ | 2299 (6.6) | 1638 (1.6) | 219 (0.5) | 4156 (2.3) | |
| CIN3+ | 1403 (4.0) | 1000 (0.9) | 118 (0.3) | 2521 (1.4) | |
| LBC (%) | |||||
| Numero | 75 847 (100) | 226 034 (100) | 92 696 (100) | 394 577 (100) | |
| Test di screening positivo | 7309 (9.6) | 6678 (3.0) | 1134 (1.2) | 15 121 (3.8) | |
| Riferimento immediato per la colposcopia | 7309 (9.6) | 6675 (3.0) | 1133 (1.2) | 15 117 (3.8) | |
| Colposcopie | 7606 (10.0) | 7436 (3.3) | 1336 (1.4) | 16 378 (4.2) | |
| CIN2+ | 3319 (4.4) | 2497 (1.1) | 297 (0.3) | 6113 (1.5) | |
| CIN3+ | 2103 (2.8) | 1555 (0.7) | 175 (0.2) | 3833 (1.0) | |
| Quota non corretta per hrHPV v LBC (95% CI) | |||||
| Test di screening positivo | 3,65 (da 3,53 a 3,78) | 3,85 (3,73 a 3,97) | 4,81 (da 4,48 a 5,17) | 3,64 (da 3,57 a 3,72) | |
| Riferimento immediato per la colposcopia | 1,14 (dall’1.09 all’1.19) | 1,08 (dall’1.03 all’1.12) | 1,11 (da 1,00 a 1,23) | 1,10 (1,07 a 1,13) | |
| Colposcopie | 1,79 (1,72 a 1,85) | 1,64 (1,58 a 1,70) | 1,89 (1,75 a 2,05) | 1,69 (1,65 a 1,73) | |
| CIN2+ | 1,53 (da 1,45 a 1,62) | 1,41 (da 1,33 a 1,51) | 1,57 (1,32 a 1,87) | 1,49 (da 1,43 a 1,55) | |
| CIN3+ | 1,46 (1,36 a 1,56) | 1,38 (1,28 a 1,50) | 1,44 (1,14 a 1,82) | 1,44 (1,36 a 1,51) | |
| Rapporto di probabilità corretto per hrHPV v LBC (95% CI) | |||||
| Test di screening positivo | 3,60 (da 3,48 a 3,73) | 4,02 (da 3,90 a 4,16) | 5,12 (da 4,76 a 5,51) | 3,90 (3,81 a 3,98) | |
| Riferimento immediato per la colposcopia | 1,13 (1,08 a 1,18) | 1,13 (dall’1.09 all’1.18) | 1,18 (dal 1,07 al 1,31) | 1,14 (da 1,11 a 1,17) | |
| Colposcopie | 1,77 (1,70 a 1,84) | 1,73 (da 1,67 a 1,79) | 2,07 (da 1,91 a 2,25) | 1,77 (1,73 a 1,82) | |
| CIN2+ | 1,50 (da 1,42 a 1,59) | 1,45 (da 1,36 a 1,55) | 1,67 (da 1,40 a 2,00) | 1,49 (da 1,43 a 1,55) | |
| CIN3+ | 1,44 (da 1,35 a 1,55) | 1,42 (1,31 a 1,54) | 1,54 (1,22 a 1,96) | 1,44 (1,36 a 1,51) | |
| Risultato | HPV 16/18 | Altri HPV | Quote di mercato per HPV 16/18 v altri HPV (95% CI) | |||||
|---|---|---|---|---|---|---|---|---|
| No (%) | Totale | No (%) | Totale | Non regolato | Aggiustato | |||
| No alla linea di base | ||||||||
| Screened | 5207 (4) | 127 238 | 10 890 (9) | 127 238 | NA | NA | ||
| Citologia positiva | 2293 (44) | 5207 | 2994 (27) | 10 890 | 2,08 (1,94 a 2,22) | 2,02 (da 1,89 a 2,17) | ||
| Persistenza dell’infezione da hrHPV | ||||||||
| Citologia negativa al basale, persistenza a 12 mesi | 1639 (68) | 2398 | 3624 (55) | 6566 | 1,75 (1,58 a 1,93) | 1,72 (1,56 a 1,90)* | ||
| Citologia negativa a 12 mesi, persistenza a 24 mesi | NA | NA | 1368 (65) | 2091 | NA | NA | ||
| Risultati della colposcopia | ||||||||
| PPV per CIN2+ al basale, citologia positiva | 1295 (57) | 2254 | 840 (29) | 2909 | 3,33 (2,96 a 3,73) | 3,12 (da 2,78 a 3,52) | ||
| PPV per CIN2+ a 12 mesi, citologia positiva | 252 (48) | 528 | 221 (27) | 825 | 2,50 (1,98 a 3,14) | 2,28 (da 1,80 a 2,89) | ||
| PPV per CIN2+ a 12 mesi, citologia negativa | 103 (13) | 789 | NA | NA | NA | NA | ||
| PPV per CIN2+ a 24 mesi, hrHPV+ persistente | NA | NA | 117 (10) | 1144 | NA | NA | ||
La figura 1B mostra che, tra le donne sottoposte a citologia, il 4,0% aveva un’anomalia di basso grado e l’1,4% aveva un’anomalia di alto grado. Dopo lo smistamento con hrHPV delle anomalie citologiche di basso grado, il 3,8%(tabella 1) di tutte le donne sottoposte a screening aveva anomalie che richiedevano una colposcopia: il 9,6% tra i 24-29 anni, il 3,0% tra i 30-49 anni e l’1,2% tra i 50 e i 64 anni(tabella 2). La tabella 2 mostra che, a titolo di confronto, dopo lo screening con hrHPV, il 4,2% delle donne è stato indirizzato immediatamente alla colposcopia a causa della citologia positiva concomitante; il 10,8% tra i 24-29 anni, il 3,2% tra i 30-49 anni e l’1,4% tra i 50 e i 64 anni. La tabella 3 mostra che, rispetto alle donne con altre infezioni ad alto rischio, le donne con infezione da HPV 16/18 avevano il doppio delle probabilità di avere una citologia positiva concomitante (44% v 27%, odds ratio corretto 2,02, 95% intervallo di confidenza 1,89-2,17). Tra i primi positivi all’hrHPV con citologia negativa, il 2,8% è stato riferito dopo il richiamo anticipato a 12 e 24 mesi, portando la percentuale totale di donne riferite per protocollo al 7,0%. La tabella 4 mostra che tra le donne con hrHPV positivo e citologico negativo e raccomandate per il richiamo anticipato a 12 mesi, l’83% ha partecipato, e tra le donne con un risultato persistente di hrHPV positivo e citologico negativo che sono state raccomandate per un nuovo test a 24 mesi, il 76% ha partecipato finora. La partecipazione alla colposcopia dopo il richiamo immediato è stata del 98% dopo lo screening con hrHPV e del 94% dopo lo screening citologico. È rimasta alta dopo il richiamo anticipato sia a 12 che a 24 mesi, rispettivamente il 96% e l’89%.
| Referral | test hrHPV | Citologia a base liquida | |||||
|---|---|---|---|---|---|---|---|
| Nessun riferimento | Nessun partecipante (%) | CIN2+ (PPV) | Nessun riferimento | Nessun partecipante (%) | CIN2+ (PPV) | ||
| Riferimento immediato per la colposcopia | 7724 | 7542 (98) | 3060 (41)* | 15 117 | 14 250 (94) | Citologia di alto grado: 4365 (86)†Bassogrado anormale: 1567 (17)‡Combinato:5932 (42) | |
| Richiamo anticipato a 12 mesi | 15 425 | 12 830 (83) | NA | NA | NA | NA | |
| Colposcopia dopo il richiamo anticipato a 12 mesi | 2914 | 2786 (96) | Citologia negativa: 108 (13)§Citologia positiva: 690 (36)¶ | NA | NA | NA | |
| Richiamo anticipato a 24 mesi | 4399 | 3326 (76) | NA | NA | NA | NA | |
| Colposcopia dopo il richiamo anticipato a 24 mesi | 2156 | 1912 (89) | 261 (14) | NA | NA | NA | |
Latabella 3 mostra che entro il richiamo anticipato di 12 mesi, le donne con citologia indice normale avevano meno probabilità di diventare hrHPV negative se erano infettate con HPV 16/18 rispetto ad altri genotipi (32% v 45%, odds ratio corretto 0,58, intervallo di confidenza del 95% da 0,53 a 0,64). Entro 24 mesi, un ulteriore 35% delle donne che erano hrHPV positive con citologia persistentemente negativa aveva cancellato le infezioni.
Latabella 1 mostra che la neoplasia cervicale intraepiteliale di grado 2 o peggiore è stata rilevata in 4156 (2,26%) donne e la neoplasia cervicale intraepiteliale di grado 3 o peggiore in 2521 (1,37%) donne sottoposte a screening con hrHPV. Circa una su quattro di queste lesioni è stata rilevata dopo il richiamo precoce di donne che erano positive all’HPV e negative alla citologia. Delle 101 donne a cui è stato diagnosticato il cancro della cervice uterina, 89 (88%) sono state diagnosticate dopo un immediato richiamo per colposcopia, suggerendo che il richiamo precoce dopo una citologia negativa era una strategia sicura. La tabella 2 mostra che la diagnosi di neoplasia cervicale intraepiteliale di grado 2 o peggiore era fortemente dipendente dall’età, con la diagnosi più alta tra le donne sotto i 30 anni (6,6%), quattro volte superiore a quella a 30-49 (1,6%), e più di 10 volte la diagnosi a 50 o più anni (0,5%). Di tutte le neoplasie cervicali intraepiteliali di grado 2 o peggio, il 55% (2299/4156) è stato rilevato a 24-29, il 39% (1638/4156) a 30-49 e il 5% (219/4156) a 50-64 anni. Tra le donne sottoposte a screening citologico, 3833 (1,0%) presentavano una neoplasia cervicale intraepiteliale di grado 3 o peggio. La neoplasia cervicale intraepiteliale di grado 2 o peggiore è stata diagnosticata in 6113 (1,5%) donne, con il 4,4% a 24-29 anni, l’1,1% a 30-49 anni e lo 0,3% a 50-64 anni.

Fig. 1.Fig. 1. Diagramma di flusso per gli episodi di prevalenza iniziati entro il 31 dicembre 2014, compresi i risultati del follow-up per protocollo fino al 31 maggio 2017 per le donne sottoposte a screening con papillomavirus umano ad alto rischio (hrHPV) (A) e citologia a base liquida (LBC) (B). CIN2+=neoplasia intraepiteliale cervicale di grado 2 o peggiore
Valore predittivo positivo del rinvio alla colposcopia
Latabella 4 mostra che dopo l’immediato referto di donne che erano hrHPV positive per l’hrHPV e per la citologia, è stata rilevata una neoplasia cervicale intraepiteliale di grado 2 o peggiore nel 41% (il valore predittivo positivo era del 19% per il grado basso e dell’87% per la citologia di grado alto). Dopo il rinvio a 12 mesi di richiamo anticipato, la neoplasia cervicale intraepiteliale di grado 2 o peggiore è stata rilevata nel 36% se la citologia era diventata anormale, ma solo nel 13% se la citologia è rimasta negativa con l’infezione del genotipo 16/18. A 24 mesi di richiamo precoce, tra tutte le donne che erano persistentemente hrHPV positive, il valore predittivo positivo della colposcopia che stabilisce una diagnosi di neoplasia cervicale intraepiteliale di grado 2 o peggiore era del 14%. Tra le donne sottoposte a citologia, il valore predittivo positivo è stato dell’86% per la neoplasia cervicale intraepiteliale di grado 2 o peggiore dopo un grado elevato e del 17% dopo una citologia di grado basso, dando un valore predittivo positivo combinato del 42%. In media, il valore predittivo positivo per la neoplasia cervicale intraepiteliale di grado 2 o peggiore è stato del 33% (4156/12-559) per le colposcopie nel test hrHPV e del 37% (6113/16-378) per le colposcopie nello screening citologico a base liquida (odds ratio corretto 0,78, intervallo di confidenza del 95% da 0,74 a 0,82; dati non mostrati).
Latabella 3 mostra che circa il 60% (1650/2828) di tutte le neoplasie cervicali intraepiteliali di grado 2 o peggiori rilevate sono state associate ad infezioni da HPV 16/18 (di cui il 94%, 1547/1650, delle donne ha avuto una citologia positiva al basale o al richiamo anticipato di 12 mesi). Dopo l’aggiustamento per le variabili chiave, le probabilità di una neoplasia cervicale intraepiteliale di grado 2 o peggiore diagnosticata alla colposcopia dopo una citologia ad indice anormale erano tre volte più alte per le infezioni da HPV 16/18 rispetto ad altri genotipi ad alto rischio (valore predittivo positivo per la neoplasia cervicale intraepiteliale di grado 2 o peggiore 57% v 29%, odds ratio aggiustato 3,12, intervallo di confidenza del 95% da 2,78 a 3,52). Questa differenza è rimasta a 12 mesi di richiamo nelle donne con infezioni persistenti e citologia positiva incidente (48% v 27%, 2,28, 1,80 a 2,89). Nelle donne con citologia negativa nonostante le infezioni persistenti da HPV 16/18, il valore predittivo positivo della colposcopia a 12 mesi era molto più basso (13%) e tra le donne con qualsiasi infezione persistente con altri genotipi di hrHPV a 24 mesi, il valore predittivo positivo era del 10%, e solo del 6% (dati non mostrati) se la citologia era negativa.
Confronto tra il test dell’hrHPV e la citologia nel ciclo di prevalenza
Latabella 1 mostra che le donne sottoposte a screening con il test hrHPV avevano maggiori probabilità di avere un test di screening positivo che richiedeva un’ulteriore gestione (odds ratio corretto 3,90, intervallo di confidenza del 95% da 3,81 a 3,98), ed erano anche più propensi a essere indirizzati per la colposcopia immediatamente dopo lo screening (1,14, da 1,11 a 1,17). La proporzione di citologia riflessa anormale era del 33% (7728/23 331, fig. 1A). Il test hrHPV ha portato ad una maggiore rilevazione della neoplasia cervicale intraepiteliale di grado 2 o peggiore al referto immediato (1,12 per la neoplasia cervicale intraepiteliale di grado 2 o peggiore, da 1,07 a 1,17.12 per neoplasia cervicale intraepiteliale di grado 3 o peggio, da 1,06 a 1,19) e per il cancro della cervice uterina (1,14, da 0,88 a 1,48); questo aumento è diventato significativo con un numero maggiore di donne sottoposte a screening (odds ratio corretto 1,21, intervallo di confidenza del 95% da 1,02 a 1,43; tabella supplementare 2).
Latabella 1 mostra che quando sono stati inclusi i rinvii dopo il richiamo anticipato a 12 e 24 mesi, la percentuale di donne con una colposcopia era significativamente più alta per il test hrHPV rispetto alla citologia (adjusted odds ratio 1,77, intervallo di confidenza del 95% da 1,73 a 1,82). La stima Mantel-Haenszel che controlla per tutti i 240 strati era molto simile, 1,79 (intervallo di confidenza del 95% da 1,75 a 1,84). Inoltre, la rilevazione della neoplasia cervicale intraepiteliale era significativamente più alta con il test hrHPV. Rispetto alla citologia, il rapporto delle probabilità corrette per la neoplasia cervicale intraepiteliale di grado 2 o peggiore è stato di 1,49 (intervallo di confidenza del 95% da 1,43 a 1,55), per la neoplasia intraepiteliale cervicale di grado 3 o peggiore è stato di 1,44 (da 1,36 a 1,51), e per il cancro della cervice uterina 1,27 (da 0,99 a 1,63); anche questa differenza ha raggiunto una rilevanza statistica con un numero maggiore di donne sottoposte a screening, 1.32 (intervallo di confidenza del 95% da 1,12 a 1,55; tabella supplementare 2). Il test hrHPV ha tuttavia comportato un maggior numero di biopsie senza anomalie (odds ratio corretto 1,98, intervallo di confidenza del 95% da 1,91 a 2,05) o con al massimo una neoplasia cervicale intraepiteliale di grado 1 (1,71, da 1,62 a 1,82). La stima di Mantel-Haenszel per la rilevazione di neoplasie cervicali intraepiteliali di grado 2 o peggio, è stata coerente con l’analisi primaria, con un odds ratio di controllo per 240 strati di 1,50 (intervallo di confidenza del 95% da 1,44 a 1,57).
Round di screening dell’incidenza
Alla fine del 2014, 354-715 donne di età compresa tra i 24 e i 46 anni erano state rinviate al richiamo di routine per tre anni. Ad oggi, 122-32 (34%) hanno partecipato a un nuovo test di screening primario; il 33% delle donne è stato sottoposto a screening con test hrHPV e il 35% è stato sottoposto a screening citologico nel round di prevalenza (odds ratio per le presenze corretto per le variabili chiave 0,86, intervallo di confidenza del 95% da 0,85 a 0,87). La frequenza al turno di incidenza è stata leggermente superiore nelle aree meno svantaggiate (odds ratio corretto per decile dell’indice di deprivazione multipla 1,03, intervallo di confidenza del 95% da 1,03 a 1,03).
Latabella 5 mostra i risultati per 110-523 donne che sono state riprogrammate con lo stesso test nel round di incidenza a tre anni. La maggior parte delle donne ha avuto lo stesso test di screening come nel turno di prevalenza. Tra le 33 506 donne sottoposte a screening con il test hrHPV in entrambi i turni, 2271 (6,8%) hanno avuto un test di screening positivo, poco più della metà di quello visto nel round di prevalenza, con 495 (1,5%) immediatamente riferite per la colposcopia. Tra le 77-017 donne sottoposte a citologia in entrambi i turni di screening, queste proporzioni erano rispettivamente del 2,5% e del 2,4%. Il rilevamento della neoplasia cervicale intraepiteliale di grado 2 o peggiore è stato sostanzialmente inferiore nelle donne sottoposte a screening con hrHPV (0,2% v 0,7% per la neoplasia cervicale intraepiteliale di grado 2 o peggiore, odds ratio corretto 0,29, intervallo di confidenza del 95% da 0,22 a 0,38; 0,1% v 0,5% per la neoplasia cervicale intraepiteliale di grado 3 o peggiore, odds ratio corretto 0,14, intervallo di confidenza del 95% da 0,09 a 0,23).
| Risultato | Prevalenza e incidenza arrotondata (%)* | Rapporto di probabilità per il test hrHPV v LBC (95% CI) | |||
|---|---|---|---|---|---|
| hrHPV | LBC | Non regolato | Aggiustato† | ||
| Episodi di incidenti: | |||||
| Totale | 33 506 (100.0) | 77 017 (100.0) | NA | NA | |
| Negativo nel round di prevalenza | 33 407 (99.7) | 77 017 (100.0) | NA | NA | |
| Risultati del ciclo di incidenti: | |||||
| Test di screening positivo | 2271 (6.8) | 1910 (2.5) | 2,86 (2,69 a 3,04) | 3,00 (da 2,82 a 3,20) | |
| Invio immediato di una colposcopia | 495 (1.5) | 1878 (2.4) | 0,60 (0,54 a 0,66) | 0,63 (da 0,57 a 0,70) | |
| Un’unica colposcopia | 373 (1.1) | 1608 (2.1) | 0,53 (0,47 a 0,59) | 0,57 (da 0,51 a 0,64) | |
| CIN2+ | 61 (0.2) | 541 (0.7) | 0,26 (0,29 a 0,34) | 0,29 (da 0,22 a 0,38) | |
| ÇIN3+ | 19 (0.1) | 349 (0.5) | 0,12 (0,08 a 0,20) | 0,14 (da 0,09 a 0,23) | |
| Tumore del centro | 0 | 15 (<0.1) | NA | NA | |
Discussione
Questo pilota ha confermato i risultati di studi randomizzati e ha mostrato una maggiore sensibilità per lo screening primario con hrHPV.12345hrHPV rispetto alla citologia a base liquida hanno rilevato il 50% in più di neoplasia cervicale intraepiteliale di grado 2 o peggio, il 40% in più di neoplasia intraepiteliale cervicale di grado 3 o peggio, e il 30% in più di cancro cervicale nel round di prevalenza. Un quarto della neoplasia cervicale intraepiteliale di grado 2 o peggiore è stato rilevato dopo il richiamo precoce in donne con citologia negativa, il che dimostra chiaramente la sensibilità aggiunta del test hrHPV visto in tutta la fascia di età. Questa maggiore sensibilità si riflette nella rilevazione notevolmente bassa della neoplasia cervicale intraepiteliale di grado 2 o peggiore tra le donne che erano negative per l’hrHPV quando sono state rianimate a tre anni, essendo solo il 29% e il 14% di quella dopo una prevalenza intorno alla citologia liquida negativa, per la neoplasia cervicale intraepiteliale di grado 2 o peggiore e la neoplasia cervicale intraepiteliale di grado 3 o peggiore, rispettivamente.
I nostri dati suggeriscono che la minore incidenza di tumore del collo dell’utero dopo un normale test di screening riportato dagli studi randomizzati sarà realizzata nel pilota.3 Negli studi, questa incidenza è stata ridotta del 70% fino a otto anni dopo lo screening (tasso di rilevazione relativo per hrHPV rispetto alla citologia 0,30, intervallo di confidenza del 95% da 0,15 a 0,60).3 Attualmente, ogni anno in Inghilterra vengono diagnosticate 2500 donne con tumore del collo dell’utero ogni anno, con un quarto diagnosticato dopo citologia negativa.13 Lo screening con il test hrHPV si tradurrebbe in 400-500 casi in meno, o in una diminuzione di circa il 20% dell’incidenza complessiva, una volta che lo screening hrHPV sarà diffuso a livello nazionale.14 La minore incidenza di neoplasia cervicale intraepiteliale di grado 3 o peggiore e di tumore del collo dell’utero negli intervalli di screening attuali sosterrebbe fortemente la sicurezza di estendere gli intervalli ad almeno cinque anni senza aumentare il rischio di malattia potenzialmente mortale.36 Il programma inglese di screening del collo dell’utero, iniziato nel 1988, è stato responsabile di una diminuzione del 30% dell’incidenza del cancro del collo dell’utero, ma dal 2002 questa tendenza si è stabilizzata. Ci aspetteremmo un’ulteriore diminuzione dopo l’implementazione dello screening primario dell’hrHPV se combinato con il programma di vaccinazione contro l’HPV del NHS, iniziato nel 2008.
Il triage citologico delle donne che sono risultate positive all’hrHPV ha fatto sì che il 7% delle donne sottoposte a screening venisse sottoposto a colposcopia, il 4% immediatamente e il 3% dopo il richiamo anticipato. Il numero di donne sotto i 30 anni è stato elevato, con quasi il 17% di donne con una colposcopia, rispetto al 5% di quelle tra i 30 e i 49 anni e al 3% di quelle tra i 50 e i 64 anni. L’aumento della richiesta di una colposcopia per le donne che erano hrHPV positive e citologiche negative è probabilmente temporaneo. I nostri dati preliminari del round di incidenza mostrano un dimezzamento delle percentuali di hrHPV positivo rispetto al round di prevalenza, così come una riduzione delle anomalie citologiche. Il tasso di riferimento diminuirà ulteriormente quando le coorti di nascita più giovani entreranno nel Programma di screening cervicale del NHS nel 2020, perché oltre l’80% di loro sarà stato vaccinato contro l’HPV 16/18,15.
hrHPV positivo con citologia negativa è sembrato essere una base sicura su cui rinviare i test ripetuti di donne che sono risultate positive all’hrHPV.16 Gli ulteriori casi di tumore del collo dell’utero diagnosticati dopo il richiamo precoce di donne che erano hrHPV positive e citologiche negative a 12 e 24 mesi supportano anche la relativa sicurezza della strategia di triage attuata, poiché queste donne sarebbero state rinviate a un richiamo di routine a 36 o 60 mesi se il loro test di screening primario fosse rimasto citologico a base liquida.
La copertura del programma di screening cervicale èdiminuita17 , e il passaggio al test hrHPV non dovrebbe esacerbare questa situazione. I processi di screening e i risultati sono stati monitorati intensamente durante il pilota. Non abbiamo identificato alcun incidente grave riguardante le preoccupazioni delle donne o la praticabilità dell’implementazione su larga scala del test hrHPV. L’aderenza alla colposcopia di riferimento e al richiamo tempestivo sono stati entrambi forti, rispettivamente al 95% e all’80%, e questo sarà un elemento importante per ottenere un’elevata sensibilità e un buon rapporto costo-efficacia dello screening dell’hrHPV.18 Inoltre, i dati iniziali del ciclo di screening dell’incidenza incompleto mostrano un assorbimento simile del test dell’hrHPV e dello screening citologico. L’assorbimento complessivo, tuttavia, rimane inferiore nelle aree più svantaggiate dal punto di vista socioeconomico. Anche se non ancora offerto, l’autocampionamento facilitato dal test hrHPV rappresenta una potenziale strategia per aumentare l’assorbimento.19
Punti di forza e di debolezza di questo studio
Due punti di forza chiave di questo studio sono le sue grandi dimensioni e il protocollo di richiamo precoce per le donne con citologia negativa. Questo è il più grande rapporto sull’uso di test hrHPV in qualsiasi programma nazionale organizzato nel mondo sviluppato.202122232424252627272829Il più grande rapporto dall’Italia comprendeva 130.000 donne sottoposte a screening con l’hrHPV e altri rapporti si basavano su un numero sostanzialmente inferiore di donne o erano limitati a specifiche fasce d’età, o entrambe le cose. Siamo stati in grado di identificare eventi anche infrequenti con maggiore accuratezza in questo grande progetto pilota, compresi i dati più forti mai riportati sui risultati dei successivi cicli di screening dell’incidenza. Questo conferma un’incidenza molto bassa di neoplasia cervicale intraepiteliale di grado 2 o peggiore e di tumore del collo dell’utero dopo il primo ciclo di screening con il test hrHPV. hrHPV era più prevalente nelle donne sottoposte a screening nel pilota inglese che nella maggior parte degli altri studi, perché abbiamo incluso donne giovani tra i 24 e i 29 anni. Questo ribadisce l’importanza dei dati specifici del paese per informare un’introduzione del test hrHPV. Il nostro studio, che è stato condotto in condizioni rappresentative di un ambiente di screening di routine in tutta l’Inghilterra, ha mostrato alti tassi di clearance nelle donne con citologia negativa, evitando così inutili colposcopie. Ha anche dimostrato che il richiamo precoce di queste donne è stato rispettato per l’80%, dimostrando la fattibilità di questo approccio, portando in ultima analisi a un aumento del rilevamento della neoplasia cervicale intraepiteliale di grado 2 o peggio di circa il 50%. Nonostante i problemi della vita reale, come la mancata partecipazione allo screening e la violazione del protocollo, lo screening dell’hrHPV in Inghilterra ha dato risultati impressionanti, e come ci si aspettava dai risultati degli studi randomizzati pivotali.
Un limite del pilota, per ragioni di praticabilità, è stato che la selezione delle donne per lo screening dell’hrHPV si è basata prevalentemente sull’area geografica e non sulla randomizzazione individuale. Le differenze di età e di deprivazione tra le donne sottoposte a hrHPV e a screening citologico erano relativamente piccole, anche se statisticamente significative a causa dei grandi numeri. Tutti i confronti dei due test di screening sono stati corretti per le informazioni che potevano essere ottenute dalle registrazioni di routine di laboratorio, anche se probabilmente sono rimaste alcune confusioni residue. Non siamo stati in grado di determinare il numero totale di colposcopie effettuate per l’indagine delle anomalie di screening, anche se i dati sul numero di donne con almeno una colposcopia dovrebbero essere molto completi in quanto vengono utilizzati per identificare le donne in ritardo per le loro colposcopie raccomandate. Inoltre, non siamo stati in grado di stabilire un collegamento con le informazioni sulla storia completa dello screening delle donne e sulle registrazioni degli inviti allo screening, e la copertura dello screening varia da un’area geografica all’altra.30 Tutti i dati sono stati forniti dai laboratori e le donne non potevano essere rintracciate se si erano trasferite a un altro fornitore di screening. Anche se la completezza del follow-up è rimasta elevata, è probabile che vi sia una sottovalutazione della malattia rilevata. Tutti i casi di cancro del collo dell’utero in Inghilterra sono monitorati attraverso un auditformale31 , e tutti i tumori diagnosticati dopo un risultato negativo del test hrHPV saranno identificati attraverso questo processo.
Conclusione
Questo pilota effettuato in condizioni di screening di routine ha confermato che lo screening cervicale primario hrHPV è praticabile su larga scala e conferisce circa il 40% in più di sensibilità per la neoplasia cervicale intraepiteliale di grado 3 o peggiore e circa il 30% in più di sensibilità per il cancro cervicale rispetto alla citologia primaria basata su liquidi. Questo aumento del rilevamento in un ciclo di prevalenza è stato seguito da una marcata riduzione dell’incidenza dopo tre anni, a sostegno di un’estensione degli intervalli di screening.
Ciò che è già noto su questo argomento
- Più di 15 anni di ricerca con studi randomizzati controllati hanno prodotto una forte base di evidenze a sostegno della superiorità dei test del papillomavirus umano ad alto rischio (hrHPV) per la rilevazione di neoplasie cervicali intraepiteliali di grado 2 o peggio rispetto all’attuale standard della citologia basata su liquidi
- Diversi paesi hanno aggiornato le loro linee guida di screening e stanno passando dalla citologia primaria basata su liquidi con triage a base di hrHPV al test primario di hrHPV con triage citologico a base di liquidi
- Il NHS England e la Public Health England stanno lavorando per un’implementazione nazionale entro la fine del 2019
Cosa aggiunge questo studio
- Il pilota ha confermato che lo screening preliminare con il test hrHPV è associato ad un’incidenza molto più bassa di neoplasia cervicale intraepiteliale di alto grado rispetto alla citologia a base liquida
- Gli intervalli di screening cervicale possono essere estesi in modo sicuro
- Il test hrHPV per lo screening cervicale è praticabile in Inghilterra
References
- Naucler P, Ryd W, Törnberg S. Human papillomavirus and Papanicolaou tests to screen for cervical cancer. N Engl J Med. 2007; 357:1589-97. DOI | PubMed
- Rijkaart DC, Berkhof J, Rozendaal L. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer: final results of the POBASCAM randomised controlled trial. Lancet Oncol. 2012; 13:78-88. DOI | PubMed
- Ronco G, Dillner J, Elfström KM, International HPV screening working group. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet. 2014; 383:524-32. DOI | PubMed
- Ronco G, Giorgi-Rossi P, Carozzi F, New Technologies for Cervical Cancer screening (NTCC) Working Group. Efficacy of human papillomavirus testing for the detection of invasive cervical cancers and cervical intraepithelial neoplasia: a randomised controlled trial. Lancet Oncol. 2010; 11:249-57. DOI | PubMed
- Kitchener HC, Gilham C, Sargent A. A comparison of HPV DNA testing and liquid based cytology over three rounds of primary cervical screening: extended follow up in the ARTISTIC trial. Eur J Cancer. 2011; 47:864-71. DOI | PubMed
- Dijkstra MG, van Zummeren M, Rozendaal L. Safety of extending screening intervals beyond five years in cervical screening programmes with testing for high risk human papillomavirus: 14 year follow-up of population based randomised cohort in the Netherlands. BMJ. 2016; 355:i4924. DOI | PubMed
- Rebolj M, Njor SH, Lynge E. Restriction of human papillomavirus DNA testing in primary cervical screening to women above age 30: systematic review. Eur J Cancer Prev. 2012; 21:73-81. DOI | PubMed
- Polman NJ, Veldhuijzen NJ, Heideman DAM, Snijders PJF, Meijer CJLM, Berkhof J. HPV-positive women with normal cytology remain at increased risk of CIN3 after a negative repeat HPV test. Br J Cancer. 2017; 117:1557-61. DOI | PubMed
- Kitchener HC, Almonte M, Gilham C, ARTISTIC Trial Study Group. ARTISTIC: a randomised trial of human papillomavirus (HPV) testing in primary cervical screening. Health Technol Assess. 2009; 13:1-150, iii-iv. DOI | PubMed
- Kitchener HC. HPV primary cervical screening: time for a change. Cytopathology. 2015; 26:4-6. DOI | PubMed
- Wise J. Pilot study will assess whether HPV test should replace smears to screen for cervical cancer. BMJ. 2012; 344:e3744. DOI | PubMed
- McBride E, Marlow L, Forster AS. Psychological Impact of Primary Screening (PIPS) for HPV: a protocol for a cross-sectional evaluation within the NHS cervical screening programme. BMJ Open. 2016; 6:e014356. DOI | PubMed
- Publisher Full Text
- Castanon A, Landy R, Sasieni P. By how much could screening by primary human papillomavirus testing reduce cervical cancer incidence in England?. J Med Screen. 2017; 24:110-2. DOI | PubMed
- Publisher Full Text
- Bergeron C, Giorgi-Rossi P, Cas F. Informed cytology for triaging HPV-positive women: substudy nested in the NTCC randomized controlled trial. J Natl Cancer Inst. 2015; 107:107. DOI | PubMed
- C Kitchener H, Canfell K, Gilham C. The clinical effectiveness and cost-effectiveness of primary human papillomavirus cervical screening in England: extended follow-up of the ARTISTIC randomised trial cohort through three screening rounds. Health Technol Assess. 2014; 18:1-196. DOI | PubMed
- Snijders PJ, Verhoef VM, Arbyn M. High-risk HPV testing on self-sampled versus clinician-collected specimens: a review on the clinical accuracy and impact on population attendance in cervical cancer screening. Int J Cancer. 2013; 132:2223-36. DOI | PubMed
- Ronco G, Giorgi Rossi P, Giubilato P, Del Mistro A, Zappa M, Carozzi F, HPV screening survey group. A first survey of HPV-based screening in routine cervical cancer screening in Italy. Epidemiol Prev. 2015; 39(Suppl 1):77-83. PubMed
- Veijalainen O, Kares S, Kujala P. Human papillomavirus test with cytology triage in organized screening for cervical cancer. Acta Obstet Gynecol Scand. 2016; 95:1220-7. DOI | PubMed
- Pasquale L, Giorgi Rossi P, Carozzi F. Cervical cancer screening with HPV testing in the Valcamonica (Italy) screening programme. J Med Screen. 2015; 22:38-48. DOI | PubMed
- Del Mistro A, Frayle H, Ferro A, Veneto HPV-screening Working Group. Cervical cancer screening by high risk HPV testing in routine practice: results at one year recall of high risk HPV-positive and cytology-negative women. J Med Screen. 2014; 21:30-7. DOI | PubMed
- Confortini M, Giorgi Rossi P, Barbarino P, Passarelli AM, Orzella L, Tufi MC. Screening for cervical cancer with the human papillomavirus test in an area of central Italy with no previous active cytological screening programme. J Med Screen. 2010; 17:79-86. DOI | PubMed
- Maggino T, Sciarrone R, Murer B. Screening women for cervical cancer carcinoma with a HPV mRNA test: first results from the Venice pilot program. Br J Cancer. 2016; 115:525-32. DOI | PubMed
- Zorzi M, Del Mistro A, Farruggio A. Use of a high-risk human papillomavirus DNA test as the primary test in a cervical cancer screening programme: a population-based cohort study. BJOG. 2013; 120:1260-8. DOI | PubMed
- Zorzi M, Frayle H, Rizzi M, and the Veneto HPV-screening Working Group. A 3-year interval is too short for re-screening women testing negative for human papillomavirus: a population-based cohort study. BJOG. 2017; 124:1585-93. DOI | PubMed
- Lamin H, Eklund C, Elfström KM. Randomised healthcare policy evaluation of organised primary human papillomavirus screening of women aged 56-60. BMJ Open. 2017; 7:e01478. DOI | PubMed
- DOI
- Publisher Full Text
- Castanon A, Ferryman S, Patnick J, Sasieni P. Review of cytology and histopathology as part of the NHS Cervical Screening Programme audit of invasive cervical cancers. Cytopathology. 2012; 23:13-22. DOI | PubMed
Fonte
Rebolj M, Rimmer J, Denton K, Tidy J, Mathews C, et al. (2019) Primary cervical screening with high risk human papillomavirus testing: observational study. The BMJ 364l240. https://doi.org/10.1136/bmj.l240





