Introduzione
Nel 2012, a circa 240.000 donne in tutto il mondo è stato diagnosticato un cancro ovarico avanzato, epiteliale, alle tube di Falloppio o al peritoneo primario.1 Circa il 75% delle donne ha un cancro di stadio III o IV della Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) al momento della diagnosi. La gestione iniziale prevede la combinazione di citoriduzione chirurgica e chemioterapia sistemica. Il carboplatino e il paclitaxel costituiscono il regime standard universale nella gestione del cancro ovarico, con un tasso di risposta di circa il 65%, una sopravvivenza libera da progressione mediana (PFS) che va da 16 a 21 mesi e una sopravvivenza globale mediana (OS) che va da 32 a 57 mesi.2 Attualmente, la SOS è il criterio standard per la valutazione del trattamento, ma sia la SOS che la PFS hanno portato all’approvazione dei farmaci da parte delle agenzie di regolamentazione (la Food and Drug Administration statunitense e l’Agenzia Europea per i Medicinali). La sopravvivenza libera da progressione dà una valutazione anticipata dell’attività antitumorale, richiede campioni di dimensioni più piccole e non è influenzata dalla terapia post-progressione. Il GCIG (Gynecologic Cancer InterGroup)3 ha raccomandato che il PFS possa servire come punto finale primario invece che come OS, a condizione che i punti finali secondari, come la qualità della vita, sostengano la superiorità del trattamento indagato. Mancano prove della validità del PFS come marker surrogato della S.O. nell’era moderna dei diversi tipi di trattamento. Nel 2009, Buyse4 ha dimostrato che il PFS era un buon marker surrogato della S.O. nel cancro ovarico, ma quello studio è stato limitato a 4 studi che hanno studiato i regimi citotossici standard (ciclofosfamide più cisplatino vs ciclofosfamide più cloridrato di doxorubicina [Adriamicina] più cisplatino) e ha usato la vecchia definizione di progressione dell’Organizzazione Mondiale della Sanità. Una correlazione a livello individuale misurata da un Kendall τ di 0,84 (95% CI, 0,83-0,85) e a livello di gruppo misurata da una correlazione di Pearson di 0,95 (95% CI, 0,82-1,00) è stata trovata. In questi studi, l’effetto del trattamento sulla PFS è stato associato all’effetto del trattamento sulla OS.
Da allora sono state introdotte nuove terapie mirate, molte delle quali sono utilizzate come terapia di mantenimento. Tra gli strumenti per valutare la progressione e la risposta al trattamento, il livello di antigene tumorale 125 (CA125) è un importante marcatore nel cancro ovarico epiteliale.5 La GCIG ha integrato l’elevazione dei livelli di CA125 nei criteri di valutazione della risposta radiologica nei tumori solidi (RECIST) per dare una definizione combinata della progressione.6 Questi criteri combinati non sono mai stati studiati, a nostra conoscenza, come un surrogato della S.O. utilizzando l’approccio meta-analitico. Le prove utilizzano diversi metodi di valutazione della progressione, tra cui la tomografia computerizzata (TC) clinica o la TC con trigger CA125 e regolare. Anche l’effetto di questi diversi metodi di valutazione sulla maternità surrogata di PFS non è stato valutato. Per valutare formalmente la PFS misurata da RECIST e i criteri combinati della GCIG come potenziale punto finale surrogato della sopravvivenza globale, il gruppo di meta-analisi GCIG ha lanciato un’analisi prospetticamente pianificata in pool dei dati di 11-029 pazienti individuali (dati individuali della paziente [IPD]) e 17 studi clinici randomizzati di terapia di prima linea (trattamento iniziale, trattamento di intensificazione, o trattamento di mantenimento) nei tumori ovarici avanzati.
Metodi
Questo rapporto segue le linee guida Preferred Reporting Items for Systematic Reviews and Meta-analyses(PRISMA)-IPD per la registrazione del protocollo, l’identificazione dello studio, la raccolta e l’integrità dei dati, la valutazione delle distorsioni e le analisi di sensibilità.7 Questa meta-analisi è stata registrata presso PROSPERO (CRD42017068135). Il Comitato etico del Gustave Roussy Cancer Center, Villejuif, Francia, ha approvato questo studio e l’autorità francese per la protezione dei dati ha rinunciato alla necessità di un consenso informato per l’uso dei dati deidentificati.
Selezione di prova
Nel settembre 2016 è stata condotta una ricerca completa su MEDLINE di pubblicazioni sul cancro ovarico avanzato. I gruppi della GCIG sono stati interrogati per studi potenzialmente completati ma non pubblicati. Gli studi ammissibili erano studi clinici randomizzati di trattamenti sistemici in pazienti con cancro ovarico non trattato in precedenza (o che studiavano il trattamento di mantenimento dopo il trattamento sistemico di prima linea) con una dimensione minima del campione di 60 pazienti in totale e pubblicati dal 1 gennaio 2001, fino al 25 settembre 2016, con entrambi i sistemi operativi e PFS disponibili. I trattamenti sperimentali considerati sono stati quelli iniziali, di mantenimento e di intensificazione, che consistevano in agenti somministrati a dosi e/o frequenze più elevate rispetto a quelli del braccio di controllo. Gli sperimentatori di tutti gli studi identificati che soddisfacevano i criteri di idoneità sono stati contattati per la condivisione del DPI.
Dati e risultati
Abbiamo richiesto i dati per tutti i singoli pazienti (indipendentemente dal fatto che fossero stati inclusi o meno nell’analisi primaria) arruolati in ogni studio. La sopravvivenza complessiva è stata definita come il tempo che va dalla randomizzazione alla morte di tutti i pazienti o la data dell’ultimo follow-up utilizzato per la censura. La sopravvivenza libera da progressione è stata definita come il tempo che va dalla randomizzazione alla progressione o al secondo tumore quando questa informazione era disponibile, il tempo fino alla morte per cause naturali o la data dell’ultimo follow-up utilizzato per la censura, a seconda di quale dei due è stato il primo. Sono state richieste informazioni dettagliate sul tipo di progressione; ciò includeva la definizione di progressione, la valutazione radiologica e/o clinica che documentava la progressione e le misurazioni seriali dei livelli di CA125. La valutazione della progressione è stata raggruppata in 3 categorie principali: (1) esame clinico e monitoraggio di 2 aumenti dei livelli di CA125 per attivare la conferma della progressione mediante TC, (2) monitoraggio radiologico basato su RECIST, e (3) sia i livelli di CA125 che la valutazione radiologica in linea con le raccomandazioni della GCIG. I pazienti vivi senza progressione di malattia documentata sono stati censurati alla data dell’ultimo follow-up. Tutti i dati sono stati rianalizzati a livello centrale e controllati per verificare la presenza di incongruenze. In particolare, sono stati sistematicamente applicati strumenti diagnostici per la qualità della randomizzazione.8,9 L’analisi della maternità surrogata è stata effettuata dal 7 gennaio al 20 marzo 2019.
Analisi statistica
Le parcelle forestali sono state utilizzate per visualizzare i rapporti di rischio (HR) in generale e per i singoli studi, che sono stati poi utilizzati per la valutazione della maternità surrogata di PFS per OS. Gli HR hanno confrontato il rischio di un evento in pazienti trattati con un regime sperimentale con il rischio in pazienti sottoposti al trattamento di controllo. È stato implementato un approccio ad effetto fisso e le risorse umane sono state ottenute dal numero di eventi previsti e osservati. Le risorse umane messe in comune sono state poi adeguate per lo studio. Il test dieterogeneità χ 2 e la statistica I2 sono stati utilizzati per indagare l’eterogeneità complessiva tra gli studi.10 Le curve di sopravvivenza sono state stimate con l’approccio attuariale di Peto et al.11 per rendere conto delle prove multiple. L’evoluzione del tempo mediano di sopravvivenza è stata valutata utilizzando un test di tendenza lineare a livello di trial ponderato in base al numero di eventi. La maternità surrogata può essere valutata a 2 diversi livelli. A livello individuale, la correlazione tra PFS e OS significa che ci si aspetta che i pazienti con PFS più lunghi abbiano OS più lunghi. Tuttavia, questo può riflettere solo la storia naturale della malattia, qualunque sia il trattamento. Per la valutazione della maternità surrogata a livello di trial, l’effetto del trattamento sulla SPP è stato correlato con l’effetto del trattamento sulla SPP; in altre parole, abbiamo valutato quanto dell’effetto del trattamento sulla SPP possa essere previsto da (o spiegato da) l’effetto del trattamento sulla SPP. Abbiamo usato il Kendall τ (un coefficiente di correlazione di rango) tra PFS e OS per valutare la maternità surrogata a livello individuale e il coefficiente di determinazione (corrispondente alla variazione spiegata) tra il logaritmo naturale delle HR per PFS e OS per valutare la maternità surrogata a livello di prova.12,13,14,15 Per entrambi i coefficienti, 0 indica assenza di correlazione, mentre 1,00 indica una correlazione perfetta. A livello individuale, l’associazione tra la distribuzione dei punti finali vero (OS) e surrogato (PFS) è stata valutata utilizzando un modello bivariabile basato sulla copula di Plackett combinato con modelli Weibull specifici di prova per PFS e OS.13 Gli effetti del trattamento su PFS e OS sono stati ottenuti dal modello bivariato. L’associazione lineare tra i 2 effetti del trattamento è stata stimata, che a sua volta ha fornito il coefficiente di determinazione R2per la prova. A seguito dell’iniziativa FLASH (Follicular Lymphoma Analysis of Surrogacy Hypothesis)16 e un rapporto sulla leucemia linfoblastica acuta infantile,17 si è ritenuto che un surrogato fornisse una previsione affidabile dell’effetto del trattamento sul sistema operativo da parte del PFS HR, quando la correlazione a livello di trial superava lo 0,8 e il suo intervallo di previsione del 95% escludeva lo 0,6. Questa soglia predefinita è arbitraria ed è servita a limitare i pregiudizi post hoc (cioè la scelta della soglia in base ai dati). Le analisi sono state effettuate in base all’intenzione di trattare (tutti i pazienti analizzati nel gruppo di appartenenza, indipendentemente da possibili deviazioni dal protocollo).
Analisi della sensibilità e della sottopopolazione
È stata implementata la convalida incrociata Leave-1-out per valutare la performance previsionale del modello di regressione. Il processo di validazione è stato eseguito su tutti gli esperimenti tranne 1, e l’OS HR è stato previsto dal PFS HR per lo studio left-out e confrontato con il valore osservato. Il processo è stato ripetuto per ciascuno dei 17 trial per identificare i potenziali trial influenti e per indagare sulla solidità dei risultati. Le analisi dei sottogruppi pianificati hanno indagato le misure di maternità surrogata per definizione della progressione, per disegno dello studio (trattamento iniziale, intensificazione, o di mantenimento), e all’interno degli studi che utilizzavano il paclitaxel e il carboplatino come braccio di controllo.
Convalida esterna
Per valutare la validità esterna dei nostri risultati, abbiamo utilizzato 16 studi per i quali non siamo stati in grado di ricevere IPD dagli sponsor. Due di noi (X.P. e E.K.) hanno estratto in modo indipendente le risorse umane e gli intervalli di confidenza per PFS e OS dalle statistiche riassuntive pubblicate in questi studi.18 Le HR su PFS riportate nella pubblicazione sono servite a prevedere le HR su OS che a loro volta abbiamo confrontato con le HR su OS pubblicate. Tutte le analisi sono state effettuate utilizzando SAS, versione 9.4 (SAS Institute Inc), con macro sviluppate da Tomasz Burzykowski, PhD, e R, versione X, utilizzando il pacchetto R surrosurv, versione 1.1.25 (R Project for Statistical Computing).19 La P</05 a due code calcolata usando il test per l’eterogeneità è stata considerata significativa dal punto di vista statistico. Gli intervalli di fiducia e di previsione sono stati calcolati al 95%.
Risultati
Descrizioni delle prove
Come illustrato nella eFigure 1 nel Supplemento, sono stati identificati 37 studi dalla ricerca in letteratura e i loro ricercatori sono stati contattati. I dati dei singoli pazienti sono stati ottenuti su 11-029 pazienti unici da 17 studi clinici randomizzati con OS e PFS documentati.2,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36
LaTabella 1 elenca le caratteristiche a livello di trial dei 17 studi; la eTabella 1 nel Supplemento fornisce una valutazione del rischio di distorsione. In 10 studi,20,21,24,25,26,27,28,29,32,36 Il carboplatino e i taxani erano il comparatore. Sette studi20,22,24,26,28,32,36 ha studiato il trattamento iniziale; 5 studi,21,24,25,30,33 trattamento di intensificazione; e 5 studi,23,27,31,34,35 trattamento di manutenzione. Quattro prove hanno testato trattamenti a bersaglio molecolare.23,27,31,34 Un totale di 10 prove21,22,23,25,26,30,33,34,36 usato livelli di CA125 per innescare TAC di follow-up dopo un aumento iniziale del biomarcatore. Sei prove24,27,28,29,31,35 ha utilizzato i criteri della GCIG (1 prova multinazionale utilizzata in entrambi i casi) e 2 prove20,32 usato solo la scansione TAC. I dati su entrambi i punti finali erano disponibili per tutti gli 11-029 pazienti, di cui 7436 hanno avuto una progressione e 5138 sono morti durante il follow-up. Informazioni dettagliate sulle caratteristiche dei pazienti per braccio di trattamento assegnato e follow-up mediano sono fornite nella eTabella 2 del supplemento . L’età media dei pazienti era di 58 anni (range, 18-88 anni); 5990 (54,3%) avevano uno stato di prestazione del Gruppo Oncologico Cooperativo Orientale di Oncologia di 0 all’arruolamento; e 8497 (77,0%) avevano una malattia FIGO stadio III o IV. eFigure 2 nel Supplemento mostra le curve di sopravvivenza Peto per PFS e OS. Non sono state rilevate tendenze temporali statisticamente significative nella SPO mediana e nella SPO secondo la data della prima randomizzazione. La OS mediana variava da 2,7 a 6,2 mesi e la PFS mediana variava da 0,9 a 2,3 mesi (vedere la Tabella 1 per la sopravvivenza mediana e la eFigure 3 nel Supplemento per la loro rappresentazione nel tempo). Non sono state rilevate tendenze temporali in base alla data della prima randomizzazione. La Figura 1 mostra una trama forestale degli effetti del trattamento su OS e PFS per tutti gli studi (la eFigure 4 nel Supplemento fornisce le trame forestali raggruppate per criteri di valutazione della progressione). Complessivamente e a livello di studio, gli effetti della chemioterapia sperimentale su PFS e OS sono stati quasi nulli (HR per PFS, 0.97 [95% CI, 0.93-1.02]; HR per OS, 0.99 [95% CI, 0.94-1.05]). Non è stata rilevata alcuna eterogeneità tra le prove per nessuno dei punti finali(I2=0%[P==.70] per OS e I2==0% [P==.60] per PFS) (Figura1).
| Fonte (nome della prova) | Regime investigativo (numero di pazienti) | Regime standard (numero di pazienti) | Valutazione della progressionea | Braccio standard, numero di pazienti | Braccio investigativo, numero di pazienti | Data della prima inclusione | Follow-up, mediano (IQR), y | Sistema operativo mediano, y | PFS mediana, y |
|---|---|---|---|---|---|---|---|---|---|
| Manutenzione | |||||||||
| Vergote et al,34 2014 (EORTC-55041) | Cloridrato di Erlotinib (420) | Osservazione (415) | Livello clinico CA125 (conferma con TC) | 412 | 419 | 2005 | 4.3 (3.8-4.8) | 4.6 | 1.0 |
| Hirte et al,23 2006 (CCTG-OV.12) | Tanomastat (122) | Placebo (121) | Livello clinico CA125 (conferma con TC) | 121 | 122 | 1998 | 0.9 (0.6-1.3) | NR | 0.9 |
| Reyners et al,31 2012 (DoCaCel) | Docetaxel, carboplatino e celecoxib (97) | Docetaxel e carboplatino (99) | Criteri GCIG | 99 | 97 | 2003 | 4.1 (2.6-5.7) | 2.9 | 1.2 |
| Oza et al,27 2015 (MRC-ICON7) | Bevacizumab (764) | Chemioterapia standard (764) | Criteri GCIG | 764 | 764 | 2006 | 4.6 (4.2-5.1) | 4.8 | 1.6 |
| Mannel et al,35 2011 (GOG-0175) | Paclitaxel a basso dosaggio (274) | Osservazione (268) | Criteri GCIG | 268 | 274 | 1998 | 11.6 (8.5-13.7) | NR | NR |
| Nessuna manutenzione | |||||||||
| Aravantinos et al,20 2008 (ETTARO-4A99) | Cisplatino, paclitaxel e doxorubicina (236) | Paclitaxel e carboplatino (233) | Scansione TAC | 221 | 225 | 1999 | 13.7 (5.4-16.1) | 3.2 | 1.3 |
| Pignata et al, 28 2011 (MITO-2) | Carboplatino e doxorubicina liposomiale (410) | Carboplatino e paclitaxel (410) | Mistob | 392 | 396 | 2003 | 6.0 (5.0-7.1) | 4.7 | 1.5 |
| Vasey et al,36 2004 (SCOTROC-1) | Docetaxel e carboplatino (539) | Paclitaxel e carboplatino (538) | Livello clinico CA125 (conferma con TC) | 537 | 538 | 1998 | 2.0 (1.6-2.4) | 2.9 | 1.2 |
| Sugiyama et al,32 2016 (JGOG-3017) | Cloridrato irinotecanico e cisplatino (332) | Carboplatino e paclitaxel (335) | Scansione TAC | 332 | 329 | 2009 | 3.7 (2.8-4.8) | NR | NR |
| Hoskins et al,24 2010 (CCTG-OV.16) | Cisplatino e topotecan seguito da paclitaxel e carboplatino (409) | Paclitaxel e carboplatino (410) | Criteri GCIG | 410 | 409 | 2002 | 8.2 (7.5-8.9) | 3.7 | 1.3 |
| Lindemann et al,26 2012 (NSGO-2012) | Paclitaxel, carboplatino e cloridrato di epirubicina (445) | Paclitaxel e carboplatino (442) | Livello clinico CA125 (conferma con TC) | 441 | 443 | 1999 | 5.3 (4.3-5.9) | 3.4 | 1.4 |
| Fruscio et al,22 2008 | Cisplatino, ifosfamide e paclitaxel (106) | Cisplatino, cloridrato di epirubicina e paclitaxel (103) | Livello clinico CA125 (conferma con TC) | 95 | 97 | 1997 | 6.8 (6.2-7.3) | 4.7 | 1.9 |
| Terapia di intensificazione | |||||||||
| Ray-Coquard et al,30 2007 (GINECO-2007) | Ciclofosfamide, cloridrato di erubicina, cisplatino e filgrastim (79) | Ciclofosfamide, cloridrato di erubicina e cisplatino (85) | Livello clinico CA125 (conferma con TC) | 85 | 79 | 1994 | 8.6 (6.2-9.9) | 2.7 | 1.2 |
| Pignata et al,29 2014 (MITO-7) | Carboplatino settimanale e paclitaxel (406) | Ogni 3 wk di carboplatino e paclitaxel (404) | Criteri GCIG | 397 | 393 | 2008 | 1.9 (1.4-2.6) | 4.0 | 1.5 |
| Banerjee et al,21 2013 (SCOTROC-4) | La dose di carboplatino è aumentata (483) | Dose piatta di carboplatino (481) | Livello clinico CA125 (conferma con TC) | 481 | 483 | 2005 | 2.7 (1.7-3.6) | 2.7 | 1.0 |
| Katsumata et al,25 2013 (JGOG-3016) | Carboplatino denso di dosaggio (317) | Carboplatino convenzionale (320) | Livello clinico CA125 (conferma con TC) | 320 | 317 | 2004 | 6.5 (5.9-7.2) | 6.2 | 2.3 |
| Van der Burg et al,33 2014 (TURBO) | Paclitaxel e carboplatino settimanale (134) | 3 volte a settimana paclitaxel e carboplatino (136) | Livello clinico CA125 (conferma con TC) | 135 | 134 | 1998 | 9.4 (8.4-11.4) | 3.6 | 1.5 |
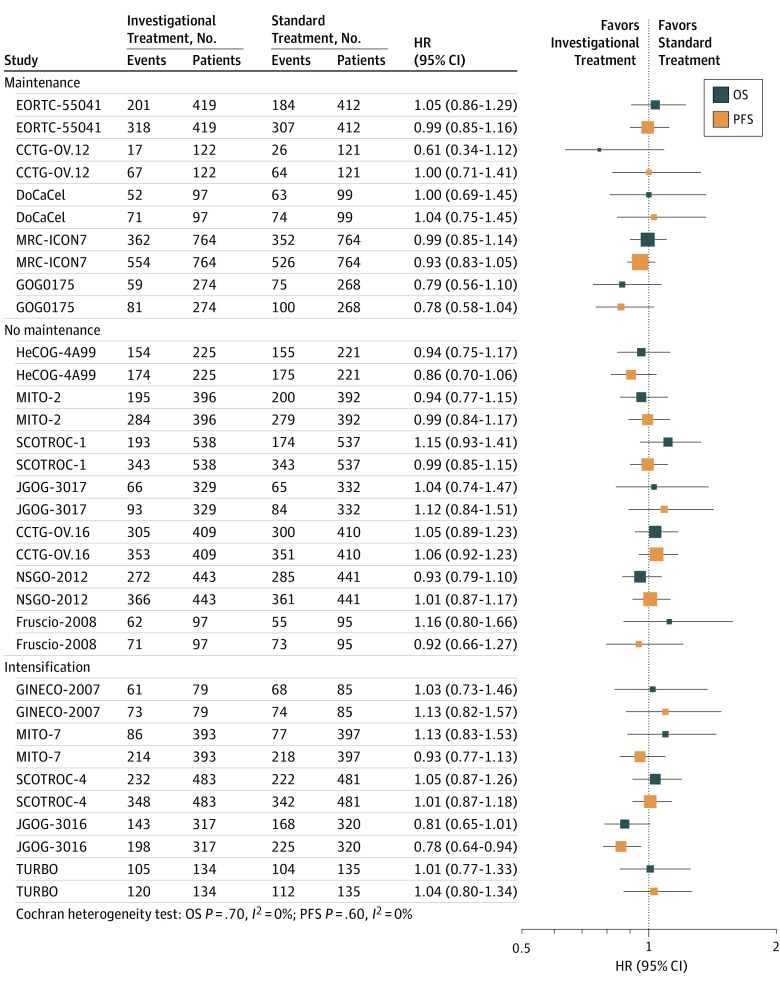
Figura 1.Effetto del trattamento globale e di prova per prova sulla sopravvivenza globale (OS) e sulla sopravvivenza senza progressione (PFS)L’HR indica il rapporto di pericolo. La dimensione dei quadrati è proporzionale alla dimensione del campione della prova.

Figura 1.Effetto del trattamento globale e della prova per prova sulla sopravvivenza globale (OS) e sulla sopravvivenza senza progressione (PFS)L’HR indica il rapporto di pericolo. La dimensione dei quadrati è proporzionale alla dimensione del campione della prova.
Associazioni di livello individuale e di prova
L’associazione a livello individuale, misurata dal coefficiente di correlazione del rango di Spearman, ha raggiunto lo 0,885 (95% CI, 0,879-0,890). La stima di Kendall τ è stata di 0,724 (95% CI, 0,717-0,732), indicando una buona correlazione tra PFS e OS; cioè, un paziente che progredisce più tardi ha più probabilità di sopravvivere più a lungo di un paziente che progredisce prima. Al contrario, è stata notata una correlazione molto bassa tra ln(OS HR) e ln(PFS HR)(Figura 2), dove ln denota la naturale trasformazione del log dell’HR per ogni punto finale. Il coefficiente di determinazione, R2per la prova, per gli effetti del trattamento stimato è stato di 0,24 (95% CI, 0-0,59), indicando una bassa correlazione tra PFS e OS a livello di prova. Il modello di regressione lineare dalle stime della copula era ln (OS HR) = 0,025+ [0,67×ln (PFS HR)]. Gli errori standard erano rispettivamente 0,03 e 0,31 per l’intercettazione e la pendenza. Questo è mostrato come una linea retta nella Figura 2, dove l’asse x rappresenta l’effetto del trattamento su PFS e l’asse y rappresenta l’effetto del trattamento su OS. L’area ombreggiata corrisponde ai limiti di previsione del 95% che indicano il range di effetto su OS che ci si può aspettare per un dato effetto su PFS, ma a causa della correlazione molto scarsa, rimane in gran parte teorica. Nonostante le grandi dimensioni del campione, alcune prove con effetto di trattamento simile su PFS hanno avuto un effetto diverso su OS, incluso PFS HR maggiore di 1,00 insieme a OS HR minore di 1,00, traducendosi in incertezza nella previsione.
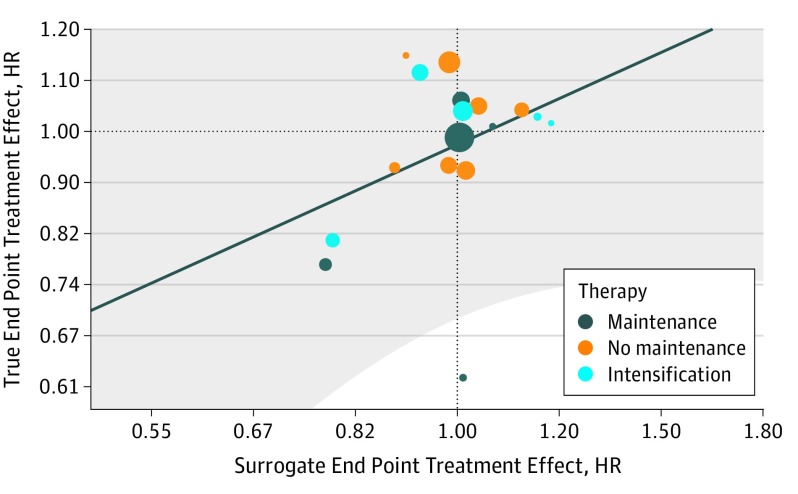
Figura 2.Associazione tra il rapporto di pericolo (Hazard Ratio – HR) per il Surrogate End Point Progression-Free Survival (PFS) e per il True End Point Overall Survival (OS) per tipo di provaOgni prova è rappresentata da una bolla di dimensioni proporzionali alla dimensione del campione di prova. La linea retta solida è il modello di regressione lineare dalle stime della copula che mette in relazione il PFS HR con l’OS HR: ln(OS HR) = 0,025+[0,67×ln(PFS HR)]. L’area ombreggiata corrisponde ai limiti di previsione del 95%.

Figura 2.Figura 2. Associazione tra il rapporto di pericolo (Hazard Ratio – HR) per il Surrogate End Point Progression-Free Survival (PFS) e per il True End Point Overall Survival (OS) per tipo di provaOgni prova è rappresentata da una bolla di dimensioni proporzionali alla dimensione del campione di prova. La linea retta solida è il modello di regressione lineare dalle stime della copula che mette in relazione il PFS HR con l’OS HR: ln(OS HR) = 0,025+[0,67×ln(PFS HR)]. L’area ombreggiata corrisponde ai limiti di previsione del 95%.
Analisi di sensibilità
La convalida incrociata Leave-1-out ha dimostrato la solidità dei risultati, perché abbiamo avuto una coerenza tra gli effetti osservati e previsti del trattamento dell’OS per ogni studio basato sul PFS (eFigure 5 nel Supplemento). È stato identificato solo 1 studio fortemente influente; lo studio OV-1223 ha studiato il tanomastat come terapia di mantenimento, che è stata interrotta dalla Bayer a causa di risultati negativi in altri tipi di cancro, e il follow-up è stato interrotto23La progressione è stata valutata con scansioni TAC dopo l’aumento iniziale dei livelli di CA125. Escludendo questa prova, la stima di R2per la prova è aumentata ad un valore moderato di 0,66 (95% CI, 0,40-0,93), più in linea con i risultati precedenti.
Sottogruppo Analisi
Le analisi della sottopopolazione che si sono concentrate separatamente sulle prove di manutenzione e non manutenzione hanno confermato che l’effetto del trattamento sul PFS è stato scarsamente previsto sull’OS: la maternità surrogata a livello di prova è stata bassa per le prove di manutenzione(Tabella 2), con R2per le stime di prova da 0,03 (95% CI, 0-0,35) per la manutenzione contro 0,67 (95% CI, 0,36-0,97) per la non manutenzione. La marcata differenza è stata spiegata principalmente dalla prova OV-12 nel sottogruppo di manutenzione, perché l’R2per le prove è aumentato a 0,78 (95% CI, 0,40-1,00) dopo l’esclusione di questa prova; il piccolo numero di prove in questo sottogruppo ha aumentato fortemente l’instabilità dei risultati. Anche la correlazione a livello di trial è stata bassa(R2per lo trial=0.15; 95% CI,|0-0.56) negli studi che hanno confrontato il trattamento sperimentale con il carboplatino e i taxani. Nei 6 studi24,27,28,29,31,35 (4603 pazienti) che hanno specificato le linee guida GCIG per valutare la progressione, la previsione della OS HR basata su PFS HR era migliore(R2per lo studio = 0,43; 95% CI, 0,02-1,00) rispetto a quella degli studi che hanno utilizzato la TC dopo l’aumento iniziale del livello di CA125; tuttavia, lo studio OV-1223 ha nuovamente ridotto l’associazione stimata tra gli effetti del trattamento negli studi che hanno utilizzato altre valutazioni della progressione.
| Analisi | N. di prove | Numero di pazienti | Correlazione a livello individuale, Kendall τ (95% CI)a | Correlazione a livello di prova, R2(95% CI)b |
|---|---|---|---|---|
| Complessivamente | 17 | 11 029 | 0.724 (0.717-0.732) | 0.24 (0-0.59) |
| Design | ||||
| Manutenzione | 5 | 3340 | 0.72 (0.71-0.74) | 0.03 (0-0.35) |
| Non manutenzione | 12 | 7689 | 0.72 (0.72-0.73) | 0.67 (0.36-0.97) |
| Carboplatino e taxani come controllo | 10 | 7321 | 0.73 (0.72-0.74) | 0.15 (0-0.56) |
| Valutazione della progressione | ||||
| Livello CA125 confermato dalla scansione CT | 10 | 5319 | 0.70 (0.69-0.71) | 0.27 (0-0.74) |
| Criteri GCIG | 5 | 4603 | 0.74 (0.73-0.75) | 0.43 (0.02-1.00) |
Convalida esterna
Dei 20 studi in cui non abbiamo potuto accedere al DPI (a causa del rifiuto degli sperimentatori,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56 nessuna risposta alla nostra richiesta, o dati dichiarati non più disponibili), abbiamo potuto estrarre le risorse umane per 16 di esse (8 per testare i trattamenti iniziali e 8 per testare i trattamenti di manutenzione).37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52 Nessuno degli studi ha dimostrato un effetto statisticamente significativo sulla S.O., e solo 3 studi43,49,51 ha riportato una riduzione statisticamente significativa di PFS. eTable 3 nel Supplemento e nella visualizzazione della Figura 3 ha osservato OS HR e PFS HR con il 95% di CI, e OS HR previsto dal modello della Figura 2. Le stime osservate per tutti gli studi, eccetto 2, rientrano negli intervalli di previsione del 95%. Tuttavia, gli intervalli sono relativamente ampi, riflettendo l’incertezza intorno alla previsione.
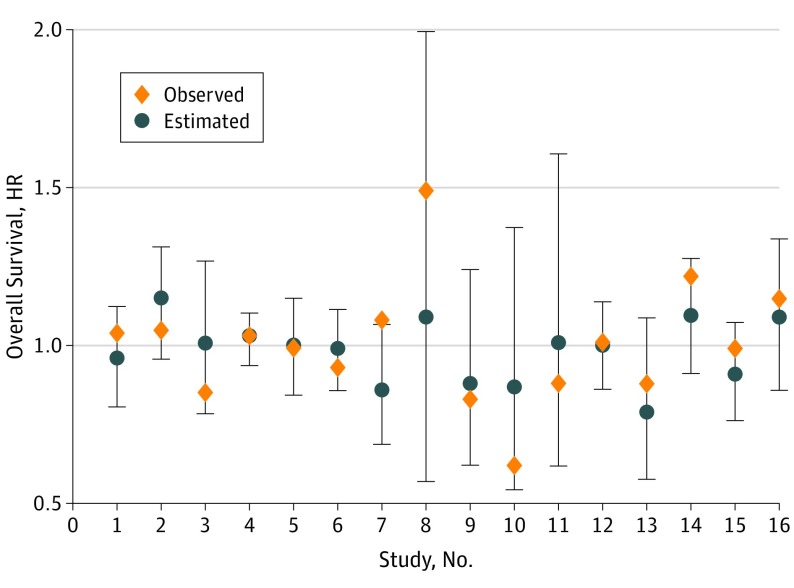
Figura 3.Effetto del trattamento osservato e stimato sulla sopravvivenza complessiva nelle prove di convalidaHR indica il rapporto di pericolo; barre di errore, 95% di IC.

Figura 3.Effetto del trattamento osservato e stimato sulla sopravvivenza complessiva nelle prove di convalidaHR indica il rapporto di pericolo; barre di errore, 95% di IC.
Discussione
Questa analisi congiunta è stata eseguita sull’IPD di 11-029 pazienti trattate in 17 studi randomizzati di trattamento di prima linea per il cancro ovarico avanzato iniziati in tutto il mondo dal 1995 al 2010. Sebbene la PFS fosse fortemente associata alla OS a livello individuale, non abbiamo trovato una forte correlazione tra gli effetti del trattamento sulla PFS e sulla OS (cioè, la HR sulla PFS non ha previsto la HR sulla OS a livello di studio). Una bassa correlazione è stata osservata negli studi di terapia di mantenimento e non di mantenimento. Nel complesso, le HR su OS e PFS sono state vicine a 1.00, con poca eterogeneità tra gli studi se sono stati esplorati trattamenti di manutenzione o non di manutenzione. Tutti gli studi hanno richiesto rigorosi programmi di valutazione della risposta, con esame clinico e fisico, valutazione dei livelli di CA125 e TC. A livello di studio, la PFS valutata con scansioni TC e i livelli di CA125 secondo le linee guida GCIG è stata moderatamente correlata con la S.O. in un sottogruppo di 6 studi.24,27,28,29,31,35 Tuttavia, il ruolo delle misurazioni del CA125 è controverso. Non è stato stabilito alcuno standard internazionale che porti alla variabilità nella calibrazione, nella progettazione dei saggi e nelle specificità dei reagenti,57 e il livello CA125 non è considerato un indicatore di progressione a sé stante.
Uno studio può essere visto come un outlier; lo studio tanomastat è stato interrotto dalla Bayer a causa di risultati negativi negli studi sul cancro del pancreas e del polmone a piccole cellule, con conseguente scarso follow-up per la S.O.23L’esclusione di questo processo ha portato ad una moderata associazione a livello di prova. Tuttavia, anche dopo l’esclusione di questa prova, la correlazione a livello di prova era al di sotto della soglia predefinita. Negli esperimenti per i quali non è stato possibile accedere all’IPD, non è stato riportato alcun effetto di trattamento statisticamente significativo sul sistema operativo. Come convalida esterna, abbiamo dimostrato che per quei 16 studi, l’effetto del trattamento osservato (OS HR) rientrava nell’intervallo previsto dal PFS HR, ma l’intervallo era troppo ampio per poter fare previsioni accurate sull’OS HR. Questi risultati non supportano quindi la PFS come sostituto della OS negli studi clinici randomizzati: dimostrare una riduzione della PFS HR non garantisce che si osserverà una riduzione del rischio di morte. Se si utilizza il PFS, i criteri GCIG potrebbero essere preferibili come mezzo di valutazione della progressione.
Precedente esplorazione della maternità surrogata negli studi di prima linea nei tumori ovarici da parte di Buyse4 ha trovato un’elevata correlazione, ma con 4 studi che sono stati suddivisi in sottounità per aumentare il numero di valutazioni dell’effetto del trattamento. Più recentemente, diversi autori58,59 ha trovato correlazioni da moderate ad alte a livello di prova(R2, 0,50-0,83) da statistiche sommarie estratte dalla letteratura. Tuttavia, a differenza dell’IPD, la meta-analisi basata sulla letteratura non consente il calcolo coerente dei punti finali o l’uso completo dei dati censurati per la sopravvivenza dopo i controlli di qualità; inoltre, la stima del modello di articolazione e quindi la contabilizzazione della PFS e della OS correlate misurate nello stesso paziente è insufficiente, portando a potenziali distorsioni.
La scelta della misura migliore per quantificare l’effetto del trattamento è controversa. Anche se l’HR è probabilmente la misura relativa più comunemente usata, la sua validità è limitata dal requisito di avere un rischio proporzionale (cioè che l’HR sia costante nel tempo). Tuttavia, nello studio clinico International Collaboration on Ovarian Neoplasm (ICON7),27 questo presupposto non valeva per il bevacizumab come trattamento di mantenimento. L’analisi primaria si basava quindi su una misura assoluta, la differenza nel tempo di sopravvivenza medio limitato tra i 2 bracci. La questione del valore della maternità surrogata dei tempi di sopravvivenza media limitata deve essere esplorata in ulteriori analisi.
Limitazioni
Il limite principale del nostro approccio è la mancanza di effetti terapeutici misurati con l’HR nelle prove raccolte. Infatti, la mancanza di eterogeneità negli effetti del trattamento limita fortemente la nostra capacità di rilevare un’associazione tra PFS HR e OS HR. La linea di regressione nella Figura 2 potrebbe essere stata stimata più precisamente se le HR fossero state distribuite su un ampio intervallo. Tuttavia, come mostrato dall’analisi di validazione, anche gli studi che non sono stati raccolti sono stati negativi e hanno seguito la stessa associazione tra PFS HR e OS HR; ulteriori studi non dovrebbero modificare fortemente le conclusioni ottenute da questo ampio campione. Il trattamento dei tumori ovarici è ben standardizzato, probabilmente grazie alla tradizione di forte collaborazione all’interno della GCIG e della Società Europea dei Gruppi di Sperimentazione Oncologica Ginecologica (ENGOT). La maggior parte degli studi hanno arruolato un gran numero di pazienti, erano multicentrici (e molti internazionali), condividevano lo stesso regime di controllo e raccoglievano variabili simili. Questo può spiegare la forte omogeneità dei risultati degli studi; questo supporta anche la generalizzabilità dei nostri risultati.
Un risultato sorprendente è rappresentato dagli effetti deludenti del trattamento misurati sul PFS e sull’OS. Questa analisi congiunta fornisce un utile punto di riferimento per le future sperimentazioni. Ci auguriamo che i recenti miglioramenti del PFS visti in uno studio sugli inibitori della polimerasi della poliadenosina difosfato ribosio ribosio60 si traducono in miglioramenti del sistema operativo. Finora, la combinazione di carboplatino e paclitaxel rimane la spina dorsale standard della chemioterapia per il trattamento di prima linea.
Conclusioni
La sopravvivenza libera da progressione non può essere convalidata come un rigoroso surrogato della S.O. per la valutazione degli effetti del trattamento in studi clinici randomizzati di prima linea per il trattamento dei tumori ovarici avanzati. I nostri risultati supportano la dichiarazione della GCIG Fifth Ovarian Cancer Consensus Conference secondo cui la S.O. è il punto finale primario preferito per gli studi clinici di prima linea con o senza componente di mantenimento,3 ma riconosciamo le sfide pratiche e il potenziale di fattori di confusione come il crossover e la lunga sopravvivenza post-progressione. La sopravvivenza senza progressione è un punto di arrivo primario alternativo, ma dato che non siamo stati in grado di convalidarla come surrogato della S.O., seguendo le linee guida della Food and Drug Administration statunitense e dell’Agenzia Europea per i Medicinali,61,62 dovrebbe rappresentare un’associazione favorevole rischio-beneficio con una grande entità dell’effetto o dovrebbe contribuire a ritardare la somministrazione di terapie più tossiche come trattamenti di seconda linea; pertanto, se si sceglie la PFS, la SOS deve essere misurata come punto finale secondario e la PFS deve essere supportata da punti finali aggiuntivi, come i risultati predefiniti dichiarati dal paziente, specialmente per la terapia di mantenimento.
References
- Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015; 136(5)DOI | PubMed
- Phase III trial of carboplatin and paclitaxel compared with cisplatin and paclitaxel in patients with optimally resected stage III ovarian cancer: a Gynecologic Oncology Group study. J Clin Oncol. 2003; 21(17):3194-3200. DOI | PubMed
- Harmonising clinical trials within the Gynecologic Cancer InterGroup: consensus and unmet needs from the Fifth Ovarian Cancer Consensus Conference. Ann Oncol. 2017; 28(suppl 8)DOI | PubMed
- Use of meta-analysis for the validation of surrogate endpoints and biomarkers in cancer trials. Cancer J. 2009; 15(5):421-425. DOI | PubMed
- Clinical use of cancer biomarkers in epithelial ovarian cancer: updated guidelines from the European Group on Tumor Markers. Int J Gynecol Cancer. 2016; 26(1):43-51. DOI | PubMed
- Definitions for response and progression in ovarian cancer clinical trials incorporating RECIST 1.1 and CA 125 agreed by the Gynecological Cancer Intergroup (GCIG). Int J Gynecol Cancer. 2011; 21(2):419-423. DOI | PubMed
- Preferred Reporting Items for Systematic Review and Meta-Analyses of individual participant data: the PRISMA-IPD Statement. JAMA. 2015; 313(16):1657-1665. DOI | PubMed
- The role of biostatistics in the prevention, detection and treatment of fraud in clinical trials. Stat Med. 1999; 18(24):3435-3451. DOI | PubMed
- Practical methodology of meta-analyses (overviews) using updated individual patient data. Stat Med. 1995; 14(19):2057-2079. DOI | PubMed
- Quantifying heterogeneity in a meta-analysis. Stat Med. 2002; 21(11):1539-1558. DOI | PubMed
- Comparisons between different polychemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100,000 women in 123 randomised trials. Lancet. 2012; 379(9814):432-444. DOI | PubMed
- The validation of surrogate endpoints in meta-analyses of randomized experiments. Biostatistics. 2000; 1(1):49-67. DOI | PubMed
- The Evaluation of Surrogate Endpoints. Springer: New York, NY.
- Individual- and trial-level surrogacy in colorectal cancer. Stat Methods Med Res. 2008; 17(5):467-475. DOI | PubMed
- Surrogate endpoints for overall survival in chemotherapy and radiotherapy trials in operable and locally advanced lung cancer: a re-analysis of meta-analyses of individual patients’ data. Lancet Oncol. 2013; 14(7):619-626. DOI | PubMed
- Thirty-month complete response as a surrogate end point in first-line follicular lymphoma therapy: an individual patient-level analysis of multiple randomized trials. J Clin Oncol. 2017; 35(5):552-560. DOI | PubMed
- Validation of minimal residual disease as surrogate endpoint for event-free survival in childhood acute lymphoblastic leukemia. J Natl Cancer Inst Cancer Spectr. 2018; 2(4)DOI | PubMed
- Extracting summary statistics to perform meta-analyses of the published literature for survival endpoints. Stat Med. 1998; 17(24):2815-2834. DOI | PubMed
- surrosurv: an R package for the evaluation of failure time surrogate endpoints in individual patient data meta-analyses of randomized clinical trials. Comput Methods Programs Biomed. 2018; 155:189-198. DOI | PubMed
- Carboplatin and paclitaxel versus cisplatin, paclitaxel and doxorubicin for first-line chemotherapy of advanced ovarian cancer: a Hellenic Cooperative Oncology Group (HeCOG) study. Eur J Cancer. 2008; 44(15):2169-2177. DOI | PubMed
- A multicenter, randomized trial of flat dosing versus intrapatient dose escalation of single-agent carboplatin as first-line chemotherapy for advanced ovarian cancer: an SGCTG (SCOTROC 4) and ANZGOG study on behalf of GCIG. Ann Oncol. 2013; 24(3):679-687. DOI | PubMed
- A phase II randomised clinical trial comparing cisplatin, paclitaxel and ifosfamide with cisplatin, paclitaxel and epirubicin in newly diagnosed advanced epithelial ovarian cancer: long-term survival analysis. Br J Cancer. 2008; 98(4):720-727. DOI | PubMed
- A phase III randomized trial of BAY 12-9566 (tanomastat) as maintenance therapy in patients with advanced ovarian cancer responsive to primary surgery and paclitaxel/platinum containing chemotherapy: a National Cancer Institute of Canada Clinical Trials Group Study. Gynecol Oncol. 2006; 102(2):300-308. DOI | PubMed
- Advanced ovarian cancer: phase III randomized study of sequential cisplatin-topotecan and carboplatin-paclitaxel vs carboplatin-paclitaxel. J Natl Cancer Inst. 2010; 102(20):1547-1556. DOI | PubMed
- Long-term results of dose-dense paclitaxel and carboplatin versus conventional paclitaxel and carboplatin for treatment of advanced epithelial ovarian, fallopian tube, or primary peritoneal cancer (JGOG 3016): a randomised, controlled, open-label trial. Lancet Oncol. 2013; 14(10):1020-1026. DOI | PubMed
- First-line treatment of advanced ovarian cancer with paclitaxel/carboplatin with or without epirubicin (TEC versus TC): a gynecologic cancer intergroup study of the NSGO, EORTC GCG and NCIC CTG. Ann Oncol. 2012; 23(10):2613-2619. DOI | PubMed
- Standard chemotherapy with or without bevacizumab for women with newly diagnosed ovarian cancer (ICON7): overall survival results of a phase 3 randomised trial. Lancet Oncol. 2015; 16(8):928-936. DOI | PubMed
- Carboplatin plus paclitaxel versus carboplatin plus pegylated liposomal doxorubicin as first-line treatment for patients with ovarian cancer: the MITO-2 randomized phase III trial. J Clin Oncol. 2011; 29(27):3628-3635. DOI | PubMed
- Carboplatin plus paclitaxel once a week versus every 3 weeks in patients with advanced ovarian cancer (MITO-7): a randomised, multicentre, open-label, phase 3 trial. Lancet Oncol. 2014; 15(4):396-405. DOI | PubMed
- Intensified dose of cyclophosphamide with G-CSF support versus standard dose combined with platinum in first-line treatment of advanced ovarian cancer: a randomised study from the GINECO group. Br J Cancer. 2007; 97(9):1200-1205. DOI | PubMed
- A randomized phase II study investigating the addition of the specific COX-2 inhibitor celecoxib to docetaxel plus carboplatin as first-line chemotherapy for stage IC to IV epithelial ovarian cancer, fallopian tube or primary peritoneal carcinomas: the DoCaCel study. Ann Oncol. 2012; 23(11):2896-2902. DOI | PubMed
- Randomized phase III trial of irinotecan plus cisplatin compared with paclitaxel plus carboplatin as first-line chemotherapy for ovarian clear cell carcinoma: JGOG3017/GCIG trial. J Clin Oncol. 2016; 34(24):2881-2887. DOI | PubMed
- Long-term results of a randomised phase III trial of weekly versus three-weekly paclitaxel/platinum induction therapy followed by standard or extended three-weekly paclitaxel/platinum in European patients with advanced epithelial ovarian cancer. Eur J Cancer. 2014; 50(15):2592-2601. DOI | PubMed
- Randomized phase III study of erlotinib versus observation in patients with no evidence of disease progression after first-line platin-based chemotherapy for ovarian carcinoma: a European Organisation for Research and Treatment of Cancer-Gynaecological Cancer Group, and Gynecologic Cancer Intergroup study. J Clin Oncol. 2014; 32(4):320-326. DOI | PubMed
- A randomized phase III trial of IV carboplatin and paclitaxel ×3 courses followed by observation versus weekly maintenance low-dose paclitaxel in patients with early-stage ovarian carcinoma: a Gynecologic Oncology Group Study. Gynecol Oncol. 2011; 122(1):89-94. DOI | PubMed
- Phase III randomized trial of docetaxel-carboplatin versus paclitaxel-carboplatin as first-line chemotherapy for ovarian carcinoma. J Natl Cancer Inst. 2004; 96(22):1682-1691. DOI | PubMed
- Incorporation of bevacizumab in the primary treatment of ovarian cancer. N Engl J Med. 2011; 365(26):2473-2483. DOI | PubMed
- Phase III trial of carboplatin plus paclitaxel with or without gemcitabine in first-line treatment of epithelial ovarian cancer. J Clin Oncol. 2010; 28(27):4162-4169. DOI | PubMed
- Paclitaxel/carboplatin versus topotecan/paclitaxel/carboplatin in patients with FIGO suboptimally resected stage III-IV epithelial ovarian cancer: a multicenter, randomized study. Eur J Cancer. 2010; 46(16):2905-2912. DOI | PubMed
- Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a phase III trial of the Gynecologic Cancer Intergroup. J Clin Oncol. 2009; 27(9):1419-1425. DOI | PubMed
- Phase III study of valspodar (PSC 833) combined with paclitaxel and carboplatin compared with paclitaxel and carboplatin alone in patients with stage IV or suboptimally debulked stage III epithelial ovarian cancer or primary peritoneal cancer. J Clin Oncol. 2008; 26(16):2674-2682. DOI | PubMed
- Addition of epirubicin as a third drug to carboplatin-paclitaxel in first-line treatment of advanced ovarian cancer: a prospectively randomized gynecologic cancer intergroup trial by the Arbeitsgemeinschaft Gynaekologische Onkologie Ovarian Cancer Study Group and the Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens. J Clin Oncol. 2006; 24(7):1127-1135. DOI | PubMed
- Incorporation of pazopanib in maintenance therapy of ovarian cancer. J Clin Oncol. 2014; 32(30):3374-3382. DOI | PubMed
- A randomized phase II trial of maintenance therapy with sorafenib in front-line ovarian carcinoma. Gynecol Oncol. 2013; 130(1):25-30. DOI | PubMed
- Randomized, phase II, placebo-controlled, double-blind study with and without enzastaurin in combination with paclitaxel and carboplatin as first-line treatment followed by maintenance treatment in advanced ovarian cancer. J Clin Oncol. 2013; 31(25):3127-3132. DOI | PubMed
- Randomized phase II trial of carboplatin and paclitaxel with or without lonafarnib in first-line treatment of epithelial ovarian cancer stage IIB-IV. Gynecol Oncol. 2012; 126(2):236-240. DOI | PubMed
- Phase III trial of observation versus six courses of paclitaxel in patients with advanced epithelial ovarian cancer in complete response after six courses of paclitaxel/platinum-based chemotherapy: final results of the After-6 protocol 1. J Clin Oncol. 2009; 27(28):4642-4648. DOI | PubMed
- Randomized phase III trial of topotecan following carboplatin and paclitaxel in first-line treatment of advanced ovarian cancer: a gynecologic cancer intergroup trial of the AGO-OVAR and GINECO. J Natl Cancer Inst. 2006; 98(15):1036-1045. DOI | PubMed
- Impact on survival of 12 versus 3 monthly cycles of paclitaxel (175 mg/m2) administered to patients with advanced ovarian cancer who attained a complete response to primary platinum-paclitaxel: follow-up of a SWOG and GOG phase 3 trial. Gynecol Oncol. 2009; 114(2):195-198. DOI | PubMed
- Phase III trial of induction gemcitabine or paclitaxel plus carboplatin followed by paclitaxel consolidation in ovarian cancer. Gynecol Oncol. 2011; 123(3):479-485. DOI | PubMed
- Standard first-line chemotherapy with or without nintedanib for advanced ovarian cancer (AGO-OVAR 12): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet Oncol. 2016; 17(1):78-89. DOI | PubMed
- Abagovomab as maintenance therapy in patients with epithelial ovarian cancer: a phase III trial of the AGO OVAR, COGI, GINECO, and GEICO—the MIMOSA study. J Clin Oncol. 2013; 31(12):1554-1561. DOI | PubMed
- A phase III randomized study comparing paclitaxel and cisplatin versus cyclophosphamide and cisplatin in patients with advanced ovarian cancer. Anticancer Res. 2007; 27(1B):681-685. Publisher Full Text | PubMed
- Paclitaxel/carboplatin with or without sorafenib in the first-line treatment of patients with stage III/IV epithelial ovarian cancer: a randomized phase II study of the Sarah Cannon Research Institute. Cancer Med. 2015; 4(5):673-681. DOI | PubMed
- Topotecan compared with no therapy after response to surgery and carboplatin/paclitaxel in patients with ovarian cancer: Multicenter Italian Trials in Ovarian Cancer (MITO-1) randomized study. J Clin Oncol. 2004; 22(13):2635-2642. DOI | PubMed
- Long-term survival in a randomized study of nonplatinum therapy versus platinum in advanced epithelial ovarian cancer. Int J Gynecol Cancer. 2007; 17(5):986-992. DOI | PubMed
- National Academy of Clinical Biochemistry laboratory medicine practice guidelines for use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers. Clin Chem. 2008; 54(12):e11-e79. DOI | PubMed
- Correlation of progression-free and post-progression survival with overall survival in phase III trials of first-line chemotherapy for advanced epithelial ovarian cancer. Eur J Gynaecol Oncol. 2015; 36(4):370-375. DOI | PubMed
- Trial-level analysis of progression-free survival and response rate as end points of trials of first-line chemotherapy in advanced ovarian cancer. Med Oncol. 2017; 34(5):87. DOI | PubMed
- Niraparib in patients with newly diagnosed advanced ovarian cancer [published online September 28, 2019]. N Engl J Med.DOI | PubMed
- 2018. Publisher Full Text
- Publisher Full Text
Fonte
Paoletti X, Lewsley L, Daniele G, Cook A, Yanaihara N, et al. (2020) Assessment of Progression-Free Survival as a Surrogate End Point of Overall Survival in First-Line Treatment of Ovarian Cancer. JAMA Network Open 3(1): e1918939. https://doi.org/10.1001/jamanetworkopen.2019.18939





