Introduzione
Il cancro al seno post-partum (PPBC), precedentemente definito come diagnosi di cancro al seno entro 5 anni dall’ultimo parto, ha un rischio di metastasi e di morte circa 3 volte maggiore.1,2,3 Questo rischio è specifico per i pazienti con cancro diagnosticato post partum, poiché le donne con cancro diagnosticato durante la gravidanza hanno una prognosi paragonabile a quella delle pazienti nullipare.1,4 L’alto rischio di metastasi è indipendente da indicatori prognostici insufficienti, tra cui sottotipo biologico, stadio, età o anno di diagnosi.1,2,3,5,6,7 Tuttavia, il PPBC è un sottoinsieme sotto riconosciuto del cancro al seno e pochi studi affrontano l’alto rischio associato di metastasi.8 Di conseguenza, mancano strategie per identificare le giovani donne con il cancro al seno più a rischio e per sviluppare opzioni di trattamento mirate.8
L’involuzione del seno è un evento biologico che si verifica dopo il parto e può spiegare l’aumento del rischio di metastasi di PPBC. Dopo l’allattamento o dopo il parto in assenza di allattamento, il seno subisce un processo di morte cellulare mediato da un robusto rimodellamento dei tessuti.9,10 Durante questo evento fisiologico, la ghiandola mammaria del roditore mostra un aumento dell’afflusso di cellule immunitarie,11,12,13 rimodellamento della matrice extracellulare,14,15 e linfangiogenesi16-eventi coerenti con la guarigione della ferita. Nei modelli di roditori, l’involuzione post-partum è sufficiente per aumentare l’invasione tumorale e le metastasi.15,16,17 Da queste osservazioni è stata proposta l’ipotesi dell’involuzione, affermando che il processo di guarigione fisiologicamente regolato dell’involuzione aumenta l’efficienza metastatica.18 A sostegno di questa ipotesi, il seno umano post-partum presenta anche un afflusso di cellule immunitarie,11,19 un modello di matrice extracellulare che guarisce le ferite e la linfangiogenesi.16 Inoltre, in 1 piccolo studio, PPBC diagnosticato entro 2 anni dal parto aveva aumentato il coinvolgimento dei linfonodi (LN) indipendentemente dalle dimensioni del tumore.16 Dati i dati che implicano l’involuzione post-partum nella promozione delle metastasi di PPBC, è importante definire la durata della finestra per l’aumento del rischio metastatico e il contributo degli attributi clinici noti.
Valutare se il rischio di aumento delle metastasi di PPBC si estende ai pazienti diagnosticati oltre 5 anni dopo il parto e indagare se l’aumento della proliferazione delle cellule tumorali, l’aumento dell’invasione linfovascolare (LVI), il coinvolgimento LN o altri attributi clinici di PPBC sono correlati al rischio di metastasi in questa popolazione di pazienti. A tal fine, abbiamo condotto uno studio di coorte utilizzando la Coorte del cancro al seno delle giovani donne del Colorado, che comprende donne con tumore al seno diagnosticato all’età di 45 anni o più giovani con ampi dati clinici e di parità.
Metodi
Studiare la popolazione
Questo studio comprendeva donne della Colorado Young Women’s Breast Cancer Cohort che sono state reclutate in prospettiva tra il 1° gennaio 2004 e il 31 dicembre 2014, o identificate retrospettivamente dal 1° gennaio 1981 al 31 dicembre 2004. Le donne erano eleggibili se avevano 45 anni o meno alla diagnosi, avevano dati di parità completi, avevano completato il follow-up per metastasi a distanza e avevano ricevuto un trattamento definitivo del tumore con intento curativo (N = 802).
Lo studio è stato eseguito in conformità con l’approvazione del comitato di revisione istituzionale da parte delle 2 istituzioni partecipanti: l’Università del Colorado Anschutz Medical Center, Aurora, che è un’istituzione accademica di assistenza terziaria con un’ampia base di riferimento dalla grande area delle Montagne Rocciose, e la sua affiliata, Vail Health Hospital, Vail, Colorado, che è un centro oncologico rurale, basato sulla comunità. Le donne che hanno partecipato alla sperimentazione clinica dal 2004 al 2014 hanno fornito il loro consenso informato scritto. Quelle nella parte retrospettiva dello studio dal 1981 al 2004 erano esenti dalla legge sulla portabilità e la responsabilità dell’assicurazione sanitaria e dal consenso con l’approvazione del comitato di revisione istituzionale. Non c’è stato alcun compenso finanziario. Questo studio ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE).
Le metastasi a distanza sono state definite come l’identificazione di metastasi ad organi al di fuori del seno omolaterale e di LN locali drenanti a seguito di una diagnosi primaria di cancro al seno determinata mediante imaging radiologico, esame fisico e/o conferma patologica. I partecipanti senza alcuna evidenza di una recidiva a distanza alla fine del follow-up sono stati censurati alla data dell’ultimo contatto. Le partecipanti con una diagnosi di cancro allo stadio IV, con dati mancanti sullo stadio del cancro o sull’anno della diagnosi, o che erano incinte al momento della diagnosi sono state escluse dall’analisi a distanza senza metastasi (ad eccezione di quanto indicato nella figura 1 del supplemento ), con il risultato di 701 partecipanti per l’analisi primaria del cancro al seno di giovani donne giovani. Per le analisi classificate in base allo stato dei recettori degli estrogeni (ER), sono stati esclusi i casi senza dati sui recettori ormonali, con il risultato di 515 partecipanti. Per le analisi Ki67, sono state inizialmente incluse le partecipanti con tessuto disponibile (n = 351); di queste, sono state escluse le donne con dimensioni del tumore sconosciute o anno di diagnosi, con il risultato di 272 partecipanti.
Sono state valutate le pazienti nullipare, definite come donne che non hanno mai avuto un parto completo (n==217). Sono state incluse le donne nullipare con una gravidanza incompleta (62 su 217 [28,6%] di tutte le pazienti nullipare) perché una prevista preanalisi dei dati non ha suggerito alcuna associazione tra una gravidanza incompleta e la sopravvivenza senza metastasi a distanza (MFS) (eFigure 2 nel supplemento ). Le partecipanti sono state identificate come persone che hanno avuto una gravidanza incompleta se la loro storia ginecologica era GXP0, dove X potrebbe essere un numero qualsiasi, che rappresenta una gravidanza precedente (gravidità [G]) di numero X senza parto precedente (parità [P]). Le informazioni sulla durata della gravidanza prima della perdita e sul metodo di perdita (spontanea, terapeutica o aborto spontaneo nel trimestre successivo) non erano disponibili di routine.
I pazienti affetti da cancro sono stati definiti come quelli con cancro in base al tempo dall’ultima nascita alla diagnosi e classificati come PPBC diagnosticati entro 5 anni (n=175), tra 5 e meno di 10 anni (n=153), o tra 10 anni o più (n=156) dopo il parto. Per alcune analisi, i PPBC diagnosticati entro 5 anni e in 5 a meno di 10 anni sono stati combinati in un unico gruppo di PPBC a meno di 10 anni (n=328) perché il rischio di metastasi è altrettanto elevato in entrambi i gruppi e per aumentare le dimensioni del campione per le analisi statistiche. Il follow-up medio è stato di 5,6 anni (range, 0-29,8 anni). I pazienti che non avevano alcuna evidenza di MFS a distanza alla fine del follow-up sono stati censurati al momento dell’ultimo contatto.
Punti finali
Il punto finale primario dell’analisi era la MFS a distanza, definita come la durata del tempo che intercorre tra la diagnosi e l’individuazione della malattia metastatica o della morte, a seconda di quale si è verificata per prima. Poiché la morte senza metastasi era rara in questa popolazione di pazienti, le metastasi a distanza rappresentavano quasi tutti gli eventi di interesse. Le metastasi a distanza sono state considerate presenti se l’evidenza definitiva di metastasi agli organi oltre il seno omolaterale e l’LN drenante locale è stata identificata mediante imaging radiologico, esame fisico e/o conferma dei risultati di test patologici dopo una diagnosi primaria di cancro al seno.
I punti finali secondari predeterminati includevano MFS a distanza nei sottotipi di parità come influenzati dallo stadio, dalle dimensioni del tumore, dal coinvolgimento LN, LVI, sottotipo biologico del tumore e dall’indice di etichettatura Ki67. Per l’analisi Ki67, il tessuto tumorale è stato raccolto dal sito primario del seno al momento della chirurgia definitiva o mediante biopsia del nucleo prima della chemioterapia neoadiuvante. Lo stato dei linfonodi è stato determinato dalle linee guida dell’American Joint Committee on Cancer Guidelines.20 L’invasione linfovascolare è stata identificata mediante il rapporto di un test patologico o la revisione patologica dei vetrini del caso da parte di un patologo. I dati di follow-up sono stati ottenuti dalla revisione della cartella clinica e dall’uso dei dati del Colorado Tumor Registry per confermare le date di metastasi, morte e ultimo contatto.
Immunoistochimica
La colorazione immunoistochimica (IHC) per Ki67 (1:400; Clone SP6; Thermo Fisher Scientific) o pan-citocheratina (1:500; Z0622; Dako) è stata eseguita come descritto in precedenza.15 I campioni di controllo positivo (tonsille, milza e tessuto mammario) (eFigure 3A nel supplemento) e i controlli negativi secondari sono stati inclusi in tutte le serie di colorazione IHC. Per confermare che i casi con meno del 5% di colorazione Ki67 non hanno avuto perdita di antigenicità a causa di protocolli di fissazione variabili, i pazienti senza alcun segnale IHC positivo precedente avevano integrità antigenica confermata utilizzando la pan-citocheratina (eFigure 3B nel supplemento).
Annotazione dei tessuti e quantificazione IHC
Tutte le analisi IHC sono state effettuate in cieco e supervisionate da un patologo come descritto in precedenza.19 Un set di test è stato utilizzato per confermare la concordanza tra i revisori. L’analisi del Ki67 si è basata sulle linee guida proposte dal gruppo di lavoro internazionale Ki-67 sul cancro al seno.21 In breve, un minimo di 1000 cellule tumorali per tumore sono state annotate e valutate. Un segnale di soglia inferiore al 14% o 14% o più indice di etichettatura Ki67 è stato utilizzato per assegnare soglie basse vs alte e sottotipo biologico ai tumori come luminale A (bassa) e luminale B (alta).
Analisi statistica
Per testare le differenze intergruppo, χ 2, Fisher esatto, analisi a 1 via di varianza, Kruskal-Wallis, o analisi a 2 vie di test di varianza sono stati utilizzati. Il metodo Kaplan-Meier è stato applicato per stimare le probabilità MFS a distanza. Sono stati eseguiti test di log-rank per valutare le differenze tra le probabilità MFS tra i gruppi. Sono stati utilizzati modelli di additivi generalizzati per valutare l’adeguatezza della categorizzazione PPBC. L’analisi di regressione dei pericoli proporzionale Cox multivariabile è stata eseguita per determinare i fattori di rischio associati a MFS. Sono stati stimati i rapporti di rischio (HR) e i loro IC al 95%. I fattori considerati nell’analisi complessiva comprendevano il sottotipo biologico, lo stadio, l’età del paziente e l’anno della diagnosi. L’ipotesi di rischio proporzionale è stata esaminata graficamente utilizzando le analisi residue proposte da Lin et al.22 Per le successive analisi classificate in base alla fase, sono stati corretti solo il sottotipo biologico, l’età e l’anno della diagnosi.
Per il confronto tra i gruppi nulliparo e PPBC a meno di 10 anni classificati in base allo stato di ER, abbiamo adattato per lo stadio, l’età e l’anno della diagnosi. Per le analisi stratificate dalla positività Ki67, abbiamo adattato per lo stadio, l’età e l’anno della diagnosi. Le curve di sopravvivenza corrette sono state generate stimando le probabilità predittive individuali utilizzando il modello di regressione dei pericoli proporzionali di Cox e calcolando le probabilità previste per gruppo di parità.
I dati dei pazienti sono stati raccolti e gestiti utilizzando REDCap. Le analisi statistiche sono state eseguite utilizzando il software Prism 7 (GraphPad) o SAS, versione 9.4 (SAS Institute Inc), e le analisi sono state condotte dal 1° luglio al 30 settembre 2017. Un valore P su due lati inferiore a .05 è stato considerato statisticamente significativo.
Risultati
Rischio di metastasi analizzato in base allo stato di parità
Il set di analisi finale comprendeva 701 partecipanti con tumore al seno di stadio I, II e III nella coorte del cancro al seno delle giovani donne del Colorado; l’età media (SD) era di 37,9 (5,1) anni. I dati clinici, demografici e di trattamento, stratificati in base allo stato di parità, sono riassunti nella Tabella. Abbiamo prima confrontato le MFS a distanza tra i nulliparosi, la PPBC a meno di 5 anni, la PPBC a meno di 10 anni e la PPBC dopo 10 o più gruppi di anni. I pazienti con PPBC a meno di 5 anni e in 5 o meno di 10 anni hanno mostrato un rischio di metastasi più che raddoppiato rispetto ai pazienti nulliparo (HR, 2,13; 95% CI, 1,21-3.74; P=.009 per PPBC <5 anni; HR, 2.23; 95% CI, 1.26-3.93; P=.006 per PPBC da 5 a <10 anni, analisi univariata) (Figura 1A e eTable 1 nelsupplemento). I pazienti con PPBC dopo 10 o più anni avevano un rischio intermedio di metastasi che non raggiungeva la significatività statistica (HR, 1,6; 95% CI, 0,87-2,81; P==.13, analisi univariata) (Figura 1Ae eTable1 nel supplemento) . Dopo l’adeguamento per sottotipo biologico, età e anno di diagnosi, l’aumento del rischio di metastasi nel gruppo PPBC meno di 5 anni (HR, 1,53; 95% CI, 0,85-2,75; P==.16, regressione di Cox) e da 5 a meno di 10 anni (HR, 2.0; 95% CI, 1.10-3.59; P==.02, regressione dei pericoli proporzionali di Cox) (Figura 1Be eTable1 nel supplemento ) non hanno più una rilevanza statistica.
| Caratteristica | N. (%) | P Valore | |||
|---|---|---|---|---|---|
| Nulliparo (n = 217) | PPBC <5 y (n==175) | PPBC da 5 a <10 y (n=153) | PPBC ≥10 y (n = 156) | ||
| Età alla diagnosi, media (SD), y | 36.9 (5.2) | 35.5 (5.1) | 38.5 (4.6) | 41.3 (3.2) | <.001a |
| Sottotipo biologico | |||||
| Luminale A (ER+, PR+, Her2-) | 84 (38.7) | 74 (42.3) | 70 (45.8) | 61 (39.1) | .66b |
| Luminale B (ER+, PR±, Her2+) | 34 (15.7) | 22 (12.6) | 21 (13.7) | 21 (13.5) | |
| Her2+ (ER-, PR-) | 16 (7.4) | 15 (8.6) | 13 (8.5) | 11 (7.1) | |
| Triplo negativo (ER-, PR-, Her2-) | 32 (14.7) | 35 (20.0) | 17 (11.1) | 28 (17.9) | |
| Manca Her2 | 38 (17.5) | 20 (11.4) | 16 (10.5) | 27 (17.3) | |
| ER o PR mancanti | 2 (0.9) | 2 (1.1) | 3 (2.0) | 0 | |
| Altro | 11 (5.1) | 7 (4.0) | 13 (8.5) | 8 (5.1) | |
| Stato degli estrogeni | |||||
| ER+ | 142 (65.4) | 114 (65.1) | 104 (68.0) | 97 (62.2) | .78b |
| ER- | 62 (28.6) | 53 (30.3) | 40 (26.1) | 53 (34.0) | |
| Manca | 13 (5.6) | 8 (4.6) | 9 (5.9) | 6 (3.8) | |
| Grado istologico | |||||
| Grado I | 25 (11.5) | 11 (6.3) | 14 (9.2) | 22 (14.1) | .08b |
| Grado II | 70 (32.3) | 51 (29.1) | 55 (36.0) | 61 (39.1) | |
| Grado III | 104 (47.9) | 96 (54.9) | 73 (47.7) | 57 (36.5) | |
| Manca | 18 (8.3) | 17 (9.7) | 11 (7.2) | 16 (10.3) | |
| Dimensione del tumore | |||||
| DCIS | 0 | 1 (0.6)c | 0 | 0 | .42b |
| da 0,1 a ≤2,0 cm | 110 (50.7) | 85 (48.6) | 63 (41.2) | 75 (48.1) | |
| >2,0 a ≤5,0 cm | 69 (31.8) | 57 (32.6) | 56 (36.6) | 54 (34.6) | |
| >5,0 cm | 17 (7.8) | 17 (9.7) | 19 (12.4) | 20 (12.8) | |
| Manca | 21 (9.7) | 15 (8.6) | 15 (9.8) | 7 (4.5) | |
| Fase | |||||
| I | 87 (40.1) | 46 (26.3) | 46 (30.1) | 52 (33.3) | .01b |
| II | 98 (45.2) | 91 (52.0) | 66 (43.1) | 64 (41.0) | |
| III | 32 (14.7) | 38 (21.7) | 41 (26.8) | 40 (25.6) | |
| Anno di diagnosi | |||||
| 1980-1998 | 45 (20.7) | 30 (17.1) | 19 (12.4) | 50 (32.1) | <.001b |
| 1999-2004 | 62 (28.6) | 32 (18.3) | 48 (31.4) | 40 (25.6) | |
| 2005-2014 | 110 (50.7) | 113 (64.6) | 86 (56.2) | 66 (42.3) | |
| IMC, medio (SD) | 25.0 (6.9) | 26.1 (6.0) | 26.0 (6.0) | 26.7 (7.0) | .03a |
| Chemioterapia | |||||
| Sì | 136 (62.7) | 132 (75.4) | 100 (65.4) | 93 (59.6) | .02b |
| No | 38 (17.5) | 15 (8.6) | 25 (16.3) | 22 (14.1) | |
| Manca | 43 (19.8) | 28 (16.0) | 28 (18.3) | 41 (26.3) | |
| Radioterapia | |||||
| Sì | 99 (45.6) | 76 (43.4) | 74 (48.4) | 57 (36.5) | .39b |
| No | 55 (25.3) | 45 (25.7) | 31 (20.3) | 41 (26.3) | |
| Manca | 63 (29.0) | 54 (30.9) | 48 (31.4) | 58 (37.2) | |
| Pazienti con metastasi | 22 (10.1) | 29 (16.6) | 28 (18.3) | 24 (15.4) | .09b |
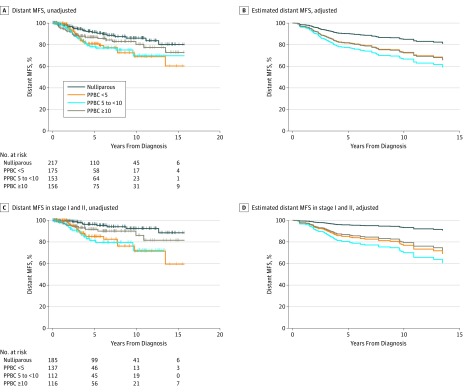
Figura 1.Figura 1. Rischio di metastasi nelle giovani donne della coorte del cancro al seno delle giovani donne del ColoradoA, Sopravvivenza senza metastasi a distanza non regolata (MFS) (log rank test, P==.02) (eTabella 1 nel supplemento). B, MFS a distanza regolata per stadio, età, anno di diagnosi e sottotipo biologico del tumore. C, MFS a distanza non regolata in donne con tumore allo stadio I o II. D, MFS a distanza nelle donne con tumore allo stadio I o II, adattate per l’età, l’anno di diagnosi e il sottotipo biologico del tumore. PPBC <5 indica il cancro al seno post-partum (PPBC) entro 5 anni dal parto; PPBC da 5 a <10, PPBC da 5 a meno di 10 anni dopo il parto; e PPBC ≥10, PPBC dopo 10 o più anni dal parto. I pannelli B e D mostrano i valori stimati dai modelli di regressione dei pericoli proporzionali Cox corretti; pertanto, includere il numero a rischio non è appropriato.
Abbiamo poi valutato i MFS distanti tra i gruppi di parità classificati per stadio(Figura 1Ce D e eTable 1 nel supplemento). L’analisi dei pazienti con tumore in stadio I e II (n = 550) ha rivelato che i pazienti con PPBC a meno di 5 anni e in 5 a meno di 10 anni erano a rischio significativamente maggiore di metastasi rispetto ai pazienti nulliparo, anche dopo l’adattamento per sottotipo biologico, età e anno di diagnosi (HR, 3.5; 95% CI, 1.56-7.89; P=.002; e HR, 5.2; 95% CI, 2.26-11.82; P<.001; regressione dei pericoli proporzionali di Cox) (Figura 1D e eTable 1nelsupplemento). Al contrario, i pazienti con cancro di stadio III (n==151) hanno mostrato un alto rischio di metastasi indipendentemente dallo stato di parità (P>.05, regressione proporzionale dei pericoli Cox per tutti i confronti), per esempio, 44 vs 58 recidive metastatiche in donne ER-positive, nullipare contro quelle con PPBC a meno di 10 anni a 5 anni di follow-up (eTable 1 nel Supplemento).

Figura 1.Rischio di metastasi nelle giovani donne della coorte del cancro al seno delle giovani donne del ColoradoA, Sopravvivenza senza metastasi a distanza non regolata (MFS) (log rank test, P==.02) (eTabella 1 nel supplemento). B, MFS a distanza regolata per stadio, età, anno di diagnosi e sottotipo biologico del tumore. C, MFS a distanza non regolata in donne con tumore allo stadio I o II. D, MFS a distanza nelle donne con tumore allo stadio I o II, adattate per età, anno di diagnosi e sottotipo biologico del tumore. PPBC <5 indica il cancro al seno post-partum (PPBC) entro 5 anni dal parto; PPBC da 5 a <10, PPBC da 5 a meno di 10 anni dopo il parto; e PPBC ≥10, PPBC dopo 10 o più anni dal parto. I pannelli B e D mostrano i valori stimati dai modelli di regressione dei pericoli proporzionali Cox corretti; pertanto, includere il numero a rischio non è appropriato.
Valutazione dei fattori di rischio clinico noti nella PPBC
Abbiamo poi valutato il sottotipo biologico, lo stadio tumorale e le dimensioni del tumore tra i gruppi(Figura 2Ae B e eFigure 4A e B nel supplemento) e non abbiamo osservato differenze significative. Ad esempio, il tumore al seno allo stadio I e II rappresentava l’85,3% dei nulliparo, il 78,3% dei PPBC in meno di 5 anni e il 73,2% dei PPBC in casi da 5 a 10 anni. Così, abbiamo valutato la frequenza del coinvolgimento di LVI e LN come potenziali spiegazioni per l’aumento delle metastasi nella PPBC, come stimato dai nostri modelli preclinici.16 Nel complesso, i pazienti con PPBC in 5 a meno di 10 anni avevano una LVI più alta e i pazienti con PPBC a meno di 5 anni mostravano un aumento della malattia LN-positiva alla diagnosi (χ 2 test) (Figura 2Ce D). Coerentemente con l’aumento delle diagnosi LN-positive, i pazienti classificati come con PPBC a meno di 5 anni hanno ricevuto più chemioterapia del gruppo nulliparo (75,4% vs 62,7%, rispettivamente; P=.007, χ 2 test) (eFigure 4C nel supplemento e nella tabella).
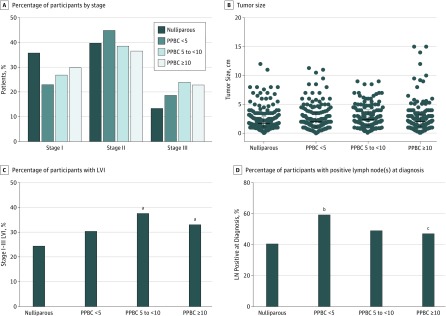
Figura 2.Invasione linfovascolare (LVI) e linfonodo (LN) Coinvolgimento valutato dai gruppi di paritàA, Stadio di malattia alla diagnosi in pazienti con malattia di stadio I-III, classificati per gruppo di parità (analisi a 2 vie della varianza [ANOVA], test di confronto multiplo Tukey); la dimensione del campione è disponibile nella Tabella. B, Dimensione del tumore alla diagnosi classificata per gruppo di parità (ANOVA a 1 via, test di confronto multiplo Tukey); le barre di errore indicano la mediana (intervallo interquartile); la dimensione del campione è disponibile nella Tabella. C, Percentuale di pazienti con tumore di stadio I-III che presentano un LVI (χ 2 test). Le dimensioni del campione sono risultate nullipare: 101 LVI negative (LVI-), 53 LVI positive (LVI+) e 67 sconosciute; cancro al seno post-partum (PPBC) entro 5 anni (PPBC <5): 73 LVI-, 53 LVI+, e 51 sconosciuto; PPBC entro 5 a meno di 10 anni (PPBC da 5 a <10): 63 LVI-, 57 LVI+, e 33 sconosciuto; PPBC dopo 10 anni o più (PPBC ≥10): 76 LVI-, 51 LVI+, e 29 sconosciuto. D, Percentuale di pazienti con tumore in stadio I-III diagnosticato con malattia LN+ (χ 2 test). Le dimensioni del campione erano nullipare, 130 LN- e 86 LN+; PPBC <5: 72 LN- e 102 LN+; PPBC da 5 a <10: 78 LN- e 73 LN+; PPBC ≥10: 82 LN- e 71 LN+.aP<<0,05 rispetto ai pazienti nulliparo.bP;001 rispetto ai pazienti nulliparo.cP;.05 rispetto al gruppo PPBC <5.

Figura 2.Figura 2. Invasione linfovascolare (LVI) e linfonodo (LN) Coinvolgimento valutato dai gruppi di paritàA, Stadio di malattia alla diagnosi in pazienti con malattia di stadio I-III, classificati per gruppo di parità (analisi a 2 vie della varianza [ANOVA], test di confronto multiplo Tukey); la dimensione del campione è disponibile nella Tabella. B, Dimensione del tumore alla diagnosi classificata per gruppo di parità (ANOVA a 1 via, test di confronto multiplo Tukey); le barre di errore indicano la mediana (intervallo interquartile); la dimensione del campione è disponibile nella Tabella. C, Percentuale di pazienti con tumore di stadio I-III che presentano un LVI (χ 2 test). Le dimensioni del campione sono risultate nullipare: 101 LVI negative (LVI-), 53 LVI positive (LVI+) e 67 sconosciute; cancro al seno post-partum (PPBC) entro 5 anni (PPBC <5): 73 LVI-, 53 LVI+, e 51 sconosciuto; PPBC entro 5 a meno di 10 anni (PPBC da 5 a <10): 63 LVI-, 57 LVI+, e 33 sconosciuto; PPBC dopo 10 anni o più (PPBC ≥10): 76 LVI-, 51 LVI+, e 29 sconosciuto. D, Percentuale di pazienti con tumore in stadio I-III diagnosticato con malattia LN+ (χ 2 test). Le dimensioni del campione erano nullipare, 130 LN- e 86 LN+; PPBC <5: 72 LN- e 102 LN+; PPBC da 5 a <10: 78 LN- e 73 LN+; PPBC ≥10: 82 LN- e 71 LN+.aP<<0,05 rispetto ai pazienti nulliparo.bP;001 rispetto ai pazienti nulliparo.cP;.05 rispetto al gruppo PPBC <5.
Rischio metastatico valutato dal Pronto Soccorso e dallo stato di parità
Poiché lo stato di ER del tumore al seno è un indicatore prognostico,23,24 abbiamo indagato sull’associazione di ER con le MFS a distanza in PPBC e abbiamo identificato chiare interazioni. Abbiamo trovato che i pazienti con una diagnosi di PPBC ER-positiva hanno mostrato una MFS a distanza simile a quella dei pazienti nulliparosi con malattia ER-negativa (HR, 1,02; 95% CI, 0,49-2,10)(Figura 3Ae eTable 2 nel supplemento), con una probabilità del 40% di metastasi entro il 15° anno. Inoltre, nelle donne con malattia ER-negativa, una diagnosi di PPBC entro 10 anni dal parto ha aumentato la probabilità di sviluppare una malattia metastatica di circa 2 volte rispetto alle pazienti nullipare con malattia ER-negativa (HR, 2,19; 95% IC, 1,04-4,58)(Figura 3Ae eTable 2 nel supplemento). Le analisi multivariabili che si adattano all’età e all’anno di diagnosi hanno confermato questi risultati(Figura 3Be eTable 2 nel supplemento).
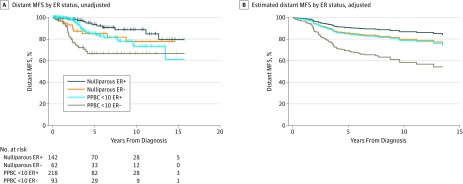
Figura 3.Analisi tra parità e stato del recettore degli estrogeni (ER) per l’associazione con la sopravvivenza senza metastasi a distanza (MFS)A, Proporzioni di MFS a distanza nel Colorado Young Women’s Breast Cancer Cohort categorizzata per parità e stato dei recettori degli estrogeni (log rank test, P<.001; eTable 2 nel supplemento). B, modello di regressione dei rischi proporzionale Cox che stima le proporzioni di MFS a distanza nel Colorado Young Women’s Breast Cancer Cohort categorizzato in base alla parità e allo stato di ER aggiustato per lo stadio, l’età e l’anno della diagnosi. Poiché la curva è stimata, incluso il numero di pazienti a rischio non è appropriato. PPBC <10 indica un cancro al seno post-partum (PPBC) diagnosticato entro 10 anni.
Abbiamo anche valutato l’esito combinato della parità e dello stato di ER su MFS a distanza classificata per stadio. Le pazienti nullipare con tumore al seno di stadio I o II avevano un basso rischio di metastasi indipendentemente dallo stato di ER (eFigure 5A e eTable 2 nel supplemento). Le pazienti con stadio I e II PPBC diagnosticate entro 10 anni dal parto presentavano un rischio maggiore di metastasi a distanza (eFigure 5A e eTable 2 nel supplemento). Al contrario, la MFS a distanza di stadio III non era significativamente diversa tra i gruppi di parità, sebbene i pazienti con cancro ER-negativo avessero un rischio di metastasi più elevato rispetto a quelli con cancro ER-positivo (eFigure 5B e eTable 2 nel supplemento). I gruppi nulliparo e PPBC ER-negativi hanno mostrato tassi di sopravvivenza libera da metastasi a 5 anni di solo circa il 50% rispetto al 75% nei casi ER-positivi, indipendentemente dallo stato di parità.

Figura 3.Figura 3. Analisi tra lo stato di parità e lo stato del recettore degli estrogeni (ER) per l’associazione con la sopravvivenza libera da metastasi a distanza (MFS)A, Proporzioni di MFS a distanza nel Colorado Young Women’s Breast Cancer Cohort categorizzata per parità e stato dei recettori degli estrogeni (log rank test, P<.001; eTable 2 nel supplemento). B, modello di regressione dei pericoli proporzionali Cox che stima le proporzioni di MFS a distanza nel Colorado Young Women’s Breast Cancer Cohort categorizzato per parità e stato ER aggiustato per stadio, età e anno della diagnosi. Poiché la curva è stimata, incluso il numero di pazienti a rischio non è appropriato. PPBC <10 indica un cancro al seno post-partum (PPBC) diagnosticato entro 10 anni.
Analisi dell’indice di proliferazione tumorale per stato di parità
Alta Ki67 positività è un biomarcatore utilizzato per stimare la prognosi e distinguere ER-positivo malattia luminale A da ER-positivo malattia luminale B.25,26,27 La distinzione dei sottotipi luminosi è importante, poiché i pazienti affetti da tumore della colonna vertebrale A hanno migliorato la sopravvivenza complessiva rispetto a quelli affetti da tumore della colonna vertebrale B.26,28,29 Per studiare le potenziali interazioni tra Ki67 e lo stato di parità, abbiamo colorato i campioni di tumore primitivi disponibili per Ki67 (eTable 3 e eFigure 3 nel supplemento). Come stimato, l’indice di etichettatura Ki67-positivo è aumentato con l’aumentare del grado (media [SEM], 1,73 [1,86] nel grado 1 rispetto a 40,7 [1,76] nel grado 3; P<<1001) (eFigure 6A nel supplemento). Abbiamo anche osservato un’elevazione marginale in Ki67 con stadio crescente, ma nessuna differenza significativa nei livelli di Ki67 quando si confrontano le dimensioni del tumore, LVI, o coinvolgimento LN (ad esempio, media [SEM], 29,9 [1,76] nella dimensione del tumore >0,1 a ≤ 2,0 cm rispetto a 34,3 [3,5] nella dimensione del tumore >5 cm; P==.82) (eFigure 6B-E nel Supplemento). Non c’è stata alcuna differenza significativa tra pazienti con PPBC e pazienti nulliparo per Ki67 (media [SEM], 34.3 [2.3] in PPBC meno di 5 casi rispetto a 30.6 [2.3] in pazienti nulliparo; P==.30) (eFigure 6F nel Supplemento ). Inoltre, abbiamo osservato Ki67 ridotto con l’aumento dell’età alla diagnosi (media [SEM], 37.5 [3.3] in pazienti ≤30 anni alla diagnosi rispetto a 27.3 [1.8] in pazienti >40 a 45 anni alla diagnosi; P==.03) (eFigure 6G nel Supplemento), come descritto in precedenza.30,31
Aggiornata la classificazione dei tumori luminosi utilizzando i risultati della colorazione Ki67
Utilizzando una definizione standard del sottotipo di luminal B (ER-positivo, recettore del progesterone [PR]-negativo, Her2-negativo o ER-positivo, PR-positivo o PR-negativo, e Her2-positivo) non c’era alcuna differenza significativa nella MFS a distanza tra luminal A e B nella nostra coorte (eFigure 7A e B nel supplemento ). Quando una definizione di luminal B basata su ER-positivo, PR-positivo o PR-negativo, Her2-positivo o Her2-negativo, e maggiore del 14% di cellule tumorali Ki67-positive26 è stato utilizzato, un gran numero di pazienti con il sottotipo luminale A è passato al gruppo con il sottotipo B attraverso tutti i gruppi di parità(Figura 4A-Ce eFigure 7C nel supplemento), confermando i risultati precedenti.1,32
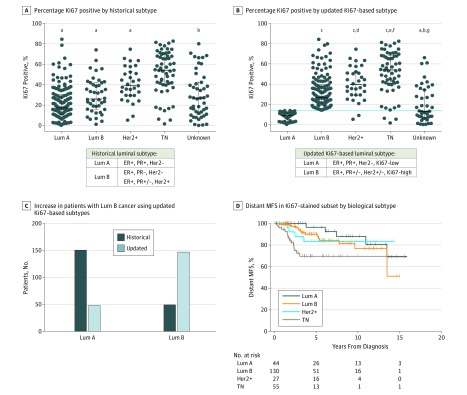
Figura 4.Incorporazione dell’indice di etichettatura Ki67 per le definizioni aggiornate dei sottotipi luminosiA, indice di colorazione Intratumorale Ki67 per sottotipo biologico tumorale utilizzando le definizioni storiche luminale A (Lum A) e luminale B (Lum B). B, Ki67 basato sulle definizioni di Lum A (Ki67 basso) e Lum B (Ki67 alto). I totali sono 316 pazienti (A) e 320 pazienti (B) (analisi a 1 via della varianza, test di confronto multiplo Tukey; le barre di errore indicano la mediana e l’intervallo interquartile). Il recettore degli estrogeni (ER), il recettore del progesterone (PR) e lo stato di Her2 sono stati utilizzati nella definizione del sottotipo biologico. Triplo negativo (TN) indica negativo per tutti e 3 i marcatori. C, Numero di tumori del paziente identificati come Lum A e Lum B utilizzando le definizioni storiche e le definizioni dei sottotipi basate su Ki67. D, Sopravvivenza libera da metastasi a distanza (MFS) classificata per sottotipo biologico utilizzando le definizioni basate su Ki67 per Lum A e Lum B (test log-rank, P=.007; eTabella 4 nel supplemento). Lum A, 44; Lum B, 130; Her2+, 27; TN, 55. + Indica positivo; -, negativo; +/-, positivo o negativo.aP<.001 vs TN.bP<.001 vs Her2.cP;.001 vs Lum A.dP;.05 vs Lum B.eP;.001 vs Lum B.fP;.05 vs Her2.gP;.01 vs Lum A.
Abbiamo valutato la MFS a distanza per sottotipo biologico utilizzando la classificazione aggiornata del luminal e abbiamo trovato che i pazienti con tumori luminal B in questo sottoinsieme della nostra coorte non hanno un rischio statisticamente significativamente aumentato di metastasi a distanza rispetto a quelli con tumori luminal A, anche dopo l’adattamento per le dimensioni del tumore, l’età alla diagnosi, e l’anno della diagnosi (HR, 1.71; 95% CI, 0,56-5,28; P==,35, analisi multivariabile) (Figura 4Ded eFigure7D e eTable 4 nel supplemento ).

Figura 4.Incorporazione dell’indice di etichettatura Ki67 per le definizioni aggiornate dei sottotipi luminosiA, indice di colorazione Intratumorale Ki67 per sottotipo biologico tumorale utilizzando le definizioni storiche luminale A (Lum A) e luminale B (Lum B). B, Ki67 basato sulle definizioni di Lum A (Ki67 basso) e Lum B (Ki67 alto). I totali sono 316 pazienti (A) e 320 pazienti (B) (analisi a 1 via della varianza, test di confronto multiplo Tukey; le barre di errore indicano la mediana e l’intervallo interquartile). Il recettore degli estrogeni (ER), il recettore del progesterone (PR) e lo stato di Her2 sono stati utilizzati nella definizione del sottotipo biologico. Triplo negativo (TN) indica negativo per tutti e 3 i marcatori. C, Numero di tumori del paziente identificati come Lum A e Lum B utilizzando le definizioni storiche e le definizioni dei sottotipi basate su Ki67. D, Sopravvivenza libera da metastasi a distanza (MFS) classificata per sottotipo biologico utilizzando le definizioni basate su Ki67 per Lum A e Lum B (test log-rank, P=.007; eTabella 4 nel supplemento). Lum A, 44; Lum B, 130; Her2+, 27; TN, 55. + Indica positivo; -, negativo; +/-, positivo o negativo.aP<.001 vs TN.bP<.001 vs Her2.cP;.001 vs Lum A.dP;.05 vs Lum B.eP;.001 vs Lum B.fP;.05 vs Her2.gP;.01 vs Lum A.
Discussione
Utilizzando la Coorte del Cancro al Seno delle Giovani Donne del Colorado, presentiamo i risultati che suggeriscono che il cancro al seno diagnosticato in donne di 45 anni o più giovani entro 10 anni dal parto serve come fattore prognostico avverso indipendente, conferendo un rischio approssimativamente 2 volte maggiore per le metastasi a distanza rispetto al rischio nelle pazienti nullipare. Tra i casi diagnosticati nella fase I o II, l’aumento del rischio nelle donne post-partum era da 3,5 a 5,0 volte superiore rispetto alle donne nullipare e rimaneva significativo dopo l’adattamento alle caratteristiche cliniche prognostiche note. I pazienti con tumore di stadio III hanno mostrato una prognosi uniformemente sfavorevole indipendentemente dallo stato di parità. Questi dati suggeriscono che la finestra di rischio di metastasi impartita da una diagnosi post-partum persiste più a lungo di quanto precedentemente riportato.1 Inoltre, i dati evidenziano il parto recente come un biomarcatore identificabile che può essere utile per determinare la prognosi dei tumori al seno delle giovani donne.
L’estensione della definizione di pazienti con PPBC che sono ad alto rischio di metastasi a distanza per includere le pazienti con diagnosi di cancro al seno entro 10 anni dal parto suggerisce che le pazienti con PPBC ora compongono circa il 45% di tutti i tumori al seno di giovani donne (eFigure 1 nel supplemento ). Tenendo conto delle statistiche annuali degli Stati Uniti di 25.000 nuove diagnosi di cancro al seno in donne di 45 anni o più giovani,33,34,35 poco più di 12.000 casi all’anno soddisferebbero il criterio della PPBC per una cattiva prognosi. L’età avanzata alla prima nascita è correlata con l’aumento del rischio di PPBC18,36,37con un maggior numero di donne che scelgono di ritardare la nascita di un figlio,38,39,40 l’incidenza di PPBC è probabilmente in aumento.8,41,42
Nonostante questi risultati, il PPBC rimane un sottoinsieme del cancro al seno non riconosciuto.8 Inoltre, questi dati suggeriscono che gli stadi I e II del cancro al seno in pazienti con PPBC diagnosticato entro 10 anni dal parto possono essere sottovalutati nel loro rischio di metastasi, poiché lo stato di parità non è attualmente considerato negli algoritmi decisionali clinici, come le linee guida del National Comprehensive Cancer Network.42 In sintesi, suggeriamo che la PPBC a bassa prognosi è un problema crescente che merita una ricerca più dedicata.
In questa sede sono state valutate le possibili spiegazioni per l’aumento delle metastasi, tra cui l’aumento delle dimensioni del tumore al momento della diagnosi (come surrogato per la diagnosi tardiva) e le variabili cliniche, come l’arricchimento di sottotipi biologici scarsamente prognostici, l’LVI e il coinvolgimento dell’LN. La fascia d’età delle nostre pazienti è prevalentemente inferiore all’età in cui le linee guida raccomandano l’avvio dello screening del tumore al seno; pertanto, la maggior parte di questi casi viene rilevata sulla base dei sintomi clinici. Non abbiamo osservato alcuna differenza di stadio o di dimensioni del tumore tra il gruppo dei PPBC e quello dei nulliparosi, suggerendo che non vi sia alcuna tendenza a una diagnosi tardiva nei PPBC. I nostri risultati sono concordi con altri rapporti in cui le donne nullipare con tumore al seno e quelle con PPBC avevano tumori di dimensioni simili e malattia in stadi simili.5,6
È ben documentato che le donne in premenopausa presentano una maggiore frequenza di tumori al seno tripla-negativi rispetto alle donne in postmenopausa.43,44,45,46 Tuttavia, le frequenze dei sottotipi biologici non differiscono per lo stato di parità in altre coorti di giovani donne con cancro al seno.1,32 In uno studio che utilizzava una grande coorte afroamericana, i pazienti con cancro al seno in premenopausa avevano tassi simili di malattia ER-negativa indipendentemente dallo stato di parità.47 Nel presente studio, il sottotipo biologico non differisce per lo stato di parità, ma il rischio di metastasi in pazienti con diagnosi di PPBC entro 10 anni dal parto sembrava essere aggravato da una diagnosi ER-negativa. Le donne con PPBC entro 10 anni dal parto con malattia ER-positiva avevano tassi di metastasi simili a quelli dei pazienti nulliparo con malattia ER-negativa. Questi dati identificano la diagnosi post-partum come un fattore di rischio indipendente per le metastasi, specialmente per le malattie in stadio precoce. Inoltre, i nostri dati suggeriscono che una diagnosi post-partum e una malattia ER-negativa possono essere una componente additiva del rischio di metastasi.
L’indice di proliferazione ha ottenuto una notevole attenzione come indicatore prognostico nel cancro al seno, poiché la sottotipizzazione molecolare dei tumori al seno umani con Ki67 può differenziare una buona prognosi luminale A da una scarsa prognosi luminale B.48 La nostra quantificazione dell’etichettatura del tumore Ki67 ha rivelato un aumento delle diagnosi della luminal B nei tumori al seno delle giovani donne. Questi dati sono coerenti con il lavoro pubblicato che mostra un alto tasso di diagnosi di luminal B nelle giovani donne.1,32 Tuttavia, nella nostra coorte, Ki67 non è correlato con lo stato di parità, suggerendo che, anche se Ki67 probabilmente aiuta a identificare i pazienti con cancro ER-positivo al pronto soccorso a maggior rischio di metastasi, non sembra delineare i pazienti post-partum a maggior rischio. Inoltre, concludiamo che l’arricchimento di sottotipi biologici scarsamente prognostici o di tumori primitivi altamente proliferativi non spiega l’aumento del rischio di metastasi nei pazienti con PPBC entro 10 anni dal parto. Al contrario, i nostri dati suggeriscono che il periodo post-partum e i cambiamenti subiti dal microambiente mammario durante questo evento vitale possono guidare l’aumento delle metastasi.
Coerentemente con questa ipotesi, gli studi del microambiente mammario post-partum eseguiti su roditori e donne implicano il programma di guarigione della ferita, come il programma di involuzione post-partum nella linfangiogenesi, LVI, l’entrata in circolazione, il coinvolgimento di LN e l’aumento del rischio di metastasi a distanza.11,15,16,17,49,50 In questo caso, i nostri dati clinici supportano questa teoria, con un’alta frequenza di pazienti con PPBC entro 10 anni dal parto che presentano un coinvolgimento di LVI e/o LN. I dati supportano anche una precedente osservazione che i linfatici elevati del seno possono persistere fino a 10 anni dopo il completamento della gravidanza.16 e suggeriscono che l’interazione delle cellule tumorali con i linfatici post-partum influenza la loro efficienza metastatica, come precedentemente riportato.51,52 Tuttavia, non è ancora stato identificato un collegamento diretto tra i fattori microambientali nei pazienti post-partum e l’aumento del rischio di metastasi.
Limitazioni
Il nostro studio è limitato in parte dalla demografia, in quanto la popolazione di pazienti donne, principalmente del Colorado, è in gran parte non ispanica, bianca, relativamente magra e con bassi tassi di mortalità per cancro al seno.53 Queste caratteristiche della nostra popolazione di pazienti potrebbero introdurre una tendenza verso risultati migliori con meno metastasi di quanto ci si potrebbe aspettare in una coorte più diversificata. Un altro limite del nostro studio è l’uso della raccolta combinata di dati prospettici e retrospettivi; i casi retrospettivi sono soggetti a dati mancanti ma offrono il follow-up più lungo.
Conclusioni
Questo studio suggerisce che le pazienti con una diagnosi di PPBC entro 10 anni dall’ultima gravidanza completata hanno un aumentato rischio di sviluppo di malattia metastatica nei tumori al seno di stadio I e II di sottotipi ER-positivi e ER-negativi. Questi dati forniscono un’ulteriore evidenza che una diagnosi di PPBC può rappresentare un sottotipo unico di cancro che richiede iniziative di ricerca clinica e traslazionale distinte. Queste osservazioni dovrebbero essere confermate in altre coorti di giovani donne con cancro al seno per la determinazione della generalizzabilità.
References
- Postpartum diagnosis demonstrates a high risk for metastasis and merits an expanded definition of pregnancy-associated breast cancer. Breast Cancer Res Treat. 2013; 138(2)DOI | PubMed
- Cause-specific survival for women diagnosed with cancer during pregnancy or lactation: a registry-based cohort study. J Clin Oncol. 2009; 27(1):45-51. DOI | PubMed
- Increased mortality in women with breast cancer detected during pregnancy and different periods postpartum. Cancer Epidemiol Biomarkers Prev. 2011; 20(9):1865-1872. DOI | PubMed
- Prognosis of women with primary breast cancer diagnosed during pregnancy: results from an international collaborative study. J Clin Oncol. 2013; 31(20):2532-2539. DOI | PubMed
- The relation of reproductive factors to mortality from breast cancer. Cancer Epidemiol Biomarkers Prev. 2002; 11(3):235-241. PubMed
- Reproductive history and mortality after breast cancer diagnosis. Obstet Gynecol. 2004; 104(1):146-154. DOI | PubMed
- Pregnancy-associated breast cancer in women from Shanghai: risk and prognosis. Breast Cancer Res Treat. 2015; 149(1):255-261. DOI | PubMed
- Management of the patient with postpartum breast cancer. Oncology (Williston Park). 2014; 28(9):768-770. PubMed
- Two distinct phases of apoptosis in mammary gland involution: proteinase-independent and -dependent pathways. Development. 1996; 122(1):181-193. PubMed
- Milk accumulation triggers apoptosis of mammary epithelial cells. Eur J Cell Biol. 1997; 73(2):158-165. PubMed
- Wound healing–like immune program facilitates postpartum mammary gland involution and tumor progression. Int J Cancer. 2015; 136(8):1803-1813. DOI | PubMed
- Alternatively activated macrophages and collagen remodeling characterize the postpartum involuting mammary gland across species. Am J Pathol. 2010; 176(3):1241-1255. DOI | PubMed
- Mucosal immunity in the female murine mammary gland. J Immunol. 2018; 201(2):734-746. DOI | PubMed
- Quantitative extracellular matrix proteomics to study mammary and liver tissue microenvironments. Int J Biochem Cell Biol. 2016; 81(pt A):223-232. DOI | PubMed
- Postpartum mammary gland involution drives progression of ductal carcinoma in situ through collagen and COX-2. Nat Med. 2011; 17(9):1109-1115. DOI | PubMed
- Cyclooxygenase-2–dependent lymphangiogenesis promotes nodal metastasis of postpartum breast cancer. J Clin Invest. 2014; 124(9):3901-3912. DOI | PubMed
- Remodeling of the mammary microenvironment after lactation promotes breast tumor cell metastasis. Am J Pathol. 2006; 168(2):608-620. DOI | PubMed
- Pregnancy-associated breast cancer and metastasis. Nat Rev Cancer. 2006; 6(4):281-291. DOI | PubMed
- Postpartum breast involution reveals regression of secretory lobules mediated by tissue-remodeling. Breast Cancer Res. 2014; 16(2):R31. DOI | PubMed
- Publisher Full Text
- Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer working group. J Natl Cancer Inst. 2011; 103(22):1656-1664. DOI | PubMed
- Checking the Cox model with cumulative sums of Martingale-based residuals. Biometrika. 1993; 80:557-572. DOI
- Prognostic significance of estrogen receptor status in breast cancer in relation to tumor stage, axillary node metastasis, and histopathologic grading. Cancer. 1984; 54(10):2237-2242. DOI | PubMed
- Relative worth of estrogen or progesterone receptor and pathologic characteristics of differentiation as indicators of prognosis in node negative breast cancer patients: findings from National Surgical Adjuvant Breast and Bowel Project Protocol B-06. J Clin Oncol. 1988; 6(7):1076-1087. DOI | PubMed
- The prognostic value of Ki67 in systemically untreated patients with node-negative breast cancer. J Clin Pathol. 2014; 67(3):222-228. DOI | PubMed
- Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst. 2009; 101(10):736-750. DOI | PubMed
- The prognostic value of Ki67 is dependent on estrogen receptor status and histological grade in premenopausal patients with node-negative breast cancer. Mod Pathol. 2010; 23(2):251-259. DOI | PubMed
- Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol. 2009; 27(8):1160-1167. DOI | PubMed
- Luminal B subtype: a key factor for the worse prognosis of young breast cancer patients in China. BMC Cancer. 2015; 15:201. DOI | PubMed
- Tumour biomarker expression relative to age and molecular subtypes of invasive breast cancer. Br J Cancer. 2012; 107(2):382-387. DOI | PubMed
- Breast cancer in young women and prognosis: how important are proliferation markers?. Eur J Cancer. 2017; 84:278-289. DOI | PubMed
- Molecular phenotype of breast cancer according to time since last pregnancy in a large cohort of young women. Oncologist. 2015; 20(7):713-718. DOI | PubMed
- Publisher Full Text
- Cancer Facts and Figures 2015. 2015. Publisher Full Text
- Pregnancy and breast cancer: when they collide. J Mammary Gland Biol Neoplasia. 2009; 14(2):87-98. DOI | PubMed
- Breast cancer risk by age at birth, time since birth and time intervals between births: exploring interaction effects. Br J Cancer. 2005; 92(1):167-175. DOI | PubMed
- Transient increase in the risk of breast cancer after giving birth. N Engl J Med. 1994; 331(1):5-9. DOI | PubMed
- Mean age of mothers is on the rise: United States, 2000-2014. NCHS Data Brief. 2016; 232:1-8. PubMed
- Births: preliminary data for 2005. Natl Vital Stat Rep. 2006; 55(11):1-18. PubMed
- Publisher Full Text
- Increasing incidence of pregnancy-associated breast cancer in Sweden. Obstet Gynecol. 2009; 114(3):568-572. DOI | PubMed
- Cancer incidence and incidence rates in Japan in 2006: based on data from 15 population-based cancer registries in the monitoring of cancer incidence in Japan (MCIJ) project. Jpn J Clin Oncol. 2012; 42(2):139-147. DOI | PubMed
- Race and triple negative threats to breast cancer survival: a population-based study in Atlanta, GA. Breast Cancer Res Treat. 2009; 113(2):357-370. DOI | PubMed
- Descriptive analysis of estrogen receptor (ER)–negative, progesterone receptor (PR)–negative, and HER2–negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California Cancer Registry. Cancer. 2007; 109(9):1721-1728. DOI | PubMed
- Variation in breast cancer subtypes with age and race/ethnicity. Crit Rev Oncol Hematol. 2010; 76(1):44-52. DOI | PubMed
- Expression of epidermal growth factor receptor in relation to BRCA1 status, basal-like markers and prognosis in breast cancer. J Clin Pathol. 2009; 62(2):139-146. DOI | PubMed
- Parity, lactation, and breast cancer subtypes in African American women: results from the AMBER Consortium. J Natl Cancer Inst. 2014; 106(10):dju237. DOI | PubMed
- An integrated genomics approach identifies drivers of proliferation in luminal-subtype human breast cancer. Nat Genet. 2014; 46(10):1051-1059. DOI | PubMed
- Physiologically activated mammary fibroblasts promote postpartum mammary cancer. JCI Insight. 2017; 2(6):e89206. DOI | PubMed
- The rodent liver undergoes weaning-induced involution and supports breast cancer metastasis. Cancer Discov. 2017; 7(2):177-187. DOI | PubMed
- Lymphatic vessels regulate immune microenvironments in human and murine melanoma. J Clin Invest. 2016; 126(9):3389-3402. DOI | PubMed
- VEGF-C promotes immune tolerance in B16 melanomas and cross-presentation of tumor antigen by lymph node lymphatics. Cell Rep. 2012; 1(3):191-199. DOI | PubMed
- . Accessed December 12, 2018.Publisher Full Text
Fonte
Goddard ET, Bassale S, Schedin T, Jindal S, Johnston J, et al. (2019) Association Between Postpartum Breast Cancer Diagnosis and Metastasis and the Clinical Features Underlying Risk. JAMA Network Open 2(1): e186997. https://doi.org/10.1001/jamanetworkopen.2018.6997





