Abstract
Introduzione
La risposta immunitaria umana alle lesioni è complessa e vitale per la sopravvivenza. Una risposta immunitaria eccessiva, inappropriata o disfunzionale porta a lesioni cellulari e alla sindrome da disfunzione di organi multipli (MODS), compresi i polmoni, i reni, il fegato e l’insufficienza cardiovascolare[1]. La MODS contribuisce alla morte e alla morbilità dei pazienti più gravemente feriti che sopravvivono all’insulto fisico iniziale[2- 3]. I pazienti affetti da MODS richiedono un supporto di terapia intensiva, e questo contribuisce in modo significativo agli esiti sanitari e ai costi delle lesioni[3]. Poiché il trauma è uno dei principali fattori che contribuiscono al peso globale della malattia[4- 6], comprendere le risposte immunitarie alle lesioni critiche e come la disregolazione porti a esiti negativi è un imperativo fondamentale nella medicina moderna.
I primi minuti o ore dopo la lesione sono probabilmente cruciali per lo sviluppo di una risposta immunitaria “normale” o disregolata e possono determinare la traiettoria di esiti sani o negativi. Tuttavia, questa fase iperacuta è molto impegnativa da studiare nei pazienti umani a causa della complessità e della logistica dell’ambiente di emergenza. Gli studi esistenti, quindi, tendono a concentrarsi sui pazienti più tardi nel loro decorso clinico, dopo che l’infiammazione diffusa è già stata stabilita e dopo che i pazienti sono stati sottoposti a ulteriori interventi chirurgici, farmaci e trasfusioni contenenti altro materiale cellulare del sangue[7]. Ciò ha potenzialmente contribuito alle controversie in corso sulla fisiopatologia delle disfunzioni d’organo dopo un trauma. Sono stati suggeriti vari modelli, tra cui un profilo bimodale pro-infiammatorio/anti-infiammatorio[8]; un secondo modello di priming seguito da un’esacerbazione[9]; e, più recentemente, una diffusa attivazione simultanea della maggior parte del trascrittoma dei globuli bianchi in circolazione, definita “tempesta genomica” [10]. Il risultato finale di tutti questi modelli è una risposta che coinvolge così tanto il sistema immunitario che il suo effetto cumulativo è sconosciuto, ed è impossibile identificare obiettivi terapeutici per la modulazione della risposta infiammatoria. È probabile, tuttavia, che questa attivazione diffusa inizi come una risposta osservata più mirata e potenzialmente unica al trauma. Gli studi sulla risposta iperacuta del sistema di coagulazione hanno completamente alterato la nostra comprensione della risposta emostatica al trauma[11], portando a nuovi paradigmi di rianimazione e a drammatici miglioramenti degli esiti[12-14]. Il superamento delle sfide logistiche per una ricerca robusta sull’infiammazione nella fase iperacuta può avere un impatto simile sulla nostra comprensione della risposta infiammatoria umana. Potrebbe essere possibile identificare i meccanismi precoci che poi evolvono nella tempesta genomica completa, in particolare i primi processi che portano allo sviluppo dei MODS.
L’obiettivo generale di questo studio è stato quello di indagare la risposta del trascrittoma del sangue intero in pazienti con lesioni critiche nella finestra temporale iperacuta (entro 2 ore). Il primo obiettivo di questo studio è stato quello di indagare la risposta iniziale a lesioni gravi e se vi è una reazione precoce e mirata. Il nostro obiettivo era quello di determinare i geni e i percorsi attivati nei leucociti immediatamente dopo la lesione e poi di descrivere come questo si evolve per diventare un’attivazione trascrizionale diffusa, con particolare attenzione ai potenziali trigger di attivazione. Abbiamo inoltre mirato ad identificare se i pazienti che hanno sviluppato MODS avevano una specifica firma di attivazione del trascrittoma nella fase iperacuta, o se lo sviluppo di MODS riflette semplicemente l’entità dell’insulto fisico e non comporta una risposta differenziale nella finestra iperacuta.
Materiali e metodi
Impostazione dello studio e partecipanti
Il Comitato Etico di Ricerca del Servizio Sanitario Nazionale (REC) ha concesso l’approvazione etica per questa ricerca (07/Q0603/29, 13/LO/0363). La ricerca è stata un sottostudio di coorte della nostra piattaforma di studio prospettica, Attivazione della coagulazione e dell’infiammazione in traumatologia (ACIT2). Tutti i campioni e i dati clinici sono stati raccolti prospetticamente. Il piano di analisi per questo sottostudio è stato sviluppato dopo l’iscrizione dei pazienti e l’acquisizione dei campioni(S1 Text). Lo studio è riportato secondo le linee guida STROBE(Tabella S1). ACIT2 è uno studio prospettico che valuta gli aspetti della coagulazione e dell’infiammazione nei pazienti traumatizzati (NHS REC: 07/Q0603/29). Tutti i pazienti adulti traumatizzati (di età superiore ai 15 anni) del Royal London Hospital che soddisfacevano i criteri locali per l’attivazione del team traumatologico erano idonei all’iscrizione quando il personale di ricerca era presente (durante questo periodo dalle 08:00 alle 22:00 ogni giorno). I criteri per l’attivazione del team traumatologico si basano su un meccanismo di lesioni ad alta energia (tra cui caduta superiore a 3 m, collisione stradale superiore a 30 mph, pedone/ciclista/motociclista contro veicolo, espulsione dal veicolo, incidente mortale nello stesso veicolo dell’occupante, intrappolamento, ferita d’arma da fuoco, lesioni da schiacciamento grave, o da esplosione), fisiologia anormale del paziente (incluso il paziente intubato, Glasgow Coma Score inferiore a 14, frequenza respiratoria inferiore a 10 o superiore a 30, pressione sistolica inferiore a 90, o frequenza cardiaca superiore a 100), o modelli di lesioni anatomiche ad alto rischio. I criteri di inclusione e di esclusione per ACIT2 sono descritti altrove[15]. Tutti i pazienti o i loro rappresentanti hanno fornito il consenso informato scritto per l’inclusione nello studio.
Campione e raccolta dati
I dati raccolti su ciascun paziente comprendevano misure di shock e ischemia tissutale (deficit di base e lattato) e la gravità della lesione come valutata dall’Injury Severity Score (ISS)[16] e dall’Abbreviated Injury Scale (AIS)[17]. Il sangue per l’ammissione è stato prelevato immediatamente all’arrivo nella sala di rianimazione ed entro 2 ore dalla lesione. Per l’analisi genomica, il sangue intero è stato raccolto in provette di RNA PAXGene Blood RNA da 2,5 ml (Pre-AnalytiX GmBH, Svizzera) e conservato come raccomandato dal produttore. Per la fenotipizzazione della sottopopolazione linfocitaria (cellule B, T e Natural Killer [NK]), il sangue intero è stato raccolto in provette da 8,0 ml CPT, Vacutainer o 6,0 ml EDTA Vacutainer (Becton Dickinson, UK). Il sangue temporale è stato prelevato a 24 e 72 ore dall’ammissione. Gli esiti dei pazienti, tra cui la mortalità a 28 giorni, le infezioni, le cure critiche e la durata della degenza ospedaliera, sono stati registrati prospetticamente.
Selezione dei pazienti
Tra i pazienti ACIT2 arruolati, i pazienti gravemente feriti sono stati selezionati per l’inclusione in studi di microarray e citometria a flusso se hanno subito un trauma grave (ISS ≥ 25) con un meccanismo di trauma smussato. Una coorte di pazienti traumatizzati che hanno subito lesioni minori (ISS ≤ 4) è servita come coorte di controllo. I pazienti sono stati esclusi dagli studi microarray se hanno ricevuto prodotti ematici o più di 1000 ml di cristalloide preospedaliero prima del prelievo di sangue al momento del ricovero, o se hanno subito gravi lesioni cerebrali traumatiche (definite come punteggio AIS testa > 3). Questi criteri di selezione predefiniti sono stati stabiliti per contrastare l’influenza degli emoderivati e dell’intervento iatrogeno sulla risposta immunitaria e l’influenza di gravi lesioni cerebrali traumatiche sull’esito. La principale misura di esito è stata la MODS, definita come un punteggio di valutazione sequenziale del fallimento d’organo (SOFA) di ≥ 5 in 2 o più giorni consecutivi, escludendo le prime 48 ore [18-19].
I pazienti per l’analisi trascrittomica sono stati iscritti ad ACIT2 tra dicembre 2008 e giugno 2012. In totale, 556 pazienti sono stati arruolati all’ACIT2, di cui 90 con trauma da corpo contundente, ISS ≥ 25, e nessuna lesione cerebrale traumatica. Di questi, 36 pazienti avevano campioni in tutti e 3 i punti temporali e costituivano la popolazione critica per questo studio. La popolazione critica è stata dicotomizzata in base alla presenza (MODS: 16 pazienti) o assenza (NoMODS: 20 pazienti) di MODS. I pazienti per l’analisi citometrica a flusso sono stati arruolati prospetticamente in ACIT2 tra giugno 2014 e gennaio 2017. In questo periodo di tempo sono stati arruolati in ACIT2 un totale di 404 pazienti, 175 dei quali sono stati gravemente feriti e hanno soddisfatto i criteri per questo studio. Per 34 di questi pazienti, era presente un ricercatore addestrato alla citometria a flusso e c’è stato tempestivamente al citometro a flusso. Una coorte di 9 volontari sani (NHS REC: 13/LO/0363) è servita come popolazione di controllo per le analisi di flusso. Queste dimensioni del campione rappresentavano campioni di convenienza, in quanto non erano disponibili dati precedenti per alimentare gli studi.
Citometria a flusso
Le cellule mononucleate del sangue periferico (PBMC) sono state isolate da tubi CPT™ (Beckton Dickinson, Regno Unito) utilizzando le istruzioni del produttore. Il sangue anticoagulato EDTA è stato trattato con Pharm Lyse (Beckton Dickinson) per la rimozione degli eritrociti. Le cellule mononucleari o lisate appena preparate sono state lavate in soluzione fisiologica tamponata con fosfato (Thermofisher Scientific, UK) due volte e risospese in tampone di colorazione (la soluzione fisiologica tamponata con fosfato di Dulbecco, con 2% di siero bovino fetale, [Stemcell, Francia]) prima della colorazione. Le sottopopolazioni di linfociti sono state identificate utilizzando combinazioni dei seguenti anticorpi: CD3-V450 (UCHT1), CD56-CF-594 (NCAM 16.2), CD16-BV510 (3G8), CD14-APC-Cy7 (MoP3), CD19-APC-Cy7 (SJ25CI), CD4-PerCP-Cy5.5 (SK3), CD8-APC-H7 (SK1), e CD19-PerCP-Cy5.5 (HIB19) (Beckton Dickinson, UK). Dopo la colorazione, i campioni sono stati lavati in PBS e fissati in soluzione di paraformaldeide al 2%. L’acquisizione è stata effettuata utilizzando un citometro a flusso LSR II (Beckton Dickinson, UK).
Analisi dei dati
Protocolli Microarray
L’RNA totale è stato estratto da sangue intero raccolto in provette PAXGene Blood RNA (Pre-AnalytiX GmBH, Svizzera) come descritto in precedenza[20]. La quantità e l’integrità è stata valutata[20]. L’RNA totale (250 ng) è stato amplificato utilizzando il kit Ambion TotalPrep (Illumina, USA), e 750 ng del cRNA risultante è stato ibridato al Beadchip di espressione Illumina Human HT-12 v4 (Illumina, USA). Gli array sono stati analizzati utilizzando il sistema Illumina iScan 2.0. I dati sono stati esportati in R per l’analisi statistica utilizzando Illumina Genome Studio V2011.1. ComBat[21] dal pacchetto di analisi variabile surrogato (SVA) in Bioconductor è stato utilizzato per rimuovere gli effetti di batch noti. La correzione di fondo e la normalizzazione quantile mediante sonde di controllo è stata applicata ai dati utilizzando la funzione neqc dei modelli lineari per il pacchetto di dati microarray (limma)[22]. Le intensità sono state trasformate log2 e le sonde di controllo sono state rimosse. Le sonde non espresse sono state filtrate, mantenendo solo le sonde con un valore p di rilevazione del 5% in 3 array o più. La funzione prcomp di R è stata utilizzata per eseguire l’analisi dei componenti principali (PCA) sui valori di espressione genica per valutare la stratificazione del paziente. Inoltre, i modelli di espressione genica sono stati ulteriormente valutati utilizzando mappe termiche a distanza euclidee. I geni espressi in modo differenziale tra le categorie di pazienti (ad esempio, critici rispetto ai controlli a 0 ore) sono stati identificati utilizzando modelli lineari e metodi empirici di Bayes[23]. Le correlazioni intraclassiche sono state stimate per tener conto di misure ripetute sugli stessi pazienti[24]. I valori p sono stati corretti per test multipli utilizzando il tasso di falsa scoperta di Benjamini-Hochberg (FDR)[25]. I geni con un FDR ≤ 0,05 sono stati considerati espressi in modo differenziato e utilizzati per ulteriori analisi. I dati di espressione genica grezzi e normalizzati sono disponibili presso ArrayExpress sotto E-MTAB-5882. Tutti i file di dati e il codice di analisi sono disponibili anche nel seguente repository: https://github.com/C4TS/HyperacutePhase.
Percorsi e reti
Il software Ingenuity path analysis software (IPA) (Qiagen, inc) è stato utilizzato per identificare i meccanismi biologici arricchiti nei geni espressi in modo differenziato. Questo software analizza i dati trascrittomici nel contesto dei percorsi noti e delle reti di regolazione, identificando le funzioni biologiche e/o i percorsi che sono significativamente arricchiti nei risultati. Sono stati analizzati i geni del set di dati che hanno incontrato un cut-off p < 0,05 e che sono stati associati a funzioni biologiche nel Knowledge Base Ingenuity Pathways. Significatività delle biofunzioni e dei percorsi canonici sono stati testati da un test Fisher Exact p-valore, per escludere la probabilità di arricchimento solo per caso. I percorsi sono stati raggruppati per il valore del rapporto (il numero di molecole significative in ogni percorso diviso per il numero totale di molecole che compongono quel percorso). Le reti di coeespressione genica sono state costruite per i percorsi più arricchiti per valutare la progressione dei cambiamenti nei geni espressi in modo differenziato e i loro modelli di raggruppamento. Queste reti di coeespressione sono state create utilizzando BioLayout Express3D[26], applicando una soglia minima di 0,7 punteggio di correlazione Pearson.
Deconvoluzione delle cellule immunitarie
Per stimare la composizione delle cellule immunitarie dei nostri campioni, abbiamo scaricato la risposta immunitaria nel repository in silico (IRIS) di 1.622 geni specificamente espressi in, e classificati da, lignaggi di cellule immunitarie multiple[27]. Per stimare i cambiamenti nella composizione cellulare dei campioni, sono stati utilizzati i trascritti specifici del lignaggio, espressi in modo differenziato, sulla base della percentuale di trascritti specifici del lignaggio presenti in ogni gruppo in ogni punto temporale. Il cluster 3.0 è stato utilizzato per generare mappe termiche di marcatori cellulari immunitari espressi in modo differenziato[28].
Analisi del modulo immunitario
Abbiamo esaminato le proprietà funzionali delle firme trascrittomiche concentrandoci sui set di geni coeespressi, precedentemente modularizzati da Chaussabel et al.[29]. Questi 260 moduli sono stati oggetto di studio approfondito su una varietà di disturbi infiammatori, e per molti di essi sono state fornite annotazioni biologiche (il contenuto del modulo trascrizioni e le annotazioni sono disponibili online su http://www.biir.net/public_wikis/module_annotation/V2_Trial_8_Modules)[30]. Abbiamo testato l’espressione differenziale tra i moduli utilizzando il QuSAGE[31- 32]. Il progetto di questa parte dello studio era identico a quello della nostra analisi del limma, con correlazioni intraclasse per osservazioni ripetute stimate usando una struttura di correlazione a simmetria composta[33].
Analisi citometrica a flusso
I dati demografici dei pazienti sono stati analizzati in Excel (Microsoft, USA) e Prism (GraphPad, USA). I risultati citometrici a flusso sono stati analizzati utilizzando FlowJo (Tree Star, USA). I conteggi assoluti per le cellule T, B e NK sono stati ottenuti moltiplicando la loro percentuale (della popolazione totale di linfociti acquisita con la citometria a flusso) per il conteggio assoluto dei linfociti ottenuto da test di laboratorio ospedalieri di routine. I dati sono riportati principalmente come mediana (intervallo interquartile) e analizzati con statistiche non parametriche, se non diversamente specificato.
Risultati
Le caratteristiche demografiche e le caratteristiche di lesione dei gruppi di pazienti sono mostrate nella Tabella 1 e S1 Fig. I pazienti gravemente feriti nella coorte microarray sono stati gravemente feriti con una ISS mediana di 33, rispetto alla coorte di controllo con una ISS mediana di 1. Nessun paziente in questa coorte ha ricevuto una trasfusione di sangue o un intervento chirurgico prima del campionamento. Il campione di sangue iniziale è stato prelevato immediatamente all’arrivo al pronto soccorso, entro 30 minuti e una mediana di 93 minuti dopo la lesione (entro 2 ore dalla lesione in tutti i pazienti).
| Coorte di microarray | Coorte citometrica a flusso | |||||||
|---|---|---|---|---|---|---|---|---|
| Demografia | Controlloa | Criticob | p-valore1 | NoMODS | MODI | p-valore2 | HV | Criticob |
| Numero | 6 | 36 | – | 16 | 20 | – | 9 | 34 |
| Età† | 40 (29–46) | 36 (26–53) | 0.90 | 33 (23–41) | 39 (26–63) | 0.05 | 34 (30–42) | 51 (33.5–61) |
| Maschio (%)††† | 83 | 75 | 1.00 | 88 | 62 | <0.01 | 60 | 71 |
| Tempo dalla lesione al prelievo di sangue (min.) | 59 (36–83) | 93 (72–111) | <0.01 | 80 (68–97) | 102 (85–115) | 0.04 | – | 105 (90–117) |
| Caratteristiche della lesione | ||||||||
| ISS† | 1 (0–2) | 33 (27–39) | <0.01 | 29 (27–33) | 38 (29–43) | 0.06 | – | 38 (29–45) |
| SBP all’ingresso† | 134 (121–152) | 98 (82–126) | 0.06 | 111 (96–138) | 94 (66–124) | 0.05 | – | 112 (73–132) |
| Preintubazione GCS† | 15 (14–15) | 14 (13–15) | 0.67 | 15 (14–15) | 14 (13–15) | 0.33 | – | 8 (3–14) |
| BD (mmol/L)† | −1.1 (-1.7–−0.6) | 5.8 (2.7–9.8) | 0.01 | 2.5 (2.0–3.8) | 9.7 (6.3–15.3) | <0.01 | – | 7.3 (4.3–16.9) |
| Indice di shock (HR/SBP)† | 0.7 (0.5–0.7) | 1.3 (0.7–1.7) | 0.20 | 0.8 (0.7–1.1) | 1.7 (1.4–2.3) | 0.02 | – | 0.9 (0.7–1.1) |
| Lattato (mmol/L)† | 2.2 (1.6–2.3) | 4.4 (2.2–7.2) | 0.08 | 2.0 (1.4–4.1) | 6.6 (4.4–11.5) | <0.01 | – | 3.2 (2.1–9.9) |
| Testa e collo AIS† | 0 (0–0) | 0 (0–1) | 0.31 | 0 (0–0) | 0 (0–2) | 0.08 | – | 2 (0–4) |
| AIS Face† | 0 (0–1) | 0 (0–0) | 0.25 | 0 (0–0) | 0 (0–0) | 0.30 | – | 0 (0–1) |
| Torace AIS† | 0 (0–0) | 4 (3–5) | <0.01 | 4 (3–5) | 4 (4–5) | 0.31 | – | 3 (3–4) |
| AIS Abdo/Pelvis† | 0 (0–0) | 2 (0–4) | <0.01 | 3 (2–4) | 2 (0–3) | 0.05 | – | 3 (2–4) |
| Estremità/pelvisiera AIS† | 0 (0–0) | 3 (2–3) | <0.01 | 3 (2–3) | 3 (3–3) | 0.03 | – | 3 (2–4) |
| Risultati | ||||||||
| Mortalità a 28 giorni (%)††† | 0 | 19 | 0.57 | 0 | 33 | <0.01 | – | 29 |
| Infezioni (%)††† | 0 | 73 | <0.01 | 44 | 86 | <0.01 | – | 48 |
| Soggiorno in ospedale (giorni)† | 4 (3–6) | 18 (12–34) | 0.11 | 16 (12–21) | 24 (12–44) | 0.23 | – | 13 (2–45) |
| Soggiorno in terapia intensiva (giorni)† | 0 | 6 (1–15) | 0.02 | 1 (0–4) | 15 (9–18) | <0.01 | – | 6 (2–21) |
La risposta immunitaria iperacuta alle lesioni
All’interno dell’immediata finestra temporale iperacuta di 2 ore, abbiamo osservato una firma focalizzata dell’espressione del gene leucocitario in pazienti gravemente feriti. Solo 1.239 (4,2%) delle 29.385 sonde geniche totali sono state espresse in modo differenziato in questo momento rispetto ai controlli (FDR ≤ 5%). Entro 24 ore dopo la lesione, questa risposta era sbocciata in una attivazione trascrizionale molto più diffusa(Fig 1A). Un totale di 6.294 geni (21,4%) ha mostrato un’espressione differenziale a 24 ore dopo l’infortunio rispetto al ricovero, e questo modello di espressione è persistito a 72 ore, in cui 6.177 geni (21,0%) sono rimasti espressi in modo differenziale rispetto al campione di ricovero(Fig 1A). Al contrario, c’è stata una forte concordanza tra i profili di espressione successivi, con 4.094 (65%) dei 6.294 geni espressi differenzialmente a 24 ore ancora espressi differenzialmente a 72 ore(Fig 1B). In un’analisi dei componenti principali, questa attivazione immediata del gene ha mostrato una buona separazione dai pazienti di controllo in tutti i punti temporali e dai pazienti critici nei punti temporali successivi(Fig 1C). La normale risposta umana alla lesione critica inizia con l’espressione differenziale di un piccolo sottoinsieme di geni, ma si evolve rapidamente ed è massima nelle 24 ore successive alla lesione.

Fig 1.La risposta iperacuta trascrittomica alla lesione critica.(A) C’è una risposta genomica focalizzata alla lesione nella finestra iperacuta dopo il trauma. Le colonne mostrano i valori di log p dei geni espressi in modo differenziato tra 36 pazienti critici e 6 pazienti di controllo a 0 ore dopo il trauma (finestra iperacuta), e tra pazienti critici a 24 e 0 ore e a 72 e 0 ore. Nella finestra iperacuta, il 4% delle trascrizioni (1.239 su 29.385) sono state espresse in modo differenziato. Questo si è esteso al 21,4% (6.294 trascrizioni) a 24 ore e al 21% (6.177 trascrizioni) a 72 ore. (B) Cluster analisi dei geni espressi in modo differenziato in pazienti con lesioni critiche (rispetto ai controlli). Tutti i campioni iperacutilici sono stati raggruppati separatamente, mentre non vi è stata alcuna differenziazione tra i campioni a 24 o 72 ore. (C) Analisi dei componenti principali dei geni espressi differenzialmente in pazienti critici e di controllo a 0 (finestra iperacuta), 24, e 72 ore dopo l’infortunio. I pazienti critici erano ben separati dai pazienti di controllo, e vi è stata una marcata separazione dei campioni iperacuto.
Abbiamo usato la cellula immunitaria nella metodologia di deconvoluzione in silico e citometria a flusso(S2 Fig) per esaminare le risposte differenziali nelle popolazioni leucocitarie all’interno della finestra iperacuta. La deconvoluzione ha identificato l’up-regolazione nei geni marcatori per neutrofili, monociti e linfociti NK, una risposta mista nei linfociti B e nelle cellule dendritiche e la down-regolazione dei linfociti T (Fig 2A). Entro 24 ore dopo l’infortunio, le firme dei leucociti avevano sviluppato un modello di attivazione profondamente diverso(Fig 2B). Le proporzioni delle cellule da in deconvoluzione in silico erano ampiamente coerenti con i dati di conteggio diretto dall’analisi del flusso(Fig 2C). Nella finestra iperacuta, abbiamo osservato un aumento drammatico nel sottoinsieme dei linfociti, che è stato quasi interamente rappresentato da un aumento del 150% del numero di cellule NK in circolazione(Fig 2C). Entro 24 ore, questi cambiamenti erano scomparsi, e il conteggio delle cellule NK era mezzo normale a 24 ore e si avvicinava a zero a 72 ore. Al contrario, i livelli dei linfociti T sono stati mantenuti nella finestra iperacuta, ma poi sono scesi del 40% a 24 ore. Anche i conteggi dei neutrofili hanno raggiunto un picco nella finestra iperacuta, fino a quasi 4 volte il livello nei controlli sani. Il conteggio è poi gradualmente diminuito nel corso degli ultimi punti di tempo a meno di due volte il normale a 72 ore(Fig 2C). I conteggi dei monociti iperacuti e delle cellule B non sono stati significativamente elevati. Tuttavia, il 20% dei marcatori del trascrittoma immunitario regolato verso l’alto erano di origine monocitaria, mentre le cellule B mostravano principalmente una diminuzione della regolazione in questa prima finestra(Fig 2A e 2C). Collettivamente, i dati sulle popolazioni di cellule immunitarie indicano un rapido cambiamento nelle popolazioni di neutrofili e linfociti innati nella fase iperacuta del danno critico. Questo è associato principalmente con l’up-regolazione del trascrittoma delle popolazioni di leucociti innati e down-regolazione delle popolazioni di linfociti adattativi.
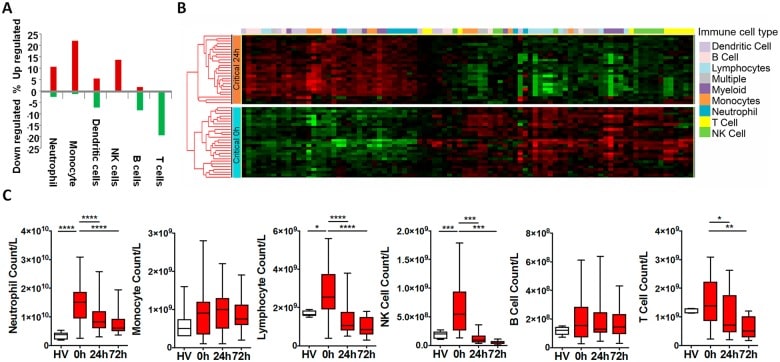
Fig 2.Fig. 2. Variazioni della sottopopolazione leucocitaria nella risposta iperacuta alla lesione.(A) Deconvoluzione delle cellule immunitarie che mostra la regolazione differenziale % globale dei marcatori immuno-specifici delle cellule (selezionati dalla risposta immunitaria in silico [IRIS] risorsa [vedi metodi]) tra pazienti critici e di controllo a 0 ore. C’è stata una predominante up-regolazione dei marcatori delle cellule neutrofile, monocito e killer naturale (NK), una risposta mista nelle cellule dendritiche e una down-regolazione delle cellule B e T. (B) Mappa termica gerarchicamente raggruppata di marcatori immuno-specifici delle cellule immunitarie / arricchito (selezionati dalla risorsa IRIS) nei 36 pazienti critici a 0 e 24 ore dopo l’infortunio. (C) Le analisi citometriche a flusso erano coerenti con la deconvoluzione. C’è stato un aumento del numero di neutrofili e linfociti (principalmente cellule NK) nella finestra iperacuta. Entro 24 ore, i linfociti totali e le cellule NK erano al di sotto della norma (rispetto ai volontari sani), e mediana T-cellule conteggi mediana era anche sceso significativamente al di sotto dei conteggi di controllo sani. (Conteggio totale dei leucociti: volontario sano: 5,8 (4,4-7,1) x 109/L; 0 ore: 19.5 (13.0-23.1) x 109/L; 24 ore: 10,4 (7,8-14,1) x 109/L; 72 ore: 8,2 (6,6-11,7) x 109/L. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0, 0001).
Il profilo di espressione leucocitaria iperacuta post lesione circolante leucocitaria rappresenta i primi geni e percorsi coinvolti nell’avvio della risposta infiammatoria sistemica. Dei 1.239 geni espressi in modo differenziato nella finestra iperacuta, 666 (54%) sono stati up-regolati e 573 (46%) down-regolati. Entro 24 ore dopo l’infortunio, l’attivazione trascrittomica era cresciuta in grandezza e si è evoluta nel carattere. La proporzione di geni up-regolati (3.382 di 6.294, 54%) e down-regolati (2.912, 46%) era simile alla fase iperacuta. Tuttavia, solo 202 (16%) dei geni espressi in modo differenziato nella finestra iperacuta erano ancora espressi in modo differenziato nella stessa direzione a 24 ore dopo l’infortunio (122 up-regolati e 80 down-regolati). A 24 ore, 254 (20%) geni che erano inizialmente up-regolati erano down-regolati, e 32 geni inizialmente down-regolati erano up-regolati.
L’analisi delle vie canoniche ingegno sui geni differenzialmente espressi nella finestra iperacuta ha dimostrato una diffusa up-regolazione dei percorsi di risposta infiammatoria innata e le biofunzioni, tra cui l’IL-10, IL-6, IL-17A, e IL-8 vie di segnalazione, ossido nitrico (NO) segnalazione, pedaggio-come la segnalazione del recettore, e la fase acuta di risposta di segnalazione vie di segnalazione(Fig 3A e 3B, S2 Table). C’è stato down-regolazione delle vie adattive come la presentazione di antigene, T-cellula di segnalazione (X40, iCOS, Nur77), e la segnalazione di rigetto allotrapianto. Dopo 24 ore, c’è stata una preponderanza molto maggiore di down-regolazione attraverso tutti i percorsi e le biofunzioni(Fig 3A e 3B). La Fig 4A mostra boxplot di geni esemplari provenienti da percorsi che sono espressi in modo differenziato nella fase iperacuta, ma che hanno cambiato la loro risposta di 24 ore.
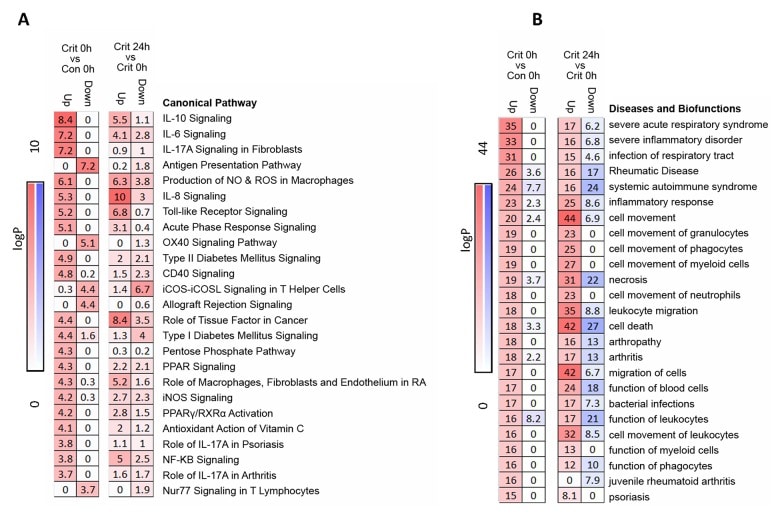
Fig 3.Fig. 3. Percorsi e biofunzioni nella risposta iperacuta alla lesione critica.(A) L’analisi dei percorsi dell’ingegno dei geni espressi in modo differenziato nella finestra iperacuta (Critical versus Control, 0 ore) procedendo a 24 ore dopo la lesione (Critical 24 ore versus Critical 0 ore). In generale, nella finestra iperacuta, c’è up-regolazione della risposta infiammatoria innata e down-regolazione di alcune vie immunitarie adattive. Da 24 ore, c’è una preponderanza molto maggiore di risposte down-regolate. (B) La malattia dell’ingenuità e l’analisi della biofunzione dei geni differenzialmente espressi nella finestra iperacuta (Critical versus Control, 0 ore) procedendo a 24 ore dopo l’infortunio (Critical 24 ore versus Critical 0 ore). Anche in questo caso, c’è un immediato up-regolamentazione delle biofunzioni legate all’infiammazione e al movimento dei leucociti, con un down-regolamentazione che diventa più prominente a 24 ore.
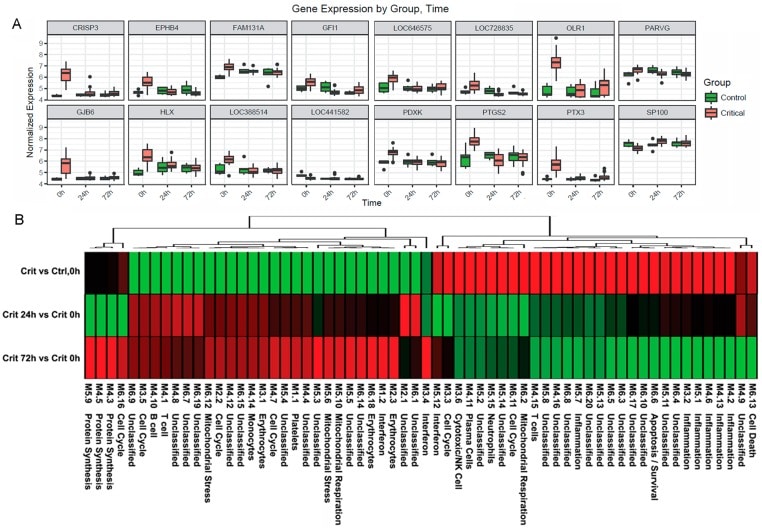
Fig. 4.Analisi dei sistemi immunitari nella finestra iperacuta.(A) Profili di espressione genica dei 16 geni con la maggiore differenza di espressione tra la finestra iperacuta e le 24 ore dopo l’infortunio nell’analisi del trascrittoma Critical versus Control. (B) Analisi del modulo immunitario della risposta critica alla lesione. Anche in questo caso, c’è stata una risposta differenziale tra la risposta iperacuta e i punti temporali successivi. C’è stata una sovraespressione nei moduli associati all’infiammazione e nei moduli delle cellule di neutrofili e di killer naturale (NK). Ci sono state sovra e sottoespressioni miste in moduli relativi a cellule T e cellule B/plasma e sottoespressione di moduli relativi a monocito (contrariamente ai dati di deconvoluzione della Fig 2B).
Per caratterizzare ulteriormente i processi biologici che possono essere alla base della fase iperacuta, abbiamo analizzato l’espressione di 260 moduli di geni immunitari precedentemente riportati coeespressi nel sangue attraverso una serie di condizioni immunologiche. Applicando una soglia di FDR del 5%, abbiamo identificato 118 moduli espressi in modo differenziato tra pazienti critici e di controllo al basale, 204 tra pazienti critici a 24 ore dopo l’infortunio rispetto a 0 ore, e 187 tra pazienti critici a 72 ore dopo l’infortunio rispetto al basale(Tabella S2). L’interpretazione funzionale da parte di QuSAGE è stata utilizzata per generare una mappa termica a cluster gerarchico che presenta un cambio di espressione dei moduli in modo logico tra pazienti critici e di controllo(Fig 4B). Dei 30 moduli sovraespressi in fase iperacuta, 28 si erano normalizzati o erano diventati sottoespressi di 24 ore dopo l’infortunio, e 27 dei 32 moduli inizialmente sottoespressi stavano diventando sovraespressi di 24 ore. Nessun modulo ha mostrato una persistente sovra o sottoespressione nel periodo di 72 ore dopo l’infortunio.
Nella fase iperacuta, l’infiammazione predominava con la sovraespressione della firma dei moduli M3,2. M4.2, M4.6, M4.13, M5.1, e M5.7, così come i moduli annotati ai neutrofili (M5.15) e alle cellule citotossiche/NK (M3.6). Una risposta mista è stata vista con moduli annotati alle cellule T (M4.15) e cellule B/cellule al plasma (M4.10, 4,11), mentre il modulo monocito M4.14 era sottoespressa. C’è stata una risposta mista tra i moduli relativi al ciclo delle celle (M2.2, M3.3, M3.5, M4.7, M6.11, M6.16), le funzioni mitocondriali (M5.6, M5.10, M6.2, M6.12), e l’interferone (M1.2, M3.4, M5.12). L’annotazione dettagliata del modulo è collegata nella tabella S2. Questi risultati rafforzano l’evidenza di una specifica firma risposta infiammatoria iperacuta che cambia in un modello molto diverso da 24 ore dopo l’infortunio e può essere guidato da una risposta differenziale tra innata (neutrofili e cellule NK) e sistemi adattativi.

Fig 1.La risposta trascrittomica iperacuta alla lesione critica.(A) C’è una risposta genomica focalizzata alla lesione nella finestra iperacuta dopo il trauma. Le colonne mostrano i log p-valori dei geni espressi in modo differenziato tra 36 pazienti critici e 6 pazienti di controllo a 0 ore dopo il trauma (finestra iperacuta), e tra pazienti critici a 24 e 0 ore e a 72 e 0 ore. Nella finestra iperacuta, il 4% delle trascrizioni (1.239 su 29.385) sono state espresse in modo differenziato. Questo si è esteso al 21,4% (6.294 trascrizioni) a 24 ore e al 21% (6.177 trascrizioni) a 72 ore. (B) Cluster analisi dei geni espressi in modo differenziato in pazienti con lesioni critiche (rispetto ai controlli). Tutti i campioni iperacutilici sono stati raggruppati separatamente, mentre non vi è stata alcuna differenziazione tra i campioni a 24 o 72 ore. (C) Analisi dei componenti principali dei geni espressi differenzialmente in pazienti critici e di controllo a 0 (finestra iperacuta), 24, e 72 ore dopo l’infortunio. I pazienti critici erano ben separati dai pazienti di controllo, e vi è stata una marcata separazione dei campioni iperacuto.

Fig 2.Fig. 2. Variazioni della sottopopolazione leucocitaria nella risposta iperacuta alla lesione.(A) Deconvoluzione delle cellule immunitarie che mostra la regolazione differenziale % globale dei marker specifici delle cellule immunitarie (selezionati dalla risposta immunitaria in silico [IRIS] risorsa [vedi metodi]) tra pazienti critici e di controllo a 0 ore. C’è stata una predominante up-regolazione dei marcatori delle cellule neutrofile, monocito e killer naturale (NK), una risposta mista nelle cellule dendritiche e una down-regolazione delle cellule B e T. (B) Mappa termica gerarchicamente raggruppata di marcatori immuno-specifici delle cellule immunitarie / arricchito (selezionati dalla risorsa IRIS) nei 36 pazienti critici a 0 e 24 ore dopo l’infortunio. (C) Le analisi citometriche a flusso erano coerenti con la deconvoluzione. C’è stato un aumento del numero di neutrofili e linfociti (principalmente cellule NK) nella finestra iperacuta. Entro 24 ore, i linfociti totali e le cellule NK erano al di sotto della norma (rispetto ai volontari sani), e mediana T-cellule conteggi mediana era anche sceso significativamente al di sotto dei conteggi di controllo sani. (Conteggio totale dei leucociti: volontario sano: 5,8 (4,4-7,1) x 109/L; 0 ore: 19.5 (13.0-23.1) x 109/L; 24 ore: 10,4 (7,8-14,1) x 109/L; 72 ore: 8,2 (6,6-11,7) x 109/L. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0, 0001).

Fig. 3.Percorsi e biofunzioni nella risposta iperacuta alla lesione critica.(A) L’analisi del percorso di ingegno di geni espressi differenzialmente nella finestra iperacuto (Critical versus Control, 0 ore) procedendo a 24 ore dopo l’infortunio (Critical 24 ore versus Critical 0 ore). In generale, nella finestra iperacuta, c’è up-regolazione della risposta infiammatoria innata e down-regolazione di alcune vie immunitarie adattive. Da 24 ore, c’è una preponderanza molto maggiore di risposte down-regolate. (B) La malattia dell’ingenuità e l’analisi della biofunzione dei geni differenzialmente espressi nella finestra iperacuta (Critical versus Control, 0 ore) procedendo a 24 ore dopo l’infortunio (Critical 24 ore versus Critical 0 ore). Anche in questo caso, c’è un immediato up-regolamentazione delle biofunzioni legate all’infiammazione e al movimento dei leucociti, con un down-regolamentazione che diventa più prominente a 24 ore.

Fig. 4.Analisi dei sistemi immunitari nella finestra iperacuta.(A) Profili di espressione genica dei 16 geni con la maggiore differenza di espressione tra la finestra iperacuta e le 24 ore dopo l’infortunio nell’analisi del trascrittoma Critical versus Control. (B) Analisi del modulo immunitario della risposta critica alla lesione. Anche in questo caso, c’è stata una risposta differenziale tra la risposta iperacuta e i punti temporali successivi. C’è stata una sovraespressione nei moduli associati all’infiammazione e nei moduli delle cellule di neutrofili e di killer naturale (NK). Ci sono state sovra e sottoespressioni miste in moduli relativi a cellule T e cellule B/plasma e sottoespressione di moduli relativi a monocito (contrariamente ai dati di deconvoluzione della Fig 2B).
Sviluppo dei MODS
Volevamo determinare se potevamo identificare un segnale trascrittomico per lo sviluppo del MODS. Abbiamo scoperto che quasi tutta la risposta differenziale associata al successivo sviluppo del MODS era presente nella finestra iperacuta con pochissimi cambiamenti a 24 ore dall’incidente o successivamente(Fig 5). Entro 2 ore dalla lesione, 363 trascrizioni sono state espresse in modo differenziale in pazienti che hanno sviluppato successivamente il MODS rispetto a quelli che non lo hanno fatto. Nelle 24 ore successive all’infortunio, solo 33 geni sono stati espressi in modo differenziato nei pazienti MODS rispetto a quelli NoMODS, e 28 geni a 72 ore(Fig 5A). Nelle analisi dei cluster e dei componenti principali, la risposta iperacuta nei pazienti che hanno sviluppato successivamente il MODS è stata molto diversa sia dai pazienti che non hanno mai sviluppato il MODS, sia dai pazienti che hanno sviluppato il MODS in tempi successivi(Fig 5B e 5C). In esame, 2 dei 3 pazienti MODS che si sono raggruppati con i pazienti NoMODS avevano punteggi SOFA borderline, che erano scesi al di sotto dei criteri di soglia per i MODS entro il terzo giorno dopo l’infortunio. La firma MODS è chiaramente impostata all’interno della finestra iperacuta, e la maggior parte di questi geni normalizza o inverte i loro livelli di espressione di 24 ore(Fig 6A & 6B).
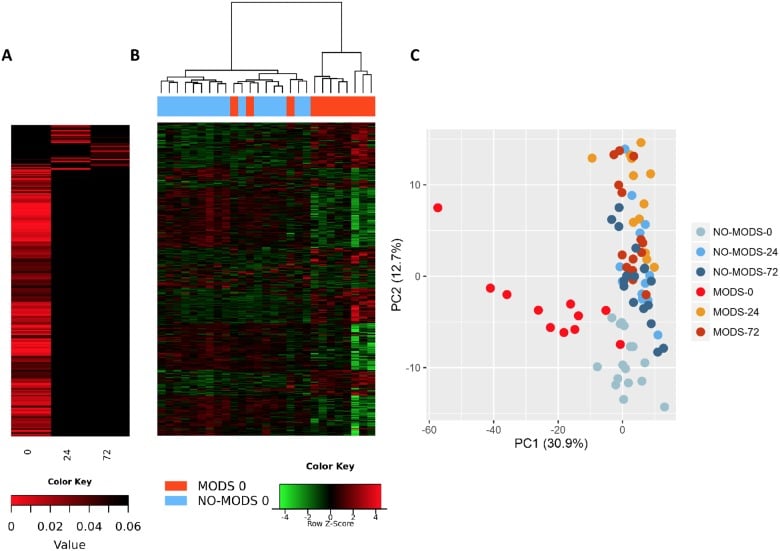
Fig 5.I pazienti che sviluppano la Sindrome da Disfunzione Multipla di Organo (MODS) hanno un’espressione genica differenziale specifica solo nella finestra iperacuta.(A) Heatmap di espressione differenziale con colonne che mostrano i valori di log p di tutti i geni espressi differenzialmente tra 20 pazienti critici che hanno sviluppato MODS in seguito contro 16 pazienti che non hanno sviluppato MODS (NoMODS) a 0 ore (punto temporale iperacuto), 24 ore e 72 ore dopo l’infortunio. A 0 ore, 363 trascrizioni sono state espresse in modo differenziato tra pazienti MODS e NoMODS, e solo 33 e 28 trascrizioni a 24 e 72 ore, rispettivamente. (B) Cluster analisi dei geni espressi in modo differenziato nei pazienti MODS rispetto ai pazienti NoMODs nella finestra iperacuta. Pazienti MODS raggruppati separatamente a parte 3 pazienti, 2 dei quali avevano un fenotipo clinico lieve che si è rapidamente risolto. (C) L’analisi dei componenti principali dei geni espressi in modo differenziato nei pazienti MODS contro NoMODS a 0 (finestra iperacuta), 24, e 72 ore dopo l’infortunio. C’è stata una forte separazione nella risposta trascrittomica alla MODS nella finestra iperacuta.

Fig 6.Espressione genica differenziale dei pazienti che in seguito sviluppano la Sindrome da Disfunzione Multipla d’Organo (MODS).(A) Profili di espressione genica dei 16 geni con la maggiore differenza di espressione tra i MODS e quelli che non hanno sviluppato MODS (NoMODS), che sono stati espressi in modo differenziato anche nell’analisi Critical versus Control. Le maggiori differenze nell’espressione MODS rispetto a NoMODS si vedono in tutti i casi nel punto temporale iperacuto (0 ore). (B) Rappresentazione in rete di Coexpression di tutti i geni MODS espressi in modo differenziato. I geni colorati sono quelli mappati per la morte delle cellule e percorsi di sopravvivenza dell’organismo. Rosso: up-regolato; verde: down-regolato. Sono rappresentati due cluster strettamente correlati, con la morte cellulare rappresentata attraverso entrambi i cluster. C’è un’inversione quasi completa del modello di espressione di questi geni tra la finestra iperacuta e le 24 ore dopo l’incidente.
Trascrizioni MODS differenzialmente espresse nella finestra iperacuta ha mostrato l’arricchimento tra le malattie e le funzioni biologiche associate con la sopravvivenza cellulare e la morte dell’organismo(Fig 7A). I geni espressi differenzialmente sono stati annotati per la morte cellulare, la necrosi o le funzioni di apoptosi in più linee cellulari. Solo 20 (6%) delle trascrizioni sono state annotate ai geni associati a una risposta infiammatoria. Nell’analisi delle vie canoniche, c’era una netta differenza tra le vie attivate nella risposta critica(Fig 3A) e quelle associate allo sviluppo del MODS(Fig 7B). Mentre i geni classici e le vie infiammatorie (ad esempio, IL-8, IL-10) non sono comparsi nell’analisi, molti erano legati alla regolazione o alla segnalazione a valle di queste vie (ad esempio, STAT3, ERK, e IGF-1 per IL-6). Un’analisi di conferma che confronta i geni espressi differenzialmente identificati in 2 analisi separate -MODS versus Control e NoMODS versus Control – ha dato risultati coerenti sia nelle analisi delle vie che in quelle delle biofunzioni (Fig7A e 7B).
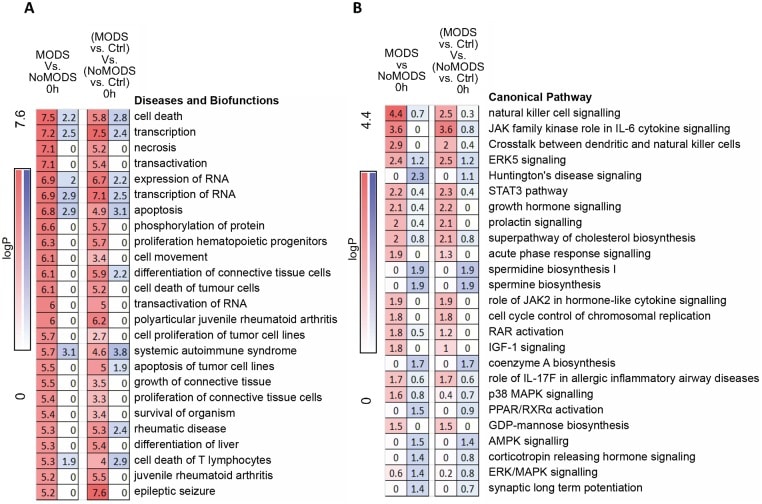
Fig 7.Fig. 7. Percorsi e biofunzioni nella risposta iperacuta nei pazienti che sviluppano successivamente la Sindrome da Disfunzione Multipla d’Organo (MODS) rispetto a quelli che non la sviluppano (NoMODS).(A) L’analisi del percorso canonica dell’ingegno dei geni che mostrano un’espressione differenziale a 0 ore dopo l’infortunio in pazienti che hanno sperimentato la MODS rispetto a quelli che non l’hanno sperimentata (MODS contro NoMODS, 0 ore). (B) Analisi delle Malattie dell’Ingenuità e delle Biofunzioni dei geni che mostrano un’espressione differenziale a 0 ore in pazienti che hanno sperimentato il MODS rispetto a quelli che non l’hanno sperimentato (MODS contro NoMODS, 0 ore). C’è poca sovrapposizione tra i percorsi identificati nell’analisi MODS e quelli della risposta all’analisi delle lesioni critiche nella Fig 3A. In entrambe le analisi appare solo la segnalazione della risposta in fase acuta.
Nella deconvoluzione del tipo di cellule immunitarie, pochi marcatori sono stati identificati all’interno del set di geni espressi in modo differenziato MODS, ma i marcatori delle cellule NK e dendritiche sono stati up-regolati in MODS(S3 Fig). I percorsi di segnalazione delle cellule NK erano anche altamente rappresentati nell’analisi dei percorsi canonici(Fig 7B). Al contrario, c’è stato un differenziale down-regolazione nei geni di firma deconvoluzione neutrofili in quei pazienti che hanno continuato a sviluppare MODS e sostanzialmente nessun segnale iperacuto per MODS in marcatori trascrittomatici per le popolazioni di cellule T e B(S3 Fig). I moduli immunitari associati a questi geni MODS erano per lo più non preannunciati nei moduli M6, 7, 8 e 9(S3 Fig), evidenziando ancora una volta che le vie infiammatorie non erano preponderanti nella firma MODS (principalmente i moduli da M1 a M5). Tuttavia, ancora una volta, c’è stato un segnale nell’analisi dei moduli per la sovraespressione nei moduli di cellule citotossiche/NK (M3.6, M8.46) e la sottoespressione nei neutrofili (M.15). Una firma trascrittomica per il successivo sviluppo di MODS è presente nella finestra iperacuta dopo la lesione, mostra un forte segnale per i percorsi di morte delle cellule, e coinvolge le cellule NK e le popolazioni di neutrofili in questa risposta differenziale.

Fig 5.I pazienti che sviluppano la Sindrome da Disfunzione Multipla di Organo (MODS) hanno una specifica espressione genica differenziale solo nella finestra iperacuta.(A) Heatmap di espressione differenziale con colonne che mostrano i valori di log p di tutti i geni espressi differenzialmente tra 20 pazienti critici che hanno successivamente sviluppato MODS contro 16 pazienti che non hanno sviluppato MODS (NoMODS) a 0 ore (punto temporale iperacuto), 24 ore, e 72 ore dopo l’infortunio. A 0 ore, 363 trascrizioni sono state espresse in modo differenziato tra pazienti MODS e NoMODS, e solo 33 e 28 trascrizioni a 24 e 72 ore, rispettivamente. (B) Cluster analisi dei geni espressi in modo differenziato nei pazienti MODS rispetto ai pazienti NoMODs nella finestra iperacuta. Pazienti MODS raggruppati separatamente a parte 3 pazienti, 2 dei quali avevano un fenotipo clinico lieve che si è rapidamente risolto. (C) L’analisi dei componenti principali dei geni espressi in modo differenziato nei pazienti MODS contro NoMODS a 0 (finestra iperacuta), 24, e 72 ore dopo l’infortunio. C’è stata una forte separazione nella risposta trascrittomica alla MODS nella finestra iperacuta.

Fig 6.Espressione genica differenziale dei pazienti che in seguito sviluppano la Sindrome da Disfunzione Multipla d’Organo (MODS).(A) Profili di espressione genica dei 16 geni con la maggiore differenza di espressione tra i MODS e quelli che non hanno sviluppato MODS (NoMODS), che sono stati espressi in modo differenziato anche nell’analisi Critical versus Control. Le maggiori differenze nell’espressione MODS rispetto a NoMODS si vedono in tutti i casi nel punto temporale iperacuto (0 ore). (B) Rappresentazione in rete di Coexpression di tutti i geni MODS espressi in modo differenziato. I geni colorati sono quelli mappati per la morte delle cellule e percorsi di sopravvivenza dell’organismo. Rosso: up-regolato; verde: down-regolato. Sono rappresentati due cluster strettamente correlati, con la morte cellulare rappresentata attraverso entrambi i cluster. C’è un’inversione quasi completa del modello di espressione di questi geni tra la finestra iperacuta e le 24 ore dopo l’incidente.

Fig 7.Fig. 7. Percorsi e biofunzioni nella risposta iperacuta nei pazienti che in seguito sviluppano la Sindrome da Disfunzione Multipla d’Organo (MODS) rispetto a quelli che non la sviluppano (NoMODS).(A) L’analisi delle vie canoniche dell’ingegno dei geni che mostrano un’espressione differenziale a 0 ore dopo l’infortunio in pazienti che hanno sperimentato la MODS rispetto a quelli che non l’hanno sperimentata (MODS contro NoMODS, 0 ore). (B) Analisi delle Malattie dell’Ingenuità e delle Biofunzioni dei geni che mostrano un’espressione differenziale a 0 ore in pazienti che hanno sperimentato il MODS rispetto a quelli che non l’hanno sperimentato (MODS contro NoMODS, 0 ore). C’è poca sovrapposizione tra i percorsi identificati nell’analisi MODS e quelli della risposta all’analisi delle lesioni critiche nella Fig 3A. In entrambe le analisi appare solo la segnalazione della risposta in fase acuta.
Discussione
La nostra analisi presenta una rara visione della finestra iperacuta della risposta acuta alle lesioni critiche. Questo periodo di tempo clinicamente deterministico mostra una firma unica della regolazione del trascrittoma che non è prevedibile da studi successivi. La risposta iperacuta trascrittomica alla lesione critica coinvolge solo il 4% del genoma. Questo cambia poi nell’arco di 24 ore sia nel carattere che nella scala ad una risposta diffusa, che alcuni hanno definito “tempesta genomica” [10]. Lo sviluppo di MODS sembra essere impostato all’interno della finestra iperacuta e sembra essere principalmente una risposta differenziale di morte cellulare e percorsi di sopravvivenza piuttosto che un eccessivo stato pro-infiammatorio.
Una risposta focalizzata e iperacuta implica che la risposta acuta al danno può essere definita e potenzialmente misurata e terapeuticamente modulata. Una volta che la “tempesta” è stabilita, è quasi impossibile da influenzare e si può solo permettere che il suo corso si svolga. Un risultato importante del nostro studio è che sia il carattere delle popolazioni leucocitarie che le loro risposte trascrittomiche sono molto diverse tra le 2 ore e le 24 ore dopo la lesione, e questo non è semplicemente una progressione della risposta in termini di grandezza e di cascate di segnale. La risposta acuta a un danno critico non può quindi essere compresa esaminando i punti temporali tardivi e deve includere la fase di cura immediatamente successiva all’infortunio.
La risposta iperacuta è caratterizzata da un up-regolazione delle vie infiammatorie prevalentemente innate e da un down-regolazione di alcune vie adattive classiche. L’analisi delle vie di ingenuità e delle biofunzioni, la deconvoluzione delle cellule immunitarie e l’analisi modulare sono state tutte coerenti nell’identificare un up-regolamentazione delle vie di riconoscimento del danno e delle vie di segnalazione infiammatoria a valle associate ai concetti fondamentali di attivazione dei recettori di riconoscimento del modello che portano all’attivazione dell’infiammazione sterile. Le cellule NK sono emerse come potenzialmente centrali per la risposta immediata alle lesioni critiche. Le risposte linfoidi innate al trauma sono state scarsamente studiate in letteratura e si riferiscono a una funzione NK difettosa o compromessa, poiché i pazienti sono studiati in ritardo nel decorso clinico[34-36]. La regolazione precoce delle risposte adattive e la regolazione dei percorsi immunosoppressivi deve essere ulteriormente studiata, ma può aiutare a spiegare lo sviluppo di un fenotipo auto-tollerante o immunosoppressivo in pazienti con traumi critici[37-38].
Nelle 24 ore successive alla lesione, oltre un quinto del trascrittoma è stato espresso in modo differenziato rispetto al profilo iperacuto. Questa attivazione diffusa è stata definita una “tempesta genomica”, anche se i rapporti precedenti suggerivano che essa colpisse una percentuale ancora maggiore di circa l’80% del trascrittoma [10]. La differenza nel nostro studio può essere dovuta a diversi fattori, tra cui le differenze nella rianimazione traumatica contemporanea (ad esempio, evitare i cristalloidi), il nostro uso di leuco esaurito trasfusioni di globuli rossi, o la nostra metodologia analitica. Non è chiaro quale proporzione di questa tempesta genomica sia dovuta all’attivazione a cascata dell’infiammazione o ai cambiamenti nelle popolazioni leucocitarie stesse. Abbiamo dimostrato che ci sono marcati cambiamenti nelle popolazioni leucocitarie in circolazione tra il ricovero e le 24 ore. Alcune cellule si estraggono nei tessuti e altre vengono reclutate dal midollo osseo, dal fegato, dalla milza e da altri depositi, comprese le popolazioni non presenti in proporzioni significative[15, 39]. Queste cellule porteranno con sé i loro propri trascrittimi, contribuiranno ai cambiamenti diffusi osservati a 24 ore e potrebbero essere responsabili del cambiamento verso il down-regolamentazione visto in questo momento successivo. Le vie infiammatorie innate della risposta iperacuta erano già in fase di down-regolazione, la risposta linfoide innata delle cellule era scomparsa, e le risposte adattive in particolare stavano diventando sempre più predominanti. Le analisi della biofunzione, del percorso e del modulo hanno mostrato modelli diffusi e coerenti di disfunzione a 24 ore. Ciò suggerisce che, qualunque sia la fonte del trascrittoma, la risposta acuta alla lesione induce profondi e diffusi cambiamenti fisiopatologici nei leucociti circolanti che meritano il termine “tempesta genomica”. Il “lembo delle ali di farfalla” nella risposta iperacuta era quasi completamente distinto dal successivo profilo trascrittomico della tempesta genomica e rappresenta un’area importante per la ricerca traslazionale.
La finestra iperacuta conteneva una discreta firma trascrittomica per lo sviluppo di MODS che non è rilevabile a 24 ore dopo l’incidente. Studi precedenti che si concentravano su punti temporali successivi post-infortunio non sono riusciti a identificare un modello trascrittomico specifico per il MODS e hanno concluso che deve essere correlato solo alla grandezza della risposta[10]. Oltre alla fase iperacuta, abbiamo anche trovato una differenziazione limitata tra i pazienti in base al loro successivo sviluppo del MODS. Una risposta a cascata o a 2 hit mostrerebbe come un progressivo aumento della grandezza della risposta, in un pattern simile alla Fig 1A. Il fatto che la firma MODS sia presente implica immediatamente che ciò sia dovuto o alla natura delle lesioni stesse, o che vi sia una preesistente propensione ad una risposta differenziale allo stesso insulto fisico[40]. I pazienti affetti da MODS avevano lattato più elevato e deficit di base al momento dell’ammissione, e lo shock è un noto forte predittore dello sviluppo del MODS[41]. È possibile che la risposta genomica allo shock sia uno dei principali fattori che determinano i cambiamenti osservati nella fisiologia iperacuta della finestra, che, per la maggior parte, sarà invertita nei sopravvissuti di 24 ore. Saranno necessarie analisi su scala più ampia per determinare i driver della risposta trascriptomica differenziale iperacuta associata allo sviluppo dei MODS.
Il MODS è solitamente inteso come una risposta infiammatoria disordinata o eccessiva. Le vie infiammatorie classiche studiate nella patogenesi dei traumi da insufficienza d’organo multipla come l’IL-6, l’IL-8 e l’IL-10 non sono state espresse in modo differenziato nei pazienti che avrebbero sviluppato successivamente la MODS. Tuttavia, le risposte differenziali nella regolazione e nella segnalazione a valle di questi percorsi, ad esempio, i percorsi STAT3, ERK, e IGF-1 per l’IL-6, hanno caratterizzato fortemente nelle analisi. Una risposta differenziale di regolazione o di segnalazione a valle dell’IL-6 e di altri percorsi infiammatori può essere deterministica per lo sviluppo di MODS in pazienti con traumi critici.
Tuttavia, l’analisi delle vie della risposta trascrittomica iperacuta ha mostrato un arricchimento molto più elevato delle vie associate alla sopravvivenza cellulare e alla morte, come l’apoptosi e le vie di necrosi. Nell’analisi dei moduli immunitari, quei moduli che erano sovrarappresentati nei MODS erano generalmente scarsamente annotati e non ampiamente condivisi tra i disturbi infiammatori utilizzati per costruire la risorsa[29]. Insieme, questi risultati suggeriscono che il driver principale del MODS può essere un’attivazione differenziale delle risposte di morte cellulare alla lesione piuttosto che una malattia classicamente infiammatoria-driven. Gli agenti terapeutici noti per regolare i percorsi di sopravvivenza sembrano migliorare la lesione d’organo nei modelli sperimentali di traumi gravi[42], e la nostra scoperta è coerente con questo, ma richiede ulteriori studi. Le risposte differenziali nelle cellule NK sono apparse di nuovo implicate nello sviluppo di MODS, focalizzando l’attenzione sul ruolo delle popolazioni linfoidi innate nella risposta acuta al trauma[15]. La relativa riduzione dei marcatori dei neutrofili è stata una scoperta sorprendente, data la tradizionale comprensione del ruolo dei neutrofili nello sviluppo di disfunzioni multiple d’organo[43- 44], anche se è necessario un ulteriore lavoro per confermarlo. La finestra iperacuta ha fornito una visione molto diversa della patogenesi dei MODS rispetto a quella che si potrebbe ricavare da indagini successive.
Ci sono diversi limiti a questo studio. Anche se abbiamo visto forti firme trascrittomiche, la dimensione del nostro campione era relativamente piccola. Abbiamo cercato di ridurre l’eterogeneità delle popolazioni campione selezionando o escludendo specifici tipi di lesioni e abbiamo arricchito la risposta scegliendo solo una coorte di pazienti con lesioni critiche da esaminare. Un ulteriore studio di coorti più ampie amplierà senza dubbio i risultati iniziali di questo lavoro. Abbiamo anche prelevato campioni solo nella finestra iperacuta e nelle 24 e 72 ore successive. Non sappiamo quindi quanto sia lunga la finestra iperacuta, né quando e come la firma cambi alla risposta trascrittomica più stabile vista dopo 24 ore. Gli studi precedenti sono stati campionati tardivamente o durante il periodo iniziale di 24 ore. Questi studi hanno suggerito che ci sono firme genomiche successive che possono discriminare tra diversi fenotipi MODS[45]. È quindi necessario un ulteriore studio dei punti temporali intermedi e successivi dopo la lesione. Ulteriori analisi di citometria a flusso è anche necessario per esaminare le sottopopolazioni cellulari e marcatori di attivazione associati alle risposte trascrittomiche osservate. Infine, si tratta di un’analisi del solo compartimento circolante, e i nostri risultati non possono quindi riflettere i cambiamenti nei tessuti nel sito della lesione o nei tessuti nei siti di disfunzioni d’organo.
In sintesi, il periodo di tempo iperacuto dopo la lesione contiene una firma specifica della risposta alla lesione critica che è una finestra importante nella nostra comprensione dell’infiammazione sterile e lo sviluppo di una risposta differenziale che può portare a scarsi risultati come il MODS. Contrariamente alle aspettative, il segnale MODS è stato più forte nella finestra iperacuta e ha suggerito un ruolo per l’attivazione differenziale dei percorsi di morte cellulare, coinvolgendo in particolare la popolazione cellulare NK. Poiché il trauma è una delle poche malattie per le quali è noto il momento dell’insulto iniziale, questo fornisce una finestra unica nella biologia dell’infiammazione umana. I risultati suggeriscono molteplici nuove direzioni per la ricerca di scoperta e offrono opportunità di traduzione nella diagnostica, nella progettazione di studi clinici, nella medicina di precisione e in nuovi approcci terapeutici e gestionali. La comprensione della risposta umana iperacuta del sistema di coagulazione ha cambiato un intero paradigma di rianimazione nel giro di un decennio. È possibile che la comprensione della risposta infiammatoria iperacuta faccia lo stesso per il nostro approccio alla disfunzione e alla protezione degli organi.
Informazioni di supporto
References
- Lord JM, Midwinter MJ, Chen YF, Belli A, Brohi K, Kovacs EJ. The systemic immune response to trauma: an overview of pathophysiology and treatment. Lancet. 2014; 384(9952):1455-65. Publisher Full Text | PubMed
- Shepherd JM, Cole E, Brohi K. Contemporary patterns of multiple organ dysfunction in trauma. Shock. 2017; 47(4):429-435. Publisher Full Text | PubMed
- Sauaia A, Moore EE, Johnson JL, Chin TL, Banerjee A, Sperry JL. Temporal trends of postinjury multiple-organ failure: still resource intensive, morbid, and lethal. J Trauma Acute Care Surg. 2014; 76(3):582-92. Publisher Full Text | PubMed
- GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet. 2015; 385(9963):117-71. Publisher Full Text | PubMed
- GBD 2013 DALYs and HALE Collaborators, Murray CJ, Barber RM, Foreman KJ, Abbasoglu Ozgoren A, Abd-Allah F, Abera SF. Global, regional, and national disability-adjusted life years (DALYs) for 306 diseases and injuries and healthy life expectancy (HALE) for 188 countries, 1990–2013: quantifying the epidemiological transition. Lancet. 2015; 386(10009):2145-91. Publisher Full Text | PubMed
- Haagsma JA, Graetz N, Bolliger I, Naghavi M, Higashi H, Mullany EC. The global burden of injury: incidence, mortality, disability-adjusted life years and time trends from the Global Burden of Disease study 2013. Inj Prev. 2016; 22(1):3-18. Publisher Full Text | PubMed
- Hensler T, Heinemann B, Sauerland S, Lefering R, Bouillon B, Andermahr J. Immunologic alterations associated with high blood transfusion volume after multiple injury: effects on plasmatic cytokine and cytokine receptor concentrations. Shock. 2003; 20(6):497-502. Publisher Full Text | PubMed
- Moore FA, Sauaia A, Moore EE, Haenel JB, Burch JM, Lezotte DC. Postinjury multiple organ failure: a bimodal phenomenon. J Trauma. 1996; 40(4):501-10. PubMed
- Tschoeke SK, Hellmuth M, Hostmann A, Ertel W, Oberholzer A. The early second hit in trauma management augments the proinflammatory immune response to multiple injuries. J Trauma. 2007; 62(6):1396-403. Publisher Full Text | PubMed
- Xiao W, Mindrinos MN, Seok J, Cuschieri J, Cuenca AG, Gao H. Inflammation and Host Response to Injury Large Scale Collaborative Research Program. A genomic storm in critically injured humans. J Exp Med. 2011; 208(13):2581-90. PubMed
- Brohi K, Singh J, Heron M, Coats T. Acute traumatic coagulopathy. J Trauma. 2003; 54(6):1127-30. Publisher Full Text | PubMed
- Holcomb JB, Jenkins D, Rhee P, Johannigman J, Mahoney P, Mehta S. Damage control resuscitation: directly addressing the early coagulopathy of trauma. J Trauma. 2007; 62(2):307-10. Publisher Full Text | PubMed
- Oyeniyi BT, Fox EE, Scerbo M, Tomasek JS, Wade CE, Holcomb JB. Trends in 1029 trauma deaths at a level 1 trauma center: Impact of a bleeding control bundle of care. Injury. 2017; 48(1):5-12. Publisher Full Text | PubMed
- Langan NR, Eckert M, Martin MJ. Changing patterns of in-hospital deaths following implementation of damage control resuscitation practices in US forward military treatment facilities. JAMA Surg. 2014; 149(9):904-12. Publisher Full Text | PubMed
- Manson J, Cole E, De’Ath HD, Vulliamy P, Meier U, Pennington D. Early changes within the lymphocyte population are associated with the development of multiple organ dysfunction syndrome in trauma patients. Crit Care. 2016; 20(1):176. Publisher Full Text | PubMed
- Baker SP, O’Neill B, Haddon W, Long WB. The injury severity score: a method for describing patients with multiple injuries and evaluating emergency care. J Trauma. 1974; 14(3):187-96. PubMed
- Copes WS, Champion HR, Sacco WJ, Lawnick MM, Gann DS, Gennarelli T. Progress in characterizing anatomic injury. J Trauma. 1990; 30(10):1200-7. PubMed
- Antonelli M, Moreno R, Vincent JL, Sprung CL, Mendoça A, Passariello M. Application of SOFA score to trauma patients. Sequential Organ Failure Assessment. Intensive Care Med. 1999; 25(4):389-94. PubMed
- Ciesla DJ, Moore EE, Johnson JL, Sauaia A, Cothren CC, Moore JB. Multiple organ dysfunction during resuscitation is not postinjury multiple organ failure. Arch Surg. 2004; 139(6):590-4. Publisher Full Text | PubMed
- Pachot A, Monneret G, Voirin N, Leissner P, Venet F, Bohé J. Longitudinal study of cytokine and immune transcription factor mRNA expression in septic shock. Clin Immunol. 2005; 114(1):61-9. Publisher Full Text | PubMed
- Johnson WE, Li C, Rabinovic A. Adjusting batch effects in microarray expression data using empirical Bayes methods. Biostatistics. 2007; 8(1):118-27. Publisher Full Text | PubMed
- Shi W, Oshlack A, Smyth GK. Optimizing the noise versus bias trade-off for Illumina whole genome expression BeadChips. Nucleic Acids Res. 2010; 38(22):e204. Publisher Full Text | PubMed
- Ritchie ME, Phipson B, Wu D, Hu Y, Law CW, Shi W, Smyth GK. limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Res. 2015; 43(7):e47. Publisher Full Text | PubMed
- Smyth GK, Michaud J, Scott HS. Use of within-array replicate spots for assessing differential expression in microarray experiments. Bioinformatics. 2005; 21(9):2067-2075. Publisher Full Text | PubMed
- Benjamini Y, Hochberg Y. Controlling the False Discovery Rate: A Practical and Powerful Approach to Multiple Testing. J. R. Statist. Soc. B. 1995; 57:289-300.
- Theocharidis A, van Dongen S, Enright AJ, Freeman TC. Network visualization and analysis of gene expression data using BioLayout Express(3D). Nat Protoc. 2009; 4(10):1535-50. Publisher Full Text | PubMed
- Abbas AR, Baldwin D, Ma Y, Ouyang W, Gurney A, Martin F. Immune response in silico (IRIS): immune-specific genes identified from a compendium of microarray expression data. Genes Immun. 2005; 6(4):319-31. Publisher Full Text | PubMed
- de Hoon MJ, Imoto S, Nolan J, Miyano S. Open source clustering software. Bioinformatics. 2004; 20(9):1453-4. Publisher Full Text | PubMed
- Chaussabel D, Quinn C, Shen J, Patel P, Glaser C, Baldwin N. A modular analysis framework for blood genomics studies: application to systemic lupus erythematosus. Immunity. 2008; 29(1):150-64. Publisher Full Text | PubMed
- .Publisher Full Text
- Yaari G, Bolen CR, Thakar J, Kleinstein SH. Quantitative set analysis for gene expression: a method to quantify gene set differential expression including gene-gene correlations. Nucleic Acids Res. 2013; 41(18):e170. Publisher Full Text | PubMed
- Turner JA, Bolen CR, Blankenship DM. Quantitative gene set analysis generalized for repeated measures, confounder adjustment, and continuous covariates. BMC Bioinformatics. 2015; 16:272. Publisher Full Text | PubMed
- Pinheiro JC, Bates DM. Mixed effects models in S and S-PLUS. Springer-Verlag: New York; 2000.
- Schneider DF, Glenn CH, Faunce DE. Innate lymphocyte subsets and their immunoregulatory roles in burn injury and sepsis. J Burn Care Res. 2007; 28(3):365-79. Publisher Full Text | PubMed
- Hua R, Zhang Y, Chen F, Zhou Z, Li X, Shao B. Decreased levels of perforin-positive lymphocytes are associated with posttraumatic complications in patients with major trauma. Injury. 2014; 45(12):2089-95. Publisher Full Text | PubMed
- Yadav K, Zehtabchi S, Nemes PC, Miller AC, Azher M, Durkin H, Sinert R. Early immunologic responses to trauma in the emergency department patients with major injuries. Resuscitation. 2009; 80(1):83-8. Publisher Full Text | PubMed
- Gentile LF, Cuenca AG, Efron PA, Ang D, Bihorac A, McKinley BA, Moldawer LL. Persistent inflammation and immunosuppression: a common syndrome and new horizon for surgical intensive care. J Trauma Acute Care Surg. 2012; 72(6):1491-501. Publisher Full Text | PubMed
- Vanzant EL, Lopez CM, Ozrazgat-Baslanti T, Ungaro R, Davis R, Cuenca AG. Persistent inflammation, immunosuppression, and catabolism syndrome after severe blunt trauma. J Trauma Acute Care Surg. 2014; 76(1):21-9. Publisher Full Text | PubMed
- Pillay J, Kamp VM, van Hoffen E, Visser T, Tak T, Lammers JW. A subset of neutrophils in human systemic inflammation inhibits T cell responses through Mac-1. J Clin Invest. 2012; 122(1):327-36. Publisher Full Text | PubMed
- Namas RA, Vodovotz Y, Almahmoud K, Abdul-Malak O, Zaaqoq A, Namas R. Temporal Patterns of Circulating Inflammation Biomarker Networks Differentiate Susceptibility to Nosocomial Infection Following Blunt Trauma in Humans. Ann Surg. 2016; 263(1):191-8. Publisher Full Text | PubMed
- Minei JP, Cuschieri J, Sperry J, Moore EE, West MA, Harbrecht BG. Inflammation and the Host Response to Injury Collaborative Research Program. The changing pattern and implications of multiple organ failure after blunt injury with hemorrhagic shock. Crit Care Med. 2012; 40(4):1129-35. PubMed
- Sordi R, Nandra KK, Chiazza F, Johnson FL, Cabrera CP, Torrance HD. Artesunate Protects Against the Organ Injury and Dysfunction Induced by Severe Hemorrhage and Resuscitation. Ann Surg. 2017; 265(2):408-417. Publisher Full Text | PubMed
- Hazeldine J, Hampson P, Lord JM. The impact of trauma on neutrophil function. Injury. 2014; 45(12):1824-33. Publisher Full Text | PubMed
- Leliefeld PH, Wessels CM, Leenen LP, Koenderman L, Pillay J. The role of neutrophils in immune dysfunction during severe inflammation. Crit Care. 2016; 20:73. Publisher Full Text | PubMed
- Desai KH, Tan CS, Leek JT, Maier RV, Tompkins RG, Storey JD, Inflammation and the Host Response to Injury Large-Scale Collaborative Research Program. Dissecting inflammatory complications in critically injured patients by within-patient gene expression changes: a longitudinal clinical genomics study. PLoS Med. 2011; 8(9):e1001093. Publisher Full Text | PubMed
Fonte
Cabrera CP, Manson J, Shepherd JM, Torrance HD, Watson D, et al. (2017) Signatures of inflammation and impending multiple organ dysfunction in the hyperacute phase of trauma: A prospective cohort study. PLoS Medicine 14(7): e1002352. https://doi.org/10.1371/journal.pmed.1002352





