Abstract
Dichiarazione di importanza
Le persone affette da epilessia sono più a rischio di disturbi endocrini riproduttivi rispetto alla popolazione generale, ma i meccanismi neurali che collegano l’epilessia a queste comorbidità sono sconosciuti. Qui, riportiamo i cambiamenti nella funzione dei neuroni dell’ormone gonadotropina (GnRH), che controllano la fertilità, in un modello murino di epilessia del lobo temporale (TLE). GnRH neuroni GnRH da topi epilettici femminili hanno mostrato cambiamenti nell’attività dipendente dalla fase del ciclo estroso e associati con la gravità della rottura del ciclo. Gli impatti dell’epilessia sui neuroni GnRH nei maschi erano meno gravi. Questi risultati forniscono nuove prove per gli impatti dell’epilessia sulla funzione dei neuroni di GnRH, e sarà quindi di rilevanza clinica nello sviluppo di nuove strategie per migliorare le comorbidità riproduttive e per trattare le crisi sottostanti e l’epilessia.
Introduzione
I disturbi endocrini riproduttivi sono comorbidità prominenti dell’epilessia(Herzog et al., 1986a,b; Bilo et al., 2001; Klein et al., 2001; Löfgren et al., 2007; Bauer e Cooper-Mahkorn, 2008). Per esempio, il 10-20% delle donne con epilessia sviluppa la sindrome dell’ovaio policistico, rispetto al 5% delle donne senza epilessia (Baueret al., 2000; Herzog, 2008). Si osservano comunemente anche intervalli del ciclo mestruale interrotti e amenorrea(Herzog et al., 2003; Herzog, 2008; Zhou et al., 2012). Inoltre, anomalie dello sperma sono segnalati in fino al 90% degli uomini con epilessia(Herzog, 2008), e 10-30% degli uomini con epilessia focale sviluppano bassi livelli sierici di testosterone (T) (Talbotet al., 2008). I meccanismi neurali che collegano l’epilessia ai disturbi endocrini riproduttivi comorbidi sono sconosciuti.
L’epilessia del lobo temporale (TLE) è l’epilessia focale più comune nei pazienti in età riproduttiva(Engel, 2001). Circa il 60% delle donne con TLE che non assumono farmaci antiepilettici presenta disturbi mestruali, il che indica che esiste una forte associazione tra le crisi di TLE e la disfunzione endocrina riproduttiva(Herzog et al., 1986a). Inoltre, le convulsioni sono aggravate in alcune fasi del ciclo mestruale in ∼40% delle donne con epilessia, un modello chiamato epilessia catameniale (Laidlaw, 1956; Herzog et al., 2004). Un tipo importante di epilessia catameniale è caratterizzata da un periodo prolungato di elevata suscettibilità alle crisi e clustering sequestro associato ad una fase luteale inadeguata all’interno irregolare, cicli mestruali anovulatori(Herzog et al., 1997). Pertanto, il controllo delle crisi attraverso il ripristino della corretta ciclicità riproduttiva potrebbe essere un nuovo approccio terapeutico per molte donne affette da epilessia. La comprensione dei meccanismi alla base dei disturbi endocrini riproduttivi indotti dall’epilessia è fondamentale per lo sviluppo di nuove strategie sia per il mantenimento del ciclo riproduttivo che per la gestione delle crisi.
I neuroni dell’ormone gonadotropina ipotalamico che rilascia la gonadotropina (GnRH) sono l’output neurale finale che guida l’attività degli elementi a valle dell’asse ipotalamo-ipofisario-gonadi (HPG)(Herbison, 2006; Christian, 2017). A causa della difficoltà di misurare direttamente lo GnRH, l’ormone luteinizzante (LH) è spesso usato come lettura della secrezione di GnRH; i gonadotrofi pituitari secernono impulsi in bolo di LH in risposta alla stimolazione pulsatile di GnRH. Alterata frequenza degli impulsi di LH è stata riportata sia negli uomini che nelle donne con epilessia(Herzog et al., 1990; Drislane et al., 1994; Quigg et al., 2002), suggerendo cambiamenti indotti dall’epilessia nel rilascio di GnRH. Ad oggi, gli studi sugli impatti dell’epilessia sui neuroni di GnRH sono stati limitati all’analisi anatomica dell’immunoreattività di GnRH in modelli animali, con risultati contrastanti(Amado et al., 1993; Friedman et al., 2002; Fawley et al., 2012). Non è stato testato direttamente se la funzione neuronale di GnRH è compromessa nell’epilessia. Inoltre, non è noto se gli impatti dell’epilessia sui neuroni di GnRH variano con il ciclo riproduttivo femminile, o sono diversi tra maschi e femmine.
Modelli di roditori multipli di TLE mostrano cicli estrosi interrotti(Amado et al., 1987; Edwards et al., 1999; Scharfman et al., 2008), compreso il modello di topo intrahippocampal kainate (KA) (Li et al., 2017). Qui, abbiamo studiato gli impatti dell’epilessia sulla funzione neuronale GnRH in questo modello di TLE. Abbiamo valutato il tasso di cottura spontanea e l’eccitabilità intrinseca dei neuroni GnRH in fette di cervello ottenute da femmine (su diestro ed estruso) e maschi circa due mesi dopo l’iniezione intrahippocampale di KA o soluzione fisiologica di controllo. Diestrus ed estrus sono stati scelti per l’esame in quanto queste fasi sono associate a cambiamenti nella suscettibilità alle convulsioni nei roditori(Finn e Gee, 1994; Maguire et al., 2005) e mostrano il maggior grado di cambiamento in questo modello di TLE(Li et al., 2017). Lo scoppio periodico può essere alla base della secrezione di GnRH(Kelly e Wagner, 2002). Pertanto, abbiamo anche analizzato le proprietà di scoppio dei neuroni GnRH registrati. Gli steroidi sessuali esercitano un potente feedback sull’attività dei neuroni GnRH(Pielecka et al., 2006; Moenter et al., 2009), e alterati livelli di steroidi sessuali nel siero sono stati riportati in altri modelli di roditori di epilessia(Amado et al., 1987; Amado e Cavalheiro, 1998; Edwards et al., 2000; Scharfman et al., 2008). Pertanto, abbiamo misurato il progesterone sierico (P4) e l’estradiolo (E2) nel controllo e nelle femmine con iniezione di KA, e la T nei maschi. I nostri risultati indicano che gli effetti dell’iniezione intrahippocampale di KA su attività neuronale GnRH e l’eccitabilità sono diversi sul diestro rispetto all’estruso, variano a seconda della gravità della perturbazione del ciclo estroso comorbido, e sesso-specifico.
Materiali e metodi
Animali
Tutte le procedure relative agli animali sono state approvate dall’Institutional Animal Care and Use Committee dell’Università dell’Illinois a Urbana-Champaign. I topi transgenici GnRH-tdTomato sono stati allevati incrociando femmine GnRH-Cre+(Yoon et al., 2005; The Jackson Laboratory #021207) e maschi Ai9(Madisen et al., 2010; The Jackson Laboratory #007909). Entrambi i ceppi sono su sfondo C57BL/6J. I topi sono stati alloggiati in un ambiente standard in un ciclo luce/buio di 14/10 h (luci spente alle 19:00) per promuovere la riproduzione e la ciclicità estrosa(Fox et al., 2006), con un massimo di cinque topi per gabbia. La genotipizzazione per identificare i cuccioli che esprimono l’allele Cre è stata effettuata mediante PCR del DNA estratto da clip di coda raccolte prima del giorno postnatale (P)21 utilizzando le seguenti quattro sequenze di primer, come suggerito dal Laboratorio Jackson: (1) transgene inverso CGGG ACA GAA GCA GCA TTT TCC AG; (2) transgene in avanti ACA GGT GTC TGT CCC ATG TCT; (3) controllo positivo interno in avanti CAA ATG TTG CTT GTC TGGG TG; (4) controllo positivo interno inverso GTC AGT CGA GTG CAC AGT TT.
Monitoraggio del ciclo estensivo
Un normale ciclo di estrosi del topo è tipicamente lungo 4-5 d (Byerset al., 2012). Poiché i cicli di estrosi del topo possono essere facilmente interrotti da fattori di stress ambientali o di altro tipo, abbiamo classificato i cicli fino a 6 d di lunghezza come “regolari” per tener conto di piccole interruzioni temporali e per ridurre al minimo i falsi positivi delle interruzioni del ciclo di estrosi. Per confermare che tutti i topi di sesso femminile avevano cicli estrosi regolari, sono stati eseguiti strisci vaginali giornalieri tra le 10:00 e le 12:00 a partire da P42 o dopo. Un totale di 20 microlitri di PBS sterile è stato delicatamente inserito nella cavità vaginale utilizzando un 100 a 200 microlitri punta della pipetta sterile, rapidamente ritirata, ed esaminato su un vetrino da microscopio da microscopia a campo luminoso. Cicli estrosi regolari sono stati definiti come almeno due cicli 4-6 d di lunghezza con proestro, estrus, metestro, e diestrus I / II fasi che si verificano in ordine cronologico. Gli strisci sono stati classificati in ogni stadio in base ai seguenti criteri: (1) proestro: dominato da cellule epiteliali nucleate; (2) estrus: dominato da cellule epiteliali cornificate; (3) metestro: sia cellule epiteliali cornificate che leucociti; (4) diestrus I: dominato da leucociti; (5) diestrus II: poche o nessuna cellula presente. I topi che non hanno mostrato cicli estrosi regolari entro tre settimane dal monitoraggio sono stati esclusi da ulteriori studi.
Dopo l’iniezione intrahippocampale di soluzione salina o KA, i topi sono stati lasciati riposare indisturbati per un mese per ridurre al minimo lo stress ed evitare il disturbo dell’epilettogenesi. Il monitoraggio giornaliero del ciclo di estrosità è stato poi eseguito fino al momento della preparazione della fetta di cervello. Gli strisci vaginali da femmine iniettate di KA non hanno mostrato cambiamenti importanti nelle caratteristiche citologiche dello striscio. Pertanto, gli stessi criteri sono stati utilizzati per classificare le fasi del ciclo estroso per tutti i topi. Per promuovere la ciclicità sia prima che dopo l’iniezione di salina/KA, sono state introdotte lettiere sporche provenienti da gabbie che ospitano topi maschi, quando è stata rilevata una ciclicità irregolare, nelle gabbie che ospitano femmine. La lunghezza media del ciclo utilizzato per classificare i topi KA-iniezione come “KA-lungo” (cioè, periodo del ciclo estroso ≥7 d) o “KA-regolare” è stato calcolato dal monitoraggio giornaliero per il tempo da 42 d dopo l’iniezione al giorno della preparazione della fetta di cervello. Periodo del ciclo è stato scelto come parametro primario per la caratterizzazione, perché l’allungamento del ciclo estroso è una caratteristica importante di interruzione del ciclo in questo modello di TLE(Li et al., 2017).
Iniezioni intrahippocampali
Le iniezioni stereotassiche nei topi di otto settimane e oltre sono state effettuate sotto il 2-3% di anestesia isoflurano vaporizzata con ossigeno (Clipper Distributing Company). KA (Tocris Bioscience; 50 nl di 20 mM preparato in soluzione fisiologica sterile 0,9%) è stato iniettato nella regione ippocampale dorsale destra CA1 ippocampale (coordinate: 1,8 mm posteriore e 1,5 mm laterale al bregma; 1,5 mm ventrale alla superficie corticale). Topi di controllo sono stati iniettati con un volume equivalente di soluzione fisiologica sterile. Carprofen (5 mg / kg, Zoetis) è stato somministrato per via sottocutanea all’inizio della chirurgia per l’analgesia. Dopo aver chiuso l’incisione del cuoio capelluto con suture, sono stati applicati sulla ferita lidocaina anestetico 2,5% + crema di prilocaina 2,5% (Hi-Tech Pharmacal) e gel antibiotico Neosporin (Johnson e Johnson).
Monitoraggio video di crisi epilettiche acute
Dopo l’intervento di iniezione intrahippocampale, i topi sono stati collocati in una camera di recupero trasparente e riscaldata. Tutti i topi iniettati con KA sono stati monitorati con video per lo sviluppo di crisi epilettiche acute entro 5 ore dopo l’iniezione unilaterale di KA. Convulsioni comportamentali di Racine fase 3 (clono anteriore) e superiore (allevamento e caduta) potrebbe essere distinto attraverso il video, mentre le crisi comportamentali sotto la fase 3 (lieve annuendo la testa e contrazione dei muscoli facciali) non poteva. Sono stati anche osservati comportamenti di congelamento o continui di back-circling che indicano uno stato non convulsivo dell’epilessia, come precedentemente riportato in questo modello(Bouilleret et al., 1999; Riban et al., 2002).
Preparazione della fetta di cervello
Le fette di cervello acute sono state preparate circa due mesi dopo l’iniezione di salina/KA. Tutti i topi sono stati eutanasia per decapitazione tra le 10:00 e le 11:00 del mattino; sezioni cerebrali coronali di 300-μm sono state preparate utilizzando un microtomo a lama vibrante Leica VT1200S (Leica Biosystems). Le sezioni cerebrali sono state immerse in una soluzione di saccarosio ghiacciato ossigenato (95% O2, 5%CO2) (contenente 2,5 mM KCl, 1,25 mM NaH2PO4, 10 mM MgSO4, 0,5 mM CaCl2, 11 mM di glucosio e 234 mM di saccarosio) durante il sezionamento e poi trasferite a CSF artificiale ossigenato (ACSF) per 30 minuti a 32°C prima di essere trasferite a temperatura ambiente per almeno 30 minuti. ACSF conteneva 2,5 mM KCl, 10 mM di glucosio, 126 mM NaCl, 1,25 mM NaH2PO4, 1 mM MgSO4, 0,5 mM CaCl2, e 26 mM NaHCO3; osmolarità ∼298 mOsm. Per la registrazione, le singole fette sono state collocate in una camera di registrazione sul palco di un microscopio verticale BX51WI (Olympus America). Bagno ossigenato ACSF è stato riscaldato a 30-32 ° C utilizzando un riscaldatore in linea (Warner Instruments) e pompato attraverso la camera fetta ad una portata di 2,5 ml/min.
Registrazioni extracellulari mirate
Registrazioni mirate extracellulari (loose patch)(Nunemaker et al., 2002; Christian et al., 2005) sono state eseguite tra le 11:00 e le 15:00 per 40-90 min/cellula per rilevare l’attività di sparo spontanea. Pipette di registrazione in vetro borosilicato a parete spessa (∼2 Resistenza del puntale MΩ) sono state preparate utilizzando un estrattore di elettrodi P-1000 (Sutter Instruments) e riempite con soluzione filtrata ACSF con aggiunta di 10 mM di buffer HEPES. Neuroni GnRH che esprimono la fluorescenza tdTomato rosso sono stati identificati con una breve illuminazione a 593 nm e mirati per la registrazione sotto l’ottica differenziale a contrasto infrarosso utilizzando una telecamera sCMOS (Orca-Flash 4.0LT, Hamamatsu Photonics). La resistenza di tenuta è stata misurata almeno ogni 30 min. Le resistenze di tenuta iniziali variavano da 3,2 a 12 MΩ e la massima resistenza di tenuta era di 45 MΩ. Le registrazioni sono state effettuate in modo voltage-clamp con il potenziale di tenuta a 0 mV e Bessel-filtrato a 12 kHz. Non più di tre celle sono state registrate per animale. Se una cella non ha mostrato alcuna corrente di azione entro 1 h dalla registrazione, 15 mM KCl KCl è stato applicato a bagno per indurre la cottura e confermare la registrazione di successo. Un’immagine della posizione del puntale della pipetta è stata catturata utilizzando il software HCImage (Hamamatsu) dopo ogni registrazione per l’analisi della posizione dei neuroni. Classificazione della posizione del soma nel setto mediale (MS), area preottica (POA), o area ipotalamica anteriore (AHA) è stata basata su un atlante cerebrale del mouse(Paxinos e Franklin, 2012; piastre corrispondenti: MS = 23-25, POA = 25-28, AHA = 29). L’acquisizione dei dati è stata eseguita con un amplificatore MultiClamp 700B, digitalizzatore Digidata 1550 e software Clampex 10 (Dispositivi Molecolari). Il rilevamento della corrente di azione è stato eseguito con il Clampfit 10.6.
Registrazioni di corrente a pinza
Le registrazioni sono state effettuate in presenza di GABA ionotropo e di bloccanti del recettore del glutammato aggiunti alla soluzione del bagno (5 μM APV + 20 μM DNQX + 100 μM picrotossina, Abcam). Pipette di registrazione (3-5 MΩ) sono stati riempiti con una soluzione interna pipetta contenente 125 mM K-gluconato, 20 mM KCl, 10 mM HEPES, 4 mM EGTA, 4 mM Mg-ATP, 0,4 mM Na-GTP, e 0,1 mM CaCl2; pH 7,2, osmolarità 290 mOsm. Dopo aver ottenuto la configurazione dell’intera cella utilizzando le procedure convenzionali, è stato consegnato un passo di depolarizzazione a 5 mV da -70 mV di potenziale di tenuta è stato consegnato in modalità voltage-clamp per misurare le resistenze di serie e di ingresso. Nelle analisi sono state incluse solo registrazioni con resistenza in serie <20 MΩ e resistenza di ingresso >500 MΩ. Il potenziale di membrana a riposo è stato mantenuto vicino a -73 mV (calcolato dopo la correzione per un potenziale di giunzione liquido di 13 mV) applicando corrente iniettata secondo necessità. Tutte le registrazioni sono state effettuate in modalità bridge-balanced. L’acquisizione dei dati è stata effettuata come per le registrazioni extracellulare mirate. L’analisi dei dati è stata eseguita in Clampfit 10.6 per tutti i parametri tranne la soglia di potenziale di azione (AP), che è stata determinata in MATLAB (MathWorks) a partire dal valore sul diagramma di fase dove il dV/dt era ≥5 V/s. L’area sotto la curva della corrente di frequenza (F-I) per ogni neurone è stata calcolata con un metodo trapezoidale.
Categorizzazione del modello di sparo e analisi dello scoppio
In MATLAB sono state effettuate analisi di rilevamento di treni di picco e di scoppio. I modelli di sparo da registrazioni extracellulare mirate sono stati analizzati costruendo una trama di dispersione congiunta di intervallo interspike (ISI), che ha utilizzato il log ISI prima(asse x, logISIn) e dopo(asse y, logISIn + 1) un picco per rivelare la relazione temporale dei picchi neurali(Ramcharan et al., 2000; Dodla e Wilson, 2010). Per il confronto di gruppo delle proprietà dei burst, sono stati selezionati a caso 100 burst da ciascun neurone per costruire distribuzioni di probabilità cumulative. Per le registrazioni con meno di 100 burst, sono stati utilizzati tutti i burst rilevati.
Accessibilità del codice
Il codice utilizzato per il riconoscimento del modello di cottura dei neuroni GnRH, il rilevamento delle esplosioni, l’analisi delle proprietà delle esplosioni e i confronti statistici delle attività delle esplosioni è disponibile su Github(https://github.com/ChristianLabUIUC/BurstAnalysis). Tutti i codici sono disponibili anche come Extended Data Figure 1.
Violetto di cresile e proteina acida fibrillare gliale (GFAP) colorazione dell’ippocampo
Al termine della preparazione della fetta di cervello, la restante porzione di cervelletto contenente l’ippocampo è stata raccolta, fissata in PFA al 4% per 24 ore a 4°C e conservata in soluzione di saccarosio al 30% con lo 0,5% di sodio azide a 4°C fino al sezionamento; le sezioni coronali dell’ippocampo di 50 μm sono state preparate utilizzando un microtomo di congelamento (SM 2010R, Leica Biosystems). Sono state utilizzate da quattro a otto sezioni per topo della regione ippocampale dorsale per la verifica della sclerosi dell’ippocampo mediante colorazione violetta del cresile e della gliosi mediante colorazione GFAP. Per la colorazione violetto di cresile, le sezioni sono state montate su vetrini di vetro caricati, colorati con violetto di cresile (Sigma C5042) per 12 minuti a temperatura ambiente (∼22°C), disidratati con soluzioni di etanolo graduato (70-100%), e puliti in xilene. Per l’immunocolorazione GFAP, le sezioni galleggianti sono state incubate in un anticorpo monoclonale di topo anti-GFAP (1:1000, Sigma G3893) per 48 ore a 4°C su uno shaker, seguito da incubazione in Fluoresceina cavallo anti-anticorpo secondario di topo (1:1000, Vector Laboratories FI-2000) per 2 ore a temperatura ambiente su uno shaker. Le sezioni sono state poi montate su vetrini di vetro caricati e coperti utilizzando Vectashield Hardset Antifade Mounting Medium con DAPI (Vector Laboratories H-1500). L’acquisizione delle immagini è stata effettuata utilizzando un microscopio a luce e fluorescenza BX43 (Olympus) dotato di una telecamera Q-Color 3 e del software QCapture 6 (QImaging).
Saggi ormonali
I campioni di sangue del tronco dei topi utilizzati per le registrazioni in vitro(n = 85 topi) sono stati raccolti al momento della preparazione della fetta di cervello. Campioni da topi non utilizzati per le registrazioni(n = 12 topi) sono stati raccolti dopo la decapitazione per sostituire i campioni da topi registrati che erano contaminati o comunque non idonei per l’analisi. I campioni di sangue sono stati tenuti a temperatura ambiente (∼22°C) per 20 minuti e poi in ghiaccio per 20 minuti, seguiti da centrifugazione a temperatura ambiente per 15 minuti. Il siero è stato prelevato dopo la centrifugazione e conservato a -20°C fino all’uso. Gli ELISA (P4: DRG Diagnostics; E2: Calbiotech; T: IBL America) sono stati eseguiti secondo le istruzioni del produttore. Alcuni campioni sono stati diluiti in modo da corrispondere al volume richiesto per il test. I campioni sono stati eseguiti in duplicato e la media del duplicato è stata utilizzata come valore di concentrazione ormonale finale per ogni topo.
Progettazione sperimentale e statistiche
Il progetto sperimentale è delineato nella Figura 1. Pre-iniezione di monitoraggio del ciclo di estrosi per topi femmine adulte iniziato su o dopo P42. Età corrispondenti topi femmine e maschi sono stati stereotassicamente iniettati con soluzione fisiologica o KA nell’ippocampo dorsale. Due mesi dopo l’iniezione, fette di cervello acuto sono stati preparati e GnRH tasso di cottura dei neuroni e l’eccitabilità sono stati misurati tramite registrazioni elettrofisiologiche monocellulari. Per le femmine di topi, le registrazioni sono state eseguite nei giorni di diestrus o estrus. Al momento della preparazione delle fette di cervello, il siero del sangue del tronco e il tessuto ippocampale sono stati raccolti per l’analisi ormonale e l’istologia, rispettivamente.

Figura 1.
Figura 1. Progettazione sperimentale e la linea del tempo che illustra il paradigma dei gruppi di prova, le procedure, e punti di tempo sperimentale. Le procedure esclusive degli esperimenti sulle femmine sono contrassegnate in rosso.
I confronti statistici sono stati fatti usando il software OriginPro (OriginLab), SPSS (IBM), o R. I confronti tra due gruppi (ad esempio, diestrus vs estrus all’interno di ogni gruppo di trattamento, e salina vs KA per i maschi) sono stati fatti usando t test o test Mann-Whitney a seconda della normalità dei dati, che è stata determinata usando test Shapiro-Wilk. I confronti tra le femmine saline, KA-lunghe e KA-regolari sono stati fatti separatamente per il diestrus e l’estrus utilizzando i test post hoc di Kruskal-Wallis e Dunn o i test post hoc a senso unico ANOVA e Bonferroni basati sulla normalità e l’omogeneità della varianza all’interno di ciascun gruppo, come valutato dai test di Shapiro-Wilk e dai test di Levene, rispettivamente. I dati relativi al tasso di cottura evocato e ai parametri di eccitabilità sono stati trasformati in Box-Cox per ottenere distribuzioni normali, e analizzati utilizzando i test a tre vie ANOVA e LSD post hoc di Fisher. Confronti dei livelli di P4 e E2 tra i livelli salini, KA-lungo, e KA-gruppi regolari in ogni fase del ciclo sono state effettuate utilizzando unidirezionale ANOVA e Fisher test post hoc; non-normalmente distribuiti i dati sono stati normalizzati da log-trasformazione prima dell’analisi. I risultati delle prove di cui sopra sono riportati come mezzi ± SEM. Modelli di cottura dei neuroni GnRH da topi femmine sono stati valutati utilizzando una regressione logistica con il gruppo di trattamento (salina, KA-lungo, e KA-regolare) e la fase del ciclo estroso (diestro e estrus) come fattori. Le probabilità di neuroni che mostrano modelli di scoppio, irregolari, tonici, o di cottura tranquilla sono stati analizzati separatamente utilizzando Fisher test esatti. I confronti sono stati fatti tra i gruppi di trattamento all’interno di diestro o estrus, o all’interno dei gruppi di trattamento tra diestro e estrus. χ 2 test sono stati utilizzati per confrontare le proporzioni dei neuroni GnRH da controllo e KA-iniettato topi maschi che hanno mostrato scoppio e modelli di cottura irregolari, e per confrontare le proporzioni di KA-lungo e KA-regolari topi che mostrano sclerosi ippocampale sclerosi. L’analisi di correlazione è stata eseguita utilizzando Spearman rank-order test. Significato statistico nei test statistici di cui sopra è stato fissato a p <0,05. Le distribuzioni di probabilità cumulative sono state confrontate utilizzando i test di Kolmogorov-Smirnov goodness-of-fit, e il criterio per la significatività statistica in questi test è stato fissato a p < 0,001.

Figura 1.
Figura 1. Progettazione sperimentale e linea temporale che illustra il paradigma dei gruppi di prova, le procedure e i punti temporali sperimentali. Le procedure esclusive degli esperimenti sulle femmine sono contrassegnate in rosso.
Risultati
Conferma del puntamento dell’iniezione di ippocampo KA
I topi trattati con KA intrahippocampale mostrano un epilettico acuto non convulsivo o un lieve stato clonico seguito (entro due settimane o due mesi) da crisi focali spontanee che raramente si generalizzano a crisi tonico-cloniche, insieme a caratteristiche istopatologiche tra cui sclerosi ippocampale e gliosi, ricapitolando i tratti cardinali del TLE umano(Bouilleret et al., 1999; Riban et al., 2002; Blümcke et al., 2013). In questi studi, abbiamo applicato tre fasi di verifica per verificare l’accuratezza delle iniezioni intrahippocampali: (1) video screening delle crisi immediatamente dopo l’iniezione di KA; (2) valutazione istopatologica della sclerosi ippocampale mediante colorazione di cresyl violet (Nissl); e (3) colorazione GFAP immunofluorescente per la gliosi. Il piccolo sottoinsieme di topi che sono stati utilizzati per la raccolta del sangue del tronco solo per la raccolta del sangue, senza registrazioni in vitro, tutti visualizzati crisi epilettiche acute a seguito di iniezione KA. Pertanto, il tessuto ippocampale utilizzato per l’istologia è stato raccolto il giorno della preparazione della fetta di cervello per le registrazioni in vitro (circa due mesi dopo l’iniezione).
La grande maggioranza dei topi femmina KA-iniezione (57 di 69, 83%) ha mostrato almeno due convulsioni entro 5 ore dopo l’iniezione di KA, e cinque topi hanno mostrato una convulsione. Dei sette topi rimanenti, tre sono rimasti congelati o sono stati esposti al contrario girando all’indietro per l’intera registrazione, un topo non ha mostrato convulsioni o un comportamento congelato o girato all’indietro dopo l’iniezione di KA, e tre non sono stati registrati con successo in video(Tabella 1). Quattro di questi sette topi hanno mostrato una prominente dispersione di cellule granulari e altri segni di sclerosi nella colorazione violetta del cresile, come mostrato nell’esempio in Figura 2A. Gli ippocampi che non mostravano segni evidenti di sclerosi sono stati successivamente valutati per la colorazione GFAP. In due dei tre topi rimanenti esaminati, la gliosi è stata osservata nel giro dentato e / o regioni CA nell’ippocampo iniettato, come mostrato nell’esempio in Figura 2B. La rimanente femmina iniettata di KA, che non mostrava crisi epilettiche acute, sclerosi ippocampale, né gliosi, è stata esclusa dal dataset finale. Nessun segno di sclerosi o gliosi sono stati osservati nel giro dentato o regioni CA raccolti da topi iniettati di soluzione salina selezionati in modo casuale(Fig. 2C). Né gliosi né sclerosi dell’ippocampo sono stati osservati nell’ippocampo controlaterale.
| Esito della proiezione video (crisi epilettiche acute) | ||||
|---|---|---|---|---|
| >2 sequestri | 1 sequestro | Nessun sequestro o video | Totale | |
| Femmine | 57 | 5 | 7 | 69 |
| Maschi | 10 | 0 | 5 | 15 |
| Istologia per topi senza crisi epilettiche o video (2 mesi dopo l’iniezione di KA) | ||||
| Sclerosi | Gliosis | Nessuna sclerosi o gliosi | Totale | |
| Femmine | 4 | 2 | 1* | 7 |
| Maschi | 5 | 0 | 0 | 5 |
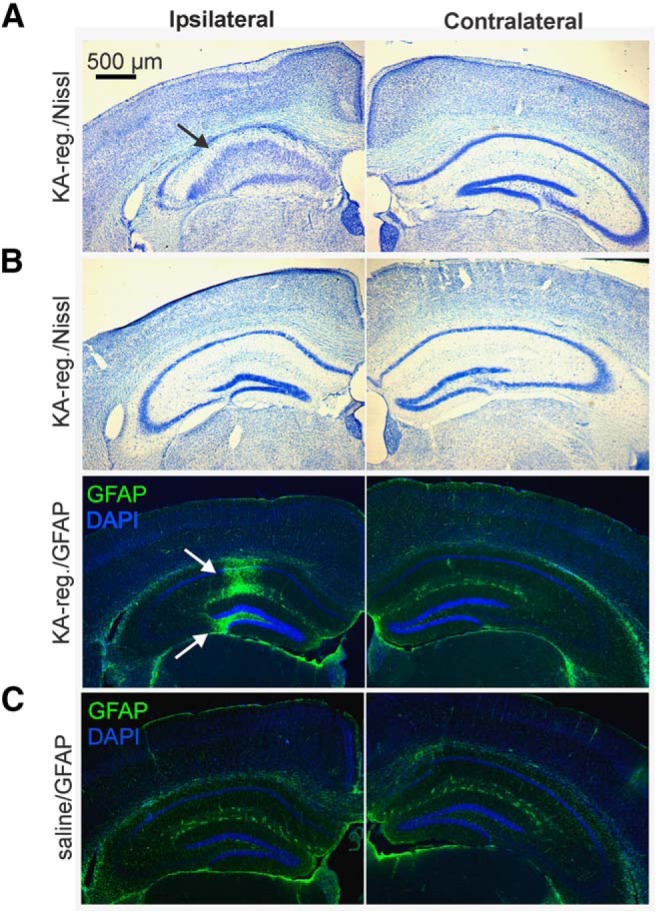
Figura 2.Verifica del puntamento dell’iniezione di KA. A, Esempio di colorazione violetto cresyl da una femmina KA-regolare con KA-regolare con marcata dispersione cellulare granulometrica ipsilaterale all’iniezione, e ippocampo ippocampo controlaterale intatto all’iniezione. B, Cresyl violet (in alto) e GFAP/DAPI colorazione (in basso) da una femmina KA-regular. Si noti la forte immunoreattività GFAP nell’ippocampo iniettato, nonostante l’assenza di una patologia importante osservata nella colorazione violetto cresile delle sezioni adiacenti. GFAP, verde; DAPI, blu. A sinistra, omolaterale all’iniezione. C, Esempio di colorazione GFAP nel tessuto di un topo iniettato con soluzione salina. Barra graduata: 500 μm. Freccia nera, sclerosi ippocampale sclerosi rilevata dalla macchia di crestyl violet; frecce bianche, gliosi in CA e giro dentato rilevato dalla colorazione GFAP.
La proiezione video di 13 maschi iniettati di KA ha confermato che 10 (77%) hanno mostrato almeno due crisi epilettiche(Tabella 1). I rimanenti tre topi non hanno mostrato alcuna convulsioni comportamentali, ma è stato confermato che hanno sviluppato la sclerosi ippocampale da due mesi dopo l’iniezione. Due altri due topi maschi non sono stati registrati con successo video, ma sono stati confermati dalla colorazione violetto cresile di aver sviluppato la sclerosi ippocampale.

Figura 2.Verifica del puntamento dell’iniezione di KA. A, Esempio di colorazione violetto cresyl da una femmina KA-regolare con KA-regolare con marcata dispersione cellulare granulometrica omolaterale all’iniezione, e ippocampo ippocampo controlaterale intatto all’iniezione. B, Cresyl violet (in alto) e GFAP/DAPI colorazione (in basso) da una femmina KA-regular. Si noti la forte immunoreattività GFAP nell’ippocampo iniettato, nonostante l’assenza di una patologia importante osservata nella colorazione violetto cresile delle sezioni adiacenti. GFAP, verde; DAPI, blu. A sinistra, omolaterale all’iniezione. C, Esempio di colorazione GFAP nel tessuto di un topo iniettato con soluzione salina. Barra graduata: 500 μm. Freccia nera, sclerosi ippocampale sclerosi rilevata dalla macchia di crestyl violet; frecce bianche, gliosi in CA e giro dentato rilevato dalla colorazione GFAP.
Il tasso di sviluppo della sclerosi dell’ippocampo non è correlato con la gravità dell’alterazione del ciclo estroso comorbiliare
Un sottoinsieme di femmine iniettate di KA può mantenere una regolare ciclicità estrosa per due mesi dopo l’iniezione(Li et al., 2017). Questa resilienza può riflettere l’imprecisione dell’iniezione iniziale o la riduzione dell’induzione di danni all’ippocampo. Pertanto, l’ippocampo di tutte le femmine KA-iniettato che hanno mantenuto regolare 4- a 6-d cicli di estrosi (KA-regolare) sono stati esaminati da istologia, anche se le crisi epilettiche acute sono stati rilevati nei video. Ippocampi di 12 dei 20 topi (60%) di questo gruppo hanno mostrato una dispersione di cellule granulose nella colorazione violetta del cresile(Fig. 2).A). Sette dei rimanenti otto topi hanno mostrato gliosi con colorazione GFAP(Fig. 2B). Il topo rimanente non è stato confermato dall’istologia a causa di problemi di sezionamento dei tessuti, ma è rimasto nel dataset finale come è stato confermato di aver mostrato crisi epilettiche acute.
Per determinare se la presentazione della sclerosi era più alta nei topi che hanno sviluppato lunghezze di ciclo estroso prolungate (≥7 d periodo, KA-lungo), abbiamo valutato gli ippocampi di 25 topi KA-lungo selezionati a caso. Diciannove di questi topi (76%) hanno mostrato la sclerosi in colorazione crestyl violet; questa proporzione non era diversa da quella del gruppo KA-regolare(p > 0,6, χ 2 test). Questi risultati indicano che la gravità della perturbazione del ciclo estroso comorbido dopo l’iniezione di KA non è direttamente correlata con il tasso di induzione della sclerosi ippocampale, e che i cambiamenti a valle dell’asse HPG probabilmente giocano un ruolo significativo nel guidare la comorbilità.
I neuroni GnRH dei topi femmine iniettati con KA mostrano tassi di cottura alterati sul diestro e sull’estruso
Per gli studi di topi femmina, fette di cervello coronale acuto sono stati preparati su diestrus o estrus circa due mesi dopo l’iniezione intrahippocampale salina /KA. Targeted registrazioni di patch extracellulare sciolto sono state eseguite per rilevare le correnti di azione spontanea, le correnti veloci alla base di APs(Fig. 3A), nei neuroni di GnRH. Tutti i neuroni GnRH registrati erano omolaterali all’ippocampo iniettato. tdTomato + somata nella MS, POA, e AHA che mostra la morfologia bipolare tipica dei neuroni GnRH sono stati mirati per la registrazione. Neuroni GnRH da topi di controllo di solito mostravano attività di cottura con quiescenza periodica tra gruppi (scoppi) di correnti di azione(Fig. 3B). Le cellule registrate su estrus avevano tassi di cottura media più elevati rispetto alle cellule registrate sul diestro (diestro n = 16 cellule / 8 topi, estrus n = 20 cellule / 9 topi; p = 0,03; Mann-Whitney test; Fig. 3C,D), fornendo nuove prove di uno spostamento da diestro a diestro endogeno nella velocità media di sparo in condizioni di controllo.
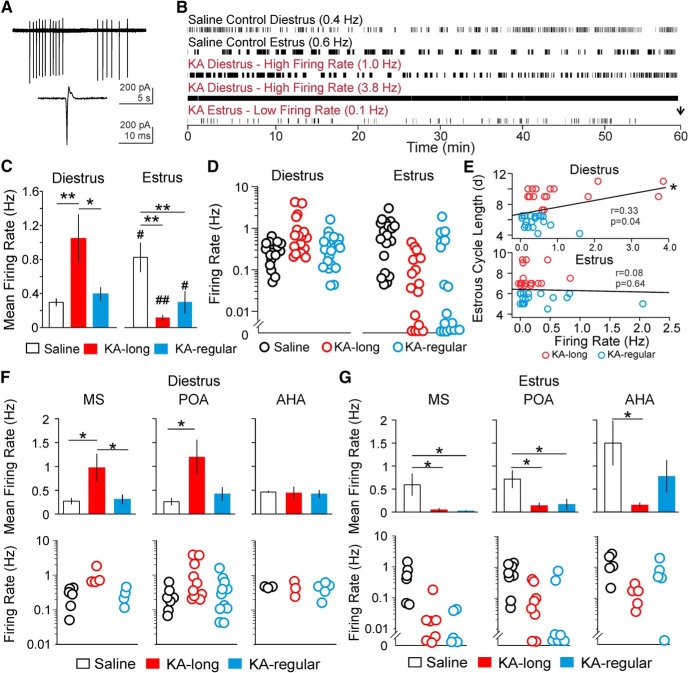
Figura 3.Diestrus contro gli spostamenti di estrus in GnRH neuroni media tasso di cottura sono compromessi nel modello intrahippocampale del mouse KA modello intrahippocampale di TLE. AEsempio di tracce grezze di esplosioni (in alto) e di singole correnti d’azione (in basso) rilevate in registrazioni di patch sciolte. B, Rappresentativo raster trame di attività nei neuroni GnRH da controllo e KA-iniettato femmine. La freccia nera segna la fine della registrazione. La velocità media di sparo di ogni cellula è data tra parentesi. C, Media ± SEM per il tasso di cottura dei neuroni GnRH nel controllo (barre aperte), KA-lungo (barre rosse), e KA-regolare (barre blu) gruppi. KA-iniettato femmine sono divisi in KA-lungo e KA-regolare gruppi in base alla loro lunghezza del ciclo di estrosi (KA-lungo ≥ 7 d, KA-regolare 4-6 d). Le cellule sono state registrate sul diestro (a sinistra) o sull’estruso (a destra). D, I tassi di cottura in singole cellule, tracciate su scala logaritmica per mostrare l’intera gamma. E, Analisi di correlazione tra il tasso di cottura dei neuroni GnRH e la lunghezza del ciclo di estrosi in femmine iniettate KA eseguita con i dati combinati da KA-lungo (cerchi rossi) e KA-regolare (cerchi blu) gruppi. Linea nera, linea di miglior adattamento per tutti i punti. F, G, Confronto del tasso di cottura dei neuroni GnRH tra i controlli, KA-lungo, e KA-gruppi regolari basati sulla posizione anatomica dei somati per le cellule registrate sul diestro (F) o estruso (G). I dati sono mostrati come velocità di cottura media di gruppo (in alto, media ± SEM) e velocità di cottura dei singoli neuroni (in basso); *p < 0, 05, **p < 0.01 per i confronti tra le femmine saline, KA-lunghe e KA-regolari di Kruskal-Wallis con i test post hoc di Dunn ; #p < 0,05, ##p < 0,01per i confronti tra diestrus ed estrus all’interno dei gruppi con i test t o con i test di Mann-Whitney. Nei diagrammi di dispersione del tasso di cottura dei singoli neuroni, i neuroni tracciati al di sotto di y = 0,01 hanno mostrato tassi di cottura ≥0 Hz e al di sotto di 0,01 Hz.
Al contrario, i neuroni GnRH delle femmine con iniezione di KA hanno mostrato modelli di sparo anomali(Fig. 3B). Su diestro, i neuroni GnRH da topi KA-lunghi(n = 17 cellule/9 topi) ha mostrato un aumento della velocità media di cottura rispetto ad entrambi i controlli(n = 16 cellule / 8 topi, p = 0,01) e KA- topi regolari(n = 20 cellule / 10 topi, p = 0,016; Kruskal-Wallis test / Dunn’s). Il tasso medio di cottura dei neuroni GnRH da femmine KA-regulari non era diverso dai controlli(Fig. 3C). I neuroni GnRH delle femmine KA-lunghe hanno mostrato alti tassi di cottura ≤3,8 Hz, anche se i tassi di cottura per alcune cellule rientravano nel range normale (Fig. 3D). Quando i dati delle femmine KA-long e KA-regolari sono stati combinati, c’è stata una correlazione lineare positiva tra la velocità di cottura e la lunghezza del ciclo sul diestro(r = 0,33, p = 0,043, Spearman’s rank-order test; Fig. 3E). Questi risultati suggeriscono che gli impatti dell’iniezione di KA sull’attività di cottura dei neuroni GnRH sul diestro sono correlati con la gravità della perturbazione del ciclo estroso comorbido.
Su estrus, i neuroni GnRH da entrambi i KA-lungo(n = 18 cellule / 8 topi, p = 0,01) e KA-regolare(n = 17 cellule / 7 topi, p = 0,01) femmine hanno mostrato tassi di cottura significativamente più bassi rispetto ai controlli(n = 20 cellule / 9 topi; Fig. 3C, Kruskal-Wallis test/Dunn’s). Alcune cellule di KA-lunghe e KA-regolari femmine hanno mostrato solo pochi o nessun APs(Fig. 3D). GnRH tasso di cottura dei neuroni e la lunghezza del ciclo estroso non sono stati correlati su estrus(r = 0,082, p = 0,64, test di Spearman; Fig. 3E). Pertanto, a differenza dei risultati ottenuti sul diestro, gli impatti dell’iniezione di KA sull’attività di cottura dei neuroni GnRH sull’estrus sono simili nei topi con e senza interruzione del ciclo estroso comorbido. Inoltre, l’impatto indotto da KA sull’attività dei neuroni di GnRH da topi KA-lunghi è opposto a quello osservato sul diestro.
In particolare, in contrasto con l’elevazione tipica in cottura su estrus rispetto al diestro nei topi di controllo, il passaggio da diestro a estrus in cottura è stato invertito nei topi KA-lungo, con diminuzione di cottura su estrus rispetto al diestro(p <0,0001; Mann-Whitney test). Anche se i tassi medi di cottura delle cellule dei topi KA-regolari erano simili tra il diestro (0,39 ± 0,08 Hz) e l’estruso (0,29 ± 0,13 Hz), un test non parametrico Mann-Whitney ha rivelato una differenza significativa (p = 0,03), che sembrava essere guidato principalmente da un sottoinsieme di neuroni con tassi di cottura vicino a zero su estrus (Fig. 3D). Questi risultati suggeriscono che l’iniezione di KA perturba i normali modelli di diestro rispetto ai cambiamenti di estrus in GnRH attività di cottura dei neuroni.

Figura 3.Diestrus contro gli spostamenti estruso in GnRH neuroni media velocità di cottura media sono compromessi nel modello intrahippocampale del mouse KA modello intrahippocampale di TLE. AEsempio di tracce grezze di esplosioni (in alto) e di singole correnti d’azione (in basso) rilevate in registrazioni di patch sciolte. B, Rappresentativo raster trame di attività nei neuroni GnRH da controllo e KA-iniettato femmine. La freccia nera segna la fine della registrazione. La velocità media di sparo di ogni cellula è data tra parentesi. C, Media ± SEM per il tasso di cottura dei neuroni GnRH nel controllo (barre aperte), KA-lungo (barre rosse), e KA-regolare (barre blu) gruppi. KA-iniettato femmine sono divisi in KA-lungo e KA-regolare gruppi in base alla loro lunghezza del ciclo di estrosi (KA-lungo ≥ 7 d, KA-regolare 4-6 d). Le cellule sono state registrate sul diestro (a sinistra) o sull’estruso (a destra). D, I tassi di cottura in singole cellule, tracciate su scala logaritmica per mostrare l’intera gamma. E, Analisi di correlazione tra il tasso di cottura dei neuroni GnRH e la lunghezza del ciclo di estrosi in femmine iniettate KA eseguita con i dati combinati da KA-lungo (cerchi rossi) e KA-regolare (cerchi blu) gruppi. Linea nera, linea di miglior adattamento per tutti i punti. F, G, Confronto del tasso di cottura dei neuroni GnRH tra i controlli, KA-lungo, e KA-gruppi regolari basati sulla posizione anatomica dei somati per le cellule registrate sul diestro (F) o estruso (G). I dati sono mostrati come velocità di cottura media di gruppo (in alto, media ± SEM) e velocità di cottura dei singoli neuroni (in basso); *p < 0, 05, **p < 0.01 per i confronti tra le femmine saline, KA-lunghe e KA-regolari di Kruskal-Wallis con i test post hoc di Dunn ; #p < 0,05, ##p < 0,01per i confronti tra diestrus ed estrus all’interno dei gruppi con i test t o con i test di Mann-Whitney. Nei diagrammi di dispersione del tasso di cottura dei singoli neuroni, i neuroni tracciati al di sotto di y = 0,01 hanno mostrato tassi di cottura ≥0 Hz e al di sotto di 0,01 Hz.
La posizione del neurone GnRH influenza la risposta della velocità di combustione all’iniezione di KA
Per determinare se il fenotipo di velocità di cottura di ogni cellula è stato influenzato dalla posizione del soma, i neuroni GnRH registrati sono stati classificati in base alla posizione del puntale della pipetta di registrazione nella MS, POA o AHA. Anche se questa analisi ha richiesto l’analisi dei dati complessivi in più gruppi, alcuni dei quali avevano solo poche cellule, sono emersi modelli distinti in base alla classificazione anatomica.
Su diestro, i neuroni GnRH nella SM da KA-lunghe femmine(n = 4 cellule / 4 topi) ha mostrato tassi di cottura più elevati rispetto alle cellule da controlli(n = 6 cellule / 3 topi, p = 0,034) e KA- topi regolari(n = 4 cellule / 4 topi, p = 0,043, Kruskal-Wallis test / Dunn’s). GnRH neuroni nel POA da KA-lunghe femmine(n = 10 cellule / 7 topi) ha avuto tassi di cottura più elevati rispetto ai neuroni da controlli(n = 7 cellule / 6 topi, p = 0,025), e un livello limite di significato in confronto ai neuroni da KA- topi regolari(n = 11 cellule/9 topi, p = 0,053, Kruskal-Wallis test / Dunn). I tassi di cottura delle cellule nel AHA, tuttavia, non sono stati diversi tra i tre gruppi (salina n = 3 cellule / 3 topi, KA-lungo n = 3 cellule / 3 topi, KA-regolare n = 5 cellule / 5 topi, p > 0,8; Fig. 3F).
Su estruso, i neuroni GnRH nella SM e POA da entrambi i KA-lungo(n = 5 cellule / 4 topi MS, n = 8 cellule / 7 topi POA) e KA-regolare( n = 5 cellule / 5 topi MS, n = 7 cellule / 6 topi POA) femmine visualizzati tassi di cottura diminuito rispetto ai controlli(n = 6 cellule / 5 topi MS, n = 8 cellule / 6 topi POA; MS: KA-lungo vs salina p = 0.019, KA-regolare vs salina p = 0,042; POA: KA-lungo vs salina p = 0,037, KA-regolare vs salina p = 0,045, Kruskal-Wallis/Dunn’s). Cellule nel AHA da KA-lungo femmine registrate su estrus(n = 5 cellule / 5 topi) ha mostrato una diminuzione di cottura rispetto ai controlli(n = 6 cellule / 5 topi; KA-lungo vs salina p = 0,027; Kruskal-Wallis test / Dunn), ma le cellule da KA- topi regolari (n = 5 cellule / 4 topi) non erano diversi dai controlli (Fig. 3G). Insieme, questi risultati indicano che, sia sul diestro che sull’estruso, i tassi di cottura dei neuroni GnRH nella SM e POA sono più fortemente colpiti dopo l’iniezione di KA. Su estrus, tuttavia, le cellule di AHA sembrano anche essere colpiti in topi con il più grave disturbo del ciclo estroso comorbido comorboso più grave.
I modelli di cottura dei neuroni GnRH sono alterati a seguito dell’iniezione di KA nei topi femmina
Il treno di picco completo di ogni neurone GnRH registrato è stato utilizzato per categorizzare i modelli di cottura con la costruzione di trame ISI dispersione congiunta ISI. I diagrammi di dispersione sono stati divisi in quattro quadranti (cluster) da una serie di valori di soglia ISI di burst candidati. Il valore ottimale tra le soglie ISI dei candidati burst è stato determinato come il valore al quale il grado di prossimità era più alto per tutti e quattro gli ammassi, quantificato come il punto di intersezione delle linee limite degli ammassi che producono la distanza quadrata più bassa sommata tra tutti i punti all’interno di un ammasso e il suo rispettivo centroide (centro dell’ammasso; Fig. 4A).
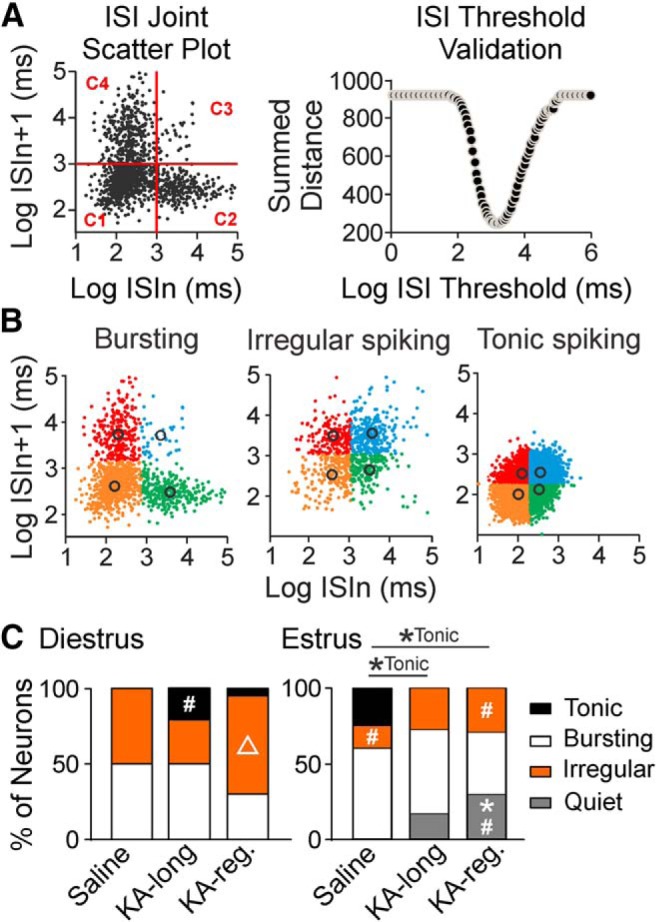
Figura 4.GnRH modelli di cottura dei neuroni sono alterati in KA-iniettato topi femmina su entrambi i diestrus ed estrus. A, BEsempi di rilevamento di scoppio e di categorizzazione dello schema di sparo. A, a sinistra, Esempio di diagramma di dispersione del giunto ISI con un valore di soglia ISI di scoppio del candidato selezionato in modo casuale (linea rossa). I quattro quadranti dividono tutti i dati in quattro cluster: C1, C2, C3 e C4. A destra, Esempio di convalida della soglia ISI mostra la distanza sommata per ogni candidato burst valore di soglia ISI. La distanza sommata è calcolata dalla somma della distanza quadrata tra ogni punto e il corrispondente centroide del cluster. Il valore del candidato con la distanza sommata più piccola viene scelto come soglia ISI di burst ottimale. BEsempi di diagrammi di dispersione per lo scoppio del neurone GnRH (a sinistra), lo spiking irregolare (al centro) e lo spiking tonico (a destra). I diversi colori rappresentano la distribuzione finale da C1 a C4 con la soglia ottimale di scoppio ISI per ogni cella. Cerchi neri, centriidi individuali dei cluster C1-C4. CProporzione di neuroni GnRH da topi femmina classificati in ogni modello su diestro (a sinistra) ed estruso (a destra); *p < 0,05 per i confronti di test di Fisher di coppia esatta per il confronto di prova indicato modello di cottura tra controllo e KA-iniettato gruppi; #p < 0.05 per i confronti per il modello di cottura indicato tra diestro ed estruso all’interno del controllo e gruppi KA-iniezione. Δ, p < 0 , 05 per i confronti per il modello di cottura indicato tra gruppi KA-lunghi e KA-regolari all’interno dello stesso stadio del ciclo estroso.
In conformità con altri studi di GnRH neuroni in vitro e in vivo(Moenter et al., 2003; Constantin et al., 2013), i neuroni registrati in questo dataset hanno mostrato modelli di spiking scoppio, spiking irregolare, o spiking tonico(Fig. 4B). Quando un neurone mostra un pattern di scoppio, ogni quadrante (C1-C4) sul diagramma di dispersione ISI contiene un cluster che comprende i picchi all’interno di scoppi, all’inizio di ogni scoppio, alla fine di ogni scoppio, e al di fuori dello scoppio, rispettivamente. Nei neuroni a scoppio, i picchi nel cluster C1 (quadrante inferiore sinistro) sono più numerosi degli altri cluster, producendo una distribuzione obliqua dei valori ISI tra i cluster. Il numero di picchi per definire uno scoppio è stato impostato più o uguale a quattro. Pertanto, affinché una cella sia identificata come un neurone a scoppio, il cluster C1 doveva contenere almeno due volte il numero di punti C2 (in basso a destra) e C4 (in alto a sinistra), e almeno cinque volte il numero di punti C3 (in alto a destra) nel diagramma di dispersione dei giunti ISI. Quando un neurone mostrava un pattern di spiking irregolare o tonico, i valori ISI erano divisi quasi equamente tra i quattro quadranti. I neuroni sono stati classificati come spiking tonico quando i centriidi di tutti i cluster si trovavano a valori ISI <1 s.
I risultati dell’analisi di regressione logistica per ogni modello di cottura che esamina gli effetti dell’iniezione di KA, dello stadio del ciclo e dell’interazione tra l’iniezione di KA e lo stadio del ciclo sono riassunti nella Tabella 2. Per la cottura a scoppio, non ci sono stati effetti di iniezione KA o fase di ciclo, e nessuna interazione. Per spiking irregolare, c’era un effetto di fase di ciclo, ma nessun effetto di iniezione KA e nessuna interazione. Per lo spiking tonico, non ci sono stati effetti di fase di ciclo o di iniezione KA separatamente, ma c’è stata una significativa interazione. Per le cellule tranquille, ci sono stati effetti sia di KA iniezione e fase di ciclo, ma nessuna interazione.
| Schema di cottura | Iniezione KA | Fase del ciclo | Interazione tra la fase di iniezione KA e la fase di ciclo |
|---|---|---|---|
| Tonico | 0.17 | 0.84 | 0.0009*** |
| Bursting | 0.18 | 0.30 | 0.99 |
| Irregolare | 0.15 | 0.0072** | 0.25 |
| Silenzioso | 0.027* | 0.0003*** | 1.00 |
Le differenze specifiche del gruppo per l’attività irregolare, tonica e quieta sono state ulteriormente analizzate post hoc utilizzando i test esatti di Fisher (Fig.4C). Le cellule da controlli trattati con sale hanno mostrato una maggiore proporzione di cellule che mostrano un picco irregolare sul diestro rispetto all’estruso(p = 0,034). L’analisi dello spiking tonico ha mostrato una differenza significativa tra il diestro e l’estruso(p = 0,053). Cellule da topi KA-lungo ha mostrato più tonico cottura su diestro rispetto a estrus(p = 0,045), e le cellule da KA- topi regolari hanno mostrato più irregolare spiking sul diestro rispetto a estrus(p = 0,049) e più quiescenza su estrus che su diestro( p = 0,014).
Sul diestrus, non sono state rilevate differenze tra i gruppi iniettati KA e i controlli per qualsiasi schema di cottura, ma i confronti tra i gruppi KA-lungo e KA-regolare hanno rilevato che le cellule di topi KA-regolare hanno mostrato un aumento di spiking irregolare(p = 0,049), senza differenze rilevate per la cottura tonica o quiescenza. Su estruso, le cellule da topi di controllo ha mostrato più tonico cottura rispetto sia KA-lungo(p = 0,048) e KA-regolare(p = 0,049) gruppi. Cellule da topi KA-regolare ha mostrato anche una maggiore quiescenza rispetto ai controlli(p = 0,014). Non sono state rilevate differenze tra i gruppi KA-lungo e KA-regolare su estrus. Su diestrus, i neuroni tonico-spiranti da KA-lunghe femmine erano nel POA (tre neuroni) e MS (un neurone), e l’uno tonico-spirante neurone da una femmina KA-regolare era nel POA. Sull’estruso, i neuroni tonico-spiranti da controlli erano nel AHA (tre neuroni), POA (un neurone), e MS (un neurone), e le cellule tranquille da entrambe le femmine KA-lungo e KA-regolare erano nel POA e MS (KA-lungo: due POA, una MS; KA-regolare tre POA, due MS). Le cellule scoppiettanti e irregolari in tutti i gruppi erano distribuite in modo uniforme tra la SM, i POA e gli AHA. Questi risultati indicano che dopo l’iniezione di KA, un sottoinsieme di neuroni GnRH nella SM e POA mostra un modello continuo di attività di cottura tonica sul diestro che non viene osservato nei controlli. Inoltre, in netto contrasto con i modelli di cottura osservati sul diestro, sottoinsiemi di neuroni GnRH nella MS e POA mostrano una quiescenza aberrante sull’estruso dopo l’iniezione di KA.

Figura 4.GnRH modelli di cottura dei neuroni sono alterati in KA-iniettato topi femmine su entrambi i diestrus ed estrus. A, BEsempi di rilevamento di scoppio e di categorizzazione dello schema di sparo. A, a sinistra, Esempio di diagramma di dispersione del giunto ISI con un valore di soglia ISI di scoppio del candidato selezionato in modo casuale (linea rossa). I quattro quadranti dividono tutti i dati in quattro cluster: C1, C2, C3 e C4. A destra, Esempio di convalida della soglia ISI mostra la distanza sommata per ogni candidato burst valore di soglia ISI. La distanza sommata è calcolata dalla somma della distanza quadrata tra ogni punto e il corrispondente centroide del cluster. Il valore del candidato con la distanza sommata più piccola viene scelto come soglia ISI di burst ottimale. BEsempi di diagrammi di dispersione per lo scoppio del neurone GnRH (a sinistra), lo spiking irregolare (al centro) e lo spiking tonico (a destra). I diversi colori rappresentano la distribuzione finale da C1 a C4 con la soglia ottimale di scoppio ISI per ogni cella. Cerchi neri, centriidi individuali dei cluster C1-C4. CProporzione di neuroni GnRH da topi femmina classificati in ogni modello su diestro (a sinistra) ed estruso (a destra); *p < 0,05 per i confronti di test di Fisher di coppia esatta per il confronto di prova indicato modello di cottura tra controllo e KA-iniettato gruppi; #p < 0.05 per i confronti per il modello di cottura indicato tra diestro ed estruso all’interno del controllo e gruppi KA-iniezione. Δ, p < 0 , 05 per i confronti per il modello di cottura indicato tra gruppi KA-lunghi e KA-regolari all’interno dello stesso stadio del ciclo estroso.
Le proprietà di scoppio del neurone GnRH sono alterate in seguito all’iniezione di KA nei topi femmina
Per valutare se lo scoppio del neurone GnRH (che può essere collegato al rilascio di ormoni) è alterato dopo l’iniezione di KA, le cellule che sono state classificate come “scoppio” sono state ulteriormente esaminate per un’analisi dettagliata delle proprietà dello scoppio. Si noti che, poiché le cellule scoppio sono stati distribuiti in tutte e tre le aree anatomiche esaminate, le categorie di posizione sono stati collassati per questa analisi.
I neuroni GnRH dei topi di controllo hanno mostrato proprietà di scoppio distinte tra il diestro e l’estrus. Le cellule di scoppio hanno mostrato una durata di scoppio più lunga, più picchi per scoppio, e più lento tasso di cottura intraburst su estrus rispetto al diestrus (diestrus n = 8 cellule, estrus n = 12 cellule; tutti p < 0,0001, a coppie Kolmogorov-Smirnov test). Gli intervalli tra le esplosioni erano anche più lunghi sull’estruso che sul diestro(p < 0,0001; Fig. 5A). I neuroni GnRH delle femmine di lunghezza KA non hanno mostrato la differenza nella durata dello scoppio e nel numero di picchi per scoppio tra gli stadi del ciclo, ma la velocità di cottura intraburst è stata ridotta e l’intervallo tra gli scoppi è stato più lungo sull’estrus che sul diestrus (diestrus n = 10 cellule, estrus n = 10 cellule; entrambi p < 0,0001, test Kolmogorov-Smirnov a coppie; Fig. 5B). I neuroni GnRH delle femmine KA-regolari hanno mostrato le stesse direzioni di cambiamento dei controlli (diestro n = 6 cellule, estrus n = 5 cellule), con una maggiore durata dello scoppio, il numero di picchi per scoppio, e l’intervallo di interburst, così come la diminuzione del tasso di cottura intraburst, su estrus rispetto al diestro (tutti p < 0,0001, a coppie Kolmogorov-Smirnov test; Fig. 5C). Questi risultati dimostrano che le proprietà di scoppio del neurone GnRH fluttuano con il ciclo estroso, mostrando cambiamenti indicativi di un aumento di scoppio (e potenzialmente un aumento del rilascio ormonale) sull’estrus rispetto al diestro.

Figura 5.GnRH proprietà di scoppio del neurone GnRH sul diestro e l’estruso; solo i neuroni che visualizzano modelli di scoppio a picco sono stati utilizzati per i confronti. A, Distribuzioni di probabilità cumulative per le proprietà di scoppio dei neuroni GnRH da topi femmina di controllo su diestro (tracce grigie) ed estrus (tracce viola). Le distribuzioni cumulative sono state costruite utilizzando 100 scoppi selezionati in modo casuale per cella. B, Proprietà di scoppio da topi femmina KA-lunghi. C, Proprietà di scoppio da topi femmina KA-regolari; **p < 0,0001 per i confronti da Kolmogorov-Smirnov test. n.s., non significativo. Gli intervalli di interburst sono presentati su scale logaritmiche per una migliore visualizzazione della parte maggiore (1-99%) delle distribuzioni.
Sul diestro, le cellule da topi KA-iniezione KA ha mostrato una maggiore durata di scoppio e il numero di picchi per scoppio rispetto ai controlli (salina n = 8 cellule; KA-lungo n = 8 cellule; KA-regolare n = 6 cellule; coppia Kolmogorov-Smirnov test: KA-lungo vs salina: p < 0,0001, KA-regolare vs salina: p < 0,0001; Fig. 6A). Le distribuzioni dei valori per i gruppi KA-lungo e KA-regolare, tuttavia, erano anche distinte l’una dall’altra, con il gruppo KA-lungo che mostrava una maggiore probabilità delle durate di scoppio più lunghe e il maggior numero di picchi per scoppio(p < 0,0001). In confronto ai controlli, le cellule di KA-lunghe femmine hanno mostrato tassi di cottura intraburst più elevati(p < 0,0001), ma al contrario, le cellule di KA-ragolari femmine hanno mostrato una diminuzione dei tassi di cottura intraburst (p < 0,0001). Inoltre, gli intervalli tra gli scoppi sono stati prolungati nei neuroni GnRH da femmine KA-regulari rispetto ai controlli(p = 0,0006; Fig. 6A), ma le cellule delle femmine KA-lunghe non hanno mostrato questa differenza. Questi ultimi risultati di una diminuzione del tasso di cottura intraburst e un aumento dell’intervallo di interburst nelle cellule da topi KA-regolari possono rappresentare meccanismi di compensazione impegnati a diminuire scoppio-driven rilascio GnRH in questo gruppo.

Figura 6.I neuroni di GnRH a scoppio dei topi femmine iniettati KA mostrano proprietà di scoppio modificate. A, Distribuzioni di probabilità cumulative per le proprietà di scoppio nelle cellule che visualizzano i modelli di scoppio da controllo (tracce nere), KA-lungo (tracce rosse), e KA-regolare (tracce blu) topi registrati su diestro. Le distribuzioni cumulative sono state costruite utilizzando 100 scoppi selezionati in modo casuale per cella. BDistribuzioni di probabilità cumulative per le proprietà di scoppio registrate su estrus; **p < 0,01 per confronti tra gruppi salini, KA-lunghi, o KA-regolari per coppie di test Kolmogorov-Smirnov. n.s., non significativo. Gli intervalli di interburst sono presentati su scale logaritmiche per una migliore visualizzazione della parte maggiore (1-99%) delle distribuzioni.
Su estruso, i neuroni GnRH da KA-lungo femmine KA mostrato scoppi più brevi, meno picchi per scoppio, e più elevati tassi di cottura intraburst rispetto ai controlli (salina n = 12 cellule; KA-lungo n = 10 cellule, tutti p < 0,0001, a coppie Kolmogorov-Smirnov test). GnRH neuroni GnRH da KA-regolari femmine(n = 5 cellule), tuttavia, ha mostrato cambiamenti nella direzione opposta, con una durata più lunga scoppio, più picchi per scoppio, e più lento tasso di cottura intraburst rispetto ai controlli (tutti p < 0,0001). I neuroni GnRH delle femmine KA-regolari hanno mostrato anche una distribuzione alterata dei valori dell’intervallo di interburst rispetto a quelli delle femmine KA-lunghe e dei controlli(p < 0,0001; Fig. 6B). Questi risultati indicano che, anche se i tassi complessivi di cottura tra le cellule di femmine KA-lunghe e KA-regolari sono simili su estrus, le proprietà di scoppio sono molto diverse. Inoltre, le proprietà di scoppio di cellule di topi KA-regolari su estrus mostrano lo stesso modello di differenze rispetto ai controlli come osservato sul diestro. Per le cellule di topi KA-lunghi, tuttavia, gli effetti sulla durata dello scoppio e sul numero di picchi per scoppio sull’estruso rispetto ai controlli sono opposti a quelli osservati sul diestro.

Figura 5.Le proprietà di scoppio dei neuroni GnRH sul diestro e sull’estruso; per i confronti sono stati utilizzati solo i neuroni che visualizzano i modelli di picco dello scoppio. A, Distribuzioni di probabilità cumulative per le proprietà di scoppio dei neuroni GnRH dei topi di controllo femmina su diestro (tracce grigie) ed estrus (tracce viola). Le distribuzioni cumulative sono state costruite utilizzando 100 scoppi selezionati in modo casuale per cella. B, Proprietà di scoppio da topi femmina KA-lunghi. C, Proprietà di scoppio da topi femmina KA-regolari; **p < 0,0001 per i confronti da Kolmogorov-Smirnov test. n.s., non significativo. Gli intervalli di interburst sono presentati su scale logaritmiche per una migliore visualizzazione della parte maggiore (1-99%) delle distribuzioni.

Figura 6.I neuroni di GnRH a scoppio dei topi femmine iniettati KA mostrano proprietà di scoppio modificate. A, Distribuzioni di probabilità cumulative per le proprietà di scoppio nelle cellule che visualizzano i modelli di scoppio da controllo (tracce nere), KA-lungo (tracce rosse), e KA-regolare (tracce blu) topi registrati su diestro. Le distribuzioni cumulative sono state costruite utilizzando 100 scoppi selezionati in modo casuale per cella. BDistribuzioni di probabilità cumulative per le proprietà di scoppio registrate su estrus; **p < 0,01 per confronti tra gruppi salini, KA-lunghi, o KA-regolari per coppie di test Kolmogorov-Smirnov. n.s., non significativo. Gli intervalli di interburst sono presentati su scale logaritmiche per una migliore visualizzazione della parte maggiore (1-99%) delle distribuzioni.
L’eccitabilità intrinseca dei neuroni GnRH cambia da diestro ad estruso ed è costantemente aumentata nei topi femmine iniettati con KA
Abbiamo usato le registrazioni di corrente a celle intere per determinare se i cambiamenti osservati nell’attività di sparo sono associati a cambiamenti nell’eccitabilità intrinseca. ANOVA a tre vie ha mostrato gruppo di trattamento, fase del ciclo di estrosi, e la posizione soma tutti hanno avuto effetti sul neurone GnRH evocato tasso di cottura (gruppo di trattamento e ciclo di estro: p <0,001, posizione soma p = 0,019). I neuroni nel gruppo di controllo aveva più alti tassi di cottura evocata evocata su estrus che su diestro (diestro = 18 cellule / 8 topi, estrus = 20 cellule / 5 topi, p = 0,005, a tre vie ANOVA / Fisher LSD; Fig. 7A-C), che indica un aumento endogeno dell’eccitabilità sull’estruso rispetto al diestro in condizioni di controllo.

Figura 7.L’eccitabilità intrinseca dei neuroni GnRH è elevata sia sul diestro che sull’estruso nel modello murino intrahippocampale KA del TLE. A, Esempi rappresentativi di cottura evocata in risposta alla depolarizzazione passi corrente depolarizzante in cellule registrate sul diestro (a sinistra) e l’estrus (a destra). Le tracce KA sono compensate per evidenziare le differenze di spiking. Tutte le tracce sono partite da un potenziale di membrana di circa -73 mV, corretto per il potenziale di giunzione liquido. BLe curve di frequenza-corrente (F-I) per i neuroni GnRH registrati sul diestro (sinistra) o estruso (destra), classificate in base alla posizione dei somati dei neuroni registrati. I passi di corrente depolarizzanti sono stati applicati con incrementi di 10 pA; *p < 0,05 per il confronto dell’area sotto la curva mediante ANOVA a tre vie con l’LSD di Fisher. C, Media ± SEM per l’area sotto la curva di trame di velocità di sparo evocato su diestro ed estruso in cellule da controllo (simboli neri e linea), KA-lungo (simboli rossi e linea), e KA-regolare (simboli blu e linea) topi. D, Media ± SEM per la soglia AP, la costante di tempo di membrana (τ), e la resistenza di ingresso; *p < 0,05, **p < 0,01 per ANOVA bidirezionale con LSD di Fisher; #p < 0,05 per il confronto tra diestro ed estruso all’interno di gruppi di tre vie ANOVA con LSD di Fisher.
Poiché non vi era alcuna interazione tra il gruppo di trattamento e la fase del ciclo estroso(p = 0,13, ANOVA complessivo a tre vie), i dati del diestro e dell’estrus sono stati inizialmente combinati per esaminare gli effetti complessivi dell’iniezione di KA sull’eccitabilità del neurone GnRH. In questa analisi, i neuroni GnRH da entrambe le femmine KA-lungo e KA-regolari hanno mostrato una maggiore eccitabilità rispetto ai controlli (salina n = 38 cellule / 13 topi, KA-lungo n = 41 cellule / 13 topi, KA-regolare n = 30 cellule / 11 topi; salina vs KA-lungo, p <0,001, salina vs KA-regolare, p = 0,001; Fig . 7B,C). Inoltre, i confronti effettuati esaminando ogni fase del ciclo separatamente identificato separatamente eccitabilità elevata in entrambi i gruppi KA-iniezione rispetto ai controlli su entrambi i diestro e estrus (diestro: salina n = 18 cellule / 8 topi, KA-lungo n = 26 cellule / 8 topi, KA-regolare n = 15 cellule / 7 topi; salina vs KA-lungo p = 0.047, salina vs KA-regolare p = 0,008, LSD di Fisher; estrus: salina n = 20 cellule/5 topi, KA-lungo n = 15 cellule/5 topi, KA-regolare n = 15 cellule/4 topi; salina vs KA-lungo p < 0,001, salina vs KA-regolare p = 0,045, LSD di Fisher). Questi risultati suggeriscono che l’eccitabilità intrinseca del neurone GnRH è elevata nei topi sia con e senza interruzione del ciclo estroso comorbido comorbido dopo l’iniezione KA, e che questa eccitabilità superiore persiste in entrambi i diestrus ed estrus.
Fisher LSD post test ad hoc sono stati utilizzati per esaminare le differenze tra i gruppi di controllo e KA iniettati rispetto alla posizione soma. In particolare, i neuroni GnRH da KA-lunghe femmine in MS e POA, ma non in AHA, hanno mostrato una maggiore eccitabilità rispetto ai controlli in entrambe le fasi del ciclo (MS p = 0,048 diestro, p < 0,001 estrus; POA p = 0,021 diestro, p = 0,027 estrus; n = 5-13 cellule per ogni gruppo e la posizione). Solo i neuroni GnRH nella SM da femmine KA-regolari hanno mostrato una maggiore eccitabilità rispetto ai controlli in entrambe le fasi del ciclo (diestro p = 0,003, estrus p = 0,027; n = 5-9 cellule per ogni posizione). Non è stata osservata alcuna differenza tra i gruppi KA-lungo e KA-regolari sia in MS o POA, e nessun effetto di iniezione di KA è stato osservato nella regione AHA(Fig. 7B). Questi risultati suggeriscono che, come per gli effetti sul tasso di cottura complessivo, i neuroni GnRH nella SM e POA mostrano il maggiore cambiamento di eccitabilità dopo l’iniezione di KA.
Per indagare se KA-iniezione femmine KA ha mostrato anche il ciclo-stadio-dipendente fluttuazioni in funzione del ciclo di eccitabilità dei neuroni GnRH come osservato nei topi di controllo, i tassi di cottura evocati da KA-iniettato topi sono stati confrontati tra diestrus ed estrus. Cellule da KA-lunghe femmine hanno mostrato una maggiore eccitabilità su estrus rispetto al diestrus(p <0,001). Le cellule di femmine KA-regolari hanno mostrato una tendenza simile, ma non al livello di significatività(p = 0,067; Fig. 7C). Insieme ai cambiamenti nella cottura a raffica specifici del gruppo KA-regular sopra descritti, questa tendenza può anche rappresentare un meccanismo di compensazione per avvicinare i valori di eccitabilità intrinseca al campo di controllo, in particolare sull’estruso.
Ulteriori parametri di eccitabilità sono stati analizzati per valutare i potenziali meccanismi di aumento del tasso di cottura dei neuroni GnRH evocati osservato nelle cellule di topi femmine KA-iniettato. Questi parametri includevano la soglia AP, la resistenza di ingresso, la capacità, la costante di tempo della membrana (τ), la latenza alla cottura, ISI, e la frequenza istantanea. Poiché le cellule nella MS e POA, ma non AHA, ha mostrato cambiamenti nel tasso di cottura evocato, questi parametri di eccitabilità sono stati analizzati solo per le cellule MS e POA. ANOVA a tre vie ha mostrato che la posizione soma non ha influenzato nessuno dei parametri testati. Pertanto, i dati di MS e POA sono stati raggruppati insieme per ulteriori analisi. Su diestrus, neuroni da KA-lungo KA e KA-regolare femmine hanno mostrato soglia AP iperpolarizzata rispetto ai controlli(p = 0,021 KA-lungo vs salina, p < 0,001 KA-regolare vs salina, a due vie ANOVA / Fisher LSD). Sull’estruso, i neuroni da KA-lungo, ma non KA-regolare, le femmine hanno mostrato una soglia di AP iperpolarizzata(p = 0,038, ANOVA bidirezionale ANOVA/Fisher LSD) e aumentato τ (p = 0,006, ANOVA bidirezionale ANOVA/Fisher LSD) rispetto ai controlli (Fig. 7D). Non sono state riscontrate differenze nella resistenza d’ingresso o negli altri parametri(Fig. 7D Tabella 3). Nessuno dei parametri cinetici AP esaminati (ampiezza a tutta larghezza a metà del massimo, ampiezza di postperpolarizzazione, tempo di postperpolarizzazione, pendenza di salita e pendenza di decadimento) è risultato diverso tra i gruppi di controllo e quelli iniettati KA(Tabella 3). Insieme, questi risultati indicano che i cambiamenti osservati nell’eccitabilità intrinseca complessiva si manifestano soprattutto nella soglia di AP iperpolarizzata sia sul diestro che sull’estruso, e nell’aumento della costante di tempo di membrana sull’estruso. Inoltre, questi effetti sono più evidenti nei neuroni GnRH da topi KA-iniettato con più grave interruzione del ciclo estroso.
| Parametri | Diestrus | Estrus | Totale ANOVA (valore F) | |||||
|---|---|---|---|---|---|---|---|---|
| Salina | KA-lungo | KA-reg. | Salina | KA-lungo | KA-reg. | Trattamento | Fase del ciclo | |
| Soglia AP (mV) | -28 + 3.6 | -39.1 + 2.5* | -40.8 + 1.7** | -35.8 + 2.8# | -44.0 + 2.0* | -40.4 + 2.1 | 6.57* | 4.54* |
| Resistenza di ingresso (MΩ) | 791.5 + 73.0 | 852.3 + 62.3 | 812.8 + 75.3 | 766.8 + 85.9 | 965.0 + 97.1 | 796.0 + 73.1 | 1.37 | 0.43 |
| Capacità (pF) | 18.5 + 2.7 | 14.8 + 0.7 | 16.5 + 1.6 | 17.9 + 2.0 | 16.1 + 0.8 | 18.5 + 1.1 | 0.63 | 1.21 |
| τ (ms) | 34.1 + 2.4 | 40.4 + 3.4 | 44.7 + 5.2 | 45.9 + 2.9# | 65.3 + 6.6*# | 51.7 + 3.9 | 4.45* | 17.02** |
| Latenza al fuoco (ms) | 0.57 + 0.07 | 0.47 + 0.05 | 0.48 + 0.08 | 0.50 + 0.07 | 0.36 + 0.08* | 0.43 + 0.06 | 1.66 | 2.40 |
| ISI primi 10 picchi (ms) | 10.0 + 0.3 | 9.1 + 0.2 | 9.6 + 0.4 | 9.1 + 0.4 | 9.8 + 0.5 | 9.2 + 0.3 | 2.71 | 0.50 |
| Freq. ins. freq. primi 10 picchi (Hz) | 112.9 + 6.1 | 122.3 + 4.1 | 117.9 + 6.0 | 130.3 + 7.2 | 113.8 + 5.7 | 119.8 + 5.1 | 0.10 | 0.50 |
| FWHM (ms) | 2.1 + 0.1 | 2.2 + 0.1 | 2.3 + 0.2 | 2.4 + 0.1 | 2.5 + 0.2 | 2.4 + 0.1 | 0.99 | 0.43 |
| AHP (pA) | 35.0 + 3.2 | 29.7 + 2.0 | 27.9 + 1.8 | 30.2 + 1.4 | 28.7 + 2.0 | 27.9 + 2.0 | 2.52 | 0.33 |
| Tempo fino a AHP (ms) | 3.8 + 0.1 | 3.8 + 0.1 | 3.7 + 0.2 | 4.1 + 0.2 | 3.9 + 0.3 | 3.8 + 0.3 | 0.19 | 0.76 |
| Pendenza massima di salita | 171.3 + 11.7 | 182.7 + 12.6 | 155.8 + 14.4 | 155.5 + 12.2 | 157.1 + 13.0 | 163.1 + 15.4 | 0.58 | 1.66 |
| Pendenza massima di decadimento | -80.9 + 3.7 | -78.8 + 4.2 | -67.4 + 6.5 | -74.8 + 3.8 | -71.9 + 3.4 | -73.2 + 3.8 | 1.94 | 0.88 |
I confronti dei parametri di eccitabilità dei neuroni GnRH all’interno dei gruppi tra il diestro e l’estruso indicano anche differenze. Soglia AP è stato iperpolarizzato su estrus rispetto al diestro nei topi di controllo(p = 0,022), ma non nei topi KA-lungo o KA-regolare (KA-lungo p = 0,063, KA-regolare p = 0.9); τ è stato aumentato su estrus rispetto al diestro nei topi di controllo e nei topi KA-lunghi (salina p = 0,013, KA-lunghi p < 0,001), ma non nei topi KA-regolari (p = 0, 12; Fig. 7D). Questi risultati indicano che i gruppi iniettati con KA non mostrano la tipica differenza da diestro a diestro nella soglia AP osservata nei controlli. Inoltre, la mancanza di di diestro contro la differenza di estruso-estrus nella costante di tempo di membrana può rappresentare un altro meccanismo di compensazione specifico del gruppo KA-regolare.

Figura 7.L’eccitabilità intrinseca dei neuroni GnRH è elevata sia sul diestro che sull’estruso nel modello murino intrahippocampale KA del TLE. AEsempi rappresentativi di cottura evocata in risposta alla depolarizzazione passi corrente depolarizzante in cellule registrate sul diestro (a sinistra) e l’estrus (a destra). Le tracce KA sono compensate per evidenziare le differenze di spiking. Tutte le tracce sono partite da un potenziale di membrana di circa -73 mV, corretto per il potenziale di giunzione liquido. BLe curve di frequenza-corrente (F-I) per i neuroni GnRH registrati sul diestro (sinistra) o estruso (destra), classificate in base alla posizione dei somati dei neuroni registrati. I passi di corrente depolarizzanti sono stati applicati con incrementi di 10 pA; *p < 0,05 per il confronto dell’area sotto la curva mediante ANOVA a tre vie con l’LSD di Fisher. C, Media ± SEM per l’area sotto la curva di trame di velocità di sparo evocato su diestro ed estruso in cellule da controllo (simboli neri e linea), KA-lungo (simboli rossi e linea), e KA-regolare (simboli blu e linea) topi. D, Media ± SEM per la soglia AP, la costante di tempo di membrana (τ), e la resistenza di ingresso; *p < 0,05, **p < 0,01 per ANOVA bidirezionale con LSD di Fisher; #p < 0,05 per il confronto tra diestro ed estruso all’interno di gruppi di tre vie ANOVA con LSD di Fisher.
Cambiamenti nei livelli di P4 ed E2 circolanti due mesi dopo l’iniezione di KA nelle femmine
Cambiamenti nell’attività dei neuroni GnRH potrebbero avere un impatto a valle della funzione gonadica, compresa la produzione e la secrezione di steroidi sessuali. Reciprocamente, il feedback degli steroidi sessuali può agire a livello ipotalamico per influenzare l’attività del neurone GnRH, e a livello ippocampale per modulare la suscettibilità alle crisi. Pertanto, per determinare se i livelli circolanti degli ormoni sessuali femminili steroidi P4 ed E2 sono alterati nel modello intrahippocampale del topo KA del TLE, abbiamo saggiato il siero del sangue del tronco con ELISA. Nei controlli, i livelli di P4 erano più alti sull’estruso che sul diestro (diestro = 23 topi, estruso = 18 topi, p = 0,01, test a due campioni t ). Nei topi KA-lunghi e KA-regolari, i livelli di P4 non erano significativamente diversi tra il diestro e l’estruso (KA-lunghi n = 19 topi, estrus n = 10 topi, p > 0,6; KA-regolari n = 20 topi, estrus n = 7 topi, p = 0,14). I livelli di siero P4 sono stati ridotti nelle femmine KA-lunghe rispetto ad entrambi i controlli e alle femmine KA-regolari su entrambi i dietilstrus (KA-lunghe vs saline p = 0,042, KA-lunghe vs KA-regolari p = 0.02; LSD monodirezionale ANOVA/Fisher’s LSD) ed estrus (KA-long vs salina p = 0,036, KA-long vs KA-regular p = 0,007; LSD monodirezionale ANOVA/Fisher’s LSD). I livelli di P4 nelle femmine KA-regolari non erano diversi dai controlli in entrambi gli stadi del ciclo(p > 0,3; Fig. 8A). Questi risultati indicano che la soppressione dei livelli di P4 sia sul diestro che sull’estruso è associata ad un aumento della gravità della perturbazione del ciclo estroso comorbido dopo l’iniezione di KA.

Figura 8.Cambiamenti nei livelli circolanti P4 ed E2 sul diestro e sull’estruso, misurati due mesi dopo l’iniezione KA. A, Media ± SEM per i livelli di P4 sul diestro (sinistra) ed estrus (destra) nel controllo (barre aperte), KA-lungo (barre rosse), e KA-regolare (barre blu) topi. B, Media ± SEM per i livelli di E2 sul diestro (sinistra) e sull’estruso (destra); *p < 0, 05 per confronti tra gruppi salini, KA-lunghi e KA-regolari con test a senso unico ANOVA e test post hoc di Fisher ; #p < 0,05 per confronti tra estruso e diestro all’interno dei gruppi con test t.
Nei topi di controllo, i livelli di E2 del siero erano più bassi sull’estrus rispetto al diestro (diestro = 6 topi, estrus = 6 topi, p = 0,035, test a due campioni t ). Nei topi KA-lunghi e KA-regolari, i livelli di E2 non erano significativamente diversi tra il diestro e l’estruso (KA-lunghi n = 8 topi, estrus n = 10 topi p = 0,59; KA-regolari n = 6 topi, estrus n = 5 topi p = 0,07). Sul diestro, i livelli di E2 non erano diversi tra i tre gruppi, ma sull’estruso i livelli di E2 erano significativamente più alti nelle femmine iniettate con KA rispetto ai controlli (KA-lungo vs salina p = 0,036, KA-regolare vs salina p = 0,016; LSD unidirezionale ANOVA/Fisher’s LSD), senza alcuna differenza osservata tra femmine KA-lungo e KA-regolare (Fig.8B). Questi risultati indicano che i topi iniettati con KA sia con che senza disturbo del ciclo estroso comorbido mancano della tipica diminuzione dei livelli di E2 sull’estruso rispetto al diestro.

Figura 8.Cambiamenti nei livelli circolanti P4 ed E2 sul diestro e sull’estruso, misurati due mesi dopo l’iniezione KA. A, Media ± SEM per i livelli di P4 sul diestro (sinistra) e sull’estruso (destra) nel controllo (barre aperte), KA-lungo (barre rosse), e KA-regolare (barre blu) nei topi. B, Media ± SEM per i livelli di E2 sul diestro (sinistra) e sull’estruso (destra); *p < 0, 05 per confronti tra gruppi salini, KA-lunghi e KA-regolari con test a senso unico ANOVA e test post hoc di Fisher ; #p < 0,05 per confronti tra estruso e diestro all’interno dei gruppi con test t.
I topi maschi mostrano una modesta interruzione dell’attività dei neuroni GnRH dopo il trattamento con KA senza variazioni dei livelli di T
Un vantaggio dell’integrazione di modelli murini di TLE con topi GnRH-tdTomato è che possiamo anche valutare gli impatti dell’epilessia sui neuroni GnRH dei topi maschi, che mancano di un parametro simile al ciclo estroso che può essere utilizzato come test ad alto rendimento delle comorbidità endocrine riproduttive. Per determinare se gli effetti del trattamento KA sui neuroni di GnRH sono specifici per il sesso, abbiamo misurato la velocità di cottura, le proprietà di scoppio e l’eccitabilità intrinseca dei neuroni di GnRH da topi maschi di controllo e KA-iniezione a due mesi dopo l’intervento chirurgico. Non c’è stato un cambiamento nella velocità di cottura media complessiva tra KA-iniezione e gruppi di controllo (salina n = 18 cellule / 10 topi, KA n = 25 cellule / 13 topi, p = 0,14; Fig. 9A), ma il confronto dei tassi medi di cottura in base alla posizione del soma ha rivelato che i neuroni MS GnRH da maschi KA-iniezione hanno mostrato un aumento di cottura rispetto ai controlli (soluzione fisiologica n = 5 cellule, KA n = 7 cellule, p = 0,034, Mann-Whitney test; Fig. 9B). Le proprietà di scoppio sono state alterate, con una maggiore durata dello scoppio e un aumento del numero di picchi per scoppio osservato nel gruppo KA-iniezione (soluzione fisiologica n = 5 cellule, KA n = 6 cellule, entrambi p < 0,0001, coppia Kolmogorov-Smirnov test; Fig. 9C). I topi iniettati di soluzione salina avevano scoppiare i neuroni GnRH nel POA (quattro neuroni) e AHA (un neurone), mentre i topi iniettati di KA avevano scoppiare i neuroni GnRH nel POA (cinque neuroni) e MS (un neurone). La velocità di cottura intraburst e l’intervallo di interburst non erano diversi tra i gruppi di controllo e KA-iniezione(Fig. 9C), e la percentuale di neuroni GnRH di topi maschi che mostravano uno spiking o uno scoppio irregolare non è stata influenzata dal trattamento KA (controllo: 61% irregolare e 39% di scoppio; KA-iniezione: 72% irregolare e 28% di scoppio; p > 0,5, χ 2 test). Nessuna cellula ha mostrato picchi di tonico o modelli tranquilli. Questi risultati suggeriscono che gli impatti dell’iniezione di KA sulla cottura dei neuroni GnRH sono diversi nei maschi rispetto alle femmine.

Figura 9.Impatti di iniezione KA su GnRH neurone media velocità di cottura e l’eccitabilità nei topi maschi dipendono dalla posizione soma. A, Media ± SEM per il tasso di cottura medio (a sinistra) e tassi di cottura per i singoli neuroni GnRH (a destra) da maschi trattati con soluzione fisiologica (barre e cerchi aperti) o KA (barre e cerchi verdi). B, Media ± SEM per la velocità di cottura media dei neuroni GnRH da controllo e KA-iniezione maschi classificati per posizione soma; *p < 0, 05, test a due campioni t. C, Distribuzioni di probabilità cumulative per la durata dello scoppio, il numero di picchi per scoppio, la velocità di cottura intraburst, e gli intervalli di interburst in cellule da maschi di controllo e KA-iniezione; **p < 0,0001 da Kolmogorov-Smirnov test. D, F-I curve per i neuroni GnRH da controllo e KA-iniezione maschi; *p < 0,05 per il confronto dell’area sotto la curva da due vie ANOVA con Fisher LSD post prove ad hoc. E, Media ± SEM per il siero T nel controllo e i topi maschi iniettati KA.
In intere cellule corrente-clamp registrazioni, i neuroni GnRH nella MS e POA da KA-iniezione maschi hanno mostrato più elevati tassi di cottura evocati rispetto ai controlli (MS p = 0,028, POA p = 0,044, a due vie ANOVA / Fisher LSD; n = 5-10 cellule per ogni gruppo e la posizione; Fig. 9D). Le celle nell’AHA non hanno mostrato una differenza di eccitabilità indotta da KA. Nessun altro parametro di eccitabilità e cinetica AP era diverso tra il controllo e i maschi iniettati KA(Tabella 4). Questi risultati indicano che, come osservato nelle femmine, l’eccitabilità dei neuroni MS e POA GnRH è elevata nei maschi KA-iniezione, anche se la variazione di eccitabilità è limitata al tasso di cottura evocata. Inoltre, i livelli di T del siero nei maschi iniettati con KA non erano diversi dai controlli(Fig. 9E).
| Parametri | Salina | KA |
|---|---|---|
| Soglia AP (mV) | -40.6 + 2.9 | -42.3 + 2.3 |
| Resistenza di ingresso (MΩ) | 745.6 + 36.9 | 1892.2 + 984.2 |
| Capacità (pF) | 16.7 + 1.0 | 15.7 + 1.0 |
| τ (ms) | 51.0 + 3.7 | 61.7 + 6.5 |
| Latenza al fuoco (ms) | 628.1 + 67.2 | 493.5 + 68.6 |
| ISI primi 10 picchi (ms) | 123.4 + 5.4 | 121.4 + 3.7 |
| Freq. ins. freq. primi 10 picchi (Hz) | 9.9 + 1.2 | 9.9 + 0.5 |
| FWHM (ms) | 2.3 + 0.12 | 2.4 + 0.3 |
| AHP | 31.6 + 2.6 | 32.8 + 1.9 |
| Tempo fino a AHP | 3.6 + 0.1 | 3.5 + 0.2 |
| Pendenza massima di salita | 187.3 + 11.7 | 158.9 + 3.2 |
| Pendenza massima di decadimento | -77.5 + 5.1 | -75.3 + 4.2 |

Figura 9.Impatti di iniezione KA su GnRH neuroni media velocità di cottura e l’eccitabilità nei topi maschi dipendono dalla posizione soma. A, Media ± SEM per il tasso di cottura medio (a sinistra) e tassi di cottura per i singoli neuroni GnRH (a destra) da maschi trattati con soluzione fisiologica (barre e cerchi aperti) o KA (barre e cerchi verdi). B, Media ± SEM per la velocità di cottura media dei neuroni GnRH da controllo e KA-iniezione maschi classificati per posizione soma; *p < 0, 05, test a due campioni t. C, Distribuzioni di probabilità cumulative per la durata dello scoppio, il numero di picchi per scoppio, la velocità di cottura intraburst, e gli intervalli di interburst in cellule da maschi di controllo e KA-iniezione; **p < 0,0001 da Kolmogorov-Smirnov test. D, F-I curve per i neuroni GnRH da controllo e KA-iniezione maschi; *p < 0,05 per il confronto dell’area sotto la curva da due vie ANOVA con Fisher LSD post prove ad hoc. E, Media ± SEM per il siero T nel controllo e i topi maschi iniettati KA.
Discussione
Patologie nel controllo neurale della riproduzione collegano probabilmente l’epilessia e le malattie endocrine comorbide della riproduzione, ma non sono stati descritti specifici cambiamenti funzionali nelle popolazioni neuronali chiave che regolano la riproduzione e la fertilità, compresi i neuroni GnRH. I presenti studi forniscono prove dirette dei cambiamenti nella funzione neuronale di GnRH con l’epilessia, e indicano che gli impatti sulla funzione neuronale di GnRH sono associati con la gravità del disturbo del ciclo estroso comorbido, diverso sul diestro rispetto all’estrus, e sesso-specifico. Nel complesso, i neuroni di GnRH delle femmine diestrose iniettate da KA, delle femmine estrose e dei maschi condividono alcuni punti in comune, così come alcuni cambiamenti specifici del gruppo. I neuroni GnRH nella SM e POA hanno mostrato un aumento dei tassi di cottura evocati in tutti i gruppi, ma solo le femmine hanno mostrato una soglia di AP significativamente iperpolarizzata. Inoltre, questi risultati sono i primi a mostrare che l’iniezione unilaterale di KA altera i livelli di ormoni sessuali in circolazione nei topi di sesso femminile. A causa dei complessi cicli di feedback coinvolti, rimane difficile allo stato attuale distinguere i cambiamenti che sono conseguenze dirette dell’attività epilettiforme nell’ippocampo da quelli che sono alterazioni secondarie che si sviluppano come risposta di feedback al disturbo del ciclo estroso comorbido. I cambiamenti comuni a tutti i gruppi, tuttavia, probabilmente riflettono le conseguenze dirette dell’epilessia indotta da KA.
Collegare l’attività di sequestro ippocampale a cambiamenti nella funzione neuronale ipotalamica GnRH ipotalamica
Le crisi epilettiche nel TLE hanno origine principalmente nell’ippocampo e raramente diventano generalizzate(Engel, 1996). Il modello murino intrahippocampale KA del TLE mostra in modo simile le ricorrenti scariche parossistiche spontanee principalmente limitate alla vicinanza dell’area ippocampale iniettata(Riban et al., 2002), anche se un lavoro recente che utilizza registrazioni di superficie corticale nello stesso modello ha rilevato picchi generalizzati che si propagano anche attraverso le cortecce frontali(Sheybani et al., 2018). Se vi è una correlazione tra l’onere sequestro ippocampale e la vicinanza temporale della recente attività di sequestro di GnRH ad anomalie funzionali dei neuroni GnRH e perturbazione del ciclo estroso sarà studiato incorporando registrazioni elettroencefalogramma in studi futuri. A questo proposito, le crisi spontanee nel modello intrahippocampale del topo KA sono presenti da circa due settimane dopo l’iniezione di KA(Riban et al., 2002; Heinrich et al., 2011), mentre l’interruzione del ciclo estroso in questo modello non emerge fino a circa sei settimane dopo l’iniezione di KA(Li et al., 2017). Questo corso del tempo indica che il modello robusto di perturbazione della ciclicità estrosa perturbata si sviluppa gradualmente dopo che l’epilessia è completamente stabilita, forse riflettendo un effetto cumulativo di onere sequestro nel tempo(Raedt et al., 2009). Questa sequenza temporale dovrebbe fornire importanti intuizioni nei futuri studi sulle relazioni causali tra epilettogenesi, la gravità delle crisi, la patologia dei neuroni GnRH, e il ciclo di interruzione degli estrogeni.
Convulsioni ippocampali focali potrebbero potenzialmente influenzare i neuroni di GnRH attraverso proiezioni dirette e / o indirette tra l’ippocampo e l’ipotalamo. Infatti, è noto da tempo che la stimolazione elettrica nell’ippocampo può ridurre il rilascio di gonadotropina e prevenire l’ovulazione, indicando collegamenti funzionali tra l’ippocampo e i circuiti ipotalamici per la riproduzione(Velasco e Taleisnik, 1969; Gallo et al., 1971). I dati attuali indicano che i neuroni di GnRH con attività di tiro aberrante nelle femmine si trovano principalmente nella SM e nella POA. Allo stesso modo, la SM è l’unica regione che conteneva i neuroni GnRH con un aumento della velocità di combustione nei topi maschi, anche se le cellule nel POA hanno mostrato proprietà di scoppio alterate. Ci sono robuste proiezioni bidirezionali tra l’ippocampo e la SM(Gaykema et al., 1991; Mattis et al., 2014). La prominenza di KA-indotta cambiamenti KA nei neuroni GnRH situati nella SM suggerisce che questi percorsi possono fornire substrati anatomici per l’attività di sequestro e / o le conseguenze secondarie di attività epilettiforme dell’ippocampo per propagare e impatto ipotalamico GnRH neuroni ipotalamici. L’estensione e le caratteristiche di riorganizzazione delle proiezioni ippocampali di proiezioni ippocampali ai circuiti neuronali GnRH dopo l’iniezione intrahippocampale KA rimangono poco chiare. Inoltre, i neuroni GnRH formano una popolazione eterogenea con variazioni, ad esempio, nelle proprietà di cottura(Constantin et al., 2013), l’espressione del recettore neuromodulatore(Jasoni et al., 2005), e la partecipazione al surge preovulatorio GnRH / LH (Hoffman et al., 1993; Wintermantel et al., 2006; Christian e Moenter, 2007) associati a differenze nella posizione soma. La relazione tra la localizzazione anatomica dei somati del neurone GnRH e l’eterogeneità cellulare non è stata ancora pienamente caratterizzata, ma i dati attuali supportano un modello di lavoro in cui la localizzazione del soma del neurone GnRH aiuta a modellare il risultato funzionale di fronte all’epilessia, di concerto con i cambiamenti nelle proiezioni ippocampali e ipotalamiche che mirano in modo differenziato alla SM, al POA e all’AHA.
Caratteristiche patologiche del TLE nell’ippocampo e nell’ipotalamo
La sclerosi ippocampale è una caratteristica comune del TLE negli esseri umani(Margerison e Corsellis, 1966; Cook et al., 1992; Blümcke et al., 2013; Blumcke et al., 2017). Il modello murino intrahippocampale KA del TLE riproduce questa sclerosi ippocampale in molteplici modi, tra cui la perdita neuronale estesa, la gliosi e la riorganizzazione del circuito ippocampale. In particolare, la degenerazione completa di CA1 e CA3 è spesso osservata nell’ippocampo ippocampale dorsale omolaterale, insieme con l’allargamento dello strato di cellule granulari dentate(Bouilleret et al., 1999; Riban et al., 2002; Fig. 2A). Anche se l’iniezione intrahippocampale di KA induce lesioni acute e perdita di cellule, va notato che la ciclicità estrosa può persistere dopo l’ablazione completa dell’ippocampo nei ratti(Terasawa e Kawakami, 1973). Inoltre, abbiamo osservato tassi simili di induzione della sclerosi ippocampale in entrambi i gruppi KA-lungo e KA-regolari. Pertanto, i cambiamenti osservati nella funzione neuronale GnRH probabilmente riflettono la riorganizzazione del circuito epilettico e gli effetti propaganti a valle di attività di sequestro, piuttosto che gli effetti acuti della lesione ippocampale iniziale precipitante di per sé (cioè, effetti indipendenti dall’attività epilettiforme). L’estensione della patologia ipotalamica nel modello di topo KA intrahippocampal KA utilizzato qui rimane poco chiaro. Tuttavia, né la perdita di cellule né la gliosi sono state osservate nell’ipotalamo in un modello di macaco KA unilaterale di epilessia(Chen et al., 2013), e nessuna perdita di cellule neuronali GnRH è stata osservata in un modello di topo pilocarpina sistemica(Fawley et al., 2012).
Cambiamenti nelle proprietà di cottura dei neuroni GnRH: potenziali collegamenti al malfunzionamento dell’asse HPG a valle
Cambiamenti nella frequenza degli impulsi di LH sono stati riportati nelle donne con epilessia in assenza di trattamento con farmaci antiepilettici, anche quando viene mantenuta una regolare ciclicità mestruale(Bilo et al., 1991; Meo et al., 1993). Il rilascio di GnRH-LH alterato in pazienti con epilessia può quindi rappresentare una forma di disfunzione riproduttiva subclinica. Poiché la secrezione ormonale da parte delle cellule neuroendocrine, come la vasopressina e i neuroni ossitocina, è stata a lungo collegata con le attività di sparo di scoppio(Wakerley e Lincoln, 1973; Dutton e Dyball, 1979), abbiamo esaminato se l’iniezione di KA ha influito sui modelli di sparo dei neuroni di GnRH e/o sulle proprietà di scoppio. Anche se le proporzioni delle cellule che mostrano la cottura scoppio non sono stati alterati dopo l’iniezione di KA, ci sono state differenze significative nelle proprietà di scoppio nelle cellule di entrambi i topi KA-iniezione maschile e femminile. Inoltre, i cambiamenti osservati in KA-iniettato topi femmina erano distinti a seconda che i cicli estrosi erano di lunghezza regolare o lunga, indicando che i cambiamenti nel modello di scoppio neuronale GnRH scoppio differiscono con la gravità della comorbilità. Alta e bassa frequenza dell’impulso di GnRH favorisce la sintesi pituitaria e il rilascio di LH e ormone follicolo-stimolante, rispettivamente(Wildt et al., 1981), ma l’effetto della durata dell’impulso di GnRH (forse riflesso nella durata dello scoppio) sul rilascio di gonadotropina è ancora sconosciuto. Inoltre, la presenza aberrante di neuroni tonici a picco sul diestro e neuroni silenziosi sull’estruso potrebbe potenzialmente compromettere la comunicazione complessiva della rete neuronale GnRH e la ritmicità. A questo proposito, i neuroni di GnRH esprimono i recettori di GnRH e l’attività di fuoco dei neuroni di GnRH cambia in risposta all’applicazione di GnRH(Xu et al., 2004; Todman et al., 2005; Han et al., 2010). A livello pituitario, tassi più elevati di attività di cottura dei neuroni di GnRH possono anche dare luogo ad aumenti sostenuti del contenuto di GnRH nella vascolarizzazione pituitaria, che potrebbero ridimensionare la risposta pituitaria a GnRH(Belchetz et al., 1978; Smith et al., 1983). Ulteriori studi sono quindi necessari per determinare se alterato GnRH modelli di cottura dei neuroni GnRH guidare disregolato GnRH e la secrezione di gonadotropina in epilessia.
Sul diestro, c’era una correlazione moderata ma significativa tra il tasso di cottura del neurone GnRH e la lunghezza del ciclo estroso nei topi KA-iniezione, che indica una relazione tra elevata attività del neurone GnRH e la gravità della comorbilità del ciclo estroso. Il ciclo estroso è regolato da una complessa interazione che coinvolge il rilascio di GnRH ipotalamico, il rilascio di gonadotropina pituitaria, e la risposta ovarica. Anche se non è noto se il rilascio di LH o FSH è alterato in questo modello di epilessia, le ovaie non mostrano cambiamenti istopatologici importanti a due mesi dopo l’iniezione di KA(Li et al., 2017), indicando che il fenotipo del ciclo estroso non riflette il danno ovarico lordo. Pertanto, anche se sarebbe prematuro collegare direttamente i cambiamenti nel tasso di cottura media del neurone GnRH agli effetti sulla ciclicità estrosa, la correlazione positiva osservata indica che i cambiamenti nell’attività del neurone GnRH, e potenzialmente a valle del rilascio di gonadotropina pituitaria, sono probabilmente i principali attori in questa comorbilità.
Relazioni di feedback degli steroidi sessuali e cambiamenti associati all’epilessia nell’attività dei neuroni di GnRH
I cambiamenti nella cottura dei neuroni di GnRH potrebbero essere, almeno in parte, le conseguenze dell’alterazione del feedback degli ormoni sessuali. P4 esercita tipicamente una forte soppressione dell’attività dei neuroni GnRH(Pielecka et al., 2006; Bashour e Wray, 2012) e il rilascio di GnRH(Goodman e Karsch, 1980; Leipheimer et al., 1984; He et al., 2017). Il nostro riscontro di una diminuzione dei livelli di P4 (e la probabile riduzione del feedback negativo di P4) nelle femmine di lunghezza KA sul diestro è quindi coerente con l’aumento del tasso di cottura medio osservato in questo gruppo. I livelli di P4 sono stati ridotti anche nelle femmine KA-lunghe su estrus, ma questo cambiamento non è coerente con il tasso di cottura significativamente soppresso dei neuroni GnRH di questo gruppo in questa fase, suggerendo che altri meccanismi sono probabilmente coinvolti. P4 può ancora giocare un ruolo nella guida soppresso cottura in KA-regolari femmine su estrus, tuttavia, come questo gruppo non ha mostrato una riduzione della P4 circolante.
Sia sul diestro che sull’estruso, i livelli di E2 erano all’interno del basso range fisiologico in cui E2 esercita tipicamente un feedback negativo (cioè soppressivo) sul rilascio di GnRH(Sarkar e Fink, 1980; Evans et al., 1994). I topi di controllo avevano livelli più alti di E2 sul diestro rispetto all’estruso. Questo risultato è in linea con il più basso tasso di cottura del neurone GnRH sul diestro, anche se una possibilità alternativa è che l’aumento del tasso di cottura del neurone GnRH osservato sull’estrus precoce riflette la fine coda del robusto aumento dell’attività di cottura che guida l’aumento preovulatorio di GnRH durante il proestro tardivo(Christian e Moenter, 2010). Inoltre, l’aumento dei livelli di E2 sull’estruso sia nelle femmine KA-lunghe che nelle femmine KA-regolari si prevede che eserciterà un aumento del feedback negativo sui neuroni di GnRH, e sono quindi coerenti con la diminuzione del tasso di cottura del neurone GnRH osservato in questa fase del ciclo in entrambi i gruppi. I livelli sierici di E2 sul diestro erano simili tra le femmine KA-iniezione e di controllo, suggerendo che E2 non contribuisce all’aumento osservato di cottura del neurone GnRH sul diestro nel gruppo KA-lungo. Queste differenze nei livelli di P4 e E2 in circolazione potrebbero riflettere la steroidogenesi ovarica alterata e/o il metabolismo compromesso degli steroidi sessuali da parte del citocromo periferico P450 ossidasi(Runtz et al., 2018). Indagine meccanicistica dei ruoli di E2 e P4 feedback nel mediare i cambiamenti associati all’epilessia nella funzione neuronale GnRH sarà un aspetto importante di studio futuro, ad esempio attraverso la sostituzione ormonale selettiva nei topi gonadectomizzati, o l’incorporazione di modelli murini in cui specifici recettori ormonali steroidei sono assenti o non funzionali.
Alterazioni nei livelli di steroidi in circolazione potrebbe anche esercitare impatti a livello di ippocampo per modulare l’attività di sequestro. Ad esempio, la conversione centrale P4 al neurosteroide allopregnanolone può ridurre la suscettibilità sequestro e l’attività epilettiforme attraverso una potente modulazione allosterica positiva dei recettori GABAA dell’ippocampo(Maguire et al., 2005; Lawrence et al., 2010; Reddy e Rogawski, 2012). Pertanto, ridotti livelli di P4 nei topi KA-lungo può anche essere indicativo di una ridotta produzione di neurosteroidi nel cervello, che potrebbe esacerbare l’attività convulsiva in questo gruppo.
In uno studio che esamina il modello sistemico pilocarpina di TLE nei ratti femmine, T circolante è stato elevato in concomitanza con la presenza di ovaie cistiche(Scharfman et al., 2008). Nei presenti studi, la misurazione di T nelle femmine è stata inconcludente perché le quantità di siero rimaste dopo aver completato i saggi per P4 ed E2 erano troppo piccole per essere saggiate in duplicato in modo affidabile. Tuttavia, va notato che molti valori erano al di sotto del limite di rilevazione ELISA, e quei campioni che hanno prodotto valori di resa non erano diversi tra i topi di controllo e quelli iniettati con KA (osservazioni non pubblicate). Insieme, questi risultati suggeriscono che la T circolante non era elevata nei topi femmine iniettati KA. Questo risultato è coerente con il lavoro precedente in cui non sono state osservate cisti ovariche in questo modello di topo di TLE(Li et al., 2017), e quindi non ci si aspetterebbe livelli di T elevati.
Da notare che il modello dei cambiamenti nei livelli di E2 e P4 rilevati in questo modello murino non corrisponde direttamente ai cambiamenti nei livelli di steroidi sessuali riportati in un numero limitato di studi clinici sull’uomo(Herzog et al., 2003; Kalininin e Zheleznova, 2007). Il TLE umano, tuttavia, è una condizione più eterogenea di quanto un modello animale possa riprodurre. La posizione di origine delle crisi, gli effetti di diversi farmaci antiepilettici, e la tempistica della misurazione del livello ormonale in relazione alla fase del ciclo mestruale potrebbe influenzare profondamente il fenotipo dei cambiamenti nei livelli di steroidi sessuali indotti dall’epilessia. Un’ulteriore esplorazione del disturbo neuroendocrino sia in clinica che nei modelli preclinici è necessaria per chiarire lo spettro dei cambiamenti che possono essere indotti dall’epilessia e dall’attività convulsiva, e per determinare i meccanismi differenziali che possono guidare questi risultati variabili.
Contributi relativi dell’eccitabilità intrinseca del neurone GnRH e degli input sinaptici nel guidare i cambiamenti associati all’epilessia nell’attività del neurone GnRH
In contrasto con i cambiamenti bidirezionali nel tasso di cottura dei neuroni GnRH osservati nei topi femmine iniettati KA, l’eccitabilità intrinseca è stata costantemente elevata nei gruppi iniettati KA sia sul diestro che sull’estruso, e indipendentemente dal fenotipo del periodo del ciclo estroso. Iperpolarizzato soglia AP è stato il cambiamento più importante osservato nelle cellule da KA-iniezione femminile. Tetrodotossina-sensibili alla tensione canali di sodio gated controllare la depolarizzazione AP nei neuroni GnRH(Norberg et al., 2013), e quindi può svolgere ruoli importanti nel determinare la soglia AP. La soglia AP dei neuroni GnRH e la latenza alla cottura possono anche essere modulate dal feedback E2, ad esempio attraverso correnti di potassio di tipo A(DeFazio e Moenter, 2002). Cambiamenti in questi e altre conduttanze sottostanti probabilmente forma gli spostamenti complessivi di eccitabilità prodotta sia attraverso le fasi del ciclo estroso e in risposta all’epilessia. Inoltre, l’aumento persistente di eccitabilità dei neuroni GnRH da topi KA-iniezione, insieme con i cambiamenti dinamici nel tasso di cottura media, indicano che gli ingressi afferenti sinaptici e / o neuromodulatori afferenti probabilmente svolgono un ruolo nel plasmare il ciclo-stadio-dipendente turni in fase di cottura globale comportamento. A questo proposito, la maggior parte E2 e P4 feedback ai neuroni GnRH è mediata trans-sinaptica(Sullivan e Moenter, 2005; Wintermantel et al., 2006; Christian e Moenter, 2007), e certamente almeno una connessione sinaptica è necessario per trasmettere gli effetti dell’attività di crisi ippocampale ai neuroni ipotalamici GnRH. Sarà interessante in studi futuri per determinare quali percorsi ormonali steroidei sensibili e ormonali sono coinvolti nella trasmissione degli effetti dell’attività convulsiva ai neuroni di GnRH, e nel guidare i cambiamenti differenziali dipendenti dalla fase del ciclo estroso.
Osservazioni conclusive
I risultati attuali forniscono nuove prove dirette dell’aberrante attività dei neuroni di GnRH e dell’eccitabilità in un modello animale di epilessia. La cosa più importante, questo studio supporta un modello in cui il modello dei cambiamenti nell’attività di cottura del neurone GnRH nell’epilessia non è una proprietà fissa, ma è profondamente influenzato dallo stato fisiologico generale. Inoltre, questi studi sottolineano l’utilità di questo modello di TLE nel distinguere quali cambiamenti sono osservati in concomitanza con la rottura del ciclo estroso, e quali cambiamenti sono osservati nelle femmine resilienti che mantengono una regolare ciclicità estrosa. Questi risultati hanno quindi importanti implicazioni per ulteriori studi sui meccanismi neurali che collegano l’epilessia alla disfunzione endocrina riproduttiva comorbida, e forniscono un’indicazione che le strategie di trattamento sia per le crisi epilettiche che per le comorbidità riproduttive devono essere personalizzate in base allo stadio del ciclo, alla gravità della comorbilità e al sesso.
References
- Effects of intrahippocampal injection of kainic acid on estrous cycle in rats. Braz J Med Biol Res. 1987; 20:829-832. PubMed
- Epilepsy and hormonal regulation: the patterns of GnRH and galanin immunoreactivity in the hypothalamus of epileptic female rats. Epilepsy Res. 1993; 14:149-159. PubMed
- Hormonal and gestational parameters in female rats submitted to the pilocarpine model of epilepsy. Epilepsy Res. 1998; 32:266-274. DOI | PubMed
- Progesterone directly and rapidly inhibits GnRH neuronal activity via progesterone receptor membrane component 1. Endocrinology. 2012; 153:4457-4469. DOI | PubMed
- Polycystic ovary syndrome in patients with focal epilepsy: a study in 93 women. Epilepsy Res. 2000; 41:163-167. PubMed
- Reproductive dysfunction in women with epilepsy: menstrual cycle abnormalities, fertility, and polycystic ovary syndrome. Int Rev Neurobiol. 2008; 83:135-155. DOI | PubMed
- Hypophysial responses to continuous and intermittent delivery of hypopthalamic gonadotropin-releasing hormone. Science. 1978; 202:631-633. PubMed
- Abnormal pattern of luteinizing hormone pulsatility in women with epilepsy. Fertil Steril. 1991; 55:705-711. PubMed
- Characterization of reproductive endocrine disorders in women with epilepsy. J Clin Endocrinol Metab. 2001; 86:2950-2956. DOI | PubMed
- International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: a task force report from the ILAE Commission on Diagnostic Methods. Epilepsia. 2013; 54:1315-1329. DOI | PubMed
- Histopathological findings in brain tissue obtained during epilepsy surgery. N Engl J Med. 2017; 377:1648-1656. DOI | PubMed
- Recurrent seizures and hippocampal sclerosis following intrahippocampal kainate injection in adult mice: electroencephalography, histopathology and synaptic reorganization similar to mesial temporal lobe epilepsy. Neuroscience. 1999; 89:717-729. DOI | PubMed
- Mouse estrous cycle identification tool and images. PLoS One. 2012; 7:e35538. DOI | PubMed
- A macaque model of mesial temporal lobe epilepsy induced by unilateral intrahippocampal injection of kainic acid. PLoS One. 2013; 8:e72336. DOI | PubMed
- Diurnal and estradiol-dependent changes in gonadotropin-releasing hormone neuron firing activity. Proc Natl Acad Sci USA. 2005; 102:15682-15687. DOI | PubMed
- Estradiol induces diurnal shifts in GABA transmission to gonadotropin-releasing hormone neurons to provide a neural signal for ovulation. J Neurosci. 2007; 27:1913-1921. DOI | PubMed
- The neurobiology of preovulatory and estradiol-induced gonadotropin-releasing hormone surges. Endocr Rev. 2010; 31:544-577. DOI | PubMed
- Hormones, brain and behavior. Academic Press: Oxford; 2017.
- In vivo recordings of GnRH neuron firing reveal heterogeneity and dependence upon GABAA receptor signaling. J Neurosci. 2013; 33:9394-9401. DOI | PubMed
- Hippocampal volumetric and morphometric studies in frontal and temporal lobe epilepsy. Brain. 1992; 115:1001-1015. DOI | PubMed
- Estradiol feedback alters potassium currents and firing properties of gonadotropin-releasing hormone neurons. Mol Endocrinol. 2002; 16:2255-2265. DOI | PubMed
- Quantification of clustering in joint interspike interval scattergrams of spike trains. Biophys J. 2010; 98:2535-2543. DOI | PubMed
- Altered pulsatile secretion of luteinizing hormone in women with epilepsy. Neurology. 1994; 44:306-306. PubMed
- Phasic firing enhances vasopressin release from the rat neurohypophysis. J Physiol. 1979; 290:433-440. PubMed
- Limbic seizures alter reproductive function in the female rat. Epilepsia. 1999; 40:1370-1377. PubMed
- The effect of seizures and kindling on reproductive hormones in the rat. Neurosci Biobehav Rev. 2000; 24:753-762. PubMed
- Introduction to temporal lobe epilepsy. Epilepsy Res. 1996; 26:141-150. PubMed
- Mesial temporal lobe epilepsy: what have we learned?. Neuroscientist. 2001; 7:340-352. DOI | PubMed
- Central regulation of pulsatile gonadotropin-releasing hormone (GnRH) secretion by estradiol during the period leading up to the preovulatory GnRH surge in the ewe. Endocrinology. 1994; 134:1806-1811. DOI | PubMed
- Pilocarpine-induced status epilepticus and subsequent spontaneous seizures: lack of effect on the number of gonadotropin-releasing hormone-positive neurons in a mouse model of temporal lobe epilepsy. Neuroscience. 2012; 203:153-159. DOI | PubMed
- The estrus cycle, sensitivity to convulsants and the anticonvulsant effect of a neuroactive steroid. J Pharmacol Exp Ther. 1994; 271:164-170. PubMed
- The mouse in biomedical research: normative biology, husbandry, and models. Academic Press: San Diego; 2006.
- GnRH-immunoreactive fiber changes with unilateral amygdala-kindled seizures. Epilepsy Res. 2002; 52:73-77. PubMed
- Effects of electrochemical stimulation of the ventral hippocampus on hypothalamic electrical activity and pituitary gonadotropin secretion in female rats. Endocrinology. 1971; 89:704-713. DOI | PubMed
- Patterns of direct projections from the hippocampus to the medial septum-diagonal band complex: anterograde tracing with Phaseolus vulgaris leucoagglutinin combined with immunohistochemistry of choline acetyltransferase. Neuroscience. 1991; 43:349-360. PubMed
- Pulsatile secretion of luteinizing hormone: differential suppression by ovarian steroids. Endocrinology. 1980; 107:1286-1290. DOI | PubMed
- Gonadotrophin-releasing hormone (GnRH) exerts stimulatory effects on GnRH neurons in intact adult male and female mice. J Neuroendocrinol. 2010; 22:188-195. DOI | PubMed
- Hypothalamic effects of progesterone on regulation of the pulsatile and surge release of luteinising hormone in female rats. Sci Rep. 2017; 7:8096. DOI | PubMed
- Increase in BDNF-mediated TrkB signaling promotes epileptogenesis in a mouse model of mesial temporal lobe epilepsy. Neurobiol Dis. 2011; 42:35-47. DOI | PubMed
- Knobil and Neill’s physiology of reproduction. Raven Press: New York; 2006.
- Reproductive endocrine disorders in women with partial seizures of temporal lobe origin. Arch Neurol. 1986a; 43:341-346. PubMed
- Reproductive endocrine disorders in men with partial seizures of temporal lobe origin. Arch Neurol. 1986b; 43:347-350. DOI | PubMed
- Abnormal pulsatile secretion of luteinizing hormone in men with epilepsy: relationship to laterality and nature of paroxysmal discharges. Neurology. 1990; 40:1557-1561. PubMed
- Three patterns of catamenial epilepsy. Epilepsia. 1997; 38:1082-1088. PubMed
- Interictal EEG discharges, reproductive hormones, and menstrual disorders in epilepsy. Ann Neurol. 2003; 54:625-637. DOI | PubMed
- Frequency of catamenial seizure exacerbation in women with localization‐related epilepsy. Ann Neurol. 2004; 56:431-434. DOI | PubMed
- Disorders of reproduction in patients with epilepsy: primary neurological mechanisms. Seizure. 2008; 17:101-110. DOI | PubMed
- c-Fos and related immediate early gene products as markers of activity in neuroendocrine systems. Front Neuroendocrinol. 1993; 14:173-213. DOI | PubMed
- Expression of mRNAs encoding receptors that mediate stress signals in gonadotropin-releasing hormone neurons of the mouse. Neuroendocrinology. 2005; 82:320-328. DOI | PubMed
- Chronology and evolution of temporal lobe epilepsy and endocrine reproductive dysfunction in women: relationships to side of focus and catameniality. Epilepsy Behav. 2007; 11:185-191. DOI | PubMed
- GnRH neurons and episodic bursting activity. Trends Endocrinol Metab. 2002; 13:409-410. PubMed
- Premature ovarian failure in women with epilepsy. Epilepsia. 2001; 42:1584-1589. PubMed
- Catamenial epilepsy. Lancet. 1956; 268:1235-1237. DOI
- Endogenous neurosteroid synthesis modulates seizure frequency. Ann Neurol. 2010; 67:689-693. DOI | PubMed
- The influence of progesterone and estradiol on the acute changes in pulsatile luteinizing hormone release induced by ovariectomy on diestrus day 1 in the rat. Endocrinology. 1984; 114:1605-1612. DOI | PubMed
- Disrupted female estrous cyclicity in the intrahippocampal kainic acid mouse model of temporal lobe epilepsy. Epilepsia Open. 2017; 2:39-47. DOI | PubMed
- Reproductive endocrine function in women with epilepsy: the role of epilepsy type and medication. Epilepsy Behav. 2007; 10:77-83. DOI | PubMed
- A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 2010; 13:133-140. DOI | PubMed
- Ovarian cycle–linked changes in GABAA receptors mediating tonic inhibition alter seizure susceptibility and anxiety. Nat Neurosci. 2005; 8:797-804. DOI | PubMed
- Epilepsy and the temporal lobes. A clinical, electroencephalographic and neuropathological study of the brain in epilepsy, with particular reference to the temporal lobes. Brain. 1966; 89:499-530. PubMed
- Frequency-dependent, cell type-divergent signaling in the hippocamposeptal projection. J Neurosci. 2014; 34:11769-11780. DOI | PubMed
- Derangement of the hypothalamic GnRH pulse generator in women with epilepsy. Seizure. 1993; 2:241-252. PubMed
- Mechanisms underlying episodic gonadotropin-releasing hormone secretion. Front Neuroendocrinol. 2003; 24:79-93. DOI | PubMed
- Neurobiological mechanisms underlying oestradiol negative and positive feedback regulation of gonadotrophin‐releasing hormone neurones. J Neuroendocrinol. 2009; 21:327-333. DOI | PubMed
- Ion channels and information processing in GnRH neuron dendrites. Channels. 2013; 7:135-145. DOI | PubMed
- Estradiol-sensitive afferents modulate long-term episodic firing patterns of GnRH neurons. Endocrinology. 2002; 143:2284-2292. DOI | PubMed
- The mouse brain in stereotaxic coordinates. Elsevier Academic Press: London; 2012.
- Androgens increase gonadotropin-releasing hormone neuron firing activity in females and interfere with progesterone negative feedback. Endocrinology. 2006; 147:1474-1479. DOI | PubMed
- Interictal and postictal alterations of pulsatile secretions of luteinizing hormone in temporal lobe epilepsy in men. Ann Neurol. 2002; 51:559-566. DOI | PubMed
- Seizures in the intrahippocampal kainic acid epilepsy model: characterization using long‐term video‐EEG monitoring in the rat. Acta Neurol Scand. 2009; 119:293-303. PubMed
- Burst and tonic firing in thalamic cells of unanesthetized, behaving monkeys. Vis Neurosci. 2000; 17:55-62. PubMed
- Jasper’s basic mechanisms of the epilepsies. National Center for Biotechnology Information (US): Bethesda, MD; 2012.
- Evolution of hippocampal epileptic activity during the development of hippocampal sclerosis in a mouse model of temporal lobe epilepsy. Neuroscience. 2002; 112:101-111. DOI | PubMed
- Hepatic and hippocampal cytochrome P450 enzyme overexpression during spontaneous recurrent seizures. Epilepsia. 2018; 59:123-134. DOI | PubMed
- Luteinizing hormone releasing factor in pituitary stalk plasma from long-term ovariectomized rats: effects of steroids. J Endocrinol. 1980; 86:511-524. PubMed
- Seizures and reproductive function: insights from female rats with epilepsy. Ann Neurol. 2008; 64:687-697. DOI | PubMed
- Electrophysiological evidence for the development of a self-sustained large-scale epileptic network in the kainate mouse model of temporal lobe epilepsy. J Neurosci. 2018; 38:3776-3791. DOI | PubMed
- Desensitization of cultured pituitary cells to gonadotropin-releasing hormone: evidence for a post-receptor mechanism. Mol Cell Endocrinol. 1983; 30:85-96. PubMed
- GABAergic integration of progesterone and androgen feedback to gonadotropin-releasing hormone neurons. Biol Reprod. 2005; 72:33-41. DOI | PubMed
- Sexual function in men with epilepsy How important is testosterone?. Neurology. 2008; 70:1346-1352. DOI | PubMed
- Effects of limbic forebrain ablation on pituitary gonadal function in the female rat. Endocrinol Jpn. 1973; 20:277-289. PubMed
- Profiling neurotransmitter receptor expression in mouse gonadotropin-releasing hormone neurons using green fluorescent protein-promoter transgenics and microarrays. Neuroscience. 2005; 132:703-712. DOI | PubMed
- Effect of hippocampal stimulation on the release of gonadotropin. Endocrinology. 1969; 85:1154-1159. DOI | PubMed
- The milk-ejection reflex of the rat: a 20- to 40-fold acceleration in the firing of paraventricular neurones during oxytocin release. J Endocrinol. 1973; 57:477-493. PubMed
- Frequency and amplitude of gonadotropin-releasing hormone stimulation and gonadotropin secretion in the rhesus monkey. Endocrinology. 1981; 109:376-385. DOI | PubMed
- Definition of estrogen receptor pathway critical for estrogen positive feedback to gonadotropin-releasing hormone neurons and fertility. Neuron. 2006; 52:271-280. DOI | PubMed
- Dose-dependent switch in response of gonadotropin-releasing hormone (GnRH) neurons to GnRH mediated through the type I GnRH receptor. Endocrinology. 2004; 145:728-735. DOI | PubMed
- Olfactory inputs to hypothalamic neurons controlling reproduction and fertility. Cell. 2005; 123:669-682. DOI | PubMed
- Polycystic ovary syndrome in patients with epilepsy: a study in 102 Chinese women. Seizure. 2012; 21:729-733. DOI | PubMed
Fonte
Li J, Robare JA, Gao L, Ghane MA, Flaws JA, et al. (2018) Dynamic and Sex-Specific Changes in Gonadotropin-Releasing Hormone Neuron Activity and Excitability in a Mouse Model of Temporal Lobe Epilepsy. eNeuro 5(5): ENEURO.0273-18.2018. https://doi.org/10.1523/ENEURO.0273-18.2018





