Abstract
Background
Il rapporto tra il consumo di alcol e le malattie coronariche (CHD) è di interesse scientifico e di salute pubblica, eppure rimane un argomento di dibattito. Gli studi hanno trovato prove sia a favore che contro la possibilità di un’associazione[1, 2]. Il concetto di un effetto potenzialmente cardioprotettivo del bere moderato rispetto al non bere o al consumo più pesante, chiamato curva a forma di U/J, è stato particolarmente controverso[3- 5]. Alcune evidenze cliniche suggeriscono che l’alcol può influenzare diverse vie che si pensa possano influenzare il rischio di CHD, tra cui l’ipertensione[6, 7], l’indice di massa corporea (BMI)[8] e i livelli lipidici[9, 10]. Tuttavia, questo presunto effetto continua ad essere contestato[11], il che pone sfide nella formazione di politiche sanitarie e può ostacolare una più ampia comprensione pubblica dell’impatto sulla salute delle scelte di stile di vita.
Gran parte della discussione sulla base delle prove di base per l’associazione alcol-CHD si è concentrata sui limiti di progettazione negli studi osservazionali, come la mancata distinzione tra i non bevitori e gli ex bevitori [12,13]. La decisione di smettere di bere potrebbe essere influenzata dall’insorgenza di patologie, e tali malati che smettono di bere potrebbero potenzialmente distorcere le stime del rischio di malattia negli astenuti per tutta la vita se non vengono analizzati in modo indipendente[14]. Gli studi hanno usato più comunemente singole misure di base dell’assunzione di alcol e il fatto che i comportamenti del bere possono cambiare nel tempo non è stato, quindi, tipicamente riflesso nella letteratura epidemiologica sull’alcol[15, 16].
Recenti sforzi sono stati fatti per stabilire traiettorie a lungo termine dell’assunzione di alcolici, consentendo di differenziare i modelli di consumo che fluttuano nel tempo. Traiettorie diverse sono state trovate per avere modelli distinti di associazione con marcatori intermedi della salute cardiovascolare, tra cui lo spessore della carotide intima media[17], la velocità dell’onda di polso[18] e marcatori infiammatori[19], ma questo lavoro non ha ancora collegato direttamente queste tipologie di consumo di alcolici agli eventi CHD. Più comunemente, studi con valutazioni longitudinali del bere hanno utilizzato l’assunzione media, tipicamente tra due sole occasioni di misurazione, nelle valutazioni del rischio di CHD[20], ma tale aggregazione può mascherare la variazione del consumo nel tempo. L’importanza di catturare la variabilità è evidente dai lavori precedenti che hanno dimostrato come episodi isolati di forte consumo di alcolici possano compensare gli effetti potenzialmente protettivi del bere moderato[2]. La mancata considerazione della stabilità dei livelli di assunzione di alcolici può influenzare le stime di rischio[21]. Nello studio attuale, abbiamo utilizzato un approccio di traiettoria dell’assunzione di alcolici, precedentemente impiegato nello studio dei marcatori CHD intermedi[17- 19], per colmare questa lacuna della ricerca. Abbiamo tratto dati da studi di coorte multipli per indagare se le traiettorie longitudinali del consumo di alcolici differiscono nella loro associazione con l’incidenza totale di CHD (mortale o non mortale). Inoltre, poiché la ricerca ha suggerito che l’effetto cardioprotettivo del bere moderato può essere meno evidente con risultati di CHD mortali[22], in particolare in confronto a un’assunzione più pesante[23], uno scopo secondario di questo lavoro è stato quello di esaminare come le traiettorie longitudinali sono specificamente associate alla mortalità dovuta al CHD.
Metodi
Campione, design e selezione della coorte
I dati sono stati ottenuti da cinque studi di coorte britannici: European Prospective Investigation of Cancer, Norfolk Cohort (EPIC-N)[24]; Medical Research Council’s National Survey of Health and Development 1946 (NSHD) [25]; West of Scotland Twenty-07: 1930s (T07-1930s) [26]; West of Scotland Twenty-07: 1950s (T07-1950s) [26] e Whitehall II (WII) [27]. Ulteriori dati sono stati ottenuti da un’ulteriore coorte francese: Gaz et Electricité (GAZEL) [28]. Le descrizioni di ciascuna coorte sono fornite nella Fig. 1 e i profili completi delle coorti sono disponibili attraverso le citazioni sopra riportate. Le coorti sono state scelte per la loro copertura di variabili rilevanti e per la somiglianza dei disegni. Ciascuna di esse includeva dati prospettici sull’assunzione di alcool attraverso tre valutazioni che coprono un intervallo di circa 10 anni, così come i dati covariarianti pertinenti e i dati verificati sui risultati del CHD. Prima dell’inizio dell’analisi, è stata effettuata un’ulteriore armonizzazione per tutti i set di dati delle coorti per massimizzare la coerenza dei nomi e delle definizioni delle variabili. Il disegno dello studio è stato pre-registrato su ClinicalTrials.gov (identificatore NCT03133689), e una dichiarazione STROBE è fornita nel file aggiuntivo 1 (Sezione S1).Fig. 1Descrizione della coorte e diagramma di flusso di selezione dei partecipanti. CHD Coronary heart disease, EPIC-N European Prospective Investigation of Cancer, Norfolk, GAZEL Gaz et Electricité, T07-1930s West of Scotland Twenty-07 Study 1930s, T07-1950s West of Scotland Twenty-07 Study 1950s, WII Whitehall II
Il set di dati combinato comprendeva inizialmente 62.799 record di partecipanti in totale (i conteggi specifici per coorte sono forniti nella Fig. 1). La variabile di esposizione è stata misurata su tre punti di valutazione che coprono in media un decennio, con l’ultimo punto di valutazione trattato come la linea di base dello studio da cui sono stati misurati i risultati da tempo ad evento. Del campione iniziale, 19.277 partecipanti sono stati esclusi a causa dell’attrito o dell’esperienza di un evento CHD prima della linea di base dello studio. Altri 8390 partecipanti non sono stati inclusi a causa di un collegamento incompleto dei dati. In base a questi criteri di esclusione (ulteriori dettagli sono forniti nella Fig. 1), è rimasto un campione di 35.132 partecipanti (62,1% di sesso maschile) che comprendeva il campione analitico.
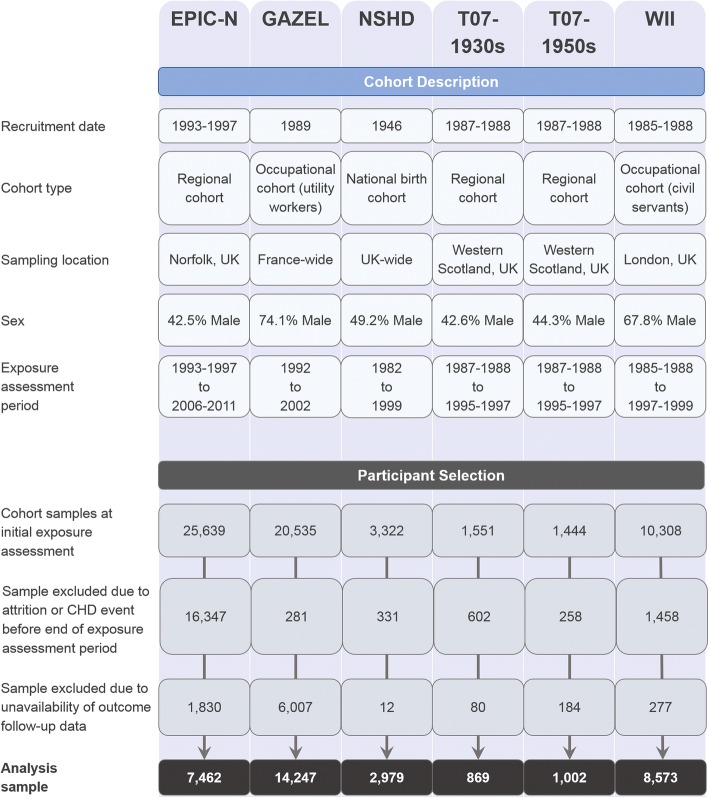
Fig. 1.Fig. 1. Descrizione della coorte e diagramma di flusso della selezione dei partecipanti. CHD Coronary heart disease, EPIC-N European Prospective Investigation of Cancer, Norfolk, GAZEL Gaz et Electricité, T07-1930s West of Scotland Twenty-07 Study 1930s, T07-1950s West of Scotland Twenty-07 Study 1950s, WII Whitehall II
Misure
Risultati
L’endpoint primario era l’incidenza del CHD, come accertato dalle cartelle cliniche collegate e dai dati delle indagini. I dati non fatali del CHD erano disponibili per l’NSHD, ma il tempo di accadimento dalla fine del periodo di esposizione non era verificabile, quindi questo studio è stato omesso dall’analisi dell’endpoint CHD incidente. La mortalità dovuta al CHD è stata esaminata come risultato secondario in analisi supplementari, e tutte le coorti hanno contribuito a questa analisi. Gli eventi di CHD sono stati precedentemente codificati utilizzando il codebook della Classificazione statistica internazionale delle malattie e dei problemi sanitari correlati (ICD)[29]: ICD-9: 410-414 Malattia cardiaca ischemica e ICD-10: I20-I25 Malattie cardiache ischemiche. Per le venti-07 coorti, gli eventi CHD non fatali sono stati identificati utilizzando il libro dei codici del Royal College of General Practitioners [30](codici 1940, 1945 e 1950). Il tempo di sopravvivenza è stato calcolato per tutti i partecipanti come tempo (in anni) tra la fine del periodo di valutazione dell’alcool e la data dell’evento CHD, morte per cause non CHD, abbandono dello studio o data dell’ultimo collegamento dei dati (specifico dello studio), a seconda di quale si è verificato per primo. Ulteriori dettagli sulle procedure di iscrizione allo studio e di follow-up sono disponibili nel file aggiuntivo 1 (sezione S10).
Esposizione
Le traiettorie dell’assunzione di alcolici auto-riferite sono state derivate utilizzando le misurazioni settimanali dell’assunzione di alcolici raccolte attraverso tre ondate consecutive di ogni studio di coorte. Le traiettorie risultanti comprendevano in media un decennio di follow-up. Le definizioni standard delle bevande sono state utilizzate per definire il contenuto di alcol (etanolo) nelle bevande segnalate (mezze pinte di birra o sidro, piccoli bicchieri di vino e singole porzioni di alcolici): 8 g di etanolo nei dati della coorte britannica e 10 g nei dati francesi GAZEL [31, 32]. Il consumo riportato in ogni occasione di misurazione è stato classificato secondo le linee guida britanniche sul consumo al momento della raccolta dei dati, che raccomandavano un livello massimo di assunzione per il consumo a basso rischio di 168 g di etanolo a settimana per i maschi e 112 g di etanolo a settimana per le femmine [33]. Sebbene le linee guida britanniche recentemente pubblicate abbiano proposto soglie identiche per i maschi e le femmine[34], il rapporto analitico su cui si basano ha identificato funzioni di rischio sia per la morbilità che per la mortalità del CHD che differiscono notevolmente tra maschi e femmine[35], in particolare a livelli di consumo più elevati[23]. L’attenzione nel presente studio si è concentrata sulla stabilità nel tempo dell’aderenza alle linee guida per il consumo di alcolici a basso rischio, e di conseguenza abbiamo classificato i partecipanti secondo i profili longitudinali definiti nella Tabella 1. Come categoria di riferimento sono stati utilizzati bevitori costantemente moderati [14]. 2. I bevitori con livelli di assunzione di alcolici incoerenti sono stati definiti in base all’assunzione modale, cioè al livello di assunzione più frequente. Per esempio, quando un partecipante ha avuto un numero uguale di periodi di consumo pesante e moderato, è stato classificato come bevitore pesante in modo incoerente. Questo assicurava che i partecipanti che occasionalmente bevevano pesantemente non fossero raggruppati con partecipanti che aderivano costantemente alle linee guida per il consumo di alcolici a basso rischio.Tabella 1 Definizioni del tipo di bevitore con conteggi e percentuali osservate (all’interno del sesso e nel complesso)Tipo di bevitoreAssunzione settimanale di alcoliciN (%)MaschioFemminileTotaleConsistente non bevitore0 g ad ogni ondata di raccolta dati807 (4.6)1335 (12.4)2142 (7.5)Ex bevitore0 g all’ultima ondata ma assunzione >0 g ad ogni ondata precedente1831 (10.4)2249 (21.0)4080 (14.4)Coerentemente moderatoMaschio: 1-168 g ad ogni onda7249 (41,0)4161 (38,8)11.410 (40,2)Femmina: 1-112 g ad ogni ondaInconsistentemente moderatoMaschio: 1-168 g per la maggior parte ma non per tutte le onde3599 (20,4)2037 (19,0)5636 (19.8)Femmina: 1-112 g per la maggior parte ma non per tutte le ondeConsistentemente pesanteMaschio: >168 g per ogni onda2216 (12,5)349 (3,3)2565 (9.0)Femmina: >112 g ad ogni ondaInconsistentemente pesanteMaschio: >168 g per la maggior parte ma non tutte le onde1979 (11.2)598 (5.6)2577 (9.1)Femmina: >112 g per la maggior parte ma non tutte le onde
Covariates
I fattori di rischio demografico e di stile di vita noti per le malattie cardiovascolari sono stati selezionati per l’inclusione nella modellazione, inclusi sesso ed età. La posizione socioeconomica è stata definita utilizzando lo status professionale del partecipante, classificato come basso (non qualificato o semiqualificato), intermedio (di medio livello) o alto (professionale o dirigenziale) [36]. Lo status di fumatore è stato valutato, con i partecipanti classificati come attuali, ex-fumatori o non fumatori. Per tener conto della variabilità dell’intervallo di valutazione dell’assunzione di alcolici, è stata calcolata la differenza di tempo tra la valutazione iniziale e quella finale per ogni partecipante. Sono stati ottenuti ulteriori dati clinici sul BMI (misurato in kg/m2) e sull’ipertensione arteriosa o sull’uso di farmaci antipertensivi (sì/no). Tutte le covariate sono state valutate all’inizio del periodo di follow-up per il CHD (l’occasione della terza e ultima valutazione alcolica), che abbiamo definito come la linea di base dello studio attuale.
Analisi statistica
Prima di intraprendere le analisi inferenziali, l’imputazione multipla mediante equazioni concatenate è stata completata utilizzando il pacchetto R ‘topi’ (v2.30) per affrontare i dati covariarianti e di esposizione mancanti. Complessivamente, sono state eseguite 100 imputazioni sia per l’analisi incidente che per quella fatale del CHD, garantendo la congruenza tra l’imputazione e i modelli sostanziali. I dati di risultato con il pericolo Nelson-Aalen [37] sono stati utilizzati ma non imputati.
La modellazione è stata eseguita come meta-analisi dei dati dei singoli partecipanti (IPD), tenendo conto del raggruppamento dei partecipanti all’interno di ogni coorte. Sono disponibili sia approcci a uno che a due fasi e possono dare risultati comparabili in condizioni particolari[38]. Tuttavia, l’approccio a uno stadio, in cui tutti i dati sono analizzati simultaneamente con il clustering incorporato come termine di effetto casuale, è ritenuto meno incline a distorsioni nelle stime degli effetti in pool e negli errori standard [39]ed è l’approccio preferito quando sono richiesti aggiustamenti covariariarianti o quando può essere presente un’eterogeneità tra gli studi [40,41]. Di conseguenza, la meta-analisi IPD in un unico passaggio è stata eseguita utilizzando la modellizzazione gerarchica (effetti misti) della regressione di Cox che incorpora un termine di effetto casuale per l’appartenenza a una coorte con stime di massima probabilità. I modelli sono stati sviluppati in modo iterativo: un modello iniziale che tiene conto dell’età, del sesso e dell’intervallo di valutazione dell’assunzione (parzialmente corretto per la confusione), seguito da un modello esteso che includeva anche lo stato del fumo e le covariate dello stato socioeconomico (corretto al massimo per la confusione). La modellazione supplementare ha esteso ulteriormente l’aggiustamento, compresi i potenziali mediatori, per esaminare i percorsi clinici (adattato al massimo per la confusione e la mediazione). I residui di Schoenfeld sono stati tracciati per accertare che l’ipotesi di rischio proporzionale non fosse stata violata (disponibile nel file aggiuntivo 1: sezione S2).
Dato che la maggior parte del lavoro esistente in questo settore ha impiegato singole misure una tantum dell’assunzione di alcool, a fini comparativi, in questo studio è stata intrapresa una prima meta-analisi IPD utilizzando la misurazione finale dell’assunzione dei partecipanti prima del periodo di follow-up dell’esito (cioè alla linea di base di questo studio). Questa singola categorizzazione della misura ha permesso di distinguere tra diversi livelli di assunzione (nessuno, moderato o pesante), ma non la stabilità dell’assunzione nel tempo o l’interruzione del consumo di alcolici. Questa analisi è stata seguita dalla modellizzazione dell’esposizione primaria, la categorizzazione della traiettoria longitudinale del bere. Sono state inoltre completate ulteriori analisi stratificate per esplorare le caratteristiche specifiche del rapporto alcol-CHD. La ricerca ha suggerito che l’associazione dell’alcol con il rischio cardiovascolare può differire tra le popolazioni più anziane e quelle più giovani[42], quindi è stata eseguita anche la modellizzazione stratificata per età della tipologia di bevitore longitudinale (età ≤55 vs >55 anni alla linea di base di questo studio). Ulteriori analisi stratificate sono state intraprese per esplorare gli effetti specifici del sesso. Infine, sono state condotte analisi di sensibilità per determinare l’impatto delle ipotesi di modellizzazione sui principali risultati di questo studio.
Le analisi statistiche sono state eseguite in R (v3.4.1; R Foundation for Statistical Computing, Vienna, Austria). Tutti i test di significatività statistica sono stati effettuati a due code, utilizzando una soglia di inferenza di p<0,05.
Risultati
Caratteristiche del campione
Le statistiche descrittive, per il campione complessivo e stratificate per tipo di bevitore, sono presentate nella tabella 2. Ulteriori statistiche descrittive, stratificate per coorte, sono fornite nel file aggiuntivo 1 (sezione S3). Le statistiche sulla mancanza di dati sono anch’esse riportate nella tabella 2 e ulteriori dettagli sono forniti nel file aggiuntivo 1(sezione S4).Tabella 2Drisultati descrittivi: campione complessivoVariabileLivello variabileLivello di bevanda Tipo di bevitoreOverallConsistente non bevitoreConsistente bevitore moderatoBevitore moderatoConsistente bevitore moderatoConsistente bevitore pesanteBevitore pesanteConsistente bevitore pesanteSconosciutoConteggio record, N2142408011,41056362525652577672235,132Età, Media (SD)58.9 (8,1)61,9 (9,1)59,7 (8,1)57,1 (6,4)58,0 (5,7)57,9 (6,6)58,6 (7,3)59,1 (7,7)Sesso, N (%)Maschio807 (37,7)1831 (44,9)7249 (63,5)3599 (63,9)2216 (86,4)1979 (76.8)4140 (61,6)21.821 (62,1)Femmina1335 (62,3)2249 (55,1)4161 (36,5)2037 (36,1)349 (13,6)598 (23,2)2582 (38,4)13.311 (37,9)Fumatore, N (%)No1351 (63.1)2383 (58,4)6933 (60,8)3124 (55,4)1218 (47,5)1234 (47,9)2280 (33,9)18.523 (52,7)Fumatore corrente321 (15,0)494 (12,1)1008 (8,8)764 (13,6)540 (21,1)473 (18,4)1022 (15,2)4622 (13.2)Ex-fumatore407 (19,0)1129 (27,7)3322 (29,1)1630 (28,9)759 (29,6)825 (32,0)1335 (19,9)9407 (26,8)Sconosciuto63 (2,9)74 (1,8)147 (1,3)118 (2,1)48 (1,9)45 (1,7)2085 (31,0)2580 (7.3)Posizione socioeconomica, N (%)Alta510 (23,8)1353 (33,2)5454 (47,8)2279 (40,4)1178 (45,9)1198 (46,5)2400 (35,7)14.372 (40,9)Intermedia1104 (51,5)1953 (47,9)4924 (43,2)2708 (48,0)1184 (46.2)1158 (44,9)3005 (44,7)16.036 (45,6)Basso512 (23,9)733 (18,0)980 (8,6)612 (10,9)190 (7,4)207 (8,0)1263 (18,8)4497 (12,8)Sconosciuto16 (0,7)41 (1,0)52 (0,5)37 (0,7)13 (0,5)14 (0,5)54 (0.8)227 (0,6)IMC, media (SD)26,2 (4,9)26,3 (4,4)25,6 (3,5)26,0 (3,9)26,1 (3,3)26,2 (3,7)26,5 (4,1)26 (3,9)Alta pressione sanguigna, N (%)No1498 (69,9)2784 (68,2)8409 (73,7)4010 (71,1)1790 (69.8)1759 (68,3)3376 (50,2)23.626 (67,2)Sì641 (29,9)1292 (31,7)2990 (26,2)1620 (28,7)774 (30,2)815 (31,6)1551 (23,1)9683 (27,6)Sconosciuto3 (0,1)4 (0,1)11 (0,1)6 (0,1)1 (~0.0)3 (0,1)1795 (26,7)1823 (5,2)Intervallo di assunzione, media (SD)11,4 (2,6)11,8 (2,4)11,4 (2,2)11,2 (2,4)11,2 (2,4)10,7 (1,7)11,1 (2,3)12,6 (2,8)11,5 (2,4)CHD (tutti) durante il follow-up, N (%)No1803 (84.2)3549 (87,0)10.260 (89,9)4775 (84,7)2375 (92,6)2229 (86,5)4748 (70,6)29.739 (84,6)Sì129 (6,0)250 (6,1)560 (4,9)264 (4,7)98 (3,8)107 (4,2)310 (4,6)1718 (4,9)Sconosciuto210 (9,8)281 (6.9)590 (5,2)597 (10,6)92 (3,6)241 (9,4)1664 (24,8)3675 (10,5)CHD (tutti) gli anni della persona, media (SD)12,7 (4,5)11,0 (4,7)12,4 (4,4)13,8 (3,7)13,9 (3,4)13,5 (3,8)12,1 (4,5)12,6 (4.3)CHD (fatale) durante il follow-up, N (%)No2113 (98,6)4031 (98,8)11.328 (99,3)5593 (99,2)2549 (99,4)2550 (99,0)6630 (98,6)34.794 (99,0)Sì27 (1,3)49 (1,2)78 (0,7)40 (0,7)15 (0,6)25 (1,0)91 (1.4)325 (0,9)Sconosciuto2 (0,1)0 (0,0)4 (~0,0)3 (0,1)1 (~0,0)2 (0,1)1 (~0,0)1 (~0,0)13 (~0,0)CHD (fatale) anni persona, media (SD)13,9 (4,2)11,9 (4,6)13,2 (4,3)14,8 (3,2)14.6 (3,1)14,3 (3,5)13,9 (4,0)13,7 (4,1) Indice di massa corporeaIMC, kg/m2chilogrammo per metro quadro, cardiopatia coronarica CHD, deviazione standard SD, conteggio N
Tra i tipi di bevitori, l’età media variava da 57,1 anni (deviazione standard, SD = 6,4) per i bevitori incoerentemente moderati a 61,9 (SD = 9,1) per gli ex bevitori. I forti bevitori erano più probabilmente maschi (costantemente pesanti 86,4%; incoerentemente pesanti 76,8%), mentre gli astenuti erano più probabilmente femmine (costantemente non bevitori 62,3%; ex bevitori 55,1%). I forti bevitori avevano la percentuale più alta di fumatori che riportavano il fumo passato o attuale (costantemente pesante 50,7%; incoerentemente pesante 50,4%). I bevitori moderati sono stati i più probabili ad avere una posizione socioeconomica elevata (47,8%), seguiti da quelli che hanno bevuto in modo consistente e incoerente (45,9% e 46,5%). Al contrario, i non bevitori costanti hanno avuto la percentuale più alta in una posizione socioeconomica bassa (23,9%). L’IMC mostrava poche variazioni tra i tipi di bevitori (tutti avevano mezzi di 26 kg/m2). L’ipertensione nota era meno comune tra i bevitori costantemente moderati (26,2%) e più comune tra i bevitori incoerenti (31,6%) e gli ex bevitori (31,7%). L’intervallo di valutazione medio coperto dalle traiettorie del bere era simile in tutti i tipi di bevitori (range 10,7-11,8 anni).
Le statistiche sui risultati grezzi sono fornite anche nella tabella 2. Nel campione messo in comune, il 4,9% dei partecipanti ha sperimentato un evento CHD (fatale o non fatale) incidente durante il follow-up. Questo dato è stato il più basso per i bevitori abituali (3,8%) e il più alto per gli ex bevitori (6,1%). Il tempo medio di follow-up è stato di 12,6 anni (SD = 4,3). In totale, sono stati catturati 397.264,4 anni-persona a rischio, con anni-persona medi variabili da 11,0 anni (ex bevitori) a 13,9 anni (bevitori abituali). Il tasso di incidenza complessivo di CHD è stato di 4,3 casi di CHD per 1000 persone-anno.
La percentuale di persone che muoiono a causa di CHD durante il follow-up è stata dello 0,9%. Questo variava a seconda del tipo di bevitore, dallo 0,6% per il gruppo dei bevitori più pesanti all’1,3% tra i non bevitori. Il tempo medio di follow-up è stato di 13,7 anni (SD = 4,1). In combinazione, sono stati catturati 480.124,7 anni-persona per questo risultato, con la media degli anni-persona di nuovo più bassa per gli ex bevitori (11,9 anni) ma più alta per i bevitori incoerentemente moderati (14,8 anni). Il tasso complessivo di CHD mortale è stato di 0,7 casi per 1000 persone-anno.
Categorizzazione della singola misura di assunzione
In una serie di modelli gerarchici di regressione Cox con l’assunzione di alcolici definiti in base a una singola misurazione dell’assunzione appena prima del periodo di follow-up dell’esito, non è stata osservata alcuna differenza percepibile nel rischio di CHD incidente tra bevitori pesanti e moderati. Tuttavia, coloro che non hanno segnalato alcuna assunzione in questo punto di misurazione più recente hanno avuto un aumento del rischio di CHD rispetto a coloro che hanno bevuto, ma lo hanno fatto entro i limiti raccomandati [modello regolato al massimo per confondere: rapporto di pericolo (HR) = 1,26, intervallo di confidenza del 95% (CI) = 1,11-1,43]. Le stime sono illustrate nella Fig. 2 e riportate per intero nel file aggiuntivo 1 (Sezione S5a).Fig. 2Associazione del tipo di bevitore (misurazione della singola assunzione) con CHD incidente (mortale o non mortale) utilizzando la regolazione massima per confondere. Le variabili di aggiustamento comprendono l’età, il sesso (categoria di riferimento: maschio), la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
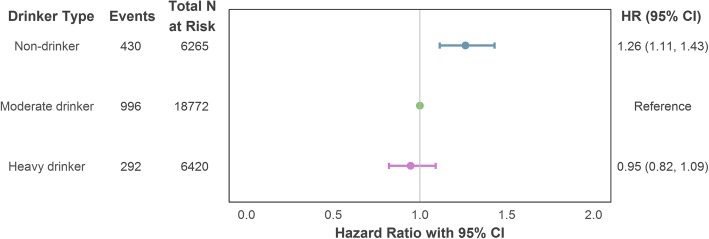
Fig. 2.Associazione del tipo di bevitore (misurazione della singola assunzione) con il CHD incidente (mortale o non mortale) utilizzando la regolazione massima per confondere. Le variabili di aggiustamento comprendono l’età, il sesso (categoria di riferimento: maschio), la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
Traiettorie di aspirazione longitudinali
Quando si modella il rischio complessivo di CHD utilizzando la tipologia di assunzione longitudinale con aggiustamento per età, sesso e intervallo di valutazione dell’assunzione, entrambi i non bevitori coerenti (HR = 1,51, 95% CI = 1.25-1,82) e gli ex bevitori (HR=1,35, 95% CI=1,16-1,57) hanno mostrato un maggiore rischio di CHD incidente rispetto ai partecipanti che hanno riferito un’assunzione persistente e moderata. Un effetto minore ma ancora significativo è stato riscontrato anche per i bevitori incoerentemente moderati (HR = 1,21, 95% CI = 1,04-1,40). Gli effetti sono rimasti statisticamente significativi dopo un ulteriore aggiustamento per lo stato del fumo e la posizione socioeconomica (dettagliati nella Fig. 3). Non sono state riscontrate differenze nel rischio per il bere pesante, coerente o meno.Fig. 3Associazione del tipo di bevitore (misurazione longitudinale dell’assunzione) con CHD incidente (mortale o non mortale) utilizzando l’aggiustamento massimo per confondere. Le variabili di aggiustamento comprendevano l’età, il sesso (categoria di riferimento: maschio), la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
Quando i potenziali mediatori, IMC e ipertensione, sono stati inclusi nella modellazione, gli effetti del tipo di bevitore sono stati attenuati, con l’effetto per i bevitori incoerentemente moderati che sono diventati non significativi (HR = 1,16, 95% CI = 1,00-1,34). I dettagli completi delle fasi di modellazione sono forniti nel file aggiuntivo 1 (sezione S5a), comprese le associazioni di ogni covariata con il rischio di insorgenza di CHD. L’età avanzata, il sesso maschile, l’anamnesi (attuale o passata) del fumo, l’IMC più elevato e l’ipertensione arteriosa sono stati tutti significativamente associati ad un aumento del rischio di CHD.
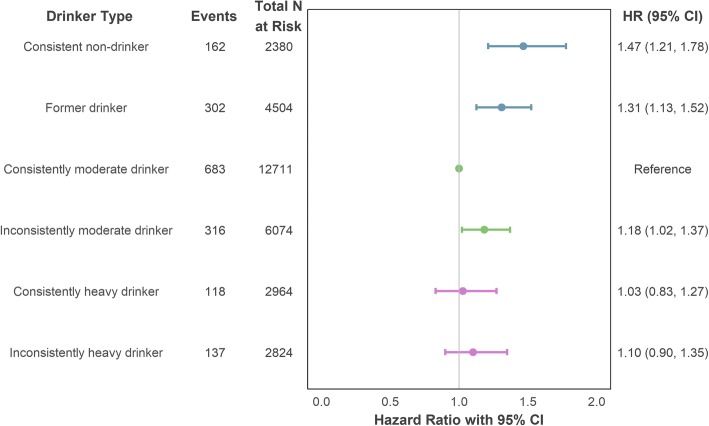
Fig. 3.Fig. 3. Associazione del tipo di bevitore (misurazione dell’assunzione longitudinale) con il CHD incidente (mortale o non mortale) utilizzando la regolazione massima per confondere. Le variabili di aggiustamento comprendevano l’età, il sesso (categoria di riferimento: maschio), la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
Analisi stratificate
Nell’analisi dell’esposizione alla traiettoria longitudinale in base all’età, i partecipanti fino a 55 anni e quelli di età superiore hanno mostrato associazioni comparabili con l’esito del CHD incidente (visualizzato nella Fig. 4). Coerenti non bevitori (di età ≤55: HR=1,97, 95% CI=1,29-3,02; di età >55: HR=1,38, 95% CI=1,11-1,71) ed ex bevitori (di età ≤55: HR=1.60, 95% CI= 1,09-2,37; età > 55 anni: HR= 1,27, 95% CI= 1,08-1,51) entrambi hanno dimostrato un rischio di CHD significativamente maggiore rispetto ai bevitori costantemente moderati. Tuttavia, i bevitori incoerentemente moderati nella fascia d’età più anziana hanno anche avuto un aumento del rischio di CHD incidente (HR = 1,25, 95% CI = 1,06-1,48), un dato non replicato nel sottocampione più giovane. Ulteriori dettagli sono forniti nel file aggiuntivo 1 (Sezione S6a).Fig. 4Age-stratified associazione del tipo di bevitore (misurazione dell’assunzione longitudinale) con il CHD incidente (mortale o non mortale) utilizzando la regolazione massima per confondere. Le variabili di aggiustamento comprendono l’età, il sesso (categoria di riferimento: maschio), la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
Sono state effettuate ulteriori analisi stratificate per valutare se l’associazione alcol-CHD differisce per sesso, sempre utilizzando le categorie di assunzione longitudinale (illustrate nella Fig. 5). Tra i partecipanti maschi, gli ex bevitori erano significativamente più a rischio di CHD incidente rispetto ai bevitori costantemente moderati dopo un adeguamento massimo per i fattori di confusione (HR = 1,29, 95% CI = 1,06-1,56). Dopo un adeguamento equivalente nello strato femminile, sia gli ex bevitori (HR=1,38, 95% CI=1,07-1,78) che i non bevitori costanti (HR=1,91, 95% CI=1,43-2,55) hanno mostrato un rischio maggiore rispetto alle loro controparti costantemente moderate. Una tabella completa dei risultati è fornita nel file aggiuntivo 1 (Sezione S7a).Fig. 5Associazione stratificata del tipo di bevitore (misurazione dell’assunzione longitudinale) con il CHD incidente (mortale o non mortale) utilizzando la massima correzione per confondere. Le variabili di aggiustamento comprendono l’età, la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
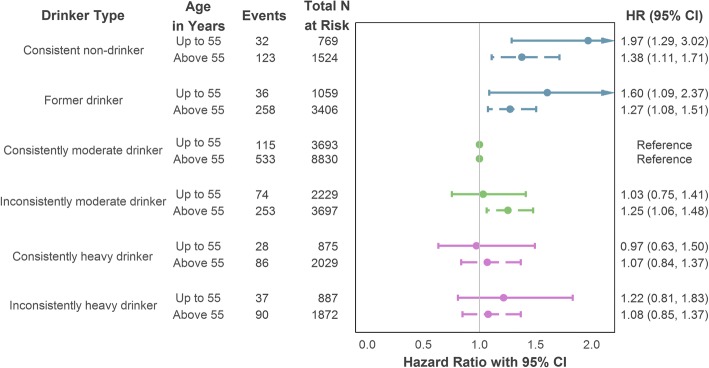
Fig. 4.Fig. 4. Associazione del tipo di bevitore in base all’età (misurazione dell’assunzione longitudinale) con il CHD incidente (mortale o non mortale) con la regolazione massima per confondere. Le variabili di aggiustamento comprendono l’età, il sesso (categoria di riferimento: maschio), la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
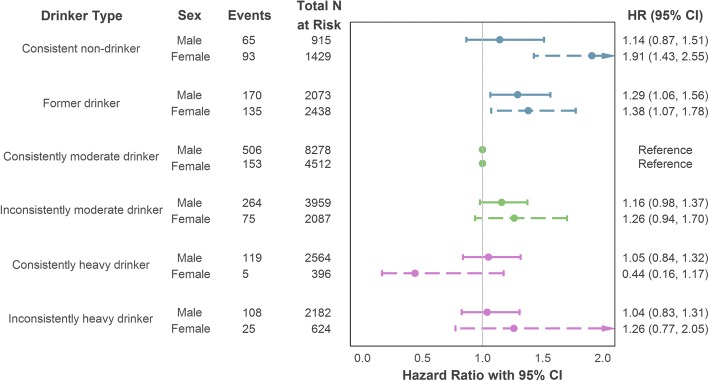
Fig. 5.Fig. 5. Associazione sessuale del tipo di bevitore (misurazione dell’assunzione longitudinale) con il CHD incidente (mortale o non mortale) con la regolazione massima per confondere. Le variabili di aggiustamento comprendono l’età, la posizione socioeconomica (categoria di riferimento: intermedio), lo status di fumatore (categoria di riferimento: non fumatore) e l’intervallo di valutazione dell’assunzione. Cardiopatia coronarica CHD, intervallo di confidenza dell’IC, indice di rischio HR
Mortalità dei CHD
Quando le analisi sono state replicate utilizzando come risultato il CHD fatale, la maggior parte dei risultati sono stati paragonabili a quelli ottenuti utilizzando tutti gli eventi CHD incidenti. Per le traiettorie longitudinali di assunzione, e in contrasto con l’analisi del CHD incidente, i bevitori incoerentemente moderati non avevano un rischio di mortalità per CHD maggiore rispetto al gruppo di riferimento costantemente moderato (HR = 1,04, 95% CI = 0,72-1,52). Solo gli ex bevitori avevano un rischio significativamente elevato di CHD mortale (HR= 1,54, 95% CI= 1,07-2).22) dopo l’aggiustamento massimo per i fattori di confusione, ma l’HR per i non bevitori costanti era quasi identico (HR = 1,52, 95% CI = 0,97-2,38), il che implica che ancora una volta entrambi i tipi di bevitori erano ad alto rischio di CHD mortale. I bevitori incostanti hanno mostrato alcune prove di avere un aumento del rischio di subire un evento CHD mortale nel modello meno regolato (HR= 1,53, 95% CI=0,99-2).37), ma non ha raggiunto la significatività statistica ed è stato attenuato dopo un ulteriore aggiustamento per lo stato del fumo e lo stato socioeconomico (HR=1,36, 95% CI=0,87-2,11). I dettagli completi del modello sono forniti nel file aggiuntivo 1 (sezione S5b).
Le analisi basate sull’età hanno rivelato modelli di associazione simili a quelli dell’analisi in pool (non stratificata). Nelle analisi basate sul sesso, tuttavia, sono state osservate alcune differenze, con solo le donne non bevitrici costanti che hanno un elevato rischio di CHD fatale dopo l’aggiustamento per le covariate (HR = 2,62, 95% CI = 1,25-5,49). Ulteriori dettagli sulle analisi basate sull’età e sul sesso sono inclusi nel file aggiuntivo 1 (sezioni S6b e S7b, rispettivamente).
Analisi di sensibilità
Poiché la coorte GAZEL era l’unica fonte di dati non britannica inclusa in questo studio, la modellazione longitudinale è stata replicata con i dati di questa coorte omessi per verificare che la sua inclusione non introducesse distorsioni. I risultati ottenuti utilizzando solo le fonti di dati del Regno Unito sono rimasti sostanzialmente invariati rispetto ai risultati ottenuti quando tutte le coorti sono state incluse (i dettagli sono forniti nel file aggiuntivo 1: sezione S8). Per identificare l’impatto del modello di imputazione implementato nelle analisi primarie, anche la modellizzazione è stata effettuata utilizzando solo i dati completi dei casi. Le stime puntuali e la significatività degli effetti sono rimaste sostanzialmente invariate rispetto alla modellizzazione dei dati imputati (cfr. file aggiuntivo 1: sezione S9).
Discussione
In questo studio, abbiamo utilizzato dati longitudinali raccolti prospetticamente sul consumo di alcolici di sei coorti per esaminare l’associazione di traiettorie di consumo decennali e il rischio di sviluppare e/o morire di CHD. Attraverso la modellizzazione iterativa che ha rappresentato l’eterogeneità tra i set di dati e i potenziali confonditori dell’associazione alcol-CHD, il nostro lavoro ha dimostrato che il rischio di CHD incidente è significativamente più alto sia tra i non bevitori che tra gli ex bevitori rispetto ai bevitori che hanno sempre aderito alle linee guida di assunzione a basso rischio. Abbiamo anche dimostrato che la stabilità di tale adesione è pertinente. I partecipanti che hanno bevuto per lo più moderatamente, ma non in modo persistente, hanno avuto un rischio maggiore di CHD incidente rispetto ai loro omologhi che bevono in modo costantemente moderato. In termini di mortalità per CHD, gli ex bevitori e i non bevitori costanti sono stati trovati ancora una volta a più alto rischio, anche se l’effetto per i persistenti astenuti è stato in qualche modo attenuato dopo l’adeguamento per lo status di fumatori e lo status socio-economico. Non abbiamo trovato alcuna prova che il bere pesantemente sia stato associato al rischio di CHD, e le ragioni di ciò sono discusse di seguito. Nel complesso, i risultati di questo studio supportano la nozione di un effetto cardioprotettivo dell’assunzione moderata di alcool rispetto al non bere. Tuttavia, in modo cruciale, la stabilità del livello di consumo di alcol nel tempo sembra essere un importante modificatore di questa associazione.
L’uso di misurazioni ripetute del consumo di alcol al posto di una valutazione una tantum ci ha permesso di misurare la stabilità del consumo nel tempo e di rispondere alla richiesta di ricerca sul ruolo delle traiettorie di assunzione nell’insorgenza del CHD[43]. Attraverso questo approccio, abbiamo dimostrato come l’aderenza intermittente alle linee guida per il consumo di alcolici a basso rischio, cioè un’assunzione incoerente e moderata, sia associata ad un aumento del rischio di insorgenza di CHD. Ciò fornisce un certo sostegno alla proposta che la variabilità dei livelli di assunzione di alcol può compensare i potenziali effetti protettivi del bere moderato[2, 20]. È stata trovata un’associazione tra i bevitori incoerenti e il CHD mortale, sebbene l’ampia fiducia limiti e l’indebolimento dell’associazione a seguito di un aggiustamento massimo per fattori confondenti limiti l’interpretazione di questo effetto. Può darsi che i modelli di consumo instabili riflettano i più ampi cambiamenti dello stile di vita in tutto il corso della vita, e forse anche l’impatto di periodi di cattiva salute o di stress della vita. Gli effetti sono stati ulteriormente attenuati quando l’adattamento è stato fatto per le caratteristiche cliniche, vale a dire l’IMC e l’ipertensione, suggerendo che questi possono entrambi agire come potenziali percorsi attraverso i quali le traiettorie instabili del bere sono associate al CHD. L’impatto dell’IMC potrebbe anche riflettere il ruolo di altre scelte di stile di vita, come la dieta e l’esercizio fisico.
L’accesso ai dati sull’assunzione di alcolici registrati prospetticamente in tempi di valutazione multipli ha anche permesso allo studio attuale di distinguere gli astenuti recenti dai non bevitori a lungo termine in un modo che aiuta a ridurre il potenziale di distorsione del richiamo. Tale distorsione può verificarsi quando il comportamento del bevitore viene misurato retrospettivamente in un unico punto temporale[44], una tecnica comunemente usata nella ricerca epidemiologica sull’alcol. In linea con l’ipotesi della cessazione della malattia[14], gli ex bevitori sono stati trovati nel presente studio per avere un elevato rischio di CHD sia incidente che mortale. Questi effetti sono stati attenuati a seguito di un aggiustamento per le covariate cliniche, suggerendo che la cattiva salute può spiegare l’aumento della probabilità di sviluppare il CHD degli ex bevitori e forse può anche aver motivato la decisione di astenersi. I non bevitori costanti, tuttavia, avevano anche un rischio significativo di CHD incidente dopo l’aggiustamento per i potenziali confonditori e, sebbene i limiti di errore fossero più ampi, la loro stima della mortalità per CHD era equivalente a quella degli ex bevitori, il che implica che l’astinenza a breve e a lungo termine è associata a un aumento del rischio di CHD.
Nonostante la nostra scoperta della parità di rischio di CHD tra i non bevitori e gli ex bevitori nelle analisi dei campioni messi in comune, le ricerche precedenti hanno suggerito che ci possono essere differenze dipendenti dall’età in questa associazione. Tuttavia, questa osservazione si basava su studi in cui l’astinenza è stata determinata retrospettivamente da un’unica valutazione di base[42], in contrasto con il disegno delle misure ripetute utilizzato nello studio attuale. Quando abbiamo stratificato il nostro campione per età, le associazioni tra i gruppi di astinenti e il rischio di CHD incidente erano comparabili per i partecipanti più giovani (≤55 anni) e più anziani (>55 anni). Poiché risultati simili sono stati osservati anche per il rischio di CHD mortale, i nostri risultati mettono in discussione l’argomentazione secondo cui esistono differenze dipendenti dall’età tra gli astenuti di lungo periodo e quelli più recenti, ma l’ampia fiducia che circonda le stime del rischio di CHD mortale per le persone di età pari o inferiore a 55 anni limita presumibilmente tali inferenze. Una divergenza tra le fasce d’età è stata riscontrata per i bevitori incoerentemente moderati. Tali bevitori nel sottocampione dei più anziani avevano un rischio significativamente elevato di CHD incidente, un effetto che non era evidente nel gruppo dei più giovani. I partecipanti più anziani potrebbero aver avuto più probabilità di sperimentare cambiamenti di stile di vita che hanno influenzato le loro abitudini di consumo. Il pensionamento, per esempio, è noto che si verifica in concomitanza con l’aumento dell’assunzione di alcolici[45, 46], in particolare tra i bevitori esistenti[47].
È stato anche suggerito che l’associazione a forma di J tra il consumo di alcol e il CHD può essere più pronunciata nelle donne che negli uomini[23], una teoria che il nostro studio sostiene in parte. Mentre sia gli ex bevitori di sesso maschile che quelli di sesso femminile avevano aumentato significativamente il rischio di CHD incidente, solo le donne non bevitrici costanti hanno mostrato un rischio così elevato. Le donne non bevitrici (sia quelle di lungo periodo sia quelle che si sono astenute di recente) erano analogamente a rischio di CHD fatale, anche dopo un aggiustamento massimo per i fattori di confusione. La ricerca ha anche suggerito che l’assunzione di alcol può aumentare i livelli di estrogeni nelle donne, che a loro volta agiscono come fattore protettivo contro il CHD[48]. Anche gli ex bevitori maschi hanno mostrato un rischio significativamente maggiore di mortalità per CHD rispetto ai bevitori costantemente moderati dopo aver tenuto conto dell’età e di altre caratteristiche, ma questa differenza è stata attenuata una volta che le stime sono state rettificate per comportamenti di vita come il fumo. Ciò suggerisce che queste covariate aggiuntive possono giocare un ruolo maggiore rispetto al bere nel verificarsi di eventi di CHD mortali per i maschi. La letteratura precedente ha proposto che il fumo può compensare eventuali differenze nel rischio di mortalità per CHD tra gli uomini dovute all’alcol[49].
Nel presente studio, non è stata trovata alcuna associazione con il rischio di CHD per i consumatori che bevono in modo consistente. Modelli stabili di forte consumo di alcolici pesanti possono riflettere la continuazione di una buona salute durante tutto l’intervallo di valutazione[50], il conversare del tipo malato che smette di bere [50]. Associazioni statisticamente significative tra alti livelli di assunzione di alcol e rischio di insorgenza di CHD sono state osservate in alcune ricerche precedenti[21, 51], ma non in modo persistente[52- 54]. Sebbene il nostro studio abbia identificato i forti bevitori in tutte le coorti, solo un numero limitato era presente nel campione femminile, limitando potenzialmente il potere statistico nella loro analisi e, per estensione, nell’analisi non stratificata. Questo problema dei piccoli conteggi per le donne che bevono pesantemente ha limitato in modo simile il lavoro svolto in precedenza in questo settore[1]. In particolare, i bevitori pesanti possono essere sottorappresentati nei set di dati utilizzati in questo studio, il che potrebbe aver influenzato verso il basso la stima dell’associazione tra l’assunzione di cibi pesanti e il rischio cardiovascolare. Se sono disponibili ulteriori dati, potrebbe essere possibile esplorare soglie di assunzione alternative e convalidare i risultati del presente studio. Allo stesso modo, ulteriori dati potrebbero consentire la disaggregazione dei fenotipi del CHD, che potrebbe fornire indicazioni più sfumate su come il bere pesante sia associato a diverse varianti della malattia[55]. Di conseguenza, l’interpretazione dell’assenza di un effetto tra i forti bevitori nel presente studio dovrebbe essere fatta con cautela, in particolare alla luce del noto più ampio impatto sulla salute dei livelli di assunzione di alcolici pesanti[56].
Ci sono ulteriori limitazioni al nostro studio che meritano di essere prese in considerazione. Ad esempio, può essersi verificato un errore di selezione[57], in cui i partecipanti hanno abbandonato gli studi di coorte prima del periodo di valutazione dei risultati. È possibile che alcuni forti bevitori abbiano avuto esiti negativi sulla salute in età più giovane e abbiano interrotto la loro partecipazione alla ricerca. È già noto che i forti bevitori sono sottocampionati nelle indagini a livello di popolazione[32, 58], per cui è necessaria cautela nel trarre conclusioni su livelli di assunzione così elevati. Allo stesso modo, le informazioni sull’assunzione di alcolici prima del periodo di valutazione dell’esposizione non erano costantemente disponibili, quindi gli astenuti a lungo termine modellati in questo studio attuale possono includere alcuni partecipanti che hanno smesso di bere prima del reclutamento. Dato che il lavoro attuale comprendeva solo studi di coorte per i quali abbiamo avuto accesso a dati a livello individuale, è pertinente anche il concetto di distorsione della disponibilità[59]. L’accesso ad ulteriori set di dati può aiutare a convalidare ulteriormente i nostri risultati. Questo aumento delle dimensioni del campione permetterebbe anche un esame più dettagliato di quanto non sia stato possibile nello studio attuale sulla variazione di assunzione che si verifica tra i bevitori che non sono coerenti nella loro aderenza alle linee guida per il consumo di alcolici a basso rischio. In relazione a ciò, l’identificazione delle traiettorie del bere nel presente studio si è basata solo sul volume del bere e quindi non eravamo attrezzati per guardare al ruolo del bere pesante episodico[60]. Un ulteriore chiarimento dell’associazione alcol-CHD può essere ottenuto quando sono disponibili dati sufficienti su altre caratteristiche di consumo, come la frequenza del consumo. Tutte le coorti incluse nello studio attuale hanno usato l’auto-rapporto per determinare l’assunzione di alcolici; sebbene questo sia vulnerabile agli errori di stima, la ricerca ha dimostrato che i dati sul bere raccolti attraverso questo metodo rimangono validi e affidabili[44, 61]. Un’ulteriore considerazione progettuale nell’interpretazione dei risultati dello studio attuale è l’armonizzazione dei dati tra le diverse serie di dati della coorte. La definizione di definizioni variabili equivalenti nell’armonizzazione dei dati limita il livello di dettaglio e aumenta la possibilità di confusione residua. Ad esempio, non è stato possibile stabilire una variabile di fumo più sfumata a causa della disponibilità di dati e quindi c’è la possibilità di confusione residua a causa dell’intensità del fumo. In relazione a ciò, sebbene per stabilire le traiettorie di assunzione sia stato utilizzato un numero uguale di misurazioni dell’assunzione tra le coorti, gli intervalli di tempo osservati sono variati (vedere la sezione S2 del file aggiuntivo 1). Mentre l’aggiustamento è stato effettuato attraverso l’inclusione della lunghezza dell’intervallo di valutazione nella modellizzazione della regressione, rimane possibile che le limitazioni nell’armonizzazione dei dati della coorte possano aver introdotto distorsioni. Sebbene per calcolare l’assunzione di alcolici siano state utilizzate conversioni di bevande specifiche per ogni paese[31], permangono potenziali differenze tra GAZEL e le altre coorti, come ad esempio la possibile influenza delle differenze alimentari per le quali potrebbe essersi verificata anche una confusione residua[62]. Il paradosso francese, ad esempio, implica che esiste una relazione inversa tra l’assunzione di grassi saturi e il rischio di insorgenza di CHD che è specifica della Francia[63], una relazione in cui l’alcol gioca un ruolo discutibile[64]. Tuttavia, le analisi di sensibilità hanno mostrato che l’esclusione dei dati di GAZEL non ha modificato i risultati dello studio attuale. Inoltre, l’uso, nel corso di questo studio, della modellazione degli effetti misti ha contribuito a rendere conto del raggruppamento dei dati e quindi a migliorare la validità dei risultati ottenuti.
Conclusioni
In sintesi, il presente studio ha utilizzato dati longitudinali sull’assunzione di alcool messi in comune da diverse fonti di coorte per stabilire le traiettorie del comportamento del bere e valutare la loro associazione con il rischio di incidente e di CHD mortale. Lo studio ha dimostrato che gli astenuti recenti e più a lungo termine sono ad alto rischio di sviluppare il CHD, anche se l’effetto per gli astenuti persistenti può essere limitato alle sole donne. L’approccio di traiettoria utilizzato in questo lavoro ci ha anche permesso di dimostrare che la stabilità dei livelli di assunzione di alcol tra coloro che non si astengono è pertinente al rischio di insorgenza del CHD. I bevitori che per lo più, ma in modo incoerente, hanno aderito a livelli di consumo moderati, soprattutto se di età superiore ai 55 anni, sono risultati avere un elevato rischio di insorgenza di CHD. Vi erano anche alcune indicazioni che la variabilità dei livelli di alcol tra i bevitori più pesanti era associata ad una maggiore probabilità di mortalità per CHD, anche se tale effetto è stato attenuato dall’adattamento ad altre caratteristiche demografiche e di stile di vita. Non sono state riscontrate prove di un rischio elevato tra i bevitori abituali di bevande pesanti, ma ciò era potenzialmente attribuibile alla sottorappresentazione di tali bevitori nei dati del campione. Questi risultati, tuttavia, illustrano che le traiettorie longitudinali dell’alcol hanno aggiunto utilità nell’identificazione dei tipi di bevitori a rischio al di là di quanto è possibile con singole valutazioni del consumo di alcol. I nostri risultati forniscono ulteriori informazioni sul potenziale effetto cardioprotettivo di un consumo moderato di alcol e indicano che la coerenza dei livelli di assunzione è una considerazione rilevante nelle valutazioni del rischio cardiovascolare e nei relativi sforzi di educazione sanitaria.
File aggiuntivo
File aggiuntivo 1:Materiale supplementare. (PDF 3002 kb)
References
- Roerecke M, Rehm J. Chronic heavy drinking and ischaemic heart disease: a systematic review and meta-analysis. Open Heart. 2014; 1:e000135. DOI | PubMed
- Ruidavets J-B, Ducimetière P, Evans A, Montaye M, Haas B, Bingham A. Patterns of alcohol consumption and ischaemic heart disease in culturally divergent countries: the prospective epidemiological study of myocardial infarction (PRIME). BMJ. 2010; 341:c6077. DOI | PubMed
- Stockwell T, Chikritzhs T. Commentary: another serious challenge to the hypothesis that moderate drinking is good for health?. Int J Epidemiol. 2013; 42:1792-1794. DOI | PubMed
- Thompson PL. J-curve revisited: cardiovascular benefits of moderate alcohol use cannot be dismissed. Med J Aust. 2013; 198:419-422. DOI | PubMed
- de Gaetano G, Costanzo S. Alcohol and health: Praise of the J curves. J Am Coll Cardiol. 2017; 70:923 LP-923925. DOI | PubMed
- Roerecke M, Kaczorowski J, Tobe SW, Gmel G, Hasan OSM, Rehm J. The effect of a reduction in alcohol consumption on blood pressure: a systematic review and meta-analysis. Lancet Public Health. 2017; 2:e108-e120. DOI | PubMed
- Chen L, Davey Smith G, Harbord RM, Lewis SJ, Smith GD, Harbord RM. Alcohol intake and blood pressure: a systematic review implementing a Mendelian randomization approach. PLoS Med. 2008; 5:0461-0471. DOI
- Cho Y, Shin S-Y, Won S, Relton CL, Davey Smith G, Shin M-J. Alcohol intake and cardiovascular risk factors: a Mendelian randomisation study. Sci Rep. 2015; 5:18422. DOI | PubMed
- Holmes MV, Asselbergs FW, Palmer TM, Drenos F, Lanktree MB, Nelson CP. Mendelian randomization of blood lipids for coronary heart disease. Eur Heart J. 2015; 36:539-550. DOI | PubMed
- Tabara Y, Ueshima H, Takashima N, Hisamatsu T, Fujiyoshi A, Zaid M. Mendelian randomization analysis in three Japanese populations supports a causal role of alcohol consumption in lowering low-density lipid cholesterol levels and particle numbers. Atherosclerosis. 2016; 254:242-248. DOI | PubMed
- Caetano R. Does a little drinking make your heart grow stronger?. J Stud Alcohol Drugs.. 2017; 78:341-343. DOI | PubMed
- Fillmore KM, Kerr WC, Stockwell T, Chikritzhs T, Bostrom A. Moderate alcohol use and reduced mortality risk: systematic error in prospective studies. Addict Res Theory. 2006; 14:101-132. DOI
- Rimm EB, Moats C. Alcohol and coronary heart disease: drinking patterns and mediators of effect. Ann Epidemiol. 2007; 17:S3-S7. DOI
- Rehm J, Irving H, Ye Y, Kerr WC, Bond J, Greenfield TK. Are lifetime abstainers the best control group in alcohol epidemiology? On the stability and validity of reported lifetime abstention. Am J Epidemiol. 2008; 168:866-871. DOI | PubMed
- Roerecke M. On bias in alcohol epidemiology and the search for the perfect study. Addiction. 2017; 112:217-218. DOI | PubMed
- Knott CS, Bell S, Britton A. The stability of baseline-defined categories of alcohol consumption over the adult life course: a 28-year prospective cohort study. Addiction. 2018; 113:34-43. DOI | PubMed
- Britton A, Hardy R, Kuh D, Deanfield J, Charakida M, Bell S. Twenty-year trajectories of alcohol consumption during midlife and atherosclerotic thickening in early old age: findings from two British population cohort studies. BMC Med. 2016; 14:111. DOI | PubMed
- O’Neill D, Britton A, Brunner EJ, Bell S. Twenty-five-year alcohol consumption trajectories and their association with arterial aging: a prospective cohort study. J Am Heart Assoc. 2017; 6:e005288. DOI | PubMed
- Bell S, Mehta G, Moore K, Britton A. Ten-year alcohol consumption typologies and trajectories of C-reactive protein, interleukin-6 and interleukin-1 receptor antagonist over the following 12 years: a prospective cohort study. J Intern Med. 2017; 281:75-85. DOI | PubMed
- Emberson JR, Shaper AG, Wannamethee SG, Morris RW, Whincup PH. Alcohol intake in middle age and risk of cardiovascular disease and mortality: accounting for intake variation over time. Am J Epidemiol. 2005; 161:856-863. DOI | PubMed
- Britton A, Marmot MG, Shipley MJ. How does variability in alcohol consumption over time affect the relationship with mortality and coronary heart disease?. Addiction. 2010; 105:639-645. DOI | PubMed
- Rehm J, Sempos CT, Trevisan M. Average volume of alcohol consumption, patterns of drinking and risk of coronary heart disease – a review. J Cardiovasc Risk. 2003; 10:15-20. DOI | PubMed
- Roerecke M, Rehm J. The cardioprotective association of average alcohol consumption and ischaemic heart disease: a systematic review and meta-analysis. Addiction. 2012; 107:1246-1260. DOI | PubMed
- Day N, Oakes S, Luben R, Khaw K-T, Bingham S, Welch A. EPIC-Norfolk: study design and characteristics of the cohort. Br J Cancer. 1999; 80(Suppl 1):95-103. PubMed
- Kuh D, Pierce M, Adams J, Deanfield J, Ekelund U, Friberg P. Cohort profile: updating the cohort profile for the MRC National Survey of health and development: a new clinic-based data collection for ageing research. Int J Epidemiol. 2011; 40:e1-e9. DOI | PubMed
- Benzeval M, Der G, Ellaway A, Hunt K, Sweeting H, West P. Cohort profile: west of Scotland Twenty-07 study: health in the community. Int J Epidemiol. 2009; 38:1215-1223. DOI | PubMed
- Marmot M, Brunner E. Cohort profile: the Whitehall II study. Int J Epidemiol. 2005; 34:251-256. DOI | PubMed
- Goldberg M, Leclerc A, Zins M. Cohort profile update: The GAZEL cohort study. Int J Epidemiol. 2015; 44:77g. DOI | PubMed
- World Health Organization. The ICD-10 classification of mental and behavioural disorders: clinical descriptions and diagnostic guidelines. World Health Organization: Geneva; 1992.
- The Royal College of General Practitioners. The classification and analysis of general practice data. Occasional paper no. 26. The Royal College of General Practitioners: London; 1986.
- Kalinowski A, Humphreys K. Governmental standard drink definitions and low-risk alcohol consumption guidelines in 37 countries. Addiction. 2016; 111:1293-1298. DOI | PubMed
- Britton A, O’Neill D, Bell S. Underestimating the alcohol content of a glass of wine: the implications for estimates of mortality risk. Alcohol Alcohol. 2016; 51:609-614. DOI | PubMed
- Royal Colleges of Physicians Psychiatrists and General Practitioners. Alcohol and the heart in perspective: Sensible limits reaffirmed. J R Coll Physicians Lond. 1995; 29:266-271. PubMed
- Department of Health. UK chief medical officers’ low risk drinking guidelines. Department of Health: London; 2016.
- Holmes J, Angus C, Buykx P, Ally AK, Stone T, Meier P. Mortality and morbidity risks from alcohol consumption in the UK: analyses using the Sheffield alcohol policy model (v.2.7) to inform the UK chief medical officers’ review of the UK lower risk drinking guidelines. ScHARR, University of Sheffield: Sheffield; 2016.
- Office for National Statistics. Standard occupational classification 2010. Palgrave Macmillan: Basingstoke; 2010.
- White IR, Royston P. Imputing missing covariate values for the cox model. Stat Med. 2009; 28:1982-1998. DOI | PubMed
- Thompson S, Kaptoge S, White I, Wood A, Perry P, Danesh J. Statistical methods for the time-to-event analysis of individual participant data from multiple epidemiological studies. Int J Epidemiol. 2010; 39:1345-1359. DOI | PubMed
- Debray TPA, Moons KGM, van Valkenhoef G, Efthimiou O, Hummel N, Groenwold RHH. Get real in individual participant data (IPD) meta-analysis: a review of the methodology. Res Synth Methods. 2015; 6:293-309. DOI | PubMed
- Thomas D, Radji S, Benedetti A. Systematic review of methods for individual patient data meta-analysis with binary outcomes. BMC Med Res Methodol. 2014; 14:79. DOI | PubMed
- Tierney JF, Vale C, Riley R, Smith CT, Stewart L, Clarke M. Individual participant data (IPD) meta-analyses of randomised controlled trials: guidance on their use. PLoS Med. 2015; 12:e1001855. DOI | PubMed
- Zhao J, Stockwell T, Roemer A, Naimi T, Chikritzhs T. Alcohol consumption and mortality from coronary heart disease: an updated meta-analysis of cohort studies. J Stud Alcohol Drugs.. 2017; 78:375-386. DOI | PubMed
- Maggs JL, Staff J. No benefit of light to moderate drinking for mortality from coronary heart disease when better comparison groups and controls included: a commentary on Zhao et al. (2017). J Stud Alcohol Drugs. 2017; 78:387-388. DOI | PubMed
- Bell S, Britton A. Reliability of a retrospective decade-based life-course alcohol consumption questionnaire administered in later life. Addiction. 2015; 110:1563-1573. DOI | PubMed
- Zins M, Guéguen A, Kivimaki M, Singh-Manoux A, Leclerc A, Vahtera J. Effect of retirement on alcohol consumption: longitudinal evidence from the French GAZEL cohort study. PLoS One. 2011; 6:e26531. DOI | PubMed
- Halonen JI, Stenholm S, Pulakka A, Kawachi I, Aalto V, Pentti J. Trajectories of risky drinking around the time of statutory retirement: a longitudinal latent class analysis. Addiction. 2017; 112:1163-1170. DOI | PubMed
- Wang X, Steier JB, Gallo WT. The effect of retirement on alcohol consumption: results from the US health and retirement study. Eur J Pub Health. 2014; 24:485-489. DOI | PubMed
- Grønbæk M. The positive and negative health effects of alcohol- and the public health implications. J Intern Med. 2009; 265:407-420. DOI | PubMed
- Xu W-H, Zhang X-L, Gao Y-T, Xiang Y-B, Gao L-F, Zheng W. Joint effect of cigarette smoking and alcohol consumption on mortality. Prev Med. 2007; 45:313-319. DOI | PubMed
- Ng Fat L, Cable N, Shelton N. Worsening of health and a cessation or reduction in alcohol consumption to special occasion drinking across three decades of the life course. Alcohol Clin Exp Res. 2015; 39:166-174. DOI | PubMed
- Bobak M, Malyutina S, Horvat P, Pajak A, Tamosiunas A, Kubinova R. Alcohol, drinking pattern and all-cause, cardiovascular and alcohol-related mortality in Eastern Europe. Eur J Epidemiol. 2016; 31:21-30. DOI | PubMed
- Dai J, Mukamal KJ, Krasnow RE, Swan GE, Reed T. Higher usual alcohol consumption was associated with a lower 41-y mortality risk from coronary artery disease in men independent of genetic and common environmental factors: the prospective NHLBI twin study. Am J Clin Nutr. 2015; 102:31-39. DOI | PubMed
- Huang C, Zhan J, Liu Y-J, Li D-J, Wang S-Q, He Q-Q. Association between alcohol consumption and risk of cardiovascular disease and all-cause mortality in patients with hypertension: a meta-analysis of prospective cohort studies. Mayo Clin Proc. 2014; 89:1201-1210. DOI | PubMed
- Bell S, Daskalopoulou M, Rapsomaniki E, George J, Britton A, Bobak M. Association between clinically recorded alcohol consumption and initial presentation of 12 cardiovascular diseases: population based cohort study using linked health records. BMJ. 2017; 356:j909. DOI | PubMed
- Bell S, Hemingway H. Alcohol and cardiovascular disease: Author’s response. BMJ. 2017; 356:j1340. PubMed
- Molina PE, Gardner JD, Souza-smith FM, Annie M, Molina PE, Gardner JD. Alcohol abuse: critical pathophysiological processes and contribution to disease burden. Physiology. 2014; 29:203-215. DOI | PubMed
- Naimi TS, Stockwell T, Zhao J, Xuan Z, Dangardt F, Saitz R. Selection biases in observational studies affect associations between ‘moderate’ alcohol consumption and mortality. Addiction. 2017; 112:207-214. DOI | PubMed
- Britton A, Ben-Shlomo Y, Benzeval M, Kuh D, Bell S. Life course trajectories of alcohol consumption in the United Kingdom using longitudinal data from nine cohort studies. BMC Med. 2015; 13:47. DOI | PubMed
- Riley RD. Commentary: like it and lump it? Meta-analysis using individual participant data. Int J Epidemiol. 2010; 39:1359-1361. DOI | PubMed
- Roerecke M, Greenfield TK, Kerr WC, Bondy S, Cohen J, Rehm J. Heavy drinking occasions in relation to ischaemic heart disease mortality – an 11–22 year follow-up of the 1984 and 1995 US national alcohol surveys. Int J Epidemiol. 2011; 40:1401-1410. DOI | PubMed
- Batty GD, Shipley M, Tabák A, Singh-Manoux A, Brunner E, Britton A. Generalizability of occupational cohort study findings. Epidemiology. 2014; 25:932-933. DOI | PubMed
- Zhang X-Y, Shu L, Si C-J, Yu X-L, Liao D, Gao W. Dietary patterns, alcohol consumption and risk of coronary heart disease in adults: a meta-analysis. Nutrients. 2015; 7:6582-6605. DOI | PubMed
- Chiva-Blanch G, Arranz S, Lamuela-Raventos RM, Estruch R. Effects of wine, alcohol and polyphenols on cardiovascular disease risk factors: evidences from human studies. Alcohol Alcohol. 2013; 48:270-277. DOI | PubMed
- Biagi M, Bertelli AAE. Wine, alcohol and pills: what future for the French paradox?. Life Sci. 2015; 131:19-22. DOI | PubMed
Fonte
O’Neill D, Britton A, Hannah MK, Goldberg M, Kuh D, et al. (2018) Association of longitudinal alcohol consumption trajectories with coronary heart disease: a meta-analysis of six cohort studies using individual participant data. BMC Medicine 16124. https://doi.org/10.1186/s12916-018-1123-6





