Abstract
Background
L’encefalomielite mialgica/sindrome da affaticamento cronico (ME/CFS) è una sindrome clinicamente definita caratterizzata da una stanchezza persistente e invalidante che porta ad una compromissione funzionale. Tra le definizioni di casi che esistevano per la ME/CFS all’epoca di questo studio, i Criteri canadesi[1] sono stati considerati i più completi. Esso definiva la ME/CFS come quattro o più sintomi, ognuno dei quali persisteva o si ripresentava durante 6 o più mesi consecutivi di malattia. Questi sintomi includono: stanchezza continua e inspiegabile, malessere post-esercizio che dura più di 24 ore, e due o più dalla definizione di Manifestazioni Neurologiche/Cognitive (ad esempio, deficit cognitivo o di memoria), e almeno un sintomo da due delle seguenti categorie, vale a dire, autonomico, neuroendocrino, o manifestazioni immunitarie. Anche se la validità di alcuni criteri è contesa, gli studi che utilizzano questa definizione hanno riportato una prevalenza compresa tra lo 0,3 e l’1,8 per cento[2, 3].
L’eziologia di ME/CFS è complessa e poco compresa. Aneddoticamente, la ME/CFS spesso inizia a seguito di un episodio acuto di sintomi “influenzali”, tra cui linfoadenopatia, febbre, malessere, mal di testa e mal di gola. Tali aneddoti sono suggestivi di agenti infettivi, in particolare virus. Storicamente, i “cluster” o “focolai” di ME/CFS sono stati spesso collegati a focolai noti di malattie virali, in particolare la polio nel caso del Royal Free Hospital Group negli anni ’50 , o il virus Epstein-Barr nell’ondata di diagnosi di ME/CFS nel lago Tahoe alla fine degli anni ’80 [4]. Questa ipotesi è stata indagata empiricamente da uno studio prospettico su 256 pazienti con diagnosi di virus di Epstein-Barr, febbre Q o malattia da virus di Ross River, che ha concluso che l’11% della coorte ha sviluppato ME/CFS, con sintomatologia simile, entro 12 mesi dall’infezione [5]. Attualmente esistono associazioni empiriche tra ME/CFS e dieci diversi virus. Si ipotizza che i virus implicati nella patogenesi della fatica cronica condividano due caratteristiche principali: non possono essere completamente eliminati dal sistema immunitario, portando forse alla cronicità dei sintomi, e possono colpire il sistema nervoso centrale, potenzialmente responsabili di disfunzioni autonomiche[6, 7].
È anche importante affrontare la relazione tra la disfunzione immunitaria e il grado di sintomatologia ME/CFS. Purtroppo, la maggior parte delle teorie della patogenesi ME/CFS non sono in grado di spiegare pienamente l’eterogeneità dei sintomi sperimentati, né la gravità di questi sintomi. Questo spesso porta alla visione fuorviante della ME/CFS come disturbo psicogeno perché non è possibile identificare un’eziologia istologica o biochimica sufficiente. La ricerca recente sta identificando sempre più sottogruppi di popolazioni ME/CFS, che sono caratterizzate da disfunzioni in particolari domini, rispetto ad altri pazienti che soddisfano anche i criteri ME/CFS[8, 9].
Il test permanente è utilizzato dai clinici per valutare il grado di intolleranza ortostatica (OI) in una varietà di condizioni, tra cui ME/CFS, e per la valutazione della risposta cardiovascolare[10, 11], così come per lo studio dell’ipotensione ortostatica e della tachicardia[12]. Oltre alla misurazione del tempo, il test della posizione eretta può includere un punteggio soggettivo della difficoltà di stare in piedi, che riflette una serie di sintomi, per esempio la presincope e il dolore.
Le misure della difficoltà di deambulazione o del dolore sono spesso ordinate piuttosto che ad intervalli o a rapporto, a causa della natura soggettiva e individualizzata dell’esperienza misurata, e nei casi in cui il soggetto non può rispondere da solo (per esempio i punteggi clinici sugli animali[13]). Il tempo in piedi attualmente registrato rappresenta una scala a categoria singola con dieci livelli (2-20 min). Esistono scale del dolore ordinali basate su immagini, sviluppate per l’uso con bambini pre-numerati[14].
La ponderazione o la regolazione di una misurazione per un’altra è ben nota nella letteratura sulla qualità della vita, con gli anni di vita corretti per la disabilità[15] e gli anni di vita corretti per la qualità[16], entrambi costruiti prendendo una misurazione quantitativa (anni di vita) e moltiplicandola per un fattore inferiore a uno che rappresenta la gravità della disabilità o la riduzione della qualità. Sono state espresse alcune preoccupazioni sul valore della ponderazione degli anni di vita[17]. Mentre i critici riconoscono che la validità facciale e l’intuizione della ponderazione di un rating per un’importanza, sollevano preoccupazioni circa l’alta correlazione tra rating ponderati e non ponderati, e le complicazioni aggiuntive introdotte dalla moltiplicazione di un rating per un’importanza.
Poiché la distribuzione del tempo in piedi non è stata ampiamente esplorata, è utile indagare sulla distribuzione del tempo in piedi non ponderato in primo luogo. Inoltre, non è ancora noto se la ponderazione del tempo in piedi possa migliorare le proprietà del tempo in piedi non ponderato, in particolare la capacità del test in piedi di delineare tra i livelli di gravità ME/CFS nei pazienti. Il presente studio affronta queste domande.
Metodi
Obiettivo
Lo scopo di questo documento è quello di introdurre il tempo di permanenza ponderato (WST) come proxy della gravità ME/CFS, coinvolgendo una coorte australiana reclutata nella regione di Melbourne. Le questioni affrontate per raggiungere questo obiettivo comprendono la distribuzione del WST per i controlli sani e i pazienti con ME/CFS, la relazione tra WST e i criteri canadesi per la diagnosi ME/CFS, e la relazione tra WST e gli analiti siero/urina raccolti sia per i test patologici richiesti per lo screening e il monitoraggio dei pazienti, sia per i profili delle citochine sieriche.
Coorte di pazienti
I partecipanti sono stati indirizzati o presentati volontariamente alla CFS Discovery Clinic (Donvale, Victoria) tra il 2011 e il 2013. I pazienti sono stati inclusi se hanno soddisfatto i criteri del Canadian Diagnostic ME/CFS[1], e hanno acconsentito all’esame fisico e alla valutazione biochimica. Quarantasette partecipanti consecutivi al ME/CFS sono stati reclutati per lo studio, con due donne volontarie escluse dalla coorte finale a causa del superamento dei criteri di età. Una delle 45 pazienti rimanenti aveva una misurazione del tempo in piedi mancante (min.), che è stata stimata usando l’imputazione mediana, permettendo al partecipante di continuare lo studio. Ci sono stati 17 volontari di controllo reclutati nella stessa area di Melbourne, che erano in generale in buona salute, ma non risiedevano con un paziente attuale, né con una storia familiare ME/CFS. La fascia d’età per i partecipanti al ME/CFS e per i partecipanti al controllo sani era di 18-65 anni, con un rapporto femminile/maschi di circa 4:1.
Inventari
Tutti i partecipanti alla ricerca (ME/CFS e controlli di studio sani) hanno completato un’anamnesi completa, un esame fisico e una valutazione dell’indagine per accertare il loro profilo secondo i Criteri canadesi per la diagnosi ME/CFS. Ciò ha generato 48 variabili binarie tra neurologiche, intestinali, attività immunitaria, dolore e così via, come prescritto dai Criteri di consenso canadesi[1], con ogni criterio valutato come 0 o 1 (assente o presente) dalla valutazione clinica, o dalle risposte al questionario. Questo studio è iniziato poco prima della pubblicazione dei Criteri Internazionali[18]; pertanto, è continuato con la diagnosi dei Criteri Canadesi per la durata del progetto.
Come requisito diagnostico minimo per la ME/CFS, l’attività che limita la fatica deve essere stata presente per almeno 6 mesi e deve essere stata caratterizzata dalla fatica post-esercizio (“payback”). È stato esplorato un profilo completo dei sintomi di criteri aggiuntivi, tra cui la funzione cognitiva e neurologica, la funzione immunitaria, il sonno, la funzione gastrointestinale, il dolore e le risposte autonomiche. I sintomi di screening e i relativi segni fisici di significato sono presentati dal sistema nel file aggiuntivo 1: Tabella S1. Oltre allo screening con criteri canadesi, a tutti i partecipanti è stato chiesto di completare una scala di depressione, ansia e stress (DASS)[19]. Nessun partecipante è stato escluso a causa dei risultati del DASS.
Tempo di permanenza in piedi ponderato
Il protocollo di intolleranza ortostatica CFS Discovery (test in piedi) è descritto in dettaglio altrove[10]. In breve, ai partecipanti è stato richiesto di stare in piedi, senza aiuto, per un massimo di 20 minuti dopo un periodo di riposo necessario per le misurazioni di base (prestanding). Frequenza cardiaca, pressione sanguigna e saturazione di ossigeno sono stati misurati al basale, e successivamente ogni 2 minuti durante lo stare in piedi. I parametri sono stati misurati alla fine del compito (con un limite massimo di 20 minuti, o quando il partecipante non poteva più continuare) e dopo 3 minuti di riposo dopo il completamento del compito. L’infermiera ha anche registrato un punteggio di difficoltà, una misura soggettiva di quanto il paziente ha trovato difficile il test in piedi. E’ stato registrato un punteggio compreso tra 0 e 10 (0= nessuna difficoltà in piedi, 10= supporto richiesto per stare in piedi, presincope). Per questo studio, sono stati aggiunti due ulteriori punteggi, con un punteggio soggettivo di 12 che indicava la difficoltà di stare in piedi al punto che il test in piedi è stato terminato a meno di 20 min (ma superiore a 10 min), e un punteggio di 14 rappresentava la difficoltà più estrema dove la posizione in piedi era possibile solo per 10 min, o meno.
Con la maggior parte della coorte ME/CFS che ha raggiunto un tempo in piedi di 20 minuti, i confronti tra i tempi in piedi per ME/CFS e le coorti di controllo sano non erano informativi. Per ponderare il tempo in piedi in relazione alla difficoltà soggettiva in piedi e produrre una singola variabile di risposta alla fatica, il tempo in piedi (massimo 20 minuti, misurato a intervalli di 2 minuti) e la difficoltà in piedi sono stati combinati per produrre una misura chiamata “Tempo in piedi ponderato” (WST). Il WST (minuti) è stato calcolato con la seguente equazione:\cumentclassedocumentale[12pt]{minimale}usepackage{amsmath}usepackage{wasysym}.
\\x22-Il pacchetto usufruisce di…\x22
\\x22Amssymb\x22…\x22
\x22usepackage \x22amsbsy\x22usepackage\x22mathrsfs \x22usepackage\x22upgreek\x22-oddsidemargin\x22-oddsidemargin\x22-69pt \x22(1 – (Difficolta\x22difficolta\x22/14\x22)) \x22, \x2222(1 – (Testo\x22difficolta\x221\x22) \x22.$$_end{documento}Tempo di permanenza in piedi ponderato (WST)=Tempo di permanenza in piedi (minuti)×(1-(Difficoltà/14)).
Il WST è stato calcolato per ogni partecipante al ME/CFS e al controllo dello studio, e il punteggio WST (minuti) è stato usato successivamente come proxy misurabile della gravità della fatica. Per le analisi statistiche, il WST è stato assegnato come variabile di risposta (dipendente) per il confronto di sangue, urine e citochine.
Analisi statistica
(i) Criteri clinici (canadesi) – L’analisi dei fattori di una matrice di correlazione tetracorica (rotazione varimax) è stata condotta per identificare i fattori clinici significativi in base a questi criteri diagnostici, come rappresentato dalla varianza percentuale spiegata dai fattori di carico. La correlazione tetracorica permette l’analisi di dati contenenti misure categoriali, per esempio “sì” o “no” alla presenza di un sintomo diagnostico secondo i criteri canadesi. L’analisi della varianza è stata utilizzata per determinare la differenza statistica dei punteggi dei fattori nelle classi WST (Tabella 1).Tabella 1Sintomi e relativi segni fisici basati sui Criteri canadesi per la diagnosi ME/CFS, presentati per classe e valutati presso la CFS Discovery ClinicClassi di sintomi secondo i criteri canadesiRuolo nella diagnosi CFS/MESintomi specifici identificati Analisi dei fattori (% di varianza)* ANOVA (valore p)**Malessere e affaticamento post-esperzionaleMalessere, malessere e/o dolore post-sforzo obbligatorioFatigue, malessere e/o dolore post-sforzo≥ 24 ore di recupero Tutti i sintomi sono obbligatori (100%)#Fatica minima di 6 mesiFatica obbligatoria≥ 6 mesi di fatica inspiegabileFaticità inspiegabileSintomo obbligatorio (100%)#Disordine del sonnoObbligatorioDifficoltà adaddormentarsiDormiredurante ilgiorno62% (p<0.0001)DoloreObbligatorioPain(qualsiasi regione)Cefalea87%(p<0,0001)71% (p=0,118)Manifestazioni neurologiche/cognitive≥ 2 criteririchiestiSensibilitàalla luce, ai suoni e/o agliodoriConfusione62% (p<0.0001)38% (p<0.0001)AutonomiaBreathless58%(p<0.0001)Aritmia42% (p<0.0001)Autonomia/neuroendocrina/ manifestazioni immunitarie≥ 1 criterio per 2 delle 3 categorie richiesteGutBloating, dolore addominale, diarrea40% (p<0.0001)NeuroendocrinoCaldo/Freddovampate di calore/freddo73%(p<0.0001)ImmuneTender ghiandole, sintomi simil-influenzali,sensibilitàchimica (allergia)45% (p<0.0001)Identificazione di risposte significative ai criteri diagnostici attraverso l’analisi fattoriale di una matrice di correlazione tetracoricaBasata sui criteri canadesi[1]* Varianza percentuale spiegata, derivata dall’analisi fattoriale della matrice di correlazione tetracorica in tutte le classi di gravità CFS/ME, compresi i controlli sani dello studio** valori p calcolati da ANOVA dei punteggi dei fattori in quattro classi di gravità definite dal tempo di permanenza ponderato (WST)#Nessuno (0%) dei controlli sani ha riportato un minimo di 6 mesi di affaticamento, o di fatica/malessere post-esercizio
Le analisi dei fattori (FA) sono state eseguite utilizzando le librerie psych() e lattice() di R3.3.0[20- 22], applicando il metodo FA descritto da Tabachnick e Fidell [23]. I criteri individuali di “Fatica≥ 6 mesi”, “Attività limitata” e “Rimborso” sono stati omessi dall’analisi dei fattori a causa del 100% dei pazienti e dello 0% dei controlli sani che ne segnalano la presenza. I dettagli dei fattori e dei loro carichi sono inclusi nel file aggiuntivo 1: Tabelle S2-S10.
(ii) Analiti – Per la gamma di marcatori del sangue, delle urine e delle citochine confrontati per i controlli ME/CFS rispetto ai controlli (sani) dello studio, le statistiche descrittive sono state espresse come media (± deviazione standard) per le variabili continue e come proporzioni (%) per le variabili categoriali. Due test campione (Mann-Whitney U) sono stati utilizzati per determinare se il controllo dello studio (sano) e i partecipanti allo studio ME/CFS potevano essere separati statisticamente a p<0,05.
(iii) Scala di gravità WST – Il WST è stato utilizzato per definire tre categorie di gravità per ME/CFS: lieve, moderata e grave. Insieme ai controlli sani dello studio come categoria WST distinta, sono stati applicati test di analisi della varianza (ANOVA) e di follow-up Tukey Highest Significant Difference test per determinare se la significatività statistica (p<0.05) è stata raggiunta per i singoli analiti tra i controlli e i tre livelli di gravità ME/CFS, come definito dal WST (Tabella 2 e file aggiuntivo 1: Tabella S11).Tabella 2Statistiche riassuntive per il tempo in piedi (ST) e il tempo in piedi ponderato (WST) per i gruppi di controllo ME/CFS e per i gruppi di controllo di studio saniCriteri in piedi (mediana)CFS (n= 45) (min) (min)Sano (n=17) (min)p valoreTempo di permanenza (IQR)20 (20-14=6)20 (20-20=0)p=0.0106aWST (IQR)10 (14.29-4=10.29)18.57 (14.29-4=10.29) p<0.0001aaWilcoxon signed rank (WSR) test (p<0.05)
A causa dell’asimmetria dei dati relativi al tempo di permanenza in piedi (ST) e al tempo di permanenza in piedi ponderato (WST), sono stati impiegati test di rango firmati da Wilcoxon per indagare la significatività sia per la mediana ST che per la mediana WST tra i gruppi (Tabella 2). Il test di rango firmato da Wilcoxon, Mann-Whitney U, ANOVA a senso unico e i test di follow-up sono stati condotti utilizzando R 3.3.0 [20].
L’identificazione dei criteri diagnostici che discriminano tra le categorie di ME/CFS è stata effettuata sulla base del fatto che non più di tre dei pazienti sani-malati hanno registrato la presenza del criterio.
Patologia e test delle citochine
Tutte le analisi di siero, sangue e urine dei partecipanti sono state condotte da HealthScope Pathology (ora Australian Clinical Laboratories), Clayton Victoria, Australia. Le proteine attive e le citochine sono state misurate nel siero, come descritto in precedenza[24-26].
Approvazione dell’etica umana
Tutti i partecipanti alla ricerca inclusi in questo studio hanno fornito il consenso pieno e firmato, come dettato dalle linee guida dell’ANU Human Research Ethics Committee (ANU-HREC). Questo studio e i protocolli associati sono stati condotti dopo l’approvazione dell’ANU-HREC (identificazione HREC 2011/031).
Risultati
Il tempo di permanenza e il WST differiscono in modo coerente tra ME/CFS e i controlli di studio
Tutti i 17 controlli sani sono rimasti per 20 minuti, con punteggi di difficoltà che vanno da 0 a 3 (un partecipante al controllo dello studio ha avuto una difficoltà permanente di 8, ma non ha soddisfatto i criteri canadesi per una diagnosi ME/CFS).
Trentuno (31) dei 45 pazienti ME/CFS sono stati 20 minuti, con punteggi di difficoltà che vanno da 1 a 9. I rimanenti 14 erano tra i 2 e i 18 minuti, con punteggi di difficoltà di 12 o 14, a seconda che la posizione in piedi sia stata raggiunta per meno o più di 10 minuti.
Il tempo in piedi ponderato combina il tempo in piedi (ST) con una valutazione soggettiva della difficoltà in piedi. La distribuzione del WST è stata bimodale per i pazienti, suggerendo l’esistenza di gradi moderati e severi di ME/CFS. La distribuzione del WST per i controlli sani è altamente obliqua con quasi nessuna variazione (Fig. 1). I test di rango firmati da Wilcoxon (Tabella 2) hanno mostrato che c’erano differenze significative sia per la ST mediana che per la WST tra ME/CFS e controlli sani.Fig. 1Confronto tra il tempo di stazionamento grezzo, i profili di difficoltà di stazionamento e il tempo di stazionamento ponderato (WST) per ME/CFS e i controlli sani dello studio, come eseguito per la valutazione dell’intolleranza ortostatica. a Tempo di stazionamento (minuti), b difficoltà (scala soggettiva da 0 a 14), e c tempo di stazionamento ponderato (WST) per 45 pazienti CFS e 17 controlli sani dello studio
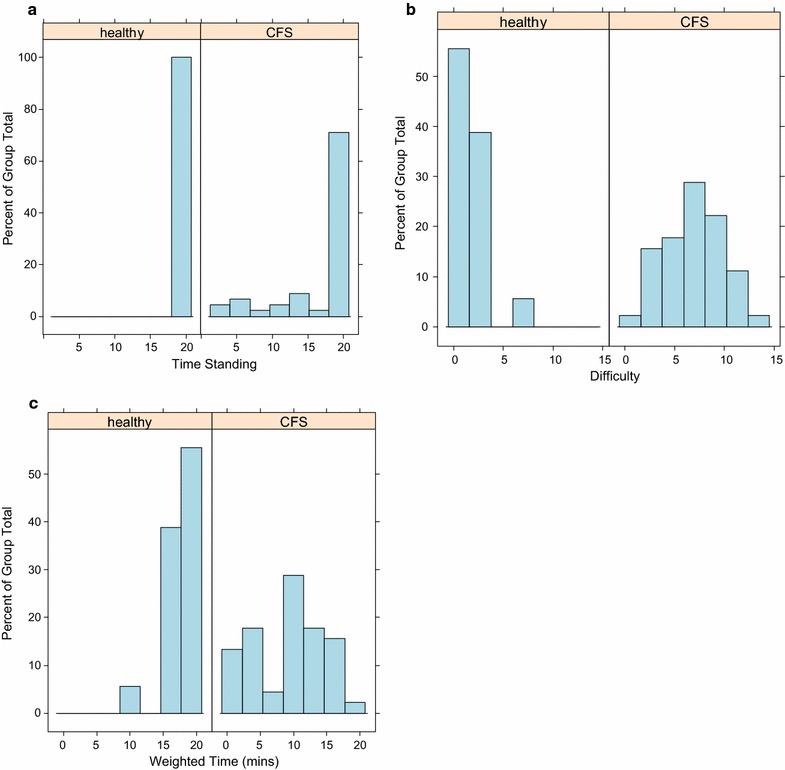
Fig. 1.Confronto tra il tempo di stazionamento grezzo, i profili di difficoltà di stazionamento e il tempo di stazionamento ponderato (WST) per ME/CFS e i controlli di studio sani, come eseguito per la valutazione dell’intolleranza ortostatica. a Tempo di stazionamento (minuti), b difficoltà (scala soggettiva da 0 a 14), e c tempo di stazionamento ponderato (WST) per 45 pazienti CFS e 17 controlli di studio sani
Il WST stratifica la severità ME/CFS
La distribuzione del WST nei pazienti ME/CFS ha portato all’assegnazione di tre classi per stratificare la gravità ME/CFS (mild = 1, moderate = 2, severe = 3) come definito dal WST (min), oltre ad una classe per i controlli di studio (healthy = 0). La valutazione attraverso i criteri canadesi ha determinato l’assegnazione iniziale come controllo di studio sano, o come partecipante ME/CFS (vedi “Metodi”).
Il WST differisce significativamente da classe a classe per le quattro categorie riassunte nella Tabella 3 (F=188.8; df=3, 58; p<0.0001) (e Fig. 2a).Tabella 3Definizioni 3D del tempo ponderato in piedi (minuti WST) controlli di studio sani e classi ME/CFSClassnWST (mins)Definizione della categoriaNo ME/CFS (0)1615.0-20.0Non ha soddisfatto i criteri canadesi. Tutti sono stati 20 minuti con difficoltà che vanno da 0 a 3Mild (1)815.0-20.0Met i criteri canadesi. Tutti sono stati 20 min con difficoltà che vanno da 0 a 3Moderato (2)24a6.0-< 15.0Met i criteri canadesi. Tutti sono stati 20 min con difficoltà che vanno da 4 a 10Severe (3)14<6.0Met i criteri canadesi. Tutti si sono piazzati a 20 min con difficoltà assegnate come 12 o 14Severe caso di difficoltà in piedi ha ottenuto un punteggio di 12 se il partecipante CFS/ME si è piazzato per 10-18 min, e 14 se è stato possibile stare in piedi per meno di (<) 10 minaInclude 1 controllo sano con tempo= 20 min e difficoltà= 8Fig.2Mean (± SEM) sieri, urine e profili di marcatori cellulari come riassunti dal tempo di permanenza ponderato (WST), vale a dire, (a) WST (minuti), (b) 24 ore di volume delle urine (mL/24-h) (c) conteggio totale dei globuli bianchi (WCC) (× 109/L) (d) monociti (× 109/L) (e), linfociti(× 109/L) e (f) siero VitaminaD(nmol/L). Le classi WST sono: Controlli di studio sani (0), ME/CFS-mite (1), ME/CFS-moderato (2), e ME/CFS-severo (3) Le definizioni delle classi WST sono presentate nella Tabella 3
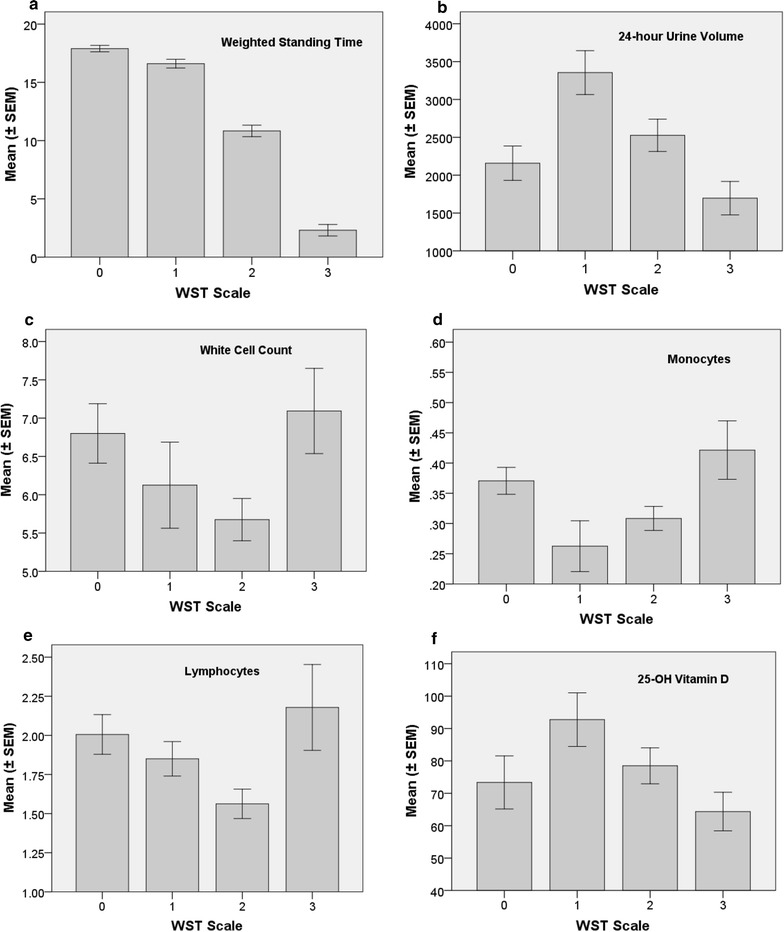
Fig. 2.Siero medio (± SEM), urine e profili dei marcatori cellulari come riassunti dal tempo di permanenza ponderato (WST), vale a dire, (a) WST (minuti), (b) volume delle urine a 24 ore (mL/24-h) (c) conteggio totale dei globuli bianchi (WCC) (× 109/L) (d) monociti (× 109/L) (e), linfociti(× 109/L) e (f) sieroVitamina D (nmol/L). Le classi WST sono: Controlli di studio sani (0), ME/CFS-mite (1), ME/CFS-moderato (2), e ME/CFS-severo (3) Le definizioni delle classi WST sono presentate nella Tabella 3
Il confronto tra ME/CFS e le coorti di partecipanti al controllo degli studi sani ha identificato diversi fattori diagnostici dai criteri di consenso canadesi
I criteri canadesi[1] prevedevano 48 condizioni interrogate in base alla correlazione tetracorica e alla FA; i sintomi che discriminavano i casi dai controlli nel 100% dei casi non erano inclusi. Percentuali significativamente più elevate di partecipanti al ME/CFS hanno costantemente segnalato la presenza di sintomi secondo i Criteri canadesi, ad eccezione della cefalea mensile e dell’emicrania, che non erano significativamente diverse tra le coorti. La fatica inspiegabile per 6 mesi o più (con attività limitata) e il malessere post-esercizio e/o la stanchezza erano obbligatori per una diagnosi ME/CFS positiva; tutti i partecipanti alla ricerca ME/CFS avevano questi sintomi, ma non c’erano controlli di studio sani. Oltre a questi criteri diagnostici obbligatori, sono stati identificati 12 sintomi significativi dei Criteri Canadesi (p<0.0001) attraverso l’analisi dei fattori (Tabella 1: sintomi specifici in corsivo): Disturbi del sonno(Difficoltà ad addormentarsi, dormire durante il giorno), Dolore(qualsiasi regione del corpo, mal di testa), manifestazioni neurologiche (Sensibilità alla luce, al suono, all’umore, confusione), sintomi autonomici (mancanza di respiro, aritmia), sintomi intestinali (gonfiore, dolore addominale, diarrea), regolazione della temperatura(vampate di calore o di freddo) e sintomi immuni(ghiandole teneri, allergia chimica,sensibilità).
In termini di variazione percentuale dei suddetti sintomi spiegata dall’analisi dei fattori, il dolore (qualsiasi regione del corpo) rappresentava l’87%. Anche sotto il fattore dolore, il mal di testa ha spiegato il 71% della variazione dei sintomi, ma non è stato significativamente diverso tra le categorie WST come determinato tramite ANOVA a senso unico (Tabella 1). Anche il sintomo neuroendocrino di una scarsa regolazione della temperatura(vampate di calore o di freddo) è stato notevole, spiegando il 73% della variazione tra le categorie WST, così come i sintomi neurologici/cognitivi della sensibilità alla luce/sonoro/smell al 62%.
Ulteriori dettagli sui parametri e sull’implementazione delle analisi dei fattori (FA) che hanno rilevato i criteri clinici più predittivi sono disponibili nel file aggiuntivo 1: Tabelle S3-S10.
Questi risultati hanno identificato sintomi specifici all’interno dei domini clinici generali applicati secondo i Criteri canadesi e, come tali, hanno semplificato i criteri diagnostici utilizzati per valutare il paziente. Con la fatica inspiegabile e persistente per 6 mesi o più, e la fatica/malessere post-esercizio come sintomi obbligatori, il dolore (ma non il mal di testa) e la scarsa regolazione della temperatura corporea sono stati i principali sintomi ME/CFS identificati dalla coorte CFS Discovery.
I criteri clinici discriminano i livelli di gravità della ME/CFS, definiti dalla WST
Per i criteri canadesi non obbligatori identificati dall’analisi dei fattori (Tabella 4), il 7-57% dei partecipanti ME/CFS moderati e severi ha riferito positivamente, mentre il 13% o meno dei controlli sani ha riferito sintomi all’interno di questi criteri. Pertanto, c’è stato un piccolo grado di sovrapposizione dei sintomi che richiederà un’ulteriore differenziazione nelle indagini future.Tabella 4Percentuale di partecipanti che hanno manifestato sintomi definiti da criteri e non obbligatori per tre livelli di gravità ME/CFS (ordine crescente di occorrenza da coorti sana/mite a coorti gravi) CriterioSalubre/mite % (n=24) Moderata % (n=21) Grave % (n=14) valore p (χ 2 test) Mal di testa mensile014210.0801Migraine01470.1636Malattia giornaliera843280.0282*Sensibile all’odore85252570.0014*Sensibile al tatto1323360.2425Malattia settimanale1329360.217Tutti i casi da lievi a gravi segnalati> Affaticamento di 6 mesi e malessere post sforzo* Significato statistico a p<0,05
Gli analiti non differiscono in modo significativo tra ME/CFS e Study Controls, ad eccezione dell’attivina sierica B
Tra un’ampia gamma di risultati di test di patologia e citochine (file aggiuntivo 1: tabella S2), solo l’attivina sierica B è risultata significativamente diversa (p<0,05) per il confronto diretto tra ME/CFS e i partecipanti al controllo dello studio (sani), come precedentemente riportato [24]. I risultati di patologia sierica e urinaria dei singoli partecipanti rientravano generalmente nell’intervallo di riferimento del laboratorio. Seguono i risultati delle indagini sulla capacità della stratificazione WST di identificare variazioni significative dell’analita a causa della gravità dell’intolleranza ortostatica.
Cinque marcatori di patologia di routine discriminano statisticamente tra i livelli di gravità ME/CFS come definito da WST
L’ANOVA a senso unico ha mostrato differenze statisticamente significative nei valori delle quattro categorie di WST (da controlli sani a ME/CFS severi) per cinque marcatori di patologia di routine, vale a dire:
Volume delle urine (p=0,0009), URINA CREATININA (p=0,0092), monociti (p=0,0129), linfociti (p=0,0250) e conta dei globuli bianchi (p=0,0381). La vitamina D del siero, il TSH, il gap anionico e l’emoglobina non erano significativamente diversi nella scala WST (Fig. 2 e file aggiuntivo: 1).
La figura 2 mostra la media WST (± SEM) per diversi marcatori sierici o urinari, ad esempio la conta dei globuli bianchi e il volume delle urine a 24 ore. Il WST medio è mostrato per i quattro livelli di gravità ME/CFS, per rafforzare il potere discriminatorio del WST. Le differenze significative post-hoc tra i livelli di gravità ME/CFS sono indicate nel file aggiuntivo 1: Tabella S11. I risultati di altri marcatori sierici appaiono nel file aggiuntivo 1: Figura S1 in quanto hanno un’importanza più ampia per lo screening della fatica generale (ad esempio emoglobina, TSH, vitamina D del siero). Indipendentemente dal fatto che siano statisticamente significativi nella scala di gravità WST o meno, i valori individuali e medi sono rimasti all’interno dell’intervallo di riferimento specifico di laboratorio del marcatore per ogni categoria WST.
La figura 3 riassume le concentrazioni sieriche medie associate al WST (± SEM) per le proteine della famiglia delle attivine (Fig. 3a-c). Una differenza statisticamente significativa nei valori medi è stata rilevata per l’attivina B (F = 3,549; df = 3, 57; p = 0,02), ma non per l’attivina A, o per la follistatina proteica legante l’attivina. Interleuchina 10 (IL-10) non variava in modo significativo tra le categorie WST (Fig. 3d), e nemmeno IL-2, IL-4, IL-6 e IFN-γ. TNF e IL-17A sono stati analizzati anche, ma non sono stati rilevati nella maggior parte dei campioni di siero dei partecipanti allo studio (risultati non mostrati).Fig.3Mean (± SEM) concentrazioni sieriche di proteine attivine e una citochina rappresentativa come riassunto dal tempo di permanenza ponderato (WST), vale a dire, (a) l’attivina A (pg / ml), (b) l’attivina B (pg / ml), (c) follistatina (ng / ml), e (d) interleuchina 10 (IL-10) (pg / ml). Le classi WST sono: Controlli di studio sani (0), ME/CFS-mite (1), ME/CFS-moderato (2), e ME/CFS-severo (3) Le definizioni delle classi WST sono presentate nella Tabella 3
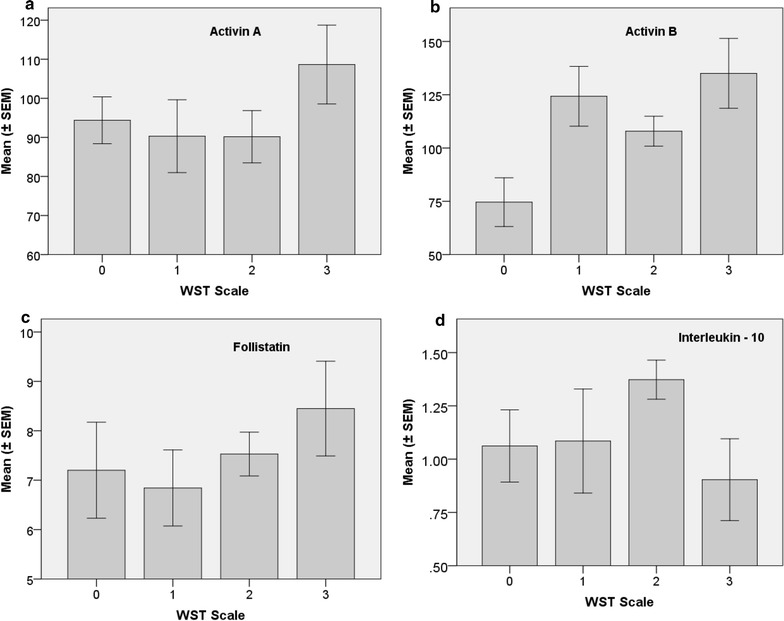
Fig. 3.Concentrazioni sieriche medie (± SEM) di proteine attiviniche e di una citochina rappresentativa, riassunte dal tempo di permanenza ponderato (WST), vale a dire, (a) l’attivina A (pg/mL), (b) l’attivina B (pg/mL), (c) la follistatina (ng/mL), e (d) l’interleuchina 10 (IL-10) (pg/mL). Le classi WST sono: Controlli di studio sani (0), ME/CFS-mite (1), ME/CFS-moderato (2), e ME/CFS-severo (3) Le definizioni delle classi WST sono presentate nella Tabella 3
Discussione
Questo studio consisteva di due gruppi di partecipanti primari: i controlli sani (studio) e i pazienti che soddisfacevano i criteri canadesi per il ME/CFS[1]. Il confronto dei criteri e degli analiti in questi due gruppi ha trovato che nessun marcatore di patologia di routine era significativamente diverso a p<0,05, e non ha trovato alcun modello di risultati anomali per i pazienti ME/CFS quando si applicano gli intervalli di riferimento standard [24, 27]. Il calcolo di un tempo in piedi ponderato (WST), che combinava il tempo in piedi del partecipante (minuti) con un punteggio soggettivo di difficoltà in piedi, misurato come componente delle valutazioni dell’intolleranza ortostatica (OI) da una clinica specializzata ME/CFS con 20 anni di esperienza. Mentre l’OI non è unica per ME/CFS, la presenza di fatica debilitante per 6 mesi, o più a lungo, e la fatica/malessere post-esercizio aumenta la sua rilevanza per ME/CFS.
La scala WST, con tre livelli di gravità ME/CFS, ha permesso di rilevare una variazione significativa (p<0,05) per una serie di marcatori di routine tramite ANOVA a senso unico. Pertanto, questa interpretazione dei dati patologici tramite il profilo di risposta WST fornisce una nuova comprensione di come utilizzare i dati patologici per la diagnosi e il monitoraggio ME/CFS, al di fuori delle tradizionali pratiche di osservazione ad intervalli di riferimento.
Le difficoltà di diagnosticare la ME/CFS e di delinearne la gravità sono riflesse dai venti criteri clinici/consuntivi separati sviluppati nel corso degli anni, con i criteri di Fukuda del 1994 i più popolari nel contesto della ricerca[28, 29]. Questa mancanza di consenso diagnostico può essere attenuata dallo sviluppo di scale misurabili, come la WST, associate a marcatori siero/urina facilmente accessibili che sono richiesti ai dipartimenti di patologia quando si valutano i pazienti per la ME/CFS. Hornig et al.[30] hanno avuto successo a questo proposito, con profili di citochine sieriche che separano le coorti ME/CFS in pazienti a breve o lungo termine. IFN-γ era il marcatore di citochine prominente che separava i pazienti a breve e a lungo termine, con analisi di rete e di partizionamento ricorsivo che descrivevano le relazioni più ampie tra i marcatori immunitari testati, così come l’età. Recenti indagini sui profili delle citochine ME/CFS hanno mostrato una significatività statistica per TGF-β e Resistin rispetto ai controlli sani corrispondenti, così come correlazioni significative di diciassette citochine con la gravità della malattia, di cui tredici sono pro-infiammatorie [31].
I tentativi di stratificare i pazienti ME/CFS in sottocategorie hanno una lunga storia, e gli sforzi passati hanno incluso anche le risposte immunitarie[32], anche nel contesto della privazione del sonno o dell’esercizio fisico[33]. La comorbilità con la sindrome da tachicardia ortostatica posturale (POTS) è stata presa in considerazione anche quando si è cercato di classificare ulteriormente i sintomi ME/CFS, anche in termini di profili neuroumorali ed emodinamici[34]. Secondo Reynolds et al.[10], i pazienti con POTS comorbidi erano significativamente più giovani, e quindi avevano sintomi per un periodo più breve, avevano maggiori difficoltà a stare in piedi e significative variazioni nel funzionamento autonomo. Queste caratteristiche sono state identificate nell’11% di una coorte retrospettiva comprendente 306 pazienti CFS Discovery, simile a quella identificata da uno studio britannico[35].
La carenza di vitamina D è un risultato ben noto per i pazienti legati al letto, come spesso accade nei casi gravi di ME/CFS[36]. L’osservabile, ma statisticamente non significativo calo dei livelli di vitamina D osservato in questo studio come ME / CFS gravità aumenta, suggerisce che la carenza di vitamina D non è un contributore di sintomi ME / CFS, o la gravità, per questa coorte. Allo stesso modo, l’ormone stimolante della tiroide (TSH) non varia in modo significativo tra le categorie WST. Allo stesso modo, l’emoglobina non era significativamente diversa. Al contrario, è stato osservato il cambiamento statisticamente significativo nel volume delle urine 24 ore per i diversi livelli di gravità ME/CFS, coerente con le anomalie in uno studio trasversale più ampio[27]. IL-10 è stato implicato nella patogenesi di ME/CFS[37, 38], ma non ci sono prove da questo studio per una relazione tra i livelli di IL-10 e la presenza/severità dei sintomi di ME/CFS. D’altra parte, Activin B è stato recentemente identificato come significativo quando si separa questa coorte ME/CFS dallo stesso studio (sano) controlli[24], una relazione che è stata anche riflessa dall’analisi WST.
Analisi dei fattori dei sintomi ME / CFS nei bambini[39] ha identificato tre fattori che sono stati successivamente indicati come fenotipi: muscoloscheletrico, emicrania e mal di gola. La nostra ricerca ha identificato un insieme più ampio di fattori, che può essere dovuto alla natura più complessa di ME/CFS negli adulti, o la natura dei criteri utilizzati per valutare ME/CFS in ogni studio. Al di fuori dei 6 mesi obbligatori fatica inspiegabile e malessere post-esercizio, dolore corporeo (non mal di testa) e perturbazioni di regolazione della temperatura ha spiegato 87 e 73%, rispettivamente, di variazione attraverso lo spettro WST da sani a gravi sintomi ME/CFS (per questo studio definito come partecipanti che non erano in grado di stare in piedi per 20 min).
Punti di forza di questo studio sottolineano l’uso innovativo del tempo in piedi e la difficoltà di costruire il WST, e da lì derivano le tre categorie di gravità ME/CFS. La ricchezza del set di dati, le risposte dei Criteri Canadesi e le previsioni associate ai risultati dei test patologici di routine sono anch’esse punti di forza in relazione alla traduzione clinica. Tuttavia, lo studio è limitato dalle dimensioni moderate del campione, che hanno limitato in particolare l’acutezza delle analisi fattoriali a criteri clinici completamente separati. Anche il numero di controlli sani è piccolo. L’analisi non pubblicata di una coorte separata di controlli sani è attualmente incompleta, ma finora conferma i risultati di questo lavoro. Inoltre, la ST viene eseguita una sola volta per paziente, a causa del contesto clinico dei pazienti affaticati e della natura potenzialmente gravosa del test. La ricerca futura può concentrarsi sull’accesso ai dati storici al fine di aumentare le dimensioni del campione, ripetendo i test laddove clinicamente possibile, utilizzando i dati longitudinali sui pazienti nel tempo, o intraprendendo una validazione indipendente con una coorte più ampia in più sedi.
Conclusioni
L’encefalomielite mialgica/sindrome da fatica cronica è una condizione disabilitante ma prevalente, e la sua fisiopatologia è poco conosciuta. Questo studio ha ulteriormente definito i sintomi chiave della sindrome in un campione australiano reclutato nell’area metropolitana di Melbourne, nel Victoria, e ha identificato modelli di analita unici per ME/CFS. Le indagini della patogenesi ME/CFS sono state condotte attraverso l’indagine di dati biochimici, immunologici, ematologici ed endocrini, con il supporto dell’esame clinico e dei dati di indagine dei partecipanti utilizzati.
È importante sottolineare che il WST è una misura utile della gravità della ME/CFS e facile da implementare in ambienti clinici. La sua utilità potrebbe essere ulteriormente migliorata registrando il tempo esatto di permanenza piuttosto che uno arrotondato a 2 min. Un punteggio di difficoltà registrato ogni 2 minuti sarebbe anche una fonte di dati molto ricca, così come una rubrica standard per i medici o i pazienti per registrare le difficoltà. La migliore comprensione del comportamento della ST e della WST di questo studio favorirà un maggiore utilizzo di questo semplice test come componente della valutazione ME/CFS, per la diagnosi e il trattamento futuri.
File aggiuntivo
File aggiuntivo 1. 2. Tabelle e figure aggiuntive.
References
- Carruthers B, Jain A, Meirleir K. Myalgic encephalomyelitis/chronic fatigue syndrome: clinical working case definition, diagnostic and treatment protocols. J Chronic Fatigue Syndr.. 2003; 11:7-116. DOI
- Bates DW, Schmitt W, Buchwald D. Prevalence of fatigue and chronic fatigue syndrome in a primary care practice. Arch Intern Med. 1993; 153:2759-2765. DOI | PubMed
- Wessely S, Chalder T, Hirsch S, Wallace P, Wright D. The prevalence and morbidity of chronic fatigue and chronic fatigue syndrome: a prospective primary care study. Am J Pub Health.. 1997; 87:1449-1455. DOI | PubMed
- Levine PH, Jacobson S, Pocinki AG. Clinical, epidemiologic, and virologic studies in four clusters of the chronic fatigue syndrome. Arch Intern Med. 1992; 152:1611-1616. DOI | PubMed
- Hickie I, Davenport T, Wakefield D. Post-infective and chronic fatigue syndromes precipitated by viral and non-viral pathogens: prospective cohort study. BMJ. 2006; 333(7568):575. DOI | PubMed
- Komaroff AL. Clues to chronic fatigue syndrome. Health News.. 2000; 6:3. PubMed
- Komaroff AL, Cho TA. Role of infection and neurologic dysfunction in chronic fatigue syndrome. Semin Neurol. 2011; 31:325-337. DOI | PubMed
- Stewart JM. Chronic orthostatic intolerance and the postural tachycardia syndrome (POTS). J Pediatr. 2004; 145:725-730. DOI | PubMed
- Raj SR. The postural tachycardia syndrome (POTS): pathophysiology, diagnosis & management. Indian Pacing Electrophysiol J.. 2006; 6:84-99. PubMed
- Reynolds GK, Lewis DP, Richardson AM, Lidbury BA. Comorbidity of postural orthostatic tachycardia syndrome and chronic fatigue syndrome in an Australian cohort. J Intern Med. 2013; 275:409-417. DOI | PubMed
- Hollingsworth KG, Jones DEJ, Taylor R, Blamire AM, Newton JL. Impaired cardiovascular response to standing in chronic fatigue syndrome. Eur J Clin Invest. 2010; 40:608-615. DOI | PubMed
- Streeten DH, Tomas D, Bell DS. The roles of orthostatic hypotension, orthostatic tachycardia and subnormal erythrocyte volume in the pathogenesis of the chronic fatigue syndrome. Am J Med Sci. 2000; 320:1-8. DOI | PubMed
- . Accessed 20 Oct 2017.Publisher Full Text
- Hicks CL, von Baeyer CL, Spafford PA, van Korlaar I, Goodenough B. The Faces Pain Scale—revised: toward a common metric in pediatric pain measurement. Pain. 2001; 93:173-183. DOI | PubMed
- Murray C, Lopez A. The global burden of disease. Harvard University Press: Cambridge; 1996.
- Torrance GW, Feeny D. Utilities and quality-adjusted life years. Int J Tech Assess Health Care.. 1989; 5:559-575. DOI
- Trauer T, Mackinnon A. Why are we weighting? The role of importance weightings in quality of life measurement. Qual Life Res. 2001; 2001(10):579-585. DOI
- Carruthers BM, van de Sande MI, De Meirleir KL. Myalgic encephalomyelitis: international Consensus Criteria. J Intern Med. 2011; 270:327-338. DOI | PubMed
- Lovibond SH, Lovibond PF. Manual for the depression anxiety stress scales. Psychology Foundation: Sydney; 1995.
- . Accessed 20 Oct 2017.Publisher Full Text
- . Accessed 20 Oct 2017.Publisher Full Text
- Sarkar D. Lattice: multivariate data visualization with R. Springer: New York; 2008.
- Tabachnick BG, Fidell LS. Using multivariate statistics. Pearson: Boston; 2013.
- Lidbury BA, Kita B, Lewis DP, Hayward S, Ludlow H, Hedger MP, de Kretser DM. Activin B is a novel biomarker for chronic fatigue syndrome/myalgic encephalomyelitis (ME/CFS) diagnosis: a cross sectional study. J Transl Med.. 2017; 15:60-69. DOI | PubMed
- Knight PG, Muttukrishna S, Groome NP. Development and application of a two-site enzyme immunoassay for the determination of ‘total’ activin-A concentrations in serum and follicular fluid. J Endocrinol. 1996; 148:267-279. DOI | PubMed
- Ludlow H, Phillips DJ, Myers M. A new ‘total’ activin B enzyme-linked immunosorbent assay (ELISA): development and validation for human samples. Clin Endocrinol. 2009; 71:867-873. DOI
- Niblett SH, King KE, Dunstan RH. Hematologic and urinary excretion anomalies in patients with chronic fatigue syndrome. Exp Biol Med. 2007; 232:1041-1049. DOI
- Fukuda K, Straus SE, Hickie I, Sharpe MC, Dobbins JG, Komaroff A. The chronic fatigue syndrome: a comprehensive approach to its definition and study. Ann Intern Med. 1994; 121:953-959. DOI | PubMed
- Brurberg KG, Fønhus MS, Larun L, Flottorp S, Malterud K. Case definitions for chronic fatigue syndrome/myalgic encephalomyelitis (ME/CFS): a systematic review. BMJ Open. 2014; 4:2. DOI
- Hornig M, Montoya JG, Klimas NG. Distinct plasma immune signatures in ME/CFS are present early in the course of illness. Sci Adv.. 2015; 1:e1400121. DOI | PubMed
- Montoya JG, Holmes TH, Anderson JN. Cytokine signature associated with disease severity in chronic fatigue syndrome patients. Proc Natl Acad Sci USA. 2017; 114:E7150-E7158. DOI | PubMed
- Mawle AC, Nisenbaum R, Dobbins JG. Immune responses associated with chronic fatigue syndrome: a case-control study. J Infect Dis. 1997; 175:136-141. DOI | PubMed
- Nakamura T, Schwander S, Donnelly R. Exercise and sleep deprivation do not change cytokine expression levels in patients with chronic fatigue syndrome. Clin Vaccine Immunol. 2013; 20:1736-1742. DOI | PubMed
- Okamoto LE, Raj SR, Peltier A. Neurohumoral and haemodynamic profile in postural tachycardia and chronic fatigue syndromes. Clin Sci. 2012; 122:183-192. DOI | PubMed
- Lewis IPJ, Spickett G, Newton JL. Clinical characteristics of a novel subgroup of chronic fatigue syndrome patients with postural orthostatic tachycardia syndrome. J Intern Med. 2013; 273:501-510. DOI | PubMed
- Blaney GP, Albert PJ, Proal AD. Vitamin D metabolites as clinical markers in autoimmune and chronic disease. Ann N Y Acad Sci. 2009; 1173:384-390. DOI | PubMed
- Brenu EW, van Driel ML, Staines DR, Ashton KJ, Rams SB, Keane J, Klimas NG, Marshall-Gradisnik S. Immunological abnormalities as potential biomarkers in chronic fatigue syndrome/myalgic encephalomyelitis. J Transl Med.. 2011; 9:81. DOI | PubMed
- Tomoda A, Joudoi T, Rabab el-M, Matsumoto T, Park TH, Miike T. Cytokine production and modulation: comparison of patients with chronic fatigue syndrome and normal controls. Psychiatry Res.. 2005; 134:101-104. DOI | PubMed
- May M, Emond A, Crawley E. Phenotypes of chronic fatigue syndrome in children and young people. Arch Dis Child. 2009; 95:245-249. DOI | PubMed
Fonte
Richardson AM, Lewis DP, Kita B, Ludlow H, Groome NP, et al. (2018) Weighting of orthostatic intolerance time measurements with standing difficulty score stratifies ME/CFS symptom severity and analyte detection. Journal of Translational Medicine 1697. https://doi.org/10.1186/s12967-018-1473-z





