Ricerca nel contestoEvidenza prima di questo studioLe cellule senescenti si accumulano nei tessuti con l’invecchiamento e nei siti eziologici in molteplici malattie croniche, compreso il tessuto adiposo nel diabete. Le cellule senescenti possono rilasciare prodotti che causano l’infiammazione e la morte delle cellule non senescenti, il fenotipo secretorio associato alla senescenza (SASP). La somministrazione intermittente della combinazione di farmaci senolitici, Dasatinib più Quercetina (D + Q), che disabilita transitoriamente le vie di sopravvivenza che difendono le cellule senescenti contro il loro ambiente apoptotico, elimina selettivamente le cellule senescenti dalle colture di topo e di cellule umane, dai topi che invecchiano, dai topi con resistenza all’insulina e da molti altri disturbi cronici, e dagli espianti di tessuto adiposo appena isolati da soggetti umani obesi e diabetici. Nel primo studio clinico di senolitici, D + Q ha alleviato la disfunzione fisica in pazienti con fibrosi polmonare idiopatica (IPF), una malattia progressiva, fatale, associata alla senescenza cellulare. In un altro studio clinico, la somministrazione prolungata di D ai pazienti con sclerosi sistemica è sembrata ridurre il SASP e altri marcatori di senescenza nelle biopsie cutanee. Ad oggi, nessun rapporto di studio clinico peer-reviewed ha dimostrato direttamente che la somministrazione di senolitici riduce le cellule senescenti.valore aggiunto di questo studioQui, in uno studio pilota di Fase 1 a marchio aperto, dimostriamo per la prima volta che i farmaci senolitici riducono l’abbondanza di cellule senescenti nell’uomo. Un corso orale di 3 giorni di D + Q in soggetti con malattia renale diabetica (DKD) ha ridotto il carico delle cellule senescenti del tessuto adiposo 11 days in seguito, come indicato dalle diminuzioni delle cellule con marcatori di senescenza: p16INK4A- e p21CIP1-cellule espressive, cellule con attività di β-galattosidasi associata alla senescenza (SAβgal), e progenitori adipocitari con limitato potenziale di replica. Coerente con la diminuzione del carico complessivo delle cellule senescenti negli esseri umani trattati con senolitici, epidermide cutanea p16INK4A- e p21CIP1-cellule di espressione sono stati anche ridotti, così come i fattori chiave SASP, tra cui interleuchina (IL)-1α, IL-6, e MMPs 9 e 12, nel sangue. Così, il trattamento “mordi e fuggi” con agenti senolitici, che nel caso di D + Q hanno semivita di eliminazione di <11 h, è sufficiente per diminuire il carico di cellule senescenti negli esseri umani. In seguito, il carico cellulare senescente rimane basso per giorni o settimane, in linea con il >2 weeks che ci vuole per sviluppare nuove cellule senescenti (almeno nella coltura cellulare).Implicazioni di tutte le prove disponibiliIntervenzioni mirate a processi di invecchiamento fondamentali come la senescenza cellulare potrebbe ritardare, prevenire o alleviare più malattie e disturbi legati all’età come gruppo, invece di uno alla volta, secondo l’ipotesi di Geroscience. Sempre più spesso nei topi, questa ipotesi sembra essere vera. In combinazione con il primo studio clinico di agenti senolitici che mostra che D + Q migliora la funzione fisica nei pazienti con IPF pubblicato all’inizio di quest’anno su questa rivista, il nostro attuale articolo che mostra che D + Q diminuisce effettivamente il carico cellulare senescente negli esseri umani è coerente con la possibilità che l’Ipotesi di Geroscienza possa valere anche per gli esseri umani. Se gli studi clinici nei prossimi anni sosterranno ed estenderanno le nostre scoperte per dimostrare che questi agenti possono alleviare ulteriori disturbi e malattie legate all’età e alla senescenza cellulare (al di là dell’IPF) e ridurre il carico cellulare senescente (al di là del tessuto adiposo e della pelle e come riflesso dalla diminuzione dei fattori SASP nel sangue), i senolitici potrebbero diventare un percorso completamente nuovo per alleviare le malattie croniche attualmente non curabili e migliorare la salute umana: Scatola non etichettata
Prove prima di questo studio
Le cellule senescenti si accumulano nei tessuti con l’invecchiamento e nei siti eziologici in molteplici malattie croniche, compreso il tessuto adiposo nel diabete. Le cellule senescenti possono rilasciare prodotti che causano l’infiammazione e la morte delle cellule non senescenti, il fenotipo secretorio associato alla senescenza (SASP). La somministrazione intermittente della combinazione di farmaci senolitici, Dasatinib più Quercetina (D + Q), che disabilita transitoriamente le vie di sopravvivenza che difendono le cellule senescenti contro il loro ambiente apoptotico, elimina selettivamente le cellule senescenti dalle colture di topo e di cellule umane, dai topi che invecchiano, dai topi con resistenza all’insulina e da molti altri disturbi cronici, e dagli espianti di tessuto adiposo appena isolati da soggetti umani obesi e diabetici. Nel primo studio clinico di senolitici, D + Q ha alleviato la disfunzione fisica in pazienti con fibrosi polmonare idiopatica (IPF), una malattia progressiva, fatale, associata alla senescenza cellulare. In un altro studio clinico, la somministrazione prolungata di D ai pazienti con sclerosi sistemica è sembrata ridurre il SASP e altri marcatori di senescenza nelle biopsie cutanee. A tutt’oggi, nessun rapporto di studio clinico peer-reviewed ha dimostrato direttamente che la somministrazione di senolitici riduce le cellule senescenti.
Valore aggiunto di questo studio
Qui, in uno studio pilota di Fase 1 a marchio aperto, dimostriamo per la prima volta che i farmaci senolitici riducono l’abbondanza di cellule senescenti negli esseri umani. Un corso orale di 3 giorni di D + Q in soggetti con malattia renale diabetica (DKD) ha ridotto il carico delle cellule senescenti del tessuto adiposo 11 days in seguito, come indicato dalle diminuzioni delle cellule con marcatori di senescenza: p16INK4A- e p21CIP1-cellule espressive, cellule con attività di β-galattosidasi associata alla senescenza (SAβgal), e progenitori adipocitari con limitato potenziale di replica. Coerente con la diminuzione del carico complessivo delle cellule senescenti negli esseri umani trattati con senolitici, epidermide cutanea p16INK4A- e p21CIP1-cellule di espressione sono stati anche ridotti, così come i fattori chiave SASP, tra cui interleuchina (IL)-1α, IL-6, e MMPs 9 e 12, nel sangue. Così, il trattamento “mordi e fuggi” con agenti senolitici, che nel caso di D + Q hanno semivita di eliminazione di <11 h, è sufficiente per diminuire il carico di cellule senescenti negli esseri umani. In seguito, il carico cellulare senescente rimane basso per giorni o settimane, in linea con il >2 weeks che ci vuole per sviluppare nuove cellule senescenti (almeno nella coltura cellulare).
Implicazioni di tutte le prove disponibili
Gli interventi mirati ai processi fondamentali dell’invecchiamento, come la senescenza cellulare, potrebbero ritardare, prevenire o alleviare molteplici malattie e disturbi legati all’età come gruppo, invece che uno alla volta, secondo l’Ipotesi di Geroscienza. Sempre più spesso nei topi, questa ipotesi sembra essere vera. In combinazione con il primo studio clinico di agenti senolitici che mostra che D + Q migliora la funzione fisica nei pazienti con IPF pubblicato all’inizio di quest’anno su questa rivista, il nostro attuale articolo che mostra che D + Q diminuisce effettivamente il carico cellulare senescente negli esseri umani è coerente con la possibilità che l’Ipotesi di Geroscienza possa valere anche per gli esseri umani. Se gli studi clinici nei prossimi anni sosterranno ed estenderanno le nostre scoperte per dimostrare che questi agenti possono alleviare ulteriori disturbi e malattie legate all’età e alla senescenza cellulare (al di là dell’IPF) e ridurre il carico cellulare senescente (al di là del tessuto adiposo e della pelle e come riflesso dalla diminuzione dei fattori SASP nel sangue), i senolitici potrebbero diventare un percorso completamente nuovo per alleviare le malattie croniche attualmente non curabili e migliorare la salute umana.
Introduzione
La senescenza cellulare è un destino cellulare che comporta un arresto replicativo essenzialmente irreversibile e che è stato segnalato per la prima volta in cellule umane subcolturate in serie nel 1961[1]. Insulti come il passaggio seriale, il danno al DNA, l’esposizione alle molecole molecolari associate al danno che si accumulano nei tessuti feriti o cronicamente malati e gli insulti metabolici possono causare la senescenza delle cellule[2]. Le cellule senescenti e le cellule presenescenti con un potenziale di replica limitato si accumulano con l’invecchiamento in più tessuti in cui sono legate a cali funzionali, anche nel tessuto adiposo, dove l’abbondanza di progenitori adipociti con capacità proliferativa ridotta aumenta con l’invecchiamento [[3], [ 4], [ 5], [ 6], [ 7], [ 8], [ 9], [ 10], [ 11], [ 12], [ 13], [ 14], [ 15]]]. Anche nei topi più giovani o nei soggetti umani, l’abbondanza di cellule senescenti è aumentata nel tessuto adiposo in condizioni come l’obesità associata a disfunzioni metaboliche e nelle malattie renali croniche [[15], [ 16], [ 17], [ 18], [ 19], [ 20]]]. Infatti, le cellule senescenti si accumulano nei siti eziologici di molteplici malattie croniche in tutta la fascia di età[2,5,[8], [ 9], [9], [ 10],12,16,17,[21], [ 22], [ 23], [ 24], [ 25]]]. Le cellule senescenti sono metabolicamente attive e possono acquisire un fenotipo secretorio associato alla senescenza pro-infiammatoria, distruttiva per i tessuti, proapoptotica (SASP)[26], tale che il trapianto anche di un piccolo numero di topo senescente o di progenitori adipocitari umani o di fibroblasti autologhi senescenti nei topi più giovani può portare a disabilità e malattie locali [27] e sistemiche[28], ma le cellule senescenti stesse sono resistenti all’apoptosi [29].
I senolitici sono farmaci che colpiscono specificamente le cellule senescenti inducendo l’apoptosi delle cellule senescenti ma non quelle non senescenti[30]. Il lavoro che ha portato alla scoperta dei senolitici è stato suggerito da un articolo del 2004 che mostrava che l’aumento delle cellule senescenti legato all’età è ritardato da interventi che aumentano la durata della salute: la restrizione calorica o la carenza di Prop-1 nei topi Ames longevi[31]. Questo ci ha suggerito che gli interventi per ridurre il carico di cellule senescenti potrebbero estendere la durata della vita e alleviare le malattie legate all’età. Da notare che i nostri sforzi per scoprire i senolitici sono iniziati prima e sono progrediti indipendentemente dall’ideazione e dalla realizzazione di topi transgenici dai quali cellule altamente p16Ink4a-espressive, alcune delle quali sono senescenti, possono essere eliminate attivando il prodotto del transgene, un approccio che non è traducibile per gli esseri umani. I senolitici agiscono facilitando l’apoptosi delle cellule senescenti a causa della loro stessa SASP, non mirando direttamente a tutte le cellule che hanno un’alta espressione di p16Ink4a.
Per definizione, il bersaglio dei senolitici sono le cellule senescenti, non una molecola o un singolo percorso biochimico. I primi farmaci senolitici, il Dasatinib (D) e la Quercetina (Q), sono stati scoperti utilizzando un approccio basato su un meccanismo, invece dello screening casuale ad alto rendimento di solito utilizzato per la scoperta del farmaco[32]. Attraverso una strategia bioinformatica che sfruttava i dati proteomici e trascrittomici, abbiamo scoperto reti di percorsi antiapoptotici a cellule senescenti (SCAP) che permettono alle cellule senescenti di sopravvivere nonostante il loro SASP. Abbiamo verificato questo ruolo di queste reti nelle cellule senescenti utilizzando l’interferenza dell’RNA per mostrare che il puntamento dei nodi SCAP, come BCL-xL nel caso delle cellule endoteliali della vena ombelicale umana, uccide le cellule senescenti. Utilizzando la conoscenza a priori dei loro bersagli molecolari e dei meccanismi di azione, D e Q sono stati identificati come potenzialmente senolitici sulla base della loro prevista capacità di disabilitare transitoriamente queste reti SCAP[32]. L’attività senolitica di D e Q è stata verificata per la prima volta in cellule senescenti umane vs. non senescenti. Abbiamo scoperto che diversi tipi di cellule senescenti utilizzano diversi SCAP o anche combinazioni ridondanti di SCAP per eludere l’apoptosi, il che significa che gli agenti che prendono di mira un singolo SCAP dovrebbero solo eliminare un sottoinsieme di cellule senescenti. Infatti, abbiamo scoperto che D, che è stato selezionato in base alle specifiche tirosina chinasi e ad altri elementi chiave SCAP che prende di mira, è senolitico nel caso di progenitori adipocitari umani, come previsto dalle particolari SCAP da cui queste cellule dipendono. Abbiamo trovato che il flavonoide Q, che è stato specificamente selezionato perché si rivolge a membri della famiglia BCL-2 così come HIF-1α e nodi particolari in PI3-chinasi e p21-correlati percorsi anti-apoptotici, è senolitico nel caso di cellule endoteliali umane, sempre come previsto. Q non si rivolge ai progenitori adipociti umani senescenti in modo efficiente e D non si rivolge alle cellule endoteliali umane senescenti. Per estendere la gamma di cellule senescenti bersaglio, in successivi studi in vivo sul topo e nello studio clinico qui riportato, abbiamo utilizzato la combinazione di D + Q.
Perché le cellule senescenti possono richiedere settimane o mesi per svilupparsi e non dividersi, e perché anche eliminando solo il 30% delle cellule senescenti può essere sufficiente per alleviare le disfunzioni negli studi preclinici[3,5,7,7,9,23,24,28, [32], [ 33], [ 34], [ 35], [ 36], [ 37]]], D + Q è efficace nei topi se somministrato a intermittenza, per esempio ogni 2 weeks a un mese, come in modo continuativo, anche se D e Q hanno semivita di eliminazione di soli 4 e 11 h, rispettivamente [38,39]. Ciò è coerente con il punto che, poiché il bersaglio dei senolitici sono le cellule senescenti, questi farmaci non hanno bisogno di essere continuamente presenti nella circolazione allo stesso modo dei farmaci il cui meccanismo d’azione è quello di occupare un recettore, modulare un enzima, o agire su una particolare via biochimica, almeno nei topi. La somministrazione intermittente di D + Q elude efficacemente qualsiasi potenziale effetto fuori obiettivo dovuto all’occupazione continua dei recettori o alla modulazione di un enzima o di una via biochimica.
Sulla base dei molti studi promettenti di D + Q nei topi [3,5,7,7,9,23,24,28,[32],[33], [ 34], [ 35], [ 36], [ 37]], l’esperienza acquisita dall’uso di D nell’uomo per oltre 20 years, e il fatto che Q è un prodotto naturale presente in molti alimenti come le mele, abbiamo avviato studi clinici di questi agenti. La prima sperimentazione clinica di senolitici nell’uomo è stato un breve corso di D + Q per pazienti con IPF, che ha portato a miglioramenti statisticamente significativi nella funzione fisica in 14 soggetti con questa malattia incessantemente progressiva, debilitante, e in ultima analisi fatale senescenza cellulare-driven, come pubblicato nel gennaio 2019 [40]. Sebbene l’attenuazione di questo fenotipo correlato alla senescenza cellulare sia stata dimostrata in quello studio pionieristico in tandem con le tendenze alla diminuzione dei fattori SASP, e altri hanno trovato una diminuzione dei fattori SASP in uno studio di somministrazione continua di D nella pelle di soggetti con sclerosi sistemica[41], finora non c’è stata una dimostrazione diretta della clearance delle cellule senescenti da parte dei farmaci senolitici in studi clinici umani pubblicati e sottoposti a peer-reviewed.
Per verificare se l’intermittenza D + Q è efficace nel mirare alle cellule senescenti negli esseri umani, abbiamo somministrato un singolo corso di 3 day orale D + Q e saggiato l’abbondanza delle cellule senescenti 11 days dopo l’ultima dose nei soggetti con DKD, la causa più comune di insufficienza renale allo stadio finale e che è caratterizzata da un aumento del carico di cellule senescenti [18,[42], [43], [44]]. Abbiamo trovato D + Q allevia la resistenza all’insulina, la proteinuria e la disfunzione renale dei podociti causata dall’obesità indotta dalla dieta ad alto contenuto di grassi o dall’obesità genetica nei topi [23]. Abbiamo anche scoperto che anche il Q da solo può prevenire l’aumento dei marcatori di senescenza, la fibrosi renale, la diminuzione dell’ossigenazione renale e l’aumento della creatinina nei topi, anche se il Q da solo non ha impedito la resistenza all’insulina[20]. Il diabete e le malattie renali croniche (CKD) negli esseri umani rappresentano quindi condizioni che possono beneficiare di D + Q terapia-alleviazione indotta dalla disfunzione dei tessuti e la progressione della malattia, che è in fase di test, come lo studio clinico qui riportato continua. In questo rapporto intermedio dei risultati di tale studio, abbiamo trovato il singolo breve decorso di D + Q attenuare il tessuto adiposo attenuato e il carico cellulare senescente della pelle, diminuire l’accumulo di macrofagi del tessuto adiposo risultante, migliorare il potenziale replicativo dei progenitori adipociti e ridurre i fattori chiave SASP circolanti.
Materiali e metodi
Partecipanti allo studio e amministrazione senolitica
I partecipanti allo studio sono stati maturati da novembre 2016 ad aprile 2019 presso la Mayo Clinic di Rochester, Minnesota. La Tabella 1 mostra le caratteristiche demografiche e cliniche di questi partecipanti. Sono stati inclusi adulti di età compresa tra i 50 e i 17 anni con diabete mellito (in terapia anti diabete) e CKD (tasso di filtrazione glomerulare stimato nell’intervallo 15-45 mL/min/1-73m2). Sono stati esclusi gli individui con prolungamento del QTc (>450 msec), disfunzioni epatiche, malattie renali non diabetiche, dialisi, malignità, infezioni attive, obesità patologica (indice di massa corporea [BMI] >50 kg/m2), trapianto diorgani solidi o assunzione di farmaci noti per interagire con D + Q. Tali farmaci includono quelli con un intervallo terapeutico ristretto che sono substrati per il CYP3A4, CYP2C8, CYP2C9, CYP2D6, CYP2C19, CYP1A2, o OATP1B1 o forti inibitori o induttori del CYP3A4 (ad esempio, ciclosporina, tacrolimus, o sirolimus). È stato ottenuto il consenso informato dei partecipanti allo studio. Il Mayo Clinic Institutional Review Board ha approvato questo studio, che è registrato presso ClinicalTrials.gov(NCT02848131) e che è uno studio clinico in corso per determinare l’efficacia dei senolitici per il ripristino della funzione cellulare, tissutale e clinica nei pazienti con malattia renale cronica diabetica. Un singolo regime di trattamento orale di 3 giorni con D 100 mg al giorno e Q 1000 mg totale giornaliero (500 mg due volte al giorno) è stato somministrato a tutti i partecipanti nei giorni di studio da 1 a 3.Tabella 1Baseline variabili demografiche e cliniche dei partecipanti alla malattia renale diabetica trattati con un singolo corso orale di 3 giorni di D + Q.Tabella 1VariabilePartecipanti trattati con D + Q (N = 9a)Età, anni68-7 (1-0)Sesso maschile7 (77-8%)Razza bianca8 (88-9%)IMC, kg/m233-9 (0-8)eGFR, mL/min/1-73m227-0 (0-7)Diabete Solo terapia di insulina5/9Terapia di abbassamento del glucosio per via orale2/9Terapia di abbassamento del glucosio per via orale2/9Dati rappresentano la media (SEM) o il numero (%).IMC: indice di massa corporea; eGFR: tasso di filtrazione glomerulare stimato.aTessuto adiposo sufficiente per isolare i progenitori adiposi ma non per l’immunoistochimica o l’attività SAβgal o i saggi cutanei era disponibile da altri 2 soggetti (età 70 & 75 years, BMI 31-1 & 29-4 kg/m2, eGFR 38 & 29 mL/min/1-73m2, maschi, bianchi, diabetici, con la sola terapia per l’abbassamento del glucosio).
Campionamento dei tessuti adiposi e della pelle e raccolta del plasma
Per evitare le aree di pelle esposte al sole e per ottenere contemporaneamente il tessuto adiposo sottocutaneo addominale superficiale alla fascia di Scarpa, sono state acquisite biopsie incisionali ellittiche del tessuto adiposo e della pelle attaccata da un punto a destra o a sinistra e 2-5 cm inferiore all’ombelico. Il tessuto adiposo sottocutaneo addominale (0-5-2 g) e la pelle attaccata sono stati raccolti in condizioni sterili attraverso un’incisione 3-5 cm nei giorni di studio 0 e 14. Il sito per la biopsia post-trattamento era controlaterale a quello per la biopsia pretrattamento, con entrambe le biopsie pre- e post-trattamento essendo dello stesso dermatomo. La pelle attaccata alla biopsia del tessuto adiposo è stata tagliata dal tessuto adiposo sottostante. Anche nei giorni di studio 0 e 14, il sangue è stato raccolto. I campioni di sangue sono stati conservati a -80 ° C per le analisi successive.
Immunoistochimica, imaging di biopsie, e il conteggio
Le biopsie dei tessuti adiposi e della pelle sono state fissate in formalina e paraffina. Cinque sezioni μm sono stati posti su vetrini e immunohistochemically stain con CINtec Histology topo monoclonale anti umano p16INK4A( clone E6H4; Roche Tissue Diagnostics, Indianapolis, IN), p21CIP1( DCS-60-2; Cell Marque Tissue Diagnostics, Rocklin, CA), CD68 (clone PG-M1; Dako, Danimarca), e CD1a (Clone MTB1; Novocastra, Leica Biosystems, UK) anticorpi che utilizzano uno strumento VENTANA Discovery ULTRA (Ventana Medical Systems, Oro Valley, AZ) seguendo le istruzioni e utilizzando materiali suggeriti dal produttore. I vetrini per biopsia adiposa dei tessuti e della cute sono stati scannerizzati utilizzando uno scanner per vetrini Motic (Motic Company, Cina) e un obiettivo 40×. Nelle biopsie del tessuto adiposo, le immagini scansionate per p16INK4A e p21CIP1 sono state tagliate (virtualmente) utilizzando Adobe Photoshop (Adobe Inc., San José, CA) per generare campi che erano 400 μm × 300 μm. Trenta campi sono stati selezionati per l’analisi da ogni immagine utilizzando un generatore di numeri casuali. p16INK4A+ e p21CIP1+ celle e adipociti sono stati contati da ImageJ[45,46]. Per i macrofagi, è stato utilizzato un microscopio ottico Olympus BX43 (Olympus, Giappone) con obiettivo 40× per l’immagine di 10 campi casuali, che sono stati contati manualmente per i macrofagi CD68+, strutture simili a corone e gusci di adipociti utilizzando il software AMCounter (Biomedical Imaging Resource, Mayo Clinic, Rochester, MN) [47]. Per le biopsie cutanee, le cellule positive per p16INK4A, p21CIP1 (presenti nello strato basale), CD1a e CD68 sono state contate e divise per la lunghezza totale dell’epidermide (mm) utilizzando ImageJ. Tutte le analisi delle immagini sono state condotte da osservatori che sono stati ciechi se i campioni erano biopsie pre- o post-trattamento.
Saggio di attività della β-galattosidasi associata alla senescenza (SAβgal)
Le biopsie adipose sono state lavate 3 volte con PBS, fissate per 5 min in PBS contenente il 2% (vol/vol) di formaldeide (Sigma-Aldrich, St. Louis, MO) e lo 0-25% di glutaraldeide (Sigma-Aldrich), e lavate con PBS 3 volte. I tessuti sono stati incubati in soluzione di attività SAβgal, pH 6-0, a 37 °C per 16-18 h (durante la notte), lavati, macchiati con tintura Hoechst per 10 min per il conteggio dei nuclei, e conservati in PBS fino ad essere ripresi con un microscopio a fluorescenza (Nikon Eclipse Ti, Giappone). Sono stati ripresi da 10 a 15 campi casuali per campione. Le cellule SAβgal+ sono state determinate in funzione di tutti i nuclei dei campi.
Per testare la consistenza dei saggi di cellule con elevata attività SAβgal tra biopsie del tessuto adiposo, le cellule SAβgal+ sono state quantificate come sopra da biopsie del tessuto adiposo raccolte 15 days a parte 15 donne obese in premenopausa che non assumevano senolitici e che sono state arruolate in uno studio separato approvato dall’IRB (Suppl. Tabella1).
Analisi del fattore SASP del sangue
Le citochine al plasma e le MMP sono state quantificate utilizzando un dosaggio a perle fluorescenti multiplex (Human Cytokine 42-Plex Discovery Assay e Human MMP & TIMP Discovery Assay; Eve Technologies; Calgary, Alberta, Canada).
Saggio di replicazione dei progenitori adipocitari
I progenitori adipocitari, chiamati anche cellule staminali mesenchimali derivate dal tessuto adiposo o preadipociti, sono stati prelevati da campioni di grasso sottocutaneo addominale come descritto in precedenza[48,49]. Le biopsie adipose sono state tritate e digerite nel 2% di collagenasi di tipo I al 2% a 37 °C per 45 min (Gibco, Waltham, MA), filtrate attraverso un filtro cellulare 100 μm (BD Biosciences, San José, CA) per rimuovere i pezzi di tessuto rimanenti, e centrifugate in cellule di pellet. Le cellule sono state coltivate in avanzato minimo indispensabile-medio (Thermo Fisher Scientific, Waltham, MA) integrato con il 5% di lisato piastrinico (PLTMax, Mill Creek Life Sciences, Rochester, MN) e 2 mM l-glutammina (Invitrogen, Carlsbad, CA) in un 37 ° C / 5% di CO2 incubatore per 3-4 days. Quando il 60-80% confluente, le cellule sono state passate utilizzando TrypLE (Trypsin-like enzima, Invitrogen, Invitrogen, Invitrogen, Waltham, MA). Le cellule del terzo passaggio sono state raccolte e conservate in Gibco Cell Culture Freezing Medium (Life Technologies, Carlsbad, CA) a -80 °C. Il cambiamento nel tempo del numero di progenitori adipocitari è stato misurato in 3-4 colture di passaggio utilizzando un composto di tetrazolio (3-[4,5-dimetiltiazol-2-il]-5-[3-carbossimetossifenil]-2-[4-solfofenil]-2H-tetrazolio, sale interno; MTS) test (CellTiter 96 Non-Radioactive Cell Proliferation Assay; Promega, Madison, WI) secondo le istruzioni del produttore.
Metodi statistici
Prima dell’avvio dello studio pilota, sono state determinate le stime delle dimensioni del campione. La stima della dimensione del campione dello studio pilota è stata basata su una dimensione del campione di 9, che ha l’80% di potenza per rilevare una differenza di mezzi del 5% (per il marcatore di senescenza, attività SAβgal), assumendo una deviazione standard delle differenze di 4-0, utilizzando un test t con un livello di significatività di 0-05 su due lati. I dati sono presentati come mean ± SE o valori grezzi (tabelle e testo). Il t-test non accoppiato di Welsh per le variazioni ineguali è stato usato per confrontare il giorno 0 contro il giorno 14. Il livello α per il significato era 0-05. Le analisi sono state condotte utilizzando GraphPad Prism 7-02 (San Diego, CA, USA).
Risultati
Biopsie addominali sottocutanee del tessuto adiposo escissionale sono state acquisite da 9 soggetti(N = 9; età media: 69, range 55-79 years; 7 maschi e 2 femmine) con diabete controllato da farmaci e CKD (Tabella 1)prima e 11 days dopo il completamento di un singolo corso orale di 3 giorni D + Q (D: 100 mg/day, Q: 500 mg due volte al giorno). Nel corso di questo studio non si sono verificati eventi avversi gravi (ad es. ricovero ospedaliero, lesioni renali che richiedevano la dialisi o morte) e nessun soggetto ha richiesto l’interruzione dell’assunzione di farmaci. L’espressione di p16INK4A e p21CIP1 sono state entrambe usate come marcatori di cellule senescenti, così come l’attività di SAβgal [50,51]. D + Q significativamente ridotto (p = 0-001) tessuto adiposo p16INK4A cellule p16INK4A +. I valori grezzi sono stati ridotti del 35%(Fig. 1a). Senolitici significativamente ridotto(p = 0-009) tessuto adiposo p21CIP1 cellule +,con i valori grezzi sono stati ridotti del 17% (Fig. 1b). D + Q anche ridotto (p = 0-005) cellule SAβgal+; i valori grezzi sono stati ridotti del 62% (Fig. 1c). Per escludere la possibilità che le cellule SAβgal+ possano essere state indotte nella seconda biopsia a causa di un trauma della prima, abbiamo saggiato le biopsie del tessuto adiposo ottenute 15 days oltre alle donne con obesità che non sono state trattate con senolitici. SAβgal + conta delle cellule SAβgal + erano simili nelle due biopsie (Suppl. Tabella 1), il che implica che i cali osservati nelle cellule SAβgal + dopo il trattamento con senolitici non erano dovuti ad un artefatto causato da un campionamento seriale.Fig. 1D + Q diminuisce le cellule senescenti del tessuto adiposo umano. (a). D + Q significativamente ridotto (p = 0-001) addominale sottocutaneo tessuto adiposo sottocutaneo p16INK4A + cellule. I valori grezzi sono stati ridotti del 35% in sezioni di tessuto adiposo biopsiato al 14° giorno (11 days dopo l’ultima dose di un corso di 3 giorni dei senolitici) rispetto al basale (giorno 0). Al giorno 0, ci sono stati 3-18 ± 0-64 p16INK4A+ cellule/100 adipociti( significa ± SEM in 30 campi [400 × 300 μm] a 40× ingrandimento). Mezzi, errori standard e deviazioni standard sono mostrati in queste trame “box and whisker”. L’asse y mostra le cellule p16INK4A+ nelle 2 biopsie di ogni soggetto ai giorni 0 e 14 come % l’una dell’altra (unità arbitrarie). N = 9 soggetti; Welch non accoppiato 2-coda t-test di Welch per le variazioni ineguali. Sono mostrate immagini rappresentative ai giorni 0 e 14. (b). D + Q significativamente ridotto (p = 0-009) tessuto adiposo p21CIP1 cellule p21CIP1 +. I valori grezzi sono stati ridotti del 17% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), ci sono stati 3-82 ± 0-65 p21CIP1 + cellule/100 adipociti(N soggetti= 9; significa± SEM). Sono mostrate immagini rappresentative. (c). D + Q significativamente ridotto (p = 0-005) tessuto adiposo SA-βgal-cellule di espressione. I valori grezzi sono stati ridotti del 62% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), ci sono stati 8-76 ± 2-51 cellule SAβgal + cellule/100 nuclei (N = 9 soggetti; mean ± SEM). Sono mostrate immagini rappresentative. Scala bars = 100 μm. Sono indicati i valori esatti di p. I colori indicano i valori di ogni individuo nei giorni 0 e 14.Fig. 1
È stato dimostrato che le cellule senescenti attraggono, attivano e ancorano i macrofagi nel tessuto adiposo, quindi la rimozione delle cellule senescenti dovrebbe essere associata ad un calo dell’abbondanza dei macrofagi[23]. Per testare questo nell’uomo, le cellule CD68+ sono state contate nelle biopsie del tessuto adiposo prima rispetto a 11 days dopo il completamento del trattamento D + Q (Fig. 2a). Ci sono stati meno CD68+ macrofagi dopo il trattamento(p = 0-0001). D + Q ha abbassato il numero grezzo di macrofagi per adipocito del 28%. Le cellule senescenti e i macrofagi contribuiscono alla formazione delle “strutture a corona” (CLS) che sono caratteristiche del tessuto adiposo nel diabete e nell’obesità [52]. Abbiamo riferito che ci sono diminuiti i numeri di CLS indipendentemente da eventuali cambiamenti nel peso corporeo o l’assunzione di cibo a seguito di un trattamento intermittente senolitico di topi obesi indotti dalla dieta, così come in risposta alla clearance genetica delle cellule p16Ink4a +[23]. Coerente con le diminuzioni di carico delle cellule senescenti e accoppiato diminuzioni di macrofagi del tessuto adiposo da esseri umani con diabete e CKD riportato qui, abbiamo trovato che D + Q diminuisce significativamente CLS nel tessuto adiposo sottocutaneo addominale (p = 0-001). Il numero grezzo di CLS per adipocito è diminuito dell’86%(Fig. 2b).Fig. 2D + Q diminuisce i macrofagi del tessuto adiposo umano e le strutture simili a corone. (a). D + Q ha ridotto significativamente (p = 0-0001) il tessuto adiposo CD68+ macrofagi del tessuto adiposo rispetto agli adipociti. I numeri grezzi sono stati ridotti del 28% da 11 days dopo aver completato il trattamento D + Q. Al basale, ci sono stati 8-4 ± 0-58 CD68 + macrofagi CD68 +/100 adipociti (N = 9 soggetti;mean ± SEM). Sono mostrate immagini rappresentative ai giorni 0 e 14. (b). D + Q ha ridotto significativamente (p = 0-001) le strutture coronali del tessuto adiposo. I valori grezzi sono stati ridotti di 11 days dopo il trattamento D + Q. Al basale (Giorno 0), ci sono stati 0-27 ± 0-05 CD68+ strutture coronali/100 adipociti (N soggetti= 9;mean ± SEM). Sono mostrate immagini rappresentative. Scala bars = 100 μm. Sono indicati i valori esatti di p. I colori indicano i valori di ogni individuo nei giorni 0 e 14.Fig. 2
Le cellule senescenti e presenescenti hanno rispettivamente un potenziale di replica nullo o limitato, con il risultato che l’aumento della popolazione raddoppia i tempi di accumulo delle cellule senescenti e presenescenti nelle colture in serie[1,53]. Ciò è parallelo al ridotto potenziale di replica osservato nei tipi di cellule primarie, compresi i fibroblasti della pelle e i progenitori adipocitari, isolati da topi, ratti o esseri umani più anziani, rispetto alle cellule isolate da individui più giovani[4,14,54]. Per determinare se l’esaurimento dei progenitori adiposi senescenti ha contribuito (al di là di qualsiasi ruolo potenziale dei macrofagi che esprimono p16INK4A+ e SAβgal) alle diminuzioni di p16INK4A+e SAβcellule gal-espressive nel tessuto adiposo dopo il trattamento senolitico, abbiamo analizzato il potenziale replicativo dei progenitori adipociti primari isolati dalle biopsie del tessuto adiposo dei 9 soggetti più altri 2 soggetti (dai quali il grasso era disponibile per queste analisi ma non l’immunoistochimica; Tabella 1). I progenitori adipociti sono stati prima coltivati in condizioni che escludono i macrofagi per 3 passaggi [[55], [56], [57]]]. In seguito alla somministrazione di D + Q ai soggetti, l’aumento del numero di progenitori adipociti primari nel tempo nelle colture derivate dalle loro biopsie di grasso sottocutaneo addominale è stato maggiore rispetto alle colture di base isolate dalle biopsie prima del trattamento, coerentemente con gli effetti della rimozione delle cellule senescenti e presenescenti (Fig.3).Fig. 3 Gli aumenti della densità delle cellule progenitrici adipocitarie nel tempo sono aumentati in seguito alla somministrazione di D + Q, in linea con la rimozione di cellule con un limitato potenziale di replica (cellule senescenti e presenescenti). Densità cellulare / tempo è stato saggiato da assorbimento tetrazolio in progenitori adipocitari isolati da biopsie adipose acquisite prima (Giorno 0) e 14 days dopo la prima dose del corso di 3 giorni di D + Q (Giorno 14) e coltivato in parallelo per 3 passaggi. Aumenti della densità cellulare / tempo in progenitori adipociti isolati dopo il trattamento senolitico sono stati l’8% maggiore rispetto ai progenitori adipociti isolati prima del trattamento(N = 11 soggetti; Tabella 1) . Il valore esatto di p è indicato. I colori indicano i valori di ogni individuo nei giorni 0 e 14.Fig. 3
Per verificare se D + Q riduce il carico cellulare senescente nei tessuti oltre al tessuto adiposo nei soggetti con diabete e CKD, abbiamo analizzato lo strato epidermico della pelle che sovrasta il tessuto adiposo sottocutaneo addominale prelevato prima e dopo il trattamento senolitico. Simile al tessuto adiposo, p16INK4A + e p21CIP1 + cellule nell’epidermide sono diminuite dopo il trattamento(p = 0-026 e p = 0-016 , rispettivamente). Le cellule p16INK4A+ in funzione della lunghezza epidermica erano il 20% meno abbondanti 11 days dopo aver completato 3 days del trattamento con D + Q rispetto alla linea di base (Fig. 4a) e le cellule p21CIP1+ erano il31% meno abbondanti (Fig. 4b). Per quanto riguarda le cellule immunitarie epidermiche, le cellule di Langerhans, che sono le cellule residenti macrofagiche che presentano l’antigene nell’epidermide ed esprimono il CD1a[58], il CD1a non è diminuito significativamente dopo il trattamento D + Q (p = .8; Fig. 4c). I macrofagi residenti che esprimono il CD68 non sono stati riportati nell’epidermide. Coerentemente con questo, pur essendo presenti nel derma, le cellule che esprimono CD68 non erano rilevabili nell’epidermide né prima né dopo il trattamento D + Q (N soggetti= 9; 18 biopsie; scansione dell’epidermide per tutta la sua lunghezza con un obiettivo 40×). Così, la diminuzione delle cellule epidermiche p16INK4A+ dopo il trattamento D + Q non è facilmente spiegabile con una diminuzione di CD68+;p16INK4A+macrofagi o nelle relative cellule di Langerhans.Fig. 4D + Q diminuisce le cellule epidermiche umane senescenti. (a). D + Q significativamente ridotto (p = 0-026) epidermico umano strato basale epidermico p16INK4A cellule umane. I valori grezzi sono stati ridotti del 20% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), ci sono stati 1-95 ± 0-63 p16INK4A + cellule p16INK4A + / mm di epidermide(N soggetti= 9;mean ± SEM). Sono mostrate immagini rappresentative ai giorni 0 e 14. (b). D + Q significativamente ridotto (p = 0-016) strato basale epidermico umano p21CIP1 cellule epidermiche. I valori grezzi sono stati ridotti del 31% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), c’erano 1-71 ± 0-31 p21CIP1+ cellule/mm di epidermide(mean ± SEM ). Sono mostrate immagini rappresentative. (c). D + Q non ha sostanzialmente cambiato (p = .803) antigene-presente CD1a + cellule immunitarie Langerhans epidermiche. Al basale (Giorno 0), ci sono stati 14-55 ± 2-16 CD1a + cellule CD1a + / mm di epidermide(mean ± SEM; N = 9). Scala bars = 100 μm. Sono indicati i valori esatti di p. I colori indicano i valori di ogni individuo nei giorni 0 e 14.Fig. 4
Abbiamo testato se i fattori chiave SASP circolanti sono stati diminuiti dal breve decorso dei senolitici. Plasma IL-1α, -2, -6, and - 9 e Matrice Metalloproteinasi (MMP)-2, -9, and -12 erano significativamente più bassi 11 days dopo la 3 days di D + Q (Fig.5) e IL1-RA, Fibroblast Growth Factor (FGF)-2, e Granulocyte Macrophage Colony-Stimulating Factor (GM-CSF) tendevano ad essere più bassi (tutti p = 0-06). Abbondanza di tessuto adiposo p16INK4A cellule p16INK4A + (rispetto agli adipociti) correlato in modo significativo con il plasma IL-6, IL-9, IL-1α, IL1-RA, MMP12, MMP9, e MMP-2 (R2 = 0-34 *, 0-25*, 0-56***, 0-24*, 0-51**, 0-36** e 0-25*, rispettivamente; * p < 0-05, ** p < 0-005, e ***p < 0-001). Questi dati sui fattori SASP circolanti sono coerenti con una diminuzione sistemica dell’abbondanza di cellule senescenti che è rimasta apparente ben oltre i 4 a 11 h eliminazione delle mezze vite di D + Q.Fig. 5D + Q diminuisce i fattori SASP plasmatici. I fattori SASP plasmatici sono stati analizzati al basale (giorno 0) e dopo il trattamento (giorno 14). I fattori chiave di SASP che sono stati significativamente diminuiti(p < 0-05) dopo il trattamento sono mostrati. I colori indicano i valori di ogni individuo nei giorni 0 e 14.Fig. 5

Fig. 1.D + Q diminuisce le cellule senescenti del tessuto adiposo umano. (a). D + Q significativamente ridotto (p = 0-001) addominale sottocutaneo tessuto adiposo sottocutaneo p16INK4A + cellule. I valori grezzi sono stati ridotti del 35% in sezioni di tessuto adiposo biopsiato al 14° giorno (11 days dopo l’ultima dose di un corso di 3 giorni dei senolitici) rispetto al basale (giorno 0). Al giorno 0, ci sono stati 3-18 ± 0-64 p16INK4A+ cellule/100 adipociti( significa ± SEM in 30 campi [400 × 300 μm] a 40× ingrandimento). Mezzi, errori standard e deviazioni standard sono mostrati in queste trame “box and whisker”. L’asse y mostra le cellule p16INK4A+ nelle 2 biopsie di ogni soggetto ai giorni 0 e 14 come % l’una dell’altra (unità arbitrarie). N = 9 soggetti; Welch non accoppiato 2-coda t-test di Welch per le variazioni ineguali. Sono mostrate immagini rappresentative ai giorni 0 e 14. (b). D + Q significativamente ridotto (p = 0-009) tessuto adiposo p21CIP1 cellule p21CIP1 +. I valori grezzi sono stati ridotti del 17% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), ci sono stati 3-82 ± 0-65 p21CIP1 + cellule/100 adipociti(N soggetti= 9; significa± SEM). Sono mostrate immagini rappresentative. (c). D + Q significativamente ridotto (p = 0-005) tessuto adiposo SA-βgal-cellule di espressione. I valori grezzi sono stati ridotti del 62% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), ci sono stati 8-76 ± 2-51 cellule SAβgal + cellule/100 nuclei (N = 9 soggetti; mean ± SEM). Sono mostrate immagini rappresentative. Scala bars = 100 μm. Sono indicati i valori esatti di p. I colori indicano i valori di ogni individuo nei giorni 0 e 14.

Fig. 2.D + Q diminuisce i macrofagi del tessuto adiposo umano e le strutture simili a corone. (a). D + Q ha ridotto significativamente (p = 0-0001) il tessuto adiposo CD68+ macrofagi del tessuto adiposo rispetto agli adipociti. I numeri grezzi sono stati ridotti del 28% da 11 days dopo aver completato il trattamento D + Q. Al basale, ci sono stati 8-4 ± 0-58 CD68 + macrofagi CD68 +/100 adipociti (N = 9 soggetti;mean ± SEM). Sono mostrate immagini rappresentative ai giorni 0 e 14. (b). D + Q ha ridotto significativamente (p = 0-001) le strutture coronali del tessuto adiposo. I valori grezzi sono stati ridotti di 11 days dopo il trattamento D + Q. Al basale (Giorno 0), ci sono stati 0-27 ± 0-05 CD68+ strutture coronali/100 adipociti (N soggetti= 9;mean ± SEM). Sono mostrate immagini rappresentative. Scala bars = 100 μm. Sono indicati i valori esatti di p. I colori indicano i valori di ogni individuo nei giorni 0 e 14.
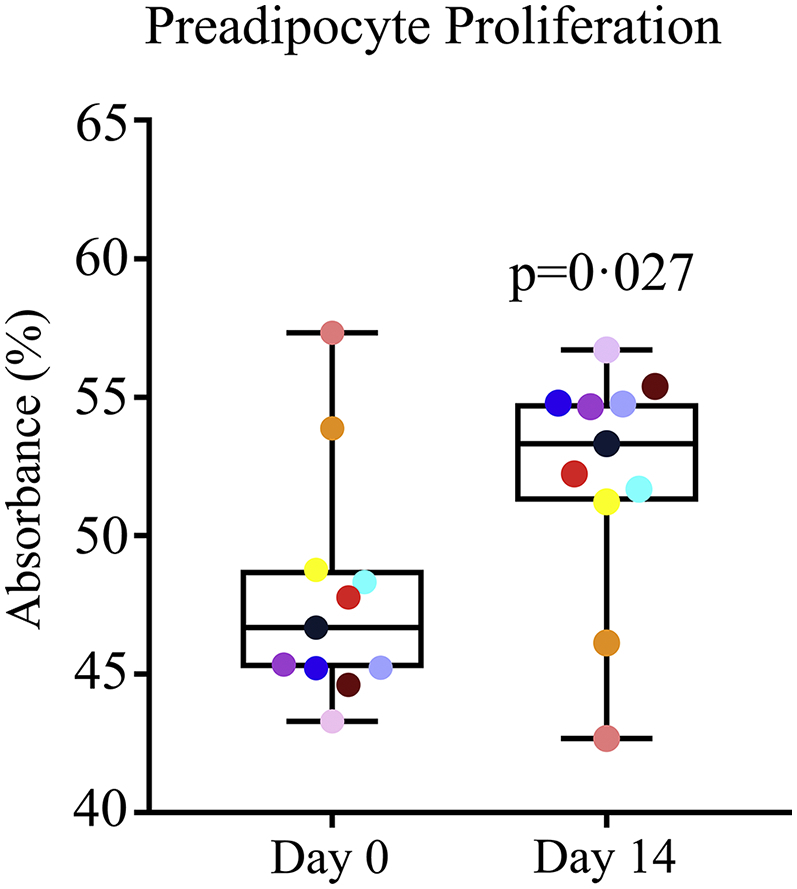
Fig. 3.Gli aumenti della densità delle cellule progenitrici adipocitarie nel tempo sono aumentati in seguito alla somministrazione di D + Q, compatibilmente con la rimozione di cellule con un potenziale di replica limitato (cellule senescenti e presenescenti). Densità cellulare / tempo è stato saggiato da assorbimento tetrazolio in progenitori adipocitari isolati da biopsie adipose acquisite prima (Giorno 0) e 14 days dopo la prima dose del corso di 3 giorni di D + Q (Giorno 14) e coltivato in parallelo per 3 passaggi. Aumenti della densità cellulare / tempo in progenitori adipociti isolati dopo il trattamento senolitico sono stati l’8% maggiore rispetto ai progenitori adipociti isolati prima del trattamento(N = 11 soggetti; Tabella 1) . Il valore esatto di p è indicato. I colori indicano i valori di ogni individuo nei giorni 0 e 14.
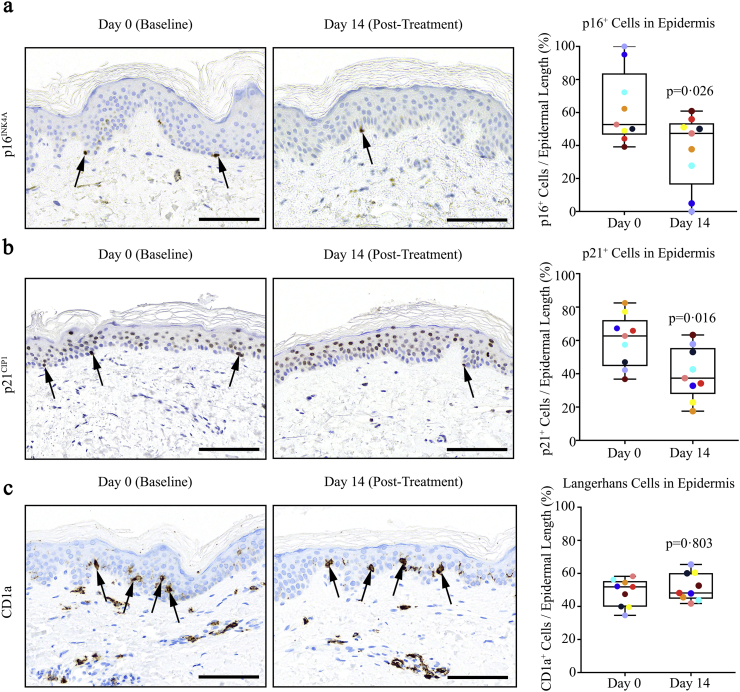
Fig. 4.D + Q diminuisce le cellule epidermiche umane senescenti. (a). D + Q ha ridotto significativamente (p = 0-026) lo strato basale epidermico umano epidermico p16INK4A+ cellule. I valori grezzi sono stati ridotti del 20% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), ci sono stati 1-95 ± 0-63 p16INK4A + cellule p16INK4A + / mm di epidermide(N soggetti= 9;mean ± SEM). Sono mostrate immagini rappresentative ai giorni 0 e 14. (b). D + Q significativamente ridotto (p = 0-016) strato basale epidermico umano p21CIP1 cellule epidermiche. I valori grezzi sono stati ridotti del 31% da 11 days dopo aver completato il trattamento D + Q. Al basale (Giorno 0), c’erano 1-71 ± 0-31 p21CIP1+ cellule/mm di epidermide(mean ± SEM ). Sono mostrate immagini rappresentative. (c). D + Q non ha sostanzialmente cambiato (p = .803) antigene-presente CD1a + cellule immunitarie Langerhans epidermiche. Al basale (Giorno 0), ci sono stati 14-55 ± 2-16 CD1a + cellule CD1a + / mm di epidermide(mean ± SEM; N = 9). Scala bars = 100 μm. Sono indicati i valori esatti di p. I colori indicano i valori di ogni individuo nei giorni 0 e 14.
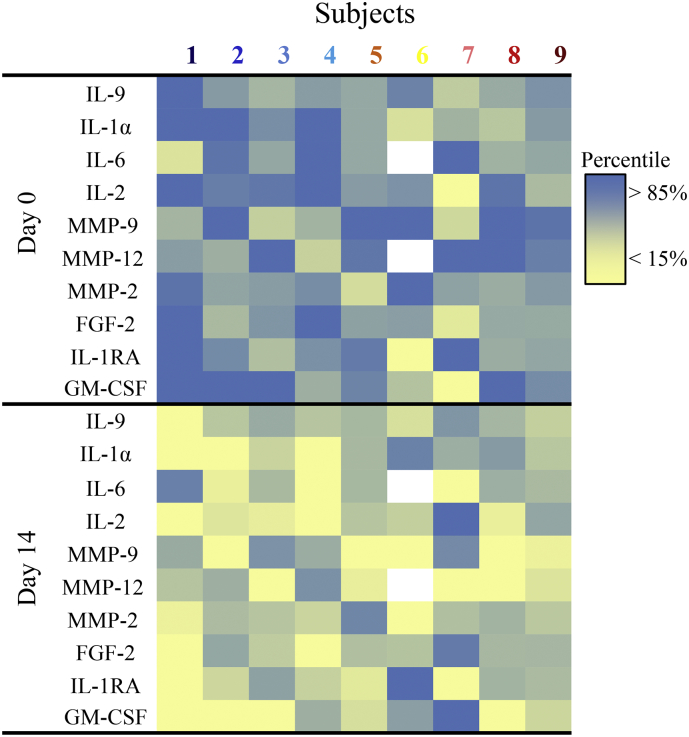
Fig. 5.D + Q diminuisce i fattori SASP plasmatici. I fattori SASP del plasma sono stati analizzati alla linea di base (Giorno 0) e dopo il trattamento (Giorno 14). I fattori chiave di SASP che sono stati significativamente diminuiti(p < 0-05) dopo il trattamento sono mostrati. I colori indicano i valori di ogni individuo nei giorni 0 e 14.
Discussione
L’obiettivo previsto per i senolitici sono le cellule senescenti. Presentiamo prove che dimostrano che i farmaci, D + Q, che sono senolitici nei topi e nei modelli di coltura cellulare o tissutale, diminuiscono le cellule senescenti negli esseri umani. Nessun marker individuale di cellule senescenti sembra essere completamente sensibile e specifico. Inoltre, i singoli fattori associati al SASP possono essere prodotti da cellule non senescenti, come le cellule immunitarie. Abbiamo quindi saggiato diversi marcatori cellulari chiave della senescenza e fattori SASP circolanti in tandem, così come marcatori di macrofagi, che possono mostrare caratteristiche simili a quelle delle cellule senescenti[59]. I macrofagi sono attratti, attivati in uno stato simile alla senescenza e ancorati dalle cellule senescenti nel tessuto adiposo[23].
I marcatori chiave del carico delle cellule senescenti sono stati diminuiti nel tessuto adiposo e nella pelle biopsiata dai soggetti 11 days dopo aver completato il corso di 3 giorni di D + Q, così come i fattori chiave SASP circolanti, rispetto a prima della somministrazione di questi farmaci senolitici. I cambiamenti nelle biopsie del tessuto adiposo coerenti con la diminuzione delle cellule senescenti comprendono la diminuzione della percentuale di cellule con un’alta espressione di p16INK4A e p21CIP1(Figg. 1a e b, rispettivamente) e l’attività SAβgal (Fig. 1c),la diminuzione dell’abbondanza di macrofagi e di strutture simili a corone (Figg. 2ae b),e l’aumento del numero di cellule nel tempo nelle colture primarie di progenitori adipocitari derivati dalle biopsie del tessuto adiposo dei soggetti (Fig. 3). La diminuzione delle cellule con alta attività SAβgal non era un artefatto causato da biopsie ripetute: l’attività cellulare SAβgal è stata coerente nelle biopsie ripetute di soggetti obesi non trattati con senolitici (Suppl.Tabella 1). D + Q è diminuito p16INK4A+e p21CIP1+cellule in un altro tessuto, lo strato epidermico della pelle (Figg. 4ae b,rispettivamente). Le cellule epidermiche ma non dermiche p16INK4A+ sono state associate al rischio di malattie cardiovascolari e all'”invecchiamento biologico” [60]. Nello strato epidermico, le diminuzioni di p16INK4A+ e p21CIP1+ cellule erano indipendenti dai cambiamenti nelle cellule di Langerhans CD1a+[58]. Inoltre, i cambiamenti nella pelle, insieme con le diminuzioni delle cellule senescenti nel tessuto adiposo e fattori SASP circolanti, suggeriscono che la somministrazione orale di D + Q diminuisce il carico complessivo delle cellule senescenti, in contrasto con il targeting delle cellule senescenti all’interno di un singolo organo o struttura, come può essere il caso a seguito di iniezione locale di agenti nelle ginocchia o negli occhi.
I macrofagi che esprimono il marcatore, CD68, sono stati diminuiti nelle biopsie del tessuto adiposo dopo la somministrazione di D + Q vs. al basale (Fig. 2a).Ci si aspettava che questo risultato si verificasse di concerto con la diminuzione delle cellule senescenti, perché le cellule senescenti ancorano i macrofagi all’interno del tessuto adiposo[23]. Parte della diminuzione delle cellule p16INK4A+ e delle cellule con attività SAβgal avrebbe potuto essere dovuta alla diminuzione della presenza di macrofagi attivati, oltre alla riduzione dell’abbondanza delle cellule senescenti. Tuttavia, è improbabile che i macrofagi attivati siano stati eliminati direttamente da D + Q, dal momento che abbiamo precedentemente riportato che, in condizioni in cui D + Q ha causato la morte di progenitori adipociti umani senescenti, i macrofagi attivati p16INK4A-espressivi non sono stati colpiti [28]. Pertanto, la riduzione dell’abbondanza di macrofagi del tessuto adiposo che abbiamo trovato qui dopo che i soggetti avevano completato il trattamento con D + Q era più probabile a causa della ridotta attrazione dei macrofagi e l’ancoraggio all’interno del tessuto adiposo conseguente alla rimozione delle cellule senescenti. Coerentemente con questo scenario, abbiamo precedentemente riportato che il pretrattamento di topi obesi con D + Q attenua il traffico nel tessuto adiposo di monociti etichettati iniettati nelle loro vene della coda rispetto ai topi pretrattati con veicolo invece di D + Q [23]. Nei topi che non erano stati pretrattati con senolitici, i monociti etichettati iniettati si sono rapidamente spostati nel loro tessuto adiposo. Questo effetto dei senolitici sulla riduzione dell’attrazione dei monociti/macrofagi circolanti nei tessuti può essere una ragione per cui abbiamo trovato poco effetto di D + Q sulle cellule epidermiche di Langherans, che sono essenzialmente macrofagi residenti [58]. Inoltre, c’erano poche o nessuna cellula CD68+ nell’epidermide prima o dopo il trattamento D + Q, indicando che il declino dellecellule p16INK4A+ epidermiche dopo D + Q non era dovuto ad un effetto sui macrofagi che esprimono CD68. Questi punti sono un’ulteriore prova che gli effetti diretti a monte di D + Q potrebbero essere principalmente sulle cellule senescenti, con effetti sui tipi di cellule immunitarie, come i macrofagi del tessuto adiposo, essendo una conseguenza di queste diminuzioni delle cellule senescenti.
Il potenziale di progenitori adipociti isolati da biopsie ottenute 11 days dopo il completamento del trattamento senolitico e passate tre volte ad aumentare di numero nel tempo è stato aumentato rispetto ai progenitori delle biopsie di base degli stessi soggetti (Fig.3). Queste cellule sono state coltivate in condizioni tali da escludere i macrofagi. Come le diminuzioni della percentuale di cellule con alta espressione p16INK4A e attività SAβgal dopo D + Q ha osservato sopra, questo è coerente con una diminuzione del carico di cellule senescenti e presenescenti. Non solo la perdita di potenziale replicativo è una caratteristica chiave delle cellule senescenti, quelle cellule che si avvicinano alla senescenza replicativa hanno una diminuzione della capacità residua di aumentare il numero e, analogamente, le cellule isolate da tessuti di soggetti più anziani con più cellule senescenti mostrano un potenziale replicativo ridotto rispetto alle cellule isolate da soggetti più giovani[3,53,54]. Così, la nostra scoperta che il potenziale di progenitori adipocitari coltivati da biopsie del tessuto adiposo ad aumentare di numero nel corso del tempo è rafforzata da un breve trattamento D + Q di soggetti diabetici con un elevato carico di cellule senescenti, rispetto al pretrattamento biopsie di base dagli stessi soggetti, è coerente con un effetto senolitico diretto di D + Q negli esseri umani.
Anche coerente con D + Q causando un calo del carico di cellule senescenti negli esseri umani, i livelli plasmatici dei fattori chiave SASP tra cui IL-1α, -2, -6, and -9 e MMP-2, -9, and -12, sono stati ridotti dopo il trattamento D + Q (Fig. 5). I risultati che le diminuzioni del tessuto adiposo e dell’abbondanza di cellule senescenti della pelle e le diminuzioni dei fattori SASP sistemici sono stati evidenti 11 days dopo l’ultima di 3 dosi giornaliere orali di D + Q è indicativo di un effetto sostenuto di questi farmaci dopo che non erano più presenti nel corpo. Ciò è coerente con D + Q che ha causato la rimozione delle cellule senescenti. Infatti, come abbiamo riportato in topi anziani trattati per l’osteoporosi legata all’età con D + Q [5],questi risultati suggeriscono che i senolitici possono essere altrettanto efficaci se somministrati in modo intermittente quanto continuo, nonostante l’eliminazione delle emivite di D e Q sia <11 h. Le cellule senescenti impiegano da settimane a più di un mese per formarsi e acquisire un SASP, almeno in cultura, il che significa che gli agenti senolitici possono essere somministrati in modo “mordi e fuggi”. Questa constatazione di un calo sostenuto del carico di cellule senescenti significa che D + Q non è probabile che eserciti i suoi effetti attraverso meccanismi off-target del tipo che coinvolge l’occupazione continua di un recettore o dalla modulazione di un enzima, ma piuttosto è più probabile che D + Q uccida lentamente le cellule senescenti che ricompaiono e non si dividono. Tale somministrazione intermittente di senolitici potrebbe ridurre gli effetti collaterali. Per esempio, D viene di solito somministrato in continuazione con un profilo di effetti collaterali tollerabile a 100 mg/day (la dose qui usata solo per un totale di 3 days) per anni o addirittura per oltre un decennio in pazienti con leucemie croniche [61]. La maggior parte dei potenziali effetti collaterali di D possono essere evitati attraverso la somministrazione intermittente e, in generale, gravi effetti collaterali di D inverso in caso di sospensione temporanea[62,63], aumentando il valore dell’opportunità di somministrare D in modo intermittente, ma beneficiando comunque dei suoi effetti senolitici.
I nostri risultati forniscono un supporto per la probabilità che gli effetti benefici di intermittenza D + Q sui fenotipi legati alla senescenza cellulare nell’IPF, che abbiamo riportato nel primo studio clinico sui senolitici [40],siano effettivamente dovuti alla riduzione del carico cellulare senescente. Al di là delle tendenze che abbiamo notato per i fattori SASP circolanti, i fattori SASP sono stati più bassi dopo di prima D + Q in quel primo studio clinico, nel secondo studio clinico per esaminare i senolitici, altri hanno documentato una diminuzione di 53 dei 66 fattori SASP, così come la diminuzione di un insieme genetico di senescenza indotta da stress del DNA/telomero. Questi cambiamenti sono stati trovati nel confronto delle biopsie cutanee di un sottoinsieme di pazienti con sclerosi sistemica che avevano un carico cellulare senescente inizialmente elevato prima di essere trattati con D (senza Q) continuamente per ~6 months vs. dopo il trattamento [41]. Ora, nel terzo studio clinico peer-reviewed di senolitici qui riportato, forniamo prove dirette per una diminuzione sia del tessuto adiposo e dell’abbondanza delle cellule senescenti epidermiche e dei fattori SASP circolanti 11 days a seguito di un singolo corso di 3 giorni di D + Q.
Molto resta da fare per ottimizzare i regimi senolitici e per identificare la possibile vasta gamma di effetti e di effetti collaterali di questi agenti nell’uomo. Se si può dimostrare che gli agenti senolitici sono efficaci per diverse condizioni individuali legate all’età, possono dimostrare di avere un ruolo che va oltre l’alleviamento di singole malattie: possono essere efficaci nel ridurre la multimorbilità comune nei pazienti anziani. Nella prima dimostrazione che la speranza di vita può essere migliorata rimuovendo le cellule senescenti dai topi in età naturale, abbiamo scoperto che la rimozione delle cellule senescenti con D + Q migliora la funzione cardiaca e la reattività vascolare nei topi anziani, allevia la fragilità e aumenta i proteoglicani del disco intervertebrale nei topi progeroidi, e migliora la resistenza del tapis roulant nei topi con una gamba sola ferita da radiazioni nei primi mesi del 2015 [32]. Confermando ed estendendo quel primo studio, noi e altri abbiamo successivamente dimostrato che D + Q ha alleviato una serie di disturbi aggiuntivi nei vecchi topi. Tra questi vi erano il calo della capacità rigenerativa cardiaca dovuto all’età, la fragilità, la debolezza muscolare, la riduzione dell’attività quotidiana, la diminuzione della resistenza alla corsa su un tapis roulant e l’osteoporosi[3,5,9,28,32]. Inoltre, nei topi anziani, D + Q ha ritardato le malattie legate all’età come gruppo e ha allungato la loro vita residua del 36% [28]. Nei modelli murini di malattie croniche legate all’età e alla senescenza, D + Q ha alleviato la disfunzione metabolica nei topi ad alto contenuto di grassi alimentati con la dieta e nei topi geneticamente obesi (in parte diminuendo la resistenza all’insulina), DKD manifestata dalla disfunzione del podocyte e dalla proteinuria, dalla fibrosi renale indotta dalla dieta ad alto contenuto di grassi, dall’ipofisi corticale renale.ossigenazione, e aumento della creatinina, steatosi epatica, disfunzione neuropsichiatrica in topi ad alto contenuto di grassi e geneticamente obesi, disfunzione cardiaca indotta da dieta ad alto contenuto di grassi e iporeattività vascolare, demenza di tipo Alzheimer nei topi con tau cerebrale o β-aggregati di proteine amiloidi, il fallimento delle fistole arteriovenose utilizzate per l’accesso vascolare durante l’emodialisi, la fibrosi polmonare indotta da bleomicina (un modello murino di IPF), e iperossia indotta da disfunzione polmonare, tra gli altri[7,9,20,23,24, [32], [ 33], [ 34], [ 35], [ 36], [ 37]]]. Così, gli agenti senolitici possono potenzialmente ritardare, prevenire o trattare le malattie legate all’età come gruppo, invece di un singolo paziente. Per avanzare verso questo obiettivo, è fondamentale concentrarsi sullo sviluppo di agenti senolitici che siano sicuri ed efficaci se somministrati per via sistemica (invece che localmente per iniezione) negli esseri umani.
Dopo che abbiamo segnalato i primi farmaci senolitici, D + Q [32], un certo numero di altri senolitici sono stati trovati da noi e da altri [37,[64], [65], [ 66], [ 67], [ 68], [ 69], [ 70]]. Ad esempio, sulla base del nostro rapporto che BCL-xL è un target di percorso SCAP a cellule endoteliali all’inizio del 2015[32], abbiamo successivamente scoperto che l’inibitore della famiglia BCL-2, Navitoclax (N; noto anche come ABT-263), e i più specifici inibitori BCL-xL, A1331852 e A1155463, sono, come Q, senolitici nel caso di cellule endoteliali umane senescenti, ma non progenitori adipocitari umani senescenti[64,71]. Pertanto, la gamma di cellule senescenti bersaglio degli inibitori BCL-xL è limitata. La nostra motivazione per l’utilizzo di D + Q in contrapposizione ad altri farmaci nella sperimentazione riportata qui di seguito. D + Q è più specificamente senolitico rispetto ad altri farmaci che agiscono come “panolitici”, compresi alcuni agenti che legano l’MDM2, prevenendo la destabilizzazione p53 (ad esempio, Nutlin3a) e alcuni inibitori della famiglia BCL-2 (ad esempio, N). Alcuni di questi agenti, ad esempio i nutlin3a, possono causare gravi (classe 3/4) riduzioni fuori obiettivo in tipi di cellule non senescenti, tra cui la carenza di piastrine che causa emorragie, neutropenia che causa infezioni e carenze di altri tipi di cellule[72,73]. Questo impatto su più tipi di cellule (oltre alle cellule senescenti) dei farmaci che agiscono principalmente sull’MDM2 può rendere difficile l’attribuzione degli effetti clinici di tali farmaci al targeting selettivo delle cellule senescenti (rispetto alle cellule non senescenti). Mentre il D può a volte causare anche un deficit piastrinico transitorio e reversibile, questo non è comune. Anche con tumori maligni ematologici che possono causare l’esaurimento delle piastrine, si verificano sanguinamenti significativi (classe 3/4) in <1% dei pazienti in trattamento continuo con D. Questo di solito si verifica solo dopo mesi di somministrazione ininterrotta di D, a differenza del regime D intermittente che abbiamo trovato qui per essere senolitico(Web Reference 1). Inoltre, alcuni senolitici (ad esempio, Q) e panolitici (ad esempio, N) non si rivolgono ad alcuni tipi di cellule senescenti, come i progenitori adipociti umani senescenti[71], che sono un tipo di cellula senescente principale nel tessuto adiposo, e che sono stati studiati nello studio clinico qui riportato, un altro motivo per combinare D con Q nel nostro studio. Un vantaggio di D + Q è che questa combinazione senolitica disattiva in modo più completo le reti SCAP rispetto a N, aumentando la gamma dei tipi di cellule senescenti eliminati selettivamente da D + Q [32]. Abbiamo quindi studiato la somministrazione sistemica di D + Q in contrapposizione ai farmaci panolitici (ad esempio, Nutlin3a), dal momento che questi ultimi possono dover essere iniettati localmente invece che sistemicamente per evitare effetti negativi causati dal loro esaurimento fuori obiettivo di tipi di cellule non senescenti.
Molti altri studi clinici per diverse indicazioni e con diversi farmaci e combinazioni di senolitici devono essere completati per confermare i risultati dei tre studi clinici di senolitici finora riportati nelle riviste scientifiche. Questi tipi di studi clinici includono studi di fase successiva, come lo studio randomizzato e controllato che noi e i nostri collaboratori stiamo attualmente conducendo utilizzando D + Q per IPF (NCT02874989) o la fragilità nelle donne anziane che utilizzano la fisetina (NCT03325322), uno studio di fase precedente di D .+ Q per lo stato di invecchiamento accelerato in seguito a trapianto di midollo osseo (NCT02652052), completamento della nostra sperimentazione con i risultati preliminari riportati qui di D + Q per l’insufficienza renale e la disfunzione delle cellule staminali nel diabete avanzato (NCT02848131), studi per i molti altri disturbi legati all’età e alla senescenza cellulare che utilizzano diversi agenti senolitici e combinazioni che stiamo per iniziare, e studi di altri che devono ancora essere segnalati a seguito di peer review, come quello in cui un agente che agisce principalmente su MDM2 viene iniettato nelle ginocchia dei soggetti affetti da osteoartrite (NCT03513016).
Conducendo studi su diverse condizioni legate all’età e alla senescenza e utilizzando diversi set di agenti senolitici, l’Ipotesi di Geroscienza[21,74,75] può essere testata nell’uomo. Questa ipotesi presuppone che, prendendo di mira un processo di invecchiamento fondamentale come la senescenza cellulare, più disturbi legati all’età possono essere ritardati, prevenuti o attenuati come gruppo, invece di uno alla volta. Questo nuovo approccio sarà molto più simile a quello dello sviluppo di un antibiotico rispetto al solito approccio a un solo farmaco, a un solo obiettivo, a una sola malattia, che ha dominato il campo dello sviluppo di farmaci biomedici negli ultimi decenni. L’obiettivo dei senolitici è per definizione quello di mirare alle cellule senescenti. Non si tratta di identificare un singolo bersaglio molecolare e di sviluppare un farmaco che influisce su quel singolo bersaglio molecolare. Questo potrebbe causare apoptosi in diversi tipi di cellule, comprese le cellule non senescenti, o limitare l’eliminazione a un piccolo sottoinsieme di cellule senescenti che esprimono quel particolare bersaglio molecolare. Nell’attuale studio clinico dimostriamo che D + Q è efficace nel diminuire le cellule senescenti, la prima prova diretta che i senolitici sono efficaci nell’uomo.
Anche se siamo ottimisti sulle prospettive di introdurre in futuro i senolitici e altri agenti che modulano i processi di invecchiamento fondamentali nella pratica clinica, in particolare nel prossimo futuro per le malattie gravi per le quali non esistono attualmente interventi efficaci, dobbiamo concludere con una nota di cautela. Il campo dei senolitici è nuovo. Il primo studio clinico di agenti senolitici è stato segnalato solo nel gennaio 2019. I risultati qui riportati sono i risultati preliminari di una sperimentazione clinica in corso sui senolitici per il trattamento delle disfunzioni nei pazienti con malattia renale cronica diabetica. Meno di 150 soggetti sono stati trattati con questi farmaci nel contesto di studi clinici di cui siamo a conoscenza finora. Oltre agli effetti collaterali legati ai singoli farmaci senolitici noti in altri contesti in cui tali farmaci sono stati utilizzati, potrebbero rivelarsi gravi effetti collaterali dei senolitici come classe, che non sono ancora noti. Mettiamo in guardia contro l’uso di agenti senolitici al di fuori del contesto degli studi clinici fino a quando non si saprà di più sui loro effetti e sugli effetti collaterali.
Fonti di finanziamento
Questo lavoro è stato sostenuto da NIH grants DK109134 (L.J.H.), DK118120 (S.M.H.), DK120292 (L.O.L.), AG013925 (J.L.K.), AG062413 (Progetto 1; J.L.K.; Progetto 2: S.K.; Progetto 3: N.K.L.), la Rete Geroscienza Traslazionale (AG061456: J.).L.K.), DK45343 (M.D.J.), DK40484 (M.D.J.), e TR002377 (S.K.; Mayo Clinic Center for Translational Science Activities), Robert e Arlene Kogod, Satellite Healthcare (L.J.H.), il Gruppo Connor (J.L.K.), Robert J. e Theresa W. Ryan (J.L.K.), e le Fondazioni Glenn (N.K.L.), Ted Nash Long Life (J.L.K.), e Noaber Foundations (J.L.K.). Gli sponsor dello studio non hanno avuto alcun ruolo nella raccolta, analisi o interpretazione dei dati, nella stesura del rapporto o nella decisione di presentare il documento per la pubblicazione. T.T. e J.L.K. confermano di aver avuto pieno accesso a tutti i dati dello studio e di avere la responsabilità finale della decisione di presentare l’articolo per la pubblicazione.
Contributi degli autori
Concetto di studio, progettazione e supervisione generale: JLK, TT, LJH.
Manoscritto preparato: JLK, LJH, TT, LGPLP.
Manoscritto preparato: JLK, LJH, EOWG, TT, LGPLP, SK, RJP, MDJ, SKH, SAB, TKE, SMH, DMK, NKL, KMM, SCT, QJ, YZ, JFP.
Ottenuto il finanziamento: JLK, LJH.
Biopsie dei tessuti adiposi e della pelle: TJM, TAK.
Approvazioni regolamentari e supervisione: LJH, TKE, KMM, SH, JLK.
Arruolamento dei pazienti, consenso e valutazioni cliniche: LJH, DKL, SMH, SMH, SCT, SAB, EOWG, TLV, JLK.
Saggi di replicazione dei progenitori adipocitari condotti e raccolta: KLJ, IMS.
Condotta immunoistochimica, SAβgal, e analisi di laboratorio del sangue: TT, LGPLP, AX, QJ, MDJ, SGV, ABL, JFP, DMK, KKS.
Analisi dei dati: JLK, TT, LJH, LJH, LGPLP, RJP.
Dichiarazione di interesse concorrente
J.L.K., T.T., Y.Z. e N.K.L. hanno un interesse finanziario legato a questa ricerca. I brevetti sui farmaci senolitici sono detenuti dalla Mayo Clinic. Questa ricerca è stata esaminata dal Mayo Clinic Conflict of Interest Review Board ed è stata condotta in conformità con le politiche di Mayo Clinic Conflict of Interest. Gli altri autori non dichiarano alcun conflitto di interesse, finanziario o di altra natura.
References
- Hayflick L., Moorehead P.. The serial cultivation of human diploid strains. Exp Cell Res. 1961; 25:585-621. PubMed
- Kirkland J.L., Tchkonia T.. Cellular senescence: a translational perspective. EBioMedicine.. 2017; 21:21-28. PubMed
- Lewis-McDougall F.C., Ruchaya P.J., Domenjo-Vila E., Shin Teoh T., Prata L., Cottle B.J.. Aged-senescent cells contribute to impaired heart regeneration. Aging Cell. 2019; 18
- Kirkland J.L., Hollenberg C.H., Gillon W.S.. Age, anatomic site, and the replication and differentiation of adipocyte precursors. Am J Physiol. 1990; 258
- Farr J.N., Xu M., Weivoda M.M., Monroe D.G., Fraser D.G., Onken J.L.. Targeting cellular senescence prevents age-related bone loss in mice. Nat Med. 2017;231072-231079.
- Justice J.N., Gregory H., Tchkonia T., LeBrasseur N.K., Kirkland J.L., Kritchevsky S.B.. Cellular senescence biomarker p16INK4a+ cell burden in thigh adipose is associated with poor physical function in older women. T J Gerontol A Biol Sci Med Sci. 2018; 73:939-945.
- Ogrodnik M., Miwa S., Tchkonia T., Tiniakos D., Wilson C.L., Lahat A.. Cellular senescence drives age-dependent hepatic steatosis. Nat Commun. 2017 Jun 13; 8:15691. PubMed
- Farr J.N., Fraser D.G., Wang H., Jaehn K., Ogrodnik M.B., Weivoda M.M.. Identification of senescent cells in the bone microenvironment. J Bone Miner Res. 2016; 31:1920-1929. PubMed
- Roos C.M., Zhang B., Palmer A.K., Ogrodnik M.B., Pirtskhalava T., Thalji N.M.. Chronic senolytic treatment alleviates established vasomotor dysfunction in aged or atherosclerotic mice. Aging Cell. 2016; 15:973-977. PubMed
- Xu M., Palmer A.K., Ding H., Weivoda M.M., Pirtskhalava T., White T.A.. Targeting senescent cells enhances adipogenesis and metabolic function in old age. eLife.. 2015.
- Xu M., Tchkonia T., Ding H., Ogrodnik M., Lubbers E.R., Pirtskhalava T.. JAK inhibition alleviates the cellular senescence-associated secretory phenotype and frailty in old age. P Proc Natl Acad Sci (USA). 2015; 112
- Zhu Y., Armstrong J.L., Tchkonia T., Kirkland J.L.. Cellular senescence and the senescent secretory phenotype in age-related chronic diseases. Curr Opin Clin Nutr Metab Care. 2014; 17:324-328. PubMed
- Tchkonia T., Morbeck D.E., von Zglinicki T., van Deursen J., Lustgarten J., Scrable H.. Fat tissue, aging, and cellular senescence. Aging Cell. 2010; 9:667-684. PubMed
- Kirkland J.L., Dobson D.E.. Preadipocyte function and aging: links between age-related changes in cell dynamics and altered fat cell function. J Amer Geriatr Soc. 1997; 45:959-967. PubMed
- Tchkonia T., Giorgadze N., Pirtskhalava T., Thomou T., Villaret A., Bouloumie A.. Cellular senescence and inflammation in obesity. Obesity. 2009; 17(Suppl. 2):S57.
- Villaret A., Galitzky J., Decaunes P., Esteve D., Marques M.A., Sengenes C.. Adipose tissue endothelial cells from obese human subjects: differences among depots in angiogenic, metabolic, and inflammatory gene expression and cellular senescence. Diabetes.. 2010; 59:2755-2763. PubMed
- Minamino T., Orimo M., Shimizu I., Kunieda T., Yokoyama M., Ito T.. A crucial role for adipose tissue p53 in the regulation of insulin resistance. N Nat Med. 2009; 15:1082-1087.
- Docherty M.H., O’Sullivan E.D., Bonventre J.V., Ferenbach D.A.. Cellular senescence in the kidney. J Am Soc Nephrol. 2019; 30:726-736. PubMed
- Dai L., Qureshi A.R., Witasp A., Lindholm B., Stenvinkel P.. Early vascular ageing and cellular senescence in chronic kidney disease. Comput Struct Biotechnol J. 2019; 17:721-729. PubMed
- Kim S.R., Jiang K., Ogrodnik M., Chen X., Zhu X.Y., Lohmeier H.. Increased renal cellular senescence in murine high-fat diet: effect of the senolytic drug quercetin. Transl Res. 2019.
- Kirkland J.L., Tchkonia T., Zhu Y., Niedernhofer L.J., Robbins P.D.. The clinical potential of senolytic drugs. J Amer Geriatr Soc. 2017 Oct; 65(10):2297-2301. PubMed
- Tchkonia T., Kirkland J.L.. Aging, cell senescence, and chronic disease: emerging therapeutic strategies. JAMA. 2018; 320
- Palmer A.K., Xu M., Zhu Y., Pirtskhalava T., Weivoda M.M., Hachfeld C.M.. Targeting senescent cells alleviates obesity-induced metabolic dysfunction. Aging Cell. 2019; 18
- Ogrodnik M., Zhu Y., Langhi L.G.P., Tchkonia T., Kruger P., Fielder E.. Obesity-induced cellular senescence drives anxiety and impairs neurogenesis. Cell Metab. 2019; 29:1061-1077. PubMed
- Musi N., Valentine J.M., Sickora K.R., Baeuerle E., Thompson C.S., Shen Q.. Tau protein aggregation is associated with cellular senescence in the brain. Aging Cell. 2018; 17
- Coppé J.P., Patil C., Rodier F., Sun Y., Muñoz D.P., Goldstein J.. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor. PLoS Biol. 2008; 6:2853-2868. PubMed
- Xu M., Bradley E.W., Weivoda M.M., Hwang S.M., Pirtskhalava T., Decklever T.. Transplanted senescent cells induce an osteoarthritis-like condition in mice. J Gerontol A Biol Sci Med Sci. 2017; 72:780-785. PubMed
- Xu M., Pirtskhalava T., Farr J.N., Weigand B.M., Palmer A.K., Weivoda M.M.. Senolytics improve physical function and increase lifespan in old age. Nat Med. 2018; 24:1246-1256. PubMed
- Wang E.. Senescent human fibroblasts resist programmed cell death, and failure to suppress BCL2 is involved. Cancer Res. 1995; 55:2284-2292. PubMed
- Kirkland J.L., Tchkonia T.. Clinical strategies and animal models for developing senolytic agents. Exp Gerontol. 2015; 68:19-25. PubMed
- Krishnamurthy J., Torrice C., Ramsey M.R., Kovalev G.I., Al-Regaiey K., Su L.. Ink4a/Arf expression is a biomarker of aging. J Clin Invest. 2004; 114:1299-1307. PubMed
- Zhu Y., Tchkonia T., Pirtskhalava T., Gower A., Ding H., Giorgadze N.. The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015; 14:644-658. PubMed
- Schafer M.J., White T.A., Iijima K., Haak A.J., Ligresti G., Atkinson E.J.. Cellular senescence mediates fibrotic pulmonary disease. Nat Commun. 2017; 8:14532. PubMed
- Parikh P., Britt R.D., Manlove L.J., Wicher S.A., Roesler A., Ravix J.. Hyperoxia-induced cellular senescence in fetal airway smooth muscle cells. Am J Respir Cell Mol Biol. 2019; 61:51-60. PubMed
- Nath K.A., O’Brien D.R., Croatt A.J., Grande J.P., Ackerman A.W., Nath M.C.. The murine dialysis fistula model exhibits a senescence phenotype: pathobiologic mechanisms and therapeutic potential. Am J Physiol Renal Physiol. 2018; 315:F1493-F1499. PubMed
- Zhang P., Kishimoto Y., Grammatikakis I., Gottimukkala K., Cutler R.G., Zhang S.. Senolytic therapy alleviates Abeta-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer’s disease model. Nat Neurosci. 2019; 22:719-728. PubMed
- Fuhrmann-Stroissnigg H., Ling Y.Y., Zhao J., McGowan S.J., Stripay J.L., Gregg S.. Identification of HSP90 inhibitors as senolytics for extending healthspan. Nat Commun. 2017; 8:422. PubMed
- Christopher L.J., Cui D., Wu C., Luo R., Manning J.A., Bonacorsi S.J.. Metabolism and disposition of dasatinib after oral administration to humans. Drug Metab Dispos. 2008; 36:1357-1364. PubMed
- Graefe E.U., Wittig J., Mueller S., Riethling A.K., Uehleke B., Drewelow B.. Pharmacokinetics and bioavailability of quercetin glycosides in humans. J Clin Pharmacol. 2001; 41:492-499. PubMed
- Justice J.N., Nambiar A.M., Tchkonia T., LeBrasseur N.K., Pascual R., Hashmi S.K.. Senolytics in idiopathic pulmonary fibrosis: results from a first-in-human, open-label, pilot study. EBioMedicine.. 2019; 40:554-563. PubMed
- Martyanov V., Whitfield M.L., Varga J.. Senescence signature in skin biopsies from systemic sclerosis patients treated with senolytic therapy: potential predictor of clinical response?. Arthritis Rheumatol. 2019.
- Verzola D., Gandolfo M.T., Gaetani G., Ferraris A., Mangerini R., Ferrario F.. Accelerated senescence in the kidneys of patients with type 2 diabetic nephropathy. Am J Physiol Renal Physiol. 2008; 295(5):F1563-F1573. PubMed
- Liu J., Yang J.R., Chen X.M., Cai G.Y., Lin L.R., He Y.N.. Impact of ER stress-regulated ATF4/p16 signaling on the premature senescence of renal tubular epithelial cells in diabetic nephropathy. Am J Physiol Cell Physiol. 2015; 308:C621-C630. PubMed
- Satriano J., Mansoury H., Deng A., Sharma K., Vallon V., Blantz R.C.. Transition of kidney tubule cells to a senescent phenotype in early experimental diabetes. Am J Physiol Cell Physiol. 2010; 299:C374-C380. PubMed
- Schneider C.A., Rasband W.S., Eliceiri K.W.. NIH image to ImageJ: 25 years of image analysis. Nat Methods. 2012; 9:671-675. PubMed
- Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T.. Fiji: an open-source platform for biological-image analysis. Nat Methods. 2012; 9:676-682. PubMed
- Morgan-Bathke M., Harteneck D., Jaeger P., Sondergaard E., Karwoski R., Espinosa De Ycaza A.. Comparison of methods for analyzing human adipose tissue macrophage content. Obesity. 2017; 25:2100-2107. PubMed
- Eirin A., Zhu X.Y., Krier J.D., Tang H., Jordan K.L., Grande J.P.. Adipose tissue-derived mesenchymal stem cells improve revascularization outcomes to restore renal function in swine atherosclerotic renal artery stenosis. Stem Cells. 2012; 30:1030-1041. PubMed
- Saad A., Dietz A.B., Herrmann S.M.S., Hickson L.J., Glockner J.F., McKusick M.A.. Autologous mesenchymal stem cells increase cortical perfusion in renovascular disease. J Am Soc Nephrol. 2017; 28:2777-2785. PubMed
- Wang A.S., Dreesen O.. Biomarkers of cellular senescence and skin aging. Front Genet. 2018; 9:247. PubMed
- Bernardes de Jesus B., Blasco M.A.. Assessing cell and organ senescence biomarkers. Circ Res. 2012; 111:97-109. PubMed
- Murano I., Barbatelli G., Parisani V., Latini C., Muzzonigro G., Castellucci M.. Dead adipocytes, detected as crown-like structures, are prevalent in visceral fat depots of genetically obese mice. J Lipid Res. 2008; 49:1562-1568. PubMed
- Mitsui Y., Schneider E.L.. Relationship between cell replication and volume in senescent human diploid fibroblasts. Mech Ageing Dev. 1976; 5:45-56. PubMed
- Schneider E.L.. Cell replication and aging: in vitro and in vivo studies. Fed Proc. 1979; 38:1857-1861. PubMed
- Zhu Y., Tchkonia T., Stout M.B., Giorgadze N., Wang L., Li P.W.. Inflammation and the depot-specific secretome of human preadipocytes. Obesity.. 2015; 23:989-999. PubMed
- Tchkonia T., Cartwright M., Wise B., Pirtskhalava T., Karagiannides I., Shpilman A.. Increased TNFa and CCAAT/enhancer binding protein homologous protein (CHOP) with aging predispose preadipocytes to resist adipogenesis. Am J Physiol. 2007; 293
- Tchkonia T., Lenburg M., Thomou T., Giorgadze N., Frampton G., Pirtskhalava T.. Identification of depot-specific human fat cell progenitors through distinct expression profiles and developmental gene patterns. Am J Physiol. 2007; 292:E298-E307.
- Doebel T., Voisin B., Nagao K.. Langerhans cells – the macrophage in dendritic cell clothing. Trends Immunol. 2017; 38:817-828. PubMed
- Hall B.M., Balan V., Gleiberman A.S., Strom E., Krasnov P., Virtuoso L.P.. p16(Ink4a) and senescence-associated beta-galactosidase can be induced in macrophages as part of a reversible response to physiological stimuli. Aging (Albany NY). 2017; 9:1867-1884. PubMed
- Waaijer M.E., Parish W.E., Strongitharm B.H., van Heemst D., Slagboom P.E., de Craen A.J.. The number of p16INK4a positive cells in human skin reflects biological age. Aging Cell. 2012; 11:722-725. PubMed
- Bhalla S., Tremblay D., Mascarenhas J.. Discontinuing tyrosine kinase inhibitor therapy in chronic myelogenous leukemia: current understanding and future directions. Clin Lymphoma Myeloma Leuk. 2016; 16:488-494. PubMed
- Fox L.C., Cummins K.D., Costello B., Yeung D., Cleary R., Forsyth C.. The incidence and natural history of dasatinib complications in the treatment of chronic myeloid leukemia. Blood Adv. 2017; 1:802-811. PubMed
- La Rosee P., Martiat P., Leitner A., Klag T., Muller M.C., Erben P.. Improved tolerability by a modified intermittent treatment schedule of dasatinib for patients with chronic myeloid leukemia resistant or intolerant to imatinib. Ann Hematol. 2013; 92:1345-1350. PubMed
- Zhu Y., Doornebal E.J., Pirtskhalava T., Giorgadze N., Wentworth M., Fuhrmann-Stroissnigg H.. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging (Albany NY). 2017; 9:955-963. PubMed
- Yousefzadeh M.J., Zhu Y., McGowan S.J., Angelini L., Fuhrmann-Stroissnigg H., Xu M.. Fisetin is a senotherapeutic that extends health and lifespan. EBioMedicine.. 2018 Oct; 36:18-28. PubMed
- Wang Y., Chang J., Liu X., Zhang X., Zhang S., Zhou D.. Discovery of piperlongumine as a potential novel lead for the development of senolytic agents. Aging (Milano). 2016; 8:2915-2926.
- Ozsvari B., Nuttall J.R., Sotgia F., Lisanti M.P.. Azithromycin and Roxithromycin define a new family of "senolytic" drugs that target senescent human fibroblasts. Aging (Milano). 2018; 10:3294-3307.
- Cherif H., Bisson D.G., Jarzem P., Weber M., Ouellet J.A., Haglund L.. Curcumin and o-vanillin exhibit evidence of senolytic activity in human IVD cells in vitro. J Clin Med. 2019; 8(4)
- Li W., He Y., Zhang R., Zheng G., Zhou D.. The curcumin analog EF24 is a novel senolytic agent. Aging (Milano). 2019; 11:771-782.
- Samaraweera L., Adomako A., Rodriguez-Gabin A., McDaid H.M.. A novel indication for panobinostat as a senolytic drug in NSCLC and HNSCC. Sci Rep. 2017; 7:1900. PubMed
- Zhu Y., Tchkonia T., Fuhrmann-Stroissnigg H., Dai H.M., Ling Y.Y., Stout M.B.. Identification of a novel senolytic agent, navitoclax, targeting the Bcl-2 family of anti-apoptotic factors. Aging Cell. 2015; 14:644-658. PubMed
- Kaefer A., Yang J., Noertersheuser P., Mensing S., Humerickhouse R., Awni W.. Mechanism-based pharmacokinetic/pharmacodynamic meta-analysis of navitoclax (ABT-263) induced thrombocytopenia. Cancer Chemother Pharmacol. 2014; 74:593-602. PubMed
- Mahfoudhi E., Lordier L., Marty C., Pan J., Roy A., Roy L.. P53 activation inhibits all types of hematopoietic progenitors and all stages of megakaryopoiesis. Oncotarget.. 2016; 7:31980-31992. PubMed
- Justice J., Miller J.D., Newman J.C., Hashmi S.K., Halter J., Austad S.N.. Frameworks for proof-of-concept clinical trials of interventions that target fundamental aging processes. J Gerontol A Biol Sci Med Sci. 2016; 71:1415-1423. PubMed
- Kennedy B.K., Berger S.L., Brunet A., Campisi J., Cuervo A.M., Epel E.S.. Geroscience: linking aging to chronic disease. Cell.. 2014; 159:709-713. PubMed
Fonte
Hickson LJ, Langhi Prata LG, Bobart SA, Evans TK, Giorgadze N, et al. (2019) Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine 47. https://doi.org/10.1016/j.ebiom.2019.08.069





