Introduzione
La percentuale di pazienti anziani in terapia intensiva (terapia intensiva) è in aumento.1 I costi delle unità di terapia intensiva rappresentano l’1% del prodotto interno lordo negli Stati Uniti e sono potenzialmente insostenibili.2,3 Studi osservazionali precedenti4,5,6 ha riferito che il trasferimento in terapia intensiva è stato associato ad un aumento della mortalità, ma si è basato su metodi di aggiustamento del rischio che non affrontano la confusione per indicazione o riconoscono una potenziale eterogeneità nell’efficacia delle cure in terapia intensiva in base alla prognosi del paziente. Ci sono grandi sfide pratiche ed etiche nell’intraprendere studi clinici randomizzati per valutare il trasferimento in terapia intensiva per i pazienti in deterioramento del reparto. Un recente studio clinico randomizzato a grappolo7 ha riferito che un programma per aumentare i ricoveri in terapia intensiva per i pazienti anziani non ha ridotto la mortalità ospedaliera. Questi risultati possono scoraggiare il trasferimento in terapia intensiva per i pazienti anziani8,9,10 o rafforzare le limitazioni del trattamento, nonostante le preoccupazioni che le conclusioni dello studio clinico randomizzato7 non si applicava alla pratica clinica di routine.2
La medicina di precisione o personalizzata mira a fornire gli interventi giusti per i pazienti giusti al momento giusto, che possono essere avviati in base a qualsiasi misura della prognosi del singolo paziente e non si limita al suo profilo genetico o biomarcatore.11,12,13 In particolare, i vantaggi del trasferimento in terapia intensiva possono dipendere da fattori prognostici, come l’età, che possono modificare l’efficacia del solo trasferimento in terapia intensiva, e in sinergia con misure, come lo stato fisiologico del paziente.14,15 Una delle principali sfide nel generare prove a sostegno del processo decisionale clinico è che i vantaggi derivanti dalle cure in terapia intensiva possono differire in base a caratteristiche non misurate, come la fragilità, che può anche determinare se il paziente viene trasferito o meno in terapia intensiva. Studi precedenti14,15 non hanno riconosciuto che l’efficacia delle cure in terapia intensiva può variare in base a fattori non misurati a livello del paziente.
Un nuovo metodo per l’esame completo dell’eterogeneità che affronta la confusione per indicazione segnala gli effetti del trattamento centrato sulla persona (PeT).16,17,18 Questo metodo utilizza intuizioni su come i medici selezionano gli interventi in base al guadagno di salute previsto per ogni paziente per fornire stime a livello individuale dell’efficacia del trattamento, che vengono poi aggregate in sottogruppi di interesse primario.16,17,18,19 Abbiamo rivisitato un esperimento naturale che utilizzava la disponibilità di letti per terapia intensiva come variabile strumentale (IV) per il trasferimento in terapia intensiva per stimare l’efficacia del trasferimento per un sottocampione di pazienti in degenza.20 A differenza dello studio precedente, che si concentrava sul trasferimento entro 4 ore, abbiamo stimato l’efficacia del trasferimento in terapia intensiva di per sé per tutti i pazienti valutati. Valutiamo completamente l’eterogeneità dell’efficacia del trasferimento in terapia intensiva in base alle caratteristiche osservate e non osservate in tutti i pazienti idonei del reparto in deterioramento. A nostra conoscenza, questo articolo è il primo a riconoscere che l’efficacia delle cure in terapia intensiva può essere modificata in base alle caratteristiche del paziente non misurate e a quelle misurate.17,20,21,22 Stimiamo l’efficacia del trasferimento in terapia intensiva in base all’età del paziente e alla gravità della malattia da soli e combinati.
Metodi
Fonte dei dati, partecipanti e definizioni
Questo studio prospettico di coorte è stato condotto dal 1° novembre 2010 al 31 dicembre 2011. Le date di questa analisi erano dal 1° giugno 2017 al 30 giugno 2018. Abbiamo utilizzato i dati dello studio (SPOT) light,20 una futura coorte di pazienti di reparto in deterioramento valutati per un possibile trasferimento in terapia intensiva in 49 ospedali del Servizio Sanitario Nazionale del Regno Unito. Questo studio ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE).20,23 Abbiamo escluso le visite ripetute, le riammissioni, i decessi durante la valutazione, i ricoveri dopo l’intervento (quando il ricovero può essere protocollato) e i pazienti con limitazioni di trattamento preesistenti. Il ricovero in terapia intensiva e la sopravvivenza sono stati definiti in base al collegamento con il database del Programma Case Mix del Centro Nazionale di Audit e Ricerca di Terapia Intensiva (ICNARC) e con il Servizio Informazioni del Servizio Sanitario Nazionale. Lo studio è stato registrato nel portafoglio di ricerca del National Institute of Health Research (n. 9139) e presso ClinicalTrials.gov (NCT0101099813). L’approvazione etica è stata fornita dal National Health Service National Research Ethics Committee (Cambridgeshire 3) il 2 settembre 2010, per il protocollo di studio versione 1.1. Non è stato ottenuto il consenso, ma il permesso di elaborare i dati dei pazienti è stato approvato dal Comitato etico e di riservatezza del National Information Governance Board. Il protocollo di studio completo è disponibile sul sito web dell’ICNARC.24
La variabile del trattamento è stata trasferita da un reparto all’unità di terapia intensiva e il risultato principale è stata la mortalità fino a 28 giorni dopo la valutazione dell’unità di terapia intensiva. La IV era la disponibilità di posti letto in terapia intensiva, definita come la somma dei posti letto fisicamente vuoti in terapia intensiva più quelli con pazienti in terapia intensiva pronti per la dimissione.20,21,25,26 Questa misura è stata precedentemente utilizzata come IV per il ricovero o il trasferimento del paziente.20,21,25,26 In seguito a questi studi, abbiamo ipotizzato che la capacità inutilizzata di terapia intensiva incoraggiasse il trasferimento, ma non influisse altrimenti sulla mortalità dei pazienti valutati.
Le covariate di base sono state tutte registrate dal medico al momento della valutazione del trasferimento e comprendevano l’età, la diagnosi di sepsi, il periarresto (un giudizio clinico di imminente arresto cardiorespiratorio) e le misure fisiologiche necessarie per calcolare i seguenti 3 punteggi fisiologici acuti: il National Health Service National Early Warning Score (NEWS),27 il punteggio di fisiologia dell’ICNARC,28 e la valutazione sequenziale del fallimento di un organo (SOFA).29 L’attuale dipendenza del paziente al momento della valutazione del reparto e il livello di assistenza raccomandato dopo la valutazione sono stati definiti dai livelli di assistenza del Critical Care Minimum Data Set del Regno Unito, equivalenti all’assistenza generale del reparto (livelli 0 e 1), all’assistenza ad alta dipendenza (livello 2) e all’ICU (livello 3).30 I dati includevano indicatori di bassa capacità di terapia intensiva, tra cui se la valutazione del reparto era durante il fine settimana (sabato o domenica), al di fuori dell’orario normale (dalle 19.00 alle 7.00), o al di fuori dei mesi invernali (da aprile a novembre).
Analisi statistica
Corrispondenza vicino all’autocarro
Abbiamo accoppiato pazienti con caratteristiche di base simili e abbiamo valutato i pazienti abbinati quando c’erano “molti” contro “pochi” posti letto disponibili in terapia intensiva, escludendo le coppie abbinate con una differenza di meno di 3 posti letto disponibili in terapia intensiva (eAppendice 1 nel supplemento).31 Questo algoritmo di corrispondenza quasi a distanza cercava di assicurare che i confonditori misurati fossero bilanciati e che lo strumento (disponibilità di letti per terapia intensiva) fosse forte (cioè, prevedeva il trasferimento in terapia intensiva).32,33,34,35 Per valutare la qualità delle partite, abbiamo riportato il bilancio covariato secondo le differenze medie standardizzate.
Abbiamo valutato se il disegno IV soddisfaceva i criteri essenziali di validità. In primo luogo, abbiamo calcolato la statistica parziale F per indicare la forza IV36 e ha scoperto che il numero di posti letto disponibili era altamente correlato con il trasferimento in terapia intensiva( statisticaF, 71). In secondo luogo, abbiamo trovato che i fattori di rischio di base misurati erano bilanciati in base al numero di posti letto disponibili in terapia intensiva (eFig. 1 nel supplemento).
Approccio alla stima degli effetti PeT utilizzando il IV Design
Abbiamo stimato che gli effetti medi di PeT tengono pienamente conto dell’eterogeneità e della confusione (eFigure 2, 3 e 4 nel Supplemento).17,18,19,37,38 Questo approccio IV riconosce che la decisione di trasferimento riflette fattori contestuali e pazienti non misurati e misurati. Abbiamo identificato i pazienti “marginali” per i quali il medico era in equipoise sulla decisione di trasferimento in base alle loro caratteristiche misurate (ad esempio, letti disponibili in terapia intensiva e punteggio fisiologico) e non misurate (ad esempio, la fragilità) (eFigure 2 nel supplemento) . Per questi pazienti, un piccolo cambiamento (o una piccola variazione (o una spinta) nel numero di posti letto disponibili in terapia intensiva (la IV) “fa aumentare l’equilibrio” per la decisione di trasferire il paziente in terapia intensiva, ma non modifica la distribuzione dei suoi fattori di rischio. Il confronto dei risultati per i pazienti definiti in base a piccole differenze nei letti disponibili per terapia intensiva fornisce una stima dell’effetto del trasferimento in terapia intensiva per pazienti simili. Ripetendo questo contrasto su un numero diverso di letti disponibili (la IV), stimiamo gli effetti del trattamento per insiemi di pazienti marginali con diverse combinazioni di confonditori (ad esempio, età e NEWS). Per ogni individuo, si ottiene un effetto PeT facendo la media degli effetti del trattamento per quei pazienti marginali che condividono le stesse caratteristiche osservate e non osservate in base alla scelta di trattamento osservata. Gli effetti PeT possono essere mediati su qualsiasi caratteristica del campione per formare un effetto medio a livello di sottogruppo.
Per l’illustrazione, la Figura 1 mostra 3 pazienti (P, Q e R) valutati per il trasferimento in terapia intensiva. Nel prendere la decisione di trasferimento, il medico considera l’esito atteso di ciascun paziente, riconoscendo la capacità del letto in terapia intensiva. Solo alcune delle informazioni che il medico utilizza per prendere questa decisione sono misurate e disponibili per lo studio (ad esempio, l’età e le NOTIZIE); altri fattori di confusione (ad esempio, la fragilità) non sono disponibili. In questo caso, il paziente Q ha una bassa propensione al trasferimento in base a caratteristiche non osservate e non viene trasferito, mentre il paziente R ha un’elevata propensione generale al trasferimento e viene trasferito. Con soli 2 letti disponibili(Figura 1A), il paziente P è definito marginale in quanto il medico è indifferente al trasferimento del paziente, che rimane nel reparto comune.
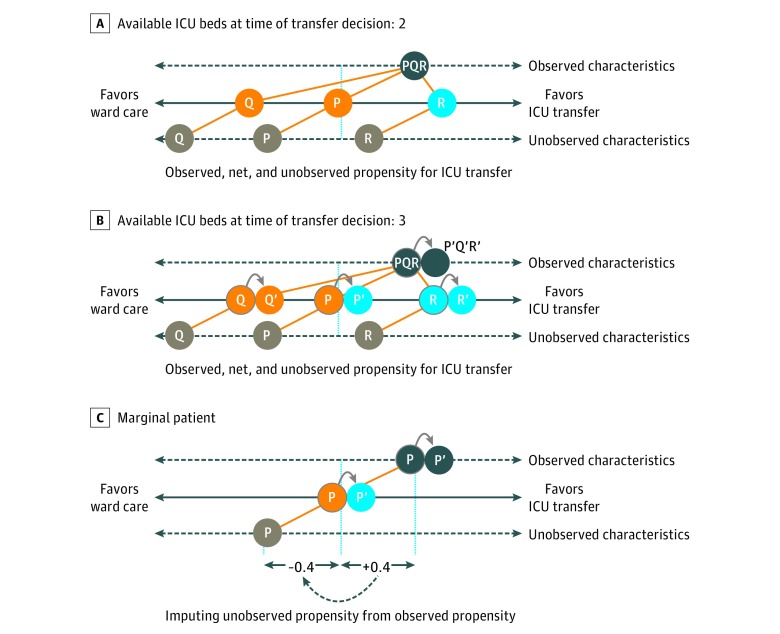
Figura 1.Essenza dell’approccio terapeutico centrato sulla personaLa propensione del paziente al trasferimento viene misurata in base alle caratteristiche osservate e non osservate. Tre pazienti (P, Q e R) condividono la stessa propensione secondo i fattori osservati. Tuttavia, la propensione al trasferimento in terapia intensiva (TI) secondo le caratteristiche non osservate è bassa per il paziente Q, bilanciata per il paziente P e alta per il paziente R. Un letto aggiuntivo influisce solo sulla decisione di trasferimento per P, il paziente “marginale”. A, il paziente P è marginale in quanto la propensione al trasferimento secondo le caratteristiche osservate e non osservate è bilanciata. Con 2 letti disponibili, il paziente marginale rimane nel reparto comune. B, La disponibilità di un letto aggiuntivo (3 letti) favorisce la decisione di trasferire il paziente marginale (P→P′). C, Per il paziente marginale, indichiamo la propensione al trasferimento in terapia intensiva secondo le caratteristiche non osservate come il negativo della propensione dovuta alle caratteristiche osservate. Per questo paziente marginale, l’effetto del trattamento viene stimato tenendo conto delle caratteristiche osservate e non osservate.
Con 3 letti per terapia intensiva disponibili(Figura 1B), il medico è invitato a raccomandare il trasferimento per il paziente P′. Utilizziamo queste informazioni sulla decisione di trasferimento per dedurre che, per i pazienti P e P′, i confonditori osservati e non osservati devono bilanciare esattamente. Utilizziamo questa intuizione per ricavare le distribuzioni delle caratteristiche non osservabili e i risultati di contrasto tra insiemi di pazienti marginali che vengono indirizzati (come il paziente P′) o allontanati (come il paziente P′) dal trasferimento in terapia intensiva in base al numero di letti disponibili. Contrapponendo gli esiti per insiemi alternativi di pazienti marginali in base ai diversi livelli di disponibilità dei letti, stimiamo gli effetti PeT per ogni paziente, tenendo conto della confusione e dell’eterogeneità non osservabili. Facciamo una media di questi singoli effetti PeT per ogni paziente attraverso i confonditori di interesse osservati per ricavare stime minimamente distorte dell’eterogeneità nell’efficacia del trasferimento in terapia intensiva.
L’approccio a livello di persona IV è stato implementato come segue. In primo luogo, abbiamo stimato la propensione di ciascun paziente al trasferimento in terapia intensiva in base alle caratteristiche osservate e al numero di letti disponibili per terapia intensiva. In secondo luogo, abbiamo utilizzato queste stime della propensione al trasferimento in terapia intensiva rispetto allo stato di trasferimento osservato per stimare la propensione “residua” di ciascun paziente marginale al trasferimento in base alle sue caratteristiche non osservate (Figura 1C). In terzo luogo, abbiamo utilizzato questa propensione stimata per il trasferimento in base a fattori non osservati per consentire una confusione non osservata quando si prevedono gli esiti dopo il trasferimento in terapia intensiva rispetto alle cure di reparto generali (eAppendice 5 nel Supplemento).
L’effetto PeT è stato definito per ogni paziente nei dati corrispondenti come la differenza nella sua mortalità prevista a 28 giorni con vs senza trasferimento in terapia intensiva. Questi effetti terapeutici stimati a livello di persona sono stati aggregati per riportare gli effetti stimolati del trasferimento in terapia intensiva su tutto il campione abbinato e per ogni sottogruppo di interesse prespecificato (età, NEWS, punteggio fisiologico ICNARC e punteggio SOFA) e per ogni misura fisiologica combinata con l’età. L’efficacia del trasferimento in terapia intensiva è stata riportata per i pazienti di 75 anni e più o meno di 75 anni21 per livelli di rischio di base bassi (<5), moderati (5 o 6) o alti (>6) secondo le NOTIZIE27 e per il punto finale secondario di mortalità a 90 giorni. Poiché sia l’esposizione che i risultati erano binari, per stimare gli effetti della PeT sono stati utilizzati modelli di regressione probit. L’efficacia del trasferimento in terapia intensiva è stata riportata come differenza media (95% di IC) nel rischio assoluto di morte.
Infine, abbiamo sviluppato un semplice modello predittivo (regressione logistica) per esaminare quali caratteristiche di base prevedessero l’entità della differenza di rischio assoluto stimato nella mortalità a 28 giorni (eAppendice 6 nel supplemento). Abbiamo definito l’entità del beneficio clinico come una differenza del 10% nella mortalità a 28 giorni.20 Tutti gli errori standard sono stati calcolati con un bootstrap non parametrico e sono stati ammessi per il clustering di individui all’interno degli ospedali, con inferenze condizionate ai dati corrispondenti. Le analisi dei dati sono state eseguite in R (versione 3.4.3; R Foundation for Statistical Computing) e in Stata (versione 14.1; StataCorp LP).

Figura 1.Essenza dell’approccio terapeutico incentrato sulla personaLa propensione del paziente al trasferimento viene misurata in base alle caratteristiche osservate e non osservate. Tre pazienti (P, Q e R) condividono la stessa propensione secondo i fattori osservati. Tuttavia, la propensione al trasferimento in terapia intensiva (TI) secondo le caratteristiche non osservate è bassa per il paziente Q, bilanciata per il paziente P e alta per il paziente R. Un letto aggiuntivo influisce solo sulla decisione di trasferimento per P, il paziente “marginale”. A, il paziente P è marginale in quanto la propensione al trasferimento secondo le caratteristiche osservate e non osservate è bilanciata. Con 2 letti disponibili, il paziente marginale rimane nel reparto comune. B, La disponibilità di letti aggiuntivi (3 letti) favorisce la decisione di trasferire il paziente marginale (P→P′). C, Per il paziente marginale, indichiamo la propensione al trasferimento in terapia intensiva secondo le caratteristiche non osservate come il negativo della propensione dovuta alle caratteristiche osservate. Per questo paziente marginale, l’effetto del trattamento viene stimato tenendo conto delle caratteristiche osservate e non osservate.
Analisi della sensibilità
Per verificare la solidità dei risultati rispetto a scelte alternative, abbiamo preso in considerazione modelli statistici alternativi, tra cui diverse forme funzionali (probit vs logit) per le equazioni di trattamento e di esito, l’inclusione vs esclusione di termini di ordine superiore per le misure di base continue, e termini di interazione tra ogni punteggio fisiologico. Abbiamo contrapposto queste stime con un approccio tradizionale per via endovenosa, con due minimi quadrati a due stadi, che riporta l’efficacia stimata per una sottopopolazione di pazienti in deterioramento,22 e ad un approccio regressivo che non si basa su un’impostazione che non assume alcun elemento di confusione non misurato (eAppendice 7 nel Supplemento).
Risultati
In totale sono stati valutati per il trasferimento in terapia intensiva 13-11 pazienti idonei, di cui 4994 (38,4%) sono stati trasferiti. Prima dell’abbinamento, i pazienti trasferiti in terapia intensiva erano, in media, più giovani, avevano più spesso una diagnosi di sepsi ed erano più gravemente malati (NEWS più alto, punteggio di fisiologia ICNARC e punteggio SOFA) (eTable 1 nel supplemento).
Tra i pazienti in degenza valutati per il trasferimento in terapia intensiva, l’algoritmo di corrispondenza vicino all’orecchio ha identificato 4596 coppie corrispondenti. Nel campione abbinato (N=9192), il 52,8% dei molti (mediana, 7) gruppi di letti in terapia intensiva erano maschi, e l’età media (SD) era di 65,2 (17,7) anni; il 53,3% dei pochi (mediana, 2) gruppi di letti in terapia intensiva erano maschi, e l’età media (SD) era di 65,0 (17,3) anni. Anche altre caratteristiche di base sono state ben bilanciate tra i gruppi di confronto(Tabella 1) e simili per i campioni confrontati rispetto a quelli non confrontati (eTable 2 nel supplemento).
| Variabile | Molti letti per terapia intensiva | Pochi letti per terapia intensiva | Differenza standardizzata |
|---|---|---|---|
| Numero di ingressi | 4596 | 4596 | NA |
| Numero di letti per terapia intensiva disponibili | |||
| Media (SD) | 7.64 (2.67) | 1.68 (1.13) | 2.905 |
| Mediana (gamma) | 7 (5-19) | 2 (0-3) | NA |
| Trasferimento in terapia intensiva, n. (%) | 1995 (43.4) | 1521 (33.1) | 0.213 |
| Età, media (SD), y | 65.23 (17.68) | 65.00 (17.35) | 0.013 |
| Maschio, n. (%) | 2426 (52.8) | 2448 (53.3) | −0.010 |
| Diagnosi di sepsi segnalata, n. (%) | 2868 (62.4) | 2873 (62.5) | −0.002 |
| Livello di assistenza CCMDS in visita, N. (%) | |||
| 0 | 496 (10.8) | 604 (13.1) | −0.072 |
| 1 | 3247 (70.6) | 3162 (68.8) | 0.040 |
| 2 | 755 (16.4) | 792 (17.2) | −0.022 |
| 3 | 54 (1.2) | 30 (0.7) | 0.055 |
| Manca | 44 (1.0) | 8 (0.2) | 0.105 |
| Periarrest, n. (%) | 233 (5.1) | 164 (3.6) | 0.074 |
| Punteggi fisiologici acuti, media (SD) | |||
| NOTIZIEa | 6.18 (3.12) | 6.28 (3.05) | −0.030 |
| Punteggio di fisiologia ICNARCb | 15.07 (7.40) | 15.23 (7.12) | −0.021 |
| Punteggio del DIVANOc | 3.14 (2.19) | 3.16 (2.15) | −0.011 |
| NOTIZIE classe di rischio, n. (%) | |||
| Nessuno | 117 (2.5) | 128 (2.8) | −0.015 |
| Basso | 1244 (27.1) | 1150 (25.0) | 0.047 |
| Medio | 1287 (28.0) | 1304 (28.4) | −0.008 |
| Alto | 1948 (42.4) | 2014 (43.8) | −0.029 |
| Ora di ammissione, n. (%) | |||
| Fine settimana | 1172 (25.5) | 1059 (23.0) | 0.057 |
| Al di fuori dell’orario di lavoro | 1549 (33.7) | 1649 (35.9) | −0.046 |
| Inverno | 960 (20.9) | 960 (20.9) | −0.000 |
Le stime di mortalità complessiva a 28 giorni erano del 23,2% (2090 decessi previsti) se tutti i pazienti abbinati sono stati trasferiti contro il 28,1% (2534 decessi previsti) se nessuno dei pazienti abbinati è stato trasferito, con una differenza di rischio stimata del -4,9% (95% IC, da -26,4% a 16,6%) (Tabella 2). L’approccio dei minimi quadrati a 2 stadi ha mostrato anche una minore mortalità a 28 giorni dopo il trasferimento in terapia intensiva (eTabella 3 nel Supplemento), mentre la regressione e gli approcci non aggiustati, che non hanno permesso di confondere i dati non osservati, hanno dimostrato che il trasferimento in terapia intensiva è stato associato ad un aumento della mortalità a 28 giorni(Tabella 2).
| Estimatore | Dimensione del campionea | Morti in terapia intensiva, n. (%)b | Morti di reparto generale, n. (%)b | Differenza di rischio, % (95% CI)c |
|---|---|---|---|---|
| IV (PeT, Probit) | 9015 | 2090 (23.2) | 2534 (28.1) | -4,9 (da -26,4 a 16,6) |
| IV (PeT, Logit) | 9015 | 2096 (23.2) | 2539 (28.2) | -4,9 (da -24,4 a 16,6) |
| Regressione | 9192 | 2594 (28.2) | 1914 (20.8) | 7,4 (da 5,0 a 9,8) |
| Non regolato | 9192 | 2915 (31.7) | 1715 (18.7) | 13,1 (11,2 a 14,9) |
Le differenze di rischio stimate da PeT in base alla gravità fisiologica variavano dal 3,7% (95% IC, -12,1% a 19,5%) per le NEWS da 0 a -25,4% (95% CI, -50,6% a -0,2%) per le NEWS di 19, con uno schema simile osservato secondo il punteggio fisiologico ICNARC di base o il punteggio SOFA (Figura 2 e eTable4 nel supplemento). Le differenze di rischio stimate per età variavano dal 7,7% (95% IC, -5,5% a 21,0%) per i 18-23 anni a -5,0% (95% IC, -26,5% a 16,6%) per i 72-77 anni (Figura 2e eTabella 4 nel Supplemento ). La differenza di rischio prevista dopo il trasferimento in terapia intensiva è stata del -10,1% (95% IC, da -33,2% a 13,0%) per coloro che sono stati effettivamente trasferiti e del 3,3% (95% IC, da -15,2% a 21,8%) per coloro che non lo sono stati (eTabella 4 e eFigure 3 nel Supplemento).
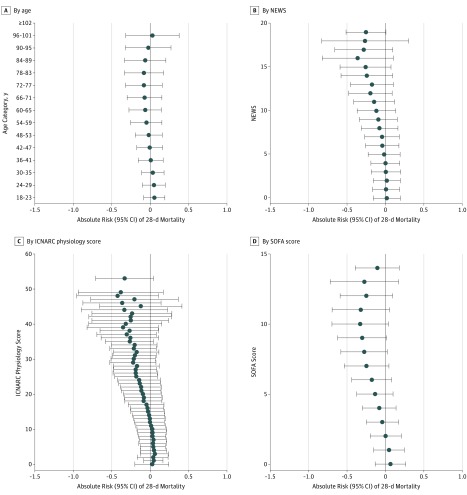
Figura 2.Figura 2. Stima degli effetti del trattamento centrato sulla persona del trasferimento in terapia intensiva rispetto alla terapia di reparto generale con mortalità di 28 giorniEffetti di trattamento centrato sulla persona per strati. Sono indicate riduzioni del rischio assoluto (95% di IC). Gli effetti eterogenei sono stimati per ogni individuo utilizzando il metodo di trattamento centrato sulla persona e poi aggregati per strati. Il National Health Service National Early Warning Score (NEWS) varia da 0 (meno grave) a 20 (più grave). Il punteggio fisiologico dell’ICNARC (Intensive Care National Audit & Research Centre) varia da 0 (meno grave) a 100 (più grave). Il punteggio della valutazione sequenziale dell’insufficienza d’organo (SOFA) varia da 0 (meno grave) a 14 (più grave).
Le differenze di rischio assoluto nella mortalità a 28 giorni dopo il trasferimento in terapia intensiva per i pazienti anziani (≥75 anni) sono state del -11,6% (95% IC, -39,0% a 15.8%) per i pazienti con NEWS elevate (>6), -4,8% (95% IC, da -30,5% a 20,9%) per i pazienti con NEWS moderate (5-6) e -1,0% (95% IC, da -24,8% a 22,8%) per i pazienti con NEWS basse (<5). Le stime per i sottogruppi corrispondenti di pazienti più giovani (<75 anni) erano -8,4% (95% IC, da -31,0% a 14,1%), -2,1% (95% IC, da -21,1% a 16,9%) e 1,4% (95% IC, da -14,5% a 17,4%) (eTabella 5 nel supplemento).
Lafigura 3 mostra che i pazienti per i quali si prevedeva una riduzione superiore al 10% del rischio assoluto di mortalità a 28 giorni erano quelli con un alto numero di NEWS (>7) al momento della valutazione, che avevano anche 60 anni e più. I pazienti che avevano previsto riduzioni del rischio tra lo 0% e il 10% avevano NEWS da 3 a 7 ed erano di 50 anni e più. I gruppi che avevano previsto una maggiore mortalità a 28 giorni dopo il trasferimento in terapia intensiva erano i pazienti più giovani (<60 anni), che avevano NEWS inferiori (<4) alla valutazione (eFigure 4 nel supplemento ).
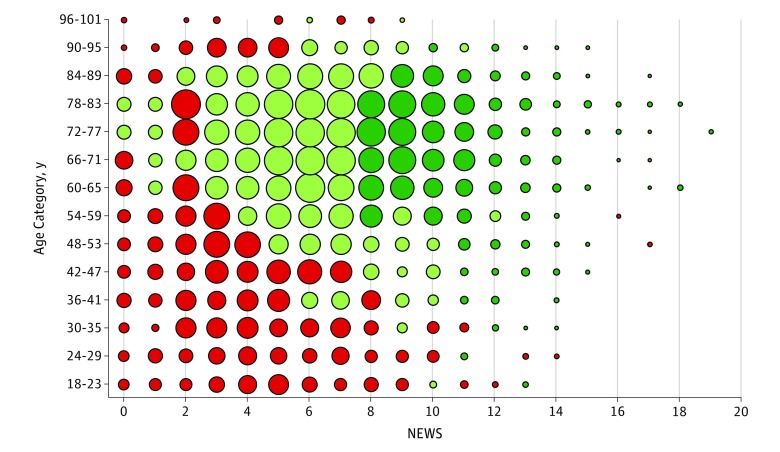
Figura 3.Figura 3. Grafico a bolle che mostra gli effetti terapeutici stimati del trasferimento in terapia intensiva contro il reparto di terapia generale a 28 giorni di mortalità, per categoria di età e NOTIZIEUn punteggio di Early Warning Score (NEWS) del Servizio Sanitario Nazionale (National Health Service National Early Warning Score) inferiore a 5 è considerato a basso rischio di mortalità a 28 giorni, da 5 a 6 come moderato e superiore a 6 come elevato. Il verde scuro indica livelli di riduzione del rischio assoluto superiori al 10%, il verde chiaro come riduzione del rischio dallo 0% al 10% e il rosso come aumento del rischio assoluto di mortalità a 28 giorni. Un punto più grande indica un numero maggiore di individui in quel sottogruppo.
Sono state valutate le caratteristiche di base associate alle riduzioni del rischio assoluto di mortalità a 28 giorni dopo il trasferimento in terapia intensiva di oltre il 10%. Queste caratteristiche includevano l’età, il sesso maschile, livelli di assistenza più elevati al momento della valutazione, il periarresto, un punteggio più alto di NEWS, il punteggio di fisiologia ICNARC e il punteggio SOFA, e i ricoveri durante l’orario di lavoro principale (dal lunedì al venerdì, dalle 9 alle 17) e non in inverno (eTable 6 e eTable 7 nel Supplemento).
I risultati complessivi di PeT per la mortalità a 90 giorni sono stati simili (eTabella 8 nel Supplemento), e lo stesso modello di eterogeneità era presente; i pazienti che si prevedeva avrebbero beneficiato maggiormente del trasferimento in terapia intensiva erano più anziani e più gravemente malati al momento della valutazione (eTabella 9 e eFigure 5 nel Supplemento). Le analisi supplementari hanno dimostrato che i risultati erano solidi rispetto alle modalità alternative di implementazione dell’approccio PeT (eTable 10 e eTable 11 nel supplemento). I risultati sono stati simili al punteggio fisiologico di base ICNARC o al punteggio SOFA (eFigure 4 e eFigure 5 nel Supplemento), così come se i pazienti che sono stati trasferiti più tardi (dopo 24 ore) o raccomandati per la terapia intensiva (livello 3) sono stati esclusi (eTable 12, eTable 13, eFigure 6, eFigure 7 nel Supplemento).

Figura 2.Figura 2. Stima degli effetti del trattamento centrato sulla persona del trasferimento in unità di terapia intensiva rispetto alla terapia di reparto generale con mortalità di 28 giorniEffetti di trattamento centrato sulla persona per strati. Sono indicate riduzioni del rischio assoluto (95% di IC). Gli effetti eterogenei sono stimati per ogni individuo utilizzando il metodo di trattamento centrato sulla persona e poi aggregati per strati. Il National Health Service National Early Warning Score (NEWS) varia da 0 (meno grave) a 20 (più grave). Il punteggio fisiologico dell’ICNARC (Intensive Care National Audit & Research Centre) varia da 0 (meno grave) a 100 (più grave). Il punteggio della valutazione sequenziale dell’insufficienza d’organo (SOFA) varia da 0 (meno grave) a 14 (più grave).

Figura 3.Figura 3. Grafico a bolle che mostra gli effetti terapeutici stimati del trasferimento di unità di terapia intensiva contro la terapia generale di reparto nei 28 giorni di mortalità, per categoria di età e NOTIZIEUn punteggio di Early Warning Score (NEWS) del Servizio Sanitario Nazionale (National Health Service National Early Warning Score) inferiore a 5 è considerato a basso rischio di mortalità a 28 giorni, da 5 a 6 come moderato e superiore a 6 come elevato. Il verde scuro indica livelli di riduzione del rischio assoluto superiori al 10%, il verde chiaro come riduzione del rischio dallo 0% al 10% e il rosso come aumento del rischio assoluto di mortalità a 28 giorni. Un punto più grande indica un numero maggiore di individui in quel sottogruppo.
Discussione
Questo approccio IV centrato sulla persona ha affrontato l’eterogeneità e la confusione secondo fattori non osservati e ha scoperto che i benefici del trasferimento in terapia intensiva aumentano con l’età e il punteggio di fisiologia. I pazienti con bassi punteggi fisiologici al momento della valutazione non sembravano beneficiare del trasferimento in terapia intensiva. I risultati dello studio aiutano a identificare quali pazienti beneficiano maggiormente del trasferimento in terapia intensiva e possono informare le future politiche di triage che mirano a fornire ulteriori benefici clinici nell’ambito dell’attuale capacità di terapia intensiva. Questi risultati mettono in discussione le raccomandazioni che si basano su stime dell’efficacia media del trasferimento in terapia intensiva; queste stime possono incoraggiare un’espansione insostenibile delle cure critiche20,21 o limitare l’accesso ai pazienti anziani, indipendentemente dal loro stato fisiologico.7
Il nostro approccio incentrato sul paziente suggerisce che l’età e la gravità fisiologica agiscono in sinergia per prevedere i probabili benefici e i danni derivanti dalle cure in terapia intensiva per i singoli pazienti. La constatazione che i benefici del trasferimento in terapia intensiva sono stati maggiori in quelli raccomandati per il trasferimento suggerisce che i medici stavano già personalizzando il loro approccio e il triage in base al probabile guadagno per i singoli pazienti (eFig. 3 nel supplemento). La nostra constatazione che il trasferimento in terapia intensiva è stato vantaggioso per i pazienti con un punteggio fisiologico più elevato al momento della valutazione amplia gli studi osservazionali precedenti20,21 dell’efficacia del trasferimento in terapia intensiva per i pazienti che hanno utilizzato un design tradizionale per via endovenosa. I risultati di questi studi precedenti si applicano solo a un sottocampione di pazienti, mentre il nostro approccio IV a livello di persona ha fornito stime complessive dell’effetto dell’assistenza in terapia intensiva che si applicano ai pazienti valutati per l’assistenza in terapia intensiva più in generale.
Una potenziale preoccupazione per la generalizzabilità dei risultati è che, nel Regno Unito, i bassi livelli di disponibilità di letti possono implicare che i pazienti considerati per il ricovero siano più gravemente malati rispetto ad altri paesi. Esistono pochi confronti internazionali sulla gravità della malattia, ma una meta-analisi a livello di paziente39 di terapia precoce orientata agli obiettivi (investigatori PRISM) ha riferito che il punteggio medio di Fisiologia acuta e valutazione della salute cronica II fisiologia alla randomizzazione era solo leggermente superiore nel Regno Unito (12; intervallo interquartile, 8-17) rispetto agli Stati Uniti (10; intervallo interquartile, 7-15). Inoltre, presentiamo stime dell’efficacia delle cure in terapia intensiva disaggregate secondo le misure di gravità dei casi comunemente usate per aiutare a informare il processo decisionale clinico in diversi contesti.
Punti di forza e limitazioni
Lo studio ha diversi punti di forza. In primo luogo, questo approccio IV sviluppato originariamente nella letteratura econometrica17,18 è stato in grado di identificare quali tipi di pazienti hanno beneficiato maggiormente del trasferimento in terapia intensiva. In secondo luogo, l’articolo ha ampliato lo studio precedentemente pubblicato20 che ha usato lo stesso disegno per via endovenosa affrontando l’eterogeneità interpaziente. In terzo luogo, lo studio riferisce che i risultati principali sono solidi per una batteria di ipotesi alternative, in particolare quelle alla base dell’approccio per via endovenosa.
Questo studio ha dei potenziali limiti. In primo luogo, le analisi IV sono notoriamente statisticamente inefficienti,40 ma l’approccio IV qui descritto ha dimostrato errori standard più piccoli intorno alle differenze di rischio assoluto rispetto ai metodi IV tradizionali. In secondo luogo, qualsiasi analisi di sottogruppo solleva una preoccupazione riguardo alle affermazioni spurie di rilevanza statistica. Pertanto, abbiamo prespecificato ipotesi su quali fattori di rischio sono stati anticipati per modificare l’effetto del trasferimento in terapia intensiva con la mortalità21 e ha sfruttato la ricca serie di misure di base disponibili dal database del Case Mix Programme di ICNARC. Ciononostante, sarebbero utili ulteriori ricerche per testare la replicazione di questi risultati.41 In terzo luogo, per assistere i futuri decisori clinici, abbiamo sviluppato un algoritmo di previsione del rischio. Sebbene l’algoritmo sia valido in base alle variabili che prevedono un aumento della mortalità da trasferimento in terapia intensiva superiore al 10%, esso merita di essere testato in altri contesti prima di poter essere considerato per l’uso nella pratica clinica di routine.
Conclusioni
A nostra conoscenza, questo è il primo studio che valuta il trasferimento in terapia intensiva con un metodo per via endovenosa che riconosce contemporaneamente l’eterogeneità del paziente e affronta la confusione per indicazione. I vantaggi del trasferimento in terapia intensiva sono stati maggiori per i pazienti più anziani e per i pazienti con livelli di gravità fisiologica più elevati al momento della valutazione. Questo approccio può contribuire a migliorare i risultati clinici derivanti da una limitata capacità di terapia intensiva informando le decisioni sul triage per la cura in terapia intensiva e può informare le mosse per personalizzare il processo decisionale clinico in modo più ampio.
References
- The status of intensive care medicine research and a future agenda for very old patients in the ICU. Intensive Care Med. 2017; 43(9)DOI | PubMed
- Admitting elderly patients to the intensive care unit: is it the right decision?. JAMA. 2017; 318(15):1443-1444. DOI | PubMed
- Critical care medicine beds, use, occupancy and costs in the United States: a methodological review. Crit Care Med. 2015; 43(11):2452-2459. DOI | PubMed
- Mortality among patients admitted to strained intensive care units. Am J Respir Crit Care Med. 2013; 188(7):800-806. DOI | PubMed
- Association between timing of intensive care unit admission and outcomes for emergency department patients with community-acquired pneumonia. Crit Care Med. 2009; 37(11):2867-2874. DOI | PubMed
- Survival of critically ill patients hospitalized in and out of intensive care. Crit Care Med. 2007; 35(2):449-457. DOI | PubMed
- Effect of systematic intensive care unit triage on long-term mortality among critically ill elderly patients in France: a randomized clinical trial. JAMA. 2017; 318(15):1450-1459. DOI | PubMed
- The Eldicus prospective, observational study of triage decision making in European intensive care units, part II: intensive care benefit for the elderly. Crit Care Med. 2012; 40(1):132-138. DOI | PubMed
- Rationing critical care beds: a systematic review. Crit Care Med. 2004; 32(7):1588-1597. DOI | PubMed
- Withholding or withdrawing of life-sustaining therapy in older adults (≥ 80 years) admitted to the intensive care unit. Intensive Care Med. 2018; 44(7):1027-1038. DOI | PubMed
- The future of precision medicine: potential impacts for health technology assessment. Pharmacoeconomics. 2018; 36(12):1439-1451. DOI | PubMed
- Personalized medicine and human genetic diversity. Cold Spring Harb Perspect Med. 2014; 4(9):a008581. DOI | PubMed
- The precision medicine initiative: a new national effort. JAMA. 2015; 313(21):2119-2120. DOI | PubMed
- Precision medicine for all? challenges and opportunities for a precision medicine approach to critical illness. Crit Care. 2017; 21(1):257. DOI | PubMed
- Implications of heterogeneity of treatment effect for reporting and analysis of randomized trials in critical care. Am J Respir Crit Care Med. 2015; 192(9):1045-1051. DOI | PubMed
- Are elderly patients with clinically localized prostate cancer overtreated? exploring heterogeneity in survival effects. Med Care. 2015; 53(1):79-86. DOI | PubMed
- Estimating person-centered treatment (PeT) effects using instrumental variables: an application to evaluating prostate cancer treatments. J Appl Econ (Chichester Engl). 2014; 29(4):671-691. DOI | PubMed
- Person-centered treatment (PeT) effects: individualized treatment effects using instrumental variables. Stata J. 2015;397. DOI
- Structural equations, treatment effects, and econometric policy evaluation. Econometrica. 2005; 73(3):669-738. DOI
- Impact on mortality of prompt admission to critical care for deteriorating ward patients: an instrumental variable analysis using critical care bed strain. Intensive Care Med.DOI | PubMed
- Association of intensive care unit admission with mortality among older patients with pneumonia. JAMA. 2015; 314(12):1272-1279. DOI | PubMed
- Analysis of observational studies in the presence of treatment selection bias: effects of invasive cardiac management on AMI survival using propensity score and instrumental variable methods. JAMA. 2007; 297(3):278-285. DOI | PubMed
- The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies. Ann Intern Med. 2007; 147(8):573-577. DOI | PubMed
- 2010. Publisher Full Text
- An examination of early transfers to the ICU based on a physiologic risk score. Manuf Serv Oper Manag. 2018; 20(3):531-549. DOI
- Association among ICU congestion, ICU admission decision, and patient outcomes. Crit Care Med. 2016; 44(10):1814-1821. DOI | PubMed
- National Early Warning Score (NEWS): Standardising the Assessment of Acute-Illness Severity in the NHS. The Royal College of Physicians: London, United Kingdom; 2012.
- A new risk prediction model for critical care: the Intensive Care National Audit & Research Centre (ICNARC) model. Crit Care Med. 2007; 35(4):1091-1098. DOI | PubMed
- The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. Intensive Care Med. 1996; 22(7):707-710. DOI | PubMed
- Guidelines for the Provision of Intensive Care Services. The Faculty of Intensive Care Medicine, The Intensive Care Society: London, United Kingdom; 2015.
- Stronger instruments and refined covariate balance in an observational study of the effectiveness of prompt admission to the ICU in the UK. J R Stat Soc Ser A.DOI
- The differential impact of delivery hospital on the outcomes of premature infants. Pediatrics. 2012; 130(2):270-278. DOI | PubMed
- Anesthesia technique, mortality, and length of stay after hip fracture surgery. JAMA. 2014; 311(24):2508-2517. DOI | PubMed
- Building a stronger instrument in an observational study of perinatal care for premature infants. J Am Stat Assoc. 2010; 105(492):1285-1296. DOI
- Near/far matching: a study design approach to instrumental variables. Health Serv Outcomes Res Methodol. 2012; 12(4):237-253. DOI | PubMed
- Identification and Inference for Econometric Models. Cambridge University Press: New York, NY; 2005. DOI
- Local instrumental variables and latent variable models for identifying and bounding treatment effects. Proc Natl Acad Sci U S A. 1999; 96(8):4730-4734. DOI | PubMed
- Nonlinear Statistical Modeling: Proceedings of the Thirteenth International Symposium in Economic Theory and Econometrics: Essays in Honor of Takeshi Amemiya. 2001. DOI
- Early, goal-directed therapy for septic shock: a patient-level meta-analysis. N Engl J Med. 2017; 376(23):2223-2234. DOI | PubMed
- Econometric Analysis of Cross Section and Panel Data. MIT Press; 2010.
- The proposal to lower P value thresholds to .005. JAMA. 2018; 319(14):1429-1430. DOI | PubMed
Fonte
Grieve R, O’Neill S, Basu A, Keele L, Rowan KM, et al. (2019) Analysis of Benefit of Intensive Care Unit Transfer for Deteriorating Ward Patients. JAMA Network Open 2(2): e187704. https://doi.org/10.1001/jamanetworkopen.2018.7704





