Abstract
Introduzione
L’estensione convergente (CE) è il motore morfogenetico evolutivo conservato che guida l’allungamento dell’asse corporeo negli animali che vanno dagli insetti ai mammiferi (Tada e Heisenberg, 2012). Comportamenti cellulari multipli possono contribuire a CE, ma il processo di gran lunga più ben compreso è l’intercalazione cellulare, con la quale le cellule si riorganizzano in modo polarizzato (Walck-Shannon e Hardin, 2014). L’intercalazione cellulare, a sua volta, si pensa che sia guidata da molteplici comportamenti subcellulari, tra cui l’estensione delle protrusioni cellulari mediolateralmente dirette (ad esempio [Keller e Hardin, 1987; Shih e Keller, 1992]) e il restringimento attivo delle giunzioni cellula-cellula mediolateralmente orientate (ad esempio [Bertet et al., 2004; Blankenship et al., 2006]). Dati più recenti suggeriscono che questi due comportamenti subcellulari probabilmente lavorano in concerto (Sun et al., 2017; Williams et al., 2014). La comprensione dei meccanismi molecolari che regolano l’attività protrusiva e la contrazione della giunzione durante l’intercalazione cellulare sarà essenziale per comprendere l’estensione convergente.
Il meccanismo di contrazione della giunzione per l’intercalazione cellulare è stato inizialmente descritto in Drosophila (Bertet et al., 2004; Blankenship et al., 2006) ed è stato successivamente identificato in entrambe le cellule epiteliali e mesenchimali nei vertebrati (Lienkamp et al., 2012; Nishimura et al., 2012; Shindo e Wallingford, 2014; Trichas et al., 2012; Williams et al., 2014). In tutti i tessuti esaminati per immagini dal vivo, la contrazione delle giunzioni è accompagnata da contrazioni di actomiosina pulsata che sono limitate o arricchite a giunzioni cellulari orientate mediolateralmente e assenti o meno comuni alle giunzioni perpendicolari all’asse anteriore-posteriore (Bertet et al., 2004; Blankenship et al., 2006; Shindo e Wallingford, 2014; Williams et al., 2014). Un’importante questione irrisolta riguarda il meccanismo molecolare attraverso il quale l’attività dell’actomiosina è limitata a specifiche giunzioni cellula-cellula durante l’intercalazione.
In Drosophila, i geni di coppia e i recettori di pedaggio sono regolatori cruciali dell’actomiosina polarizzata (Paré et al., 2014; Zallen e Wieschaus, 2004), ma i geni omologhi non sembrano essere coinvolti nei vertebrati. Invece, il regolatore più ben caratterizzato dell’intercalazione cellulare mediolaterale nei vertebrati è il sistema di segnalazione della polarità delle cellule planari (PCP) (Butler e Wallingford, 2017). Infatti, la segnalazione PCP controlla l’intercalazione cellulare durante la gastrulazione e la chiusura del tubo neurale in rane, pesci e topi, e le mutazioni nei geni PCP sono ora un fattore di rischio genetico ben definito per i difetti di nascita del tubo neurale umano (NTDs) (De Marco et al., 2014; Juriloff e Harris, 2012; Wallingford et al., 2013). La comprensione della segnalazione del PCP è quindi una sfida critica nella biologia cellulare dello sviluppo.
Un principio fondamentale della segnalazione PCP è che la polarità delle cellule è impartita dall’arricchimento asimmetrico delle proteine del nucleo PCP (Butler e Wallingford, 2017; Strutt e Strutt, 2009). Come mostrato per la prima volta in Drosophila, le proteine Prickle (Pk) e Van Gogh (Vangl) agiscono in concerto su un lato della cellula, e Dishevelled e Frizzled agiscono sul lato complementare (Axelrod, 2001; Bastock et al., 2003; Strutt, 2001; Tree et al., 2002). È interessante notare che gli studi FRAP in Drosophila hanno dimostrato che questi modelli di arricchimento sono guidati dalla polarizzazione planare della cinetica di rotazione giunzionale delle proteine PCP, sottolineando la natura dinamica del sistema di segnalazione del PCP (Strutt et al., 2011). Simili modelli di arricchimento e di turnover sono stati riportati in epiteli vertebrati (Butler e Wallingford, 2015; Chien et al., 2015; Shi et al., 2016), ma meno si sa sulla dinamica di localizzazione della proteina PCP durante l’intercalazione cellulare.
Ad esempio, i domini complementari e asimmetrici dell’arricchimento della proteina PCP sono stati descritti durante il vertebrato CE (Ciruna et al., 2006; Jiang et al., 2005; McGreevy et al., 2015; Ossipova et al., 2015; Roszko et al., 2015; Yin et al., 2008), ma come l’arricchimento della proteina PCP sia coordinato nello spazio e nel tempo con i comportamenti subcellulari che guidano l’intercalazione rimane essenzialmente inesplorato. Questa lacuna nelle nostre conoscenze è critica, perché lavori recenti dimostrano che le proteine PCP sono necessarie per i comportamenti di contrazione della giunzione che contribuiscono in modo critico all’intercalazione cellulare (Lienkamp et al., 2012; Nishimura et al., 2012; Shindo e Wallingford, 2014). Quindi, c’è un urgente bisogno di un quadro quantitativo e dinamico della localizzazione della proteina PCP in quanto si riferisce sia ai comportamenti subcellulari coinvolti nell’intercalazione cellulare che al macchinario dell’actomiosina che li guida.
A tal fine, abbiamo stabilito metodi per la quantificazione robusta della localizzazione della proteina PCP in una placca neurale di vertebrati viventi, nonché metodi per correlare la dinamica della proteina PCP con i comportamenti subcellulari che guidano l’intercalazione delle cellule epiteliali. Sorprendentemente, troviamo che, oltre ai modelli previsti di asimmetria spaziale, l’arricchimento della proteina PCP è strettamente legato al comportamento della giunzione cellula-cellula: Prickle2 (Pk2) e Vangl2 sono stati dinamicamente arricchiti in modo specifico a restringere le giunzioni cellula-cellula e impoverito da giunzioni allungate durante l’intercalazione cellulare. L’analisi FRAP ha rivelato che questi modelli di arricchimento rifletteva le differenze nella cinetica del turnover proteico in questi siti. Inoltre, l’arricchimento Pk2 era temporalmente e spazialmente correlato con le oscillazioni planari polarizzate di arricchimento actomiosinico giunzionale. È importante notare che tutte queste relazioni dinamiche sono state interrotte quando la segnalazione PCP è stata manipolata. Così, i nostri studi rivelano un intimo legame tra la localizzazione dinamica delle proteine del nucleo PCP, l’assemblaggio di actomiosina, e la contrazione della giunzione polarizzata durante l’intercalazione cellulare del tubo neurale vertebrato di chiusura.
Risultati
Abbiamo caratterizzato la dinamica della proteina PCP nella piastra neurale di Xenopus, come gli studi in questo animale prefigurano costantemente risultati simili in sistemi di mammiferi, ma forniscono una visione eccezionale dei processi biologici cellulari dinamici. Poiché la funzione scompigliata e frizzante sia nella segnalazione PCP che in quella canonica Wnt, i loro ruoli sono più difficili da interrogare, ci siamo concentrati invece su Prickle e Vangl, che agiscono esclusivamente nella segnalazione PCP e sono necessari per la chiusura del CE e del tubo neurale nei vertebrati, incluso lo Xenopus (Darken et al., 2002; Goto et al., 2005; Goto e Keller, 2002; Kibar et al., 2001; Takeuchi et al., 2003). I lavori precedenti suggeriscono che Prickle e Vangl si localizzano sulla faccia anteriore delle cellule della placca neurale di Xenopus (Ossipova et al., 2015), ma abbiamo cercato di stabilire una quantificazione più robusta di questo modello come base per gli studi time-lapse descritti di seguito.
Abbiamo usato l’iniezione di mRNA per esprimere le fusioni della proteina fluorescente (FP) alle proteine PCP nello Xenopus. Poiché la sovraespressione delle proteine PCP ha un effetto ben documentato sulla segnalazione PCP, abbiamo usato esperimenti di titolazione per determinare empiricamente la più bassa dose possibile di mRNA che ha permesso l’imaging nella piastra neurale di Xenopus. In queste condizioni, GFP-Vangl2 ha mostrato una forte polarizzazione asimmetrica alle facce delle cellule anteriori (Figura 1A), mentre a dosi leggermente più elevate di mRNA iniettato, bassi livelli di Vangl2 potrebbe essere osservato alle facce posteriori pure (non mostrato), coerente con i rapporti precedenti (Ossipova et al., 2015; Roszko et al., 2015). Le proteine del nucleo PCP sono codificate da famiglie multigene, e nonostante il ruolo riportato di Prickle1 nell’estensione convergente, GFP-Pk1 non ha mostrato un arricchimento asimmetrico nelle nostre mani (non mostrato). Tuttavia, GFP-Prickle2 (Butler e Wallingford, 2015) è stato fortemente arricchito anteriormente (Figura 1A). GFP-Pk2 è stato anche limitato alle regioni giunzionali delle cellule apicolaterali, come previsto (Figura 1-figure supplement 1). Esperimenti Knockdown ha confermato che Pk2 era fisiologicamente rilevante per l’estensione convergente e la chiusura del tubo neurale in Xenopus (Figura 1-figure supplemento 2). Negli esperimenti di doppia etichettatura, GFP-Vangl2 fortemente co-localizzato con RFP-Pk2 (Figura 1A, Video 1).
Figura 1-figure supplemento 3.Figura 1—supplemento figura 3. Planare polarizzata localizzazione di Prickle2 e Vangl2 nella piastra neurale.GFP-Pk2 localizza alle regioni apicolaterali anteriori delle cellule nella piastra neurale Xenopus.Pk2 knockdown risultati in fenotipi embrionali estensione convergente.un dominante negativo Pk2 Pk2 disturba l’estensione convergente.(A) Epitelio neurale mosaico etichettato con GFP-Vangl2, RFP-Pk2, e membranaBFP che mostra le localizzazioni sovrapposte di Pk2 e Vangl2. Anteriore è in alto, e scala = 10 µm. (B) Grafico tracciando GFP-Pk2 intensità GFP-Pk2 lungo V-giunzioni (0-45 ° rispetto all’asse mediolaterale) e T-giunzioni (46-90 ° rispetto all’asse mediolaterale) normalizzato come rapporto alla media intensità citoplasmatica nelle cellule di controllo e le cellule che esprimono Xdd1 e Pk2-ΔPΔL. Le barre di errore rappresentano la deviazione standard. Ctrl V vs. T, p<0,0001***; Xdd1 V vs. T, p=0,5799; Pk2-ΔPΔL V vs. T, p=0,173; Ctrl V vs. Xdd1 T, p=0,5770; Ctrl T vs. Pk2-ΔPΔL V, p=0,0268 (test di Mann Whitney per la significatività). n = 101 V e 71 T da tre esperimenti, sette embrioni (Ctrl); n = n = 171 V e 199 T da quattro esperimenti, cinque embrioni (Xdd1); n = 128 V e 142 T da tre esperimenti, sette embrioni (Pk2-ΔPΔL). (C) Le distribuzioni dei dati mostrati in (B) tracciate contro l’angolo della giunzione a cui è stata misurata l’intensità. Coefficienti di correlazione per Xdd1 e Pk2-ΔPΔL erano significativamente diversi dai controlli che utilizzano la trasformazione Fischer R-to-Z. n = 172 giunzioni (Controllo), n = 263 giunzioni (Xdd1) e n = 245 giunzioni (Pk2-ΔPΔL) (D-E) Immagini confocali di epiteli neurali di Xenopus etichettati in modo uniforme con GFP-Pk2 e membraneBFP e mosaici con H2B-RFP, che servono come tracciante per l’espressione Xdd1 (C) o Pk2-ΔPΔL (D). Scala = 10 µm.Pseudo 3D rendering di epitelio neurale mosaico di epitelio etichettato con GFP-Pk2 e membraneRFP che mostra Pk2 limitato alle regioni apicolaterali anteriori.(A) Vista dorsale: immagini stereoscopiche di un embrione di controllo rappresentativo dello Stadio 20, un embrione che è stato iniettato dorsalmente con 25 ng Pk2 morfolino, un embrione che ha ricevuto morfolino più una dose di salvataggio di 400 pg GFP-Pk2 mRNA, e un embrione che ha ricevuto solo i 400 pg Pk2 mRNA. La parte anteriore è in alto. (B) Grafico della distanza tra le pieghe neurali allo stadio 20. n = 8 (Controllo), 14 (Pk2 KD), 8 (Salvataggio), 9 (RNA/OE). Controllo vs. KD, p<0,0001; vs. Rescue, p=0,0019; vs. OE, p=0,0079. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard. (C) Immagini di espianti della zona marginale dorsale (DMZ) sezionati da embrioni dello stadio 11.5 degli embrioni trattati nelle stesse condizioni di (A). (D) Grafico della lunghezza dell’espianto DMZ in un momento in cui gli embrioni non sezionati avevano raggiunto lo stadio 20. n = 19 (Controllo), 19 (Pk2 KD), 16 (Salvataggio), 4 (RNA/OE). Controllo vs. KD, p<0,0001; vs. Rescue, p=0,0010; vs. OE, p=0,0041. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard. (E) Immagini rappresentative degli embrioni dello stadio 30 che hanno ricevuto 30 ng Pk2 morfolino, morfolino più 400 pg di salvataggio GFP-Pk2 mRNA, o controlli che non hanno ricevuto nessuno dei due. La parte anteriore è a sinistra e la dorsale è in alto. (F) Grafico della lunghezza della lunghezza dorsale embrionale degli embrioni rappresentati da quelli mostrati in (E). n = 35 (Controllo), n = 37 (Pk2 KD), n = 44 (Salvataggio). Controllo vs. KD, p<0,0001; vs. Rescue, p<0,0001. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard.(A-B) Immagini stereo di un embrione di controllo stadio 30 stadio (A) e clutchmate dorsalmente esprimere Pk2-ΔPΔL (B) che non è riuscito a estendere correttamente l’asse del corpo.

Video 1.Immagini confocali time-lapse di una lastra neurale di Xenopus laevis etichettata a mosaico con GFP-Vangl2 (a sinistra), RFP-Pk2 (al centro), e memBFP (a destra, fusa con i canali GFP-Vangl2, RFP-Pk2, e DIC).Le immagini fisse e la scala sono mostrate in Figura 1A.
Abbiamo quantificato questi modelli di localizzazione a livello di popolazione, raggruppando le giunzioni cellula-cellula in due gruppi in base al loro orientamento. Per mantenere una nomenclatura coerente con il lavoro precedente sull’intercalazione cellulare, ci riferiamo a giunzioni allineate entro 45 gradi dell’asse mediolaterale come ‘giunzioni a V’ e le giunzioni perpendicolari (tra 45 e 90 gradi fuori dall’asse mediolaterale) come ‘giunzioni a T’. Un’importante sottigliezza da notare qui è che le giunzioni a V sono mediolateralmente allineate, ma in realtà separano le cellule che sono vicine anteroposteriori. Abbiamo trovato che GFP-Pk2 è stato significativamente arricchito a V-giunzioni rispetto a T-giunzioni (Figura 1B). In una visione più granulare dei dati, abbiamo osservato una correlazione significativa tra l’intensità dei pixel GFP-Pk2 e l’angolo di giunzione, con un maggiore arricchimento lungo giunzioni più mediolateralmente orientate (Figura 1C).
Per testare questi schemi di quantificazione, abbiamo approfittato del fatto che in molti altri sistemi, l’interruzione di una qualsiasi proteina PCP del nucleo porta alla perdita di arricchimento polarizzato degli altri. Abbiamo usato l’iniezione mirata per coesprimere i reagenti per l’interruzione della segnalazione del PCP insieme ad un tracciante di lignaggio RFP nucleare, permettendoci di confrontare le cellule normali e quelle sperimentali nello stesso embrione (Figura 1D,E). Xdd1 è un ben definito, PCP-specifico negativo dominante di Dvl2 (Sokol, 1996; Wallingford et al., 2000) che perturba l’estensione convergente del tubo neurale in Xenopus (Wallingford e Harland, 2001; Wallingford e Harland, 2002); abbiamo trovato che Xdd1 espressione gravemente perturbato asimmetrie Prickle2 asimmetrie nella piastra neurale utilizzando sia ensemble e metriche individuali (Figura 1B,C).
Per estendere questa analisi, abbiamo esplorato la segnalazione Pk2 esprimendo un costrutto di cancellazione privo dei domini PET e LIM (Pk2-ΔPΔL), in quanto questo costrutto ha interrotto il PCP nelle cellule multiciliate di Xenopus e una cancellazione equivalente di Pk1 interrompe il CE (Butler e Wallingford, 2015; Takeuchi et al., 2003). Abbiamo trovato che Pk2-ΔPΔL fortemente perturbato l’allungamento dell’asse in Xenopus (Figura 1-figure supplement 3) e anche gravemente perturbato l’asimmetria planare di co-espresso wild-type Pk2-GFP nella piastra neurale (Figura 1B,C). Questi risultati stabiliscono la piastra neurale di Xenopus come una piattaforma efficace e quantitativa per gli studi di localizzazione della proteina PCP.

Figura 1-figure supplement 3.Figura 1. Planare polarizzata localizzazione polarizzata di Prickle2 e Vangl2 nella piastra neurale.GFP-Pk2 localizza alle regioni apicolaterali anteriori delle cellule nella piastra neurale Xenopus.Pk2 knockdown risultati in fenotipi embrionali estensione convergente.A dominante negativo Pk2 disturba l’estensione convergente Pk2.(A) Epitelio neurale mosaico etichettato con GFP-Vangl2, RFP-Pk2, e membranaBFP che mostra le localizzazioni sovrapposte di Pk2 e Vangl2. Anteriore è in alto, e scala = 10 µm. (B) Grafico tracciando GFP-Pk2 intensità GFP-Pk2 lungo V-giunzioni (0-45 ° rispetto all’asse mediolaterale) e T-giunzioni (46-90 ° rispetto all’asse mediolaterale) normalizzato come rapporto alla media intensità citoplasmatica nelle cellule di controllo e le cellule che esprimono Xdd1 e Pk2-ΔPΔL. Le barre di errore rappresentano la deviazione standard. Ctrl V vs. T, p<0,0001***; Xdd1 V vs. T, p=0,5799; Pk2-ΔPΔL V vs. T, p=0,173; Ctrl V vs. Xdd1 T, p=0,5770; Ctrl T vs. Pk2-ΔPΔL V, p=0,0268 (test di Mann Whitney per la significatività). n = 101 V e 71 T da tre esperimenti, sette embrioni (Ctrl); n = n = 171 V e 199 T da quattro esperimenti, cinque embrioni (Xdd1); n = 128 V e 142 T da tre esperimenti, sette embrioni (Pk2-ΔPΔL). (C) Le distribuzioni dei dati mostrati in (B) tracciate contro l’angolo della giunzione a cui è stata misurata l’intensità. Coefficienti di correlazione per Xdd1 e Pk2-ΔPΔL erano significativamente diversi dai controlli che utilizzano la trasformazione Fischer R-to-Z. n = 172 giunzioni (Controllo), n = 263 giunzioni (Xdd1) e n = 245 giunzioni (Pk2-ΔPΔL) (D-E) Immagini confocali di epiteli neurali di Xenopus etichettati in modo uniforme con GFP-Pk2 e membraneBFP e mosaici con H2B-RFP, che servono come tracciante per l’espressione Xdd1 (C) o Pk2-ΔPΔL (D). Scala = 10 µm.Pseudo 3D rendering di epitelio neurale mosaico di epitelio etichettato con GFP-Pk2 e membraneRFP che mostra Pk2 limitato alle regioni apicolaterali anteriori.(A) Vista dorsale: immagini stereoscopiche di un rappresentante Fase 20 embrione di controllo rappresentativo, un embrione che è stato iniettato dorsalmente con 25 ng Pk2 morfolino Pk2, un embrione che ha ricevuto morfolino più una dose di salvataggio 400 pg GFP-Pk2 mRNA, e un embrione che ha ricevuto solo i 400 pg Pk2 mRNA. La parte anteriore è in alto. (B) Grafico della distanza tra le pieghe neurali allo stadio 20. n = 8 (Controllo), 14 (Pk2 KD), 8 (Salvataggio), 9 (RNA/OE). Controllo vs. KD, p<0,0001; vs. Rescue, p=0,0019; vs. OE, p=0,0079. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard. (C) Immagini di espianti della zona marginale dorsale (DMZ) sezionati da embrioni dello stadio 11.5 degli embrioni trattati nelle stesse condizioni di (A). (D) Grafico della lunghezza dell’espianto DMZ in un momento in cui gli embrioni non sezionati avevano raggiunto lo stadio 20. n = 19 (Controllo), 19 (Pk2 KD), 16 (Salvataggio), 4 (RNA/OE). Controllo vs. KD, p<0,0001; vs. Rescue, p=0,0010; vs. OE, p=0,0041. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard. (E) Immagini rappresentative degli embrioni dello stadio 30 che hanno ricevuto 30 ng Pk2 morfolino, morfolino più 400 pg di salvataggio GFP-Pk2 mRNA, o controlli che non hanno ricevuto nessuno dei due. La parte anteriore è a sinistra e la dorsale è in alto. (F) Grafico della lunghezza della lunghezza dorsale embrionale degli embrioni rappresentati da quelli mostrati in (E). n = 35 (Controllo), n = 37 (Pk2 KD), n = 44 (Salvataggio). Controllo vs. KD, p<0,0001; vs. Rescue, p<0,0001. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard.(A-B) Immagini stereo di un embrione di controllo stadio 30 (A) e clutchmate che esprime dorsalmente Pk2-ΔPΔL (B) che non è riuscito a estendere correttamente l’asse del corpo.

Figura 1-figure supplemento 1.GFP-Pk2 localizza alle regioni apicolaterali anteriori delle cellule nella piastra neurale Xenopus.Pseudo 3D rendering di epitelio neurale mosaico etichettato con GFP-Pk2 e membraneRFP che mostra Pk2 limitato alle regioni apicolaterali anteriori.
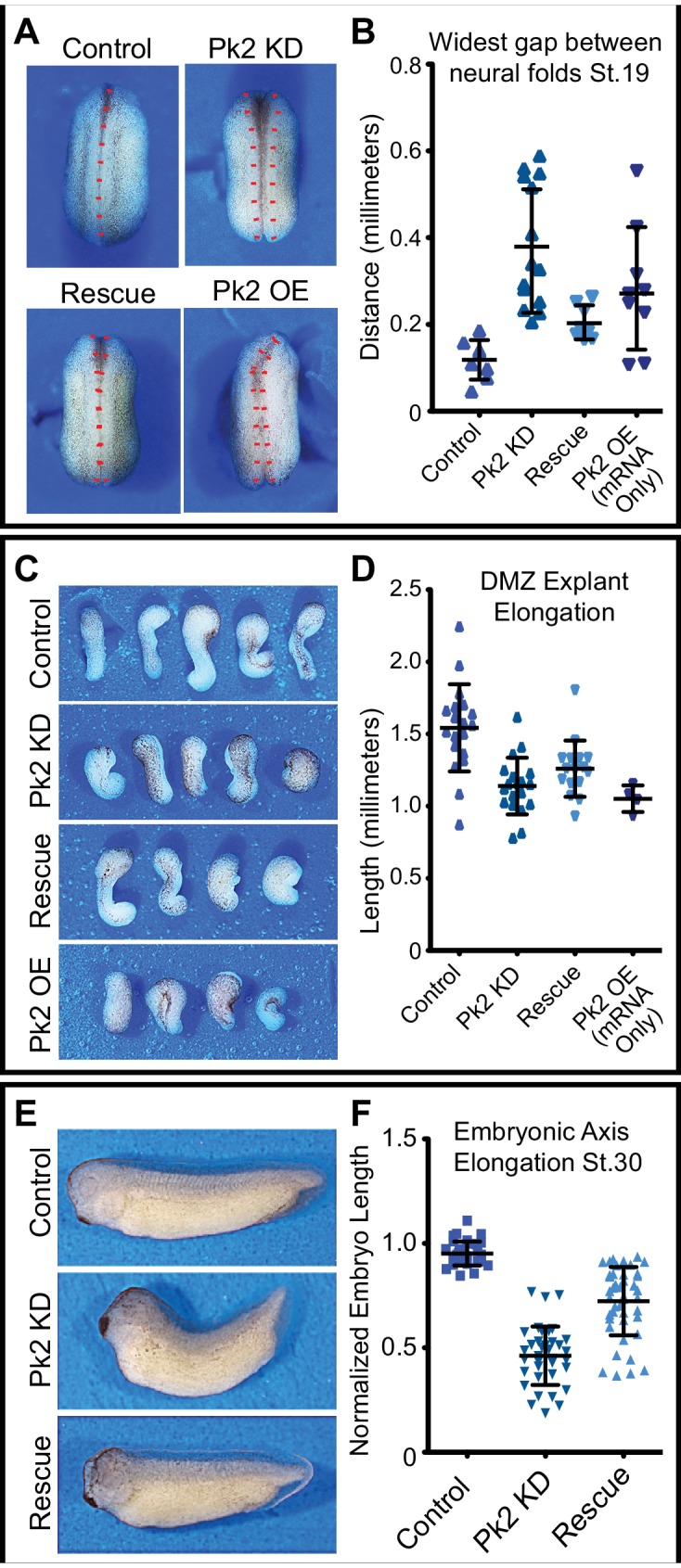
Figura 1-figure supplemento 2.Pk2 knockdown risultati in fenotipi di estensione embrionale convergenti.(A) Vista dorsale: immagini stereoscopiche di un rappresentante Fase 20 embrione di controllo rappresentativo, un embrione che è stato iniettato dorsalmente con 25 ng Pk2 morfolino, un embrione che ha ricevuto morfolino più una dose di salvataggio 400 pg GFP-Pk2 mRNA, e un embrione che ha ricevuto solo i 400 pg Pk2 mRNA. La parte anteriore è in alto. (B) Grafico della distanza tra le pieghe neurali allo stadio 20. n = 8 (Controllo), 14 (Pk2 KD), 8 (Salvataggio), 9 (RNA/OE). Controllo vs. KD, p<0,0001; vs. Rescue, p=0,0019; vs. OE, p=0,0079. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard. (C) Immagini di espianti della zona marginale dorsale (DMZ) sezionati da embrioni dello stadio 11.5 degli embrioni trattati nelle stesse condizioni di (A). (D) Grafico della lunghezza dell’espianto DMZ in un momento in cui gli embrioni non sezionati avevano raggiunto lo stadio 20. n = 19 (Controllo), 19 (Pk2 KD), 16 (Salvataggio), 4 (RNA/OE). Controllo vs. KD, p<0,0001; vs. Rescue, p=0,0010; vs. OE, p=0,0041. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard. (E) Immagini rappresentative degli embrioni dello stadio 30 che hanno ricevuto 30 ng Pk2 morfolino, morfolino più 400 pg di salvataggio GFP-Pk2 mRNA, o controlli che non hanno ricevuto nessuno dei due. La parte anteriore è a sinistra e la dorsale è in alto. (F) Grafico della lunghezza della lunghezza dorsale embrionale degli embrioni rappresentati da quelli mostrati in (E). n = 35 (Controllo), n = 37 (Pk2 KD), n = 44 (Salvataggio). Controllo vs. KD, p<0,0001; vs. Rescue, p<0,0001. (Test di Mann-Whitney per il significato). Le barre di errore rappresentano la deviazione standard.

Figura 1-figure supplemento 3.Una dominante negativa Pk2 Pk2 disturba l’estensione convergente.(A-B) Immagini stereo di un embrione di controllo stadio 30 stadio (A) e clutchmate dorsalmente esprimere Pk2-ΔPΔL (B) che non è riuscito a estendere correttamente l’asse del corpo.

Video 1.Immagini confocali time-lapse di una piastra neurale di Xenopus laevis etichettata a mosaico con GFP-Vangl2 (a sinistra), RFP-Pk2 (al centro), e memBFP (a destra, fusa con i canali GFP-Vangl2, RFP-Pk2, e DIC).Le immagini fisse e la scala sono mostrate nella Figura 1A.
Estensione epiteliale convergente nella chiusura del tubo neurale di Xenopus Xenopus comporta la contrazione della giunzione polarizzata dipendente dal PCP
L’estensione convergente è un processo intrinsecamente dinamico, in quanto le cellule si scambiano costantemente i vicini. La natura dinamica dei tessuti impegnati nell’estensione convergente differisce notevolmente dalle impostazioni in cui la localizzazione della proteina PCP è più comunemente studiata. Abbiamo quindi cercato di sfruttare i punti di forza degli embrioni di Xenopus per la dinamica della proteina PCP immagine insieme con i comportamenti subcellulari che guidano l’estensione convergente nel tubo neurale di chiusura. Curiosamente, la piastra neurale di Xenopus è costituito da due strati cellulari, uno strato epiteliale esterno e uno strato mesenchimale più profondo (Schroeder, 1970). Mentre l’intercalazione cellulare delle cellule mesenchimali profonde è stato caratterizzato (Elul et al., 1997; Keller et al., 1992), i comportamenti delle cellule epiteliali sovrastanti non hanno. Questa distinzione non è banale, perché sono le cellule epiteliali esterne che mostrano i modelli robusti di localizzazione della proteina PCP descritti sopra. Per capire come la localizzazione della proteina PCP si riferisce ai comportamenti convergenti delle cellule di estensione, abbiamo dovuto prima di tutto caratterizzare i comportamenti delle cellule in questo epitelio.
La chiusura del tubo neurale si estende per circa 6 ore in Xenopus, a partire dalla modellazione del tubo neurale in fase di ultima gastrula, seguita dalla progressiva elevazione e l’applicazione delle pieghe neurali (Figura 2A). Abbiamo immobilizzato gli embrioni in uno stadio di microscopio confocale (Kieserman et al., 2010) e abbiamo usato la piastrellatura delle immagini per raccogliere immagini ad alta ingrandimento della piastra neurale superficiale attraverso l’intera chiusura del tubo neurale (Video 2). Questo approccio ha permesso di valutare i cambiamenti morfogenetici a livello tissutale nella placca neurale, così come le traiettorie delle singole cellule, che assomigliavano molto a quelle degli studi precedenti ((Figura 2B; Figura 2-figure supplement 1) e vedi [Keller et al., 1992]). Inoltre, il nostro approccio di piastrellatura ha fornito un ingrandimento sufficiente a quantificare i comportamenti discreti delle singole cellule, e il tracciamento dei cluster di cellule ha rivelato ampie intercalazioni che erano mediolateralmente di parte, con conseguente convergenza ed estensione (Figura 2C, Video 3).
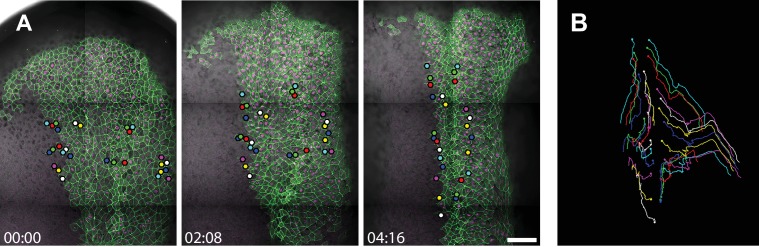
Figura 2-figure supplemento 1.2. High-magnification time-lapse imaging di estensione convergente nel tubo neurale di chiusura Xenopus.imaging in vivo di traiettorie delle cellule nel tubo neurale di chiusura.(A) Immagini stereo da un filmato time-lapse della morfogenesi del tubo neurale di Xenopus da fasi 12 a 19. (B) alambicchi da time-lapse immagine confocale del lato dorsale di un embrione dalle fasi 12 a 16. Le cellule etichettate con membraneGFP e H2B-RFP nucleare sono fuse con l’immagine DIC dello stesso embrione. Le immagini sono mostrate a ~ 2 ore di distanza l’una dall’altra (intervallo di 128 min.). Scala = 200 µm. (C) Immagini ad alto ingrandimento di riarrangiamenti cellulari in ectoderma neurale dal time-lapse mostrato in (B). Etichettatura delle singole cellule con punti colorati attraverso punti di tempo dimostra i riarrangiamenti cellulari che contribuiscono al restringimento e l’allungamento dei tessuti e transizioni T etichettati con magenta per il restringimento (T1-T2) e ciano per la crescita (T2-T3) giunzioni. Scala = circa 20 µm.Tre immagini fisse successive dal filmato time-lapse mostrate in Figura 2 e Video 1 con un sottoinsieme di cellule etichettate con membraneGFP e H2B-RFP che vengono tracciate. Scala = 200 µm. Il pannello all’estrema destra mostra le traiettorie complessive delle cellule tracciate attraverso la durata dell’intervallo di tracciamento (4 ore, 16 min).

Video 2.Immagini confocali time-lapse del lato dorsale di un embrione di Xenopus laevis dalle fasi 12 a 16.Le cellule etichettate con membraneGFP e H2B-RFP nucleare sono fuse con l’immagine DIC dello stesso embrione. Immagini fisse e scala sono mostrati in Figura 2B.

Video 3.Immagini confocali time-lapse del lato dorsale di un embrione di Xenopus laevis dagli stadi 12 a 16.Cellule etichettate con membraneGFP e pseudo-colorate per aiutare a tenere traccia dei riarrangiamenti cellulari durante l’estensione convergente neurale. Immagini fisse e la scala sono mostrati in Figura 2C.
Intercalazioni cellulari nella piastra neurale sono stati associati con le cosiddette transizioni T, che sono caratterizzati da contrazione preferenziale di giunzioni allineate nell’asse mediolaterale (T1-T2 transizione) (Figura 3A, a” ), seguita da allungamento di nuove giunzioni perpendicolarmente lungo l’asse anteroposteriore (T2-T3 transizione) (Figura 3a‘, a”’ ) (Bertet et al., 2004). Come sopra, abbiamo prima quantificato questi comportamenti a livello di insieme e abbiamo trovato che mediolateralmente orientato V-giunzioni orientate preferibilmente si è ridotto, mentre la perpendicolare T-giunzioni allungata (Figura 3B). Inoltre, quando abbiamo tracciato la variazione della lunghezza delle giunzioni cellula-cellula contro l’angolo medio di tale giunzione per tutte le cellule esaminate (n > 250), abbiamo osservato una correlazione significativamente positiva; le giunzioni a V si sono preferibilmente ristrette lungo l’asse mediolaterale e le giunzioni a T allungate perpendicolarmente (Figura 3C). È importante notare che l’orientamento delle giunzioni che si restringono e crescono in questa analisi è rimasto abbastanza costante, cambiando in media solo 5 (±4) gradi nel corso della misurazione, e nessuna giunzione spostata di più di 20 gradi. Così, in generale, le giunzioni a V separano i vicini anteroposteriori (AP) e le giunzioni a T separano i mediolaterali (ML). Infine, abbiamo anche osservato la formazione planare polarizzata e la risoluzione delle rosette multicellulari (Figura 3D-F), come sono stati descritti in altri epiteli (Blankenship et al., 2006; Lienkamp et al., 2012; Trichas et al., 2012).
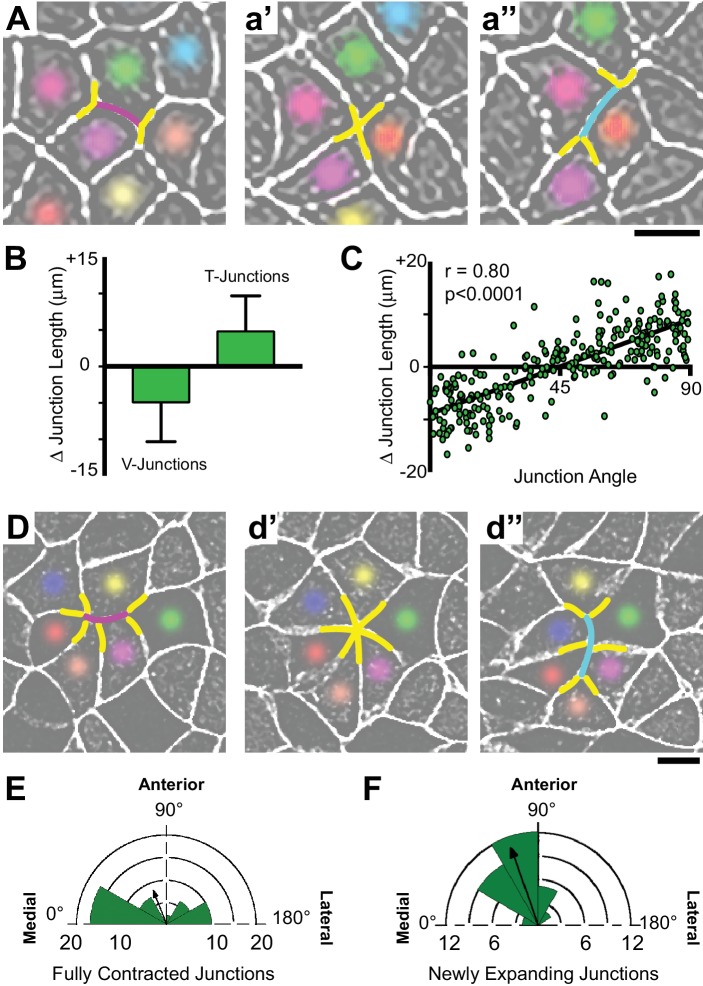
Figura 3.Figura 3. La dinamica della giunzione apicale polarizzata facilita le intercalazioni delle cellule mediolaterali.(A) Immagini confocali della dinamica di giunzione nella piastra neurale Xenopus epitelio Xenopus etichetta con membranaGFP. Linee di magenta segnano il restringimento di una giunzione a V durante una transizione T; dopo il completo restringimento mediolaterale (T1-T2) (a’ ), una nuova giunzione (ciano) si allunga perpendicolarmente lungo l’asse AP (T2-T3) (a” ). Scala = circa 20 µm. (B) Grafico che mostra la variazione media (±s.d.) della lunghezza delle giunzioni a V e a T. (C) Grafico degli angoli medi delle giunzioni oltre 1800 s rispetto alla variazione della lunghezza della giunzione. Ogni punto rappresenta sulla giunzione cellula-cellula. n = 267 giunzioni da tre embrioni attraverso tre diversi esperimenti. (D) Il restringimento mediolaterale simultaneo di due giunzioni v vicine (magenta) porta alla formazione di una rosetta multicellulare (d’ ), e nuove giunzioni (ciano) che emergono dalla rosetta risolutiva sono orientate lungo l’asse AP (d”‘ ). Scala = circa 20 µm. (E) Diagramma a rose che traccia l’orientamento delle giunzioni di restringimento che portano alla formazione di rosette multicellulari e il vettore medio risultante (freccia). n = 42 giunzioni da quattro embrioni attraverso tre esperimenti separati. (F) Diagramma a rose che traccia l’orientamento delle nuove giunzioni che emergono dalla risoluzione delle rosette e del vettore medio risultante (freccia). n = 36 nuove giunzioni da 3 embrioni attraverso tre esperimenti separati.
Poiché la segnalazione PCP è essenziale per l’estensione neurale convergente, abbiamo poi valutato l’effetto di interruzione PCP in particolare sui comportamenti di contrazione della giunzione nel epitelio neurale. Utilizzando l’approccio a mosaico descritto sopra, abbiamo trovato che l’espressione di Xdd1 ha suscitato il difetto previsto a livello tissutale nel movimento medialmente diretto delle pieghe neurali (Figura 4A, nuclei magenta indicano Xdd1 che esprime le cellule).
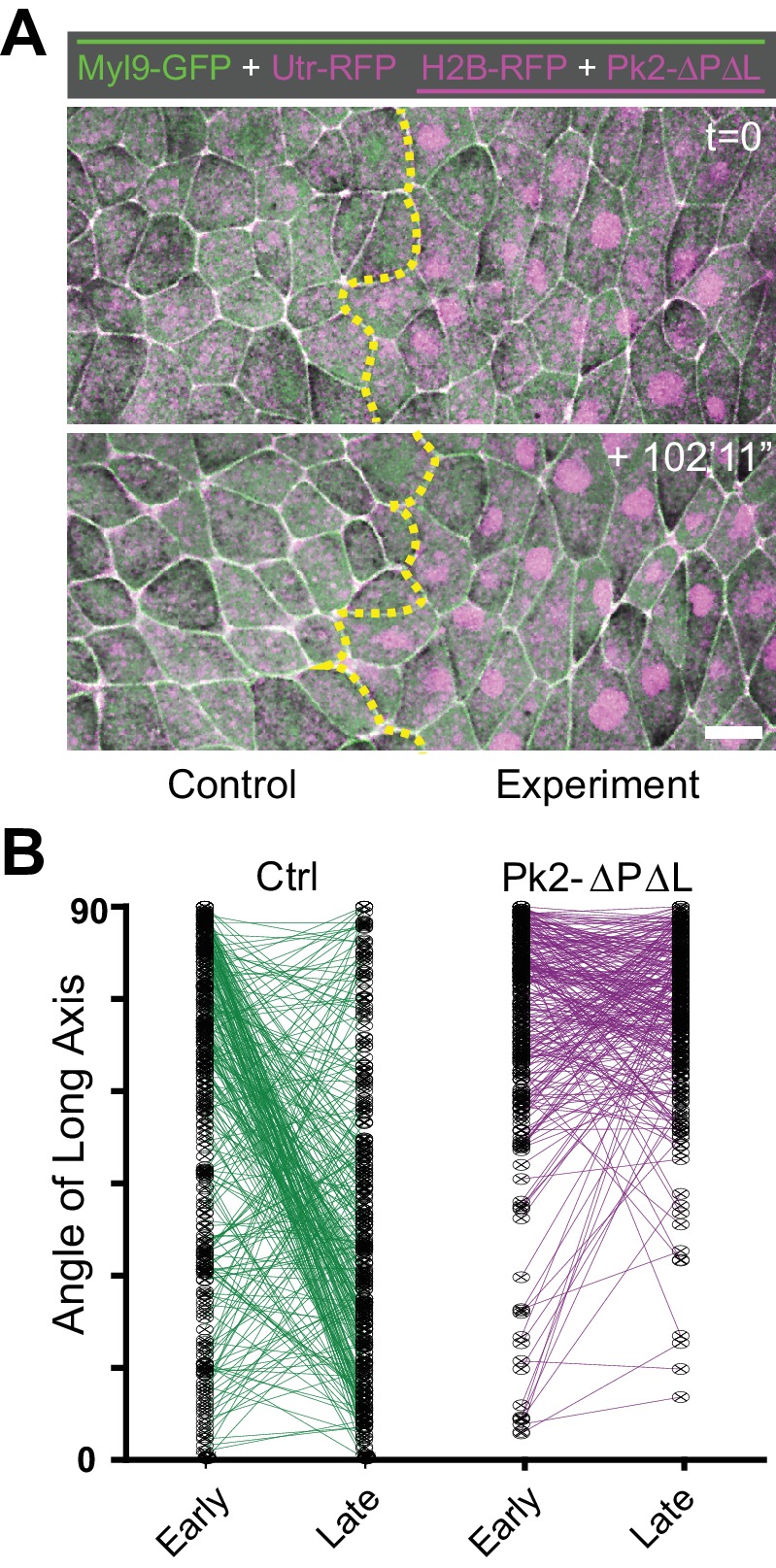
Figura 4-figure supplemento 1.Una dominante negativa Pk2 Pk2 perturba i riarrangiamenti delle cellule polarizzate.(A) Immagini confocali da una piastra neurale Xenopus uniformemente etichettato con membranaBFP e Utrophin-RFP (biosensore di actina), ma mosaicamente co-espressione H2B-RFP (nuclei magenta) insieme a Xdd1 su un lato (a destra). I confini laterali della piastra neurale sono contrassegnati in ogni fotogramma da linee gialle, dimostrando che l’espressione Xdd1 disturba il movimento mediale della piega neurale destra rispetto alla piega di controllo a sinistra. Scala = 50 µm (B) Grafico dell’angolo medio delle giunzioni rispetto alla variazione della lunghezza della giunzione per le cellule che esprimono Xdd1 da confrontare con il grafico di controllo in Figura 3C. n = 187 giunzioni da quattro embrioni attraverso tre esperimenti. (C) Grafico con il numero totale di eventi di transizione T espressi come transizioni per ora per il numero di cellule esaminate, con ogni punto che rappresenta un singolo embrione. Le barre di errore rappresentano la deviazione standard. Per l’analisi statistica, Controllo vs Xdd1, e Controllo vs Pk2-ΔPΔL ML, p=0,0025** per entrambe le classi di transizioni (Mann-Whitney Test per la significatività). n = 4 esperimenti, sette embrioni, 1167 cellule (Controllo); tre esperimenti, cinque embrioni, 560 cellule (Xdd1); tre esperimenti, cinque embrioni, 841 cellule (Pk2-ΔPΔL). (D) Il tasso calcolato di contrazione della giunzione per il completamento della transizione da Tipo uno a Tipo due (T1-T2) (contrazione completa di una giunzione a V, vedi Figura 3A-a’ ). Le barre di errore rappresentano la deviazione standard. Ctrl vs. Xdd1, p<0.0001****, Ctrl vs. Pk2-ΔPΔL, p<0.0001****, Xdd1 vs. Pk2-ΔPΔL, p=0.2051. (Test statistico Mann-Whitney). n = 24 giunzioni da quattro embrioni attraverso tre esperimenti (Ctrl), n = 19, 2, 2 (Xdd1), e n = 9, 3, 3 (Pk2-ΔPΔL). (E) Trama dell’angolo dell’asse lungo di controllo e delle celle Xdd1-espressione alle fasi 12-12,5 (iniziale) e 13-14 (finale), con linee che collegano gli angoli della stessa cella nei due diversi punti temporali. Tutte le misure sono da diverse regioni di embrioni che esprimono in mosaico Xdd1, come mostrato in (A). n = 136 cellule di controllo e 114 cellule Xdd1-espressione da quattro embrioni attraverso tre esperimenti.(A) Immagini confocali da una piastra neurale Xenopus allo stadio 12,5 (in alto) e stadio 14 (in basso) uniformemente etichettati con Myl9-GFP e Utrophin-RFP (biosensore di actina), ma mosaicamente co-espressione H2B-RFP (nuclei magenta) insieme con Pk2-ΔPΔL su un lato (a destra). Scala = 20 µm. (B) Trama dell’angolo dell’asse lungo di controllo e delle celle Pk2-ΔPΔL-espressione delle fasi 12-12,5 (iniziale) e 13-14 (finale), con linee che collegano gli angoli della stessa cella nei due diversi punti temporali. Tutte le misure sono da diverse regioni di embrioni che esprimono mosaicamente Pk2-ΔPΔL, simile a come mostrato in (A). n = 144 cellule di controllo e 143 Pk2-ΔPΔL cellule di espressione da 4 embrioni attraverso tre esperimenti.
L’analisi dei comportamenti delle singole cellule in questi embrioni ha rivelato che l’espressione Xdd1 ha significativamente interrotto la contrazione della giunzione planare polarizzata, eliminando la forte correlazione tra l’angolo di giunzione e la contrazione o la crescita della giunzione (Figura 4B, confrontare con la Figura 3C). Questo disaccoppiamento del comportamento della giunzione dall’orientamento è stato associato ad una riduzione del restringimento della giunzione in generale e ad una riduzione del numero di transizioni T produttive (Figura 4C). Infatti, anche le poche transizioni T produttive che sono state osservate sono state significativamente rallentate (Figura 4D).
Infine, questi difetti nel comportamento di intercalazione delle cellule hanno avuto un profondo impatto sulla forma delle cellule. Durante le fasi di placca neurale shaping (12-14), la maggior parte delle cellule epiteliali neurali negli embrioni di controllo ha mostrato uno spostamento da un orientamento anteroposteriore ad un orientamento mediolaterale (Figura 4E, verde), mentre Xdd1 che esprime le cellule mantengono il loro allineamento nell’asse anteroposteriore (Figura 4E, blu). In realtà, queste cellule in realtà aumentato il loro rapporto lunghezza-larghezza lungo l’asse AP (non mostrato), probabilmente come risultato di forze generate da altri comportamenti cellulari che formano la piastra neurale in queste fasi (ad esempio costrizione apicale, allungamento del mesoderma sottostante, ecc.) In particolare, la mutazione genetica dei geni PCP nei pesci zebra provoca anche uno spettro simile di difetti di forma e di orientamento delle cellule (Roszko et al., 2015). Infine, l’interruzione della funzione Prickle per espressione del dominante-negativo Pk2-ΔPΔL ha suscitato lo stesso spettro di difetti (Figura 4C,D, rosa; Figura 4-figure supplemento 1). Insieme ai nostri dati sulla localizzazione della proteina PCP (Figura 1, sopra), questi risultati stabiliscono la placca neurale di Xenopus come una piattaforma efficace con cui sondare la relazione tra i comportamenti di intercalazione delle cellule epiteliali e la dinamica della proteina PCP del nucleo.

Figura 2-figure supplemento 1.Figura 2— figura 1. High-magnification time-lapse imaging di estensione convergente nel tubo neurale di chiusura Xenopus.imaging in vivo delle traiettorie delle cellule nel tubo neurale di chiusura.(A) Fermi immagine stereo da un filmato time-lapse della morfogenesi del tubo neurale di Xenopus dalle fasi 12 a 19. (B) alambicchi da time-lapse immagine confocale del lato dorsale di un embrione dalle fasi 12 a 16. Le cellule etichettate con membraneGFP e H2B-RFP nucleare sono fuse con l’immagine DIC dello stesso embrione. Le immagini sono mostrate a ~ 2 ore di distanza l’una dall’altra (intervallo di 128 min.). Scala = 200 µm. (C) Immagini ad alto ingrandimento di riarrangiamenti cellulari in ectoderma neurale dal time-lapse mostrato in (B). Etichettatura delle singole cellule con punti colorati attraverso punti di tempo dimostra i riarrangiamenti cellulari che contribuiscono al restringimento e l’allungamento dei tessuti e transizioni T etichettati con magenta per il restringimento (T1-T2) e ciano per la crescita (T2-T3) giunzioni. Scala = circa 20 µm.Tre immagini fisse successive dal filmato time-lapse mostrato in Figura 2 e Video 1 con un sottoinsieme di cellule etichettate con membranaGFP e H2B-RFP essere rintracciati. Scala = 200 µm. Il pannello all’estrema destra mostra le traiettorie complessive delle cellule tracciate attraverso la durata dell’intervallo di tracciamento (4 ore, 16 min).

Figura 2-figure supplement 1.Immagine in vivo delle traiettorie delle cellule nel tubo neurale di chiusura.Tre immagini fisse successive dal filmato time-lapse mostrato in Figura 2 e Video 1 con un sottoinsieme di cellule etichettate con membranaGFP e H2B-RFP essere monitorati. Scala = 200 µm. Il pannello all’estrema destra mostra le traiettorie complessive delle cellule tracciate attraverso la durata dell’intervallo di tracciamento (4 ore, 16 min).

Video 2.Immagini confocali time-lapse del lato dorsale di un embrione di Xenopus laevis dagli stadi 12 a 16.Le cellule etichettate con membraneGFP e H2B-RFP nucleare sono fuse con l’immagine DIC dello stesso embrione. Immagini fisse e scala sono mostrati in Figura 2B.

Video 3.Immagini confocali time-lapse del lato dorsale di un embrione di Xenopus laevis dagli stadi 12 a 16.4. Cellule etichettate con membraneGFP e pseudo-colorate per aiutare a rintracciare riarrangiamenti cellulari durante l’estensione neurale convergente. Immagini fisse e la scala sono mostrati in Figura 2C.

Figura 3.Figura 3. Dinamica di giunzione apicale polarizzata facilitare le intercalazioni cellulari mediolaterali.(A) Immagini confocali della dinamica di giunzione nella piastra neurale Xenopus epitelio Xenopus etichettati con membraneGFP. Linee di magenta segnano il restringimento di una giunzione a V durante una transizione T; dopo il completo restringimento mediolaterale (T1-T2) (a’ ), una nuova giunzione (ciano) si allunga perpendicolarmente lungo l’asse AP (T2-T3) (a” ). Scala = circa 20 µm. (B) Grafico che mostra la variazione media (±s.d.) della lunghezza delle giunzioni a V e a T. (C) Grafico degli angoli medi delle giunzioni oltre 1800 s rispetto alla variazione della lunghezza della giunzione. Ogni punto rappresenta sulla giunzione cellula-cellula. n = 267 giunzioni da tre embrioni attraverso tre diversi esperimenti. (D) Il restringimento mediolaterale simultaneo di due giunzioni v vicine (magenta) porta alla formazione di una rosetta multicellulare (d’ ), e nuove giunzioni (ciano) che emergono dalla rosetta risolutiva sono orientate lungo l’asse AP (d”‘ ). Scala = circa 20 µm. (E) Diagramma a rose che traccia l’orientamento delle giunzioni di restringimento che portano alla formazione di rosette multicellulari e il vettore medio risultante (freccia). n = 42 giunzioni da quattro embrioni attraverso tre esperimenti separati. (F) Diagramma a rose che traccia l’orientamento delle nuove giunzioni che emergono dalla risoluzione delle rosette e del vettore medio risultante (freccia). n = 36 nuove giunzioni da 3 embrioni attraverso tre esperimenti separati.

Figura 4-figure supplement 1.La funzione PCP è necessaria per la contrazione della giunzione polarizzata nella piastra neurale.una dominante negativa Pk2 perturba i riarrangiamenti delle cellule polarizzate.(A) Immagini confocali da una piastra neurale Xenopus uniformemente etichettato con membranaBFP e Utrophin-RFP (biosensore di actina), ma mosaicamente co-espressione H2B-RFP (nuclei magenta) insieme a Xdd1 su un lato (a destra). I confini laterali della piastra neurale sono contrassegnati in ogni fotogramma da linee gialle, dimostrando che l’espressione Xdd1 disturba il movimento mediale della piega neurale destra rispetto alla piega di controllo a sinistra. Scala = 50 µm (B) Grafico dell’angolo medio delle giunzioni rispetto alla variazione della lunghezza della giunzione per le cellule che esprimono Xdd1 da confrontare con il grafico di controllo in Figura 3C. n = 187 giunzioni da quattro embrioni attraverso tre esperimenti. (C) Grafico con il numero totale di eventi di transizione T espressi come transizioni per ora per il numero di cellule esaminate, con ogni punto che rappresenta un singolo embrione. Le barre di errore rappresentano la deviazione standard. Per l’analisi statistica, Controllo vs Xdd1, e Controllo vs Pk2-ΔPΔL ML, p=0,0025** per entrambe le classi di transizioni (Mann-Whitney Test per la significatività). n = 4 esperimenti, sette embrioni, 1167 cellule (Controllo); tre esperimenti, cinque embrioni, 560 cellule (Xdd1); tre esperimenti, cinque embrioni, 841 cellule (Pk2-ΔPΔL). (D) Il tasso calcolato di contrazione della giunzione per il completamento della transizione da Tipo uno a Tipo due (T1-T2) (contrazione completa di una giunzione a V, vedi Figura 3A-a’ ). Le barre di errore rappresentano la deviazione standard. Ctrl vs. Xdd1, p<0.0001****, Ctrl vs. Pk2-ΔPΔL, p<0.0001****, Xdd1 vs. Pk2-ΔPΔL, p=0.2051. (Test statistico Mann-Whitney). n = 24 giunzioni da quattro embrioni attraverso tre esperimenti (Ctrl), n = 19, 2, 2 (Xdd1), e n = 9, 3, 3 (Pk2-ΔPΔL). (E) Trama dell’angolo dell’asse lungo di controllo e delle celle Xdd1-espressione alle fasi 12-12,5 (iniziale) e 13-14 (finale), con linee che collegano gli angoli della stessa cella nei due diversi punti temporali. Tutte le misure sono da diverse regioni di embrioni che esprimono in mosaico Xdd1, come mostrato in (A). n = 136 cellule di controllo e 114 cellule Xdd1-espressione da quattro embrioni attraverso tre esperimenti.(A) Immagini confocali da una placca neurale di Xenopus allo stadio 12,5 (in alto) e allo stadio 14 (in basso) etichettate uniformemente con Myl9-GFP e Utrophin-RFP (biosensore di actina), ma in modo mosaico co-espressivo H2B-RFP (nuclei magenta) insieme a Pk2-ΔPΔL da un lato (a destra). Scala = 20 µm. (B) Trama dell’angolo dell’asse lungo di controllo e Pk2-ΔPΔL-cellule di espressione alle fasi 12-12,5 (precoce) e 13-14 (tardiva), con linee che collegano gli angoli della stessa cella nei due diversi punti di tempo. Tutte le misure sono da diverse regioni di embrioni che esprimono mosaicamente Pk2-ΔPΔL, simile a come mostrato in (A). n = 144 cellule di controllo e 143 Pk2-ΔPΔL cellule di espressione da 4 embrioni attraverso tre esperimenti.

Figura 4-figure supplemento 1.Un dominante negativo Pk2 Pk2 disturba riarrangiamenti delle cellule polarizzate.(A) Immagini confocali da una piastra neurale Xenopus allo stadio 12,5 (in alto) e stadio 14 (in basso) uniformemente etichettati con Myl9-GFP e Utrophin-RFP (biosensore di actina), ma mosaicamente co-espressione H2B-RFP (nuclei magenta) insieme con Pk2-ΔPΔL su un lato (a destra). Scala = 20 µm. (B) Trama dell’angolo dell’asse lungo di controllo e Pk2-ΔPΔL-cellule di espressione alle fasi 12-12,5 (precoce) e 13-14 (tardiva), con linee che collegano gli angoli della stessa cella nei due diversi punti di tempo. Tutte le misure sono da diverse regioni di embrioni che esprimono mosaicamente Pk2-ΔPΔL, simile a come mostrato in (A). n = 144 cellule di controllo e 143 Pk2-ΔPΔL cellule di espressione da 4 embrioni attraverso tre esperimenti.
Prickle2 e Vangl2 sono dinamicamente arricchiti in modo specifico a restringere le giunzioni cellula-cellula
Con questi sistemi di imaging e di analisi, abbiamo eseguito l’imaging time-lapse con un occhio di riguardo alla comprensione della relazione dinamica tra la localizzazione della proteina PCP e i comportamenti delle cellule epiteliali. Questa analisi ha rivelato diverse nuove intuizioni. In primo luogo, abbiamo notato che l’accumulo di Pk2 è stato giunzione specifica, visualizzando cambiamenti evidenti di intensità proprio a giunzioni tricellulari (Figura 5A). Inoltre, abbiamo trovato che GFP-Pk2 è stato dinamicamente arricchito a giunzioni contrazione, ma impoverito da giunzioni allungamento (Figura 5A), suggerendo che l’arricchimento dinamico di Pk2 potrebbe non riflettere semplicemente l’orientamento spaziale della giunzione (ad esempio a V- vs T-giunzioni). Questa nozione è stata supportata dall’osservazione che anche quando le giunzioni adiacenti condividono un orientamento simile, l’intensità GFP-Pk2 a queste giunzioni spesso differivano sostanzialmente (Video 4 e 5). Per esempio, le immagini fisse della Figura 5B mostrano tre giunzioni adiacenti che condividono un allineamento mediolaterale approssimativamente simile; nessuna si discosta di più di 20 gradi dal mediolaterale in qualsiasi punto del filmato. Tuttavia, due delle giunzioni si restringono durante il filmato (parentesi rosse) mentre la terza cresce (parentesi gialle). Anche tra queste giunzioni orientate in modo simile, la contrazione è associata a livelli crescenti di intensità Pk2-GFP, e l’allungamento con Pk2-GFP decrescente (Figura 5C). Risultati simili sono stati ottenuti per Vangl2 (Figura 5-figure supplement 1).
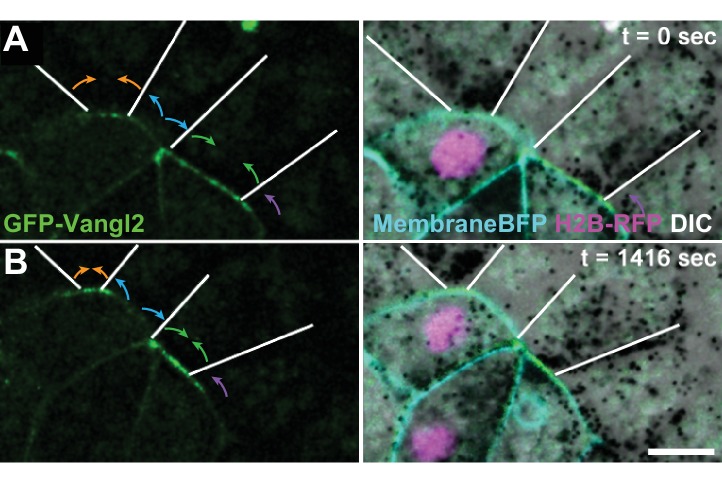
Figura 5-figure supplemento 1.Pk2 è dinamicamente arricchito a restringimento V-giunzioni. dinamica Vangl2 distinto a crescere adiacente e contrazione giunzioni adiacenti.(A) Immagini confocali di cellule epiteliali neurali etichettati con membraneRFP (pseudocolore blu) e GFP-Pk2 che mostra il cambiamento di lunghezza delle giunzioni di contrazione (punte di freccia verso l’interno) e le giunzioni in crescita (frecce rivolte verso l’esterno) insieme con il corrispondente cambiamento di intensità GFP-Pk2 in due punti di tempo diversi. Scala = 10 µm (B) Vista ad alto ingrandimento delle giunzioni orizzontali mostrate in A, mostrate ad intervalli di 5 minuti. Le parentesi rosse indicano giunzioni che si restringono; le parentesi gialle indicano giunzioni che crescono. Scala = 10 µm (C) I grafici di intensità (tracce rosso/giallo) e lunghezza (tracce tratteggiate nere) per ciascuna delle giunzioni indicate nel Pannello B. I grafici mostrano 30 minuti di dinamica di giunzione che terminano sia con la risoluzione della giunzione che con la formazione e l’espansione della giunzione; l’area grigia dietro i punti di dati selezionati indica l’intervallo dei quattro fotogrammi mostrati in (B), che sono sfalsati a causa della comparsa e della risoluzione di diverse giunzioni in tempi diversi.(A) Fotografie confocali di un epitelio neurale mosaico etichettato con GFP-Vangl2 (a sinistra) e co-etichettato con H2B-RFP e membraneBFP fuse con l’immagine DIC (a destra). Le linee bianche indicano le giunzioni delle cellule vicine senza etichetta. Le frecce colorate indicano il restringimento (arancione, verde) o la crescita (blu, viola) dei comportamenti delle giunzioni cella-cellula adiacenti. Si notino i cambiamenti drammatici dell’intensità di Vangl2 solo alle giunzioni che si restringono. Scala = 10 µm.

Video 4.Immagini confocali Time-lapse di una piastra neurale di Xenopus laevis etichettata a mosaico con GFP-Pk2 (a sinistra) e memRFP (a destra, blu pseudo-colorato e fusa con i canali GFP-Pk2 e DIC).Le immagini fisse e la scala sono mostrate nella Figura 5A e una vista ingrandita è mostrata nel Video 5 e l’analisi delle giunzioni mediolateralmente allineate annotate all’inizio del filmato sono fornite nella Figura 5B,C.

Video 5.Immagini confocali time-lapse di una lastra neurale di Xenopus laevis etichettata con GFP-Pk2 e memRFP (pseudo-colore blu) fusa con DIC.Le giunzioni che si restringono e che crescono sono annotate con linee rosse e gialle, rispettivamente, e l’analisi di queste giunzioni è fornita nella Figura 5C.
Per quantificare queste osservazioni, abbiamo tracciato le variazioni di intensità di fluorescenza GFP-Pk2 contro le corrispondenti variazioni di lunghezza delle giunzioni e abbiamo osservato una forte e significativa correlazione (Figura 6A). Risultati simili sono stati osservati con Vangl2 (Figura 6B). Abbiamo considerato la possibilità che questi cambiamenti di intensità potrebbero riflettere la densità, aumentando semplicemente se la quantità di proteine su una giunzione rimane costante come tale giunzione si riduce. Per esplorare questa idea, abbiamo esaminato un marcatore generico di membrana (FP-caax) e abbiamo trovato che, mentre ha mostrato una tendenza ad aumentare come le giunzioni si restringono, questo aumento è stato modesto e la correlazione era molto più debole di quella osservata per le proteine PCP (Figura 6C). È importante notare che, anche quando normalizzato contro il marcatore di membrana per tener conto dei cambiamenti della membrana-PFP nelle stesse giunzioni, le intensità di GFP-Vangl2 e GFP-Prickle2 mostravano ancora forti e significative correlazioni con il restringimento delle giunzioni (Figura 6-figure supplement 1).
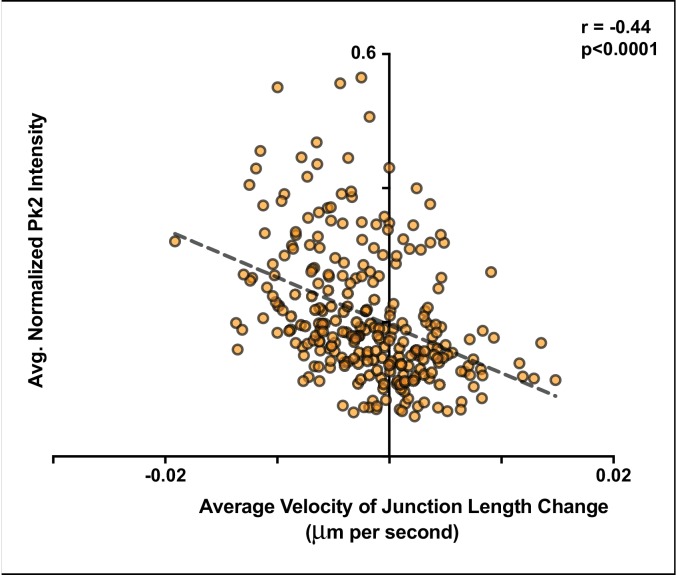
Figura 6-figure supplement 2.Figura 6—supplemento figura 2. La dinamica di Pk2 e Vangl2 alla contrazione e alla crescita delle giunzioni.la localizzazione della proteina PCP è correlata con il comportamento della giunzione.Pk2 è più altamente arricchita alla contrazione delle giunzioni mediolaterali.(A) Raw GFP-Pk2 intensità dei pixel grezzi PFP-Pk2 fortemente correlato con i cambiamenti di lunghezza della giunzione. Inset mostra una vista ingrandita del nucleo della trama. n = 71 giunzioni da cinque embrioni attraverso quattro esperimenti. (B) Le intensità dei pixel GFP-Vangl2 grezzi sono fortemente correlate con i cambiamenti di lunghezza delle giunzioni. n = 37 giunzioni da 2 embrioni di due diversi esperimenti. (C) GFP-caax mostra solo una debole correlazione con i cambiamenti di lunghezza della giunzione. Inset mostra una vista ingrandita del nucleo del grafico. n = 108 giunzioni da sette embrioni di sei esperimenti. Anche quando normalizzato contro GFP-caax, Pk2 e Vangl2 livelli mostrano una forte correlazione con i cambiamenti di lunghezza della giunzione, come mostrato in Figura 6- figura supplemento 1 Figura 6(A) Tracciato delle intensità normalizzate delle PFP-Pk2 rispetto alla variazione della lunghezza della giunzione (r = -0,49; p<0,001; n = 71). La normalizzazione è stata effettuata sottraendo lo sfondo ed esprimendo l’intensità dei livelli GFP-Pk2 come rapporto all’intensità dell’etichetta della membrana co-espressa. (B) Trama di normalizzato GFP-Vangl2 intensità contro la variazione della lunghezza della giunzione (r = -0,57; p = 0,002; n = 37). La normalizzazione è stata eseguita come da GFP-Pk2, sopra.(A) Trama di intensità media Pk2 normalizzata alle intensità di etichetta membrana a due punti di tempo contro la variazione della lunghezza della giunzione diviso per il tempo in secondi tra i due punti di tempo che le misure sono state prese. Tutte le misure sono prese da giunzioni a V che sono rimaste entro 30 gradi dell’asse mediolaterale per tutta la durata dell’analisi. Le giunzioni che si restringevano ad un tasso maggiore tendevano ad avere livelli più alti di Pk2 normalizzato localizzato rispetto ad altre giunzioni a V che non si restringevano ad un tasso comparabile. n = 205 intervalli da 22 cellule di cinque embrioni attraverso cinque esperimenti separati.
Questi risultati suggeriscono che la forza di arricchimento asimmetrico Pk2 e Vangl2 arricchimento in una particolare giunzione è almeno altrettanto fortemente legato al comportamento dinamico di quella giunzione come lo è per l’orientamento della giunzione. Come test finale di questa idea, abbiamo selezionato un sottoinsieme di giunzioni a V che sono rimaste allineate entro 30 gradi dell’asse ML per l’intero filmato e poi abbiamo tracciato la velocità media di contrazione o crescita contro l’intensità media di GFP-Pk2 a quella giunzione. Anche in questo caso, abbiamo trovato una correlazione altamente significativa (Figura 6-figure supplement 2). Insieme, questi dati suggeriscono che l’arricchimento di Pk2 e Vangl2 è governato sia dall’interazione reciproca di ogni singola coppia di cellule vicine, sia dal comportamento della giunzione condivisa tra di loro.

Figura 5-figure supplemento 1.Figura 5—supplemento figura 1. Pk2 è dinamicamente arricchito a contrazione V-giunzioni.dinamica Vangl2 distinto a crescere adiacente e contrazione giunzioni adiacenti.(A) Immagini confocali di cellule epiteliali neurali etichettati con membraneRFP (pseudocolorato blu) e GFP-Pk2 che mostra il cambiamento di lunghezza delle giunzioni di contrazione (punte di freccia verso l’interno) e le giunzioni in crescita (frecce rivolte verso l’esterno) insieme con il corrispondente cambiamento di intensità GFP-Pk2 in due punti di tempo diversi. Scala = 10 µm (B) Vista ad alto ingrandimento delle giunzioni orizzontali mostrate in A, mostrate ad intervalli di 5 minuti. Le parentesi rosse indicano giunzioni che si restringono; le parentesi gialle indicano giunzioni che crescono. Scala = 10 µm (C) I grafici di intensità (tracce rosso/giallo) e lunghezza (tracce tratteggiate nere) per ciascuna delle giunzioni indicate nel Pannello B. I grafici mostrano 30 minuti di dinamica di giunzione che terminano sia con la risoluzione della giunzione che con la formazione e l’espansione della giunzione; l’area grigia dietro i punti di dati selezionati indica l’intervallo dei quattro fotogrammi mostrati in (B), che sono sfalsati a causa della comparsa e della risoluzione di diverse giunzioni in tempi diversi.(A) Fotografie confocali di un epitelio neurale mosaico etichettato con GFP-Vangl2 (a sinistra) e co-etichettato con H2B-RFP e membraneBFP fuse con l’immagine DIC (a destra). Le linee bianche indicano le giunzioni delle cellule vicine senza etichetta. Le frecce colorate indicano il restringimento (arancione, verde) o la crescita (blu, viola) dei comportamenti delle giunzioni cella-cellula adiacenti. Si notino i cambiamenti drammatici dell’intensità di Vangl2 solo alle giunzioni che si restringono. Scala = 10 µm.

Figura 5-figure supplemento 1.Distinguere la dinamica di Vangl2 alle giunzioni adiacenti che crescono e si restringono.(A) Ancora confocale di un epitelio neurale mosaico epitelio etichettato con GFP-Vangl2 (a sinistra) e co-etichettato con H2B-RFP e membranaBFP si è fusa con l’immagine DIC (a destra). Le linee bianche indicano le giunzioni delle cellule vicine senza etichetta. Le frecce colorate indicano il restringimento (arancione, verde) o la crescita (blu, viola) dei comportamenti delle giunzioni cella-cellula adiacenti. Si notino i cambiamenti drammatici dell’intensità di Vangl2 solo alle giunzioni che si restringono. Scala = 10 µm.

Video 4.Immagini confocali Time-lapse di una piastra neurale di Xenopus laevis etichettata a mosaico con GFP-Pk2 (a sinistra) e memRFP (a destra, blu pseudo-colorato e fusa con i canali GFP-Pk2 e DIC).Le immagini fisse e la scala sono mostrate nella Figura 5A e una vista ingrandita è mostrata nel Video 5 e l’analisi delle giunzioni mediolateralmente allineate annotate all’inizio del filmato sono fornite nella Figura 5B,C.

Video 5.Immagini confocali time-lapse di una lastra neurale di Xenopus laevis etichettata con GFP-Pk2 e memRFP (pseudo-colore blu) fusa con DIC.Le giunzioni che si restringono e che crescono sono annotate con linee rosse e gialle, rispettivamente, e l’analisi di queste giunzioni è fornita nella Figura 5C.

Figura 6-figure supplement 2.La dinamica di Pk2 e Vangl2 alle giunzioni di contrazione e crescita. La localizzazione della proteina PCP è correlata con il comportamento della giunzione, mentre la Pk2 è più arricchita alle giunzioni mediolaterali di contrazione.(A) Raw GFP-Pk2 intensità dei pixel grezzi PFP-Pk2 fortemente correlato con i cambiamenti di lunghezza della giunzione. Inset mostra una vista ingrandita del nucleo della trama. n = 71 giunzioni da cinque embrioni attraverso quattro esperimenti. (B) Le intensità dei pixel GFP-Vangl2 grezzi sono fortemente correlate con i cambiamenti di lunghezza delle giunzioni. n = 37 giunzioni da 2 embrioni di due diversi esperimenti. (C) GFP-caax mostra solo una debole correlazione con i cambiamenti di lunghezza della giunzione. Inset mostra una vista ingrandita del nucleo del grafico. n = 108 giunzioni da sette embrioni di sei esperimenti. Anche quando normalizzato contro GFP-caax, Pk2 e Vangl2 livelli mostrano una forte correlazione con i cambiamenti di lunghezza della giunzione, come mostrato in Figura 6- figura supplemento 1 Figura 6(A) Tracciato delle intensità normalizzate delle PFP-Pk2 rispetto alla variazione della lunghezza della giunzione (r = -0,49; p<0,001; n = 71). La normalizzazione è stata effettuata sottraendo lo sfondo ed esprimendo l’intensità dei livelli GFP-Pk2 come rapporto all’intensità dell’etichetta della membrana co-espressa. (B) Trama di normalizzato GFP-Vangl2 intensità contro la variazione della lunghezza della giunzione (r = -0,57; p = 0,002; n = 37). La normalizzazione è stata eseguita come da GFP-Pk2, sopra.(A) Trama di intensità medie Pk2 normalizzato alle intensità di etichetta membrana a due punti di tempo contro la variazione della lunghezza della giunzione diviso per il tempo in secondi tra i due punti di tempo che le misure sono state prese. Tutte le misure sono prese da giunzioni a V che sono rimaste entro 30 gradi dell’asse mediolaterale per tutta la durata dell’analisi. Le giunzioni che si restringevano ad un tasso maggiore tendevano ad avere livelli più alti di Pk2 normalizzato localizzato rispetto ad altre giunzioni a V che non si restringevano ad un tasso comparabile. n = 205 intervalli da 22 cellule di cinque embrioni attraverso cinque esperimenti separati.
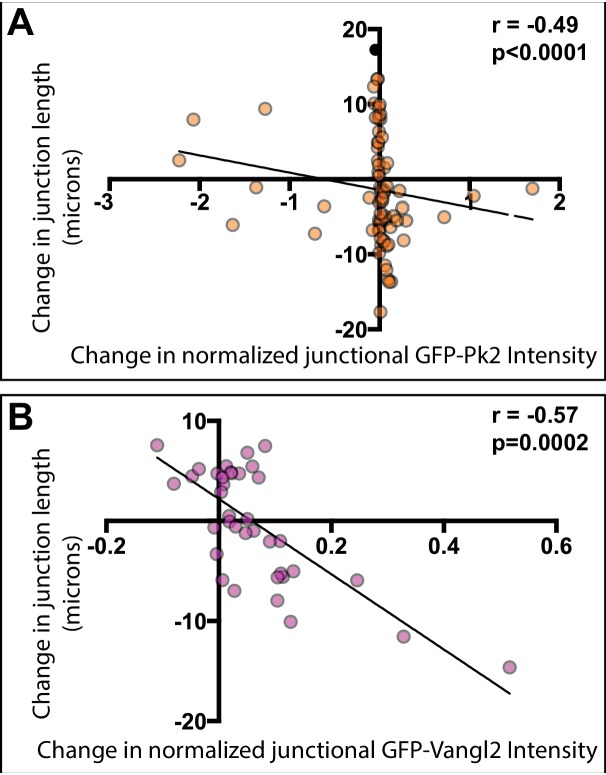
Figura 6-figure supplemento 1.La localizzazione della proteina PCP è correlata con il comportamento giunzionale.(A) Trama di intensità GFP-Pk2 normalizzata contro la variazione della lunghezza della giunzione (r = -0,49; p<0,001; n = 71). La normalizzazione è stata effettuata sottraendo lo sfondo ed esprimendo l’intensità dei livelli GFP-Pk2 come rapporto all’intensità dell’etichetta della membrana co-espressa. (B) Trama di normalizzato GFP-Vangl2 intensità contro la variazione della lunghezza della giunzione (r = -0,57; p = 0,002; n = 37). La normalizzazione è stata eseguita come da GFP-Pk2, sopra.

Figura 6-figure supplemento 2.Pk2 è più altamente arricchito a restringimento giunzioni mediolaterali.(A) Trama di intensità medie Pk2 normalizzato alle intensità di etichetta membrana a due punti di tempo contro la variazione della lunghezza della giunzione diviso per il tempo in secondi tra i due punti di tempo che le misure sono state prese. Tutte le misure sono prese da giunzioni a V che sono rimaste entro 30 gradi dell’asse mediolaterale per tutta la durata dell’analisi. Le giunzioni che si restringevano ad un tasso maggiore tendevano ad avere livelli più alti di Pk2 normalizzato localizzato rispetto ad altre giunzioni a V che non si restringevano ad un tasso comparabile. n = 205 intervalli da 22 cellule di cinque embrioni attraverso cinque esperimenti separati.
Fatturato di Prickle2 e Vangl2 a giunzioni cellula-cellula è planare polarizzata durante l’intercalazione cellulare
Della dinamica della proteina PCP che abbiamo osservato, abbiamo ritenuto che l’arricchimento specifico alle giunzioni a V in contrazione fosse il più significativo. I nostri dati con Caax-GFP (Figura 6C) suggeriscono che la semplice riduzione della lunghezza della giunzione non è sufficiente per aumentare la densità nella misura massima osservata per Pk2 e Vangl2 a giunzioni che si restringono. Abbiamo ragionato, quindi, che l’arricchimento del PCP potrebbe anche comportare un processo attivo, ad esempio in cui la cinetica di rotazione regolata è più dinamica in alcuni nodi e meno in altri. Gli studi FRAP hanno dimostrato che il turnover della proteina PCP polarizzata è polarizzato in modo planare in altri tipi di cellule (Butler e Wallingford, 2015; Chien et al., 2015; Shi et al., 2016; Strutt et al., 2011), quindi abbiamo utilizzato questo metodo per valutare le dinamiche di localizzazione durante l’intercalazione cellulare nel tubo neurale di chiusura (Figura 7A).
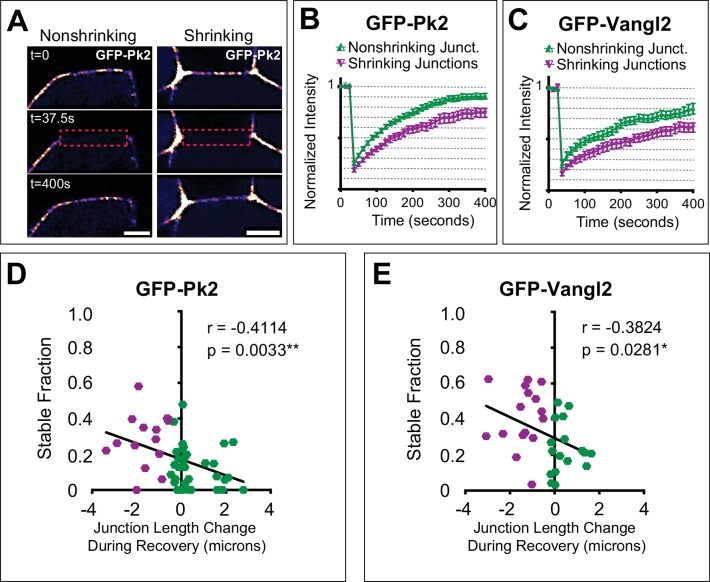
Figura 7.Figura 7. Il fatturato di Pk2 e Vangl2 è correlato con il comportamento della giunzione.(A) Immagini fisse da filmati time-lapse catturate prima e dopo la fotosintonizzazione di una giunzione senza restringimento e restringimento delle cellule etichettate con mosaico GFP-Pk2 nella piastra neurale, con una LUT applicata per i colori più caldi che rappresentano intensità di fluorescenza più elevate. Il riquadro rosso tratteggiato segna la regione sbiancata di interesse. Si noti che la cellula sul lato anteriore delle giunzioni non è etichettata. Scala = 5 µm. (B, C) Grafici che mostrano il recupero della fluorescenza media dopo il fotosecchettamento a giunzioni con restringimento e senza restringimento per GFP-Pk2 (n = 34 senza restringimento, n = 15 con restringimento) e GFP-Vangl2 (n = 17 senza restringimento, n = 16 con restringimento). Le giunzioni di restringimento sono state definite come quelle che sono state ridotte di 0,5 μm o più in lunghezza nel corso dello sbiancamento e del recupero dell’intensità della fluorescenza. Le barre di errore rappresentano il SEM. (D- E) Grafici che tracciano la variazione della lunghezza della giunzione durante il fotosabbiamento e il recupero rispetto alla frazione non mobile calcolata per le singole giunzioni analizzate in (B) e (C) con il modello di regressione lineare associato e le statistiche di analisi di correlazione incluse. n = 49 (GFP-Prickle2); n = 33 (GFP-Vangl2).
Sia Pk2 che Vangl2 hanno mostrato notevoli differenze nella cinetica del fatturato a giunzioni in contrazione rispetto a quelle non in contrazione, con un recupero significativamente minore (cioè una frazione stabile più alta) sia per Vangl2 che per Prickle2 a giunzioni in contrazione rispetto a quelle non in contrazione (Figura 7B,C). Inoltre, quando abbiamo integrato questi dati FRAP con l’analisi del time-lapse dei comportamenti cellulari, abbiamo trovato che la frazione stabile di entrambe le proteine era correlata in modo significativo con le variazioni della lunghezza della giunzione: le giunzioni a contrazione più rapida mostravano frazioni stabili più elevate di proteine PCP giunzionali (Figura 7D,E). Quindi, l’accumulo complessivo di Prickle2 e Vangl2 alle giunzioni di contrazione è parallelo alla maggiore stabilità di queste proteine in questi siti e, insieme, questi dati suggeriscono un ruolo chiave per il traffico della proteina PCP nel coordinamento della contrazione della giunzione cellula-cellula.

Figura 7.Il fatturato di Pk2 e Vangl2 è correlato al comportamento della giunzione.(A) Immagini fisse da filmati time-lapse catturate prima e dopo la fotosintonizzazione di una giunzione senza restringimenti e restringimento delle cellule etichettate a mosaico con GFP-Pk2 nella piastra neurale, con una LUT applicata per colori più caldi che rappresentano intensità di fluorescenza più elevate. Il riquadro rosso tratteggiato segna la regione sbiancata di interesse. Si noti che la cellula sul lato anteriore delle giunzioni non è etichettata. Scala = 5 µm. (B, C) Grafici che mostrano il recupero della fluorescenza media dopo il fotosecchettamento a giunzioni con restringimento e senza restringimento per GFP-Pk2 (n = 34 senza restringimento, n = 15 con restringimento) e GFP-Vangl2 (n = 17 senza restringimento, n = 16 con restringimento). Le giunzioni di restringimento sono state definite come quelle che sono state ridotte di 0,5 μm o più in lunghezza nel corso dello sbiancamento e del recupero dell’intensità della fluorescenza. Le barre di errore rappresentano il SEM. (D- E) Grafici che tracciano la variazione della lunghezza della giunzione durante il fotosabbiamento e il recupero rispetto alla frazione non mobile calcolata per le singole giunzioni analizzate in (B) e (C) con il modello di regressione lineare associato e le statistiche di analisi di correlazione incluse. n = 49 (GFP-Prickle2); n = 33 (GFP-Vangl2).
La polarizzazione planare dell’actomiosina durante la contrazione della giunzione nell’epitelio neurale è dipendente dal PCP
Abbiamo poi cercato di capire il legame tra la localizzazione della proteina PCP e il macchinario dell’actomiosina noto per guidare il restringimento della giunzione cellula-cellula. Time-lapse imaging in Drosophila ha dimostrato per la prima volta che l’intercalazione cellulare da contrazione della giunzione è accompagnata da accumuli pulsati di actomiosina alle giunzioni a V (Bertet et al., 2004; Fernandez-Gonzalez et al., 2009; Rauzi et al., 2008). Mentre questo processo è indipendente dalla segnalazione di PCP in Drosophila, simili impulsi di actomiosina sono stati osservati durante la contrazione della giunzione dipendente dal PCP nelle cellule mesenchimali dello Xenopus gastrula mesoderm (Shindo e Wallingford, 2014). Le analisi statiche di Xenopus, pulcini e topi indicano anche che l’actomiosina si arricchisce alle giunzioni orientate mediolateralmente (McGreevy et al., 2015; Nishimura et al., 2012; Williams et al., 2014). Tuttavia, la relazione spazio-temporale tra la dinamica dell’actomiosina e i comportamenti subcellulari durante l’intercalazione cellulare nel tubo neurale vertebrato rimane poco definita.
Utilizzando un GFP-fusion alla catena luminosa regolatrice della miosina Myl9 (Shindo e Wallingford, 2014), abbiamo osservato un forte arricchimento alle giunzioni a V rispetto alle giunzioni a T. Questo arricchimento è stato evidente sia a livello di popolazione (Figura 8A-C, verde) sia nella significativa correlazione tra l’intensità del Myl9 e l’angolo di giunzione per le singole giunzioni (Figura 8D, verde, n > 450). Coerentemente con i rapporti precedenti in altri sistemi (Bertet et al., 2004; Shindo e Wallingford, 2014), l’intensità del Myl9 è stata elevata nelle giunzioni che si restringono (Figura 8-figure supplement 1A). Queste correlazioni sono probabilmente rilevanti dal punto di vista funzionale, perché i cambiamenti nell’arricchimento della miosina sono fortemente correlati con la diminuzione della lunghezza delle giunzioni. Risultati simili sono stati ottenuti utilizzando il biosensore dell’actina Utrophin-RFP (Burkel et al., 2007), e le variazioni di intensità della miosina sono stati anche fortemente correlati ai cambiamenti di actina sulle singole giunzioni (Figura 8-figure supplement 1).
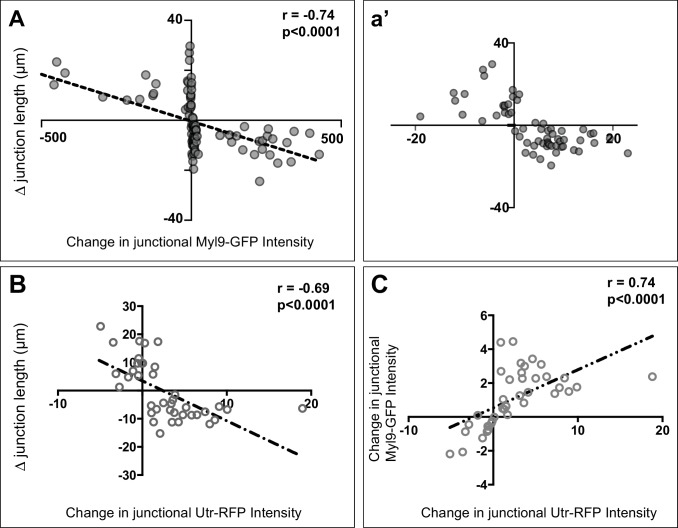
Figura 8-figure supplement 1.La funzione PCP è necessaria per la polarizzazione della contrattilità dell’actomiosina durante la contrazione della giunzione.(A-B). Immagini confocali di epiteli neurali di Xenopus etichettati in modo uniforme con Myl9-GFP e membraneBFP e mosaico con H2B-RFP che serve come tracciante per Xdd1 (A) o Pk2-ΔPΔL (B) espressione. Scala = 10 µm (C) Grafico che traccia l’intensità di Myl9-GFP lungo le giunzioni a V (0-45° rispetto all’asse mediolaterale) e le giunzioni a T (46-90° rispetto all’asse mediolaterale) normalizzate in rapporto all’intensità citoplasmatica media delle cellule che condividono la giunzione. Cellule di controllo (n = 91 V, 91T) e cellule che esprimono Xdd1 (n = 44 V, 53 T) e Pk2-ΔPΔL (n = 45 V, 45 T). Ctrl V vs. T, p<0,0001****; Pk2-ΔPΔL V vs. T, p=0,2304; Xdd1 V vs. T, p=0,0022**; Controllo V vs. Xdd1 V, p=0.5826; Controllo T vs. Xdd1 T, p<0.0001****; Controllo T vs. Pk2-ΔPΔL T, p<0.0001**** (Mann-Whitney Test per il significato). Le barre di errore rappresentano la deviazione standard. (D) Distribuzioni di intensità normalizzata Myl9-GFP tracciate contro l’angolo della giunzione a cui l’intensità è stata misurata in celle di controllo e celle che esprimono Xdd1 o Pk2-ΔPΔL. Coefficienti di correlazione per Xdd1 e Pk2-ΔPΔL hanno dimostrato di essere significativamente diversi dai controlli che utilizzano la trasformazione Fischer R-to-Z. n = 498 giunzioni (Controllo), n = 263 giunzioni (Xdd1) e n = 245 giunzioni (Pk2-ΔPΔL) da quattro esperimenti, cinque embrioni (Xdd1); tre esperimenti, sette embrioni (Pk2-ΔPΔL).(A) Trama che mostra la correlazione tra le variazioni di lunghezza della giunzione e le intensità di Utrophin-RFP (biosensore di actina). (B) Traccia che mostra la correlazione tra le variazioni della lunghezza della giunzione e le intensità di Myl9-GFP. (C) Trama che mostra la correlazione tra le variazioni della lunghezza della giunzione e le intensità di Myl9-GFP e Utrophin-RFP (biosensore di actina). n = 39 giunzioni per ogni trama.
L’espressione di Xdd1 o Pk2-ΔPΔL ha perturbato significativamente la polarizzazione planare dell’arricchimento miosinico (Figura 8A-D). È interessante notare che questi reagenti sembrano agire attraverso meccanismi di conversione: L’espressione di Xdd1 ha provocato un innalzamento dei livelli di miosina alle giunzioni a T, mentre l’espressione di Pk2-ΔPΔL ha provocato una riduzione dell’arricchimento della miosina alle giunzioni a V (Figura 8C). Questo risultato è stato sorprendentemente simile alla tendenza osservata sopra per le intensità GFP-Pk2 in queste condizioni (Figura 1B), suggerendo inoltre che gli arricchimenti di PCP e Myl9 sono funzionalmente correlati. Così, l’interruzione della segnalazione di PCP disturba sia la localizzazione asimmetrica della proteina PCP e la polarizzazione planare della contrazione dell’actomiosina nel tubo neurale di chiusura.

Figura 8-figure supplemento 1.La funzione PCP è necessaria per la polarizzazione della contrattilità dell’actomiosina durante la contrazione della giunzione.(A-B). Immagini confocali di epiteli neurali Xenopus etichettati in modo uniforme con Myl9-GFP e membranaBFP e mosaico con H2B-RFP che serve come tracciante per Xdd1 (A) o Pk2-ΔPΔL (B) espressione. Scala = 10 µm (C) Grafico che traccia l’intensità di Myl9-GFP lungo le giunzioni a V (0-45° rispetto all’asse mediolaterale) e le giunzioni a T (46-90° rispetto all’asse mediolaterale) normalizzate in rapporto all’intensità citoplasmatica media delle cellule che condividono la giunzione. Cellule di controllo (n = 91 V, 91T) e cellule che esprimono Xdd1 (n = 44 V, 53 T) e Pk2-ΔPΔL (n = 45 V, 45 T). Ctrl V vs. T, p<0,0001****; Pk2-ΔPΔL V vs. T, p=0,2304; Xdd1 V vs. T, p=0,0022**; Controllo V vs. Xdd1 V, p=0.5826; Controllo T vs. Xdd1 T, p<0.0001****; Controllo T vs. Pk2-ΔPΔL T, p<0.0001**** (Mann-Whitney Test per il significato). Le barre di errore rappresentano la deviazione standard. (D) Distribuzioni di intensità normalizzata Myl9-GFP tracciate contro l’angolo della giunzione a cui l’intensità è stata misurata in celle di controllo e celle che esprimono Xdd1 o Pk2-ΔPΔL. Coefficienti di correlazione per Xdd1 e Pk2-ΔPΔL hanno dimostrato di essere significativamente diversi dai controlli che utilizzano la trasformazione Fischer R-to-Z. n = 498 giunzioni (Controllo), n = 263 giunzioni (Xdd1) e n = 245 giunzioni (Pk2-ΔPΔL) da quattro esperimenti, cinque embrioni (Xdd1); tre esperimenti, sette embrioni (Pk2-ΔPΔL).(A) Trama che mostra la correlazione tra le variazioni di lunghezza della giunzione e le intensità di Utrophin-RFP (biosensore di actina). (B) Traccia che mostra la correlazione tra le variazioni della lunghezza della giunzione e le intensità di Myl9-GFP. (C) Trama che mostra la correlazione tra le variazioni della lunghezza della giunzione e le intensità di Myl9-GFP e Utrophin-RFP (biosensore di actina). n = 39 giunzioni per ogni trama.

Figura 8-figure supplemento 1.(A) Trama che mostra la correlazione tra le variazioni di lunghezza della giunzione e Utrophin-RFP (biosensore di actina) intensità. (B) Trama che mostra la correlazione tra le variazioni della lunghezza della giunzione e le intensità di Myl9-GFP. (C) Trama che mostra la correlazione tra le variazioni della lunghezza della giunzione e le intensità di Myl9-GFP e Utrophin-RFP (biosensore di actina). n = 39 giunzioni per ogni trama.
Le proteine PCP e la dinamica dell’actomiosina sono coordinate spazio-temporalmente con il restringimento delle giunzioni
Alla luce dei modelli spazio-temporali osservati della localizzazione della proteina PCP (Figura 8), abbiamo esaminato più da vicino la localizzazione di Myl9 e Pk2 durante i film time-lapse. Come ci si aspettava dai risultati ottenuti in altri sistemi, il Myl9-GFP mostrava un comportamento pulsatile alle giunzioni a V in contrazione (Figura 9A-B, Video 6). Myl9 ha anche pulsato alle giunzioni a T, anche se tali impulsi tendevano a comportare fluttuazioni più ampie e non sono riusciti a restringere la giunzione in modo persistente (Figura 9C). Sorprendentemente, intensità Pk2 visualizzato anche l’arricchimento pulsatile arricchimento, e inoltre, i cambiamenti in Pk2 sono stati fortemente correlati con simili cambiamenti di intensità Myl9 alle giunzioni cellula-cellula (Figura 9A-D). Infine, gli impulsi di Pk2 e Myl9 sono stati anche fortemente cross-correlati nel tempo (Figura 9E). Insieme, questi dati dimostrano modelli dinamici condivisi di proteine PCP nucleo e la localizzazione actomiosina nello spazio e nel tempo durante l’intercalazione cellulare e suggeriscono che questi sistemi lavorano in stretto concerto per guidare contrazione giunzione di guida nel epitelio neurale Xenopus epitelio.
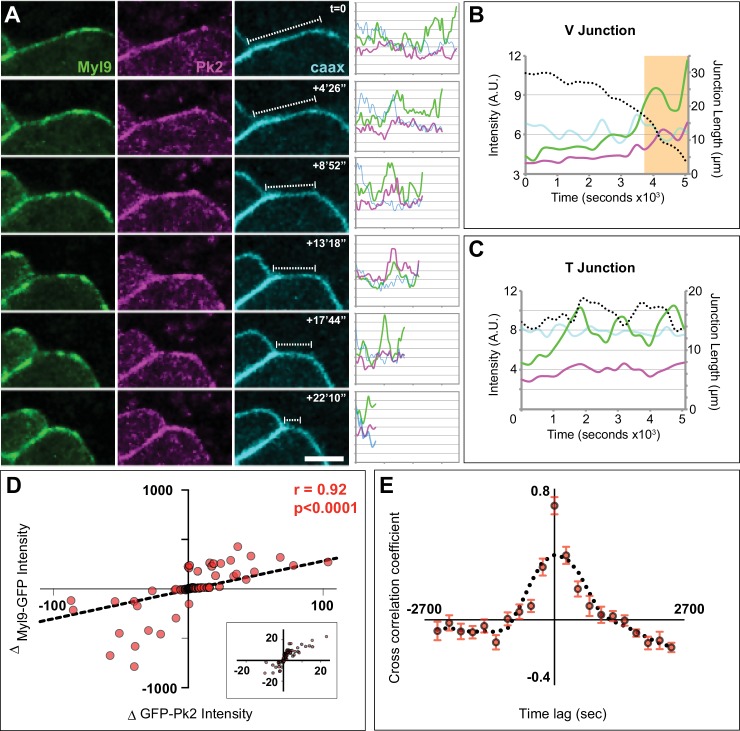
Figura 9.Figura 9. Coordinamento spazio-temporale di Prickle2 e l’accumulo di actomiosina alle giunzioni di contrazione.(A) Immagini confocali di un rimpicciolimento V-giunzione mosaico di contrazione etichettato con Myl9-GFP, RFP-Pk2, e membranaBFP nel corso di un lasso di tempo 1600 s e l’intensità associata trama profilo per ogni fluoroforo per tutta la lunghezza della giunzione. Scala = 10 µm. (B) Tracciato delle intensità medie nel tempo per la giunzione a V in (A) che mostra il cumulo pulsato di Pk2 (rosa) e Myl9 (verde) mentre la lunghezza della giunzione si riduce (linea tratteggiata nera). La casella arancione segna i punti di tempo rappresentati in (A) (C) Trama delle intensità medie nel tempo per un mosaico etichettato T-junction che mostra la co-cumulo pulsato di Pk2 (rosa) e Myl9 (verde) come giunzione fluttua tra il restringimento e la crescita (linea tratteggiata nera). (D) Trama di dispersione del cambiamento di intensità RFP-Pk2 contro il cambiamento di intensità GFP-Myl9 e la correlazione associata; una vista ingrandita del nucleo di questo grafico è mostrato in Panel c’. n = 96 giunzioni da tre embrioni attraverso due esperimenti. (E) Analisi di correlazione incrociata delle variazioni di intensità RFP-Pk2 e GFP-Myl9 nel tempo, con un coefficiente medio di correlazione incrociata di 0,7 a 0 s di ritardo temporale che dimostra la dinamica di accumulazione sincrona. n = 22 giunzioni da tre embrioni; le barre di errore rappresentano il SEM.

Video 6.Time-lapse immagini confocali di una lastra neurale di Xenopus laevis etichettata con Myl9-GFP (in alto a sinistra), RFP-Pk2 (in basso a sinistra), e memBFP (in alto a destra).Il pannello in basso a destra è una fusione dei canali Myl9-GFP e RFP-Pk2. Le immagini fisse e l’analisi di questi filmati sono fornite nella Figura 9A,B.

Figura 9.Coordinamento spazio-temporale del Prickle2 e dell’accumulo di actomiosina in corrispondenza delle giunzioni di restringimento.(A) Immagini confocali di un restringimento di un mosaico di giunzione a V, etichettato con Myl9-GFP, RFP-Pk2, e membranaBFP nel corso di un lasso di tempo di 1600 s e il profilo di intensità associata trama di intensità per ogni fluoroforo per tutta la lunghezza della giunzione. Scala = 10 µm. (B) Tracciato delle intensità medie nel tempo per la giunzione a V in (A) che mostra il cumulo pulsato di Pk2 (rosa) e Myl9 (verde) mentre la lunghezza della giunzione si riduce (linea tratteggiata nera). La casella arancione segna i punti di tempo rappresentati in (A) (C) Trama delle intensità medie nel tempo per un mosaico etichettato T-junction che mostra la co-cumulo pulsato di Pk2 (rosa) e Myl9 (verde) come giunzione fluttua tra il restringimento e la crescita (linea tratteggiata nera). (D) Trama di dispersione del cambiamento di intensità RFP-Pk2 contro il cambiamento di intensità GFP-Myl9 e la correlazione associata; una vista ingrandita del nucleo di questo grafico è mostrato in Panel c’. n = 96 giunzioni da tre embrioni attraverso due esperimenti. (E) Analisi di correlazione incrociata delle variazioni di intensità RFP-Pk2 e GFP-Myl9 nel tempo, con un coefficiente medio di correlazione incrociata di 0,7 a 0 s di ritardo temporale che dimostra la dinamica di accumulazione sincrona. n = 22 giunzioni da tre embrioni; le barre di errore rappresentano il SEM.

Video 6.Immagini confocali time-lapse di una piastra neurale di Xenopus laevis etichettata con Myl9-GFP (in alto a sinistra), RFP-Pk2 (in basso a sinistra) e memBFP (in alto a destra).Il pannello in basso a destra è una fusione dei canali Myl9-GFP e RFP-Pk2. Le immagini fisse e l’analisi di questi filmati sono fornite nella Figura 9A,B.
Discussione
Qui, abbiamo usato la piastrellatura delle immagini e la microscopia time-lapse negli embrioni di Xenopus per generare filmati ad alto ingrandimento del tubo neurale del vertebrato in chiusura. Questi filmati ci hanno permesso di quantificare la localizzazione e la dinamica della proteina del nucleo PCP in relazione ai comportamenti cellulari associati all’estensione convergente. Ci concentriamo qui sulla contrazione della giunzione, che insieme alle sporgenze mediolaterali è un comportamento subcellulare essenziale che contribuisce all’intercalazione cellulare. Troviamo che il Prickle2 e Vangl2 mostrano un modello coerente di localizzazione e di rotazione nello spazio e nel tempo durante l’intercalazione cellulare che è fortemente legato all’assemblaggio di actomiosina alle giunzioni cellula-cellula. Per comprendere appieno le relazioni qui riportate saranno necessari studi meccanicistici diretti, ma i nostri dati sono comunque significativi per fornire una visione completa e quantitativa dei modelli spaziali e temporali della localizzazione della proteina PCP durante i movimenti collettivi delle cellule vertebrate.
Localizzazione della proteina PCP nel tempo e nello spazio durante l’estensione convergente
L’asimmetria spaziale delle proteine del nucleo PCP è fondamentale per la loro funzione. In una vasta gamma di tipi di cellule, la polarizzazione planare è definita da Dvl e Frizzled arricchimento ad una regione della cellula e Vangl e Prickle in un modello reciproco. Il feedback attraverso le membrane cellulari è pensato per rinforzare l’asimmetria inizialmente debole, portando alla robusta asimmetria nelle fasi successive (Butler e Wallingford, 2017; Strutt e Strutt, 2009).
È interessante notare che, mentre l’intercalazione cellulare è stata la prima impostazione in cui è stato definito il PCP dei vertebrati, i primi rapporti di localizzazione asimmetrica della proteina nei vertebrati sono venuti invece da studi sulle cellule ciliate del nodo e delle vie aeree (Rida e Chen, 2009; Wallingford, 2010). In effetti, ancora oggi sappiamo poco dei modelli spaziali e quasi nulla dei modelli temporali della localizzazione della proteina PCP nel contesto dell’estensione convergente.
Attualmente, è emerso un consenso sul fatto che le proteine PCP delineano spazialmente un asse anteriore-posteriore nelle cellule che subiscono l’intercalazione cellulare. Questo consenso è supportato da studi su varie proteine PCP in diversi tessuti, prima nel pesce zebra e successivamente in altri animali (Ciruna et al., 2006; McGreevy et al., 2015; Nishimura et al., 2012; Ossipova et al., 2015; Roszko et al., 2015; Yin et al., 2008). Questo modello è coerente con l’analogo modello di localizzazione anteroposteriore per le proteine PCP nell’orientamento del battito ciliare direzionale nel nodo embrionale e nel midollo spinale (Antic et al., 2010; Borovina et al., 2010; Hashimoto et al., 2010). Inoltre, questo asse di polarizzazione è coerente con i dati embriologici che suggeriscono che il patterning anteroposteriore è cruciale per l’estensione convergente in Xenopus (Ninomiya et al., 2004). Tuttavia, va notato che diversi studi suggeriscono ulteriori regioni di localizzazione nelle estremità mediolaterali delle cellule durante l’intercalazione cellulare (ad esempio [Jiang et al., 2005; Kinoshita et al., 2003; Panousopoulou et al., 2013]).
I nostri dati qui sono coerenti con l’idea che la localizzazione anteroposteriore delle proteine PCP è fondamentale per l’intercalazione cellulare, anche se non escludono ruoli aggiuntivi nelle protrusioni mediolaterali, e la rottura del PCP disturba la polarità e la stabilità delle protrusioni mediolaterali (Wallingford et al., 2000). È significativo che lavori recenti suggeriscano che sia le protrusioni mediolaterali che la contrazione della giunzione agiscono insieme durante l’estensione convergente (Sun et al., 2017; Williams et al., 2014), quindi è chiaro che saranno necessari ulteriori studi.
A nostro avviso, i risultati più importanti qui riguardano gli aspetti temporali della localizzazione della proteina PCP, in quanto gli studi precedenti hanno fornito solo istantanee statiche di quello che è un processo altamente dinamico. I nostri studi time-lapse non solo rivelano che Prickle2 e Vangl2 sono dinamicamente arricchiti in giunzioni che si restringono, ma suggeriscono anche che lo stato di restringimento/ crescita di una giunzione può essere un fattore determinante per l’arricchimento della proteina PCP tanto quanto il suo orientamento lungo gli assi mediolaterale/anteroposteriore. Inoltre, i nostri dati FRAP rivelano che anche la cinetica di rotazione differisce con il comportamento dinamico delle giunzioni, con frazioni stabili più elevate associate a giunzioni che si restringono. Così, il nostro studio rivela una nuova complessità al modello di localizzazione della proteina PCP che probabilmente riflette la natura dinamica delle cellule coinvolte, in quanto si scambiano costantemente i vicini mentre si intercalano.
Infine, i nostri dati forniscono un interessante complemento agli studi precedenti che collegano il turnover alle giunzioni cellulari alla localizzazione della proteina PCP polarizzata planare. A Drosophila, le regioni arricchite della localizzazione della proteina PCP mostrano frazioni stabili più elevate rispetto alle regioni non arricchite, e la perdita della localizzazione asimmetrica della proteina dopo aver interrotto la segnalazione del PCP è accompagnata da una perdita di questo turnover asimmetrico (Strutt et al., 2011). Risultati simili sono stati ottenuti nelle cellule dell’epidermide dello Xenopus e nell’ovidotto murino (Butler e Wallingford, 2015; Chien et al., 2015; Shi et al., 2016). Tuttavia, lo scambio cellula-cellula vicina è minimo in quei contesti, a differenza di CE, dove tali scambi vicini sono costanti. Troviamo quindi interessante che abbiamo osservato una tendenza simile durante l’intercalazione cellulare, dove le regioni arricchite della localizzazione della proteina PCP mostrano anche frazioni più alte e stabili della proteina PCP, anche se queste giunzioni si restringono drasticamente. È interessante notare che, quando abbiamo calcolato la frazione media stabile per le proteine PCP (cioè la media di tutte le giunzioni), questo valore era sostanzialmente inferiore a quello che abbiamo osservato in precedenza con metodi simili nelle cellule multiciliate di Xenopus (Butler e Wallingford, 2015); questa differenza può rappresentare un adattamento alla natura dinamica delle giunzioni coinvolte. Insieme agli studi precedenti, i nostri dati dimostrano che la cinetica di rotazione delle giunzioni planari polarizzate è una caratteristica generale della localizzazione della proteina PCP, che abbraccia un ampio spettro di organismi e tipi di cellule.
L’interazione tra la proteina PCP e la miosina durante l’estensione convergente
Un altro risultato interessante di questo studio è lo stretto rapporto spazio-temporale tra le proteine del PCP e la miosina alle giunzioni di contrazione. È stato dimostrato che le proteine PCP sono necessarie per la fosforilazione della miosina durante l’intercalazione cellulare nello xenopus, nei pulcini e nei topi (Lienkamp et al., 2012; McGreevy et al., 2015; Nishimura et al., 2012; Shindo e Wallingford, 2014; Williams et al., 2014), così come nella coclea dei topi (Lee et al., 2012). Il meccanismo con cui le proteine PCP agiscono sulla miosina rimane poco chiaro, ma delle proteine PCP è il Dvl ad essere più direttamente coinvolto. Il Dvl agisce attraverso la formina Daam1, il PDZ-RhoGEF, e la RhoA per attivare la Rho Kinase (Habas et al., 2001; Nishimura et al., 2012), che a sua volta è essenziale per l’intercalazione cellulare (Marlow et al., 2002; Ybot-Gonzalez et al., 2007). Quindi, la nostra attenzione qui su Prickle e Vangl (resa necessaria dalla complessità della funzione Dvl/Fzd) è un limite, perché i meccanismi con cui Pk2 e Vangl2 impattano l’attivazione della miosina sono sconosciuti.
Poiché il feedback meccanico contribuisce alle oscillazioni di actomiosina alle giunzioni di contrazione durante l’intercalazione cellulare indipendente dal PCP in Drosophila (ad esempio [Fernandez-Gonzalez et al., 2009]), un’ipotesi attraente coinvolge Dvl / RoA-mediata accumulo di miosina su una faccia cellulare con conseguente accumulo di miosina meccanicamente indotta sulla faccia della cellula opposta. In questo caso, Pk2 e Vangl2 funzionano solo per garantire la localizzazione Dvl/Fzd dall’altro lato della giunzione. In alternativa, Pk2 e Vangl2 possono anche interagire direttamente con i macchinari di actomiosina da un meccanismo ancora da descrivere.
Indipendentemente dal meccanismo preciso, è chiaro che è necessario un sistema PCP funzionale per guidare la contrazione della miosina, quindi è interessante che due studi recenti suggeriscono che, al contrario, la miosina è necessaria per la normale localizzazione della proteina PCP. L’interruzione dell’azione della miosina interrompe la localizzazione polarizzata di Vangl2 nella placca neurale di Xenopus e di Pk nella notocorda ascidica (Newman-Smith et al., 2015; Ossipova et al., 2015). Questi dati possono suggerire una relazione ‘reciproca’ tra le proteine PCP e la miosina, un’idea supportata dalle nostre osservazioni di una strettissima correlazione temporale e spaziale tra i livelli di miosina e i livelli di Pk2 alle giunzioni cellula-cellula. Tuttavia, poiché ci sono prove che gli stimoli meccanici possono avere un impatto sulla segnalazione del PCP in Drosophila, Xenopus e nei topi (Aigouy et al., 2010; Bosveld et al., 2012; Chien et al., 2015; Luxenburg et al., 2015), è importante considerare che sia la placca neurale che la notocorda sono impegnate in movimenti cellulari collettivi su larga scala. L’ampia applicazione degli inibitori della miosina perturberebbe chiaramente i modelli globali di movimento cellulare e persino l’orientamento e l’entità della tensione esercitata sulle giunzioni cellula-cellula, per cui l’inibizione della miosina potrebbe disturbare secondariamente la localizzazione della proteina PCP. Per affrontare adeguatamente questo problema saranno necessari futuri esperimenti che utilizzino l’inibizione della miosina acuta, risolta spazialmente, per risolvere questo problema.
Conclusioni
In sintesi, i dati qui riportati forniscono una visione quantitativa e dinamica della localizzazione della proteina PCP in relazione al comportamento subcellulare che guida l’intercalazione cellulare. Questo lavoro fornisce nuove intuizioni sul problema generale di come i sistemi di segnalazione dello sviluppo come l’interfaccia PCP con macchine cellulari fondamentali come l’actomiosina. Infine, poiché i difetti nella segnalazione del PCP sono fortemente legati ai difetti del tubo neurale umano, questo lavoro pone anche le basi per comprendere lo spettro crescente delle mutazioni associate alla malattia umana nei geni del PCP.
Materiali e metodi
Manipolazioni di Xenopus
Le uova erano e sono state fecondate esternamente secondo i protocolli standard (Sive et al., 2000). Il cappotto di gelatina è stato rimosso dagli embrioni allo stadio di due cellule facendo il bagno in una soluzione di cisteina al 2% (pH 7,9). Gli embrioni sono stati poi lavati in 1/3x Ringer modificato di Marc (MMR) e microiniettato in una soluzione di 1/3x MMR con il 2% di Ficoll utilizzando un manipolatore di Oxford. La codifica mRNAs per le fusioni proteiche fluorescenti sono stati sintetizzati utilizzando mMessage mMachine kit (Ambion) e iniettato in uno degli otto blastomeri dorsali per l’etichettatura anche della piastra neurale alle seguenti concentrazioni: 50 pg membraneGFP, 60 pg di membraneRFP, 80 pg di membraneBFP, 200 pg per GFP- o RFP-Pk2, 60 pg per GFP-Vangl2, 50 pg per H2B-RFP, e 30 pg per Myl9-GFP. Per i tessuti etichettati a mosaico, gli mRNA sono stati iniettati nelle fasi a 16 o 32 cellule con circa il 70% degli importi totali sopra elencati. Dominante-negativo Pk2 (Pk2-ΔPETΔLIM) è stato iniettato a 700-800 pg per la sovraespressione, allo stadio a otto cellule, come è stato il dominante-negativo Dvl (Xdd1), ed entrambi sono stati analogamente ridotti del 70% per le iniezioni in fase successiva. Per i trattamenti con morfolino Pk2, 20-25 ng sono stati iniettati in una cella allo stadio a otto celle, e 400 pg di GFP-Pk2 sono stati utilizzati per salvare i fenotipi di morfolino. Fasi di sviluppo sono stati determinati secondo (Nieuwkoop e Faber, 1994).
Immagine dal vivo e quantificazione dell’immagine
L’imaging confocale è stato fatto utilizzando embrioni vivi immersi in 1/3x MMR in camere cellulari AttoFluor Cell Chambers (Life Technologies A7816) e tra i vetri di copertura, utilizzando grasso siliconico come distanziatore adesivo, e realizzato con un microscopio confocale Zeiss LSM700. Le immagini sono state elaborate con la distribuzione alle Fiji delle suite di software ImageJ, Imaris (Bitplane) e Photoshop (Adobe) e le figure sono state assemblate in Illustrator (Adobe). Per le misure di lunghezza della giunzione e di arricchimento delle proteine, sono state tracciate delle linee (3-6 pixel di larghezza, a seconda della scala dell’immagine / zoom) sulle regioni giunzionali delle cellule (esclusi i vertici giunzionali tricellulari), mentre le misure citoplasmatiche sono state prese utilizzando gli strumenti di forma a mano libera all’interno delle regioni corticali apicolaterali. Intensità medie di fluorescenza PCP e Myl9 lungo una giunzione cellula-cellula sono stati normalizzati a contro l’etichetta della membrana in analisi dei cambiamenti di PCP vs. durante i cambiamenti di lunghezza della giunzione (Supp. Figura 6) e contro la media delle intensità citoplasmatiche delle due cellule che condividono una giunzione nelle analisi quando le cellule sono etichettati. (Figure 1B e 8C). Le analisi statistiche sono state effettuate utilizzando il software Prism (Graphpad) con i test di Mann Whitney per le correlazioni non parametriche di significato e Spearman. Sono stati eliminati dall’analisi gli outlier estremi con intensità di fluorescenza più di tre deviazioni standard dalla media; in tutti i dataset tali outlier erano molto rari (<6). Questi valori anomali rappresentano probabilmente onde di contrazione non specifiche, talvolta osservate nella placca neurale di Xenopus. Per l’analisi FRAP, i filmati time-lapse sono stati acquisiti dopo la localizzazione di fusioni PCP GFP del core PCP a domini discreti di photobleaching. Le misurazioni dell’intensità sono state effettuate alle Fiji, con registrazioni per ogni punto temporale prese singolarmente da ogni fotogramma catturate in regioni sbiancate e normalizzate come descritto in Goldman e Spector (2005). L’analisi statistica è stata eseguita nel software Prism (Graphpad) con funzioni di decadimento esponenziale. Gli angoli delle giunzioni che si restringono a formare ed emergono dalle rosette sono stati misurati manualmente nelle Fiji, e i diagrammi a rose sono stati tracciati con il software Oriana (Kovach Computing Services). L’analisi della correlazione incrociata è stata eseguita utilizzando un calcolatore statistico gratuito basato sul web all’indirizzo www.wessa.net. L’imaging stereo time-lapse è stato eseguito utilizzando uno stereomicroscopio Zeiss AXIO Zoom.V16 e il software Zen associato. I filmati sono stati esportati dalle Fiji ed elaborati in Adobe Photoshop, e il tracking delle cellule è stato eseguito con il plug-in di tracking manuale delle Fiji.
References
- Aigouy B, Farhadifar R, Staple DB, Sagner A, Röper JC, Jülicher F, Eaton S. Cell flow reorients the axis of planar polarity in the wing epithelium of Drosophila. Cell. 2010; 142:773-786. DOI | PubMed
- Antic D, Stubbs JL, Suyama K, Kintner C, Scott MP, Axelrod JD. Planar cell polarity enables posterior localization of nodal cilia and left-right axis determination during mouse and Xenopus embryogenesis. PLoS One. 2010; 5DOI | PubMed
- Axelrod JD. Unipolar membrane association of dishevelled mediates frizzled planar cell polarity signaling. Genes & Development. 2001; 15:1182-1187. DOI | PubMed
- Bastock R, Strutt H, Strutt D. Strabismus is asymmetrically localised and binds to Prickle and Dishevelled during Drosophila planar polarity patterning. Development. 2003; 130:3007-3014. DOI | PubMed
- Bertet C, Sulak L, Lecuit T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 2004; 429:667-671. DOI | PubMed
- Blankenship JT, Backovic ST, Sanny JS, Weitz O, Zallen JA. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Developmental Cell. 2006; 11:459-470. DOI | PubMed
- Borovina A, Superina S, Voskas D, Ciruna B. Vangl2 directs the posterior tilting and asymmetric localization of motile primary cilia. Nature Cell Biology. 2010; 12:407-412. DOI | PubMed
- Bosveld F, Bonnet I, Guirao B, Tlili S, Wang Z, Petitalot A, Marchand R, Bardet PL, Marcq P, Graner F, Bellaïche Y. Mechanical control of morphogenesis by Fat/Dachsous/Four-jointed planar cell polarity pathway. Science. 2012; 336:724-727. DOI | PubMed
- Burkel BM, von Dassow G, Bement WM. Versatile fluorescent probes for actin filaments based on the actin-binding domain of utrophin. Cell Motility and the Cytoskeleton. 2007; 64:822-832. DOI | PubMed
- Butler MT, Wallingford JB. Control of vertebrate core planar cell polarity protein localization and dynamics by Prickle 2. Development. 2015; 142:3429-3439. DOI | PubMed
- Butler MT, Wallingford JB. Planar cell polarity in development and disease. Nature Reviews Molecular Cell Biology. 2017; 18:375-388. DOI | PubMed
- Chien YH, Keller R, Kintner C, Shook DR. Mechanical strain determines the axis of planar polarity in ciliated epithelia. Current Biology. 2015; 25:2774-2784. DOI | PubMed
- Ciruna B, Jenny A, Lee D, Mlodzik M, Schier AF. Planar cell polarity signalling couples cell division and morphogenesis during neurulation. Nature. 2006; 439:220-224. DOI | PubMed
- Darken RS, Scola AM, Rakeman AS, Das G, Mlodzik M, Wilson PA. The planar polarity gene strabismus regulates convergent extension movements in Xenopus. The EMBO Journal. 2002; 21:976-985. DOI | PubMed
- De Marco P, Merello E, Piatelli G, Cama A, Kibar Z, Capra V. Planar cell polarity gene mutations contribute to the etiology of human neural tube defects in our population. Birth Defects Research Part A: Clinical and Molecular Teratology. 2014; 100:633-641. DOI | PubMed
- Elul T, Koehl MA, Keller R. Cellular mechanism underlying neural convergent extension in Xenopus laevis embryos. Developmental Biology. 1997; 191:243-258. DOI | PubMed
- Fernandez-Gonzalez R, Simoes SM, Röper JC, Eaton S, Zallen JA. Myosin II dynamics are regulated by tension in intercalating cells. Developmental Cell. 2009; 17:736-743. DOI | PubMed
- Goldman RD, Spector DL. Live Cell Imaging: A Laboratory Manual. CSHL Press: Cold Spring Harbor, NY; 2005.
- Goto T, Davidson L, Asashima M, Keller R. Planar cell polarity genes regulate polarized extracellular matrix deposition during frog gastrulation. Current Biology. 2005; 15:787-793. DOI | PubMed
- Goto T, Keller R. The planar cell polarity gene strabismus regulates convergence and extension and neural fold closure in Xenopus. Developmental Biology. 2002; 247:165-181. DOI | PubMed
- Habas R, Kato Y, He X. Wnt/Frizzled activation of Rho regulates vertebrate gastrulation and requires a novel Formin homology protein Daam1. Cell. 2001; 107:843-854. DOI | PubMed
- Hashimoto M, Shinohara K, Wang J, Ikeuchi S, Yoshiba S, Meno C, Nonaka S, Takada S, Hatta K, Wynshaw-Boris A, Hamada H. Planar polarization of node cells determines the rotational axis of node cilia. Nature Cell Biology. 2010; 12:170-176. DOI | PubMed
- Jiang D, Munro EM, Smith WC. Ascidian prickle regulates both mediolateral and anterior-posterior cell polarity of notochord cells. Current Biology. 2005; 15:79-85. DOI | PubMed
- Juriloff DM, Harris MJ. A consideration of the evidence that genetic defects in planar cell polarity contribute to the etiology of human neural tube defects. Birth Defects Research Part A: Clinical and Molecular Teratology. 2012; 94:824-840. DOI | PubMed
- Keller R, Hardin J. Cell behaviour during active cell rearrangement: evidence and speculations. Journal of Cell Science. 1987; 8:369-393. DOI | PubMed
- Keller R, Shih J, Sater A. The cellular basis of the convergence and extension of the Xenopus neural plate. Developmental Dynamics. 1992; 193:199-217. DOI | PubMed
- Kibar Z, Vogan KJ, Groulx N, Justice MJ, Underhill DA, Gros P. Ltap, a mammalian homolog of Drosophila Strabismus/Van Gogh, is altered in the mouse neural tube mutant Loop-tail. Nature Genetics. 2001; 28:251-255. DOI | PubMed
- Kieserman EK, Lee C, Gray RS, Park TJ, Wallingford JB. High-magnification in vivo imaging of Xenopus embryos for cell and developmental biology. Cold Spring Harbor Protocols. 2010; 2010DOI | PubMed
- Kinoshita N, Iioka H, Miyakoshi A, Ueno N. PKC delta is essential for Dishevelled function in a noncanonical Wnt pathway that regulates Xenopus convergent extension movements. Genes & Development. 2003; 17:1663-1676. DOI | PubMed
- Lee J, Andreeva A, Sipe CW, Liu L, Cheng A, Lu X. PTK7 regulates myosin II activity to orient planar polarity in the mammalian auditory epithelium. Current Biology. 2012; 22:956-966. DOI | PubMed
- Lienkamp SS, Liu K, Karner CM, Carroll TJ, Ronneberger O, Wallingford JB, Walz G. Vertebrate kidney tubules elongate using a planar cell polarity-dependent, rosette-based mechanism of convergent extension. Nature Genetics. 2012; 44:1382-1387. DOI | PubMed
- Luxenburg C, Heller E, Pasolli HA, Chai S, Nikolova M, Stokes N, Fuchs E. Wdr1-mediated cell shape dynamics and cortical tension are essential for epidermal planar cell polarity. Nature Cell Biology. 2015; 17:592-604. DOI | PubMed
- Marlow F, Topczewski J, Sepich D, Solnica-Krezel L. Zebrafish Rho kinase 2 acts downstream of Wnt11 to mediate cell polarity and effective convergence and extension movements. Current Biology. 2002; 12:876-884. DOI | PubMed
- McGreevy EM, Vijayraghavan D, Davidson LA, Hildebrand JD. Shroom3 functions downstream of planar cell polarity to regulate myosin II distribution and cellular organization during neural tube closure. Biology Open. 2015; 4:186-196. DOI | PubMed
- Newman-Smith E, Kourakis MJ, Reeves W, Veeman M, Smith WC. Reciprocal and dynamic polarization of planar cell polarity core components and myosin. eLife. 2015; 4DOI | PubMed
- Nieuwkoop PD, Faber J. Normal Table of Xenopus Laevis (Daudin). 1994.
- Ninomiya H, Elinson RP, Winklbauer R. Antero-posterior tissue polarity links mesoderm convergent extension to axial patterning. Nature. 2004; 430:364-367. DOI | PubMed
- Nishimura T, Honda H, Takeichi M. Planar cell polarity links axes of spatial dynamics in neural-tube closure. Cell. 2012; 149:1084-1097. DOI | PubMed
- Ossipova O, Kim K, Sokol SY. Planar polarization of Vangl2 in the vertebrate neural plate is controlled by Wnt and Myosin II signaling. Biology Open. 2015; 4:722-730. DOI | PubMed
- Panousopoulou E, Tyson RA, Bretschneider T, Green JB. The distribution of Dishevelled in convergently extending mesoderm. Developmental Biology. 2013; 382:496-503. DOI | PubMed
- Paré AC, Vichas A, Fincher CT, Mirman Z, Farrell DL, Mainieri A, Zallen JA. A positional Toll receptor code directs convergent extension in Drosophila. Nature. 2014; 515:523-527. DOI | PubMed
- Rauzi M, Verant P, Lecuit T, Lenne PF. Nature and anisotropy of cortical forces orienting Drosophila tissue morphogenesis. Nature Cell Biology. 2008; 10:1401-1410. DOI | PubMed
- Rida PC, Chen P. Line up and listen: Planar cell polarity regulation in the mammalian inner ear. Seminars in Cell & Developmental Biology. 2009; 20:978-985. DOI | PubMed
- Roszko I, S Sepich D, Jessen JR, Chandrasekhar A, Solnica-Krezel L. A dynamic intracellular distribution of Vangl2 accompanies cell polarization during zebrafish gastrulation. Development. 2015; 142:2508-2520. DOI | PubMed
- Schroeder TE. Neurulation in Xenopus Laevis. an analysis and model based upon light and electron microscopy. Journal of Embryology and Experimental Morphology. 1970; 23:427-462. PubMed
- Shi D, Usami F, Komatsu K, Oka S, Abe T, Uemura T, Fujimori T. Dynamics of planar cell polarity protein Vangl2 in the mouse oviduct epithelium. Mechanisms of Development. 2016; 141:78-89. DOI | PubMed
- Shih J, Keller R. Cell motility driving mediolateral intercalation in explants of xenopus laevis. Development. 1992; 116:901-914. PubMed
- Shindo A, Wallingford JB. PCP and septins compartmentalize cortical actomyosin to direct collective cell movement. Science. 2014; 343:649-652. DOI | PubMed
- Sive HL, Grainger RM, Harland RM. Early Development of Xenopus Laevis: A Laboratory Manual. 2000.
- Sokol SY. Analysis of Dishevelled signalling pathways during Xenopus development. Current Biology. 1996; 6:1456-1467. DOI | PubMed
- Strutt DI. Asymmetric localization of frizzled and the establishment of cell polarity in the Drosophila wing. Molecular Cell. 2001; 7:367-375. DOI | PubMed
- Strutt H, Strutt D. Asymmetric localisation of planar polarity proteins: Mechanisms and consequences. Seminars in Cell & Developmental Biology. 2009; 20:957-963. DOI | PubMed
- Strutt H, Warrington SJ, Strutt D. Dynamics of core planar polarity protein turnover and stable assembly into discrete membrane subdomains. Developmental Cell. 2011; 20:511-525. DOI | PubMed
- Sun Z, Amourda C, Shagirov M, Hara Y, Saunders TE, Toyama Y. Basolateral protrusion and apical contraction cooperatively drive Drosophila germ-band extension. Nature Cell Biology. 2017; 19:375-383. DOI | PubMed
- Tada M, Heisenberg CP. Convergent extension: using collective cell migration and cell intercalation to shape embryos. Development. 2012; 139:3897-3904. DOI | PubMed
- Takeuchi M, Nakabayashi J, Sakaguchi T, Yamamoto TS, Takahashi H, Takeda H, Ueno N. The prickle-related gene in vertebrates is essential for gastrulation cell movements. Current Biology. 2003; 13:674-679. DOI | PubMed
- Tree DR, Shulman JM, Rousset R, Scott MP, Gubb D, Axelrod JD. Prickle mediates feedback amplification to generate asymmetric planar cell polarity signaling. Cell. 2002; 109:371-381. DOI | PubMed
- Trichas G, Smith AM, White N, Wilkins V, Watanabe T, Moore A, Joyce B, Sugnaseelan J, Rodriguez TA, Kay D, Baker RE, Maini PK, Srinivas S. Multi-cellular rosettes in the mouse visceral endoderm facilitate the ordered migration of anterior visceral endoderm cells. PLoS Biology. 2012; 10DOI | PubMed
- Walck-Shannon E, Hardin J. Cell intercalation from top to bottom. Nature Reviews Molecular Cell Biology. 2014; 15:34-48. DOI | PubMed
- Wallingford JB, Harland RM. Xenopus dishevelled signaling regulates both neural and mesodermal convergent extension: parallel forces elongating the body Axis. Development. 2001; 128:2581-2592. PubMed
- Wallingford JB, Harland RM. Neural tube closure requires Dishevelled-dependent convergent extension of the midline. Development. 2002; 129:5815-5825. DOI | PubMed
- Wallingford JB, Niswander LA, Shaw GM, Finnell RH. The continuing challenge of understanding, preventing, and treating neural tube defects. Science. 2013; 339DOI | PubMed
- Wallingford JB, Rowning BA, Vogeli KM, Rothbächer U, Fraser SE, Harland RM. Dishevelled controls cell polarity during Xenopus gastrulation. Nature. 2000; 405:81-85. DOI | PubMed
- Wallingford JB. Planar cell polarity signaling, cilia and polarized ciliary beating. Current Opinion in Cell Biology. 2010; 22:597-604. DOI | PubMed
- Williams M, Yen W, Lu X, Sutherland A. Distinct apical and basolateral mechanisms drive planar cell polarity-dependent convergent extension of the mouse neural plate. Developmental Cell. 2014; 29:34-46. DOI | PubMed
- Ybot-Gonzalez P, Savery D, Gerrelli D, Signore M, Mitchell CE, Faux CH, Greene ND, Copp AJ. Convergent extension, planar-cell-polarity signalling and initiation of mouse neural tube closure. Development. 2007; 134:789-799. DOI | PubMed
- Yin C, Kiskowski M, Pouille PA, Farge E, Solnica-Krezel L. Cooperation of polarized cell intercalations drives convergence and extension of presomitic mesoderm during zebrafish gastrulation. The Journal of Cell Biology. 2008; 180:221-232. DOI | PubMed
- Zallen JA, Wieschaus E. Patterned gene expression directs bipolar planar polarity in Drosophila. Developmental Cell. 2004; 6:343-355. DOI | PubMed
Fonte
Butler MT, Wallingford JB, Solnica-Krezel L, Stainier DY () Spatial and temporal analysis of PCP protein dynamics during neural tube closure. eLife 7e36456. https://doi.org/10.7554/eLife.36456





