Introduzione
Le unità di terapia intensiva (ICU) sono progettate per la cura di pazienti con condizioni di pericolo di vita acuta. L’invecchiamento della popolazione, associato a una crescente incidenza di pazienti con comorbilità cronica, aumenta la necessità di posti letto per le unità di terapia intensiva nei paesi ad alto reddito.1 Ciò rappresenta un onere significativo sia a livello individuale che collettivo. Il beneficio del ricovero in terapia intensiva per i pazienti anziani è stato messo in discussione2,3,4 perché può portare a cure invasive non necessarie e a spese sanitarie evitabili.5 Di conseguenza, è in corso un dibattito sull’opportunità di utilizzare l’età come criterio per l’ammissione in terapia intensiva.
In Francia, il numero di posti letto in terapia intensiva per 100.000 abitanti è alla media europea,6 senza barriere finanziarie per l’accesso alle cure in terapia intensiva, grazie a un sistema nazionale di assicurazione sanitaria che offre una copertura universale per la popolazione francese. Tuttavia, esistono pochi studi su larga scala basati sulla popolazione che documentano i risultati a breve e a lungo termine dei pazienti adulti dopo la dimissione in terapia intensiva in tutti gli strati di età. L’uso di un database nazionale dei sinistri per documentare gli esiti a breve e a lungo termine dei pazienti ricoverati in terapia intensiva potrebbe fornire informazioni essenziali al pubblico, ai medici, ai decisori sanitari e ai ricercatori clinici.
L’obiettivo principale del nostro studio è stato quello di descrivere la mortalità a breve e a lungo termine (in ospedale e a 3 mesi e 3 anni dopo la dimissione dall’ospedale) dei pazienti adulti ricoverati in terapia intensiva in Francia nel 2013. Un’attenzione particolare è stata dedicata all’associazione dell’età.
Metodi
Fonte dei dati
I dati sono stati ottenuti dal database del sistema sanitario nazionale francese (Système National des Données de Santé [SNDS], precedentemente denominato Système National d’Information Interrégimes de l’Assurance Maladie [SNIIRAM]). Queste fonti comprendono dati sanitari amministrativi completi e anonimi, rimborsati dal sistema nazionale francese di assicurazione malattia.7 Lo SNDS comprende la banca dati francese delle dimissioni ospedaliere (Programme de Médicalisation des Systèmes d’Information [PMSI]), che contiene le diagnosi e le procedure ospedaliere e che è collegata ai dati ambulatoriali (farmaci su prescrizione, visite mediche e indagini di laboratorio o di imaging). La data del decesso è riportata in modo esaustivo per i beneficiari del regime di copertura al 100%. Lo SNDS include anche dati sullo stato del paziente per il regime di copertura al 100% per le malattie a lungo termine. I ricoveri ospedalieri sono classificati dal sistema Groupes Homogènes de Malades (GHM), un adattamento francese dei gruppi correlati alla diagnosi. Le diagnosi ospedaliere e le diagnosi di malattie a lungo termine sono codificate secondo la Classificazione Statistica Internazionale delle Malattie, 10a Revisione. Le procedure sono codificate secondo la classificazione comune francese delle procedure mediche (Classification Commune des Actes Médicaux [CCAM]). Questo studio di coorte ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE) (eFigure 1 nel supplemento). L’utilizzo dei dati SNDS da parte della Caisse Nationale d’Assurance Maladie (CNAM) è stato approvato con decreto e dall’autorità francese per la protezione dei dati (Commission Nationale de l’Informatique et des Libertés [CNIL]). Si è rinunciato al consenso informato. La CNAM ha accesso permanente ai dati SNDS in applicazione delle disposizioni dell’articolo R. 1461-12 del codice della sanità pubblica francese. Tutti i dati sono identificati.
Studiare la popolazione
Tutti i pazienti di età pari o superiore ai 18 anni coperti dal regime generale dell’assicurazione sanitaria nazionale francese (ossia il principale regime di assicurazione sanitaria che copre circa il 76% della popolazione residente in Francia) che sono stati ricoverati in una struttura sanitaria in Francia per almeno 1 notte tra il 1° gennaio e il 31 dicembre 2013, sono stati inclusi in questo studio osservazionale (eFigure 1 nel Supplemento). Non sono stati inclusi i pazienti ricoverati in unità ustionati e in unità di dimissione. Le date di analisi erano da novembre 2017 a dicembre 2018.
Analisi statistica
Le caratteristiche della popolazione comprendono l’età, il sesso, le comorbilità, il motivo del ricovero, le procedure di terapia intensiva, la durata della degenza ospedaliera, la durata della degenza in terapia intensiva e il punteggio II di Fisiologia Acuta Semplificata. I dati sulle comorbilità sono stati ricavati da algoritmi che combinano diagnosi ospedaliere, informazioni sulle malattie a lungo termine e richieste di rimborso in farmacia applicate annualmente a ciascun beneficiario del regime generale. Le comorbilità identificate nel 2012 sono state utilizzate in questo studio, riferendosi all’anno precedente al soggiorno in terapia intensiva nel 2013. I metodi dettagliati degli algoritmi di identificazione delle morbilità sono disponibili al pubblico in francese.8 È disponibile anche una presentazione sintetica in inglese.9
I tassi di mortalità grezza sono stati calcolati nei seguenti punti finali predefiniti: in ospedale, 3 mesi e 3 anni dopo il ricovero e 3 mesi e 3 anni dopo la dimissione dall’ospedale. La coorte è stata suddivisa in 10 diversi strati di età, da 18 a 34 anni a 90 anni e oltre. Gli indici di mortalità standardizzati per età e sesso (SMR) sono stati calcolati per il primo, il secondo e il terzo anno dopo la dimissione ospedaliera per i sopravvissuti di ogni periodo per consentire il confronto del tasso di mortalità tra la popolazione dello studio e quella della popolazione generale francese.10 L’SMR è il rapporto tra i decessi osservati all’interno della popolazione dello studio diviso per i decessi previsti. I decessi previsti sono stati calcolati in base al tasso di mortalità della popolazione generale francese applicato a ogni strato di età e sesso. Il tasso di mortalità della popolazione generale del 2014 è stato utilizzato per il primo anno, quello del 2015 per il secondo anno e quello del 2016 per il terzo anno.
I modelli di regressione logistica sono stati utilizzati per valutare i fattori associati a (1) mortalità in ospedale, (2) mortalità entro 3 mesi dalla dimissione ospedaliera e (3) mortalità tra 3 mesi e 3 anni dopo la dimissione ospedaliera. La prima analisi è stata effettuata su tutta la coorte. Una seconda analisi è stata eseguita sui sopravvissuti in ospedale, e una terza analisi è stata condotta sui sopravvissuti di 3 mesi. Variabili esplicative identiche sono state incluse in tutti i modelli, inclusi i dati demografici, le comorbilità, la ragione del ricovero e le procedure di terapia intensiva. Per ogni paziente è stato calcolato un rischio di mortalità e la popolazione è stata poi classificata in quintili, dalla probabilità di mortalità più bassa (quintile 1) a quella più alta (quintile 5). Le caratteristiche della popolazione sono state descritte in base ai quintili di rischio di mortalità per i 3 periodi, come sopra citato. I modelli di regressione logistica sono stati eseguiti tra i pazienti di età inferiore agli 80 anni e quelli di età pari o superiore agli 80 anni.2 I risultati sono espressi come percentuale o mediana e intervallo interquartile (IQR), SMR e CI al 95%, o odds ratio (OR) e CI al 95%. Le analisi sono state eseguite utilizzando il software SAS 9.2 (associato a SAS Enterprise Guide versione 7.13; SAS Institute Inc.)
Risultati
Caratteristiche dei pazienti ricoverati in terapia intensiva
Nel 2013, un totale di 208-275 pazienti sono stati ricoverati in un’unità di terapia intensiva francese, di cui 133966 sono stati inclusi nell’analisi (eFig. 1 nel supplemento ). L’età media era di 65 anni (IQR, 53-76 anni) e il 59,9% era di sesso maschile. Le caratteristiche sono elencate nella Tabella 1. L’89 per cento dei pazienti è stato ricoverato da casa, con il 46,0 per cento tramite il pronto soccorso. Il 48 per cento sono stati pazienti chirurgici, di cui il 17,7% ha subito un intervento di cardiochirurgia. Le malattie respiratorie (16,3%) e cardiovascolari (10,0%) sono state le 2 principali cause di ricovero non chirurgico. Le ragioni del ricovero in ospedale per fasce d’età sono indicate in eFigure 2 nel Supplemento.
| Variabile | Valore |
|---|---|
| No. | 133 966 |
| Categoria di età, y, n. (%) | |
| 18-34 | 10 122 (7.6) |
| 35-44 | 9514 (7.1) |
| 45-54 | 17 120 (12.8) |
| 55-64 | 27 899 (20.8) |
| 65-69 | 16 144 (12.1) |
| 70-74 | 14 130 (10.5) |
| 75-79 | 15 754 (11.8) |
| 80-84 | 13 820 (10.3) |
| 85-89 | 7280 (5.4) |
| ≥90 | 2183 (1.6) |
| Sesso, No. (%) | |
| Maschio | 80 296 (59.9) |
| Femmina | 53 670 (40.1) |
| Comorbidità, n. (%) | |
| Insufficienza cardiaca | 13 660 (10.2) |
| Malattia cerebrovascolare | 6917 (5.2) |
| Diabete | 29 854 (22.3) |
| Cancro attivo | 13 026 (9.7) |
| Demenza, compreso il morbo di Alzheimer | 3029 (2.3) |
| Malattia respiratoria cronica | 26 915 (20.1) |
| Malattia renale allo stadio finale | 3378 (2.5) |
| Malattia del fegato | 7372 (5.5) |
| Pazienti chirurgici, n. (%) | 63 704 (47.6) |
| Motivo del ricovero, n. (%) | |
| Chirurgia cardiaca | 23 712 (17.7) |
| Malattia respiratoria | 21 879 (16.3) |
| Malattie cardiovascolari | 13 444 (10.0) |
| Malattia neurologica | 7842 (5.9) |
| Chirurgia non cardiaca | 36 254 (27.1) |
| Avvelenamento | 6317 (4.7) |
| Epatogastroenterologia | 5306 (4.0) |
| Malattia renale o metabolica | 5377 (4.0) |
| Traumi e ustioni | 4387 (3.3) |
| Trapianto di organi | 1832 (1.4) |
| Malattia infettiva | 2930 (2.2) |
| Varie | 4686 (3.5) |
| Procedure di terapia intensiva, n. (%) | |
| Ventilazione meccanica invasiva | 81 303 (60.7) |
| Ventilazione meccanica non invasiva | 35 673 (26.6) |
| Vasopressori o inotropi | 53 166 (39.7) |
| Rianimazione fluida | 24 696 (18.4) |
| Somministrazione di prodotti sanguigni | 8948 (6.7) |
| Rianimazione cardiopolmonare con intubazione | 3277 (2.4) |
| Terapia sostitutiva renale | 14 918 (11.1) |
| Cardioversione elettrica esterna di emergenza | 1800 (1.3) |
| Monitoraggio della pressione intracranica | 2483 (1.9) |
| Supporto circolatorio meccanico | 1707 (1.3) |
| Durata della degenza ospedaliera, mediana (IQR), d | 13 (7-23) |
| Durata della permanenza in terapia intensiva, mediana (IQR), d | 3 (2-8) |
| SAPS II, mediana (IQR)a | 37 (26-52) |
| Dati mancanti, No.b | 454 |
Tassi di mortalità del greggio e SMR
Le curve di sopravvivenza per fasce d’età per la coorte totale e per i sopravvissuti ospedalieri sono mostrate nella Figura 1Ae B, rispettivamente. Il tasso di mortalità complessiva in ospedale è stato del 19,0%. I tassi di mortalità a 3 mesi e a 3 anni dopo il ricovero ospedaliero sono stati rispettivamente del 23,1% e del 39,7%. La sopravvivenza mediana dei pazienti anziani (≥80 anni) ricoverati in terapia intensiva è stata di 24 mesi per i pazienti di età compresa tra gli 80 e gli 84 anni, di 10 mesi per quelli di età compresa tra gli 85 e gli 89 anni e di 4 mesi per quelli di 90 anni e più. Per i 108-539 pazienti dimessi vivi dall’ospedale, il 6,8% è morto di 3 mesi e il 25,8% è morto di 3 anni dopo la dimissione dall’ospedale. Tra i pazienti dimessi vivi, la sopravvivenza mediana è stata di 35 mesi per la coorte di età compresa tra gli 85 e gli 89 anni e di 22 mesi per i 90 anni e più. I tassi di mortalità in ospedale e a 3 anni dopo la dimissione sono stati rispettivamente del 30,5% e del 44,9% nei pazienti di 80 anni e più rispetto al 16,5% e al 22,5% nei pazienti di età superiore agli 80 anni. La mortalità totale a 3 anni è stata del 61,4% nei pazienti di 80 anni e più rispetto al 35,1% nei pazienti di età inferiore agli 80 anni.
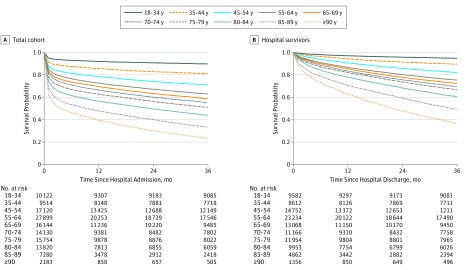
Figura 1.Curve di sopravvivenza Kaplan-Meier di tutti i pazienti dal ricovero in ospedale e dalla dimissione dall’ospedaleLa sopravvivenza è indicata per categoria di età.
Dopo la standardizzazione per età e sesso, gli SMR sono stati 6,64 (95% IC, 6,61-6,73) per il primo anno dopo la dimissione dall’ospedale, 3,50 (95% IC, 3,48-3,55) per il secondo anno, e 2,86 (95% IC, 2,84-2,91) per il terzo anno(Figura 2). Sono state osservate importanti variazioni di SMR a seconda degli strati di età, con un SMR più alto nei pazienti più giovani e un SMR più basso nei pazienti più anziani.
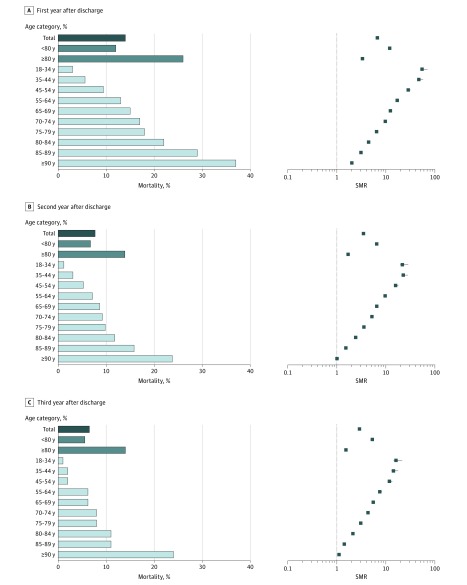
Figura 2.Tasso di mortalità e rapporto di mortalità standardizzato (SMR) nel primo anno, secondo anno e terzo anno dopo la dimissione dall’ospedale, per categoria di etàLe barre di errore indicano il 95% di IC.

Figura 1.Curve di sopravvivenza Kaplan-Meier di tutti i pazienti dal ricovero in ospedale e dalla dimissione dall’ospedaleLa sopravvivenza è indicata per categoria di età.

Figura 2.Tasso di mortalità e rapporto di mortalità standardizzato (SMR) nel primo anno, secondo anno e terzo anno dopo la dimissione dall’ospedale, per categoria di etàLe barre di errore indicano il 95% di IC.
Fattori associati alla mortalità
Mortalità in ospedale
L’analisi multivariabile ha dimostrato che l’età, il sesso, la maggior parte delle comorbilità, la maggior parte dei motivi di ospedalizzazione (utilizzando la cardiochirurgia come riferimento) e la maggior parte delle procedure di terapia intensiva sono stati associati alla mortalità in ospedale(Tabella 2). Il sesso femminile, una storia medica di malattia renale allo stadio terminale e l’uso della ventilazione meccanica non invasiva sono stati associati alla sopravvivenza in ospedale.
| Variabile | Stato vitale in ospedale (n=133966) | Stato vitale entro 3 mesi dalla dimissione dall’ospedale per i sopravvissuti (n=108-539) | Stato vitale tra 3 mo e 3 y dopo la dimissione dall’ospedale per i sopravvissuti di 3 mo (n=101-207) | ||||||
|---|---|---|---|---|---|---|---|---|---|
| N. (%) | OR (95% CI) | N. (%) | OR (95% CI) | N. (%) | OR (95% CI) | ||||
| Vivo (n=108-539) | Morto (n = 25-427) | Vivo (n = 101 207) | Morto (n = 7332) | Vivo (n = 80-482) | Morto (n = 20 725) | ||||
| Categoria di età, y | |||||||||
| 18-34 | 9582 (8.8) | 540 (2.1) | 1 [Riferimento] | 9452 (9.3) | 130 (1.8) | 1 [Riferimento] | 9081 (11.3) | 371 (1.8) | 1 [Riferimento] |
| 35-44 | 8612 (7.9) | 902 (3.5) | 1.80 (1.59-2.03) | 8400 (8.3) | 212 (2.9) | 1.76 (1.41-2.20) | 7711 (9.6) | 689 (3.3) | 1.98 (1.73-2.25) |
| 45-54 | 14 752 (13.6) | 2368 (9.3) | 2.55 (2.28-2.84) | 14 143 (14.0) | 609 (8.3) | 2.74 (2.25-3.32) | 12 111 (15.0) | 2032 (9.8) | 3.31 (2.95-3.72) |
| 55-64 | 23 234 (21.4) | 4665 (18.3) | 3.30 (2.97-3.66) | 21 841 (21.6) | 1393 (19.0) | 3.88 (3.22-4.67) | 17 490 (21.7) | 4351 (21.0) | 4.56 (4.08-5.10) |
| 65-69 | 13 068 (12.0) | 3076 (12.1) | 4.05 (3.63-4.51) | 12 168 (12.0) | 900 (12.3) | 4.48 (3.70-5.43) | 9450 (11.7) | 2718 (13.1) | 5.19 (4.61-5.83) |
| 70-74 | 11 166 (10.3) | 2964 (11.7) | 4.94 (4.43-5.51) | 10 297 (10.2) | 869 (11.9) | 5.25 (4.33-6.36) | 7758 (9.6) | 2539 (12.3) | 6.06 (5.38-6.82) |
| 75-79 | 11 954 (11.0) | 3800 (14.9) | 6.18 (5.55-6.88) | 10 874 (10.7) | 1080 (14.7) | 6.29 (5.20-7.61) | 7965 (9.9) | 2909 (14.0) | 7.10 (6.31-7.98) |
| 80-84 | 9953 (9.2) | 3867 (15.2) | 8.22 (7.38-9.16) | 8838 (8.7) | 1115 (15.2) | 7.99 (6.61-9.66) | 6026 (7.5) | 2812 (13.6) | 9.23 (8.20-10.39) |
| 85-89 | 4862 (4.5) | 2418 (9.5) | 11.85 (10.57-13.29) | 4106 (4.1) | 756 (10.3) | 10.85 (8.92-13.20) | 2394 (3.0) | 1712 (8.3) | 13.41 (11.82-15.23) |
| ≥90 | 1356 (1.2) | 827 (3.3) | 17.89 (15.54-20.58) | 1088 (1.1) | 268 (3.7) | 14.10 (11.25-17.67) | 496 (0.6) | 592 (2.9) | 20.70 (17.55-24.43) |
| Sesso | |||||||||
| Maschio | 64 851 (59.7) | 15 445 (60.7) | 1 [Riferimento] | 60 373 (59.7) | 4478 (61.1) | 1 [Riferimento] | 47 326 (58.8) | 13 047 (63.0) | 1 [Riferimento] |
| Femmina | 43 688 (40.3) | 9982 (39.3) | 0.95 (0.91-0.98) | 40 834 (40.3) | 2854 (38.9) | 0.87 (0.83-0.92) | 33 156 (41.2) | 7678 (37.0) | 0.76 (0.73-0.78) |
| Comorbidità | |||||||||
| Insufficienza cardiaca | 9770 (9.0) | 3890 (15.3) | 1.27 (1.21-1.34) | 8479 (8.4) | 1291 (17.6) | 1.47 (1.37-1.58) | 5004 (6.2) | 3475 (16.8) | 1.93 (1.83-2.04) |
| Malattia cerebrovascolare | 5173 (4.8) | 1744 (6.9) | 1.10 (1.03-1.18) | 4656 (4.6) | 517 (7.1) | 1.12 (1.02-1.24) | 3222 (4.0) | 1434 (6.9) | 1.27 (1.18-1.36) |
| Diabete | 23 252 (21.4) | 6602 (26.0) | 0.97 (0.94-1.01) | 21 252 (21.0) | 2000 (27.3) | 1.03 (0.97-1.09) | 15404 (19.1) | 5848 (28.2) | 1.21 (1.16-1.26) |
| Cancro attivo | 9729 (9.0) | 3297 (13.0) | 1.43 (1.36-1.51) | 8391 (8.3) | 1338 (18.2) | 2.04 (1.90-2.18) | 4761 (5.9) | 3630 (17.5) | 2.72 (2.59-2.86) |
| Demenza, compreso il morbo di Alzheimer | 1987 (1.8) | 1042 (4.1) | 1.36 (1.24-1.49) | 1644 (1.6) | 343 (4.7) | 1.50 (1.33-1.71) | 854 (1.1) | 790 (3.8) | 1.86 (1.67-2.07) |
| Malattia respiratoria cronica | 20 821 (19.2) | 6094 (24.0) | 1.16 (1.11-1.21) | 18 753 (18.5) | 2068 (28.2) | 1.14 (1.08-1.21) | 12 520 (15.6) | 6233 (30.1) | 1.49 (1.43-1.55) |
| Malattia renale allo stadio finale | 2674 (2.5) | 704 (2.8) | 0.74 (0.67-0.83) | 2407 (2.4) | 267 (3.6) | 1.24 (1.08-1.43) | 1615 (2.0) | 792 (3.8) | 1.85 (1.67-2.05) |
| Malattia del fegato | 5304 (4.9) | 2068 (8.1) | 1.67 (1.57-1.79) | 4750 (4.7) | 554 (7.6) | 1.62 (1.47-1.79) | 3192 (4.0) | 1558 (7.5) | 2.02 (1.88-2.16) |
| Motivo del ricovero | |||||||||
| Chirurgia cardiaca | 22 339 (20.6) | 1373 (5.4) | 1 [Riferimento] | 21 908 (21.6) | 431 (5.9) | 1 [Riferimento] | 19 987 (24.8) | 1921 (9.3) | 1 [Riferimento] |
| Malattia respiratoria | 16 688 (15.4) | 5191 (20.4) | 10.13 (9.39-10.93) | 14 827 (14.7) | 1861 (25.4) | 6.67 (5.95-7.47) | 10 060 (12.5) | 4767 (23.0) | 4.70 (4.40-5.02) |
| Malattie cardiovascolari | 8969 (8.3) | 4475 (17.6) | 10.54 (9.76-11.38) | 7986 (7.9) | 983 (13.4) | 5.45 (4.83-6.15) | 5707 (7.1) | 2279 (11.0) | 3.70 (3.44-3.98) |
| Malattia neurologica | 5216 (4.8) | 2626 (10.3) | 19.57 (17.97-21.32) | 4812 (4.8) | 404 (5.5) | 6.39 (5.53-7.38) | 3947 (4.9) | 865 (4.2) | 3.57 (3.25-3.92) |
| Chirurgia non cardiaca | 30 068 (27.7) | 6186 (24.3) | 4.84 (4.50-5.20) | 28 140 (27.8) | 1928 (26.3) | 3.75 (3.36-4.19) | 21 328 (26.5) | 6812 (32.9) | 3.82 (3.60-4.05) |
| Avvelenamento | 6056 (5.6) | 261 (1.0) | 2.31 (2.00-2.68) | 5948 (5.9) | 108 (1.5) | 2.02 (1.62-2.51) | 5371 (6.7) | 577 (2.8) | 2.61 (2.35-2.90) |
| Epatogastroenterologia | 3878 (3.6) | 1428 (5.6) | 9.87 (8.95-10.89) | 3375 (3.3) | 503 (6.9) | 7.98 (6.93-9.20) | 2396 (3.0) | 979 (4.7) | 4.62 (4.20-5.09) |
| Malattia renale o metabolica | 4478 (4.1) | 899 (3.5) | 4.58 (4.11-5.11) | 4022 (4.0) | 456 (6.2) | 5.56 (4.79-6.45) | 2988 (3.7) | 1034 (5.0) | 3.77 (3.43-4.16) |
| Traumi e ustioni | 3561 (3.3) | 826 (3.2) | 8.86 (7.93-9.90) | 3461 (3.4) | 100 (1.4) | 2.93 (2.33-3.68) | 3256 (4.0) | 205 (1.0) | 1.53 (1.31-1.79) |
| Trapianto di organi | 1677 (1.5) | 155 (0.6) | 1.15 (0.94-1.40) | 1651 (1.6) | 26 (0.4) | 0.74 (0.49-1.11) | 1508 (1.9) | 143 (0.7) | 0.79 (0.66-0.96) |
| Malattia infettiva | 1920 (1.8) | 1010 (4.0) | 12.85 (11.47-14.40) | 1691 (1.7) | 229 (3.1) | 7.01 (5.88-8.37) | 1212 (1.5) | 479 (2.3) | 4.48 (3.95-5.09) |
| Varie | 3689 (3.4) | 997 (3.9) | 14.19 (12.73-15.80) | 3386 (3.3) | 303 (4.1) | 8.02 (6.83-9.42) | 2722 (3.4) | 664 (3.2) | 5.34 (4.78-5.96) |
| Procedure di terapia intensiva | |||||||||
| Ventilazione meccanica invasiva | 60 357 (55.6) | 20 946 (82.4) | 2.87 (2.75-2.99) | 56 557 (55.9) | 3800 (51.8) | 1.08 (1.02-1.14) | 46 253 (57.5) | 10 304 (49.7) | 1.04 (1.00-1.08) |
| Ventilazione meccanica non invasiva | 29 300 (27.0) | 6373 (25.1) | 0.71 (0.68-0.73) | 26 716 (26.4) | 2584 (35.2) | 1.06 (1.01-1.12) | 19 277 (23.9) | 7439 (35.9) | 1.22 (1.18-1.27) |
| Vasopressori o inotropi | 34 865 (32.1) | 18 301 (72.0) | 2.88 (2.78-2.99) | 31 785 (31.4) | 3080 (42.0) | 1.48 (1.40-1.57) | 24 920 (31.0) | 6865 (33.1) | 1.10 (1.06-1.14) |
| Rianimazione fluida | 17 520 (16.1) | 7176 (28.2) | 1.19 (1.15-1.24) | 16 034 (15.8) | 1486 (20.3) | 1.11 (1.04-1.18) | 12 462 (15.5) | 3572 (17.2) | 1.03 (0.98-1.08) |
| Somministrazione di prodotti sanguigni | 6039 (5.6) | 2909 (11.4) | 1.41 (1.33-1.50) | 5576 (5.5) | 463 (6.3) | 1.22 (1.10-1.35) | 4493 (5.6) | 1083 (5.2) | 1.11 (1.03-1.20) |
| Rianimazione cardiopolmonare con intubazione | 1125 (1.0) | 2152 (8.5) | 4.01 (3.68-4.38) | 977 (1.0) | 148 (2.0) | 1.51 (1.25-1.82) | 725 (0.9) | 252 (1.2) | 1.20 (1.02-1.40) |
| Terapia di sostituzione renale | 7606 (7.0) | 7312 (28.8) | 3.47 (3.32-3.64) | 6650 (6.6) | 956 (13.0) | 1.48 (1.36-1.61) | 4712 (5.9) | 1938 (9.4) | 1.17 (1.10-1.25) |
| Cardioversione elettrica esterna di emergenza | 866 (0.8) | 934 (3.7) | 1.39 (1.24-1.56) | 770 (0.8) | 96 (1.3) | 1.12 (0.89-1.41) | 590 (0.7) | 180 (0.9) | 0.96 (0.79-1.16) |
| Monitoraggio della pressione intracranica | 1794 (1.7) | 689 (2.7) | 2.06 (1.86-2.28) | 1706 (1.7) | 88 (1.2) | 1.26 (1.01-1.58) | 1549 (1.9) | 157 (0.8) | 0.69 (0.58-0.83) |
| Supporto circolatorio meccanico | 958 (0.9) | 749 (2.9) | 3.98 (3.51-4.52) | 894 (0.9) | 64 (0.9) | 1.70 (1.29-2.23) | 766 (1.0) | 128 (0.6) | 1.28 (1.05-1.57) |
Mortalità a lungo termine tra i pazienti dimessi vivi dall’ospedale
I fattori nell’analisi multivariabile indipendentemente associati alla mortalità a 3 mesi e 3 anni dopo la dimissione dall’ospedale sono elencati nella Tabella 2. Solo alcune variabili marginali non sono state associate ad un aumento della mortalità. Il rischio di mortalità è aumentato in tutti gli strati di età, con un punto di inflessione netto superiore agli 80 anni(Figura 3). Rispetto alla chirurgia cardiaca, il rischio di mortalità era significativamente più alto per tutti i motivi di ospedalizzazione (eccetto che per il trapianto di organi). Le ragioni del ricovero ospedaliero avevano un’associazione inferiore con la mortalità a lungo termine (cioè 3 anni dopo la dimissione in vita) rispetto alla mortalità a breve termine (cioè 3 mesi dopo la dimissione in vita). Ad eccezione del cancro attivo (OR, 2,04; 95% IC, 1,90-2,18 a 3 mesi e 2,72; 95% IC, 2,59-2,86 a 3 anni), gli OR di comorbidità a 3 anni di mortalità erano tutti inferiori a 2. Ad eccezione della ventilazione meccanica non invasiva, l’associazione tra l’uso di supporto d’organo e la mortalità era inferiore a 3 anni rispetto a 3 mesi dopo la dimissione da vivi. Le associazioni tra ventilazione meccanica invasiva o somministrazione di prodotti ematici e la mortalità a 3 anni dalla dimissione erano deboli.
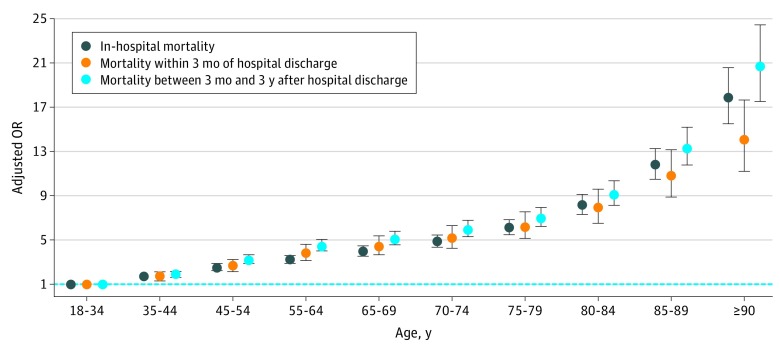
Figura 3.Associazione tra età e mortalità dopo l’adattamento per sesso, comorbilità, motivo del ricovero e supporto d’organoOR indica il rapporto di probabilità. Le barre di errore rappresentano il 95% degli IC, e la linea tratteggiata mostra un OR di 1.

Figura 3.Associazione tra età e mortalità dopo l’adattamento per sesso, comorbilità, motivo del ricovero e sostegno agli organiOR indica il rapporto di probabilità. Le barre di errore rappresentano il 95% degli IC, e la linea tratteggiata mostra un OR di 1.
Mortalità nei pazienti di 80 anni e più anziani
I pazienti dagli 80 anni in su rappresentano il 17,4% della coorte (eTabella 1 nel Supplemento). Le donne (50,4%) erano sovrarappresentate in questa fascia d’età rispetto ai pazienti di età inferiore agli 80 anni. Le comorbilità erano più frequenti nei pazienti di 80 anni e più (ad eccezione delle malattie del fegato). La durata media della terapia intensiva e della degenza ospedaliera è stata rispettivamente di 3 (IQR, 2-8) giorni e 12 (IQR, 7-23) giorni per i pazienti di età inferiore agli 80 anni e di 4 (IQR, 2-8) giorni e 14 (IQR, 7-23) giorni per i pazienti anziani (≥80 anni). Per quanto riguarda le procedure di terapia intensiva, la ventilazione meccanica non invasiva e l’uso di vasopressori o inotropi erano più frequenti nei pazienti di 80 anni e oltre. I tassi di mortalità in ospedale e a 3 anni dopo la dimissione sono stati rispettivamente del 30,4% e del 61,7% nei pazienti anziani rispetto al 16,5% e al 35,3% nei pazienti di età inferiore agli 80 anni. I fattori associati alla mortalità sono stati simili indipendentemente dagli strati di età (eTabella 2 e eTabella 3 nel supplemento). Le caratteristiche della popolazione classificate in base al rischio di mortalità sono riassunte nelle tabelle 4, 5 e 6 del supplemento. Un’analisi che escludeva le procedure di terapia intensiva è stata eseguita come analisi di sensibilità. L’associazione tra gli strati di età e il risultato è rimasta (eTable 7 nel supplemento).
Discussione
Nonostante vivesse in un paese ad alto reddito con ampio accesso alle cure sanitarie, circa il 40% dei pazienti ricoverati in Francia non è sopravvissuto per 3 anni. Anche tra i sopravvissuti all’ospedale, il 6,8% è morto di 3 mesi e il 25,8% è morto di 3 anni dopo la dimissione dall’ospedale. Il nostro studio mostra un aumento del rischio di mortalità a breve e lungo termine dopo il ricovero in terapia intensiva rispetto a una popolazione generale in linea con l’età. È stato osservato un aumento graduale della mortalità per tutti gli strati di età, con un forte aumento del rischio per i pazienti dagli 80 anni in su. I pazienti che sono sopravvissuti fino alla dimissione dall’ospedale avevano una probabilità 3 volte maggiore di morire durante i primi 3 anni rispetto alla popolazione generale dopo la standardizzazione per età e sesso. Tuttavia, la mortalità in eccesso è diminuita con l’aumentare dell’età e tendeva a scomparire nei pazienti più anziani. Anche le comorbilità e le ragioni del ricovero ospedaliero erano associate a un aumento della mortalità a lungo termine. L’uso di supporto d’organo durante il ricovero in terapia intensiva non era fortemente associato alla mortalità a lungo termine.
Il nostro tasso di mortalità a 3 anni dopo la dimissione dall’unità di terapia intensiva è stato vicino al 21% riportato da Hill et al.5 dal database medico amministrativo dell’Ontario, Canada. Wunsch et al11 ha osservato un tasso di mortalità a 3 anni del 40% in una popolazione selezionata di beneficiari di Medicare (cioè, di età superiore ai 65 anni); questo è intermedio rispetto al 44,9% di mortalità che riportiamo nei pazienti di 80 anni e più. Non sorprende che la mortalità sia stata influenzata dall’età.12 Abbiamo scoperto che i tassi di mortalità in ospedale, a 3 mesi e a 3 anni sono aumentati progressivamente con l’età da 18 anni a 80 anni, con un forte aumento dopo gli 80 anni. Questo suggerisce che la soglia per definire le persone anziane rispetto al ricovero in terapia intensiva potrebbe essere di circa 80 anni. Al contrario, anche l’SMR varia molto tra gli strati di età, ma con un’associazione inversa, essendo più alta nei pazienti giovani durante il primo anno dopo la dimissione dall’ospedale. Al contrario, il rischio di mortalità era vicino al rischio generale della popolazione dopo la dimissione ospedaliera nei pazienti più anziani.
A prima vista, l’osservazione di un rischio di mortalità più elevato nei pazienti più anziani, ma inferiore in associazione con la popolazione generale corrispondente per età, potrebbe apparire contraddittoria. Questi risultati sono probabilmente associati alla maggiore aspettativa di vita dei più giovani. Dopo un evento acuto, i pazienti più giovani hanno più anni di vita persi in caso di morte rispetto ai pazienti anziani. Un secondo fattore è il ruolo della senescenza e delle comorbidità sottostanti che facilitano lo sviluppo di insufficienza d’organo. Si prevede che l’insufficienza degli organi nei pazienti giovani sia in gran parte o interamente il risultato dell’insulto acuto. Negli individui anziani, e nonostante la specifica malattia cronica degli organi, la senescenza (come parte del processo naturale di invecchiamento) riduce la riserva funzionale.13,14 Di conseguenza, una malattia acuta meno grave può portare a insufficienza di organi a causa della mancanza di una riserva funzionale dell’organo.15,16,17 L’uso del supporto degli organi (che riflette la gravità dell’insufficienza degli organi) non è stato associato alla sopravvivenza a lungo termine nella coorte degli anziani. Pertanto, il grado di senescenza e la riserva funzionale compromessa possono essere più rilevanti in un paziente anziano.13 Il potenziale “guadagno” in termini di sopravvivenza dopo il ricovero in terapia intensiva è quindi evidente.2 Questo punto merita particolare considerazione nella stima del potenziale beneficio di interventi mirati a pazienti critici in terapia intensiva in studi clinici.18 Infine, un orientamento alla selezione dei pazienti anziani con un buon stato funzionale percepito potrebbe spiegare, almeno in parte, perché i sopravvissuti in terapia intensiva hanno un esito post-scarica vicino a quello della popolazione generale non ricoverata in terapia intensiva. Da questi dati non è possibile trarre linee guida per il ricovero in terapia intensiva di pazienti anziani. Tuttavia, questo studio fornisce importanti informazioni oggettive sull’esito del paziente per tutti gli strati di età disponibili per gli operatori sanitari, i pazienti e i parenti.
L’associazione dell’uso del supporto d’organo con l’esito è diminuita dopo la dimissione dall’ospedale. La ventilazione meccanica invasiva e l’uso di vasopressori o inotropi non sono stati associati alla mortalità a lungo termine. Questi risultati suggeriscono che l’uso del supporto d’organo (ad eccezione della terapia renale sostitutiva) ha probabilmente una scarsa influenza residua sugli esiti a lungo termine.19 Allo stesso modo, gli OR di comorbidità erano bassi per la mortalità in ospedale, ma sono progressivamente aumentati a 3 mesi e a 3 anni dalla dimissione. Ciò è in linea con uno studio precedente20 concentrandosi sui pazienti con shock settico in cui le comorbidità non erano il determinante principale degli esiti a breve termine, ma erano rilevanti in seguito.
Infine, questi risultati suggeriscono che probabilmente sono necessari sforzi per migliorare la gestione immediata dopo la dimissione dal reparto di terapia intensiva, soprattutto tra i pazienti più giovani. Tali iniziative potrebbero includere lo sviluppo di strutture di assistenza post-acuzie o di un’adeguata assistenza domiciliare nei pazienti dimessi dall’unità di terapia intensiva. Il passaggio dalle cure acute a domicilio è stato probabilmente sottovalutato e potrebbe rappresentare un fattore di potenziale miglioramento per questi pazienti. Anche altre ragioni, come la malattia terminale o la non escalation del trattamento, possono avere un ruolo nella mortalità precoce vista dopo la dimissione dall’unità di terapia intensiva.
Punti di forza e limitazioni
Uno dei principali punti di forza del nostro studio è stato l’inclusione di un gran numero di pazienti utilizzando un database nazionale. In secondo luogo, c’è stata una bassa perdita per il follow-up. Solo i pazienti che non erano di nazionalità francese e che sono morti all’estero hanno perso il follow-up per quanto riguarda la sopravvivenza. Abbiamo scelto di analizzare la mortalità post-scarica dei sopravvissuti separatamente dalla mortalità in ospedale per evitare una sovrarappresentazione dei fattori associati alla degenza in ospedale.
Il nostro studio ha alcuni limiti. In primo luogo, il suo disegno osservazionale impedisce di trarre qualsiasi associazione causale. In secondo luogo, sono stati inclusi solo i pazienti coperti dal regime generale dell’assicurazione sanitaria nazionale. Tuttavia, il regime generale copre circa il 76% della popolazione francese. Alcuni lavoratori indipendenti, agricoltori, studenti e funzionari pubblici non erano rappresentati. In terzo luogo, non erano disponibili dati sul comportamento a rischio (alcol e tabacco) e sull’indice di massa corporea. Abbiamo concentrato le nostre analisi sulle caratteristiche dei pazienti e sulle degenze ospedaliere al momento del ricovero iniziale in terapia intensiva, ma anche gli eventi successivi alla dimissione dall’ospedale e lo stile di vita potrebbero alterare il rischio di mortalità a lungo termine. I fattori che possono influenzare la mortalità, come la fragilità, non erano disponibili. Tali pazienti possono avere un grado di senescenza maggiore. In quarto luogo, il pregiudizio di selezione ha probabilmente influenzato la decisione di ricoverare i pazienti anziani in terapia intensiva, di avviare le procedure di terapia intensiva e di offrire un sostegno a sostegno della vita. La decisione di ricoverare i pazienti anziani meno fragili ha probabilmente selezionato quelli in cui è stata ritenuta appropriata un’assistenza attiva che prolungasse la vita. Questo orientamento alla selezione potrebbe influenzare la generalizzabilità a tutti i pazienti anziani. L’errore di selezione potrebbe aver alterato la mortalità in ospedale per quanto riguarda l’offerta di interventi di terapia intensiva. Tuttavia, questa distorsione è ridotta perché i pazienti hanno dovuto passare almeno una notte in terapia intensiva per essere inclusi e la maggior parte delle procedure è stata probabilmente implementata all’inizio del loro soggiorno in terapia intensiva. Ciononostante, non riteniamo che il tempo immortale abbia influenzato l’analisi della mortalità a lungo termine perché tutti i pazienti sono sopravvissuti al loro soggiorno in terapia intensiva e in ospedale e sono quindi andati oltre la decisione di farsi offrire un supporto d’organo. Inoltre, abbiamo valutato solo la mortalità a lungo termine, ma non lo stato funzionale o i marcatori della qualità della vita.
Conclusioni
In questo ampio studio nazionale condotto in Francia, la sopravvivenza complessiva dei pazienti ricoverati in terapia intensiva è stata di circa il 60% a 3 anni. Il tasso di mortalità è aumentato progressivamente con l’età e in modo più marcato a partire dagli 80 anni. Tuttavia, la SMR era particolarmente elevata tra i pazienti più giovani subito dopo la dimissione in terapia intensiva, suggerendo un’area di miglioramento in questa popolazione e in questo arco di tempo. Al contrario, i pazienti anziani che sono sopravvissuti alle dimissioni ospedaliere avevano un’aspettativa di vita molto più vicina a quella della popolazione generale in linea con l’età.
References
- Trends in hospital and intensive care admissions in the Netherlands attributable to the very elderly in an ageing population. Crit Care. 2015; 19DOI | PubMed
- Effect of systematic intensive care unit triage on long-term mortality among critically ill elderly patients in France: a randomized clinical trial. JAMA. 2017; 318(15):1450. DOI | PubMed
- Long-term outcomes after ICU admission triage in octogenarians. Crit Care Med. 2017; 45(4):e363-e371. DOI | PubMed
- Decision-making process, outcome, and 1-year quality of life of octogenarians referred for intensive care unit admission. Intensive Care Med. 2006; 32(7):1045-1051. DOI | PubMed
- Long-term outcomes and healthcare utilization following critical illness: a population-based study. Crit Care. 2016; 20:76. DOI | PubMed
- The variability of critical care bed numbers in Europe. Intensive Care Med. 2012; 38(10):1647-1653. DOI | PubMed
- Value of a national administrative database to guide public decisions: from the Système National d’Information Interrégimes de l’Assurance Maladie (SNIIRAM) to the Système National des Données de Santé (SNDS) in France. Rev Epidemiol Sante Publique. 2017; 65(suppl 4):S149-S167. DOI | PubMed
- 2015. Publisher Full Text
- Two morbidity indices developed in a nationwide population permitted performant outcome-specific severity adjustment. J Clin Epidemiol. 2018; 103:60-70. DOI | PubMed
- Publisher Full Text
- Three-year outcomes for Medicare beneficiaries who survive intensive care. JAMA. 2010; 303(9):849-856. DOI | PubMed
- Long-term outcome in medical patients aged 80 or over following admission to an intensive care unit. Crit Care. 2011; 15(1):R36. DOI | PubMed
- Cellular senescence: a hitchhiker’s guide. Hum Cell. 2015; 28(2):51-64. DOI | PubMed
- Telomerase deficiency delays renal recovery in mice after ischemia-reperfusion injury by impairing autophagy. Kidney Int. 2015; 88(1):85-94. DOI | PubMed
- Glomerular aging and focal global glomerulosclerosis: a podometric perspective. J Am Soc Nephrol. 2015; 26(12):3162-3178. DOI | PubMed
- Structural and functional changes with the aging kidney. Adv Chronic Kidney Dis. 2016; 23(1):19-28. DOI | PubMed
- Aging, telomeres and heart failure. Heart Fail Rev. 2010; 15(5):479-486. DOI | PubMed
- Designing phase 3 sepsis trials: application of learned experiences from critical care trials in acute heart failure. J Intensive Care. 2016; 4:24. DOI | PubMed
- Acute kidney injury and chronic kidney disease as interconnected syndromes. N Engl J Med. 2014; 371(1):58-66. DOI | PubMed
- Risk factors for death in septic shock: a retrospective cohort study comparing trauma and non-trauma patients. Medicine (Baltimore). 2017; 96(50):e9241. DOI | PubMed
Fonte
Atramont A, Lindecker-Cournil V, Rudant J, Tajahmady A, Drewniak N, et al. (2019) Association of Age With Short-term and Long-term Mortality Among Patients Discharged From Intensive Care Units in France. JAMA Network Open 2(5): e193215. https://doi.org/10.1001/jamanetworkopen.2019.3215





