Introduzione
La malattia di Parkinson (PD) è un disturbo neurodegenerativo correlato all’invecchiamento caratterizzato da una progressiva compromissione motoria.1 È la seconda malattia neurodegenerativa più comune (dopo il morbo di Alzheimer), che colpisce più dell’1% delle persone di 65 anni e più.2,3 Negli Stati Uniti, l’incidenza del parkinsonismo e del PD è aumentata considerevolmente tra il 1976 e il 2005, in particolare tra gli uomini di 70 anni e più.4 Inoltre, un’indagine trasversale ha rivelato che, secondo le stime, in Cina, circa 1,7 milioni di persone di 55 anni e più hanno la PD.5
L’eziologia della PD è poco conosciuta, ma probabilmente coinvolge sia fattori genetici che ambientali.6 Negli ultimi 2 decenni, i risultati di una serie di studi di coorte prospettici hanno suggerito che i fattori dello stile di vita modificano probabilmente il rischio di sviluppare la PD.7 Uno di questi fattori, l’attività fisica, è noto da tempo per ridurre il rischio di una vasta gamma di malattie e condizioni, tra cui malattie cardiovascolari, ictus e diabete.8,9,10
Recentemente, un numero crescente di prove ha suggerito che l’aumento dell’attività fisica può anche ridurre il rischio di PD.11 Tuttavia, questi studi variavano in relazione alle dimensioni del campione, all’etnia e ad altre caratteristiche, portando così a incoerenze rispetto alla loro interpretazione. Inoltre, relativamente pochi studi hanno quantificato sistematicamente la relazione dose-risposta presunta tra attività fisica e rischio di PD. Pertanto, abbiamo eseguito una meta-analisi dose-risposta degli studi prospettici pubblicati per ottenere stime quantitative dell’associazione tra attività fisica e rischio di PD.
Metodi
Strategia di ricerca
Abbiamo seguito la meta-analisi degli studi osservazionali in epidemiologia(MOOSE) che riporta le linee guida per la segnalazione.12 Una ricerca sistematica della letteratura per gli studi prospettici fino al 28 febbraio 2018 è stata condotta nelle banche dati, tra cui PubMed, Embase e Web of Science, utilizzando le seguenti parole chiave per la ricerca della letteratura: (“attività fisica” O “attività motoria” O “esercizio”) AND (“Morbo di Parkinson” OPPURE “Morbo di Parkinson” O “Morbo di Parkinson”). La ricerca non aveva alcuna restrizione linguistica. Abbiamo anche cercato e rivisto i riferimenti citati all’interno dei rapporti pertinenti recuperati per eventuali studi aggiuntivi.
Selezione dello studio
Gli studi sono stati inclusi nella meta-analisi attuale se hanno soddisfatto i seguenti 4 criteri: (1) hanno utilizzato il disegno dello studio prospettico, compresi gli studi di coorte e gli studi di caso-controllo nidificati; (2) l’esposizione di interesse era l’attività fisica; (3) il risultato era l’incidenza della PD; e (4) gli autori hanno riportato la stima del rischio con intervalli di confidenza del 95%. Abbiamo escluso studi retrospettivi, studi su animali, ricerche non originali (recensioni, editoriali o commenti), abstract e studi duplicati. Per garantire la corretta identificazione degli studi idonei, abbiamo utilizzato un processo di selezione in 2 fasi. In primo luogo, 2 ricercatori (X.F. e D.H.) hanno condotto in modo indipendente la ricerca della letteratura e lo screening iniziale di tutti i titoli e gli abstract; il testo completo di ogni articolo potenzialmente rilevante è stato poi valutato. Le discrepanze sono state risolte attraverso una discussione di gruppo con un terzo ricercatore (F.W.).
Estrazione dei dati
Per l’estrazione dei dati è stato utilizzato un modulo di raccolta dati standardizzato. Da ogni studio recuperato, abbiamo estratto le seguenti informazioni: il nome del primo autore, l’anno di pubblicazione, il paese in cui è stato condotto lo studio, il nome dello studio (se applicabile), il disegno dello studio (studio di coorte o studio caso-controllo nidificato), l’età dei partecipanti alla linea di base, la durata del follow-up, il sesso dei partecipanti, la dimensione del campione (cioè il numero di casi e/o partecipanti), i quintili di attività fisica di base e le corrispondenti stime del rischio di PD con intervalli di confidenza del 95%. Per gli studi che non hanno classificato qualitativamente l’attività fisica, è stata registrata la stima di rischio più corretta per il quintile più alto rispetto al quintile più basso dell’attività fisica e il corrispondente intervallo di confidenza del 95%. Due investigatori indipendenti (X.F. e D.H.) hanno eseguito il processo di estrazione dei dati e gli eventuali disaccordi sono stati risolti con una discussione di gruppo.
La qualità degli studi inclusi è stata valutata secondo la scala di Newcastle-Ottawa per gli studi non randomizzati. Ad ogni studio è stato assegnato un massimo di 9 punti come segue: 4 per la selezione dei partecipanti e la misurazione dell’esposizione, 2 per la comparabilità e 3 per la valutazione dei risultati e un adeguato follow-up. Un punteggio da 0 a 3, da 4 a 6 o da 7 a 9 è stato considerato rispettivamente basso, moderato o di alta qualità.
Analisi statistica
In questa meta-analisi, i rischi relativi (RRs) con intervalli di confidenza del 95% sono stati considerati come la misura comune delle associazioni tra gli studi; ove necessario, il rapporto di rischio e/o il rapporto di incidenza sono stati utilizzati per approssimare gli RRs. Per il confronto tra le categorie di attività fisica più alte e più basse, abbiamo calcolato le RR riassunte e i corrispondenti intervalli di confidenza del 95% utilizzando un modello a effetti casuali, che potrebbe incorporare sia la variabilità all’interno dello studio che tra gli studi.
A causa della gamma relativamente ampia di definizioni per le categorie di attività fisica negli studi inclusi, una dose-risposta analisi basata su un aumento dell’attività fisica di 10 equivalente metabolico di ore di lavoro (MET-ora) a settimana è stata condotta utilizzando il metodo descritto dalla Groenlandia e Longnecker13 e il codice del software statistico Stata pubblicamente disponibile, scritto da Orsini e colleghi.14 Secondo il metodo, abbiamo estratto le categorie dell’attività fisica, le distribuzioni dei casi e degli anni-persona e gli RR con intervalli di confidenza del 95%. Se il numero di casi o di anni-persona non era disponibile, è stata effettuata una regressione dei minimi quadrati ponderati in base alla varianza per calcolare la stima sintetica del rischio.15 Il valore mediano o medio di ciascuna categoria è stato utilizzato come dose corrispondente di attività fisica. Se non è stato riportato né il valore mediano né quello medio, abbiamo considerato il punto medio dei confini superiore e inferiore come dose di ciascuna categoria. Se la categoria più alta e/o più bassa era aperta, il punto medio di tale categoria è stato fissato assumendo che l’ampiezza della categoria fosse la stessa della categoria adiacente. Per valutare una potenziale associazione curvilinea tra attività fisica e rischio di PD, abbiamo condotto un modello di spline cubico ristretto con 3 nodi al 10°, 50° e 90° percentile della distribuzione.16
L’eterogeneità tra gli studi è stata stimata dall’I2 Statistica,17 e abbiamo considerato i valori di basso, moderato e alto I2 Il sistema metrico decimale deve essere rispettivamente del 25%, 50% e 75%. Per esaminare il significato della differenza di RR e la possibile influenza dei fattori di confusione residua, abbiamo eseguito analisi di sottogruppo su possibili fonti di eterogeneità, tra cui il sesso, la posizione geografica, il follow-up, la dimensione del campione e la qualità dello studio.
Abbiamo valutato il potenziale di distorsione della pubblicazione utilizzando i test di regressione lineare di Egger e i test di correlazione del grado di Begg. Tutte le analisi statistiche sono state eseguite utilizzando il software statistico Stata versione 12 (StataCorp) e tutti i valori P sono stati confrontati su due lati con un livello di significatività di .05.
Risultati
Caratteristiche di ricerca e studio della letteratura
Il processo di selezione dello studio e i risultati della ricerca della letteratura sono illustrati in eFigure 1 nel Supplemento. Utilizzando la nostra strategia di ricerca, abbiamo identificato 5088 articoli in PubMed, 4978 articoli in Embase e 2907 articoli in Web of Science. Dopo la rimozione dei duplicati, sono rimasti 5274 articoli; 5249 di questi articoli sono stati esclusi in base al titolo e/o all’abstract, lasciando 25 articoli potenzialmente rilevanti per una revisione completa del testo. Dopo aver applicato ulteriori criteri di esclusione, sono stati inclusi nella nostra analisi un totale di 8 studi prospettici (pubblicati in 7 articoli),18,19,20,21,22,23,24 di cui 544-336 partecipanti e 2192 pazienti con PD con un follow-up mediano (range) di 12 (6,1-22,0) anni. Tra questi studi, il rapporto di Sasco e colleghi,21 uno studio caso-controllo nidificato, è la prima indagine epidemiologica dell’effetto dell’attività fisica sull’eziologia della PD. Abbiamo incluso lo studio perché questo studio normativo rispondeva ai criteri di inclusione della nostra meta-analisi.
Le caratteristiche di questi 8 studi sono riassunte nella tabella. Sei studi18,19,21,22,23 sono stati condotti negli Stati Uniti, 1 studio20 in Finlandia, e 1 studio24 in Svezia. Tutti gli studi hanno utilizzato l’attività fisica dichiarata, che è stata raccolta tramite questionari o interviste. I punteggi di qualità dello studio variavano da 6 a 9, con un punteggio medio (SD) di 7,9 (1,1)(Tabella; eTabella 1 nel supplemento).
| Fonte: | Posizione | Nome dello studio | Design | Sesso | Età, y | Seguito, y | Casi, n./Partecipanti, n. | Qualitàa |
|---|---|---|---|---|---|---|---|---|
| Chen et al,18 2005 | Stati Uniti | Studio di follow-up per i professionisti della salute | Coorte | Maschio | 40-75 | 14 | 252/48 574 | 9 |
| Studio sulla salute degli infermieri | Femmina | 30-55 | 12 | 135/77 254 | ||||
| Logroscino et al,19 2006 | Stati Uniti | Studio sulla salute degli alunni di Harvard | Coorte | Femmina | 67.6 (8.1)b | 6.1 | 101/10 714 | 8 |
| Säääksjärvi et al,20 2014 | Finlandia | Indagine sulla salute della clinica mobile finlandese | Coorte | Entrambi | 50-79 | 22 | 101/6715 | 7 |
| Sasco et al,21 1992 | Stati Uniti | NA | Controllo del caso annidato | Maschio | NA | NA | 137/685 | 6 |
| Thacker et al,22 2008 | Stati Uniti | CPS II Coorte nutrizionale | Coorte | Entrambi | 63c | 9 | 413/143 325 | 8 |
| Xu et al,23 2010 | Stati Uniti | NIH-AARP Studio sulla dieta e la salute | Coorte | Entrambi | 50-71 | 10 | 767/213 701 | 9 |
| Yang et al,24 2015 | Svezia | Coorte Nazionale Svedese di Marzo | Coorte | Entrambi | 50.3 (17.1)b | 12.6 | 286/43 368 | 8 |
Associazione categoriale tra attività fisica e rischio PD
I RRs multivariabili corretti di PD per la categoria di attività fisica più alta contro la più bassa in ogni studio, e per tutti gli studi combinati, sono mostrati nella Figura 1. Tra gli 8 studi, solo 1 ha trovato una correlazione inversa statisticamente significativa tra l’attività fisica e il rischio di PD; tuttavia, il RR di PD in pool era 0,79 (95% CI, 0,68-0,91) quando abbiamo confrontato la più alta contro la categoria più bassa di attività fisica. Nessuna eterogeneità è stata osservata in tutti gli studi(I2 = 0%).
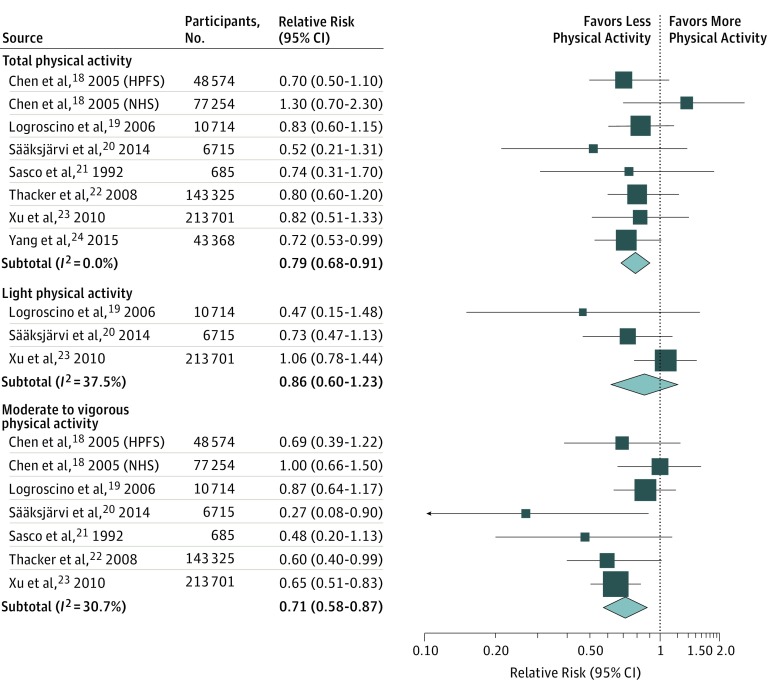
Figura 1.Rischio del morbo di Parkinson per le categorie di attività fisica più alte o più basseLa dimensione di ogni scatola indica il peso dello studio nell’analisi. HPFS indica lo studio di follow-up dei professionisti della salute; NHS, Studio sulla salute degli infermieri.
Questa associazione è dovuta interamente ad un’attività da moderata a vigorosa. In particolare, i partecipanti a questa categoria di attività più elevata avevano un rischio di PD inferiore del 29% rispetto a quelli che non hanno segnalato alcuna attività da moderata a vigorosa (RR, 0,71; 95% CI, 0,58-0,87; I2 = 30.7%). Al contrario, l’attività fisica leggera non è stata significativamente correlata con il rischio di PD (RR, 0,86; 95% CI, 0,60-1,23; I2 = 37.5%).
Considerando la possibilità della causalità inversa tra PD precoce con diminuzione dell’attività fisica, abbiamo condotto una meta-analisi del tempo utilizzando 6 studi che escludono i primi 4 a 10 anni di follow-up.18,20,22,23,24 I risultati dell’analisi del tempo sono stati simili ai nostri principali risultati presentati in questo studio, suggerendo che tale causalità inversa è improbabile (eFigure 2 nel supplemento).

Figura 1.Rischio del morbo di Parkinson per le categorie di attività fisica più alte o più basseLa dimensione di ogni scatola indica il peso dello studio nell’analisi. HPFS indica lo studio di follow-up dei professionisti della salute; NHS, Studio sulla salute degli infermieri.
Sottogruppo Analisi
I risultati delle nostre analisi di sottogruppo stratificate per disegno dello studio e popolazione di studio sono riassunti nella eTabella 2 del Supplemento. La nostra analisi ha rivelato che l’associazione tra attività fisica e rischio di PD non è stata sostanzialmente modificata in base alla regione geografica, alla durata del follow-up, alla dimensione della popolazione o alla qualità dello studio. In particolare, tuttavia, l’associazione tra attività fisica e rischio di PD era più robusta tra gli uomini, indipendentemente dal fatto che abbiamo esaminato l’attività fisica totale (RR, 0,68; 95% CI, 0,54-0,87) o attività da moderata a vigorosa (RR, 0,68; 95% CI, 0,57-0,82), con poca eterogeneità(Figura 2).
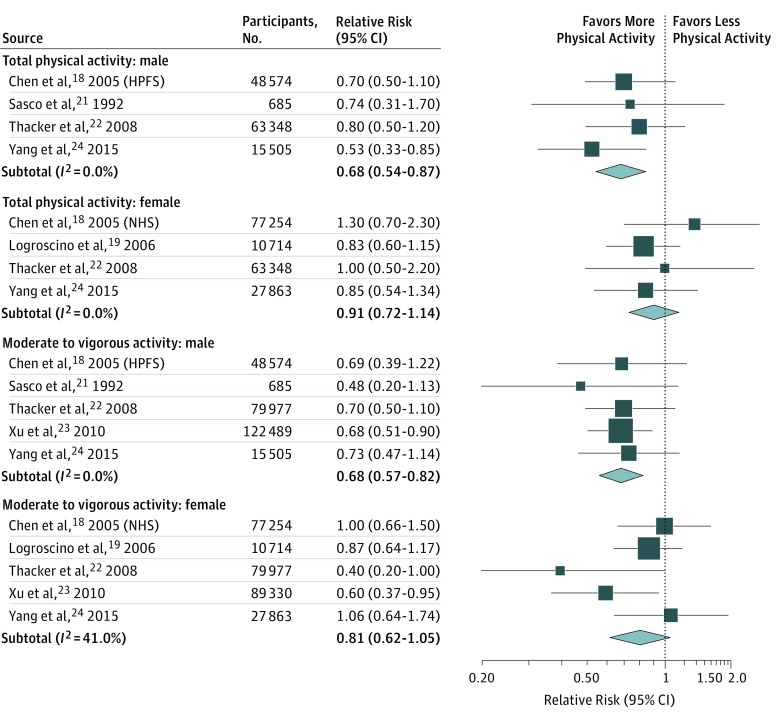
Figura 2.Rischio di morbo di Parkinson per sesso per le categorie di attività fisica totale e da moderata a vigorosa, per le categorie di attività fisica totale e da moderata a vigorosaHPFS indica lo studio di follow-up dei professionisti della salute; NHS, Studio sulla salute degli infermieri.

Figura 2.Figura 2. Rischio di malattia di Parkinson in base al sesso per le categorie di attività fisica totale e da moderata a vigorosa.HPFS indica lo studio di follow-up dei professionisti della salute; NHS, Studio sulla salute degli infermieri.
Associazione lineare dose-risposta tra attività fisica e rischio PD
Dopo aver escluso 2 studi a causa della mancanza di categorie di attività fisica dettagliate,19,20 abbiamo esaminato la RR lineare specifica per sesso (e intervalli di confidenza del 95%) per un aumento di 10 ore MET/settimana, ordinati per categoria(Figura 3A). Questa analisi dose-risposta ha rivelato che ogni aumento di 10 ore MET/settimana di attività fisica totale ha diminuito il rischio di PD del 10% negli uomini (RR, 0,90; 95% CI, 0,85-0,95; I2=0%) e 9% nelle popolazioni di sesso misto (RR, 0,91; 95% CI, 0,86-0,96; I2 = 0%). Al contrario, non abbiamo trovato alcuna relazione lineare dose-risposta tra l’attività fisica totale e il rischio di PD tra le donne (RR, 0,95; 95% CI, 0,87-1,04; I2=0%) (Figura 3A).
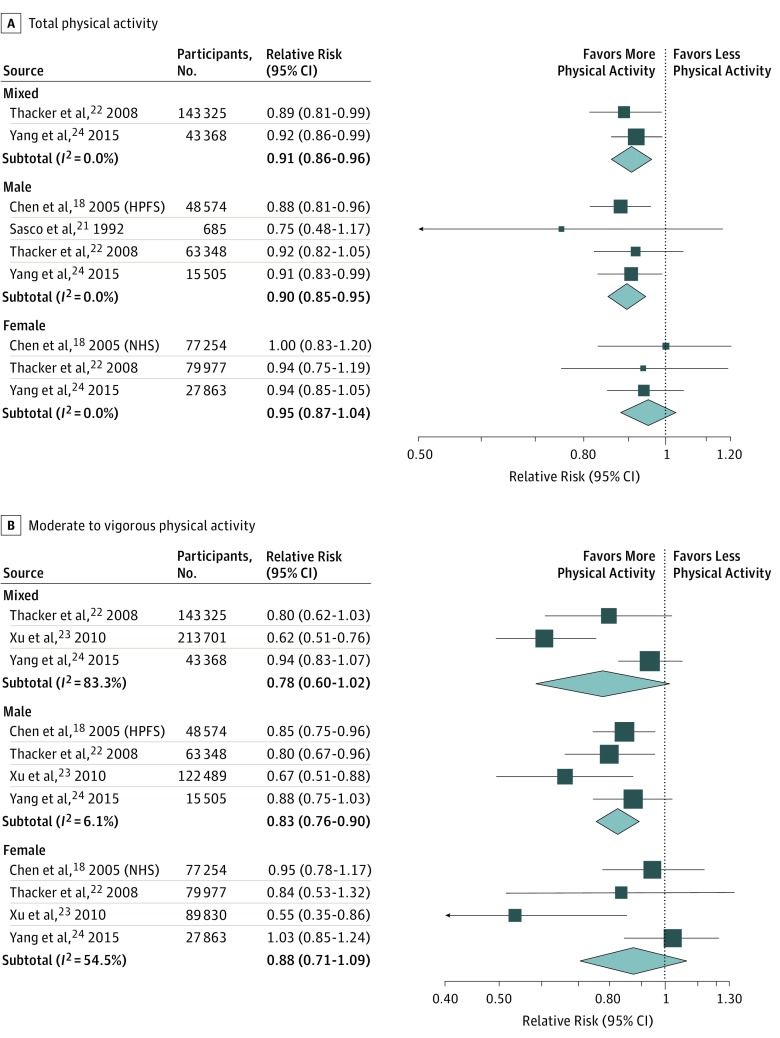
Figura 3.Rischio di malattia di Parkinson per 10 Equivalente metabolico dell’aumento di ore di lavoroLa trama mostra il rischio relativo lineare specifico del sesso per ogni aumento di 10 ore dell’equivalente metabolico delle ore di lavoro settimanali per l’attività fisica totale (A) e per l’attività fisica da moderata a vigorosa (B). HPFS indica lo Studio di Follow-up dei Professionisti della Salute; NHS, Studio sulla Salute degli Infermieri.
Per quanto riguarda gli effetti di attività da moderata a vigorosa, il rischio ridotto di PD è stato osservato solo negli uomini, e non nelle popolazioni femminili o di sesso misto(Figura 3B). In particolare, tra i partecipanti di sesso maschile il RR di PD associato ad un aumento di 10 ore MET/settimana di attività da moderata a vigorosa è stato di 0,83 (95% CI, 0,76-0,90) con bassa eterogeneità(I2 = 6.1%).

Figura 3.Rischio di malattia di Parkinson per 10 Equivalente metabolico dell’aumento di ore di lavoroLa trama mostra il rischio relativo lineare specifico del sesso per ogni aumento di 10 ore dell’equivalente metabolico delle ore di lavoro settimanali per l’attività fisica totale (A) e per l’attività fisica da moderata a vigorosa (B). HPFS indica lo Studio di Follow-up dei Professionisti della Salute; NHS, Studio sulla Salute degli Infermieri.
Associazione dose-risposta continua tra attività fisica e rischio PD
Lafigura 4 illustra l’associazione continua dose-risposta tra le stime quantitative dell’attività fisica (ore MET a settimana) e il rischio di PD. Livelli più elevati di attività fisica totale(Figura 4A) o da moderata a vigorosa(Figura 4B) sono stati coerentemente associati a un minor rischio di PD.
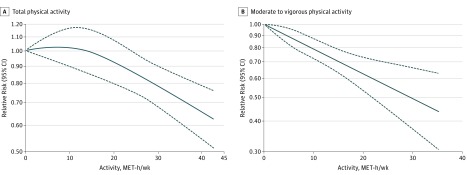
Figura 4.Analisi dose-rispostaAnalisi dose-risposta dell’associazione non lineare tra attività fisica totale (A) e da moderata a vigorosa (B) e il rischio di malattia di Parkinson. La linea solida rappresenta le stime puntuali dell’associazione tra attività fisica e rischio di malattia di Parkinson; le linee tratteggiate indicano intervalli di confidenza del 95%. MET indica l’equivalente metabolico del compito.

Figura 4.Analisi dose-rispostaAnalisi dose-risposta dell’associazione non lineare tra attività fisica totale (A) e da moderata a vigorosa (B) e il rischio di malattia di Parkinson. La linea solida rappresenta le stime puntuali dell’associazione tra attività fisica e rischio di malattia di Parkinson; le linee tratteggiate indicano intervalli di confidenza del 95%. MET indica l’equivalente metabolico del compito.
Bias di pubblicazione
La correlazione del rango di Begg e i test di regressione lineare di Egger hanno rivelato poche prove di distorsione della pubblicazione rispetto all’attività fisica in relazione al rischio di PD.
Discussione
A nostra conoscenza, questa meta-analisi è la più ampia e completa valutazione del rapporto dose-risposta tra l’attività fisica e il rischio di PD nella popolazione generale. Utilizzando i dati estratti da studi prospettici, la nostra analisi congiunta di oltre mezzo milione di adulti ha rivelato che livelli più elevati di attività fisica – in particolare attività da moderata a vigorosa – sono associati a un minore rischio di sviluppare la PD. Questa associazione è rimasta quando abbiamo eseguito le analisi dei sottogruppi in base alla regione geografica, alla durata del follow-up, alla dimensione del campione e alla qualità dello studio. È importante notare, tuttavia, che l’effetto benefico dell’attività fisica sul rischio di PD era esclusivo degli uomini e non è stato osservato tra le donne negli studi.
Nel 1992, Sasco e i suoi colleghi21 in primo luogo ha suggerito che l’aumento dell’attività fisica può avere un effetto protettivo contro la PD, segnalando che gli uomini che hanno praticato sport al college e/o in età adulta hanno un rischio ridotto di sviluppare la PD; inoltre, hanno trovato che livelli più elevati di attività fisica sono stati associati con un rischio progressivamente inferiore di PD. Da questo primo rapporto, una serie di studi epidemiologici successivi ha indagato questa relazione putativo, dando risultati convincenti. Ad esempio, livelli più elevati di esercizio fisico sono stati trovati per ridurre il rischio di PD negli uomini nello studio di follow-up dei professionisti della salute, ma non nelle donne nello studio sulla salute degli infermieri, indicando che uomini e donne possono avere risposte biologiche diverse all’attività fisica.18 D’altra parte, una precedente meta-analisi condotta da Xu et al23 non ha trovato alcuna differenza basata sul sesso tra l’attività fisica e il rischio di PD. Tuttavia, questi autori hanno confrontato solo il livello di attività più alto con il livello di attività più basso, e molti altri studi di coorte sono stati pubblicati dopo la loro meta-analisi.
Tanaka et al25 anche misurato gli effetti di un programma di esercizio fisico multimodale in 20 pazienti anziani con PD e ha trovato che i pazienti che hanno subito un allenamento fisico generale per 6 mesi hanno mostrato un miglioramento del funzionamento esecutivo. Recentemente, Schenkman et al26 ha suggerito che l’esercizio ad alta intensità su un tapis roulant può essere sia fattibile che sicuro per i pazienti con PD. Ciononostante, questi promettenti risultati indotti dall’esercizio fisico dovrebbero essere ulteriormente investigati in ampi studi che coinvolgono pazienti con PD.
Sono stati suggeriti diversi meccanismi per il presunto effetto neuroprotettivo dell’attività fisica. Ad esempio, l’attività fisica in modelli animali di PD ha dimostrato di (1) upregolare la produzione di vari fattori di crescita e recettori, (2) mantenere la funzione dopaminergica, e (3) ridurre l’infiammazione cellulare e lo stress ossidativo.11,27 Negli esseri umani sani, l’esercizio fisico promuove l’espressione di fattori di crescita neuroprotettivi come il fattore neurotrofico di derivazione cerebrale e il fattore neurotrofico di derivazione gliale.28,29 L’attività fisica può anche ridurre i danni ai neuroni dopaminergici all’interno dei circuiti motori.30 Infine, i modelli roditori di PD indotta da lesioni hanno conservato i livelli di dopamina striatale dopo l’attività del tapis roulant e hanno una maggiore perdita di neuroni dopaminergici a seguito del non utilizzo forzato dell’arto anteriore controlaterale.31,32
La forza della nostra meta-analisi risiede in 4 aspetti chiave. In primo luogo, abbiamo incluso tutti gli studi prospettici disponibili con campioni di alta qualità e di grandi dimensioni e dati di follow-up sufficientemente a lungo termine. In secondo luogo, oltre ad eseguire una meta-analisi categorica tradizionale, siamo stati anche in grado di quantificare – e quindi categorizzare – la quantità di attività fisica e valutare il rischio di PD associato a specifici livelli quantitativi di attività fisica, ottenendo così informazioni più significative. In terzo luogo, non abbiamo trovato alcuna eterogeneità significativa tra gli studi inclusi nella nostra meta-analisi. In quarto luogo, abbiamo eseguito diverse analisi di sottogruppi e abbiamo osservato differenze significative basate sul sesso per quanto riguarda l’associazione tra l’attività fisica, inclusa l’intensità dell’esercizio fisico, e il rischio di PD.
Limitazioni
Il nostro studio ha diversi limiti che possono influenzare l’interpretazione dei nostri risultati. In primo luogo, una quantità limitata di dati empirici è stata appropriata per l’inclusione nella nostra meta-analisi. In secondo luogo, sono possibili fattori di confondimento residui, dato che il livello di aggiustamento è diverso per ogni studio; pertanto, abbiamo utilizzato stime di rischio derivate da modelli completamente aggiustati per la nostra analisi in pool per ridurre i potenziali fattori di confondimento. In terzo luogo, anche se la ricerca sia di Embase che di PubMed dovrebbe coprire circa il 97,5% degli articoli pubblicati,33 e sebbene abbiamo incluso anche il Web of Science nella nostra ricerca, non possiamo escludere la possibilità che altri articoli rilevanti possano essere mancati a causa della limitazione della nostra ricerca a queste 3 banche dati. Tuttavia, oltre alla ricerca in queste banche dati, abbiamo anche cercato manualmente le liste di riferimento di tutti gli articoli rilevanti; pertanto, riteniamo che il numero di articoli mancanti dalla nostra analisi sia probabilmente piccolo e che avrebbe poco impatto sulla nostra analisi. In quarto luogo, la maggior parte degli studi inclusi nella nostra analisi ha raccolto le informazioni tramite questionari autodenunciati, il che avrebbe potuto portare ad errori nella misurazione dell’attività fisica. Quinto, non possiamo escludere del tutto la possibilità che la patogenesi preclinica o non diagnosticata della PD al livello di base possa manifestarsi come un livello inferiore di attività fisica. Tuttavia, uno studio precedente che utilizzava misurazioni ripetute non ha riportato alcuna diminuzione significativa del livello di attività fisica tra i pazienti con PD fino a circa 2 o 4 anni prima della diagnosi della malattia.18 Sulla base della nostra meta-analisi temporale, la potenziale causalità inversa tra la PD iniziale e la diminuzione dell’attività fisica non dovrebbe influenzare i risultati principali di questo studio. Anche così, se il periodo presindromico è più lungo del previsto, anche escludendo i primi 4-10 anni non risolverebbe il problema.
Conclusioni
Si segnala che livelli più elevati di attività fisica totale – in particolare da moderata a vigorosa – sono associati a un ridotto rischio di PD. Questi benefici sono stati significativi tra gli uomini, ma sono stati meno consistenti tra le donne; in particolare, un aumento di 10 ore MET/settimana in totale e un’attività fisica da moderata a vigorosa hanno ridotto il rischio di PD negli uomini rispettivamente del 10% e del 17%. Questi risultati possono aiutare a guidare i medici e i responsabili delle politiche sanitarie nel formulare raccomandazioni e nello sviluppare linee guida in merito al grado di attività fisica che possono contribuire a ridurre il rischio di PD sia a livello individuale che a livello di popolazione. Ulteriori studi epidemiologici con un campione di grandi dimensioni e una quantificazione dettagliata dell’attività fisica contribuiranno a stabilire informazioni più precise su questa associazione.
References
- Alzheimer’s disease and Parkinson’s disease. N Engl J Med. 2003; 348(14)DOI | PubMed
- Epidemiology and etiology of Parkinson’s disease: a review of the evidence. Eur J Epidemiol. 2011; 26(suppl 1):S1-S58. DOI | PubMed
- How common are the “common” neurologic disorders?. Neurology. 2007; 68(5):326-337. DOI | PubMed
- Time trends in the incidence of Parkinson disease. JAMA Neurol. 2016; 73(8):981-989. DOI | PubMed
- Parkinson’s disease in China: prevalence in Beijing, Xian, and Shanghai. Lancet. 2005; 365(9459):595-597. DOI | PubMed
- The epidemiology of Parkinson’s disease: risk factors and prevention. Lancet Neurol. 2016; 15(12):1257-1272. DOI | PubMed
- Parkinson disease: an evolutionary perspective. Front Neurol. 2017; 8:157. DOI | PubMed
- Dose-response relationship between physical activity and risk of heart failure: a meta-analysis. Circulation. 2015; 132(19):1786-1794. DOI | PubMed
- Physical activity and risk of breast cancer, colon cancer, diabetes, ischemic heart disease, and ischemic stroke events: systematic review and dose-response meta-analysis for the Global Burden of Disease Study 2013. BMJ. 2016; 354:i3857. DOI | PubMed
- Physical activity and incident type 2 diabetes mellitus: a systematic review and dose-response meta-analysis of prospective cohort studies. Diabetologia. 2016; 59(12):2527-2545. DOI | PubMed
- The best medicine? the influence of physical activity and inactivity on Parkinson’s disease. Mov Disord. 2016; 31(10):1444-1454. DOI | PubMed
- Meta-analysis of observational studies in epidemiology: a proposal for reporting. Meta-analysis of Observational Studies in Epidemiology (MOOSE) group. JAMA. 2000; 283(15):2008-2012. DOI | PubMed
- Methods for trend estimation from summarized dose-response data, with applications to meta-analysis. Am J Epidemiol. 1992; 135(11):1301-1309. DOI | PubMed
- Generalized least squares for trend estimation of summarized dose-response data. Stata J. 2006; 6(1):40-57. Publisher Full Text
- Dietary magnesium intake and the risk of cardiovascular disease, type 2 diabetes, and all-cause mortality: a dose-response meta-analysis of prospective cohort studies. BMC Med. 2016; 14(1):210. DOI | PubMed
- Regression models in clinical studies: determining relationships between predictors and response. J Natl Cancer Inst. 1988; 80(15):1198-1202. DOI | PubMed
- Measuring inconsistency in meta-analyses. BMJ. 2003; 327(7414):557-560. DOI | PubMed
- Physical activity and the risk of Parkinson disease. Neurology. 2005; 64(4):664-669. DOI | PubMed
- Physical activity and risk of Parkinson’s disease: a prospective cohort study. J Neurol Neurosurg Psychiatry. 2006; 77(12):1318-1322. DOI | PubMed
- Reduced risk of Parkinson’s disease associated with lower body mass index and heavy leisure-time physical activity. Eur J Epidemiol. 2014; 29(4):285-292. DOI | PubMed
- The role of physical exercise in the occurrence of Parkinson’s disease. Arch Neurol. 1992; 49(4):360-365. DOI | PubMed
- Recreational physical activity and risk of Parkinson’s disease. Mov Disord. 2008; 23(1):69-74. DOI | PubMed
- Physical activities and future risk of Parkinson disease. Neurology. 2010; 75(4):341-348. DOI | PubMed
- Physical activity and risk of Parkinson’s disease in the Swedish National March Cohort. Brain. 2015; 138(Pt 2):269-275. DOI | PubMed
- Benefits of physical exercise on executive functions in older people with Parkinson’s disease. Brain Cogn. 2009; 69(2):435-441. DOI | PubMed
- Effect of high-intensity treadmill exercise on motor symptoms in patients with de novo Parkinson disease: a phase 2 randomized clinical trial. JAMA Neurol. 2018; 75(2):219-226. DOI | PubMed
- Protective effects of physical exercise in Alzheimer’s disease and Parkinson’s disease: a narrative review. J Clin Neurol. 2015; 11(3):212-219. DOI | PubMed
- Endurance training increases plasma brain-derived neurotrophic factor concentration in young healthy men. J Physiol Pharmacol. 2008; 59(suppl 7):119-132. PubMed
- Serum levels of brain-derived neurotrophic factor correlate with motor impairment in Parkinson’s disease. J Neurol. 2010; 257(4):540-545. DOI | PubMed
- Changes in dopamine availability in the nigrostriatal and mesocortical dopaminergic systems by gait in Parkinson’s disease. Brain. 2001; 124(Pt 4):784-792. DOI | PubMed
- Forced nonuse in unilateral parkinsonian rats exacerbates injury. J Neurosci. 2002; 22(15):6790-6799. DOI | PubMed
- Exercise induces behavioral recovery and attenuates neurochemical deficits in rodent models of Parkinson’s disease. Neuroscience. 2003; 119(3):899-911. DOI | PubMed
- Comparing the coverage, recall, and precision of searches for 120 systematic reviews in Embase, MEDLINE, and Google Scholar: a prospective study. Syst Rev. 2016; 5:39. DOI | PubMed
Fonte
Fang X, Han D, Cheng Q, Zhang P, Zhao C, et al. (2018) Association of Levels of Physical Activity With Risk of Parkinson Disease. JAMA Network Open 1(5): e182421. https://doi.org/10.1001/jamanetworkopen.2018.2421





