Introduzione
Il trattamento del diabete di tipo 1 (T1D) è incentrato sul miglioramento e sul mantenimento di uno stretto controllo glicemico, come valutato dai livelli di emoglobinaA1c (HbA1c), per prevenire le complicanze acute e croniche del diabete.1,2,3 Il controllo glicemico può variare notevolmente dall’insorgenza del diabete all’adolescenza,4,5,6 dove sono note fluttuazioni durante la pubertà3,4,7,8,9,10,11,12 e durante la prima età adulta. Uno scarso controllo glicemico durante la prima età adulta o dall’infanzia alla giovane età adulta è stato attribuito a una mancanza di continuità nella cura clinica del diabete4,11,12 così come i cambiamenti nella cura di sé come i bambini e gli adolescenti con T1D crescono fino all’età adulta.9,10,13 Tuttavia, il controllo glicemico nei giovani e nei giovani adulti con T1D è fondamentale, poiché un livello medio più alto di HbA1c in questo periodo di sviluppo è associato a una crescita ridotta e a complicazioni diabetiche.14,15,16,17
Negli studi trasversali di adolescenti e giovani adulti, il controllo glicemico si differenzia per sottogruppi razziali ed etnici.18 I giovani afroamericani, indiani d’America, ispanici, asiatici o delle isole del Pacifico con T1D hanno più probabilità di avere livelli di HbA1c più alti rispetto ai giovani bianchi non ispanici.19 Negli studi longitudinali, i giovani non bianchi con T1D hanno aumentato i marcatori di prognosi sfavorevole al momento della diagnosi e a 3 anni dalla diagnosi, compresi i livelli più alti di HbA1c, la chetoacidosi diabetica più frequente e l’ipoglicemia grave.20 È stata proposta una costellazione di fattori sociodemografici legati alla razza/etnia e al controllo glicemico, che vanno dalle dinamiche familiari, ai sintomi depressivi e alla qualità della vita.13,21,22,23,24,25 al regime del diabete.26,27,28 Il ruolo della posizione socioeconomica come mediatore delle associazioni razziali/etniche rimane controverso.28,29,30,31 Inoltre, fattori specifici dell’assistenza sanitaria, come le disparità nell’alfabetizzazione sanitaria, le conoscenze relative al diabete o l’accesso all’assistenza sanitaria, sono noti per contribuire alla disparità sanitaria pediatrica, ma non sono stati ben esplorati nel T1D.32,33
La modellazione della traiettoria delle classi latenti è stata utilizzata per identificare i sottogruppi che condividono una traiettoria simile a quella dell’HbA1c nel tempo.34 Pochi studi hanno esaminato se le disparità razziali/etniche nel controllo glicemico persistono nel tempo dall’infanzia all’età adulta tra gli individui con T1D. Il nostro obiettivo era di visualizzare prima le traiettorie principali del controllo glicemico dall’infanzia all’età adulta utilizzando tutti i dati della gioventù di tutti i gruppi razziali ed etnici e di caratterizzare poi le associazioni specifiche tra razza/etnicità e i modelli longitudinali distinti del controllo glicemico. La nostra ipotesi era che la gioventù nera e quella ispanica non ispanica sarebbe stata più probabile che la gioventù bianca non ispanica avesse modelli di traiettoria sfavorevoli che rappresentassero uno scarso controllo glicemico e che questa associazione potesse essere mediata da fattori clinici come il regime del diabete.26,27,28 e dalla posizione socioeconomica.29,30,31
Metodi
Studiare la popolazione
Lo studio SEARCH for Diabetes in Youth è iniziato nel 2000 con l’obiettivo generale di descrivere l’incidenza e la prevalenza del diabete infantile tra i 5 principali gruppi razziali ed etnici negli Stati Uniti.35 Individui con diabete diagnosticato prima dei 20 anni di età sono stati identificati da una rete di registri di incidenza basati sulla popolazione in 5 siti statunitensi (South Carolina; Cincinnati, Ohio, e contee limitrofe; Colorado con siti dei nativi americani del sud-ovest; Seattle, Washington, e contee limitrofe; e Kaiser Permanente, California meridionale).36 Ai pazienti è stata recentemente diagnosticata la T1D nel 2002 e fino al 2005. Ai pazienti che potevano essere contattati è stato chiesto di completare un breve sondaggio e sono stati reclutati per una visita di base. Se hanno completato la prima visita, è stato chiesto loro di tornare per le visite a 12, 24 e 60 mesi per misurare i fattori di rischio per le complicanze del diabete(Figura 1A). Un sottogruppo di partecipanti di età pari o superiore a 10 anni e con almeno 5 anni di diabete è stato reclutato per una visita di follow-up tra il 2012 e il 2015. Il sottogruppo di giovani che sono stati inclusi nella visita di coorte di RICERCA non si differenziava in modo significativo da tutti gli altri giovani diagnosticati tra il 2002 e il 2008 in termini di età media all’insorgenza del diabete, distribuzione del sesso o della razza e dell’etnia o misure cliniche.14
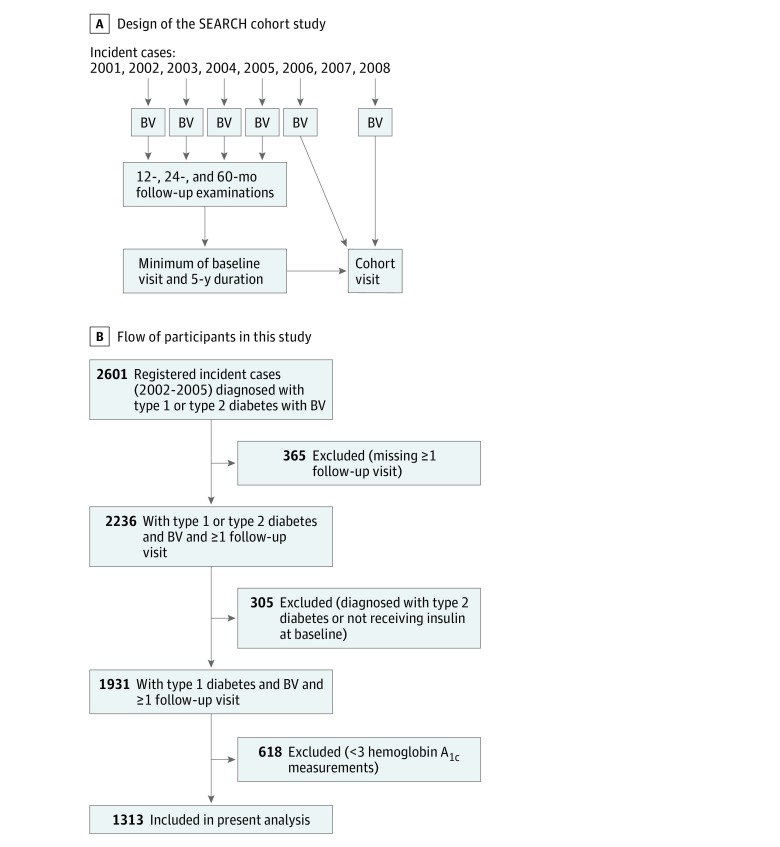
Figura 1.Progettazione dello studio e reclutamento del campioneA, Progetto di studio dello studio di coorte di RICERCA. B, Diagramma di flusso che illustra i partecipanti in questo rapporto, compresi i motivi di esclusione. Il campione finale comprendeva 1313 giovani con diabete di tipo 1. BV indica la visita di base.
I criteri di inclusione per queste analisi consistevano in giovani con diagnosi di T1D tra il 2002 e il 2005. Il diabete di tipo 1 era basato sulla diagnosi clinica fatta da un medico o da un altro operatore sanitario all’inizio ed è stato raccolto da questi operatori sanitari o estratto dalle cartelle cliniche. Sono stati inclusi i giovani con una diagnosi clinica di diabete di tipo 1a, tipo 1b o tipo 1. Sono stati esclusi i giovani che hanno avuto meno di 3 misure di HbA1c dalle visite di ricerca durante i 6,1-13,3 anni di follow-up (n = 618). Gli individui esclusi non sono stati diversi per quanto riguarda le misure di HbA1c utilizzando i dati disponibili dalla linea di base dello studio e dalla visita di coorte. Il campione finale dello studio comprendeva 1313 giovani con T1D(Figura 1B). Lo studio è stato approvato da comitati di revisione istituzionali con giurisdizione; il genitore, il partecipante o entrambi hanno fornito il consenso scritto o il consenso per tutti i partecipanti (il consenso del genitore o del tutore legale ≥1 era richiesto per i partecipanti di età inferiore ai 18 anni). Lo studio ha seguito la linea guida per il rafforzamento della segnalazione degli studi osservazionali in epidemiologia(STROBE).

Figura 1.Progettazione dello studio e reclutamento del campioneA, Progetto di studio dello studio di coorte di RICERCA. B, Diagramma di flusso che illustra i partecipanti in questo rapporto, compresi i motivi di esclusione. Il campione finale comprendeva 1313 giovani con diabete di tipo 1. BV indica la visita di base.
Visite di ricerca
Personale formato ha somministrato questionari, misurato l’altezza, il peso e la pressione sanguigna e ha ottenuto campioni di sangue. L’indice di massa corporea è stato definito come il peso (chilogrammi) diviso per l’altezza (metri al quadrato) e convertito in un punteggio z.37 Un prelievo di sangue è avvenuto dopo un digiuno di 8 ore durante la notte, e i farmaci, compresa l’insulina a breve durata d’azione, sono stati trattenuti la mattina della visita.
Misure di laboratorio
I campioni di sangue sono stati ottenuti in condizioni di stabilità metabolica, definita come assenza di episodi di chetoacidosi diabetica nel mese precedente e assenza di febbre e infezioni acute. Sono stati elaborati localmente e spediti entro 24 ore al laboratorio centrale (Northwest Lipid Metabolism and Diabetes Research Laboratories). L’emoglobinaA1c è stata misurata con uno strumento dedicato per cromatografia liquida ad alte prestazioni a scambio ionico (TOSOH Bioscience).
Altre misure
La razza e l’etnia dichiarate sono state raccolte sulla base di domande modellate sul modello del censimento americano del 2000.38 e classificati come non ispanici bianchi, non ispanici neri, ispanici e altri (asiatici, nativi americani, abitanti delle isole del Pacifico, altri e sconosciuti). Anche se il censimento statunitense prevede la segnalazione di più razze, lo studio SEARCH non aveva un numero di partecipanti sufficiente per consentire la valutazione di categorie separate di gruppi di razze multiple segnalate.39 e ha utilizzato l’approccio pluralistico del National Center for Health Statistics, in cui sono stati utilizzati i dati di uno studio progettato per affrontare la segnalazione di più gare per determinare quale categoria di gara singola dovrebbe essere assegnata per specifiche combinazioni di più gare segnalate.38
Il regime insulinico si basava sulla modalità di somministrazione dell’insulina, classificata come pompa, ad azione prolungata con iniezioni di insulina ad azione rapida con 3 o più iniezioni al giorno, e qualsiasi altra forma di iniezioni multiple giornaliere. La dose di insulina è stata riportata come unità per chilogrammo di peso corporeo. La frequenza dell’autocontrollo della glicemia è stata dichiarata e classificata come meno di 1 volta al giorno, da 1 a 3 volte al giorno e 4 o più volte al giorno. Il tipo di assicurazione sanitaria è stato classificato come nessuno, privato, Medicaid o altro. L’educazione dei genitori si basava sul più alto livello di istruzione raggiunto da uno dei due genitori e veniva classificata come inferiore al diploma di scuola superiore, al diploma di scuola superiore, a qualche college attraverso il diploma di associato, e al diploma di laurea o più. La struttura della famiglia è stata classificata come 2 genitori, genitore singolo o altro. La ricezione di cure per il diabete è stata basata sul numero di visite con professionisti sanitari del diabete predefiniti, inclusi endocrinologi pediatrici, diabetologi adulti e infermieri diabetologi, nei 6 mesi precedenti e classificati in base alla distribuzione: Da 0 a 1 visita, da 2 a 3 visite, da 4 a 5 visite e 6 o più visite. La ricezione di cure non diabetologiche si è basata sul numero di visite con operatori sanitari non diabetologici (pediatra, medico di famiglia, medico di medicina generale, internista, infermiere o assistente medico, guaritore tradizionale, dietologo, optometrista o oftalmologo e psichiatra, psicologo o consulente per la salute mentale) nei 6 mesi precedenti e classificate in base alla distribuzione: da 0 a 1 visita, da 2 a 3 visite, da 4 a 6 visite e 7 o più visite. La soddisfazione per la cura del diabete si basava sulla risposta alla domanda “Come giudichereste la vostra cura del diabete in generale?” (le possibili risposte erano eccellenti, buone, giuste, scarse e non applicabili).
Analisi statistica
Abbiamo utilizzato la modellazione delle traiettorie di gruppo per identificare le traiettorie di HbA1c tra i giovani con T1D utilizzando la durata del diabete (mesi) come scala temporale tramite la macro PROC TRAJ del software statistico SAS versione 9.4 (SAS Institute Inc), che si adatta a un modello semiparametrico (miscela discreta) per i dati longitudinali utilizzando il metodo della massima probabilità.40,41,42,43,44 L’analisi della traiettoria utilizza tutti i dati disponibili per un partecipante ed è robusta rispetto ai dati mancanti a caso. I dettagli sull’analisi della traiettoria sono stati descritti altrove.43,44 Il numero ottimale di gruppi è stato determinato in base al criterio dell’informazione bayesiana e con almeno il 5% del campione nel gruppo di traiettoria più piccolo. Abbiamo denominato le traiettorie in base al valore di base HbA1c (dalla visita di ricerca iniziale) e alla forma della traiettoria durante le visite successive. Abbiamo poi calcolato la probabilità posteriore prevista per ogni partecipante di essere un membro di ogni gruppo di traiettoria dato il suo modello HbA1c osservato. I partecipanti sono stati assegnati al gruppo di traiettoria per il quale avevano la maggiore probabilità posteriore di essere membri del gruppo. La regressione multinazionale è stata utilizzata per valutare l’associazione di razza/etnicità (bianco non ispanico vs. nero non ispanico vs. ispanico) con l’appartenenza al gruppo di traiettoria HbA1c. I giovani che hanno segnalato l’asiatico o l’isolano del Pacifico, i nativi americani, altri, e razza/etnicità sconosciuta (n = 34) sono stati esclusi dalla modellazione multinomiale. Il bianco non ispanico è stato designato come gruppo di riferimento.
Tutte le covariate sono state misurate alla linea di base. Il modello 1 non era regolato. Il modello 2 è stato adattato ai fattori demografici (sesso, età alla diagnosi e sito della clinica). Il modello 3 è stato inoltre regolato per le variabili cliniche (punteggio dell’indice di massa corporea z, regime insulinico, dose di insulina e frequenza dell’automonitoraggio del glucosio nel sangue). Il modello 4 è stato ulteriormente corretto per la posizione socioeconomica (istruzione parentale più elevata, struttura della famiglia e tipo di assicurazione sanitaria).
Date le precedenti constatazioni di disuguaglianza sanitaria,45 abbiamo testato per i sottogruppi legati al sesso e all’età che possono essere particolarmente vulnerabili agli effetti dell’iniquità della salute. La modifica degli effetti di razza/etnia in base all’età e al sesso è stata testata aggiungendo un termine di interazione (rispettivamente razza/etnia×sesso e razza/etnia×età alla diagnosi) al modello 4. La natura della modifica è stata esplorata in modelli stratificati per sesso e per età mediana della diagnosi (9 anni). A causa delle limitate dimensioni del campione, per le analisi stratificate, la razza/etnia è stata categorizzata in bianco non ispanico e altro (definito come nero non ispanico, ispanico, asiatico o dell’isola del Pacifico, nativo americano, altro, e sconosciuto).
Tutte le analisi sono state completate nel software SAS nel 2017. La significatività statistica si basava su un valore P su due lati di .05. Le analisi descrittive hanno utilizzato la media e la deviazione standard o la mediana e l’intervallo interquartile (IQR) per le distribuzioni non normali e per le variabili continue e le frequenze per descrivere le variabili categoriali. Le medie e le frequenze delle caratteristiche demografiche e cliniche sono state confrontate utilizzando il test χ 2 per le variabili categoriali e l’analisi della varianza o il test di Kruskal-Wallis per le variabili continue.
Risultati
Il campione di 1313 giovani con T1D era composto per il 49,3% da donne (647 pazienti); il 77,0% da bianchi non ispanici (1011 pazienti); il 10,7% da ispanici (140 pazienti); il 9,8% da neri non ispanici (128 pazienti); e il 2,6% da altri razzisti/etnici (34 pazienti)(Tabella 1). Alla visita di base, l’età media (SD) era di 9,7 (4,3) anni e la durata media (SD) del diabete era di 9,2 (6,3) mesi. La modellazione della traiettoria basata sul gruppo ha identificato 3 distinte traiettorie HbA1c su un follow-up medio (SD) di 108 (16) mesi (9,0 [1,4] anni) di durata del diabete: gruppo 1, baseline bassa e aumenti lievi (50,7% [666 pazienti]); gruppo 2, baseline moderata e aumenti moderati (41,7% [548 pazienti]); e gruppo 3, baseline moderata e aumenti maggiori (7,5% [99 pazienti])(Figura 2).
| Caratteristica | N. (%) | P Valorea | |||
|---|---|---|---|---|---|
| Totale partecipanti (N=1313) | Gruppo 1: Basso livello di base e lievi aumenti (n = 6666) | Gruppo 2: Baseline moderata e incrementi moderati (n = 548) | Gruppo 3: Baseline moderata e aumenti maggiori (n==99) | ||
| Età alla diagnosi, media (SD), y | 8.9 (4.2) | 8.8 (4.5) | 8.5 (3.9) | 11.3 (3.5) | <.001 |
| Età alla linea di base, media (SD), y | 9.7 (4.3) | 9.6 (4.5) | 9.3 (3.9) | 12.2 (3.5) | <.001 |
| Durata del diabete, media (SD), mo | 9.2 (6.3) | 9.0 (6.4) | 9.3 (6.1) | 10.4 (6.4) | .13 |
| Femmina | 647 (49.3) | 316 (47.5) | 280 (51.1) | 51 (51.5) | .40 |
| Razza/etnicità non biancab | 302 (23.0) | 102 (15.3) | 153 (27.9) | 47 (47.5) | <.001 |
| Razza/etnicitàb | |||||
| Bianco non ispanico | 1011 (77.0) | 564 (84.7) | 395 (72.1) | 52 (52.5) | <.001 |
| Nero non ispanico | 128 (9.8) | 34 (5.1) | 69 (12.6) | 25 (25.3) | |
| Ispanico | 140 (10.7) | 56 (8.4) | 67 (12.2) | 17 (17.2) | |
| Altro | 34 (2.6) | 12 (1.8) | 17 (3.1) | 5 (5.1) | |
| Educazione dei genitori | |||||
| Meno del liceo | 48 (3.7) | 20 (3.0) | 20 (3.7) | 8 (8.1) | <.001 |
| Diplomato | 180 (13.8) | 61 (9.2) | 93 (17.1) | 26 (26.3) | |
| Alcuni college (attraverso la laurea di un associato) | 441 (33.8) | 184 (27.8) | 219 (40.3) | 38 (38.4) | |
| Laurea o superiore | 636 (48.7) | 397 (60.0) | 212 (39.0) | 27 (27.3) | |
| Assicurazione | |||||
| Nessuno | 19 (1.5) | 8 (1.2) | 8 (1.5) | 3 (3.0) | <.001 |
| Privato | 1052 (80.7) | 586 (88.4) | 402 (74.3) | 64 (64.7) | |
| Medicaid | 211 (16.2) | 61 (9.2) | 119 (22.0) | 31 (31.3) | |
| Altro | 21 (1.6) | 8 (1.2) | 12 (2.2) | 1 (1.1) | |
| Struttura familiare | |||||
| Famiglia a due genitori | 961 (73.6) | 543 (81.9) | 366 (67.4) | 52 (52.5) | <.001 |
| Famiglia monoparentale | 311 (23.8) | 109 (16.4) | 161 (29.7) | 41 (41.4) | |
| Altra struttura | 33 (2.53) | 11 (1.7) | 16 (3.0) | 6 (6.1) | |
| Regime insulinico | |||||
| Pompa | 106 (8.15) | 67 (10.1) | 36 (6.6) | 3 (3.1) | .01 |
| Lunga con insulina breve o rapida, ≥3 volte/d | 418 (32.1) | 225 (33.9) | 164 (30.3) | 29 (29.6) | |
| Lunga con altre combinazionic | 779 (59.8) | 371 (56.0) | 342 (63.1) | 66 (67.4) | |
| Dose di insulina, media (SD), unità/kg | 0.63 (0.42) | 0.59 (0.46) | 0.66 (0.38) | 0.73 (0.38) | .001 |
| Monitoraggio della glicemia, tempi/d | |||||
| <1 | 10 (0.8) | 14 (2.1) | 11 (2.0) | 4 (4.0) | <.001 |
| 1-3 | 148 (11.5) | 64 (9.6) | 58 (10.6) | 26 (26.5) | |
| ≥4 | 1134 (88.8) | 588 (88.3) | 478 (87.4) | 68 (70.4) | |
| Indice di massa corporea indice z punteggio medio (SD) | 0.58 (0.97) | 0.40 (0.92) | 0.66 (1.00) | 0.68 (1.10) | .02 |
| Visite per la cura del diabete negli ultimi 6 mesi, No.d | |||||
| Media (SD)d | 3.9 (2.9) | 3.9 (2.9) | 4.1 (3.0) | 3.6 (2.6) | .31 |
| 0-1 | 173 (13.2) | 95 (14.3) | 65 (11.9) | 13 (13.1) | .12 |
| 2-3 | 479 (36.5) | 228 (34.2) | 211 (38.5) | 40 (40.4) | |
| 4-5 | 383 (29.2) | 211 (31.7) | 142 (25.9) | 30 (30.30) | |
| ≥6 | 278 (21.2) | 132 (19.8) | 130 (23.7) | 16 (16.2) | |
| Altre visite di assistenza negli ultimi 6 mesi, No.d | |||||
| Media (SD)d | 5.0 (4.1) | 4.8 (3.9) | 5.1 (4.3) | 5.0 (4.5) | .44 |
| 0-1 | 175 (13.3) | 83 (12.5) | 73 (13.3) | 19 (19.2) | .23 |
| 2-3 | 384 (29.3) | 207 (31.1) | 153 (27.9) | 24 (24.2) | |
| 4-6 | 424 (33.1) | 225 (33.8) | 182 (33.2) | 27 (27.3) | |
| ≥7 | 320 (24.4) | 151 (22.7 | 140 (25.6) | 29 (29.3) | |
| Soddisfazione per la cura del diabetee | |||||
| Eccellente | 938 (72.4) | 505 (77.2) | 382 (70.6) | 51 (54.8) | <.001 |
| Buono | 288 (22.4) | 127 (19.4) | 133 (24.6) | 28 (30.1) | |
| Fiera | 49 (3.8) | 16 (2.5) | 21 (3.9) | 12 (12.9) | |
| Povero | 5 (0.4) | 1 (0.2) | 3 (0.6) | 1 (1.1) | |
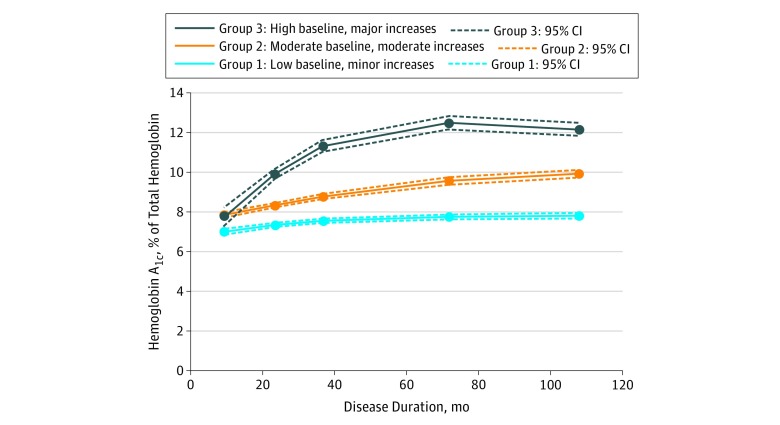
Figura 2.Traiettorie dell’emoglobinaA1c nel 1313 Pazienti con diabete di tipo 1 nella RICERCA per il diabete in età giovanile La modellazione delle traiettorie basata sul gruppo ha identificato 3 distinte traiettorie di emoglobinaA1c su una durata media del diabete di tipo 1 di 108 mesi. Per convertire l’emoglobinaA1c in proporzione dell’emoglobina totale, moltiplicare per 0,01.
La prevalenza di giovani neri e ispanici è stata la più alta nel gruppo 3 e la più bassa nel gruppo 1 (i pazienti neri non ispanici costituivano il 5,1% del gruppo 1, il 12,6% del gruppo 2 e il 25,3% del gruppo 3; i pazienti ispanici costituivano l’8,4% del gruppo 1, il 12,2% del gruppo 2 e il 17,2% del gruppo 3). Per i pazienti neri non ispanici, la differenza tra il gruppo 1 e il gruppo 2 era del 7,5% (95% IC, 4,2%-10,7%; P= 001); tra il gruppo 1 e il gruppo 3, 20,2% (95% IC, 11,4%-28,9%; P = 001) ; e tra il gruppo 2 e il gruppo 3, 12,6% (95% IC, 3,7%-21,7%; P = 001). Per i pazienti ispanici, la differenza tra il gruppo 1 e il gruppo 2 è stata del 3,8% (95% IC, 0,4%-7,3%; P==.03); tra il gruppo 1 e il gruppo 3, 8,8% (95% IC, 1,0%-16,5%; P==. 006); e tra il gruppo 2 e il gruppo 3, 5,0% (95% IC, 3,0%-12,9%; P==.18). Il gruppo 3 era composto per il 47,5% da giovani non bianchi (47 pazienti)(Tabella 1). La Tabella 2 illustra i rapporti di probabilità (OR) per i neri non ispanici e gli ispanici contro i bianchi non ispanici e il gruppo di traiettoria HbA1c in una serie di modelli corretti in sequenza. I giovani neri non ispanici avevano 7,98 probabilità maggiori rispetto ai giovani bianchi non ispanici di trovarsi nel gruppo di traiettoria HbA1c più alto rispetto al gruppo di traiettoria HbA1c più basso (OR non regolato di razza nera non ispanica nel gruppo 3 vs gruppo 1, 7,98; 95% CI, 4,42-14,38). Dopo l’aggiustamento per le caratteristiche demografiche di base, i fattori clinici e la posizione socioeconomica, i giovani neri non ispanici avevano una probabilità 4,54 volte superiore rispetto ai giovani bianchi non ispanici di trovarsi nel gruppo di traiettoria HbA1c più alto rispetto al gruppo di traiettoria HbA1c più basso (OR corretto [aOR] di razza nera non ispanica nel gruppo 3 vs gruppo 1, 4,54; 95% di IC, 2,08-9,89). I giovani ispanici avevano 3,29 più alte probabilità non aggiustate rispetto ai giovani bianchi non ispanici di essere nel più alto gruppo di traiettoria HbA1c rispetto al più basso gruppo di traiettoria HbA1c (OR non aggiustato di etnia ispanica nel gruppo 3 vs gruppo 1, 3,29; 95% CI, 1,78-6,08). L’aggiustamento per le caratteristiche demografiche di base, i fattori clinici e la posizione socioeconomica non hanno attenuato completamente l’associazione (OR di etnia ispanica nel gruppo 3 vs gruppo 1, 2,24; 95% IC, 1,02-4,92). L’aggiustamento per le variabili cliniche ha diminuito la significatività statistica associata alla traiettoria moderata di HbA1c (aOR dell’etnia ispanica nel gruppo 2 vs gruppo 1, 1,43; 95% IC, 0,90-2,27 vs OR non aggiustato, 1,71; 95% IC, 1,17-2,49).
| Modelloa | Rapporto di probabilità (95% CI) | |||||
|---|---|---|---|---|---|---|
| Razza nera (n=128)b | Etnia ispanica (n = 140)b | |||||
| Gruppo 1: Basso livello di base e lievi aumenti | Gruppo 2: Baseline moderata e incrementi moderati | Gruppo 3: Baseline moderata e grandi aumenti | Gruppo 1: Basso livello di base e lievi aumenti | Gruppo 2: Baseline moderata e incrementi moderati | Gruppo 3: Baseline moderata e grandi aumenti | |
| Modello 1 | 1 [Riferimento] | 2.90 (1.88-4.46) | 7.98 (4.42-14.38) | 1 [Riferimento] | 1.71 (1.17-2.49) | 3.29 (1.78-6.08) |
| Modello 2 | 1 [Riferimento] | 3.00 (1.92-4.67) | 9.94 (5.15-19.20) | 1 [Riferimento] | 1.67 (1.08-2.58) | 3.56 (1.75-7.21) |
| Modello 3 | 1 [Riferimento] | 2.50 (1.54-4.05) | 7.50 (3.68-15.26) | 1 [Riferimento] | 1.43 (0.90-2.27) | 3.32 (1.60-6.91) |
| Modello 4 | 1 [Riferimento] | 1.73 (1.04-2.90) | 4.54 (2.08-9.89) | 1 [Riferimento] | 1.16 (0.71-1.89) | 2.24 (1.02-4.92) |
L’associazione razza/etnicità e traiettoria HbA1c è stata modificata per sesso(P per interazione=.04) (Tabella 3). I pazienti di sesso maschile non bianco avevano quote significativamente elevate di appartenenza al gruppo di traiettoria HbA1c più alto (OR del gruppo 3 vs gruppo 1, 5,34; 95% di CI, 2,16-13,2) e moderata traiettoria HbA1c (OR del gruppo 2 vs gruppo 1, 2,06; 95% di CI, 1,18-3,57) rispetto ai pazienti di sesso maschile non ispanico bianco. Le associazioni non erano significative nelle pazienti di sesso femminile (aOR del gruppo 3 vs gruppo 1, 1,48; 95% IC, 0,65-3,39 e aOR del gruppo 2 vs gruppo 1, 1,00; 95% IC, 0,61-1,64). Anche l’associazione razza/etnicità e traiettoria HbA1c è stata modificata dall’età al momento della diagnosi(P per interazione=.02) (Tabella 3). I giovani non bianchi diagnosticati a o meno di 9 anni avevano quote significativamente elevate di appartenenza nel più alto gruppo di traiettoria HbA1c (aOR del gruppo 3 vs gruppo 1, 5,37; 95% CI, 1,91-15,1) e il moderato gruppo di traiettoria HbA1c (aOR del gruppo 2 vs gruppo 1, 2,04; 95% CI, 1,23-3,37). L’associazione non è stata significativa nei giovani che sono stati diagnosticati quando avevano più di 9 anni (aOR del gruppo 3 vs gruppo 1, 1,65; 95% IC, 0,77-3,51 e aOR del gruppo 2 vs gruppo 1, 0,96; 95% CI, 0,55-1,65).
| Modellob | Rapporto di probabilità (95% CI) | P Valore per l’interazione | ||
|---|---|---|---|---|
| Gruppo 1: Basso livello di base e lievi aumenti | Gruppo 2: Baseline moderata e incrementi moderati | Gruppo 3: Baseline moderata e grandi aumenti | ||
| Sesso | ||||
| Femmina (n = 581) | 1 [Riferimento] | 1.00 (0.61-1.64) | 1.48 (0.65-3.39) | .04 |
| Maschio (n = 593) | 1 [Riferimento] | 2.06 (1.18-3.57) | 5.34 (2.16-13.2) | |
| Età alla diagnosi, y | 1 [Riferimento] | |||
| ≤9 (n = 611) | 1 [Riferimento] | 2.04 (1.23-3.37) | 5.37 (1.91-15.1) | .02 |
| >9 (n = 564) | 1 [Riferimento] | 0.96 (0.55-1.65) | 1.65 (0.77-3.51) | |

Figura 2.Traiettorie dell’emoglobinaA1c nel 1313 Pazienti con diabete di tipo 1 nella RICERCA per il diabete in età giovanile La modellazione delle traiettorie basata sul gruppo ha identificato 3 distinte traiettorie di emoglobinaA1c su una durata media del diabete di tipo 1 di 108 mesi. Per convertire l’emoglobinaA1c in proporzione dell’emoglobina totale, moltiplicare per 0,01.
Discussione
In una vasta coorte multietnica di giovani con T1D, abbiamo trovato 3 distinte traiettorie di HbA1c che si sono deteriorate su un follow-up medio (SD) di 9,0 (1,4) anni (range, 6,1-13,3 anni) dopo la diagnosi di diabete, rafforzando che la prima giovinezza e il passaggio all’età adulta sono periodi ad alto rischio per il peggioramento del controllo glicemico.3,7,8 La razza nera e l’etnia ispanica sono state associate all’appartenenza al gruppo di traiettoria HbA1c più alto e in rapido aumento (in peggioramento).
Abbiamo testato l’associazione di razza/etnicità con la traiettoria HbA1c regolando per altre variabili, compresi i fattori clinici e la posizione socioeconomica. Ad esempio, le pratiche di prescrizione possono variare in base alla razza/etnia27 e l’uso della pompa per insulina è noto per essere più elevato nei giovani bianchi rispetto ai giovani non ispanici neri o ispanici.28 La posizione socioeconomica più bassa è stata proposta come importante mediatore dell’associazione razza/etnicità con gli esiti sanitari,29,30,31 comprese le complicazioni del T1D, a causa della scarsa autogestione tra le persone le cui condizioni socio-economiche sono meno favorevoli.20,46 Nonostante l’adeguamento per questi noti fattori di rischio, la razza nera è rimasta significativamente associata alla traiettoria dell’HbA1c. Allo stesso modo, l’aggiustamento per le caratteristiche demografiche, le variabili cliniche e la posizione socioeconomica non ha attenuato completamente l’associazione dell’etnia ispanica con la traiettoria HbA1c più alta, dove la sala operatoria è rimasta significativamente elevata, suggerendo un impatto residuo di disuguaglianza in questo gruppo. L’evidenza di una disparità nella traiettoria del controllo glicemico che esiste in particolare tra i pazienti maschi non bianchi e i giovani non bianchi con diagnosi di diabete in età precoce (≤9 anni) è coerente con i modelli precedentemente riportati nelle complicanze glicemiche acute che sono più comuni tra i pazienti più giovani e i pazienti maschi di tutte le età.47
Un risultato importante dell’analisi della traiettoria è stato che il sottogruppo di traiettoria HbA1c più alto ha mostrato anche il più alto livello medio di HbA1c al basale, che si è verificato ad una media (SD) di 9,8 (6,3) mesi dopo la diagnosi. Ciò suggerisce che il controllo glicemico ottenuto nel primo anno successivo alla diagnosi può conferire informazioni sulle tendenze longitudinali nel tempo. Inoltre, l’entità dell’iniquità razziale/etnica rispetto ai dati longitudinali è impressionante. Il gruppo 3 si è differenziato nel periodo di follow-up per fornire misure HbA1c medie molto diverse alla visita di coorte che possono tradursi in un aumento significativo del rischio di complicanze del diabete sulla base delle evidenze del Diabetes Control and Complications Trial (DCCT) e dell’Epidemiology of Diabetes Interventions and Complications Study (EDIC).1,2,3,48 La disparità nel controllo glicemico tra i gruppi di traiettoria nelle presenti analisi supera addirittura le differenze riportate tra i gruppi dello studio DCCT/EDIC (che ha confrontato un HbA1c mediano del 7% dell’emoglobina totale nel gruppo di trattamento insulinico intensivo con un HbA1c mediano del 9% dell’emoglobina totale nel gruppo convenzionale), suggerendo che tali stime di rischio possono essere prudenti per i giovani che devono inoltre affrontare un periodo più lungo di esposizione alla malattia.49
Studi precedenti hanno dimostrato che lo stato di migrazione dei genitori è associato al controllo glicemico tra i giovani con T1D.50 Per affrontare le potenziali differenze, abbiamo esaminato un sottoinsieme del campione con i dati sulla natività dei genitori (cioè, nati negli Stati Uniti vs. nati all’estero) e non abbiamo trovato differenze significative tra i gruppi di traiettoria HbA1c. L’aggiustamento per la natività dei genitori non ha attenuato l’associazione della razza nera o dell’etnia ispanica con il gruppo di traiettoria HbA1c moderato o più alto, anche se l’analisi è limitata dalle piccole dimensioni del campione (dati non mostrati). Le differenze nello stato di gioventù e di natività dei genitori giustificano probabilmente uno studio futuro in campioni adeguatamente alimentati.
Data la complessità dello studio dei risultati di razza e salute negli Stati Uniti, in cui i rischi per la salute associati alla razza/etnicità non sono intrinseci, ma possono invece segnalare le disuguaglianze sottostanti,51 riteniamo che i nostri risultati possano riflettere le disuguaglianze sanitarie nel T1D che opera a più livelli. I determinanti sociali della salute che operano al di fuori del sistema sanitario, compresi gli aspetti dell’ambiente fisico, la sicurezza alimentare, l’integrazione sociale, le barriere all’assistenza sanitaria,52 e modelli complessi nell’utilizzo dell’assistenza sanitaria,53,54 possono creare gruppi di individui basati sulla razza per i quali il controllo glicemico è messo in discussione da incoerenze nella disponibilità di risorse o supporto per la gestione del T1D. In generale, è stato dimostrato che le esperienze infantili avverse tra i giovani non bianchi si traducono in una miriade di postumi psicologici e medici più tardi nella vita.55
Ci possono essere anche aspetti modificabili all’interno del sistema sanitario, comprese le differenze razziali/etniche nelle dinamiche interpersonali delle interazioni tra pazienti o genitori e operatori sanitari che si verificano in contesti clinici pediatrici, che si estendono da pregiudizi e microaggressioni implicite a stereotipi, pregiudizi e macroaggressioni.56 I giovani non bianchi e le famiglie riferiscono di un evidente indebolimento della comunicazione tra pazienti e operatori sanitari e di una diminuzione del processo decisionale partecipativo.32,33 Il pregiudizio implicito, gli atteggiamenti inconsci che influenzano involontariamente il comportamento, possono influenzare le decisioni di gestione medica degli operatori sanitari56 e le percezioni sui neri, gli ispanici e i giovani di colore in termini di esperienza di malattia57 e la compliance del paziente.58 Livelli più elevati di pregiudizio o discriminazione percepiti sono stati collegati a una peggiore cura del diabete.59,60 L’effetto diretto del pregiudizio implicito sull’HbA1c non è stato ben studiato nel diabete pediatrico. Infine, mentre lo stigma sociale associato al T1D è noto,61,62,63 può essere più pronunciato in comunità specifiche in cui l’alfabetizzazione sanitaria e le risorse sono carenti o dove il T1D è significativamente meno comune del diabete di tipo 2. I giovani non bianchi possono lottare contro l’incomprensione e lo stigma che agiscono come fattori di stress cronici che indirettamente influenzano il controllo glicemico attraverso effetti psicosociali o comportamentali,64,65 con il risultato di strategie di auto-cura compromesse o di comportamenti disadattivi che danneggiano la salute.66
Limitazioni
Un limite dello studio è che l’iniquità osservata dopo l’aggiustamento per altri fattori può riflettere differenze razziali ed etniche nella validità dell’HbA1c come misura della glicemia media dovuta a differenze razziali nella glicazione dell’emoglobina o altri fattori che influenzano il turnover dei globuli rossi.67,68,69 Tuttavia, le differenze tra le gare che sono state segnalate sono piccole (0,4 punti percentuali in HbA1c69) rispetto alle differenze del presente studio, dove la media (SD) HbA1c del gruppo 3 era del 12,2% (1,5%) dell’emoglobina totale all’ultima visita, circa il 2,2% in più rispetto al gruppo 2 e il 4,4% in più rispetto al gruppo 1 in quel momento. La combinazione di individui di molte razze, etnie e culture in singole categorie per l’analisi può causare confusione residua e sottovalutare l’eterogeneità all’interno del gruppo. Siamo attenti ad evitare di sottintendere che tutti i giovani non bianchi abbiano uno scarso controllo; nei nostri dati, quasi un quarto dei giovani non bianchi aveva un HbA1c al 7,4% o meno dell’emoglobina totale alla visita di coorte (dati non mostrati). Molte delle variabili misurate alla linea di base possono cambiare nel tempo, compreso lo stato dell’assicurazione sanitaria. Le variabili di aggiustamento possono fornire informazioni per il lavoro futuro che approfondiranno le cause delle disuguaglianze. Ad esempio, le misure della posizione socioeconomica possono essere migliorate includendo altre misure come la capacità di pagare i farmaci, l’alfabetizzazione sanitaria, la sicurezza dell’alloggio o la sicurezza alimentare. In queste analisi non abbiamo controllato la dieta e l’attività fisica. Un campione più ampio può identificare ulteriori traiettorie che catturano l’esperienza di sottopopolazioni più piccole, come gli individui che inizialmente hanno un basso livello di HbA1c che si deteriora in seguito nel corso del T1D. L’esito del gruppo di traiettorie ha reso necessario l’uso di modelli di regressione logistica, che possono sopravvalutare le stime degli effetti, in particolare quando l’esito è comune.70,71 Infine, c’era un numero relativamente piccolo di partecipanti tra i gruppi nelle analisi stratificate per sesso ed età al momento della diagnosi. Sono necessari studi più ampi per esplorare ulteriormente le interazioni e identificare i giovani non bianchi che sono a più alto rischio di uno scarso controllo glicemico nel tempo. Infine, le associazioni di modelli di traiettoria basati su dati dovrebbero essere confermate con analisi future che quantifichino e confrontino le differenze di HbA1c longitudinale tra gruppi razziali/etnici.
Tuttavia, lo studio ha diversi punti di forza, tra cui l’ampia coorte multietnica ben caratterizzata;72 il periodo di follow-up esteso; e l’uso di un approccio analitico per caratterizzare più traiettorie comuni HbA1c comuni e capire le caratteristiche individuali associate da una vasta collezione di covariate.
Conclusioni
Rispetto ai giovani bianchi non ispanici con T1D, i giovani neri non ispanici, i giovani ispanici e i giovani con altre origini razziali/etniche che sono maschi e che hanno una diagnosi precoce nella vita hanno maggiori probabilità di mostrare un rapido deterioramento del controllo glicemico entro 9 anni dalla diagnosi di T1D. I risultati di questo studio possono essere utilizzati per informare le future ricerche sull’identificazione dei fattori che contribuiscono e rafforzano la disparità razziale ed etnica tra i giovani con T1D, in particolare i pazienti maschi non bianchi e i giovani non bianchi con diagnosi precoce.
References
- Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulin-dependent diabetes mellitus: Diabetes Control and Complications Trial. J Pediatr. 1994; 125(2)DOI | PubMed
- The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med. 1993; 329(14):977-986. DOI | PubMed
- Beneficial effects of intensive therapy of diabetes during adolescence: outcomes after the conclusion of the Diabetes Control and Complications Trial (DCCT). J Pediatr. 2001; 139(6):804-812. DOI | PubMed
- Challenges contributing to disrupted transition from paediatric to adult diabetes care in young adults with type 1 diabetes. Diabet Med. 2014; 31(12):1615-1624. DOI | PubMed
- Brief report: trajectories of glycemic control over early to middle adolescence. J Pediatr Psychol. 2010; 35(10):1161-1167. DOI | PubMed
- Identification and prediction of group-based glycemic control trajectories during the transition to adolescence. Health Psychol. 2014; 33(10):1143-1152. DOI | PubMed
- Insulin resistance during puberty: results from clamp studies in 357 children. Diabetes. 1999; 48(10):2039-2044. DOI | PubMed
- Insulin resistance in newly diagnosed type 1 diabetic children and adolescents [in Polish]. Med Wieku Rozwoj. 2003; 7(2):181-191. PubMed
- Adolescents with type 1 diabetes: parental perceptions of child health and family functioning and their relationship to adolescent metabolic control. Health Qual Life Outcomes. 2013; 11:50. DOI | PubMed
- Disclosure of psychosocial stressors affecting diabetes care among uninsured young adults with type 1 diabetes. Diabet Med. 2013; 30(9):1140-1144. DOI | PubMed
- Characterizing the transition from paediatric to adult care among emerging adults with type 1 diabetes. Diabet Med. 2013; 30(5):610-615. DOI | PubMed
- Barriers and facilitators associated with attendance at hospital diabetes clinics among young adults (15-30 years) with type 1 diabetes mellitus: a systematic review. Pediatr Diabetes. 2016; 17(7):509-518. DOI | PubMed
- Prevalence and correlates of depressed mood among youth with diabetes: the SEARCH for Diabetes in Youth study. Pediatrics. 2006; 117(4):1348-1358. DOI | PubMed
- Association of type 1 diabetes vs type 2 diabetes diagnosed during childhood and adolescence with complications during teenage years and young adulthood. JAMA. 2017; 317(8):825-835. PubMed
- The contribution of glycemic control to impaired growth during puberty in young people with type 1 diabetes and microalbuminuria. Pediatr Diabetes. 2014; 15(4):303-308. DOI | PubMed
- Mortality and incidence of renal replacement therapy in people with type 1 diabetes mellitus—a three decade long prospective observational study in the Lainz T1DM cohort. J Clin Endocrinol Metab. 2014; 99(12):4523-4530. DOI | PubMed
- Changes in glycaemic control and risk of coronary artery disease in type 1 diabetes mellitus: findings from the Pittsburgh Epidemiology of Diabetes Complications Study (EDC). Diabetologia. 2007; 50(11):2280-2288. DOI | PubMed
- Predictors of glycemic control in children with type 1 diabetes: the importance of race. J Diabetes Complications. 2000; 14(2):71-77. DOI | PubMed
- Glycemic control in youth with diabetes: the SEARCH for Diabetes in Youth study. J Pediatr. 2009; 155(5):668-72.e1, 3. DOI | PubMed
- Racial/ethnic minority youth with recent-onset type 1 diabetes have poor prognostic factors. Diabetes Care. 2018; 41(5):1017-1024. DOI | PubMed
- The prevalence of co-morbid depression in adults with type 1 diabetes: systematic literature review. Diabet Med. 2006; 23(4):445-448. DOI | PubMed
- Psychosocial burden and glycemic control during the first 6 years of diabetes: results from the SEARCH for Diabetes in Youth study. J Adolesc Health. 2014; 55(4):498-504. DOI | PubMed
- The PedsQL in type 1 and type 2 diabetes: reliability and validity of the Pediatric Quality of Life Inventory Generic Core Scales and type 1 Diabetes Module. Diabetes Care. 2003; 26(3):631-637. DOI | PubMed
- Health-related quality of life of children and adolescents with type 1 or type 2 diabetes mellitus: SEARCH for Diabetes in Youth study. Arch Pediatr Adolesc Med. 2008; 162(7):649-657. DOI | PubMed
- Diabetes in African American youth: prevalence, incidence, and clinical characteristics: the SEARCH for Diabetes in Youth study. Diabetes Care. 2009; 32(suppl 2):S112-S122. DOI | PubMed
- Relationship between glycemic control, ethnicity and socioeconomic status in Hispanic and white non-Hispanic youths with type 1 diabetes mellitus. Pediatr Diabetes. 2003; 4(1):19-23. DOI | PubMed
- Predictors of insulin regimens and impact on outcomes in youth with type 1 diabetes: the SEARCH for Diabetes in Youth study. J Pediatr. 2009; 155(2):183-9.e1. DOI | PubMed
- Racial-ethnic disparities in management and outcomes among children with type 1 diabetes. Pediatrics. 2015; 135(3):424-434. DOI | PubMed
- Disparity in glycemic control and adherence between African-American and Caucasian youths with diabetes: family and community contexts. Diabetes Care. 1997; 20(10):1569-1575. DOI | PubMed
- Disparities in social support systems for youths with type 1 diabetes. Clin Diabetes. 2015; 33(2):62-69. DOI | PubMed
- Impact of neighbourhood-level inequity on paediatric diabetes care. Diabet Med. 2017; 34(6):794-799. DOI | PubMed
- Technical report—racial and ethnic disparities in the health and health care of children. Pediatrics. 2010; 125(4):e979-e1020. DOI | PubMed
- Unequal treatment: confronting racial and ethnic disparities in health care. J Natl Med Assoc. 2002; 94(8):666-668. PubMed
- Longitudinal trajectories of metabolic control from childhood to young adulthood in type 1 diabetes from a large German/Austrian registry: a group-based modeling approach. Diabetes Care. 2017; 40(3):309-316. DOI | PubMed
- SEARCH for Diabetes in Youth: a multicenter study of the prevalence, incidence and classification of diabetes mellitus in youth. Control Clin Trials. 2004; 25(5):458-471. DOI | PubMed
- The SEARCH for Diabetes in Youth study: rationale, findings, and future directions. Diabetes Care. 2014; 37(12):3336-3344. DOI | PubMed
- CDC growth charts: United States. Adv Data. 2000; 314:1-27. PubMed
- United States Census 2000 population with bridged race categories. Vital Health Stat 2. 2003; 135:1-55. PubMed
- The many faces of diabetes in American youth: type 1 and type 2 diabetes in five race and ethnic populations: the SEARCH for Diabetes in Youth study. Diabetes Care. 2009; 32(suppl 2):S99-S101. DOI | PubMed
- A SAS procedure based on mixture models for estimating developmental trajectories. Sociol Methods Res. 2001; 29:374-393. DOI
- Group-based trajectory modeling in clinical research. Annu Rev Clin Psychol. 2010; 6:109-138. DOI | PubMed
- Group-based trajectory modeling (nearly) two decades later. J Quant Criminol. 2010; 26(4):445-453. DOI | PubMed
- Trajectory of body shape across the lifespan and cancer risk. Int J Cancer. 2016; 138(10):2383-2395. DOI | PubMed
- Analyzing developmental trajectories: a semiparametric, group-based approach. Psychol Methods. 1999; 4(2):139-157. DOI
- Social Determinants of Health and Well-Being Among Young People. Health Behaviour in School-aged Children (HBSC) Study: International Report From the 2009-2010 Survey. WHO Regional Office for Europe: Copenhagen, Denmark; 2012.
- Associations between socioeconomic status and major complications in type 1 diabetes: the Pittsburgh Epidemiology of Diabetes Complication (EDC) Study. Ann Epidemiol. 2011; 21(5):374-381. DOI | PubMed
- Predictors of acute complications in children with type 1 diabetes. JAMA. 2002; 287(19):2511-2518. DOI | PubMed
- The diabetes control and complications trial/epidemiology of diabetes interventions and complications study at 30 years: overview. Diabetes Care. 2014; 37(1):9-16. DOI | PubMed
- Intensive diabetes treatment and cardiovascular outcomes in type 1 diabetes: the DCCT/EDIC study 30-year follow-up. Diabetes Care. 2016; 39(5):686-693. DOI | PubMed
- Migration status in relation to clinical characteristics and barriers to care among youth with diabetes in the US. J Immigr Minor Health. 2012; 14(6):949-958. DOI | PubMed
- Race vs burden in understanding health equity. JAMA. 2017; 317(20):2133. DOI | PubMed
- Prevalence of and disparities in barriers to care experienced by youth with type 1 diabetes. J Pediatr. 2014; 164(6):1369-75.e1. DOI | PubMed
- Racial and ethnic differences in health care access and health outcomes for adults with type 2 diabetes. Diabetes Care. 2001; 24(3):454-459. DOI | PubMed
- Glycaemic control and diabetes care utilization in young adults with type 1 diabetes. Diabet Med. 2008; 25(8):968-973. DOI | PubMed
- Effects of adverse childhood experiences, stress, and social support on the health of college students. J Interpers Violence.DOI | PubMed
- Implicit racial/ethnic bias among health care professionals and its influence on health care outcomes: a systematic review. Am J Public Health. 2015; 105(12):e60-e76. DOI | PubMed
- The influence of implicit bias on treatment recommendations for 4 common pediatric conditions: pain, urinary tract infection, attention deficit hyperactivity disorder, and asthma. Am J Public Health. 2012; 102(5):988-995. DOI | PubMed
- Physician implicit attitudes and stereotypes about race and quality of medical care. Med Care. 2008; 46(7):678-685. DOI | PubMed
- Self-reported racial discrimination in health care and diabetes outcomes. Med Care. 2011; 49(7):618-625. DOI | PubMed
- The effects of perceived discrimination on diabetes management. J Health Care Poor Underserved. 2008; 19(1):149-163. DOI | PubMed
- Life with type 1 diabetes: views of Hispanic adolescents and their clinicians. Diabetes Educ. 2016; 42(4):408-417. DOI | PubMed
- Understanding diabetes and the role of psychology in its prevention and treatment. Am Psychol. 2016; 71(7):515-525. DOI | PubMed
- Type 1 diabetes stigma in China: a call to end the devaluation of individuals living with a manageable chronic disease. Diabetes Res Clin Pract. 2015; 107(2):306-307. DOI | PubMed
- Burden of psychosocial adversity and vulnerability in middle age: associations with biobehavioral risk factors and quality of life. Psychosom Med. 2003; 65(6):1029-1037. DOI | PubMed
- Carrots, Sticks and Sermons: Policy Instruments and Their Evaluation. Transaction Publishers: Piscataway, NJ; 2002.
- Stress, adaptation, and disease: allostasis and allostatic load. Ann N Y Acad Sci. 1998; 840(1):33-44. DOI | PubMed
- Racial and ethnic differences in the relationship between HbA1c and blood glucose: implications for the diagnosis of diabetes. J Clin Endocrinol Metab. 2012; 97(4):1067-1072. DOI | PubMed
- Variability in the relationship of hemoglobin A1c and average glucose concentrations: how much does race matter?. Ann Intern Med. 2017; 167(2):131-132. DOI | PubMed
- Racial differences in the relationship of glucose concentrations and hemoglobin A1c levels. Ann Intern Med. 2017; 167(2):95-102. DOI | PubMed
- Biased estimates of treatment effect in randomized experiments with nonlinear regressions and omitted covariates. Biometrika. 1984; 71(3):431-444. DOI
- A consequence of omitted covariates when estimating odds ratios. J Clin Epidemiol. 1991; 44(1):77-81. DOI | PubMed
- Prevalence of type 1 and type 2 diabetes among children and adolescents from 2001 to 2009. JAMA. 2014; 311(17):1778-1786. DOI | PubMed
- The influence of age, gender, insulin dose, BMI, and blood pressure on metabolic control in young patients with type 1 diabetes. Pediatr Diabetes. 2015; 16(8):581-586. DOI | PubMed
Fonte
Kahkoska AR, Shay CM, Crandell J, Dabelea D, Imperatore G, et al. (2018) Association of Race and Ethnicity With Glycemic Control and Hemoglobin A. JAMA Network Open 1(5): e181851. https://doi.org/10.1001/jamanetworkopen.2018.1851





