Abstract
Introduzione
Le malattie croniche, come la broncopneumopatia cronica ostruttiva (BPCO), sono una delle principali cause di morte e disabilità nei paesi ad alto reddito e di crescente importanza nei paesi a basso e medio reddito.1 A causa della loro elevata prevalenza e cronicità, l’attuale politica internazionale si concentra sulla necessità di supportare i pazienti nell’autogestione delle loro condizioni.2 La maggior parte degli interventi volti a sostenere l’autogestione sono stati rivolti a persone con malattie più gravi che sono probabilmente motivate a cambiare comportamento e dove vi sono maggiori opportunità di miglioramento dei sintomi. Tuttavia, gli sforzi più recenti hanno mirato a prevenire l’insorgenza o a rallentare la progressione all’inizio del decorso della malattia per ridurre l’onere e i costi del trattamento delle malattie più avanzate in un secondo momento. Questo modello di prevenzione è stato adottato solo di recente nella BPCO, con richieste di interventi per ridurre il rischio nelle persone con malattia precoce.3
Il numero crescente di persone a rischio di sviluppare condizioni a lungo termine e la prevalenza di malattie precoci, significa che è necessario adottare un approccio accessibile e a basso consumo di risorse per sostenere l’autogestione. Uno di questi approcci consiste nell’utilizzare un coaching telefonico interattivo per la salute, con il coach e il paziente che lavorano insieme per identificare le barriere al cambiamento dei comportamenti e trovare il modo di superarle. Le tecniche chiave includono la modellazione del comportamento, la definizione di obiettivi e la responsabilizzazione del paziente per migliorare il suo stato di salute.4 Il coaching telefonico sulla salute ha mostrato potenziali benefici sull’auto efficacia, sul comportamento sanitario e sullo stato di salute in una rapida revisione degli studi in condizioni a lungo termine.5
La BPCO è una patologia respiratoria comune con circa 65 milioni di persone in tutto il mondo con malattie moderate o gravi.1 Come la maggior parte delle malattie croniche, causa un notevole onere per i servizi sanitari e la società ed è una delle principali cause di morte nella maggior parte dei paesi.67 Gli interventi a sostegno dell’autogestione nei pazienti con BPCO si sono dimostrati efficaci nel migliorare la qualità della vita in ambito sanitario e nel ridurre i ricoveri ospedalieri tra i pazienti con BPCO,89 ma gli studi hanno in gran parte reclutato persone provenienti da cure secondarie ed escluso quelle con malattia lieve.9 Tuttavia, i pazienti con dispnea lieve rappresentano dal 38% al 54% dei pazienti diagnosticati in cure primarie.1011 Questa percentuale è destinata ad aumentare con le iniziative di ricerca di casi per identificare la malattia nelle persone con sintomi.12
Molte componenti degli interventi di autogestione potrebbero promuovere una migliore salute e prevenire la progressione della malattia nelle prime fasi della BPCO. Il fumo è una delle cause principali della BPCO e la cessazione del fumo si è dimostrata utile per mantenere una migliore funzionalità polmonare e per rallentare la progressione della malattia a tutti i livelli di gravità.1314La riduzione del livello di attività fisica è un fattore di rischio indipendente per le esacerbazioni, le degenze ospedaliere e la mortalità tra i soggetti affetti da BPCO e si verifica anche nelle prime fasi della malattia.151617I trattamenti inalatori hanno un’efficacia consolidata nel ridurre le esacerbazioni e i ricoveri tra i pazienti con BPCO moderata e grave, e una crescente evidenza di efficacia nel migliorare i risultati clinici e nel ridurre il declino della funzione polmonare tra i pazienti con compromissione più lieve.1819Qualsiasi intervento che migliori l’aderenza ai farmaci e la tecnica di utilizzo dell’inalatore, che è spesso scarsa,20 è quindi in grado di migliorare gli esiti per i pazienti. Il 60% dei pazienti con BPCO riferisce di esacerbazioni della loromalattia10 , associate a un più rapido declino della funzione polmonare.14 Gli interventi che mirano a ridurre la gravità delle esacerbazioni includono il riconoscimento precoce dei sintomi e l’uso rapido di antibiotici o corticosteroidi, o di entrambi, sia attraverso la ricerca di un appuntamento per le cure primarie, sia attraverso l’uso di un pacchetto di farmaci di salvataggio per l’autoterapia.
Abbiamo valutato il coaching sanitario telefonico in pazienti con BPCO lievemente sintomatica per esplorare l’efficacia del supporto alle attività di autogestione in questo gruppo di pazienti. Abbiamo ipotizzato che un intervento di coaching sanitario telefonico fornito da un’infermiera per sostenere l’autogestione, rispetto alle cure primarie abituali, avrebbe portato a un miglioramento della qualità della vita relativa alla BPCO a 12 mesi di follow-up e avrebbe migliorato l’attività fisica, la cessazione del fumo, i comportamenti di autogestione, la salute psicologica e l’efficacia di sé.
Metodi
Design
L’autogestione del paziente per la broncopneumopatia cronica ostruttiva (BPCO) è stato un pragmatico studio multicentrico di fase III randomizzato controllato (RCT) di un intervento di coaching sanitario telefonico a sostegno dell’autogestione rispetto alle cure abituali per le persone con BPCO con dispnea lieve. I dettagli del protocollo di studio sono stati pubblicati altrove.21 Abbiamo seguito le linee guida del CONSORT per la segnalazione degli RCT di trattamenti non farmacologici per riportare questo studio.22 Dopo la pubblicazione del protocollo nel registro degli studi clinici dell’ISRCTN nella fase di studio di fattibilità, abbiamo cambiato il criterio di inclusione per la spirometria post-broncodilatatoria da sotto il limite inferiore del volume espiratorio normale a quello del volume espiratorio forzato in un secondo/capacità vitale forzata <0,7, che è quello raccomandato dalla Global Initiative for Obstructive Lung Disease (GOLD).6 Abbiamo anche incluso alcune analisi di sottogruppo aggiuntive a quelle del protocollo pubblicato (volume espiratorio forzato di base in un secondo previsto (≥80 o <80) e grado di limitazione delle attività nel Questionario Respiratorio di San Giorgio (SGRQ-C)).21 Abbiamo inserito un sotto-studio che ha studiato il materiale di reclutamento dei partecipanti. In questo sottostudio, le pratiche generali sono state randomizzate per l’invio del foglio informativo standard per i partecipanti o di un foglio informativo per i partecipanti che conteneva un indirizzo web aggiuntivo e un codice Quick Response per dare accesso a materiali basati sul web, compresi i podcast sulla partecipazione alla ricerca in generale e allo studio di autogestione del paziente sulla BPCO in particolare.23 Questo non ha alterato nessun altro processo di sperimentazione.
Partecipanti
I partecipanti sono stati reclutati tra 71 pratiche generali in Inghilterra, situate a Birmingham e West Midlands South, Greater Manchester, West Midlands North e Oxfordshire o Gloucestershire. I pazienti di età superiore ai 18 anni sono stati identificati come idonei se erano nel registro della BPCO, quindi avevano sintomi respiratori coerenti con la BPCO; hanno riportato una lieve dispnea (MRC di grado 1 (solo senza fiato durante l’esercizio fisico intenso) o 2 (respiro corto solo quando si affrettavano su un terreno pianeggiante o su una leggera collina)) alla valutazione di base; avevano un volume espiratorio forzato in un secondo/capacità vitale forzata <0.7 dopo la spirometria post-broncodilatatore (coerente con le attuali linee guida del Regno Unito)24alla valutazione di base. Se c’era una controindicazione o se il paziente non era in grado di eseguire o ha rifiutato la spirometria, è stato utilizzato un risultato spirometrico riportato dall’ospedale negli ultimi 18 mesi. Ai medici è stato chiesto di escludere i pazienti che ritenevano inappropriati per lo studio (ad esempio, che avevano una malattia terminale o un grave disturbo psichiatrico). Ai pazienti idonei è stata inviata una lettera d’invito, un opuscolo informativo e un opuscolo informativo dal loro studio, con un foglio di risposta al team di ricerca che comprendeva la scala della dispnea MRC. I pazienti con MRC di grado 1 o 2 e quelli senza un punteggio di dispnea registrato sono stati invitati a partecipare.
Valutazione di base
I pazienti che hanno espresso interesse per lo studio sono stati telefonati da un ricercatore e invitati ad una valutazione di reclutamento presso il loro studio, effettuata da un’infermiera ricercatrice o da un ricercatore formato. Ai pazienti che hanno partecipato alle valutazioni di base è stata data l’opportunità di discutere lo studio. Dopo il consenso informato, è stata effettuata la spirometria post-broncodilatazione, sono stati misurati l’altezza e il peso e al paziente è stato chiesto di compilare un questionario di base. Questo pacchetto di questionari comprendeva domande sulla demografia del paziente e sulle misure per i risultati primari e secondari. Al polso non dominante è stato applicato un accelerometro GENEActiv, che è stato chiesto di restituire per posta in una busta prepagata dopo sette giorni di usura continua.
Intervento e cura abituale
Si è trattato di una prova pragmatica senza vincoli per la gestione dei medici dei partecipanti di entrambi i gruppi.
Il gruppo di cura abituale ha ricevuto un opuscolo informativo standard sull’autogestione della BPCO.25 L’opuscolo di 13 pagine dava una definizione della BPCO, una descrizione dettagliata dei sintomi associati, come la malattia può essere gestita con l’uso di inalatori, come trattare le esacerbazioni e dettagli su altre risorse (ad esempio, British Lung Foundation e NHS Smokefree).
L’intervento consisteva nell’assistenza sanitaria telefonica fornita da un’infermiera con documenti scritti a sostegno, un contapassi e un diario di autocontrollo. L’obiettivo era quello di sostenere l’autogestione in relazione alla cessazione del fumo, all’aumento dell’attività fisica, alla corretta tecnica di utilizzo degli inalatori e all’aderenza ai farmaci. Per coloro che soffrono di esacerbazioni ricorrenti, ha anche lo scopo di migliorare la fiducia del paziente nell’identificazione precoce di un’esacerbazione al fine di iniziare i farmaci di soccorso (ad esempio, antibiotici o steroidi).
La Teoria Cognitiva Sociale è stata alla base dell’intervento26 e ha incluso l’educazione, il monitoraggio e la valutazione dei progressi e ha insegnato le competenze con l’obiettivo di aumentare l’auto efficacia.2728Abbiamo incorporato le migliori prove per la promozione dell’attività fisica (supporto personalizzato e continuo, durata sei mesi, uso del contapassi).29303132I componenti dell’intervento sono descritti in dettaglio nell’appendice 1. La prima sessione di coaching telefonico a una settimana dalla randomizzazione mirava a durare 35-60 minuti (determinata dal numero di questioni che richiedono una discussione, come il fumo corrente), seguita da una sessione telefonica di 15-20 minuti alle settimane 3, 7 e 11 con materiale di supporto scritto su misura per il paziente dopo ogni telefonata (ad esempio, riassunto degli obiettivi concordati, diario dell’attività fisica, dettagli di contatto per i servizi locali, opuscolo informativo che mostra la corretta tecnica di utilizzo dell’inalatore). Gli infermieri hanno fornito istruzioni o informazioni scritte standard alle settimane 16 e 24.
Gli otto infermieri hanno partecipato a due giorni di formazione e si sono esercitati in sessioni di coaching telefonico con il team di ricerca. Gli infermieri hanno seguito un proforma per guidare la consultazione secondo il protocollo di consultazione telefonica. Gli infermieri hanno riassunto brevemente il contenuto della telefonata e le eventuali azioni concordate dopo ogni telefonata. Un campione di consulti telefonici è stato registrato con il consenso dei pazienti ed esaminato da un ricercatore per determinare la conformità con il contenuto dell’intervento.
Randomizzazione e mascheramento
I pazienti che avevano dato il consenso informato e completato tutte le misure di base sono stati randomizzati individualmente in un rapporto di 1:1 rispetto al coaching sanitario telefonico o al gruppo di cura abituale stratificato per centro. L’assegnazione è stata effettuata utilizzando un programma basato sul web ospitato dalla Primary Care Clinical Research and Trials Unit dell’Università di Birmingham. Le liste di randomizzazione specifiche del centro sono state prodotte da uno statistico presso l’unità di sperimentazione. I quattro centri di reclutamento sono stati Birmingham e West Midlands South, Greater Manchester, West Midlands North e Oxfordshire o Gloucestershire. Solo l’unità di ricerca clinica e di sperimentazione delle cure primarie aveva accesso alla sequenza di assegnazione. I pazienti sono stati informati della loro assegnazione alla fine dell’appuntamento di reclutamento; non sono stati mascherati per l’assegnazione del trattamento. I dati sono stati inseriti nel database dello studio da ricercatori dell’Università di Birmingham che sono stati mascherati per l’assegnazione del trattamento.
Valutazione dei risultati
Abbiamo misurato i risultati tramite questionario postale a sei mesi per determinare il cambiamento a breve termine alla fine dell’intervento e a 12 mesi per determinare se il cambiamento è stato sostenuto. A 12 mesi, gli accelerometri sono stati inviati ai partecipanti con una successiva telefonata per spiegare come iniziare la registrazione. È stato chiesto loro di indossare gli accelerometri ininterrottamente per sette giorni e poi di restituirli per posta. I non rispondenti hanno ricevuto una telefonata e hanno avuto la possibilità di compilare il questionario per telefono.
Risultati
La misura di outcome primaria importanza è stata la qualità della vita relativa alla salute a 12 mesi dalla randomizzazione misurata con l’SGRQ-C.33 I punteggi vanno da 0 a 100, con punteggi più alti che indicano una maggiore compromissione della qualità della vita.
Gli esiti secondari sono stati la scala della dispnea MRC,34 l’attività fisica riferita all’attività fisica (utilizzando il questionario internazionale sull’attività fisica),35 la morbilità psicologica (utilizzando la scala dell’ansia e della depressione ospedaliera),36 l’auto-efficacia per la gestione della BPCO e l’attività fisica (utilizzando la scala di auto-efficacia di Stanford),28 e l’utilità dello stato di salute (utilizzando i livelli EuroQoL 5 Dimensioni 5 Livelli)37 a sei e 12 mesi dalla randomizzazione. Anche la qualità della vita relativa alla salute a sei mesi dalla randomizzazione misurata con l’SGRQ-C è stata un risultato secondario. I tassi di cessazione del fumo e l’attività fisica misurati con gli accelerometri GENEActiv sono stati valutati a 12 mesi. Gli esiti esplorativi predefiniti sono stati le attività di autogestione (relative alla cessazione del fumo, all’aderenza ai farmaci, ai piani di cura, ecc.) riportate dai pazienti e all’uso sanitario a sei e 12 mesi. È stata intrapresa anche una valutazione economica, ma sarà riportata altrove.
Gli eventi avversi sono stati segnalati dai partecipanti all’intervento durante le telefonate e dai questionari di follow-up a sei e 12 mesi; sono stati valutati in modo indipendente da due medici indipendenti.
Giustificazione statistica della dimensione del campione
La dimensione del campione è stata determinata per rilevare una differenza nell’SGRQ-C a 12 mesi. Per avere l’80% di potenza per rilevare una differenza di quattro punti (la minima differenza clinicamente significativa)38 da un valore di base del punteggio totale di 39,39 con una deviazione standard di 15 al livello di significatività del 5%, sono stati richiesti i dati di 445 pazienti. Consentendo un tasso di logoramento del 20% a 12 mesi, abbiamo avuto bisogno di 556 partecipanti (278 per ogni gruppo).
Il potere di rilevare le differenze nell’attività fisica autodenunciata e nei tassi di smettere di fumare è descritto in dettaglio nel documento di protocollo.21
Analisi
Tutti i dati sono stati analizzati in base all’intenzione di trattare. Le analisi principali hanno confrontato le misure di esito primario e secondario tra i gruppi di trattamento a 12 mesi dalla randomizzazione per valutare l’effetto a lungo termine dell’intervento di autogestione. I dati sono stati analizzati anche a sei mesi per valutare il cambiamento a breve termine.
L’esito primario e altre misure di esito secondario continuo sono state analizzate utilizzando un modello di regressione lineare. Le misure di outcome secondarie di tipo categorico ordinato (ad esempio, la scala della dispnea MRC) sono state analizzate utilizzando un modello di regressione logistica ordinata. Tutte le analisi primarie e secondarie sono state adeguate ai valori di base e al centro. Le differenze tra i gruppi di trattamento sono state riassunte utilizzando stime di effetto adeguate (ad esempio, differenza media e odds ratio) con intervalli di confidenza del 95%. Abbiamo utilizzato un livello di significatività statistica del 5%.
Le misure di esito esplorativo non sono state analizzate utilizzando modelli statistici, ad eccezione dei dati di conteggio. Le misure di esito binarie o categoriche sono state analizzate utilizzando χ 2o il test esatto di Fisher e le misure continue sono state analizzate utilizzando test t o un equivalente non parametrico (ad esempio, test di Wilcoxon rank). Le misure di conteggio sono state analizzate utilizzando un modello di regressione di Poisson o un modello binomiale negativo, come appropriato per ottenere un rapporto di tasso di incidenza. I modelli includevano un aggiustamento per i valori di base e il centro e un termine di offset per la lunghezza del follow-up.
Sono state effettuate diverse analisi di sensibilità per l’SGRQ-C. In primo luogo, un’analisi per protocollo che comprendeva solo i pazienti che ricevevano tutte e quattro le telefonate nel gruppo di intervento ed escludeva l’unico paziente del gruppo di cura abituale che riceveva l’intervento per errore. In secondo luogo, un’analisi per valutare l’effetto dei dati mancanti, con pazienti con punteggi SGRQ-C di 12 mesi mancanti simulati mediante imputazione di regressione utilizzando i dati di base, con il punteggio di base, l’età, il sesso, il punteggio MRC e il gruppo di trattamento utilizzati come predittori per imputare i punteggi mancanti. Tutti i partecipanti sono stati inclusi in questa analisi a meno che non fossero morti entro 12 mesi o che non mancassero entrambi i punteggi di base e i punteggi SGRQ-C a 12 mesi. Infine, un’analisi che ha escluso i partecipanti in cui i questionari SGRQ-C a 12 mesi sono stati restituiti in anticipo (>1 mese prima della data di scadenza della valutazione) o in ritardo (>65 giorni dopo la data di scadenza della valutazione).
Sono state effettuate analisi di sottogruppo per esplorare gli effetti dell’intervento in diversi sottogruppi di pazienti per l’esito primario. I sottogruppi, prespecificati nel piano di analisi statistica, includevano le caratteristiche dei partecipanti (età, sesso, etnia, condizione di fumo, punteggio di base della dispnea MRC e numero di comorbidità), i partecipanti attivi all’intervento (attraverso l’aumento dell’attività fisica, l’assorbimento del supporto per la cessazione del fumo), o il controllo della tecnica di utilizzo dell’inalatore), il livello di base dell’attività fisica (sia dal questionario internazionale sull’attività fisica che dai dati dell’accelerometro), la qualità della vita relativa alla salute (SGRQ-C), l’auto-efficacia di base (Stanford) e la depressione e l’ansia di base (dalla scala dell’ansia e della depressione dell’ospedale). Due sottogruppi di analisi post hoc sono stati effettuati anche per il volume espiratorio forzato di base in un secondo previsto (≥80 o <80) e il grado di limitazione delle attività nell’SGRQ-C. Nel modello di regressione lineare è stato incluso un parametro di interazione gruppo di trattamento per sottogruppo per valutare se ci fossero differenze nell’effetto del trattamento tra i diversi strati. Le differenze tra i gruppi di trattamento all’interno dei sottogruppi sono state esaminate solo se i parametri di interazione erano statisticamente significativi (P<0,05).
I dettagli delle analisi dell’accelerometria e i dati disponibili dell’accelerometria sono forniti nell’appendice 2 del web.
Coinvolgimento del paziente
Lo studio è stato sostenuto da un gruppo di consulenza per i pazienti affetti da BPCO che ha fornito un contributo ad un programma di ricerca sulla BPCO. Il gruppo si è riunito regolarmente ed è stato membro del gruppo di gestione dello studio per tutta la durata dello studio. Il gruppo ha commentato il progetto iniziale dello studio, l’onere del processo di valutazione dello studio, i materiali dei partecipanti e il contenuto e il materiale a supporto dell’intervento. Inoltre, il gruppo direttivo di prova aveva un membro laico. Alla fine dello studio, il gruppo ha commentato i risultati e ha contribuito al piano di divulgazione.
Risultati
Abbiamo inviato un questionario di screening e un volantino d’invito a 5279 persone sui registri della BPCO di 71 pratiche generali; 2066 hanno risposto con interesse allo studio, ma 920 sono stati esclusi in quanto avevano un punteggio della scala di dispnea MRC di 3 o più. La Figura 1 mostra che abbiamo esaminato 728 persone nel loro studio tra il 18 marzo 2014 e il 5 febbraio 2015; 577 erano eleggibili e randomizzate per il coaching sanitario telefonico (n=289) o per le cure abituali (n=288). In totale, 531 (92%) dei partecipanti hanno fornito dati a sei mesi e 516 (89%) a 12 mesi di follow-up. C’è stato uno squilibrio nei tassi di follow-up tra i gruppi a 12 mesi tra il coaching sanitario telefonico (82,7%; 37 ritiri) e l’assistenza abituale (96,2%; 7 ritiri), in gran parte dovuto al fatto che i pazienti che volevano ritirarsi dal coaching sanitario telefonico si sono ritirati anche da un ulteriore follow-up. Dei 37 pazienti che si sono ritirati dal gruppo di coaching sanitario telefonico, quattro si sono ritirati prima di ricevere qualsiasi intervento e 16 si sono ritirati durante l’intervento; otto hanno citato la malattia e 10 hanno citato fattori correlati all’intervento che vanno da un livello troppo impegnativo a uno insufficiente. Diciassette partecipanti si sono ritirati dopo il follow-up di sei mesi. I pazienti che si sono ritirati dallo studio non differivano per le caratteristiche del campione completo.
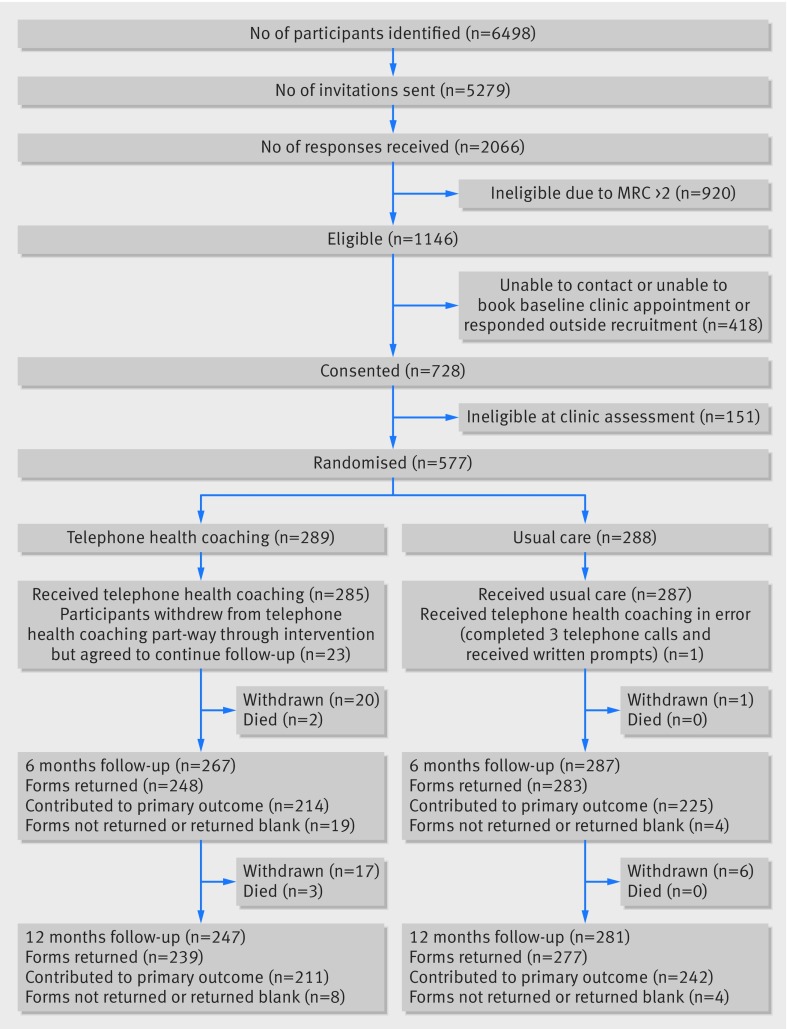
Fig. 1.Diagramma di flusso dello studio
Latabella 1 mostra le caratteristiche del paziente. I partecipanti erano prevalentemente bianchi; il 63% erano maschi; l’età media era di 70,4 anni; il 23% erano fumatori attuali e solo il 19% aveva un lavoro retribuito. I partecipanti avevano una malattia lieve: il FEV1 medio era del 71,6% previsto, 193 (33%) erano GOLD stadio 1 e 309 (54%) GOLD stadio 2; 165 (28,6%) hanno riportato dispnea di livello I MRC e 270 (47%) hanno riportato farmaci per un’esacerbazione nei 12 mesi precedenti. Il punteggio totale medio di SGRQ-C è stato del 28,7. I gruppi di studio sono stati generalmente ben bilanciati in termini di caratteristiche del paziente, anche se c’è stata una percentuale più alta di fumatori attuali nel gruppo di coaching sanitario telefonico. Il gruppo di cura abituale ha riportato un livello più elevato di auto-attività fisica moderata e vigorosa, ma questo non si è riflesso nei dati di accelerometria al basale. I dati di accelerometria per tutti i partecipanti hanno mostrato che i partecipanti hanno fatto una mediana di 31 minuti di attività moderata o vigorosa in attacchi di almeno 10 minuti al giorno (intervallo interquartile 0-160). I partecipanti che non hanno fornito dati a 12 mesi avevano più probabilità di trovarsi nella fase 3 di GOLD, di essere fumatori, di avere livelli di auto-attività fisica più bassi e di vivere da soli rispetto ai rispondenti.
| Caratteristica | Allenamento telefonico per la salute(n=289) | Cura abituale(n=288) |
|---|---|---|
| Età media (SD) (anni) | 70.7 (8.8) | 70.2 (7.8) |
| Età ≥65 anni | 221 (76) | 231 (80) |
| Uomini | 183 (63) | 183 (64) |
| Razza bianca | 283 (98) | 284 (99) |
| Età media (fascia interquartile) al completamento dell’istruzione a tempo pieno (anni)*. | 15 (15-16) | 15 (15-16) |
| Il più alto livello di qualificazione: | ||
| Nessuna qualifica formale | 128 (44) | 135 (47) |
| GCSE, CSE, O Livello equivalente | 58 (20) | 63 (22) |
| Livello A, livello AS o equivalente | 27 (9) | 24 (8) |
| Livello di grado o superiore | 35 (12) | 41 (14) |
| Altro | 40 (14) | 23 (8) |
| Mancanza | 1 (<1) | 2 (1) |
| Vive da solo | 83 (29) | 69 (24) |
| Stato di occupazione†: | ||
| Lavoro retribuito | 58 (20) | 53 (18) |
| Disoccupati o in cerca di lavoro | 3 (1) | 5 (2) |
| Pensionato dal lavoro retribuito | 216 (75) | 214 (74) |
| Per chi cerca la famiglia o la casa | 8 (3) | 9 (3) |
| Incapace di lavorare a causa di problemi di salute | 8 (3) | 7 (2) |
| Altro | 5 (2) | 9 (3) |
| Caratteristiche cliniche | ||
| Fumatore corrente | 75 (26) | 55 (19) |
| Indice di massa corporea media (SD) (kg/m2) | 27.1 (4.4) | 27.4 (4.9) |
| Punteggio della scala di dispnea MRC: | ||
| 1 | 89 (31) | 76 (26) |
| 2 | 200 (69) | 212 (74) |
| Media (SD) FEV1 prevista (%) | 71.2 (18.9) | 72.1 (18.7) |
| FEV1 previsto (%): | ||
| <30 | 1 (<1) | 2 (1) |
| 30-49 | 39 (13) | 33 (11) |
| 50-79 | 160 (55) | 149 (52) |
| ≥80 | 89 (31) | 104 (36) |
| Comorbidità: | ||
| Cancro | 34 (12) | 37 (13) |
| Il diabete | 32 (11) | 36 (13) |
| Alta pressione sanguigna | 135 (47) | 123 (43) |
| Malattia cardiaca coronarica | 34 (12) | 44 (15) |
| Insufficienza cardiaca | 15 (5) | 10 (3) |
| Corsa o mini-corsa | 16 (6) | 25 (9) |
| Asma | 98 (34) | 100 (35) |
| Tubercolosi | 6 (2) | 10 (3) |
| Osteoartrite | 46 (16) | 56 (19) |
| Artrite reumatoide | 22 (8) | 25 (9) |
| Osteoporosi | 13 (5) | 20 (7) |
| Depressione | 44 (15) | 57 (20) |
| Altra condizione | 37 (13) | 52 (18) |
| Farmaci assunti regolarmente per problemi polmonari: | ||
| Beta-2 agonista | 201 (70) | 197 (68) |
| Steroidi inalati | 27 (9) | 39 (14) |
| Arovent o Spiriva | 109 (38) | 117 (41) |
| Seretide | 88 (30) | 92 (32) |
| Symbicort | 33 (11) | 21 (7) |
| Teofillina o compresse di aminofillina | 7 (2) | 6 (2) |
| Compresse steroidi | 5 (2) | 9 (3) |
| Corso di antibiotici o steroidi, o entrambi, negli ultimi 12 mesi | 135 (47) | 135 (47) |
| Qualità della vita legata alla salute | ||
| Media (SD) Punteggio totale SGRQ-C | 27.8 (14.6) | 29.5 (14.5) |
| Punteggio medio (SD) dei sintomi SGRQ-C | 48.5 (21.7) | 47.9 (20.7) |
| Media (SD) Punteggio di attività SGRQ-C | 36.3 (21.0) | 38.7 (21.3) |
| Media (SD) Punteggio di impatto SGRQ-C | 15.4 (13.4) | 17.6 (13.9) |
| Media (SD) EuroQoL 5 Dimensioni 5 Punteggio dei livelli | 0.90 (0.13) | 0.89 (0.13) |
| Ansia e depressione‡ | ||
| Punteggio medio (SD) della scala dell’ansia | 3.8 (3.4) | 4.3 (3.8) |
| Punteggio medio (SD) della scala della depressione | 2.9 (2.6) | 3.1 (2.8) |
| Attività fisica | ||
| Minuti medi (SD) di MVPA/settimana per accelerometria | 372.1 (305.1) | 379.1 (282.9) |
| Media (SD) moderata MET minuti/settimana§ | 766.4 (1253.9) | 941.5 (1437.6) |
| Media (SD) minuti MET medio/settimana vigorosa§ | 809.4 (1771.5) | 910.2 (1997.4) |
| Autoefficacia | ||
| Punteggio medio (SD) dell’auto-efficacia di Stanford | 8.3 (1.6) | 8.0 (1.7) |

Fig. 1.Diagramma di flusso dello studio
Consegna dell’intervento
La dose e la copertura dell’intervento è stata elevata: l’86,4% (999/1156) delle chiamate programmate è stato consegnato e il 75,4% (218/289) dei partecipanti ha ricevuto tutte e quattro le chiamate. La durata media delle chiamate è stata di 39,2 minuti (SD 10,7) per la prima chiamata, poi 23,8 (9,2), 21,4 (8,6) e 20,6 minuti (8,7) rispettivamente per la seconda, terza e ultima chiamata. Le infermiere hanno brevemente annotato il contenuto e la durata di ogni sessione di coaching sanitario telefonico. La maggior parte dei pazienti ha parlato con la stessa infermiera per tutte e quattro le chiamate, anche se a volte ciò non è stato possibile a causa della malattia o del congedo. Il fumo è stato discusso nel 33% delle sessioni, l’attività fisica in oltre il 99%, la tecnica di utilizzo degli inalatori nel 90% e la pianificazione delle azioni nell’88% di tutte le chiamate. Obiettivi SMART (specifici, misurabili, raggiungibili, rilevanti e vincolati al tempo) sono stati fissati nel 57% delle chiamate per l’attività fisica, nell’11% per la cessazione del fumo e nel 9% per la verifica della tecnica di utilizzo dell’inalatore.
Risultato primario
A 12 mesi, non c’è stata alcuna differenza significativa nel punteggio totale di SGRQ-C (differenza media -1,3, intervallo di confidenza del 95% -3,6 a 0,9, P=0,23), anche se la direzione ha favorito il gruppo di intervento. La differenza media nel punteggio di attività SGRQ-C è stata di significato limite, favorendo il gruppo di intervento (-3.2, da -6.3 a 0.0, P=0.05). La tabella 2 mostra che non c’è stata alcuna differenza significativa tra i gruppi per i sintomi SGRQ-C o per i punteggi di impatto.
| Caratteristica | Linea di base | 6 mesi | 12 mesi | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allenamento telefonico per la salute | Cura abituale | Allenamento telefonico per la salute | Cura abituale | Differenza media (95% CI) | Valore P | Allenamento telefonico per la salute | Cura abituale | Differenza media (95% CI) | Valore P | |||||||||
| No | Media (SD) | No | Media (SD) | No | Media (SD) | No | Media (SD) | No | Media (SD) | No | Media (SD) | |||||||
| Qualità della vita legata alla salute | ||||||||||||||||||
| SGRQ-C totale* | 277 | 27.8 (14.6) | 272 | 29.5 (14.5) | 222 | 28.6 (17.1) | 237 | 30.5 (16.7) | -0,3(da -2,3 a 1,7) | 0.76 | 217 | 27.9 (15.7) | 256 | 30.9 (17.0) | -1,3(-3,6 a 0,9) | 0.23 | ||
| Sintomo SGRQ-C* | 284 | 48.5 (21.7) | 279 | 47.9 (20.7) | 241 | 49.5 (22.6) | 266 | 49.2 (21.4) | -0,04 (da -2,9 a 2,8) | 0.98 | 230 | 49.3 (21.4) | 273 | 50.1 (22.6) | -1,9(-4,9 a 1,1) | 0.22 | ||
| Attività SGRQ-C* | 281 | 36.3 (21.0) | 279 | 38.7 (21.3) | 229 | 36.0 (22.7) | 252 | 37.9 (23.9) | 0,4(da -2,3 a 3,2) | 0.75 | 224 | 33.7 (21.1) | 260 | 39.2 (24.4) | -3,2(-6,3 a 0,0) | 0.05 | ||
| Impatto SGRQ-C* | 286 | 15.4 (13.4) | 280 | 17.6 (13.9) | 233 | 16.9 (16.3) | 255 | 19.0 (15.5) | -0,7(da -2,8 a 1,4) | 0.52 | 225 | 16.5 (15.2) | 261 | 19.3 (15.6) | -1,1(-3,3 a 1,1) | 0.33 | ||
| EQ-5D-5L† | 285 | 0.90 (0.13) | 280 | 0.89 (0.13) | 244 | 0.88 (0.16) | 272 | 0.87 (0.14) | 0,01(-0,01 a 0,03) | 0.30 | 235 | 0.87 (0.14) | 270 | 0.86 (0.17) | 0,01(-0,01 a 0,03) | 0.38 | ||
| Ansia e depressione | ||||||||||||||||||
| HADS punteggio della scala di valutazione dell’ansia* | 286 | 3.8 (3.4) | 285 | 4.3 (3.8) | 243 | 3.8 (3.8) | 279 | 4.5 (4.0) | -0,3(da -0,8 a 0,2) | 0.21 | 227 | 4.0 (3.8) | 267 | 4.7 (4.0) | -0,06(da -0,6 a 0,4) | 0.81 | ||
| Punteggio della scala di depressione HADS* | 287 | 2.9 (2.6) | 285 | 3.1 (2.8) | 244 | 3.1 (3.0) | 279 | 3.5 (3.1) | -0,2(da -0,6 a 0,1) | 0.21 | 228 | 3.3 (3.3) | 270 | 3.8 (3.4) | -0,1(da -0,6 a 0,4) | 0.63 | ||
| Autoefficacia | ||||||||||||||||||
| Punteggio di autoefficacia di Stanford† | 287 | 8.3 (1.6) | 284 | 8.0 (1.7) | 247 | 8.1 (1.7) | 275 | 7.8 (1.8) | 0,2 (da -0,07 a 0,4) | 0.16 | 228 | 8.1 (1.6) | 272 | 7.7 (1.8) | 0,1(-0,1 a 0,4) | 0.32 | ||
| Attività fisica (accelerometria) | ||||||||||||||||||
| MVPA minuti/settimana† | 263 | 372.1 (305.1) | 259 | 379.1 (282.9) | NA | NA | NA | NA | NA | NA | 179 | 346.5 (276.6) | 232 | 315.5 (256.1) | 11,8(-21,1 a 44,8) | 0.48 | ||
| Attività fisica (Questionario internazionale di attività fisica) | ||||||||||||||||||
| Totale minuti MET/settimana† | 230 | 3242.2 (3284.2) | 236 | 3265.8 (3480.6) | 202 | 3786.0 (3685.7) | 237 | 2920.6 (3195.0) | 924,7(318,3 a 1531,1) | 0.003 | 191 | 3214.3 (3578.4) | 223 | 2738.1 (3249.9) | 410,0(-235,7 a 1055,7) | 0.21 | ||
| Camminare in MET minuti/settimana† | 249 | 1496.0 (1324.6) | 253 | 1371.0 (1249.0) | 216 | 1728.8 (1390.6) | 248 | 1404.2 (1244.0) | 283,4(55,2 a 511,6) | 0.02 | 200 | 1588.5 (1386.7) | 234 | 1362.7 (1318.2) | 161,5 (da -86,2 a 409,3) | 0.20 | ||
| Moderato MET minuti/settimana† | 267 | 766.4 (1253.9) | 265 | 941.5 (1437.6) | 236 | 950.8 (1399.7) | 268 | 732.9 (1208.2) | 233,9 (da 10,6 a 457,1) | 0.04 | 218 | 765.9 (1256.4) | 261 | 628.6 (1164.8) | 130,1 (da -83,9 a 344,0) | 0.23 | ||
| Vigoroso MET minuti/settimana† | 271 | 809.4 (1771.5) | 282 | 910.2 (1997.4) | 229 | 1050.5 (2212.7) | 270 | 728.7 (1656.6) | 335,8 (23,2 a 648,4) | 0.04 | 218 | 864.4 (1994.3) | 264 | 705.3 (1674.0) | 160,1(-141,1 a 461,3) | 0.30 | ||
Risultati secondari
Latabella 2 mostra che a sei mesi non ci sono differenze significative tra il totale e i subcores della SGRQ-C. A sei e 12 mesi, non c’erano differenze anche nella scala EuroQoL 5 Dimensioni 5 Livelli, Scala ansia e depressione ospedaliera, scala di auto-efficacia di Stanford, o livello di dispnea (MRC, tabella 3). A sei mesi, l’attività fisica totale di autostima, la deambulazione, l’attività di intensità moderata e vigorosa erano tutti significativamente più elevati nel braccio di intervento(tabella 2). Le differenze hanno favorito il braccio d’intervento a 12 mesi, ma non sono rimaste statisticamente significative. Non c’è stata alcuna differenza nell’attività moderata o vigorosa misurata con l’accelerometria a 12 mesi. Non c’è stata inoltre alcuna differenza nei tassi di cessazione del fumo a sei e 12 mesi(tabella 3).
| Caratteristica | Linea di base | 6 mesi | 12 mesi | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allenamento telefonico per la salute | Cura abituale | Allenamento telefonico per la salute | Cura abituale | Quoziente di probabilità (95% CI)* | Valore P | Allenamento telefonico per la salute | Cura abituale | Quoziente di probabilità (95% CI)* | Valore P | |||
| Punteggio della scala della dispnea MRC: | 0,8 (da 0,6 a 1,2) | 0.39 | 1,1 (da 0,7 a 1,5) | 0.79 | ||||||||
| 1 | 89 (31) | 76 (26) | 77 (32) | 84 (32) | 69 (31) | 74 (28) | ||||||
| 2 | 200 (69) | 212 (74) | 137 (58) | 158 (60) | 137 (61) | 163 (61) | ||||||
| 3 | NA | NA | 14 (6) | 18 (7) | 16 (7) | 27 (10) | ||||||
| 4 | NA | NA | 8 (3) | 5 (2) | 4 (2) | 5 (2) | ||||||
| 5 | NA | NA | 1 (<1) | 0 (NA) | 0 (NA) | 0 (NA) | ||||||
| Smettere di fumare† | 75 (26) | 55 (19) | 14 (22) | 9 (18) | NA | 0.60 | 7 (13) | 13 (25) | NA | 0.11 | ||
Utilizzo in ambito sanitario
A sei mesi, i partecipanti all’intervento hanno segnalato consultazioni mediche e farmacologiche inferiori, ma superiori a tutte le visite al pronto soccorso. A 12 mesi non ci sono state differenze(tabella 4). A sei e 12 mesi, a 106 (43%) e 89 (37%) del gruppo di intervento era stato prescritto rispettivamente almeno un ciclo di antibiotici rispetto a 105 (37%) e 96 (35%) del gruppo di cura abituale (dati non riportati).
| Caratteristica | Linea di base | 6 mesi | 12 mesi | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allenamento telefonico per la salute | Cura abituale | Allenamento telefonico per la salute | Cura abituale | Rapporto di incidenza* (95% CI) | Valore P† | Allenamento telefonico per la salute | Cura abituale | Rapporto di incidenza* (95% CI) | Valore P† | |||||||||
| No | Media (SD) | No | Media (SD) | No | Media (SD) | No | Media (SD) | No | Media (SD) | No | Media (SD) | |||||||
| Ricoveri in ospedale | ||||||||||||||||||
| Tutte le cause | 277 | 0.11 (0.4) | 281 | 0.12 (0.4) | 248 | 0.07 (0.3) | 283 | 0.08 (0.3) | 0,86 (0,45 a 1,62) | 0.64 | 239 | 0.06 (0.3) | 277 | 0.06 (0.3) | 0,90‡(0, 39 a 2,09) | 0.81 | ||
| Respiratorio | 281 | 0.02 (0.2) | 283 | 0.02 (0.1) | 248 | 0.02 (0.1) | 283 | 0.03 (0.2) | 0,55‡(0, 15 a 2,07) | 0.38 | 239 | 0.01 (0.1) | 277 | 0.01 (0.1) | 0,56‡(0, 08 a 4,11) | 0.57 | ||
| Reparto di emergenza | ||||||||||||||||||
| Tutte le cause | 286 | 0.22 (0.5) | 280 | 0.23 (0.6) | 248 | 0.33 (1.8) | 283 | 0.16 (0.5) | 1,87‡(1, 06 a 3,27) | 0.03 | 238 | 0.26 (0.8) | 276 | 0.23 (0.7) | 1,06‡( da 0, 62 a 1,83) | 0.82 | ||
| Respiratorio | 286 | 0.04 (0.2) | 282 | 0.02 (0.1) | 248 | 0.04 (0.2) | 283 | 0.03 (0.2) | 1,48‡( da 0, 50 a 4,43) | 0.48 | 239 | 0.04 (0.2) | 277 | 0.01 (0.1) | 2,85‡(0, 67 a 12,20) | 0.16 | ||
| Consulenze per l’assistenza primaria | ||||||||||||||||||
| Tutte cause: | ||||||||||||||||||
| Dottore… | 288 | 1.18 (1.7) | 285 | 1.23 (1.5) | 243 | 1.41 (1.5) | 282 | 1.76 (2.2) | 0,80‡(0, 66 a 0,96) | 0.02 | 236 | 1.45 (1.8) | 272 | 1.67 (1.8) | 0,85‡(0, 70 a 1,03) | 0.09 | ||
| Infermiera | 288 | 0.60 (1.8) | 285 | 0.65 (1.4) | 243 | 0.71 (1.5) | 282 | 0.72 (1.4) | 0,98‡(0, 73 a 1,31) | 0.88 | 234 | 0.56 (1.0) | 272 | 0.67 (1.0) | 0,81‡(0, 62 a 1,07) | 0.14 | ||
| Farmacista | 288 | 0.10 (0.9) | 285 | 0.13 (0.6) | 243 | 0.05 (0.4) | 282 | 0.17 (0.8) | 0,27‡(0, 10 a 0,75) | 0.01 | 233 | 0.10 (0.6) | 268 | 0.11 (0.5) | 0,75‡(0, 29 a 1,91) | 0.54 | ||
| Respiratorio | 186 | 0.63 (0.9) | 190 | 0.84 (1.1) | 164 | 0.90 (1.1) | 197 | 0.96 (1.3) | 0,99‡(0, 72 a 1,35) | 0.93 | 132 | 0.77 (1.0) | 167 | 0.83 (1.2) | 0,84‡(0, 60 a 1,19) | 0.34 | ||
Attività mirate con il coaching sanitario telefonico
L’attività fisica e i tassi di cessazione del fumo sono stati descritti in precedenza. Non c’è stata alcuna differenza tra i gruppi nei tentativi di smettere di fumare nei sei mesi precedenti o la partecipazione ai servizi di disassuefazione dal fumo in uno dei due punti successivi. A sei mesi, i partecipanti al gruppo di intervento hanno riferito di aver migliorato l’aderenza ai farmaci, con percentuali significativamente più alte con un controllo inalatorio negli ultimi sei mesi (68% v 55%), un piano di assistenza concordato con un operatore sanitario (44% v 30%), consigli scritti su cosa fare in caso di peggioramento dei sintomi (23% v 17%) e un pacchetto di salvataggio antibiotico (37% v 29%). Tuttavia, non hanno segnalato un miglioramento della fiducia nell’uso dei pacchetti di salvataggio. La tabella 5 mostra che molti di questi miglioramenti sono stati sostenuti a 12 mesi.
| Variabili | Linea di base | 6 mesi | 12 mesi | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allenamento telefonico per la salute | Cura abituale | Allenamento telefonico per la salute | Cura abituale | Valore P | Allenamento telefonico per la salute | Cura abituale | Valore P | |||
| Tentativo di smettere di fumare negli ultimi 6 mesi | NA | NA | 29 (54) | 21 (49) | 0.72 | 30 (58) | 21 (53) | 0.55 | ||
| Presenza al servizio di disassuefazione dal fumo* | NA | NA | 3 (10) | 1 (5) | 0.63 | 3 (10) | 4 (19) | 0.43 | ||
| Punteggio medio (IQR, n) di aderenza ai farmaci† | 1 (0-2, 273) | 1 (0-2, 265) | 1 (0-2, 219) | 1 (0-2, 255) | 0.008 | 1 (0-1, 218) | 1 (0-2, 255) | 0.10 | ||
| Controllo inalatore negli ultimi 6 mesi | NA | NA | 168 (68) | 157 (55) | 0.006 | 156 (65) | 153 (55) | 0.02 | ||
| Concordato un piano di assistenza con il fornitore di assistenza sanitaria‡: | ||||||||||
| Negli ultimi 6 mesi | 80 (28) | 82 (29) | 108 (44) | 85 (30) | 0.002 | 79 (33) | 75 (27) | 0.02 | ||
| >6 mesi fa | 25 (9) | 26 (9) | 53 (21) | 70 (25) | 72 (30) | 70 (25) | ||||
| Mai | 165 (57) | 156 (54) | 63 (25) | 104 (37) | 68 (28) | 111 (40) | ||||
| Consigli scritti su cosa fare se i sintomi peggiorano | 49 (17) | 49 (17) | 57 (23) | 47 (17) | 0.05 | 54 (23) | 52 (19) | 0.14 | ||
| Pacchetto di salvataggio antibiotico: | ||||||||||
| Ha uno | 77 (27) | 75 (26) | 93 (37) | 81 (29) | 0.02 | 97 (40) | 83 (30) | 0.02 | ||
| Sicuro nel suo utilizzo | 71 (92) | 68 (91) | 85 (91) | 76 (94) | 0.49 | 95 (98) | 76 (92) | 0.09 | ||
| Pacchetto di salvataggio con steroidi: | ||||||||||
| Ha uno | 56 (19) | 51 (18) | 63 (25) | 60 (21) | 0.23 | 70 (29) | 58 (21) | 0.03 | ||
| Sicuro nel suo utilizzo | 52 (93) | 47 (92) | 53 (84) | 55 (92) | 0.40 | 65 (93) | 54 (93) | 1.00 | ||
Analisi della sensibilità e dei sottogruppi
Non ci sono state differenze nei risultati dell’analisi secondo il protocollo, quando l’imputazione per regressione è stata utilizzata per imputare i dati mancanti o quando l’analisi ha escluso i questionari restituiti in anticipo o in ritardo (vedi appendice 3). Le analisi dei sottogruppi non hanno inoltre trovato alcuna evidenza che la dimensione dell’effetto differisse per età, sesso, etnia, comorbilità, livello MRC di base, stato di fumo, scala di ansia e depressione ospedaliera, attività fisica, volume espiratorio forzato previsto in un secondo (≥80 o <80), grado di limitazione delle attività nell’SGRQ-C, impegni attivi o auto efficacia. Ci sono state alcune evidenze di un’interazione con l’SGRQ-C di base (P=0.04); con un maggior beneficio per l’intervento nei partecipanti con un punteggio di base≥25 (cioè, quelli con una qualità di vita più bassa) (differenza media -3.0, intervallo di confidenza del 95% -6.4 a 0.3) rispetto a quelli con un punteggio di base<25 (2.3, -1.6 a 6.2).
Eventi avversi
Ci sono stati 44 eventi avversi gravi segnalati dai partecipanti; 24 nel braccio di assistenza sanitaria telefonica e 20 nel braccio di cura abituale. Nel gruppo di intervento si sono verificati cinque decessi a causa di corpulento, ictus, rottura di un aneurisma aortico e malignità (2). Nessuna è stata considerata correlata all’intervento.
Discussione
Principali risultati
Questo studio è il primo a valutare l’efficacia di un intervento di coaching sanitario telefonico fornito da un’infermiera per supportare l’autogestione di pazienti con sintomi lievi di broncopneumopatia cronica ostruttiva (BPCO). Abbiamo mostrato un miglioramento delle attività di autogestione nel gruppo di coaching sanitario telefonico rispetto alle cure abituali, ma non abbiamo osservato una differenza nel nostro risultato primario della qualità di vita relativa alla salute misurata dal Questionario Respiratorio di San Giorgio (SGRQ-C) (né nell’impatto, nel sintomo o nei domini di attività), sebbene gli intervalli di confidenza includano la differenza minima clinicamente importante di quattro punti per i domini di attività e di sintomo. L’attività fisica autosegnalata era più elevata a sei mesi nel gruppo di intervento, ma non è stata sostenuta a 12 mesi. Inoltre, le attività mirate dall’intervento, compresi i pazienti che hanno chiesto a un operatore sanitario di controllare la loro tecnica di uso dell’inalatore, che hanno chiesto al loro medico di concordare un piano di cura e che hanno un pacchetto di salvataggio, sono state più alte nel gruppo di intervento a sei e 12 mesi di follow-up, rispetto alle cure abituali. Ciò ha suggerito che una parte dei partecipanti all’intervento ha adottato un’autogestione attiva.
Confronto con altri studi
Il nostro approccio è stato nuovo rispetto ad altri studi di autogestione e interventi di coaching telefonico, rivolgendosi a pazienti con patologie lievemente sintomatiche. La maggior parte dei precedenti studi di autogestione della BPCO hanno escluso i partecipanti con la Global Initiative for Obstructive Lung Disease (GOLD) fase I (ostruzione del flusso d’aria lieve),940mentre un terzo dei nostri pazienti, erano in questa categoria, in quanto volevamo in particolare valutare un intervento per i pazienti con BPCO lieve, che sono un gruppo clinicamente importante, ma in gran parte trascurato nonostante la ridotta qualità di vita in termini di salute.41
Le revisioni sistematiche degli interventi di autogestione hanno riportato miglioramenti della qualità della vita in relazione alla BPCO, misurati dall’SGRQ con una differenza media di -2,40 a 12 mesi di follow-up.94042Tutte le revisioni hanno riportato effetti superiori alla differenza di -1,3 punti a 12 mesi riscontrata nel nostro studio. La qualità della vita in relazione alla salute è stata favorita come risultato principale per gli studi di autogestione della BPCO in quanto lo stato funzionale è importante per i pazienti ed è sensibile ai cambiamenti, mentre la funzione polmonare ha una variazione naturale che rende difficile l’interpretazione del cambiamento in brevi periodi di follow-up. Rispetto ad altri studi di autogestione nella BPCO, anche in popolazioni piùmiti39 , il punteggio totale SGRQ-C nel nostro studio è stato molto basso al basale (che rappresenta una buona qualità di vita correlata alla salute). Ciò ha portato potenzialmente ad un effetto di base, in cui il cambiamento può essere difficilmente raggiungibile, o il miglioramento può essere osservato solo per un periodo molto più lungo. Tuttavia, per il sottoscore di attività dell’SGRQ-C, la differenza media a 12 mesi (-3,2) riscontrata nel nostro studio si confronta bene con quelle delle revisioni sistematiche, che riportano differenze medie statisticamente significative di -2,75 e -2,21,940 Questi risultati sono coerenti con le differenze riscontrate a sei mesi (alla fine dell’intervento di autogestione del paziente BPCO) nell’attività fisica autosegnalata (Questionario Internazionale di Attività Fisica). Tuttavia, questo risultato della riduzione delle limitazioni all’attività fisica non si è riflesso nella quantità o intensità dell’attività fisica riportata (Questionario Internazionale di Attività Fisica) o nelle nostre misure oggettive di attività fisica in cui non ci sono state differenze tra i gruppi a 12 mesi.
Anche uno studio randomizzato controllato australiano (RCT) di un intervento di mentoring sanitario telefonico intensivo di 12 mesi per pazienti con BPCO da moderata a grave in cure primarie non ha riportato una differenza nel SGRQ a 12 mesi; ma ha ottenuto maggiori miglioramenti nella capacità di autogestione e nella conoscenza della BPCO rispetto alle cure abituali.43 Analogamente al nostro studio, un RCT di 12 settimane di un programma intensivo di telecoaching automatizzato ha riportato miglioramenti nell’attività fisica e nel dominio funzionale del Questionario clinico sulla BPCO, ma non nella qualità della vita legata alla salute (Test di valutazione della BPCO) alla fine del periodo di intervento di 12 settimane.44 Al contrario, un RCT di mentoring telefonico per la deambulazione a domicilio non ha mostrato alcun beneficio in termini di capacità di esercizio fisico nei pazienti con BPCO prima di iniziare un programma di riabilitazione polmonare, ed ha anche avuto un alto tasso di astinenza.45 In linea con i nostri risultati, una rapida revisione di 30 RCT degli effetti del coaching telefonico per la salute a sostegno dell’autogestione di condizioni a lungo termine ha riportato miglioramenti nei comportamenti sanitari, ma non ha trovato prove conclusive di miglioramenti nella qualità della vita.5
I miglioramenti osservati a breve termine nell’attività fisica autodidatta possono aver richiesto una maggiore durata del supporto o attività di manutenzione intermittente per sostenere i cambiamenti. Anche i consulti per le cure primarie sono stati inferiori nel gruppo d’intervento a sei mesi, il che può riflettere l’aumento dei contatti telefonici in questo periodo. Un messaggio coerente del coaching telefonico sulla salute è stato quello di far sì che i partecipanti all’intervento utilizzassero i loro appuntamenti di routine con le cure primarie per la tecnica di utilizzo dell’inalatore per essere controllati o per discutere un piano di cura o di azione e sembra che i partecipanti abbiano ascoltato questo messaggio e non abbiano prenotato ulteriori consulti per consigli o supporto di autogestione.
Punti di forza e limiti di questo studio
Ci sono stati molti punti di forza di questo studio. In primo luogo, il fatto di concentrarsi su un gruppo di pazienti leggermente sintomatico, che sono in gran parte esclusi da altri studi, ha fornito una novità e un potenziale di beneficio clinico. Abbiamo utilizzato un disegno di studio multicentrico che incorporava un ampio campione di pratiche rappresentative della popolazione generale del Regno Unito; un disegno pragmatico per accogliere un ampio gruppo di pazienti senza alcuna selezione in base alla motivazione a cambiare i comportamenti sanitari; la spirometria è stata intrapresa utilizzando personale addestrato e la qualità assicurata e abbiamo raggiunto un buon tasso di follow-up. L’intervento è stato sostenuto da una teoria cognitiva sociale e comprendeva tecniche come la fissazione di obiettivi che si sono dimostrate efficaci nel modificare i comportamenti e che hanno raggiunto un’intensità che potrebbe essere potenzialmente erogata in un servizio sanitario finanziato con fondi pubblici.46 Abbiamo raggiunto una buona fedeltà nella realizzazione dell’intervento, con il 75% dei partecipanti all’intervento che hanno ricevuto tutte e quattro le chiamate e solo quattro pazienti che non ne hanno ricevuto nessuna. Non sembra esserci stata alcuna contaminazione o cambiamento di comportamento nel gruppo di cura abituale, con i loro comportamenti di autogestione che sono rimasti statici per tutta la durata dello studio. In linea con la natura pragmatica di questo intervento, non abbiamo controllato se coloro che hanno controllato la tecnica di uso dell’inalatore avevano una formazione adeguata, ma questa è una componente fondamentale della gestione delle cure primarie della BPCO.24
Il nostro studio ha alcuni limiti. L’intervento si è svolto in un gruppo di persone con solo lievi sintomi di dispnea, che potrebbero non essersi considerate malate, quindi potrebbe essere stato necessario un alto grado di motivazione per partecipare. I pazienti altamente motivati sarebbero stati più propensi ad autogestirsi e a cambiare i comportamenti di vita. Il nostro campione ha riportato alti livelli di attività fisica regolare che superano la minore quantità raccomandata di attività fisica moderata o vigorosa alla settimana alla linea di base; quindi, nonostante i nostri sforzi per reclutare tutti i pazienti idonei alle cure primarie, è probabile che ci sia stata un’auto selezione delle persone che hanno partecipato allo studio, che può aver influito sulla capacità di migliorare, che è una caratteristica della maggior parte degli studi sul cambiamento del comportamento. L’intervento non ha soddisfatto le esigenze di alcuni pazienti che si sono ritirati dall’intervento e in alcuni casi si sono anche ritirati dallo studio, con il risultato di uno squilibrio nei tassi di follow-up tra le braccia dello studio. I pazienti che si sono ritirati hanno fornito motivazioni, tra cui la sensazione che l’intervento non soddisfaceva le loro esigenze in quanto erano già fisicamente attivi e alcuni che erano troppo malati dopo un’esacerbazione. Questo può indicare la necessità di un maggior numero di interventi di sartoria individuale rispetto a quanto effettivamente avvenuto. Inoltre, il parto per telefono può dare meno possibilità di costruire un rapporto tra il paziente e l’infermiera. Le questioni relative al rapporto, all’accettabilità e alla personalizzazione dell’intervento saranno affrontate in modo più dettagliato in una pubblicazione separata della valutazione qualitativa. Non abbiamo osservato grandi differenze nelle caratteristiche di chi si è ritirato dallo studio, né differenze nell’interpretazione del risultato primario con un’analisi di sensibilità per valutare l’impatto dei dati mancanti. Il calcolo della potenza è stato basato sul rilevamento di una differenza di quattro punti nella SGRQ-C a 12 mesi (punteggio medio 39, SD 15). Sebbene i partecipanti all’autogestione della BPCO abbiano avuto una malattia meno grave al basale (punteggio medio 28,7) di quanto previsto, la deviazione standard è stata di 14,5, il che significa che abbiamo ancora l’80% di potenza per rilevare la differenza di quattro punti. Tuttavia, a causa del punteggio SGRQ-C inferiore alla linea di base, questa differenza di quattro punti corrisponde ora ad una riduzione proporzionale del 14% rispetto alla riduzione proporzionale del 10% della dimensione originale del campione.
Abbiamo formato gli infermieri per due giorni con ulteriori giochi di ruolo e chiamate di gruppo per discutere le sfide una volta iniziato l’intervento. La nostra valutazione dei registri delle loro chiamate telefoniche e delle chiamate registrate identifica una variazione nello stile di comunicazione da un approccio incentrato sul paziente ad un approccio più direttivo. Inoltre, a causa della natura del reclutamento in diverse sedi, la distribuzione delle chiamate effettuate dagli infermieri è stata disomogenea. Era evidente che alcuni pazienti erano riluttanti a fissare obiettivi di attività fisica. È possibile che una formazione infermieristica più lunga avrebbe portato a una maggiore capacità di comunicazione e a un maggiore cambiamento comportamentale, ma si è trattato di uno studio pragmatico che mirava a valutare un intervento che potesse essere implementato nella pratica. È possibile che una maggiore durata dell’intervento, con chiamate oltre i tre mesi, avrebbe portato a maggiori effetti e che nel nostro gruppo con malattia prevalentemente lieve, il follow-up oltre i 12 mesi potrebbe essere necessario per rilevare i cambiamenti.
Implicazioni per i medici e i responsabili politici
L’aggiunta di un coaching telefonico per la salute a sostegno dell’autogestione non ha migliorato la qualità di vita dei nostri pazienti con malattie solo lievemente sintomatiche e che erano già abbastanza attivi fisicamente al basale. Tuttavia, ha portato a un aumento dell’attività fisica a sei mesi, che probabilmente si tradurrà in benefici per la salute,1516e in attività di autogestione che probabilmente ridurranno la frequenza e la gravità delle esacerbazioni. Mentre c’è ancora incertezza sulle migliori pratiche per la gestione delle persone con malattie lievemente sintomatiche, le terapie inalatorie sono ampiamente utilizzate in questo gruppo e un migliore impegno con l’educazione alla corretta tecnica di somministrazione aiuterà a realizzare risultati migliori per questi pazienti.1819Il supporto all’autogestione è attualmente raccomandato, ma non è probabile che sia ben implementato.47 Molte evidenze per il supporto all’autogestione della BPCO provengono da pazienti reclutati per le cure secondarie ed è necessaria una sintesi dei risultati del supporto all’autogestione nei pazienti reclutati per le cure primarie. Può essere che tra le persone con una malattia lievemente sintomatica, il sostegno all’autogestione debba essere fornito a coloro che hanno una qualità di vita più povera in termini di salute, che è il più grande predittore della qualità di vitafutura48 , o in quelle con le esacerbazioni più frequenti.14 Può anche essere che sia necessaria una diversa misura di outcome della qualità della vita in relazione alla salute per le persone con BPCO lieve o precoce, che affronti i limiti specifici dello stadio della loro malattia.
Manca l’evidenza di interventi efficaci per i pazienti con BPCO lieve e questo studio, pur migliorando alcuni comportamenti di autogestione, non ha dimostrato un beneficio clinico. Rimane la necessità di identificare interventi efficaci per i pazienti con sintomi più lievi della BPCO e questo ha anche chiare implicazioni per le attività di screening o di ricerca dei casi, che identificherebbero i pazienti con malattia lieve, e non può essere raccomandato mentre mancano opzioni di trattamento efficaci per questo gruppo di pazienti. Ci sono implicazioni più ampie nell’uso del coaching sanitario telefonico; una rapida revisione ha riportato che sembra essere più efficace nelle popolazioni vulnerabili, che hanno difficoltà ad accedere ai servizisanitari4 , il che non riflette la popolazione del nostro studio. Sostenere l’autogestione nei pazienti con malattie precoci, o con fattori di rischio, rimane una sfida. Oltre ai programmi di prevenzione del diabete, i servizi sanitari in genere concentrano il sostegno all’autogestione e i servizi di riabilitazione sulle persone con malattie più avanzate, ma c’è il potenziale per un notevole guadagno in termini di salute e di servizi sanitari se potessimo facilitare l’autogestione nei pazienti con malattie precoci e rallentare il loro declino. Per stabilire se ciò sia possibile occorreranno studi di follow-up a lungo termine.
Conclusioni e implicazioni politiche
Un nuovo intervento di coaching sanitario telefonico per promuovere un cambiamento di comportamento nei pazienti con lievi sintomi di dispnea nelle cure primarie ha portato a cambiamenti nelle attività di autogestione, ma non ha migliorato la qualità della vita in relazione alla salute. Rimane la chiara necessità di identificare interventi di mitigazione del rischio che possano efficacemente prevenire o ritardare la progressione della malattia in questo gruppo di pazienti.
Ciò che è già noto su questo argomento
- L’attuale politica di prevenzione e gestione delle condizioni a lungo termine si concentra sugli sforzi per prevenire l’insorgenza o la lenta progressione della malattia nelle prime fasi della traiettoria della malattia
- Questo paradigma di prevenzione è stato adottato solo recentemente per la broncopneumopatia cronica ostruttiva (BPCO)
- Le revisioni sistematiche hanno dimostrato che il supporto all’autogestione per i pazienti con BPCO è efficace nel migliorare la qualità della vita in relazione alla salute e nel ridurre i ricoveri ospedalieri, ma l’evidenza proviene in gran parte da pazienti con malattia moderata o grave e prevalentemente reclutati dalle cure secondarie
Cosa aggiunge questo studio
- Il coaching sanitario telefonico, che comprendeva componenti teoricamente associati al rallentamento del declino della funzione polmonare, ha migliorato le attività di autogestione che sono state oggetto dell’intervento in pazienti con BPCO lievemente sintomatica reclutati dalle cure primarie
- La qualità della vita legata alla salute non è migliorata nel periodo di follow-up di 12 mesi
References
- Publisher Full Text
- Kiley J, Gibbons G. Developing a research agenda for primary prevention of chronic lung diseases–an NHLBI perspective. Am J Respir Crit Care Med. 2014; 189:762-3. DOI | PubMed
- Lindner H, Menzies D, Kelly J, Taylor S, Shearer M. Coaching for behaviour change in chronic disease: a review of the literature and the implications for coaching as a self-management intervention. Aust J Prim Health. 2003; 9:177-85. DOI
- Dennis SM, Harris M, Lloyd J, Powell Davies G, Faruqi N, Zwar N. Do people with existing chronic conditions benefit from telephone coaching? A rapid review. Aust Health Rev. 2013; 37:381-8. PubMed
- GOLD. From the Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease.. GOLD; 2017.
- Publisher Full Text
- Lenferink A, Brusse-Keizer M, van der Valk PD. Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017; 8:CD011682. DOI | PubMed
- Zwerink M, Brusse-Keizer M, van der Valk PD. Self management for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014; 3:CD002990. PubMed
- Adab P, Fitzmaurice DA, Dickens AP. Cohort Profile: The Birmingham Chronic Obstructive Pulmonary Disease (COPD) Cohort Study. Int J Epidemiol. 2017; 46:23. PubMed
- Haughney J, Gruffydd-Jones K, Roberts J, Lee AJ, Hardwell A, McGarvey L. The distribution of COPD in UK general practice using the new GOLD classification. Eur Respir J. 2014; 43:993-1002. DOI | PubMed
- Jordan RE, Adab P, Sitch A. Targeted case finding for chronic obstructive pulmonary disease versus routine practice in primary care (TargetCOPD): a cluster-randomised controlled trial. Lancet Respir Med. 2016; 4:720-30. DOI | PubMed
- Anthonisen NR, Connett JE, Kiley JP. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA. 1994; 272:1497-505. DOI | PubMed
- Dransfield MT, Kunisaki KM, Strand MJ, COPDGene Investigators. Acute Exacerbations and Lung Function Loss in Smokers with and without Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2017; 195:324-30. PubMed
- Gimeno-Santos E, Frei A, Steurer-Stey C, PROactive consortium. Determinants and outcomes of physical activity in patients with COPD: a systematic review. Thorax. 2014; 69:731-9. DOI | PubMed
- Vaes AW, Garcia-Aymerich J, Marott JL. Changes in physical activity and all-cause mortality in COPD. Eur Respir J. 2014; 44:1199-209. DOI | PubMed
- Watz H, Waschki B, Meyer T, Magnussen H. Physical activity in patients with COPD. Eur Respir J. 2009; 33:262-72. DOI | PubMed
- Vogelmeier C, Fabbri LM, Rabe KF. Effect of tiotropium vs. salmeterol on exacerbations: GOLD II and maintenance therapy naïve patients. Respir Med. 2013; 107:75-83. DOI | PubMed
- Zhou Y, Zhong NS, Li X. Tiotropium in Early-Stage Chronic Obstructive Pulmonary Disease. N Engl J Med. 2017; 377:923-35. DOI | PubMed
- Sanchis J, Gich I, Pedersen S, Aerosol Drug Management Improvement Team (ADMIT). Systematic Review of Errors in Inhaler Use: Has Patient Technique Improved Over Time?. Chest. 2016; 150:394-406. DOI | PubMed
- Sidhu MS, Daley A, Jordan R. Patient self-management in primary care patients with mild COPD – protocol of a randomised controlled trial of telephone health coaching. BMC Pulm Med. 2015; 15:16. DOI | PubMed
- Boutron I, Altman DG, Moher D, Schulz KF, Ravaud P, CONSORT NPT Group. Consort statement for randomized trials of nonpharmacologic treatments: A 2017 update and a consort extension for nonpharmacologic trial abstracts. Ann Intern Med. 2017; 167:40-7. DOI | PubMed
- Rick J, Graffy J, Knapp P. Systematic techniques for assisting recruitment to trials (START): study protocol for embedded, randomized controlled trials. Trials. 2014; 15:407. DOI | PubMed
- Publisher Full Text
- Publisher Full Text
- Bandura A. Self-efficacy: toward a unifying theory of behavioral change. Psychol Rev. 1977; 84:191-215. DOI | PubMed
- Lorig KR, Holman H. Self-management education: history, definition, outcomes, and mechanisms. Ann Behav Med. 2003; 26:1-7. DOI | PubMed
- Lorig KR, Sobel DS, Ritter PL, Laurent D, Hobbs M. Effect of a self-management program on patients with chronic disease. Eff Clin Pract. 2001; 4:256-62. PubMed
- Bravata DM, Smith-Spangler C, Sundaram V. using pedometers to increase physical activity and improve health: a systematic review. JAMA. 2007; 298:2296-304. DOI | PubMed
- Eakin EG, Lawler SP, Vandelanotte C, Owen N. Telephone interventions for physical activity and dietary behavior change: a systematic review. Am J Prev Med. 2007; 32:419-34. DOI | PubMed
- Kahn EB, Ramsey LT, Brownson RC. The effectiveness of interventions to increase physical activity. A systematic review. Am J Prev Med. 2002; 22(Suppl):73-107. DOI | PubMed
- Ogilvie D, Foster CE, Rothnie H, Scottish Physical Activity Research Collaboration. Interventions to promote walking: systematic review. BMJ. 2007; 334:1204. DOI | PubMed
- Jones PW, Quirk FH, Baveystock CM, Littlejohns P. A self-complete measure of health status for chronic airflow limitation. The St. George’s Respiratory Questionnaire. Am Rev Respir Dis. 1992; 145:1321-7. DOI | PubMed
- Fletcher CM. The clinical diagnosis of pulmonary emphysema; an experimental study. Proc R Soc Med. 1952; 45:577-84. PubMed
- Craig CL, Marshall AL, Sjöström M. International physical activity questionnaire: 12-country reliability and validity. Med Sci Sports Exerc. 2003; 35:1381-95. DOI | PubMed
- Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983; 67:361-70. DOI | PubMed
- Herdman M, Gudex C, Lloyd A. Development and preliminary testing of the new five-level version of EQ-5D (EQ-5D-5L). Qual Life Res. 2011; 20:1727-36. DOI | PubMed
- Jones PW. George’s respiratory questionnaire: MCID. COPD. 2005; 2:75-9. DOI | PubMed
- van Wetering CR, Hoogendoorn M, Mol SJ, Rutten-van Mölken MP, Schols AM. Short- and long-term efficacy of a community-based COPD management programme in less advanced COPD: a randomised controlled trial. Thorax. 2010; 65:7-13. DOI | PubMed
- Cannon D, Buys N, Sriram KB, Sharma S, Morris N, Sun J. The effects of chronic obstructive pulmonary disease self-management interventions on improvement of quality of life in COPD patients: A meta-analysis. Respir Med. 2016; 121:81-90. DOI | PubMed
- Wacker ME, Jörres RA, Karch A, COSYCONET study group. Relative impact of COPD and comorbidities on generic health-related quality of life: a pooled analysis of the COSYCONET patient cohort and control subjects from the KORA and SHIP studies. Respir Res. 2016; 17:81. DOI | PubMed
- Jolly K, Majothi S, Sitch AJ. Self-management of health care behaviors for COPD: a systematic review and meta-analysis. Int J Chron Obstruct Pulmon Dis. 2016; 11:305-26. DOI | PubMed
- Walters J, Cameron-Tucker H, Wills K. Effects of telephone health mentoring in community-recruited chronic obstructive pulmonary disease on self-management capacity, quality of life and psychological morbidity: a randomised controlled trial. BMJ Open. 2013; 3:e003097. DOI | PubMed
- Demeyer H, Louvaris Z, Frei A, Mr Papp PROactive study group and the PROactive consortium. Physical activity is increased by a 12-week semiautomated telecoaching programme in patients with COPD: a multicentre randomised controlled trial. Thorax. 2017; 72:415-23. DOI | PubMed
- Cameron-Tucker HL, Wood-Baker R, Joseph L, Walters JA, Schüz N, Walters EH. A randomized controlled trial of telephone-mentoring with home-based walking preceding rehabilitation in COPD. Int J Chron Obstruct Pulmon Dis. 2016; 11:1991-2000. DOI | PubMed
- Publisher Full Text
- Khan A, Dickens AP, Adab P, Jordan RE. Self-management behaviour and support among primary care COPD patients: cross-sectional analysis of data from the Birmingham Chronic Obstructive Pulmonary Disease Cohort. NPJ Prim Care Respir Med. 2017; 27:46. DOI | PubMed
- Siebeling L, Musoro JZ, Geskus RB. Prediction of COPD-specific health-related quality of life in primary care COPD patients: a prospective cohort study. NPJ Prim Care Respir Med. 2014; 24:14060. DOI | PubMed
Fonte
Jolly K, Sidhu MS, Hewitt CA, Coventry PA, Daley A, et al. (2018) Self management of patients with mild COPD in primary care: randomised controlled trial. The BMJ 361k2241. https://doi.org/10.1136/bmj.k2241





