Abstract
Introduzione
Prove da studi in vitro e studi su modelli animali supportano un ruolo anti-neoplastico della vitamina D.1 La vitamina D funziona attivando il recettore nucleare della vitamina D, che è onnipresente e regola la crescita, la differenziazione e l’apoptosi delle cellule normali e tumorali.1
Gli studi epidemiologici sulle concentrazioni di vitamina D in circolazione e sul rischio di vari tipi di cancro hanno prodotto risultati incoerenti. Le meta-analisi degli studi osservazionali hanno suggerito che concentrazioni più elevate di 25 idrossivitamina D (25(OH)D), la forma primaria circolante, sono associate ad un minor rischio di cancro colorettale.2 L’evidenza epidemiologica per il cancro al seno e alla prostata è inconcludente, mentre i dati per gli altri tumori sono limitati.345Le precedenti associazioni osservazionali tra la forma circolante 25(OH)D e il cancro sono limitate da dimensioni relativamente piccole del campione specifico dello studio (per esempio, 3000-5000 casi in meta-analisi di cancro al seno, alla prostata e al colon-retto) e da diversi potenziali problemi metodologici. In particolare, la causalità inversa potrebbe esistere se il 25(OH)D viene misurato alla diagnosi del cancro o in prossimità di essa, potrebbe essere presente una confusione residua a causa di un controllo inadeguato per le cause comuni del cancro, e gli errori nella misurazione dell’esposizione al 25(OH)D potrebbero derivare da singole misurazioni.
Mancano i dati definitivi di studi randomizzati controllati in quanto pochi studi adeguatamente potenziati hanno esaminato l’integrazione di vitamina D e il rischio di cancro. La Women’s Health Initiative,6 uno studio randomizzato controllato con placebo di 400 UI di vitamina D più 1000 mg di calcio al giorno in 36-282 donne in postmenopausa, non è riuscito a sostenere un ruolo protettivo della vitamina D per un periodo di sette anni per il cancro al colon-retto (n=332 casi), il cancro al seno (n=1074 casi), o il cancro totale (n=2639 casi). La dose di vitamina D, tuttavia, era probabilmente inadeguata e il follow-up era troppo breve per produrre un contrasto sostanziale. Una meta-analisi di quattro studi di integrazione di vitamina D non ha trovato alcuna associazione con l’incidenza totale del cancro.7 Un’altra meta-analisi di 18 studi ha trovato una diminuzione della mortalità totale per cancro, ma la possibilità di errore di tipo I e di distorsione dell’attrito è stata segnalata come pochi partecipanti sono stati esaminati e c’è stato un sostanziale abbandono.8 Un precedente studio di randomizzazione mendeliana ha riportato che concentrazioni geneticamente basse di 25(OH)D erano associate ad un aumento della mortalità per cancro, ma questo studio includeva solo circa 2800 morti per cancro e non poteva eseguire analisi per sito di cancro.9
Per superare i limiti della ricerca osservazionale convenzionale e degli studi randomizzati e per chiarire se lo stato della vitamina D è causa di malattia o solo un indicatore correlato della salute generale, abbiamo usato un approccio di randomizzazione mendeliana e abbiamo stimato le associazioni tra i polimorfismi dei singoli polimorfismi nucleotidici associati alla vitamina D e il rischio di colorettale, seno, cancro alla prostata, alle ovaie, ai polmoni e al pancreas e neuroblastoma utilizzando i dati riassuntivi delle Associazioni genetiche e dei meccanismi oncologici (GAME-ON), del Genetic and Epidemiology of Colorectal Cancer Consortium (GECCO) e del Prostate Cancer Association Group to Investigate Cancer Associated Alterations in the Genome (PRACTICAL) consorzi e della piattaforma MR-Base. La randomizzazione mendeliana mira a migliorare l’inferenza causale valutando le associazioni di rischio della componente geneticamente determinata delle esposizioni ambientali e dei biomarcatori.10
11
Metodi
Dati per l’epidemiologia genetica del cancro
Abbiamo recuperato dati sommari per l’associazione tra polimorfismi di singoli nucleotidi associati alla vitamina D e al cancro da tre grandi reti di epidemiologia genetica. L’iniziativa GAME-ON è una rete di cinque consorzi specifici per il cancro: CORECT (Studio Colo-Rettale Transdisciplinare); DRIVE (Discovery, Biology, and Risk of Inherited Variants in Breast Cancer); ELLIPSE (Elucidating Loci Involved in Prostate Cancer Susceptibility); FOCI-OCAC (Follow-up of Ovarian Cancer Genetic Association and Interaction Studies of the Ovarian Cancer Association Consortium); e TRICL-ILCCO (Transdisciplinary Research in Cancer of the Lung of the International Lung Cancer Consortium). Dati riassuntivi su più ampia scala sull’epidemiologia genetica del cancro colorettale e della prostata sono stati recuperati dai consorzi GECCO e PRACTICAL. Ulteriori dettagli su queste reti possono essere trovati altrove.121314I dati per l’epidemiologia genetica del cancro al pancreas e del neuroblastoma sono stati ricavati da PanScan1 (Pancreatic Cancer Cohort Consortium Genome-Wide Association Study) e da uno studio di associazione a livello genomico del neuroblastoma attraverso la piattaforma MR-Base.15
16
17
18
I risultati di singoli studi di associazione a livello genomico per ogni tipo di cancro sono stati combinati utilizzando metodi standard di meta-analisi a effetti fissi. Abbiamo utilizzato gli array Illumina o Affymetrix per la genotipizzazione e MACH19 o IMPUTE20 per l’imputazione con il pannello di riferimento dei 1000 genomi. Abbiamo incorporato i componenti principali come covariate nel polimorfismo dei singoli polimorfismi nucleotidici e nei modelli di regressione logistica del cancro per adattarli alla stratificazione della popolazione. Ulteriori informazioni riguardanti l’analisi statistica, l’imputazione e le fasi di controllo della qualità negli studi di associazione a livello genomico sono state precedentemente riportate.16
17
21
22
23
24
Dati per l’epidemiologia genetica delle concentrazioni di 25(OH)D circolanti
Abbiamo condotto una ricerca di studi di associazione a livello genomico pubblicati in PubMed e nel relativo catalogo e abbiamo identificato quattro singoli polimorfismi nucleotidici come fortemente associati a P<5×10-8 con la concentrazione di 25(OH)D circolante in due studi di associazione a livello genomico.2526Questi erano rs2282679 nel componente specifico del gruppo (GC) sul cromosoma 4p12 che codifica la proteina legante della vitamina D; rs10741657 nel CYP2R1 sul cromosoma 11p15 che è coinvolto nell’idrossilazione della vitamina D3 a 25(OH)D; rs12785878 situato vicino al DHCR7 sul cromosoma 11q12 che catalizza la conversione del 7-deidrocolesterolo in colesterolo; e rs6013897 vicino al CYP24A1 sul cromosoma 20q13 che codifica un enzima che avvia la degradazione di 1,25(OH)2D. Tutti e quattro i singoli polimorfismi nucleotidici sono stati identificati tra gli individui di ascendenza europea. Ciascuno di essi ha spiegato circa l’1% della variabilità 25(OH)D e fino al 5% per le combinazioni dei quattro polimorfismi.252627Stime più precise delle associazioni tra i polimorfismi con i 25(OH)D circolanti sono state ottenute da un recente grande studio di randomizzazione mendeliana.28 Tale studio ha analizzato l’associazione tra i suddetti polimorfismi con concentrazioni di 25(OH)D circolanti come per variazione di unità (nmol/L) nella scala naturale (non trasformata).
Analisi statistica
Abbiamo condotto analisi di randomizzazione mendeliana per testare le potenziali associazioni causali tra il 25(OH)D circolante e il rischio di sette tumori (colorettale, seno, prostata, ovaio, polmone, pancreatico e neuroblastoma) utilizzando i dati sommari di GAME-ON, GECCO, PRACTICAL, MR-Base e studi di associazione a livello genomico della concentrazione del 25(OH)D. Abbiamo anche eseguito analisi per i sottotipi di cancro: cancro colorettale negli uomini e nelle donne, cancro del colon, cancro del colon, cancro rettale, cancro del colon prossimale, cancro del colon distale, cancro al seno negativo del recettore degli estrogeni, cancro aggressivo alla prostata2429; cancro delle cellule chiare, endometrioide e cancro delle ovaie sierose; e adenocarcinoma adenocarcinoma e carcinoma del polmone a cellule squamose. Abbiamo formulato un punteggio ponderato di multi-polimorfismo, che è stato precedentemente dimostrato essere linearmente associato alla concentrazione 25(OH)D circolante.28 Abbiamo usato due metodi di randomizzazione mendeliana utilizzando dati genetici sommari: una media ponderata della varianza inversa delle associazioni per specifici polimorfismi e un metodo basato sulla probabilità.3031Ulteriori informazioni su questi metodi sono fornite nell’appendice 1.
Affinché le analisi di randomizzazione mendeliana abbiano una valida interpretazione, è necessario che le seguenti tre ipotesi di variabili strumentali siano valide3233: i marcatori genetici sono fortemente associati alla concentrazione di vitamina D circolante; i marcatori influenzano il cancro solo attraverso il loro effetto sulla vitamina D circolante; e i marcatori sono indipendenti da qualsiasi confondimento dell’associazione tra vitamina D circolante e cancro. Per valutare la potenziale violazione di queste ipotesi abbiamo eseguito diversi test statistici (MR-Egger,34 approccio mediano ponderato,35 e test di sovraidentificazione36) e analisi di sensibilità (analisi di randomizzazione mendeliana con due punteggi allelici separati: un punteggio allelico di sintesi della vitamina D (rs10741657 e rs12785878) e un punteggio allelico del metabolismo (rs2282679 e rs6013897)), ulteriori informazioni in merito ai quali sono fornite nell’appendice 1.
Risultati
Descrizioni e potenza statistica
La tabella 1 elenca le dimensioni dei campioni utilizzati nello studio attuale per ogni tipo di cancro. Il numero di casi di cancro variava da 1627 per il neuroblastoma a 22-898 per il cancro alla prostata. Le nostre analisi di randomizzazione mendeliana avevano una potenza dell’80%, supponendo che il 3% della varianza 25(OH)D fosse spiegata dai quattro singoli polimorfismi nucleotidici, per rilevare dimensioni di effetto di moderata entità, che vanno da rapporti di probabilità di 0,58 per SD (per esempio, 25 nmol/L o 10 ng/mL) aumento della concentrazione di 25(OH)D circolante per il neuroblastoma a 0,86 per il cancro alla prostata (tabella 1), che sono comparabili con le dimensioni dell’effetto che sono state osservate negli studi osservazionali che mettono in relazione la concentrazione di 25(OH)D circolante con il rischio di cancro. Simili dimensioni minime di effetto rilevabili sono state stimate per sottotipi di cancro, ad eccezione dei carcinomi ovarici a cellule chiare e endometrioidi, per i quali esisteva un potere adeguato per rilevare solo effetti di grandi dimensioni (ad esempio, rapporti di probabilità 0,19-0,43). La potenza era maggiore se si ipotizzava che il 5% della varianza 25(OH)D fosse spiegata dai singoli polimorfismi nucleotidici (tabella 1). La tabella 2 mostra le informazioni sulle associazioni di rs2282679, rs10741657, rs12785878 e rs6013897 con concentrazione 25(OH)D.
| Tipo di cancro | Studio | Casi | Controlli | Minimo rilevabile OR*(R2=0.03) | Minimo rilevabile OR*(R2=0.05) | OR (95% CI) nelle meta-analisi pubblicate† |
|---|---|---|---|---|---|---|
| Colorettale | ||||||
| Tutti | GAME-ON | 5100 | 4831 | 0.72/1.39 | 0.78/1.28 | 0,74 (da 0,63 a 0,89)37 |
| Tutti | GECCO | 11 488 | 11 679 | 0.81/1.23 | 0.85/1.18 | |
| Tutti (donne) | GECCO | 6132 | 6380 | 0.75/1.33 | 0.80/1.25 | NR |
| Tutti (uomini) | GECCO | 5356 | 5297 | 0.73/1.37 | 0.78/1.28 | NR |
| Colon | GECCO | 7678 | 11 679 | 0.78/1.28 | 0.83/1.20 | NR |
| Rettale | GECCO | 2783 | 11 679 | 0.68/1.47 | 0.75/1.33 | NR |
| Colon distale | GECCO | 3354 | 11 679 | 0.70/1.43 | 0.77/1.30 | NR |
| Colon prossimale | GECCO | 4185 | 11 679 | 0.73/1.37 | 0.79/1.27 | NR |
| Seno | ||||||
| Tutti | AUTOMOBILE | 15 748 | 18 084 | 0.84/1.19 | 0.87/1.15 | 0,89 (0,81 a 0,98)38 |
| ER- | DRIVE | 4939 | 13 128 | 0.75/1.29 | 0.80/1.22 | NR |
| Prostata | ||||||
| Tutti | PRATICO | 22 898 | 23 054 | 0.86/1.16 | 0.89/1.12 | 1,04 (0,99 a 1,10)39 |
| Tutti | GAME-ON | 14 159 | 12 712 | 0.82/1.22 | 0.86/1.17 | |
| Aggressivo | GAME-ON | 4445 | 12 724 | 0.74/1.30 | 0.79/1.23 | 0,98 (0,84 a 1,15)39 |
| Ovarica | ||||||
| Tutti | FOCI | 4369 | 9123 | 0.73/1.33 | 0.79/1.25 | 0,91 (da 0,79 a 1,04)40 |
| Clear-cell | FOCI | 356 | 9123 | 0.19/1.86 | 0.36/1.67 | NR |
| Endometrioide | FOCI | 715 | 9123 | 0.43/1.62 | 0.55/1.48 | NR |
| Serous | FOCI | 2556 | 9123 | 0.67/1.39 | 0.74/1.30 | NR |
| Polmone | ||||||
| Tutti | TRICL-ILCCO | 12 537 | 17 285 | 0.82/1.20 | 0.86/1.16 | 0,98 (0,96 a 0,99)41 |
| Adenocarcinoma | TRICL-ILCCO | 3804 | 16 289 | 0.73/1.30 | 0.78/1.23 | NR |
| Squamous | TRICL-ILCCO | 3546 | 16 434 | 0.72/1.31 | 0.78/1.24 | NR |
| Pancreatica | ||||||
| Tutti | PanScan1‡ | 1896 | 1939 | 0.59/1.67 | 0.67/1.49 | NR |
| Neuroblastoma | ||||||
| Tutti | Capasso, et al17‡ | 1627 | 3254 | 0.58/1.57 | 0.66/1.43 | NR |
| Polimorfismo a singolo nucleotide | Cromosoma | Locus | Allele di rischio | β stima† | Valore P |
|---|---|---|---|---|---|
| rs2282679 | 4 | GC | G | −4.67 | <3.4×10−302 |
| rs10741657 | 11 | CYP2R1 | G | −1.72 | 6.5×10−81 |
| rs12785878 | 11 | DHCR7/NADSYN1 | G | −2.11 | 6.4×10−129 |
| rs6013897 | 20 | CYP24A1 | A | −0.98 | 3.4×10−17 |
Associazione tra polimorfismi singoli singoli nucleotidi e cancro
L’Appendice 2 mostra l’associazione tra ogni singolo polimorfismo nucleotidico legato alla vitamina D e il rischio di cancro colorettale, al seno, alla prostata, alle ovaie, ai polmoni, al pancreas e al neuroblastoma e i loro sottotipi con i dati di GAME-ON, GECCO, PRACTICAL e la piattaforma MR-Base. Nessuno dei quattro polimorfismi è stato significativamente associato ad alcun rischio di cancro, ad eccezione di rs6013897 con il cancro alla prostata nei dati GAME-ON (odds ratio per allele effetto 1,06, intervallo di confidenza del 95% da 1,01 a 1,10; P=0,02), ma questa associazione non è stata osservata nei dati PRACTICAL più grandi (1,00, da 0,97 a 1,04; P=0,81). Il polimorfismo rs6013897 è stato anche associato al rischio di cancro al colon nei dati GECCO (0,94, 0,89 a 0,99; P=0,03).
Stime di randomizzazione mendeliana per i punteggi del polimorfismo multiplo
Sulla base delle analisi di randomizzazione mendeliana con il metodo della varianza inversa ponderata o con il metodo basato sulla probabilità, abbiamo trovato poche prove che i punteggi del multi-polimorfismo per la concentrazione continua di 25(OH)D erano associati al rischio di cancro colorettale, al seno, alla prostata, alle ovaie, ai polmoni o al pancreas e al neuroblastoma o ai loro sottotipi (tabella 3). Le figure 1-6 mostrano diagrammi di dispersione delle associazioni tra il polimorfismo della vitamina D e il rischio di vari tipi di cancro. I grafici sono sovrapposti dalla stima della randomizzazione mendeliana (pendenza della linea solida) e dal suo intervallo di confidenza del 95% (linee tratteggiate) del punteggio di multi-polimorfismo di 25(OH)D a circolazione continua sul rischio dei sette tumori e dei loro sottotipi. Abbiamo trovato un’associazione marginalmente significativa per il cancro totale della prostata, per il quale un aumento geneticamente determinato di 25 nmol/L della concentrazione di 25(OH)D ha prodotto un rapporto di probabilità di 0,89 (intervallo di confidenza del 95% da 0,77 a 1,02; P=0,08; fig 3).
| Tipo di cancro | Studio | OR* (95% CI); valore P | |
|---|---|---|---|
| Varianza inversa ponderata | Probabilità | ||
| Colorettale | |||
| Tutti | GAME-ON | 1,04 (da 0,78 a 1,38); 0,81 | 1,04 (0,78 a 1,38); 0,81 |
| Tutti | GECCO | 0,92 (da 0,76 a 1,10); 0,36 | 0,92 (0,76 a 1,10); 0,36 |
| Tutti (donne) | GECCO | 0,92 (da 0,71 a 1,18); 0,52 | 0,92 (0,71 a 1,18); 0,52 |
| Tutti (uomini) | GECCO | 0,91 (da 0,70 a 1,20); 0,52 | 0,91 (0,70 a 1,20); 0,52 |
| Colon | GECCO | 0,90 (da 0,73 a 1,11); 0,33 | 0,90 (0,73 a 1,11); 0,33 |
| Rettale | GECCO | 0,93 (da 0,68 a 1,26); 0,64 | 0,93 (0,68 a 1,26); 0,64 |
| Colon distale | GECCO | 0,97 (da 0,73 a 1,28); 0,83 | 0,97 (0,73 a 1,28); 0,83 |
| Colon prossimale | GECCO | 0,83 (da 0,64 a 1,07); 0,14 | 0,82 (0,64 a 1,07); 0,14 |
| Seno | |||
| Tutti | AUTOMOBILE | 1,05 (da 0,89 a 1,24); 0,59 | 1,05 (0,89 a 1,24); 0,59 |
| ER- | DRIVE | 1,15 (da 0,88 a 1,50); 0,30 | 1,15 (0,88 a 1,50); 0,30 |
| Prostata | |||
| Tutti | PRATICO | 0,89 (da 0,77 a 1,02); 0,08 | 0,89 (da 0,77 a 1,02); 0,08 |
| Tutti | GAME-ON | 1,08 (0,88 a 1,33); 0,47 | 1,08 (0,88 a 1,33); 0,46 |
| Aggressivo | GAME-ON | 1,14 (da 0,85 a 1,54); 0,38 | 1,15 (0,85 a 1,54); 0,38 |
| Ovarica | |||
| Tutti | FOCI | 1,12 (0,86 a 1,47); 0,40 | 1,12 (0,86 a 1,47); 0,40 |
| Clear-cell | FOCI | 0,99 (0,46 a 2,11); 0,98 | 0,99 (0,46 a 2,11); 0,98 |
| Endometrioide | FOCI | 0,83 (da 0,48 a 1,43); 0,51 | 0,83 (da 0,48 a 1,43); 0,51 |
| Serous | FOCI | 1,26 (da 0,91 a 1,76); 0,17 | 1,26 (da 0,91 a 1,76); 0,17 |
| Polmone | |||
| Tutti | TRICL-ILCCO | 1,03 (0,87 a 1,23); 0,72 | 1,03 (0,87 a 1,23); 0,72 |
| Adenocarcinoma | TRICL-ILCCO | 1,03 (da 0,79 a 1,35); 0,84 | 1,03 (0,79 a 1,35); 0,84 |
| Squamous | TRICL-ILCCO | 0,95 (da 0,72 a 1,25); 0,74 | 0,95 (0,72 a 1,25); 0,74 |
| Pancreatica | |||
| Tutti | PanScan1† | 1,36 (da 0,81 a 2,27); 0,25 | 1,36 (0,80 a 2,27); 0,25 |
| Neuroblastoma | |||
| Tutti | Capasso, et al17† | 0,76 (da 0,47 a 1,21); 0,24 | 0,76 (da 0,47 a 1,21); 0,24 |
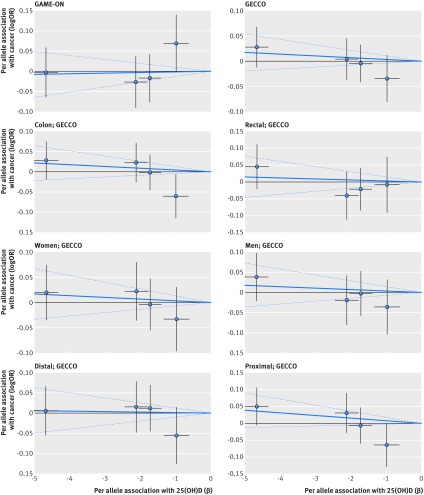
Fig. 1 Associazione tra i polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro colorettale e la concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)
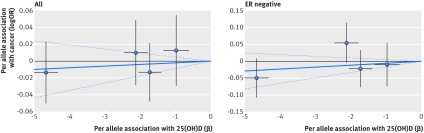
Fig. 2 Associazione tra i polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro al seno e la concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)
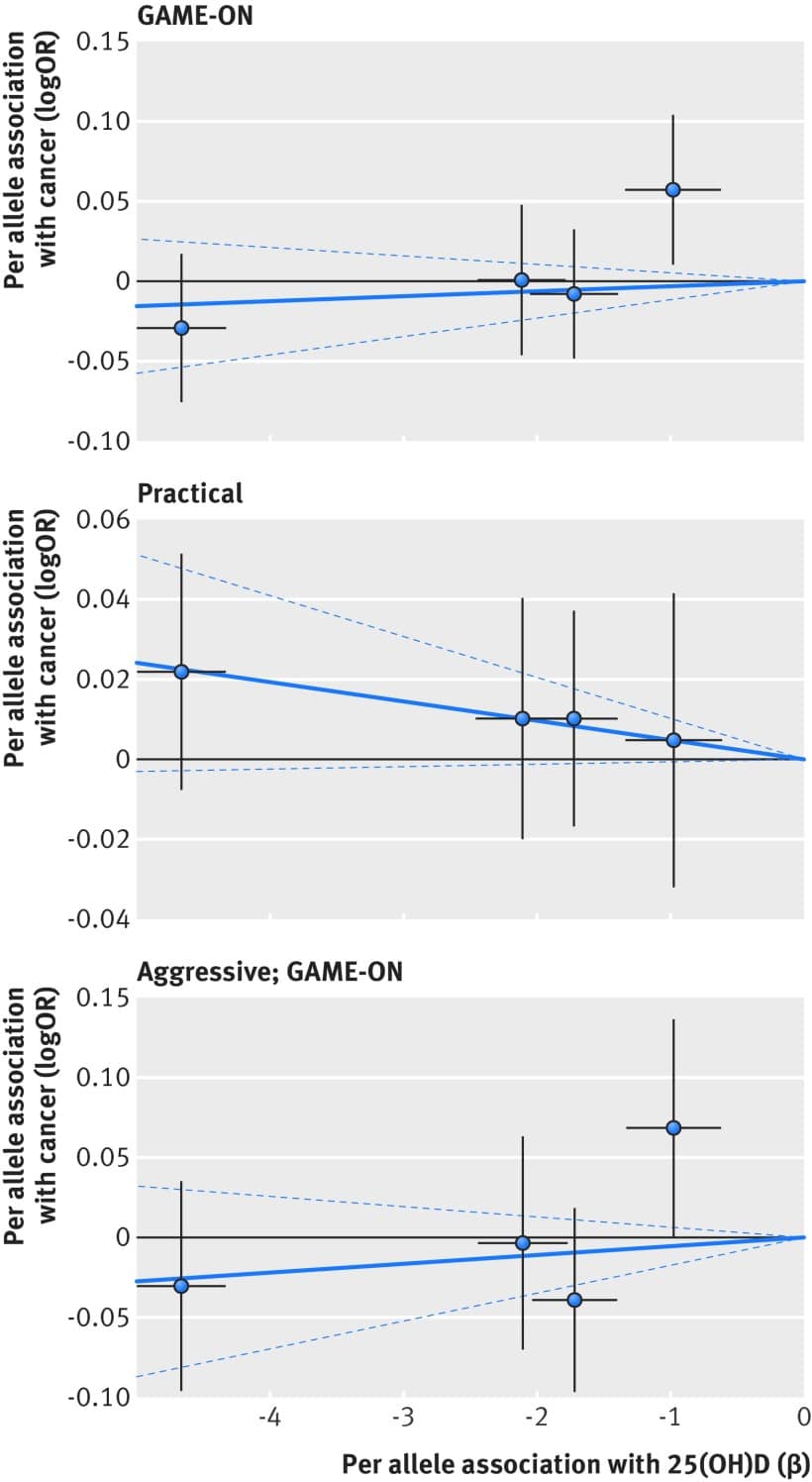
Fig. 3 Associazione tra polimorfismi mono nucleotidici associati alla vitamina D e rischio di cancro alla prostata e concentrazione di 25(OH)D circolante. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)
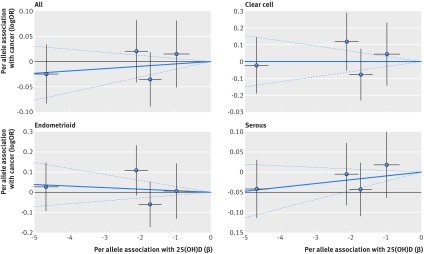
Fig. 4 Associazione tra polimorfismi mono nucleotidici associati alla vitamina D e rischio di cancro alle ovaie e concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)
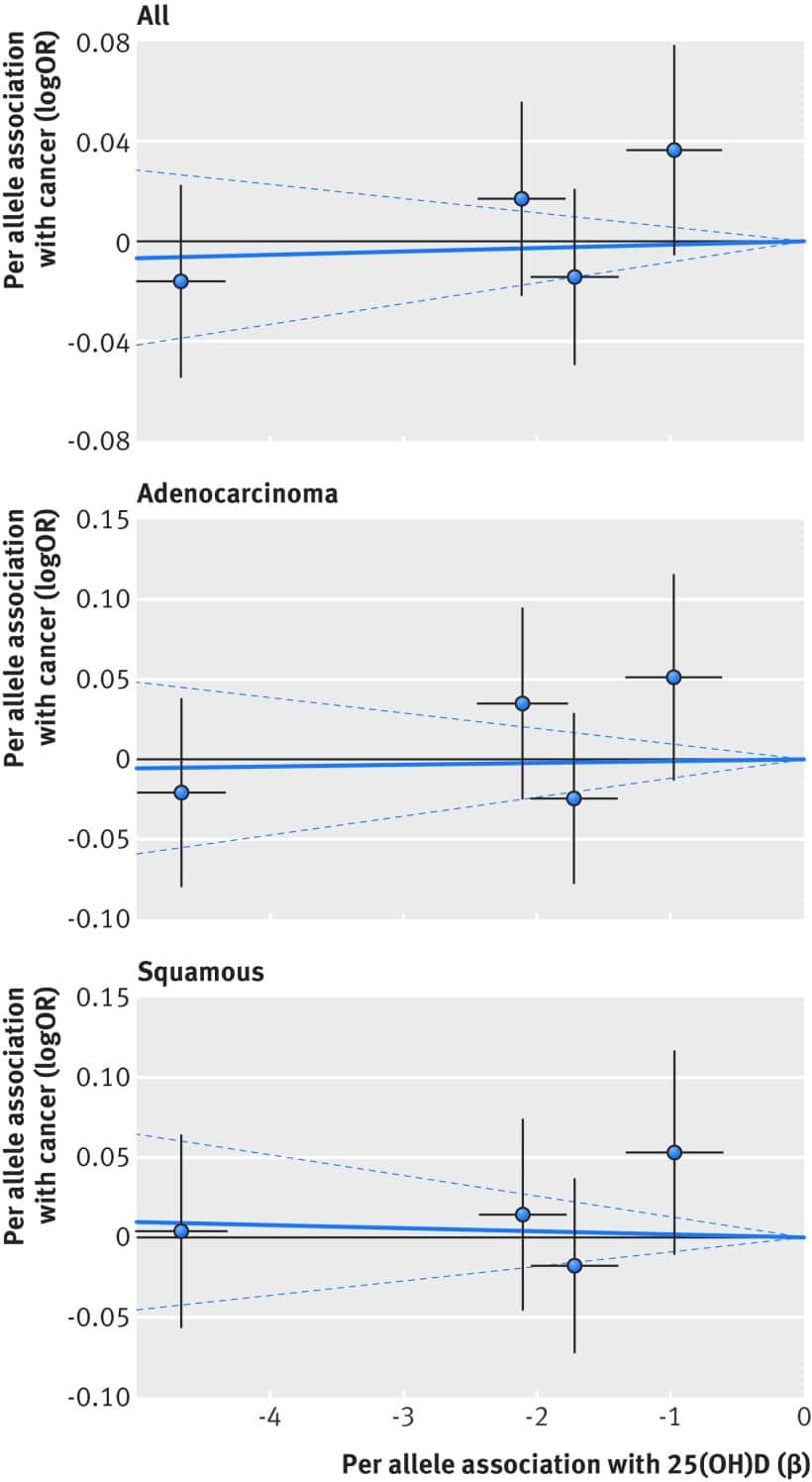
Fig. 5 Associazione tra i polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro ai polmoni e la concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)
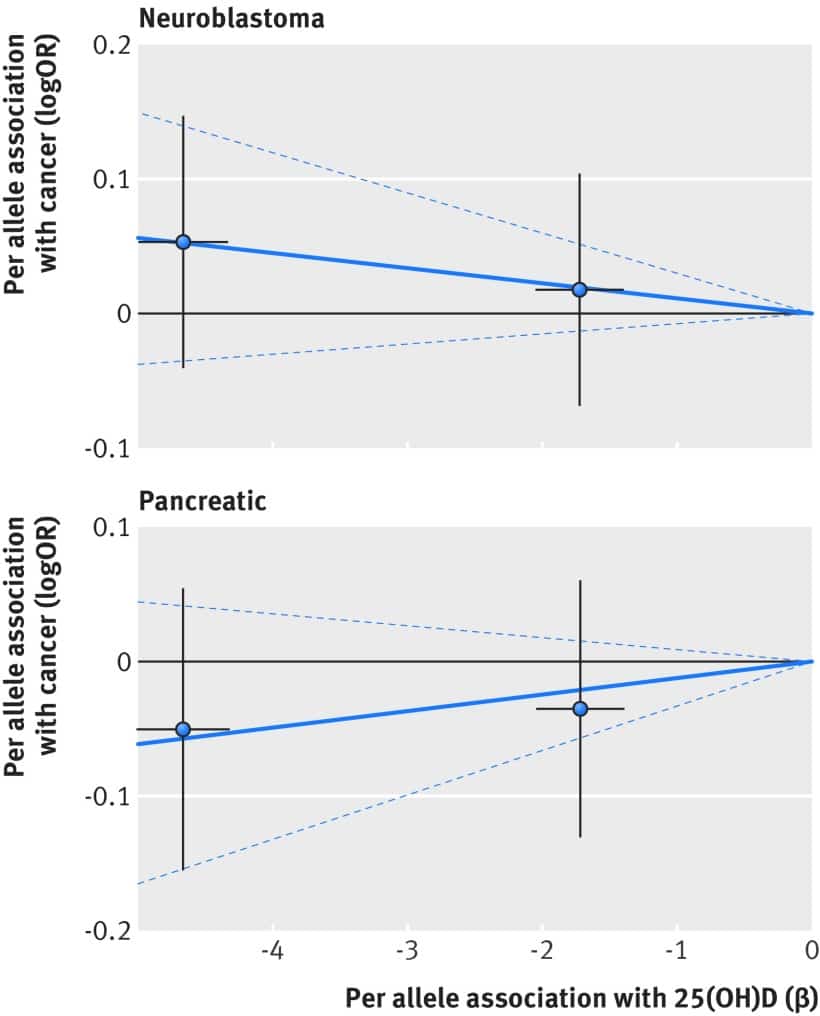
Fig. 6 Associazione tra polimorfismi a singolo nucleotide associati alla vitamina D e al rischio di neuroblastoma e tumore del pancreas e concentrazione 25(OH)D circolante. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)

Fig. 1 Associazione tra i polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro colorettale e la concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)

Fig. 2 Associazione tra i polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro al seno e la concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)

Fig. 3 Associazione tra polimorfismi mono nucleotidici associati alla vitamina D e rischio di cancro alla prostata e concentrazione di 25(OH)D circolante. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)

Fig. 4 Associazione tra polimorfismi mono nucleotidici associati alla vitamina D e rischio di cancro alle ovaie e concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)

Fig. 5 Associazione tra i polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro ai polmoni e la concentrazione di 25(OH)D in circolazione. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)

Fig. 6 Associazione tra polimorfismi a singolo nucleotide associati alla vitamina D e al rischio di neuroblastoma e cancro al pancreas e concentrazione 25(OH)D circolante. Per associazioni alleliche con rischio tracciato contro per associazioni alleliche con concentrazione circolante continua 25(OH)D (le linee nere verticali e orizzontali intorno ai punti mostrano un intervallo di confidenza del 95% per ogni polimorfismo)
Valutazione delle ipotesi di randomizzazione mendeliana
Le stime di randomizzazione mendeliana hanno un’interpretazione causale solo se le ipotesi di variabile strumentale del metodo sono valide. Per soddisfare la prima ipotesi, abbiamo selezionato polimorfismi a singolo nucleotide con un’associazione significativa a livello genomico con concentrazioni di 25(OH)D. Abbiamo ottenuto stime di associazione con concentrazione continua di 25(OH)D per ogni polimorfismo da un precedente grande studio di randomizzazione mendeliano, che ha stimato che la statistica F era 230 (n=35-873) e 489 (n=38-191) per i punteggi allelici della sintesi della vitamina D e del metabolismo, rispettivamente.28
Abbiamo effettuato test statistici e analisi di sensibilità per valutare la potenziale violazione della seconda e della terza ipotesi. La bontà dei test di idoneità ha indicato l’assenza di effetti pleiotropici orizzontali dei quattro polimorfismi sul cancro che non sono correlati all’effetto di ciascun polimorfismo sulla circolazione 25(OH)D (tabella A nell’appendice 3). Test di sovraidentificazione hanno anche suggerito che le stime dell’effetto con diverse varianti genetiche erano simili per tutti i tumori. Quando abbiamo ulteriormente valutato la presenza di pleiotropia orizzontale eseguendo l’analisi di randomizzazione mendeliana utilizzando due punteggi allelici separati (cioè sintesi della vitamina D e metabolismo), i risultati sono stati identici e non significativi per tutti i tumori (tabelle B e C in appendice 3). Il metodo di regressione MR-Egger, inoltre, non ha mostrato alcuna evidenza della presenza di pleiotropia orizzontale per nessuna delle associazioni riportate (tabella D in appendice 3), in quanto i valori P per l’intercettazione erano elevati e le stime corrette per la pleiotropia suggerivano effetti nulli, anche se ci si aspetta che questo metodo abbia un basso potere di rilevare la violazione delle ipotesi quando vengono utilizzati solo quattro strumenti genetici. Anche il metodo della mediana ponderata non ha prodotto stime significative (tabella D dell’appendice 3). Non abbiamo trovato alcuna prova negli studi di associazione a livello genomico pubblicati che i quattro singoli polimorfismi nucleotidici associati alla vitamina D fossero significativamente associati a qualsiasi altro fenotipo ad eccezione delle concentrazioni di 25(OH)D, il che significa che la terza ipotesi di randomizzazione mendeliana non è probabilmente violata. Inoltre, precedenti studi di randomizzazione mendeliana che utilizzavano dati a livello individuale non hanno trovato alcuna prova di associazione tra i polimorfismi della vitamina D e i potenziali confonditori ambientali.9
42
43
Discussione
Principali risultati e confronti con la letteratura
In questo grande studio di randomizzazione mendeliana, abbiamo osservato poche prove che un punteggio di polimorfismo nucleotidico multi-singolo per la concentrazione di 25(OH)D in circolazione era associato al rischio di diversi tumori, tra cui il cancro colorettale, al seno, alla prostata, alla prostata, alle ovaie, ai polmoni e al pancreas e il neuroblastoma o alcuni dei loro sottotipi. Questo è stato il primo studio con una dimensione del campione sufficiente, secondo le ipotesi di randomizzazione mendeliana, a mostrare una mancanza di effetto causale per un’associazione lineare tra la concentrazione di 25(OH)D e il rischio di questi tumori.
Cancro colorettale
L’evidenza generale di un’associazione tra la vitamina D e il rischio di specifici tumori è mista. Una maggiore concentrazione di 25(OH)D in circolazione è stata associata ad un minor rischio di cancro colorettale. Una revisione sistematica di otto studi prospettici che includevano 2690 casi di cancro colorettale ha osservato un 34% (odds ratio 0.66, 95% intervallo di confidenza 0.54 a 0.81) di rischio più basso di cancro colorettale per la parte superiore rispetto al quartile inferiore della concentrazione di 25(OH)D.2 Un’altra meta-analisi ha rilevato che un incremento di 25 nmol/L nella circolazione di 25(OH)D era associato ad un rischio relativo di 0,74 (da 0,63 a 0,89).37 Sebbene l’attuale studio di randomizzazione mendeliana fosse alimentato per rapporti di probabilità minime rilevabili fino a 0,85 per 25 nmol/L nella circolazione di 25(OH)D, non supportava tale associazione. In accordo con i nostri risultati, una precedente analisi di randomizzazione Mendeliana di un caso di studio scozzese di controllo del 2001 e di 2237 controlli non ha trovato un’associazione tra le concentrazioni di vitamina D geneticamente determinate e il rischio di cancro colorettale.42 Il consorzio GECCO non ha trovato alcuna associazione tra i quattro singoli polimorfismi nucleotidici associati alla vitamina D e il rischio di cancro colorettale.44
Cancro al seno
L’evidenza epidemiologica prospettica di un’associazione tra le concentrazioni di 25(OH)D circolanti e il rischio di cancro al seno è inconcludente. Una meta-analisi di Gandini e colleghi ha riportato che un incremento di 25 nmol/L nella concentrazione di 25(OH)D in circolazione è stato associato ad un rischio relativo di 0,89 (intervallo di confidenza del 95% da 0,81 a 0,98).38 Due meta-analisi successive non hanno osservato alcuna associazione tra la concentrazione di 25(OH)D e il rischio di cancro al seno in premenopausa, mentre un’associazione inversa è stata suggerita per il cancro al seno in post-menopausa.4546In particolare, Bauer e colleghi hanno suggerito un’associazione inversa significativa per le donne in postmenopausa con un rischio relativo per 12,5 nmol/Lof circolante 25(OH)D di 0,97 (da 0,93 a 1,00).45 Non abbiamo trovato un’associazione tra le concentrazioni geneticamente determinate di 25(OH)D e il rischio di cancro al seno, e il nostro studio è stato alimentato per trovare rapporti di probabilità minime rilevabili che vanno da 0,84 a 0,87 per 25 nmol/L in 25(OH)D. Le informazioni sullo stato della menopausa non erano disponibili nelle grandi reti genetiche che abbiamo utilizzato, ma la maggior parte delle donne del nostro campione aveva un cancro al seno in post-menopausa. In accordo con i nostri risultati, la sperimentazione dell’Iniziativa per la salute delle donne sulla vitamina D più l’integrazione di calcio nelle donne in postmenopausa non ha sostenuto un’associazione protettiva con il cancro al seno (rapporto di rischio 0,96, intervallo di confidenza del 95% da 0,85 a 1,09).47 Un grande consorzio di coorte di 9456 casi e 10-816 controlli non ha inoltre trovato alcuna associazione tra i quattro polimorfismi a singolo nucleotide associati alla vitamina D e il rischio di cancro al seno.48
Cancro alla prostata
Una meta-analisi di 14 studi prospettici pubblicati nel 2011 ha fornito poche prove che la concentrazione di 25(OH)D è stata associata al rischio di cancro alla prostata totale (odds ratio per 25 nmol/L), 1,04, intervallo di confidenza del 95% da 0,99 a 1,10) o aggressivo (0,98, 0,84 a 1,15).39 Studi prospettici più recenti hanno riportato associazioni nulle tra la concentrazione di 25(OH)D circolante e il rischio di cancro alla prostata totale, ma associazioni inverse per malattie aggressive o letali.4950Altri studi prospettici hanno riportato associazioni positive per la malattia totale e associazioni nulle per la malattia letale,5152o un’associazione significativa a forma di U per la malattia totale e aggressiva53; mentre, una meta-analisi di 17 studi prospettici pubblicati nel 2014 ha osservato un aumento significativo del rischio di cancro alla prostata totale (rischio relativo 1,18, intervallo di confidenza del 95% da 1,07 a 1,30) per il più alto rispetto alle concentrazioni più basse di 25(OH)D circolante.54 Un ampio consorzio di coorte di 10.018 casi di tumore totale della prostata e 11.052 controlli ha trovato un’associazione significativa tra un punteggio di rischio genetico dei quattro singoli polimorfismi nucleotidici associati alla vitamina D e il rischio di un tumore alla prostata aggressivo, ma non totale.55 La nostra analisi di randomizzazione mendeliana su 22-898 casi e 23-054 controlli non ha trovato alcuna forte evidenza di un’associazione tra concentrazioni geneticamente determinate di 25(OH)D circolanti e il rischio di cancro alla prostata totale o aggressivo.
Cancro alle ovaie
Pochi studi epidemiologici prospettici hanno esaminato l’associazione tra le concentrazioni di 25(OH)D circolanti e il rischio di cancro ovarico, e la maggior parte ha dato risultati nulli.4056Un recente studio di randomizzazione mendeliano di Ong e colleghi ha osservato una significativa diminuzione (odds ratio 0,988, intervallo di confidenza del 95% 0,979 a 0,997) del rischio di cancro ovarico per 1 nmol/L aumento delle concentrazioni di 25(OH)D,57 che si traduce in un odds ratio di 1,27 (1,06 a 1,51) per 20 nmol/L diminuzione di 25(OH)D. Questo studio è stato il doppio del nostro studio di randomizzazione mendeliano per le associazioni gene-risultato, ma ha utilizzato tre invece di quattro polimorfismi nucleotidici singoli polimorfismi.57 Inoltre, gli autori hanno usato una stima pubblicata per l’associazione tra le concentrazioni di rs2282679 e 25(OH)D da una piccola coorte di 2347 partecipanti,43 mentre la nostra analisi ha usato stime pubblicate da una grande meta-analisi di circa 38.000 partecipanti.28 Non abbiamo trovato un’associazione significativa (odds ratio per unità di incremento di 25(OH)D, 1,005, 0,994 a 1,016). Quando abbiamo ri-analizzato lo studio di randomizzazione mendeliano utilizzando tre (rs2282679, rs10741657, rs12785878) invece di quattro polimorfismi o utilizzando la stessa stima per l’associazione tra rs2282679 con concentrazioni di 25(OH)D come nell’articolo di Ong e colleghi, abbiamo osservato risultati non significativi quasi identici. Pertanto, la piccola differenza tra i due studi di randomizzazione mendeliana è plausibile e può essere spiegata dalla maggiore potenza statistica dell’associazione gene-risultato nello studio precedente.
Cancro al polmone e al pancreas e neuroblastoma
Ci sono limitate prove epidemiologiche per un ruolo della vitamina D nel rischio di cancro al polmone e al pancreas e neuroblastoma. Una meta-analisi di 10 studi prospettici ha riportato una riduzione significativa (rischio relativo 0,95, intervallo di confidenza del 95% da 0,91 a 0,99) del rischio di cancro ai polmoni per ogni incremento di 10 nmol/L in concentrazione 25(OH)D, ma l’eterogeneità tra gli studi era grande ed è stata suggerita una potenziale relazione non lineare.41 Non abbiamo osservato un’associazione significativa tra le concentrazioni di 25(OH)D geneticamente determinate e il rischio di cancro al polmone o al pancreas o di neuroblastoma nell’attuale studio di randomizzazione di Mendelian, ma il nostro studio non è stato in grado di rilevare le piccole dimensioni dell’effetto suggerite dalla meta-analisi pubblicata per il cancro al polmone.
Punti di forza e limiti di questo studio
Il principale vantaggio degli studi di randomizzazione mendeliani è che evitano i pregiudizi comunemente presenti nella letteratura osservazionale convenzionale. Le stime che ne risultano hanno un’interpretazione causale solo se le ipotesi del metodo tengono. Sebbene non sia possibile dimostrare la validità delle ipotesi, abbiamo effettuato analisi di sensibilità e utilizzato diversi test statistici per cercare potenziali violazioni. Non abbiamo trovato alcuna prova di violazione, anche se alcuni dei test statistici hanno un basso potere di rilevazione quando vengono utilizzati pochi strumenti genetici (per esempio, MR-Egger).34 I precedenti studi di randomizzazione mendeliani sulla vitamina D e sul rischio di cancro o di morte che utilizzavano dati a livello individuale, tuttavia, non suggerivano alcuna violazione delle ipotesi.942Abbiamo usato dati sommari per sette tumori e diversi dei loro sottotipi, utilizzando migliaia di casi di cancro e controlli di diversi grandi consorzi genetici e studi di associazione a livello genomico pubblicati. Siamo stati in grado di rilevare dimensioni di effetti di moderata entità per la maggior parte degli esiti del cancro primario, ma non possiamo escludere l’esistenza di effetti causali clinicamente rilevanti di bassa entità.
Nell’interpretare i nostri risultati si dovrebbero considerare anche diversi limiti. I dati di livello sommario che abbiamo utilizzato non hanno permesso di effettuare analisi stratificate per covariate di interesse, come l’età, il sesso, lo stato della menopausa, il fumo, l’indice di massa corporea (IMC), e l’uso di una terapia ormonale sostitutiva o di altri geni correlati o a seconda che le popolazioni fossero o meno carenti di vitamina D. Inoltre, non abbiamo potuto esplorare le potenziali associazioni non lineari tra le concentrazioni di 25(OH)D e il rischio di cancro, che sono state suggerite da alcuni studi. Inoltre, i polimorfismi mono nucleotidici attualmente noti associati alla vitamina D rappresentano solo una piccola parte della varianza osservata nella concentrazione di 25(OH)D, ma precedenti studi di randomizzazione mendeliana hanno identificato associazioni significative tra la vitamina D e diversi risultati.9435758Inoltre, questi singoli polimorfismi nucleotidici non predicono concentrazioni di 1,25-diidrossivitamina D, che è il metabolita biologicamente più attivo della vitamina D, e inoltre non possono prevedere concentrazioni di vitamina D a livello cellulare. Pertanto, i nostri risultati non possono essere considerati definitivi. Futuri grandi consorzi di pooling, studi di associazione a livello genomico più ampi di concentrazione di 25(OH)D e studi di randomizzazione mendeliana con dati a livello individuale potrebbero affrontare questi ultimi problemi. Inoltre, sono in corso studi su larga scala, sulla popolazione generale, studi di integrazione di vitamina D ad alte dosi, progettati per superare molti dei limiti degli studi precedenti (come le dimensioni modeste, la dose inadeguata, la durata relativamente breve e il numero ridotto di tumori)5960 e potrebbero fornire una migliore comprensione del ruolo dell’integrazione per lo sviluppo e la morte a causa di esiti non scheletrici.
Conclusione
In sintesi, utilizzando uno studio completo di randomizzazione mendeliana, abbiamo trovato poche prove di associazioni causali lineari tra i determinanti genetici della concentrazione di vitamina D in circolazione e il rischio di cancro colorettale, al seno, alla prostata, alle ovaie, ai polmoni e al pancreas e di neuroblastoma, ma non possiamo escludere l’esistenza di effetti causali clinicamente rilevanti di bassa entità. I nostri risultati, in combinazione con la letteratura precedente, forniscono la prova che lo screening a livello di popolazione per la carenza di vitamina D e la successiva integrazione diffusa di vitamina D non dovrebbero essere attualmente raccomandati come strategia per la prevenzione primaria del cancro.
Ciò che è già noto su questo argomento
- Si discute se lo stato della vitamina D sia legato alla malattia o se sia solo un indicatore correlato della salute generale
- Le prove di studi in vitro e di modelli animali supportano un ruolo anti-neoplastico della vitamina D, ma gli studi epidemiologici e gli studi controllati randomizzati hanno dato risultati contrastanti.
Cosa aggiunge questo studio
- Questo studio di randomizzazione mendeliana fornisce poche prove di un’associazione causale lineare tra la concentrazione di vitamina D in circolazione e il rischio di cancro colorettale, al seno, alla prostata, alle ovaie, ai polmoni e al pancreas e di neuroblastoma, ma non si può escludere l’esistenza di effetti clinicamente rilevanti di bassa entità.
- Lo screening a livello di popolazione per la carenza di vitamina D e la successiva diffusa integrazione di vitamina D non può essere attualmente raccomandato come strategia per la prevenzione primaria del cancro.
References
- Nat Rev Cancer. 2014; 14:342-57. Publisher Full Text | DOI | PubMed
- Cancer Prev Res (Phila). 2011; 4:735-43. Publisher Full Text | DOI | PubMed
- Adv Exp Med Biol. 2014; 810:17-32. Publisher Full Text | PubMed
- BMJ. 2014; 348:g2035. Publisher Full Text | DOI | PubMed
- Adv Exp Med Biol. 2014; 810:33-51. Publisher Full Text | PubMed
- Nutr Cancer. 2011; 63:827-41. Publisher Full Text | DOI | PubMed
- Br J Cancer. 2014; 111:976-80. Publisher Full Text | DOI | PubMed
- Cochrane Database Syst Rev. 2014; 1:CD007470. Publisher Full Text
- BMJ. 2014; 349:g6330. Publisher Full Text | DOI | PubMed
- Am J Clin Nutr. 2016; 103:965-78. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2003; 32:1-22. Publisher Full Text | DOI | PubMed
- Publisher Full Text
- Publisher Full Text
- Publisher Full Text
- World J Gastroenterol. 2015; 21:8868-77. Publisher Full Text | DOI | PubMed
- Nat Genet. 2009; 41:986-90. Publisher Full Text | DOI | PubMed
- Carcinogenesis. 2013; 34:605-11. Publisher Full Text | DOI | PubMed
- DOI
- Genet Epidemiol. 2013; 37:25-37. Publisher Full Text | DOI | PubMed
- Nat Genet. 2012; 44:955-9. Publisher Full Text | DOI | PubMed
- J Natl Cancer Inst. 2015; 107:djv246. Publisher Full Text | DOI | PubMed
- Gut. 2014; 63:800-7. Publisher Full Text | DOI | PubMed
- Nat Genet. 2014; 46:1103-9. Publisher Full Text | DOI | PubMed
- Nat Genet. 2013; 45:385-91, e1-2. Publisher Full Text | DOI | PubMed
- Hum Mol Genet. 2010; 19:2739-45. Publisher Full Text | DOI | PubMed
- Lancet. 2010; 376:180-8. Publisher Full Text | DOI | PubMed
- Genet Epidemiol. 2013; 37:92-8. Publisher Full Text | DOI | PubMed
- PLoS Med. 2013; 10:e1001383. Publisher Full Text | DOI | PubMed
- Eur Urol. 2015; 67:649-57. Publisher Full Text | DOI | PubMed
- Genet Epidemiol. 2013; 37:658-65. Publisher Full Text | DOI | PubMed
- PLoS Genet. 2012; 8:e1002607. Publisher Full Text | DOI | PubMed
- Stat Methods Med Res. 2007; 16:309-30. Publisher Full Text | DOI | PubMed
- J Am Stat Assoc. 1996; 91:444-55. DOI
- Int J Epidemiol. 2015; 44:512-25. Publisher Full Text | DOI | PubMed
- Genet Epidemiol. 2016; 40:304-14. Publisher Full Text | DOI | PubMed
- Am J Epidemiol. 2012; 175:332-9. Publisher Full Text | DOI | PubMed
- J Clin Oncol. 2011; 29:3775-82. Publisher Full Text | DOI | PubMed
- Int J Cancer. 2011; 128:1414-24. Publisher Full Text | DOI | PubMed
- Cancer Causes Control. 2011; 22:319-40. Publisher Full Text | DOI | PubMed
- Gynecol Oncol. 2011; 121:369-75. Publisher Full Text | DOI | PubMed
- Cancer Causes Control. 2015; 26:1719-28. Publisher Full Text | DOI | PubMed
- PLoS One. 2012; 7:e37662. Publisher Full Text | DOI | PubMed
- PLoS Med. 2015; 12:e1001866. Publisher Full Text | DOI | PubMed
- Cancer Epidemiol Biomarkers Prev. 2013; 22:2037-46. Publisher Full Text | DOI | PubMed
- Medicine (Baltimore). 2013; 92:123-31. Publisher Full Text | DOI | PubMed
- Tumour Biol. 2013; 34:3509-17. Publisher Full Text | DOI | PubMed
- J Natl Cancer Inst. 2008; 100:1581-91. Publisher Full Text | DOI | PubMed
- Cancer Epidemiol Biomarkers Prev. 2015; 24:627-30. Publisher Full Text | DOI | PubMed
- J Natl Cancer Inst. 2012; 104:690-9. Publisher Full Text | DOI | PubMed
- Int J Cancer. 2012; 131:1187-96. Publisher Full Text | DOI | PubMed
- Cancer Epidemiol Biomarkers Prev. 2011; 20:1850-60. Publisher Full Text | DOI | PubMed
- Cancer. 2015; 121:1949-56. Publisher Full Text | DOI | PubMed
- Cancer Epidemiol Biomarkers Prev. 2014; 23:1494-504. Publisher Full Text | DOI | PubMed
- J Cancer Res Clin Oncol. 2014; 140:1465-77. Publisher Full Text | DOI | PubMed
- Cancer Epidemiol Biomarkers Prev. 2013; 22:688-96. Publisher Full Text | DOI | PubMed
- Am J Epidemiol. 2010; 172:70-80. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2016; 45:1619-30. Publisher Full Text | DOI | PubMed
- Neurology. 2016; 87:2567-74. Publisher Full Text | DOI | PubMed
- Contemp Clin Trials. 2012; 33:159-71. Publisher Full Text | DOI | PubMed
- Contemp Clin Trials. 2016; 48:83-90. Publisher Full Text | DOI | PubMed
Fonte
Dimitrakopoulou VI, Tsilidis KK, Haycock PC, Dimou NL, Al-Dabhani K, et al. (2017) Circulating vitamin D concentration and risk of seven cancers: Mendelian randomisation study. The BMJ 359j4761. https://doi.org/10.1136/bmj.j4761





