Secondo una revisione sistematica degli studi condotti dal 2000 al 2016, le prevalenze stimate di clamidia rettale e gonorrea tra gli MSM erano rispettivamente del 9,0% e del 6,1% (5). Sono disponibili meno dati sulla clamidia faringea e la gonorrea; le stime di prevalenza sono state dello 0%-3,6% per la clamidia faringea e dello 0%-16,5% per la gonorrea faringea tra gli MSM (6). Quasi tutte le prevalenze riportate di infezioni extragenitali tra gli MSM sono state stimate da campioni clinici di pazienti. Poiché gli uomini di questi campioni hanno richiesto cure cliniche (e potrebbero essere ad alto rischio di MSM, specialmente se visti in una clinica di MSM), le stime riportate potrebbero non riflettere le prevalenze tra una più ampia popolazione di MSM. Per informare l’epidemiologia delle malattie sessualmente trasmissibili batteriche tra gli MSM, è stato offerto uno screening per la clamidia extragenitale e la gonorrea agli MSM reclutati per partecipare alla NHBS in cinque città statunitensi (Houston, Texas; Miami, Florida; New York City, New York; San Francisco, California; e Washington, DC). L’NHBS ha valutato l’aderenza alle attuali raccomandazioni di screening utilizzando la domanda “Negli ultimi 12 mesi, è stato sottoposto al test di un medico o di un altro operatore sanitario per una malattia sessualmente trasmissibile come la gonorrea, la clamidia o la sifilide? Non includere i test per l’HIV o l’epatite”.
La NHBS conduce indagini comportamentali anonime a rotazione tra le popolazioni ad alto rischio di HIV negli Stati Uniti (7). Nel 2017, i partecipanti MSM sono stati reclutati in luoghi frequentati dalla comunità MSM (ad esempio, bar, club, centri fitness e altri luoghi patrocinati da MSM) ed erano idonei se erano di sesso maschile alla nascita, identificati come maschi, avevano un’età ≥18 anni, avevano dichiarato di aver avuto rapporti sessuali con un maschio, risiedevano nella città di amministrazione, non avevano precedentemente completato il sondaggio NHBS nel ciclo attuale, e potevano completare il sondaggio in inglese o spagnolo. Questa analisi è stata limitata ai partecipanti che hanno avuto rapporti sessuali con un maschio nei 12 mesi precedenti. I partecipanti hanno completato un’indagine di intervista personale standardizzata assistita da un intervistatore, che ha raccolto caratteristiche sociodemografiche ed epidemiologiche. A tutti i partecipanti è stato offerto un test HIV anonimo. Ai partecipanti sono stati forniti dei gettoni di apprezzamento in denaro per la partecipazione; gli importi sono stati determinati a livello locale. Le attività dell’NHBS sono state esaminate presso il CDC come ricerca non impegnata e approvate dai comitati di revisione istituzionali locali per ogni sede partecipante.
Ai partecipanti all’NHBS sono stati offerti ulteriori segni di apprezzamento per aver fornito tamponi rettali e faringei raccolti in modo anonimo per il test della clamidia e della gonorrea. CDC ha testato campioni provenienti da quattro delle città utilizzando il sistema Aptima Combo 2 Panther (Hologic), e il San Francisco Department of Public Health Laboratory ha testato campioni provenienti da San Francisco utilizzando lo stesso test. I risultati dei test sono stati comunicati ai team locali dell’NHBS per la notifica e i riferimenti al trattamento quando indicato, utilizzando identificatori numerici per mantenere l’anonimato dei partecipanti. I risultati del test sono stati collegati ai dati del sondaggio completato e ai risultati del test HIV. La prevalenza di STD è stata calcolata come il numero di persone con risultati positivi del test diviso per il numero totale di persone testate con un risultato valido, stratificato per sito anatomico (retto e orofaringe) e STD (clamidia e gonorrea) con intervalli di confidenza di Wald del 95% (CI) e analisi bivariate per il confronto delle caratteristiche. Le analisi sono state eseguite utilizzando il software SAS (versione 9.4; SAS Institute).
Dei 2.371 MSM ammissibili che hanno partecipato a NHBS nelle cinque città, 2.077 (87,6%) hanno fornito campioni per l’analisi di STD, 2.044 (98,4%) dei quali hanno fornito sia tamponi rettali che faringei. L’analisi ha coinvolto 2.075 partecipanti, dopo aver escluso due che non avevano ottenuto risultati validi. Complessivamente, il 13,3% (95% CI = 11,8%-14,8%) dei partecipanti è stato infettato da almeno una delle due STD in uno o due siti anatomici. La prevalenza della clamidia rettale (7,3%) era superiore a quella della gonorrea rettale (4,5%; p<0,001), mentre la prevalenza della gonorrea faringea (4,6%) era superiore a quella della clamidia faringea (1,4%; p<0,001) (Figura). La prevalenza della gonorrea rettale era più alta tra gli MSM che hanno riferito di essere sieropositivi rispetto a quelli che erano HIV-negativi (8,2% contro il 3,3%; p<0,001) (Tabella). Le prevalenze di entrambe le infezioni faringee erano simili tra coloro che hanno effettuato il test HIV-positivo e HIV-negativo. La prevalenza dell’infezione era più alta negli uomini più giovani (di età compresa tra i 18 e i 29 anni), rispetto agli uomini più anziani per ogni tipo e sito anatomico di infezione, ad eccezione della clamidia faringea. Il MSM nero e quello ispanico avevano prevalenze di gonorrea faringea più elevate rispetto al MSM bianco, altrimenti non sono state osservate differenze per categorie razziali/etniche. San Francisco aveva le prevalenze più basse per ogni agente patogeno e sito anatomico; le prevalenze per ogni infezione variavano a seconda della città di residenza(Tabella).
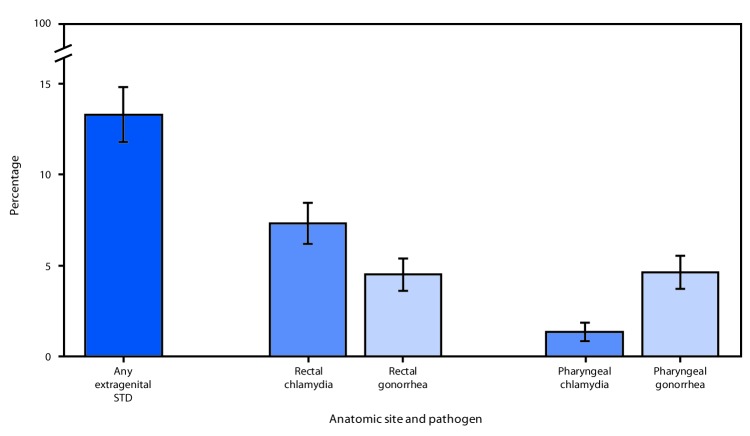
FIGURA.Prevalenza di clamidia e gonorrea extragenitale tra gli uomini che frequentano i locali della comunità* e che hanno rapporti sessuali con uomini, per sito anatomico – National HIV Behavioral Surveillance, cinque città americane† , 2017Abbreviazioni: HIV = virus dell’immunodeficienza umana; STD = malattia sessualmente trasmissibile.* I luoghi della comunità includono bar, club, centri fitness e altri luoghi frequentati da uomini che hanno rapporti sessuali con altri uomini.† Houston, Texas; Miami, Florida; New York City, New York; San Francisco, California; Washington, DC.
| Caratteristica | N. (%) di tutti i partecipanti | Prevalenza (95% CI) | |||
|---|---|---|---|---|---|
| Clamidia rettale (n. testato = 2.024) | Gonorrea rettale (n. testato = 2.023) | Clamidia faringea (n. testato = 2.072) | Gonorrea faringea (n. testato = 2.072) | ||
| Complessivamente | 2,075 (100) | 7.3 (6.2–8.5) | 4.5 (3.6–5.4) | 1.4 (0.9–1.9) | 4.6 (3.7–5.5) |
| Fascia d’età (anni) | |||||
| 18–29 | 737 (35.5) | 9.2 (7.1–11.4) | 6.2 (4.5–8.0) | 1.8 (0.8–2.7) | 6.0 (4.3–7.7) |
| 30–39 | 676 (32.6) | 7.4 (5.4–9.4) | 4.2 (2.7–5.8) | 1.3 (0.5–2.2) | 4.9 (3.3–6.5) |
| 40–49 | 330 (15.9) | 6.2 (3.6–8.8) | 3.4 (1.4–5.4) | 0.9 (0.0–1.9) | 3.3 (1.4–5.3) |
| ≥50 | 332 (16.0) | 3.8 (1.7–5.9) | 2.2 (0.6–3.9) | 0.9 (0.0–1.9) | 2.4 (0.8–4.1) |
| Gara/Etnia | |||||
| Ispanico | 733 (35.3) | 7.5 (5.6–9.5) | 4.9 (3.3–6.5) | 2.0 (1.0–3.1) | 5.3 (3.7–7.0) |
| Bianco, non ispanico | 688 (33.2) | 7.3 (5.3–9.3) | 3.9 (2.4–5.3) | 0.9 (0.2–1.6) | 3.2 (1.9–4.5) |
| Nero, non ispanico | 455 (21.9) | 7.2 (4.8–9.6) | 5.6 (3.5–7.7) | 1.3 (0.3–2.4) | 6.6 (4.3–8.9) |
| Altro | 187 (9.0) | 7.3 (3.5–11.1) | 2.2 (0.1–4.4) | 0.5 (0.0–1.6) | 2.7 (0.4–5.0) |
| Sconosciuto | 12 (0.6) | N/A | N/A | N/A | N/A |
| Risultati del test HIV† | |||||
| HIV-negativo | 1,577 (76.0) | 6.6 (5.3–7.8) | 3.3 (2.4–4.1) | 1.3 (0.7–1.8) | 4.3 (3.3–5.3) |
| Sieropositivo | |||||
| Sieropositivo dichiarato | 386 (18.6) | 9.0 (6.1–11.9) | 8.2 (5.5–11.0) | 1.6 (0.3–2.8) | 5.2 (3.0–7.4) |
| Non si è dichiarato sieropositivo | 73 (3.5) | 9.9 (2.9–16.8) | 5.6 (0.3–11.0) | 2.7 (0.0–6.5) | 5.5 (0.3–10.7) |
| Non sono disponibili risultati di test validi | 39 (1.9) | N/A | N/A | N/A | N/A |
| Test di STD nei 12 mesi precedenti§ | |||||
| Testato | 1,371 (66.1) | 7.1 (5.7–8.5) | 4.2 (3.1–5.3) | 1.2 (0.6–1.7) | 4.5 (3.4–5.6) |
| Non testato | 698 (33.6) | 7.8 (5.8–9.8) | 5.0 (3.4–6.6) | 1.7 (0.8–2.7) | 4.7 (3.2–6.3) |
| Non so, non so | 6 (0.3) | N/A | N/A | N/A | N/A |
| Città di residenza | |||||
| Houston, Texas | 468 (22.6) | 8.0 (5.5–10.4) | 6.7 (4.4–9.0) | 2.8 (1.3–4.3) | 6.2 (4.0–8.4) |
| Miami, Florida | 345 (16.6) | 5.6 (3.1–8.0) | 5.6 (3.1–8.0) | 1.4 (0.2–2.7) | 4.6 (2.4–6.9) |
| New York City, New York | 425 (20.5) | 7.2 (4.7–9.7) | 4.3 (2.4–6.3) | 0.9 (0.0–1.9) | 3.8 (2.0–5.6) |
| San Francisco, California | 418 (20.1) | 5.2 (3.0–7.4) | 1.8 (0.5–3.1) | 0.7 (0.0–1.5) | 3.6 (1.8–5.4) |
| Washington, DC | 419 (20.2) | 10.1 (7.2–13.1) | 3.9 (2.0–5.7) | 0.7 (0.0–1.5) | 4.8 (2.7–6.8) |
Complessivamente, 698 (33,6%) partecipanti al MSM hanno riferito di non essere stati testati per una STD nei 12 mesi precedenti(Tabella). La prevalenza è stata simile per i MSM che hanno fatto e non hanno riferito di aver effettuato recenti test per le malattie sessualmente trasmissibili, indipendentemente dal sito anatomico o dall’agente patogeno.
Discussione
In un campione di MSM sessualmente attivo in una sede della comunità, circa un partecipante su otto è risultato positivo alla clamidia rettale o faringea o alla gonorrea. Rispetto alle stime di prevalenza di clamidia e gonorrea tra gli MSM derivati da campioni prevalentemente clinici (5,6), queste stime sono inferiori. Le persone sottoposte a screening per le malattie sessualmente trasmissibili in ambienti clinici (spesso cliniche per le malattie sessualmente trasmissibili) potrebbero rappresentare una popolazione a più alto rischio (ad esempio, malattie sessualmente trasmissibili precedenti, un numero maggiore di partner sessuali e un’esposizione nota o sospetta a malattie sessualmente trasmissibili) (8). Questa analisi dimostra che il rischio di clamidia e gonorrea potrebbe essere elevato anche tra gli MSM se campionati in luoghi non clinici della comunità MSM. Questo risultato suggerisce che la popolazione generale di MSM sessualmente attiva potrebbe essere ad alto rischio di MSM e che le stime della prevalenza di STD batterica da campioni clinici di MSM basati su STD potrebbero non essere sostanzialmente influenzate.
L’attuale raccomandazione per la MSM sessualmente attiva è di effettuare uno screening per le MSM in tutti i siti anatomici esposti almeno una volta all’anno (4), e gli MSM che vivono con l’infezione da HIV hanno probabilmente maggiori opportunità di screening delle MST quando sono in cura. Questo studio ha trovato un’alta prevalenza di clamidia e gonorrea extragenitale tra gli MSM che vivono con l’HIV, e i risultati rafforzano le attuali linee guida per la cura dell’HIV, che raccomandano che gli MSM che riferiscono di avere rapporti sessuali anali e orali ricettivi dovrebbero essere sottoposti a screening per la gonorrea rettale e faringea e la clamidia, rispettivamente, alla loro visita iniziale e almeno una volta l’anno dopo (9).
Tra questo campione di MSM reclutato nei locali della comunità, circa un terzo ha riferito di non essere stato sottoposto a test per una MSM nei 12 mesi precedenti, suggerendo che un numero sostanziale di MSM ad alto rischio di MSM non è stato sottoposto a screening per le MST secondo le attuali raccomandazioni. Sebbene la prevalenza di MSM extragenitale tra questi uomini sia stata elevata, la prevalenza è stata altrettanto elevata tra gli MSM che hanno riferito di essere stati testati negli ultimi 12 mesi. Tra quelli testati nei 12 mesi precedenti, questa indagine non ha registrato quali test sono stati eseguiti o con quale frequenza sono stati testati questi uomini. Uno screening più frequente (ad esempio, ogni 3-6 mesi) di MSM con rischio elevato potrebbe essere necessario per ridurre la prevalenza tra coloro che sono già stati sottoposti a screening per le malattie sessualmente trasmissibili.
I risultati di questo rapporto sono soggetti ad almeno quattro limitazioni. In primo luogo, lo screening NHBS STD comprendeva solo cinque città statunitensi. Sebbene le città fossero geograficamente e sociodemograficamente diverse, l’estrapolazione a tutte le città statunitensi non è appropriata. In secondo luogo, gli MSM sono stati reclutati attraverso un campionamento basato sulla comunità locale, non sul campionamento di probabilità; pertanto, un’ulteriore estrapolazione alla popolazione MSM all’interno delle cinque città non è possibile. In terzo luogo, questa indagine è stata limitata allo screening della clamidia faringea e rettale e alla gonorrea; non sono stati raccolti campioni urogenitali o di urine. La maggior parte degli MSM con infezione urogenitale asintomatica sono infettati anche nei siti extragenitali (10); pertanto, è improbabile che sia mancato un gran numero di persone infette che sarebbero state individuate se la NHBS avesse effettuato lo screening urogenitale. Infine, i dati autodenunciati sui test delle STD nei 12 mesi precedenti potrebbero sopravvalutare l’aderenza alle attuali raccomandazioni di screening, perché comprendevano qualsiasi test delle STD, non specificamente test per la clamidia e la gonorrea extragenitale nei siti anatomici di esposizione.
Tra un campione di MSM che frequentava le sedi della comunità in cinque città degli Stati Uniti, circa uno su otto aveva un’infezione da clamidia o gonorrea in un sito extragenitale. Secondo le linee guida del CDC, gli MSM sessualmente attivi dovrebbero essere sottoposti a screening almeno una volta all’anno per le MSM nei siti anatomici esposti, compreso uno screening più frequente (ad esempio, ogni 3-6 mesi) negli MSM ad alto rischio di MSM (4,9). Nonostante la raccomandazione di screening, un MSM su tre in questo studio non ha riportato test di STD nei 12 mesi precedenti. La natura asintomatica delle MST extragenitali e le elevate prevalenze riscontrate in questa popolazione supportano ulteriormente la necessità di uno screening regolare di tutti gli MSM sessualmente attivi in tutti i siti anatomici di esposizione. Un migliore accesso a cure culturalmente competenti e l’adesione dei medici alle linee guida per lo screening di MSM sono componenti fondamentali per ridurre le disparità di STD che colpiscono questa popolazione.
Cosa si sa già su questo argomento?
Gli uomini che hanno rapporti sessuali con altri uomini (MSM) sono colpiti in modo sproporzionato dalle malattie sessualmente trasmissibili (MST) e dal virus dell’immunodeficienza umana (HIV). La maggior parte dei dati sulla prevalenza delle MSM STD provengono dai partecipanti alle cliniche STD e HIV.
Cosa viene aggiunto da questo rapporto?
Nel 2017, in cinque città, circa una persona su otto aveva un’infezione extragenitale da clamidia o gonococco. La prevalenza della gonorrea rettale era più alta negli MSM infettati dall’HIV che in quelli non infettati dall’HIV.
Quali sono le implicazioni per la pratica sanitaria pubblica?
Gli MSM sessualmente attivi dovrebbero essere sottoposti a screening per la clamidia e la gonorrea almeno una volta all’anno in tutti i siti anatomici esposti; alcuni MSM potrebbero beneficiare di uno screening più frequente.
References
- CDC. 2018. Publisher Full Text
- Antimicrobial resistance in Neisseria gonorrhoeae in the 21st century: past, evolution, and future.. Clin Microbiol Rev. 2014; 27:587-613. DOI | PubMed
- From epidemiological synergy to public health policy and practice: the contribution of other sexually transmitted diseases to sexual transmission of HIV infection.. Sex Transm Infect. 1999; 75:3-17. DOI | PubMed
- Sexually transmitted diseases treatment guidelines, 2015.. MMWR Recomm Rep. 2015; 64(RR-03)PubMed
- Prevalence of rectal chlamydial and gonococcal infections: a systematic review.. Sex Transm Dis. 2018; 45:287-93. PubMed
- Extragenital infections caused by Chlamydia trachomatis and Neisseria gonorrhoeae: a review of the literature.. Infect Dis Obstet Gynecol. 2016; 2016DOI | PubMed
- Behavioral surveillance among people at risk for HIV infection in the U.S.: the National HIV Behavioral Surveillance System.. Public Health Rep. 2007; 122(Suppl 1):32-8. DOI | PubMed
- Studies relying on passive retrospective cohorts developed from health services data provide biased estimates of incidence of sexually transmitted infections.. Sex Transm Dis. 2004; 31:596-600. DOI | PubMed
- CDC; Health Resources and Services Administration; National Institutes of Health; American Academy of HIV Medicine; Association of Nurses in AIDS Care; International Association of Providers of AIDS Care; National Minority AIDS Council; Urban Coalition of HIV/AIDS Prevention Services.Publisher Full Text
- Infections missed by urethral-only screening for chlamydia or gonorrhea detection among men who have sex with men.. Sex Transm Dis. 2011; 38:922-4. DOI | PubMed
Fonte
Johnson Jones ML, Chapin-Bardales J, Bizune D, Papp JR, Phillips C, et al. (2019) Extragenital Chlamydia and Gonorrhea Among Community Venue–Attending Men Who Have Sex with Men — Five Cities, United States, 2017. Morbidity and Mortality Weekly Report 68(14): . https://doi.org/10.15585/mmwr.mm6814a1





