Abstract
Introduzione
I neuroni sono il tipo di cellula strutturalmente più vario e complesso che conosciamo(Bullock e Horridge, 1965). I loro alberelli sono fondamentali per la raccolta, l’integrazione e la diffusione di informazioni tra i diversi partner sinaptici. Durante lo sviluppo, gli arboricelli crescono dinamicamente e questa morfogenesi pone dei limiti alla loro posizione finale, ai possibili partner sinaptici e alle proprietà elettrofisiologiche del nucleo(Chagnac-Amitai et al., 1990; Roberts et al., 2014). Sebbene vi siano forme specifiche riconoscibili di tipo cellulare, ogni singolo neurone ha un proprio modello unico di ramificazione e connettività. Si ritiene che le “regole generative” per la costruzione di complessi arboricelli siano codificate da algoritmi genetici che si svolgono in diversi contesti di sviluppo per produrre tipi morfologici distinti (Cuntz etal., 2010; Teeter e Stevens, 2011; Chen e Haas, 2011; Hassan e Hiesinger, 2015). Quali siano le molecole e i meccanismi alla base di questi algoritmi rimane un’importante domanda senza risposta all’interno delle neuroscienze.
Dalle osservazioni sulle prime fasi della crescita di dendriti motoneuronali nel midollo spinale, Vaughn e colleghi hanno trasmesso l’ipotesi sinaptotropica(Vaughn et al., 1974, 1988). L’ipotesi sinaptoptopica presuppone che la stabilità dei rami assonali e dendritici in crescita sia controllata dalla stabilizzazione selettiva dei processi da parte delle sinapsi nascenti, favorendo la crescita in territori ricchi di potenziali partner sinaptici. Berry e colleghi, lavorando sulle cellule di Purkinje, hanno trasmesso la stessa idea, chiamandola teoria filopodiale sin aptogena(Berry e Bradley, 1976). Da allora, l’imaging dal vivo nei cervelli dei vertebrati ha rivelato una crescita dinamica assonale e dendritica(Kaethner e Stuermer, 1992; Wu et al., 1999; Jontes et al., 2000; Hossain et al., 2012) dove l’arrivo e la localizzazione dei macchinari sinaptici è correlata alla stabilizzazione dei rami(Alsina et al., 2001; Niell et al., 2004; Meyer e Smith, 2006; Ruthazer et al., 2006). I dati sulla crescita dendritica dei neuroni tettali di Xenopus hanno rivelato un ruolo per Neurexin (Nrx) e Neuroligin (Nlg) nella dinamica dei rami, per cui si ritiene che le interazioni Nrx-Nlg dirigano la genesi e la maturazione degli emisinapi opposti, dopo di che la neurotrasmissione stabilizza i rami(Chen et al., 2010). L’idea che la trasmissione sinaptica stabilizzi i contatti nascenti durante l’elaborazione è supportata da una serie di studi(Rajan et al., 1999; Sin et al., 2002; Ruthazer et al., 2003; Haas et al., 2006; Ruthazer et al., 2006). Tuttavia, altri lavori hanno suggerito che l’attività ha uno scarso impatto sulle caratteristiche di crescita degli alberi su larga scala, ma gioca un ruolo più sfumato nel raffinare la connettività strutturale durante la plasticità dipendente dall’attività(Verhage et al., 2000; Varoqueaux et al., 2002; Hua et al., 2005; Ben Fredj et al., 2010).
Da questo lavoro emergono due domande chiave: in primo luogo, i rami in crescita sono stabilizzati da eventi locali “sinaptogeni”? In secondo luogo, queste sinapsi nascenti vengono “testate” dalla neurotrasmissione convenzionale? Qui descriviamo un nuovo sistema che abbiamo sperimentato a Drosophila per esplorare queste domande. A differenza dell’embrione della mosca, dove gli arborisations sono molto piccoli e costruiti molto rapidamente (<4 ore), il nostro sistema sfrutta i grandi arborisations assonali dei motoneuroni del muscolo pleurico (PM-Mns) che sono costruiti per un periodo prolungato, durante la metamorfosi. Inoltre, a differenza dei terminali dei motoneuroni larvali, che crescono in scala incrementale con i cambiamenti delle dimensioni del muscolo durante la vita larvale, gli arborisations assonali PM-Mn crescono in modo esuberante, per prova ed errore, molto simili ai neuroni complessi che si trovano nei sistemi nervosi centrali dei vertebrati.
Durante lo sviluppo vediamo una relazione coerente tra la distribuzione dei macchinari presinaptici e la dinamica dei rami, simile a quella che si trova negli assoni delle cellule dei gangli della retina nei pesci e nelle rane. È importante notare che la crescita dei rami è guidata da complessi dinamici formatisi tra i partner sinaptici che chiamiamo ‘complessi di adesione neuritici’ (CNA). Questi NAC contengono Nlg1 (postsinapticamente), insieme a Nrx, Syd1 e Liprin-α (presinapticamente), e agiscono localmente per stabilizzare i filopodi con unmeccanismo di ‘bastone ecrescere’ senza la necessità di macchinari per il rilascio delle vescicole sinaptiche o sinapsi funzionali.
Risultati
Stabilire un nuovo modello per esplorare la crescita dell’arboricoltura complessa
Nella ricerca di un sistema per studiare dal vivo la crescita di pergole complesse, in vivo, abbiamo individuato le pergole assonali dei motoneuroni che innervano i muscoli pleurici addominali della mosca adulta. Ci riferiamo a questi come i motoneuroni del muscolo pleurico (PM-Mns), le cui pergole assonali sono grandi, complesse e facilmente accessibili durante la metamorfosi. È importante notare che il sistema PM-Mn permette di manipolare geneticamente l’uno o l’altro partner sinaptico, mentre l’altro è in grado di visualizzare l’altro in modo indipendente.
Ogni emisegmento addominale adulto (da A1-A7) contiene una coppia di motoneuroni che escono dal nervo sulla parete laterale del corpo(Figura 1A). Nell’adulto, ogni motoneurone forma un arborisation che innerva tra 15 e 18 fibre muscolari parallele che abbracciano il tronco-ventrale, dai tergiti agli sterniti(Figura 1B). In contrasto con la rigida, target-specificità che si trova nel sistema neuromuscolare larvale, l’innervazione dei muscoli pleurici mostra variazioni tra i segmenti e tra gli animali. Anche se non si trova un one-to-one neurone / muscolo targeting si trova, arborisations raggiungere una coerente organizzazione spaziale con dimensioni regolari, non sovrapposizione dei campi di proiezione.
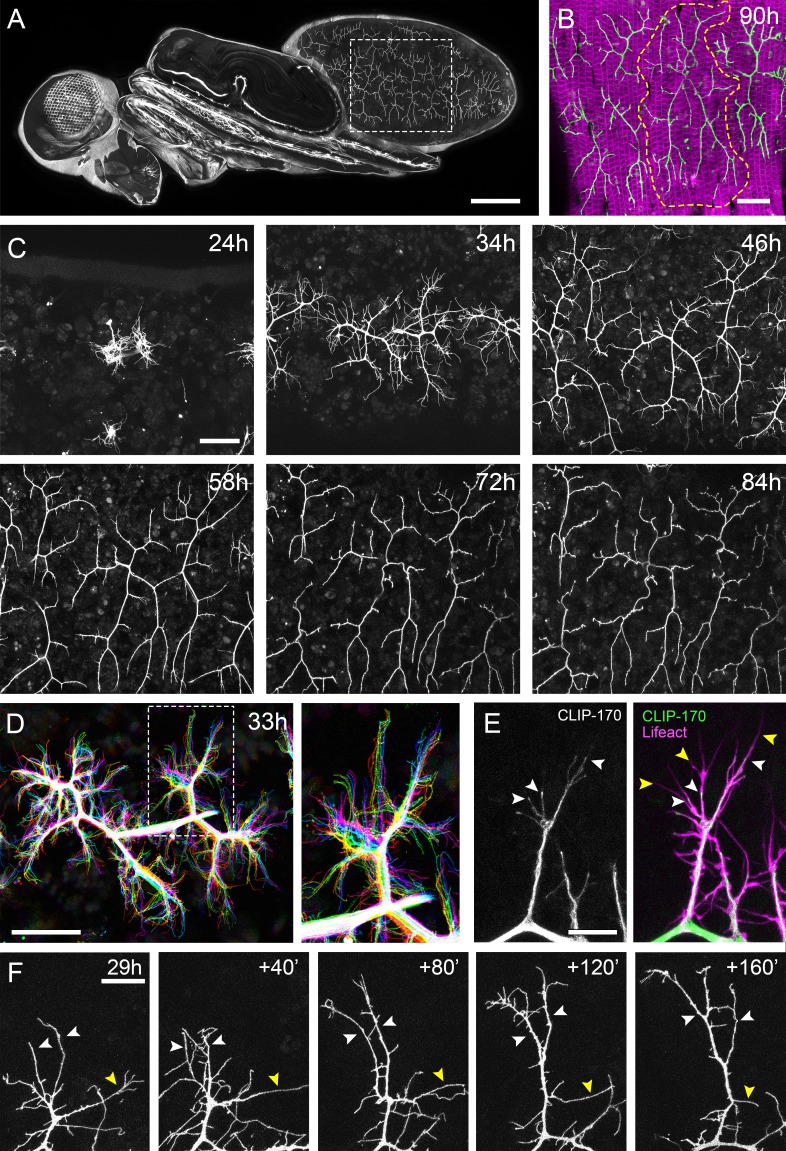
Figura 1.I motoneuroni pleurici mostrano una crescita dinamica durante lo sviluppo.(A) Una vista dorso-laterale di una pupa a 90 ore APF che esprime UAS-myr::GFP nel modello del driver glutamatergico OK371-GAL4. Linee tratteggiate delimitano le pergole che innervano i segmenti A3 e 4.(B) Innervazione dei muscoli pleurici nei segmenti A3 e 4 a 90 ore APF. Muscoli etichettati con mCD8::ChRFP(Mef2-GAL4; magenta; Ranganayakuluet al., 1996) e motoneuroni etichettati con myr: :GFP (VGlut-LexA; Diao et al., 2015; verde). Linee tratteggiate delimitano l’arborizzazione anteriore in 4A (A4A).(C) Una serie temporale segue la crescita degli arborisations nel segmento A3 da 24 ore a 84 ore APF in intervalli di 10-14 ore (VGlut-LexA> myr::GFP).(D) Un time-lapse di 10 minuti (temporalmente codificato a colori ogni 2 minuti) rivela la crescita dinamica di una coppia di arborisations nel segmento A3 a 32 hr APF.(E) Localizzazioni subcellulari di componenti citoscheletriche. I microtubuli, rivelati da CLIP-170::GFP, sono concentrati in rami e invadono dinamicamente le ramificazioni nascenti (punte di freccia bianche). I filopodi (punte di freccia gialle), sono ricchi di actina, rivelati da Lifeact::Rubino, ma in gran parte privi di microtubuli.(F) Una serie temporale con intervalli di 40 minuti mostra la crescita di un ramo a 29 ore APF. Le punte di freccia bianche indicano filopodi che si stabilizzano e maturano in rami. La punta della freccia gialla indica un ramo che si ritrae in un filopodio. Barre di scala: 250 µm (A),50 µm (B,C,D), 10µm(E), 20 µm (F).
Per comprendere lo sviluppo globale dei terminali assonali PM-Mn, abbiamo immaginato il segmento A3 da 24 ore a 84 ore dopo la formazione del pupario (APF)(Figura 1C). Da 24 ore APF la maggior parte dei muscoli larvali, ed i neuroni che li innervano, vengono rimossi dalla morte cellulare programmata e dalla fagocitosi(Currie e Bate, 1991). Il nervo periferico dorsalmente sporgente mantiene quattro contatti con l’epidermide durante la pupillazione e permette l’innervazione continua dei muscoli larvali persistenti. A ~ 24 ore APF ricrescita assonale APF inizia con l’emergere di coni di crescita ricchi di filopodi dal nervo. Da 34 ore APF rami primari APF sono stabiliti e festonati con filopodi. I due PM-Mns all’interno di ogni emisfero si separano in domini anteriori e posteriori e aumentano in dimensioni e complessità fino a ~ 72 ore APF. A seguito di questo, c’è un periodo di maturazione durante il quale si formano varicosità lungo tutti i rami, tranne quelli più prossimali. Con 84 ore di APF la morfologia dei pergolati è indistinguibile da quella osservata all’eclosione.
L’imaging dal vivo a intervalli di 2 minuti ha rivelato che la crescita dei rami è altamente dinamica, coinvolgendo un gran numero di filopodi che si estendono e si ritraggono, esplorando continuamente il loro ambiente locale(Figura 1D). Questa esplorazione avviene quasi esclusivamente all’interno del piano dei muscoli in via di sviluppo. In tutto questo articolo, definiamo e ci riferiamo ai filopodi e ai rami come segue. Secondo criteri anatomici e molecolari, i filopodi sono considerati sottili (<0,3 µm), protuberanze mobili con citoscheletri composti da filamenti F-actina paralleli (Mattilae Lappalainen, 2008). Al contrario, i rami sono di calibro superiore e meno dinamici, con nuclei contenenti microtubuli paralleli e notevolmente meno F-actina. Utilizzando Lifeact, una sonda citoscheletrica F-actin con marcatura fluorescente(Riedl et al., 2008), vediamo l’arricchimento in sottili strutture ‘filopodiche’ (Figura 1E). Al contrario, la plus-end microtubule binding proteina CLIP-170(Stramer et al., 2010), che rivela microtubuli, si trova in quello che noi chiamiamo rami, ma è per lo più escluso da filopodi. I neurite in crescita sono dinamici e in continuo cambiamento, ma è stato fatto ogni sforzo per essere coerente con la nostra classificazione.
Intervalli di imaging più lunghi hanno catturato le modifiche più sostanziali alla struttura del pergolato durante la crescita precoce(Figura 1F). Ciò ha rivelato che la maggior parte dei filopodi sono transitori, poiché vengono generati grandi numeri e si perdono tra un fotogramma e l’altro. Nonostante questo, un piccolo numero di filopodi persistono, pionieri dei singoli rami (punte di freccia bianche). Inoltre, anche i rami collassano di nuovo in filopodi singoli (punta di freccia gialla), evidenziando l’instabilità e il continuo rimodellamento degli arborisations in questa fase iniziale (vedi Video 1).

Video 1.La crescita dei pergolati assonali PM-Mn è esplorativa e altamente dinamica.Una coppia di pergolati assonali Pm-Mn che crescono oltre 15 ore da 35 ore APF(OK371-GAL4> cytoplasmicGFP). La crescita dell’arboricoltura è un processo esplorativo “trial-and-error” che comporta un elevato turnover di filopodi e l’estensione e il collasso di segmenti di ramo più grandi. Cornici prese a intervalli di 10 minuti. Formato temporale: hh:mm.

Figura 1.I motoneuroni pleurici mostrano una crescita dinamica durante lo sviluppo.(A) Una vista dorso-laterale di una pupa a 90 hr APF che esprime UAS-myr::GFP nel modello del driver glutamatergico OK371-GAL4. Linee tratteggiate delimitano le pergole che innervano i segmenti A3 e 4.(B) Innervazione dei muscoli pleurici nei segmenti A3 e 4 a 90 ore APF. Muscoli etichettati con mCD8::ChRFP(Mef2-GAL4; magenta; Ranganayakuluet al., 1996) e motoneuroni etichettati con myr: :GFP (VGlut-LexA; Diao et al., 2015; verde). Linee tratteggiate delimitano l’arborizzazione anteriore in 4A (A4A).(C) Una serie temporale segue la crescita degli arborisations nel segmento A3 da 24 ore a 84 ore APF in intervalli di 10-14 ore (VGlut-LexA> myr::GFP).(D) Un time-lapse di 10 minuti (temporalmente codificato a colori ogni 2 minuti) rivela la crescita dinamica di una coppia di arborisations nel segmento A3 a 32 hr APF.(E) Localizzazioni subcellulari di componenti citoscheletriche. I microtubuli, rivelati da CLIP-170::GFP, sono concentrati in rami e invadono dinamicamente le ramificazioni nascenti (punte di freccia bianche). I filopodi (punte di freccia gialle), sono ricchi di actina, rivelati da Lifeact::Rubino, ma in gran parte privi di microtubuli.(F) Una serie temporale con intervalli di 40 minuti mostra la crescita di un ramo a 29 ore APF. Le punte di freccia bianche indicano filopodi che si stabilizzano e maturano in rami. La punta della freccia gialla indica un ramo che si ritrae in un filopodio. Barre di scala: 250 µm (A),50 µm (B,C,D), 10µm(E), 20 µm (F).

Video 1.La crescita dell’assone PM-Mn è esplorativa e altamente dinamica.2. Una coppia di pergole assonali Pm-Mn che crescono oltre 15 ore da 35 ore APF(OK371-GAL4> cytoplasmicGFP). La crescita dell’arboricoltura è un processo esplorativo “trial-and-error” che comporta un elevato turnover di filopodi e l’estensione e il collasso di segmenti di ramo più grandi. Cornici prese a intervalli di 10 minuti. Formato temporale: hh:mm.
Una stretta relazione tra ramificazione e distribuzione dei componenti presinaptici
Per esplorare la crescita delle pergole assonali PM-Mn e i loro bersagli muscolari abbiamo immaginato contemporaneamente neuroni e progenitori muscolari (mioblasti) nelle prime fasi della crescita. A 35 hr i neuroni APF e i mioblasti sono direttamente connessi l’uno all’altro(Figura 2A e Video 2). I rami assonali in crescita sono avvolti da grappoli di mioblasti, mentre i coni di crescita più distali e i filopodi si estendono su fogli di miotubi immaturi.
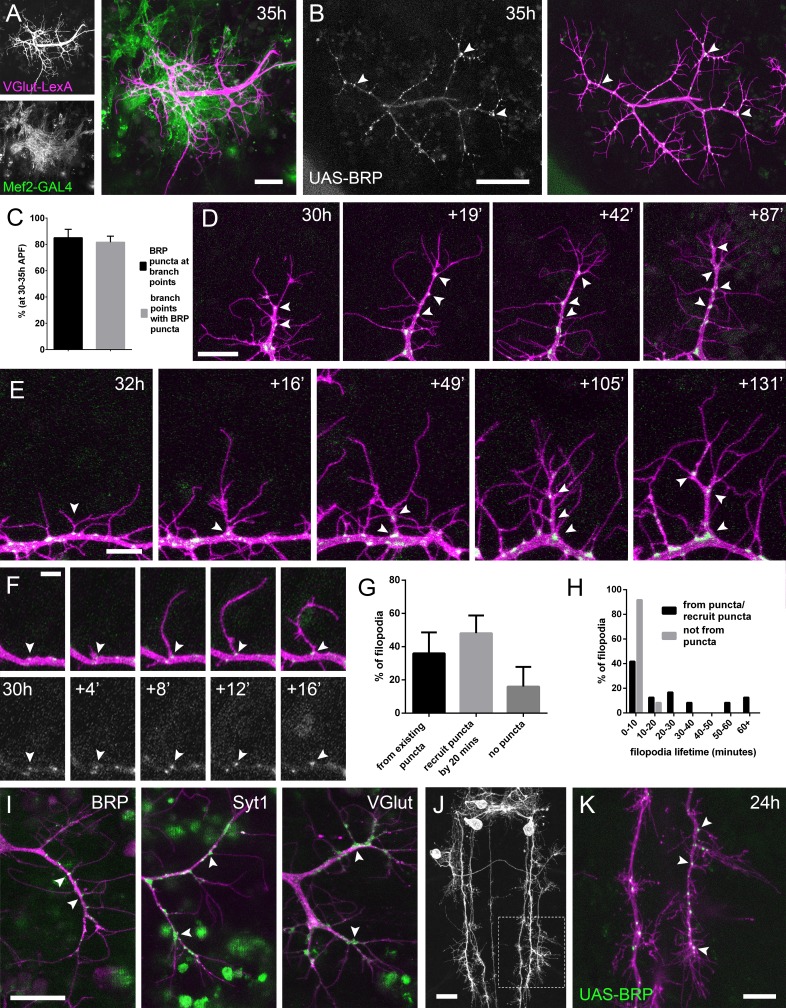
Figura 2.L’arrivo e la localizzazione delle componenti presinaptiche è strettamente legata alla crescita del pergolato.(A) Muscoli e sviluppo dei motoneuroni in stretta vicinanza a 35 ore APF. Muscoli etichettati con myr::tdTomato(Mef2-GAL4) e motoneuroni etichettati con myr::GFP(VGlut-LexA).(B) Una coppia di terminali assonali dei motoneuroni che esprimono BRP::RFP (verde) e myr::G FP (magenta) sotto il controllo di OK371-GAL4 a 35 ore APF. BRP::RFP è particolarmente chiaro nei punti di di diramazione (punte di freccia).(C) Nelle fasi 30-35 hr APF, 85,05 ± 6,42% dei BRP::RFP puncta sono localizzati nei punti di diramazione o nelle basi di filopodia e 81,62 ± 4,64% dei punti di diramazione/basi di filopodia ospitano un punctum (n = 5).(D) BRP::RFP puncta sono stabiliti in seguito alla crescita dei rami assonali. La serie temporale rivela il rapido arrivo di BRP::RFP puncta (verde) nel cono di crescita di un ramo esteso (punte di freccia), producendo un segmento di ramo costellato di puncta. La maggior parte dei BRP::RFP puncta segna i siti di crescita dei filopodi.(E) Una serie temporale che rivela la maturazione di un filopodio che ha origine da un BRP::RFP punctum (punta di freccia nel primo fotogramma) in un ramo. Ulteriori BRP::RFP puncta (punte di freccia) vengono rapidamente reclutate in nuovi nodi di ramo.(F) Le serie temporali mostrano l’emergere di un filopodio da un sito segnato da un BRP::RFP punctum (punta di freccia).(G) Le proporzioni dei filopodio che (i) emergono dai puncta esistenti, (ii) reclutano un punctum alla loro base entro 20 minuti e (iii) non reclutano i puncta alle loro basi (83 filopodio da tre film time-lapse nelle fasi 30-33 ore APF).(H) Le vite dei filopodia che originano da / reclutano i puncta entro 20 minuti dall’emergenza (21,67 ± 20,30 minuti, n = 24) o non reclutano i puncta (3,83 ± 2,76 minuti, n = 24). I filopodi che provengono da puncta/recruit puncta sono significativamente più longevi di quelli che non reclutano puncta (Mann-Whitney U = 73, p<0,0001, a due code).(I) Le linee trappola proteica rivelano la localizzazione di BRP endogeno, Syt1 e VGlut (raccolta MiMIC; Venken et al., 2011; punte di freccia). Arborizzazioni in scena tra 30 ore e 33 ore APF.(J e K) Eve + ve interneuron in T3, a 24 ore APF, (da RN2-FLP, Tub-FRT-CD2-FRT-GAL4 ) con punctate BRP::RFP (punte di freccia ) concentrate in punti di diramazione e basi di filopodia in crescenti arborisations di produzione. L’area con linee tratteggiate in(J) è espansa in(K). Le barre rappresentano le SD. Barre di scala: 20 µm (A,D,I,J), 50 µm (B), 10 µm (E,K), 5 µm (F).

Video 2.Gli assoni PM-Mn e i loro bersagli sinaptici crescono contemporaneamente e in stretta associazione.PM-Mn terminali assoni e loro partner muscolari interagiscono dinamicamente durante la crescita precoce (31 ore APF; OK371-GAL4 + Mef2-GAL4> cytoplasmicGFP). Una diramazione che sporge in alto a destra si estende su più miotoubi tramite giri di filopodio, stabilizzazione e maturazione. Frammenti presi a intervalli di 2 minuti. Formato temporale: hh:mm.
Alla luce di questa stretta associazione tra i partner sinaptici, ci siamo chiesti se le componenti presinaptiche sono presenti nei rami distali nelle prime fasi, dato che il lavoro precedente nei vertebrati ha trasmesso che le sinapsi nascenti giocano un ruolo chiave nella stabilizzazione dei rami. Utilizzando una versione etichettata RFP di Bruchpilot (BRP), un omologo di ELKS/CAST, espresso con OK371-GAL4(Mahr e Aberle, 2006), vediamo accumuli puntati nei nodi dei rami e nelle basi filopodiali(Figura 2B). Un’analisi di BRP::RFP puncta nei terminali assonali di 5 animali in scena da 30 hr a 35 hr APF ha rivelato che l’85,1 ± 6,4% (SD) del totale di BRP puncta erano localizzati nei punti di diramazione e nelle basi filopodiche, e l’81,6 ± 4,6% dei punti di diramazione/basi aveva un punctum (Figura 2C).
Per esplorare le dinamiche di BRP::RFP e ramificazione abbiamo immaginato le diramazioni PM-Mn a intervalli di 2 minuti. Questo filmato ha mostrato che i BRP::RFP puncta sono rapidamente reclutati sulle punte dei rami in crescita dove segnano i siti di crescita dei nuovi filopodi(Figura 2D). I cicli successivi di estensione e stabilizzazione dei filopodi in questo modo producono rami costellati di BRP::RFP puncta. I filopodi che si estendono da questi puncta possono dare origine a nuovi rami(Figura 2E).
La dinamica di BRP::RFP puncta parla di una stretta relazione tra la crescita dei filopodi e la distribuzione delle proteine presinaptiche(Figura 2F). Per quantificare questo abbiamo analizzato 83 eventi di generazione di filopodi da tre filmati time-lapse di arborisations in scena tra 30 ore e 33 ore APF. La nostra analisi ha rilevato che il 36,0 ± 12,6% dei filopodi è emerso dall’esistente BRP puncta, il 48,1 ± 10,7% ha reclutato un punctum entro 20 minuti dalla loro formazione e il 16,0 ± 11,9% non è riuscito a reclutare un ovvio punctum (Figura 2G). La frequenza di filopodia che emerge da o recluta un BRP::RFP punctum 71,4 ± 11,0% è stata significativamente maggiore di una frequenza attesa conservativa del 50% (X2 =36,4, p<0,0001). Inoltre, abbiamo scoperto che il 100% dei filopodi che non sono riusciti a reclutare i puncta nelle loro basi sono stati eliminati entro 20 minuti dall’emergenza (n = 24) (Figura 2H). Al contrario, sebbene il 54,2% dei filopodi che hanno avuto origine da, o che hanno rapidamente reclutato BRP::RFP puncta sono stati anch’essi persi entro 20 minuti, il 33,3% è sopravvissuto tra i 20 e i 60 minuti e un ulteriore 12,5% ha persistito per oltre un’ora (n = 24). Così, la vita dei filopoda associati ai puncta alle loro basi era significativamente più lunga di quella dei senza (Mann – Whitney a due code U = 73, p<0,0001) (Vedi Video 3).

Video 3.La crescita dell’Arbor è associata a distinte localizzazioni di proteine presinaptiche.PM-Mn arborisations assone che esprimono myr::GFP e BRP::RFP a 32 ore APF(OK371-GAL4). BRP::RFP forma puncta che sono fortemente localizzati a nodi ramificati e basi filopodiali. I puncta a basi filopodiali sono correlati con la vita dei filopodi. Cornici a intervalli di 2 minuti. Formato temporale hh:mm.
Per verificare l’accuratezza di GAL4 guidato BRP::RFP, abbiamo immaginato GFP endogeno etichettati BRP, dal momento che l’immunoistochimica è particolarmente difficile su fragili pareti del corpo pupale precoce precoce del corpo(Figura 2I). Il BRP::GFP trappola proteica trappola GFP ha rivelato una distribuzione punctate in punti di ramo e le basi di filopodia, come avevamo visto con il reporter esogeno. Altri GFP etichettato trappola proteica linee trappola che etichetta vescicola sinaptica (SV) proteine associate Syt1 e VGlut esposto meno localizzazioni punctate, ma erano ancora chiaramente concentrati nei rami assone e alle basi di filopodio(Figura 2I). È interessante notare che non abbiamo mai visto queste proteine all’interno dei filopodi.
Ci siamo chiesti se questa localizzazione dei nodi dei macchinari presinaptici nei rami in crescita sia specifica del PM-Mns o sia più diffusa all’interno del sistema nervoso della mosca. Per testare questo abbiamo immaginato i terminali di uscita degli interneuroni positivi di Eva(Even-skipped) nei neuromeri toracici durante la metamorfosi (24 ore APF)(Roy et al., 2007). Qui abbiamo trovato distribuzioni punctate di BRP::RFP molto simili a quelle del PM-Mns, con 79,5 ± 3,7% di puncta situati in punti di diramazione o basi di filopodia (n = 8 campi di uscita da quattro individui; Figura 2J e K) .

Figura 2.L’arrivo e la localizzazione delle componenti presinaptiche è strettamente legata alla crescita del pergolato.(A) Muscoli e sviluppo di motoneuroni in stretta vicinanza a 35 ore APF. Muscoli etichettati con myr::tdTomato(Mef2-GAL4) e motoneuroni etichettati con myr::GFP(VGlut-LexA).(B) Una coppia di terminali assonali dei motoneuroni che esprimono BRP::RFP (verde) e myr::G FP (magenta) sotto il controllo di OK371-GAL4 a 35 ore APF. BRP::RFP è particolarmente chiaro nei punti di di diramazione (punte di freccia).(C) Nelle fasi 30-35 hr APF, 85,05 ± 6,42% dei BRP::RFP puncta sono localizzati nei punti di diramazione o nelle basi di filopodia e 81,62 ± 4,64% dei punti di diramazione/basi di filopodia ospitano un punctum (n = 5).(D) BRP::RFP puncta sono stabiliti in seguito alla crescita dei rami assonali. La serie temporale rivela il rapido arrivo di BRP::RFP puncta (verde) nel cono di crescita di un ramo esteso (punte di freccia), producendo un segmento di ramo costellato di puncta. La maggior parte dei BRP::RFP puncta segna i siti di crescita dei filopodi.(E) Una serie temporale che rivela la maturazione di un filopodio che ha origine da un BRP::RFP punctum (punta di freccia nel primo fotogramma) in un ramo. Ulteriori BRP::RFP puncta (punte di freccia) vengono rapidamente reclutate in nuovi nodi di ramo.(F) Le serie temporali mostrano l’emergere di un filopodio da un sito segnato da un BRP::RFP punctum (punta di freccia).(G) Le proporzioni dei filopodio che (i) emergono dai puncta esistenti, (ii) reclutano un punctum alla loro base entro 20 minuti e (iii) non reclutano i puncta alle loro basi (83 filopodio da tre film time-lapse nelle fasi 30-33 ore APF).(H) Le vite dei filopodia che hanno origine da/recludono i puncta entro 20 minuti dall’emergenza (21,67 ± 20,30 minuti, n = 24) o non reclutano i puncta (3,83 ± 2,76 minuti, n = 24). I filopodi che provengono da puncta/recruit puncta sono significativamente più longevi di quelli che non reclutano puncta (Mann-Whitney U = 73, p<0,0001, a due code).(I) Le linee trappola proteica rivelano la localizzazione di BRP endogeno, Syt1 e VGlut (raccolta MiMIC; Venken et al., 2011; punte di freccia). Arborizzazioni in scena tra 30 ore e 33 ore APF.(J e K) Eve + ve interneuron in T3, a 24 ore APF, (da RN2-FLP, Tub-FRT-CD2-FRT-GAL4 ) con punctate BRP::RFP (punte di freccia ) concentrate in punti di diramazione e basi di filopodia in crescenti arborisations di produzione. L’area con linee tratteggiate in(J) è espansa in(K). Le barre rappresentano le SD. Barre di scala: 20 µm (A,D,I,J), 50 µm (B), 10 µm (E,K), 5 µm (F).

Video 2.Gli assoni PM-Mn e i loro bersagli sinaptici crescono contemporaneamente e in stretta associazione.PM-Mn terminali assoni e loro partner muscolari interagiscono dinamicamente durante la crescita precoce (31 ore APF; OK371-GAL4 + Mef2-GAL4> cytoplasmicGFP). Una diramazione che sporge in alto a destra si estende su più miotoubi tramite giri di filopodio, stabilizzazione e maturazione. Frammenti presi a intervalli di 2 minuti. Formato temporale: hh:mm.

Video 3.La crescita del pergolato è associata a distinte localizzazioni di proteine presinaptiche.4. Arborisations assone PM-Mn che esprimono myr::GFP e BRP::RFP a 32 hr APF(OK371-GAL4). BRP::RFP forma puncta che sono fortemente localizzati a nodi ramificati e basi filopodiali. I puncta a basi filopodiali sono correlati con la vita dei filopodi. Cornici a intervalli di 2 minuti. Formato temporale hh:mm.
PM-Mns elaborano i loro assonali senza attività sinaptica
La localizzazione e la dinamica dei macchinari presinaptici sopra descritti rispecchia da vicino le osservazioni fatte in Xenopus e zebrafish tecta, e ha suggerito un ruolo per le sinapsi e l’attività sinaptica nella crescita dei rami durante l’elaborazione del PM-Mn(Alsina et al., 2001; Niell et al., 2004; Meyer e Smith, 2006; Ruthazer et al., 2006).
Per esplorare se l’attività gioca un ruolo nella crescita dell’arboricoltura, abbiamo prima mappato lo sviluppo dell’attività nel PM-Mns utilizzando l’indicatore di calcio geneticamente codificato GCaMP6m come proxy(Video 4- 6). Le dinamiche del calcio, registrate come variazioni di fluorescenza, sono visualizzate come chimografi registrati a caldo in diversi stadi di sviluppo (Figura 3A). L’assenza di cambiamenti evidenti di fluorescenza a 32 ore APF indica che in questa fase i motoneuroni sono elettricamente inattivi. Non fino a 42 ore APF abbiamo visto i primi eventi di calcio indicativi di depolarizzazioni della membrana. Questi eventi sono stati isolati e poco frequenti. La frequenza degli eventi di calcio è aumentata notevolmente e da 48 ore di attività APF è stata caratterizzata da episodi di transitori in rapida successione della durata di ~ 8 min, intervallati da periodi più lunghi di quiescenza. Avvicinandoci alle fasi finali della crescita del pergolato, a 74 ore di APF abbiamo osservato modelli simili di attività, tuttavia ora gli attacchi contengono un numero molto maggiore di eventi.
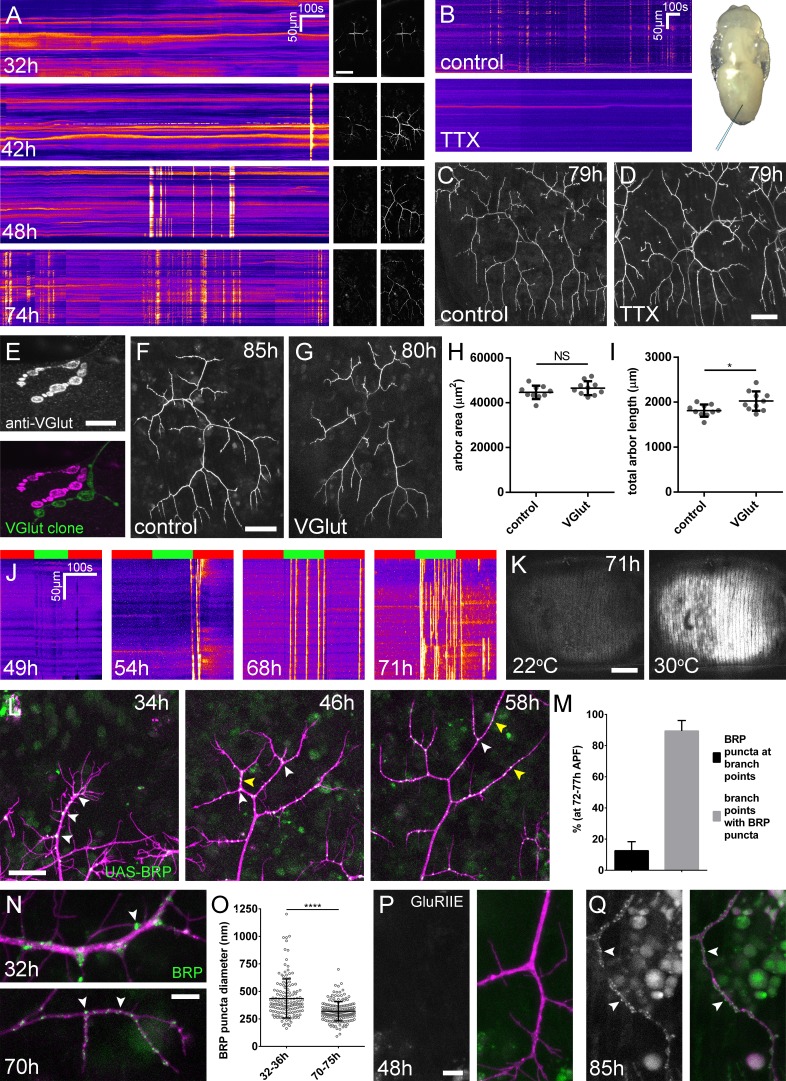
Figura 3.La crescita dell’albero avviene senza la formazione di sinapsi funzionali.(A) Attività del calcio nei terminali assonali PM-Mn a 32, 42, 48 e 74 ore APF, misurata dalle variazioni di fluorescenza GCaMP6m (Δf) (guidata da OK371-GAL4 ). Le immagini sequenziali mostrano esempi di Δfs visualizzati come chimografi registrati a caldo (B) GCaMP6m Δfs nei terminali assone PM-Mn a 78 hr APF in una pupa iniettata con una soluzione di controllo di PBS (in alto) e una soluzione di 0,5 mM TTX in PBS (in basso) nell’addome di una pupa (inset).(C) Arborisations nel segmento A3(OK371-GAL4> myr::GFP) a79 ore APF dopo l’iniezione a 32 ore APF con una soluzione di PBS e (D) soluzione contenente TTX.(E) Terminale assone motoneurone di un clone VGlut null MARCM (verde) accanto ad un terminale eterozigote VGlut in larva L3 macchiata con un anticorpo contro VGlut (magenta).(F) L’arborizzazione più anteriore nel segmento A3 (A3-A) di un controllo eterozigote VGlut che esprime myr: :GFP e mCD8 ::GFP (VGlutNMJX-GAL4) a 85 hr APF (G)un’arborizzazione equivalente in VGlut null MARCM clone a 80 hr APF.(H e I) Arborizzazioni di cloni VGlut null A3-A MARCM non differiscono in modo significativo dai controlli nell’area dell’arbor (controlli: 44643 ± 2982 µm2, VGlut: 46518 ± 3083 µm2, n1,2 = 10, t(18) = 1,38, p=0,18, t-test, a due code). Lunghezze totali del perno marginalmente maggiori (controlli: 1812 ± 134 µm, VGlut: 2024 ± 216 µm , n1,2 = 10, t(18) = 2,64, p=0,02, t-test, adue code ).(J) Muscolo GCaMP6m(Mef2-GAL4) Δf in risposta all’attivazione dei motoneuroni a 49 ore, 54 ore, 68 ore e 71 ore APF, utilizzando il canale ionico riscaldato TRPA1 (VGlut-LexA> dTRPA1). Le barre rosse indicano il tempo alla temperatura restrittiva (22° C), le barre verdi indicano il tempo alla temperatura permissiva (30° C).(K) Le immagini mostrano il muscolo GCaMP6m Δfs prima e dopo l’attivazione dei motoneuroni con dTRPA1 a 71 ore APF.(L) Organizzazione di BRP::RFP puncta attraverso lo sviluppo. Le serie temporali dello stesso segmento di pergola a 34 hr, 48 hr e 56 hr APF mostrano uno spostamento da puncta nei punti di di diramazione (punte di freccia bianche) ad una distribuzione lungo le lunghezze dei rami (punte di freccia gialle).(M) Tra 72 ore e 77 ore APF, 12,55 ± 5,79% del totale BRP::RFP puncta si trovano nei punti di di diramazione/base di filopodia, ma la maggior parte (89,38 ± 6,73%) dei punti di diramazione/base di filopodia host puncta (n = 5).(N) Dimensioni e distribuzione delle GFP endogene, etichettate BRP. I puncta di BRP (indicati dalle punte delle frecce) sono più grandi e di diametro più eterogeneo durante la crescita precoce del pergolato (32 ore APF) che nelle fasi successive (70hAPF), quando la fase principale di escrescenza è cessata(OK371-GAL4> mCD8::ChRFP).(O) Diametri di BRP endogeno::GFP puncta misurata come l’intera larghezza a metà del massimo dei picchi di fluorescenza sono significativamente maggiori a 32 ore APF (435.8 ± 177,8 nm, n = 144) che a 72 ore APF (319,6 ± 87,9 nm, n = 177) (Mann-Whitney U = 6935, p<0,0001, a due code).(P) Localizzazione di GluRIIE a 48 ore APF. Questa versione GFP tagged di GluRIIE (FlyFos; Sarov et al., 2016) pilotata sotto il controllo dell’unità trascrizionale nativa non può essere vista nella membrana postsinaptica prima o a 48 ore APF.(OK371-GAL4> mCD8::ChRFP).(D) A 85 hr APF cospicuo GluRIIE::GFP cluster (punte di freccia) si trovano lungo i terminali assone. Le barre rappresentano le SD. Barre di scala: 50 µm (A,C,D,F,G), 10 µm (E), 100 µm (K), 25 µm (L), 5 µm (N,P,Q).

Video 4.Lo sviluppo dell’attività PM-Mn; 32h APF.
GCaMP6m espresso con OK371-GAL4 rivela lo sviluppo elettrico dei Pm-MNs. A 32h APF la mancanza di grandi cambiamenti di fluorescenza indica l’assenza di potenziali d’azione. Frame presi ad intervalli di 1 s. Formato tempo mm:ss.

Video 5.Lo sviluppo dell’attività PM-Mn; 43h APF.GCaMP6m espresso con OK371-GAL4rivela lo sviluppo elettrico dei Pm-MNs. Da 43 ore di attività del calcio APF 43h APF è caratterizzata da grandi cambiamenti di fluorescenza indicativi di depolarizzazioni di membrana. fotogrammi presi a intervalli di 1 s. Formato tempo mm:ss.

Video 6.Lo sviluppo dell’attività PM-Mn; 78h APF.GCaMP6m espresso con OK371-GAL4rivela lo sviluppo elettrico dei Pm-MNs. Di 78 ore l’attività APF è definita da attacchi di transitori ad alta frequenza. Frames presi ad intervalli di 1 s. Formato orario mm:ss.
Per affrontare direttamente se la crescita dell’arbor può avvenire indipendentemente dalla neurotrasmissione di attività, abbiamo messo a tacere i neuroni con l’iniezione intravitale di tetrodotossina tetrodotossina (0,5 mM TTX), un bloccante dei canali del sodio. Degli otto animali iniettati tra 24 ore e 32 ore APF, sei non hanno mostrato alcuna attività di calcio rilevabile a 78 ore APF(Figura 3B) e due hanno mostrato solo deboli transitori limitati a piccoli segmenti di ramo. Al contrario, i controlli iniettati tampone ha dato livelli attesi di attività presinaptica (n = 5). A 79 ore APF abbiamo trovato che gli arborisations di animali iniettati con TTX erano morfologicamente indistinguibili da quelli iniettati con buffer(Figura 3C e D).
Oltre alla neurotrasmissione evocata, il rilascio spontaneo dei neurotrasmettitori, responsabile dei potenziali postsinaptici miniaturizzati (mEPSPs), ha dimostrato di svolgere un ruolo chiave nella crescita e nello sviluppo dei neuroni(Choi et al., 2014; Andreae e Burrone, 2015). Per determinare se la neurotrasmissione spontanea è importante per la crescita degli arborisations assonali PM-Mn abbiamo generato cloni PM-Mn omozigoti mutanti per il trasportatore di glutammato vescicolare(VGlut) utilizzando l’allele nullo Df(2L)VGlut2. Questo allele ha dimostrato in precedenza di bloccare completamente sia la neurotrasmissione glutamatergica evocata che quella spontanea(Daniels et al., 2006). La colorazione degli anticorpi ha confermato una perdita completa della proteina VGlut in Df(2L)VGlut2 cloni MARCM di motoneuroni(Figura 3E). Per valutare l’effetto della rimozione di VGlut sulla crescita del pergolato abbiamo eseguito l’analisi morfometrica sui cloni dei motoneuroni più anteriori del segmento A3 (A3-A) nelle femmine in scena tra 80 ore e 90 ore APF(Figura 3F e G). Non è stata trovata alcuna differenza significativa tra l’area di copertura di VGlut null A3-A arborisations e controlli(Figura 3H), anche se i nulli di VGlut erano marginalmente maggiori nella lunghezza totale dell’arbor(Figura 3I).
La linea temporale dell’attività neurale e i dati nulli di VGlut suggeriscono fortemente che la trasmissione sinaptica non gioca un ruolo durante la ‘fase elaborativa’ di crescita del sistema neuromuscolare pleurico. Per determinare quando la trasmissione sinaptica diventa ‘fisiologicamente’ possibile all’interno di questo sistema, abbiamo stimolato artificialmente i neuroni utilizzando il canale ionico TRPA1 (Hamadaet al., 2008), mentre la misurazione delle risposte del calcio postsinaptico nei muscoli pleurici utilizzando GCaMP6m. Prima di 49 ore APF non sono stati registrati eventi di calcio nei muscoli (n = 2; Figura 3J) . Tra le 50 ore e le 59 ore di APF sono stati registrati alcuni eventi di calcio di grandi dimensioni nei muscoli, ma in ogni caso questi si sono verificati durante gli ultimi secondi di stimolazione o subito dopo l’abbassamento della temperatura (n = 2). Al contrario, quando si stimola in fasi comprese tra 68 ore e 72 ore APF abbiamo osservato una robusta, rapida e sostenuta attività del calcio postsinaptico (n = 7; Figura 3J e K). Tra 68-72 hr APF eventi di calcio APF si è verificato a tassi significativamente maggiori alla temperatura permissiva (30 ° C) rispetto alla temperatura restrittiva (22 ° C) (6.15 ± 5,60 minuti-1 contro 0,93 ± 0,81 minuti-1, Mann-Whitney U = 6,0, n = 7, p=0,02, a due code). Questi dati indicano che la trasmissione sinaptica evocata non avviene all’interno di questo sistema prima delle 60 ore APF.
La mancanza di impatto sulla crescita derivante dalla rimozione della trasmissione sinaptica ci ha portato a guardare più da vicino l’organizzazione dei macchinari presinaptici in tempi diversi durante lo sviluppo(Figura 3L). Come descritto in precedenza, a 34 ore APF, BRP::RFP puncta sono stati trovati quasi esclusivamente nei punti di diramazione e alla base dei filopodi (punte di freccia bianche). A 48 ore APF, oltre ai puncta nei punti di di diramazione, molti puncta sono stati trovati anche lungo le lunghezze dei rami, tra i nodi dei rami (punte di freccia gialle). Entro 58 ore APF tutti i rami, tranne quelli più prossimali, erano rivestiti con un gran numero di BRP::RFP puncta. Infine, nelle fasi 72-77 hr APF, un’analisi della distribuzione dei puncta ha rivelato che solo 12,6 ± 5,8%, n = 5 arborisations da cinque individui) di puncta erano in punti di diramazione, il resto essendo distribuito lungo le lunghezze dei rami (Figura 3M). La maggior parte (89,4 ± 6,7%) dei punti di di diramazione, tuttavia, sono stati trovati ancora puncta.
Oltre alla distribuzione, abbiamo usato la linea di trappola proteica BRP::GFP per esaminare le modifiche alle dimensioni di BRP puncta(Figura 3N). Nelle prime fasi, puncta erano molto più eterogenei in diametro rispetto alle fasi successive, misurata da un confronto di deviazioni standard, trovato per essere significativo da un F-test di uguaglianza delle varianze (F143.176 = 4,092, p<0,0001). Abbiamo anche trovato che BRP::GFP puncta è diventato significativamente più piccolo nel corso dello sviluppo(Figura 3O).
La tendenza verso puncta più piccoli e più omogenei nel corso dello sviluppo ha evidenziato che i puncta che vediamo nei primi arborisations PM-Mn possono in realtà non rappresentare sinapsi. Per esplorare questa possibilità abbiamo cercato di vedere quando i recettori del glutammato appaiono per la prima volta nei muscoli. Nessun GluRIIE rilevabile era evidente a 48 ore APF(Figura 3P), ma da 85 ore APF chiaro cluster di GluRIIE sono stati trovati apposto ai rami(Figura 3Q). Così, i cambiamenti nell’organizzazione dei macchinari sinaptici nel corso dello sviluppo suggeriscono che i primi accumuli di componenti presinaptici non rappresentano sinapsi differenziate.

Figura 3.La crescita del pergolato avviene senza la formazione di sinapsi funzionali.(A) Attività del calcio nei terminali assonali PM-Mn a 32, 42, 48 e 74 ore APF, misurata dalle variazioni di fluorescenza GCaMP6m (Δf) (guidata da OK371-GAL4 ). Le immagini sequenziali mostrano esempi di Δfs visualizzati come chimografi registrati a caldo (B) GCaMP6m Δfs nei terminali assone PM-Mn a 78 hr APF in una pupa iniettata con una soluzione di controllo di PBS (in alto) e una soluzione di 0,5 mM TTX in PBS (in basso) nell’addome di una pupa (inset).(C) Arborisations nel segmento A3(OK371-GAL4> myr::GFP) a79 ore APF dopo l’iniezione a 32 ore APF con una soluzione di PBS e (D) soluzione contenente TTX.(E) Terminale assone motoneurone di un clone VGlut null MARCM (verde) accanto ad un terminale eterozigote VGlut in larva L3 macchiata con un anticorpo contro VGlut (magenta).(F) L’arborizzazione più anteriore nel segmento A3 (A3-A) di un controllo eterozigote VGlut che esprime myr: :GFP e mCD8 ::GFP (VGlutNMJX-GAL4) a 85 hr APF (G)un’arborizzazione equivalente in VGlut null MARCM clone a 80 hr APF.(H e I) Arborizzazioni di cloni VGlut null A3-A MARCM non differiscono in modo significativo dai controlli nell’area dell’arbor (controlli: 44643 ± 2982 µm2, VGlut: 46518 ± 3083 µm2, n1,2 = 10, t(18) = 1,38, p=0,18, t-test, a due code). Lunghezze totali del perno marginalmente maggiori (controlli: 1812 ± 134 µm, VGlut: 2024 ± 216 µm , n1,2 = 10, t(18) = 2,64, p=0,02, t-test, adue code ).(J) Muscolo GCaMP6m(Mef2-GAL4) Δf in risposta all’attivazione dei motoneuroni a 49 ore, 54 ore, 68 ore e 71 ore APF, utilizzando il canale ionico riscaldato TRPA1 (VGlut-LexA> dTRPA1). Le barre rosse indicano il tempo alla temperatura restrittiva (22° C), le barre verdi indicano il tempo alla temperatura permissiva (30° C).(K) Le immagini mostrano il muscolo GCaMP6m Δfs prima e dopo l’attivazione dei motoneuroni con dTRPA1 a 71 ore APF.(L) Organizzazione di BRP::RFP puncta attraverso lo sviluppo. Le serie temporali dello stesso segmento di pergola a 34 hr, 48 hr e 56 hr APF mostrano uno spostamento da puncta nei punti di di diramazione (punte di freccia bianche) ad una distribuzione lungo le lunghezze dei rami (punte di freccia gialle).(M) Tra 72 ore e 77 ore APF, 12,55 ± 5,79% del totale BRP::RFP puncta si trovano nei punti di di diramazione/base di filopodia, ma la maggior parte (89,38 ± 6,73%) dei punti di diramazione/base di filopodia host puncta (n = 5).(N) Dimensioni e distribuzione delle GFP endogene, etichettate BRP. I puncta di BRP (indicati dalle punte delle frecce) sono più grandi e di diametro più eterogeneo durante la crescita precoce del pergolato (32 ore APF) che nelle fasi successive (70hAPF), quando la fase principale di escrescenza è cessata(OK371-GAL4> mCD8::ChRFP).(O) Diametri di BRP endogeno::GFP puncta misurata come l’intera larghezza a metà del massimo di picchi di fluorescenza sono significativamente maggiori a 32 ore APF (435.8 ± 177,8 nm, n = 144) che a 72 ore APF (319,6 ± 87,9 nm, n = 177) (Mann-Whitney U = 6935, p<0,0001, a due code).(P) Localizzazione di GluRIIE a 48 ore APF. Questa versione GFP tagged di GluRIIE (FlyFos; Sarov et al., 2016) pilotata sotto il controllo dell’unità trascrizionale nativa non può essere vista nella membrana postsinaptica prima o a 48 ore APF.(OK371-GAL4> mCD8::ChRFP).(D) A 85 hr APF cospicuo GluRIIE::GFP cluster (punte di freccia) si trovano lungo i terminali assone. Le barre rappresentano le SD. Barre di scala: 50 µm (A,C,D,F,G), 10 µm (E), 100 µm (K), 25 µm (L), 5 µm (N,P,Q).

Video 4.Lo sviluppo dell’attività PM-Mn; 32h APF.
GCaMP6m espresso con OK371-GAL4 rivela lo sviluppo elettrico dei Pm-MNs. A 32h APF la mancanza di grandi cambiamenti di fluorescenza indica l’assenza di potenziali d’azione. Frame presi ad intervalli di 1 s. Formato tempo mm:ss.

Video 5.Lo sviluppo dell’attività PM-Mn; 43h APF.GCaMP6m espresso con OK371-GAL4rivela lo sviluppo elettrico dei Pm-MNs. Da 43 ore di attività del calcio APF 43h APF è caratterizzata da grandi cambiamenti di fluorescenza indicativi di depolarizzazioni di membrana. fotogrammi presi a intervalli di 1 s. Formato tempo mm:ss.

Video 6.Lo sviluppo dell’attività PM-Mn; 78h APF.GCaMP6m espresso con OK371-GAL4rivela lo sviluppo elettrico dei Pm-MNs. Di 78 ore l’attività APF è definita da attacchi di transitori ad alta frequenza. Frames presi ad intervalli di 1 s. Formato orario mm:ss.
Un ruolo per la segnalazione di Neurexin-Neuroligin 1 nella crescita dell’arborizzazione PM-Mn
La segnalazione neurexina-euroliginale è in grado di guidare la formazione di sinapsi in molti contesti, e nel tettum Xenopus regola la crescita del pergolato in modo dipendente dall’attività(Chen et al., 2010). Sebbene i nostri dati escludano un ruolo chiave per l’attività nella crescita assonale dell’albero PM-Mn, abbiamo cercato di verificare se queste proteine di adesione sinaptica possono essere importanti.
Per generare mutanti omozigoti, abbiamo utilizzato gli alleli nulli Nlg1ex2.3, Nlg11960(Banovic et al., 2010) e Nrx241(Li et al., 2007) in combinazione con carenze cromosomiche. Queste combinazioni sono possibili fino all’età adulta. A stadi pupillari tardivi abbiamo trovato che sia Nlg1 e Nrx nulli mostrano difetti comparabili nella morfologia del pergolato, con grandi riduzioni di copertura rispetto ai controlli wild-type(Figura 4A e B).
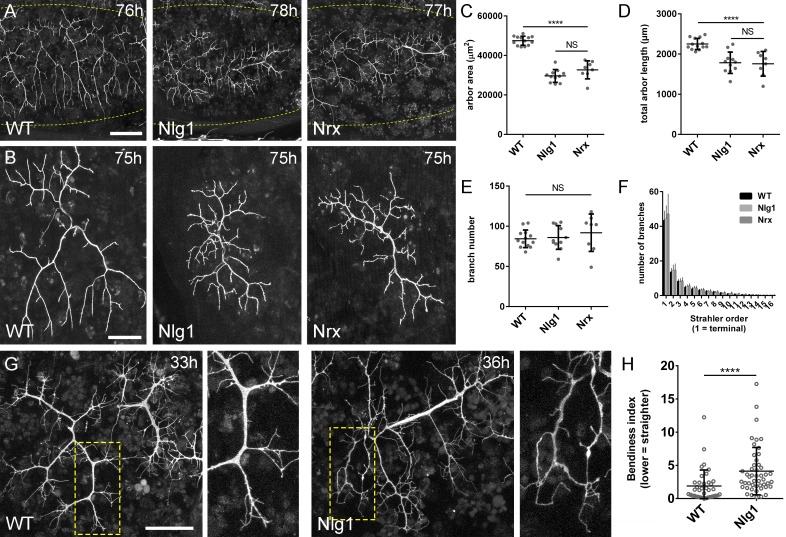
Figura 4.Neurexin e Neuroligin 1 sono necessari durante la crescita dell’arbor.(A) Arborizzazioni di assoni PM-Mn nei segmenti A3-A5 in un controllo wild-type, un Nlg1 nullo e un Nrx nullo messo in scena tra 76 hr e 78 hr APF(VGlut-LexA> myr::GFP). I punti gialli mostrano il contorno dell’epidermide(B) Le pergole più anteriori nel segmento A3 (A3-A) in stadi compresi tra 75 hr e 85 hr APF. Gli arborisations appartenenti ad altri motoneuroni a fianco sono stati rimossi utilizzando l’elaborazione delle immagini.(C-F) Analisi morfometrica degli arborisations A3-A di Nlg1 nulli (n = 11), Nrx nulli (n = 8 ) e controlli wild-type (n = 13) in stadi compresi tra 75 hr e 85 hr APF.(C) Nlg1 e Nrx nulli coprono territori significativamente più bassi (controlli: 47445 ± 2298 µm2, Nlg1: 29616 ± 3259 µm2, Nrx: 32696 ± 4565 µm2. Nlg1 vs controlli: t(22) = 15,67, p<0,0001. Nrx vs controlli: t(19) = 9,89, p<0,0001. t-test, a due code) (D) Totale PM-Mn controlli lunghezza perni: 2251 ± 140 µm, Nlg1: 1785 ± 265 µm, Nrx : 1758 ± 306 µm. Nlg1 vs controlli: t(22) = 5,51, p<0,0001. Nrx vs controlli: t(19) = 5,07, p<0,0001. t-test, a due code), sono significativamente diversi.(E) Il numero totale delle diramazioni PM-Mn non è significativo (controlli: 84,38 ± 10,97, Nlg1: 86,00 ± 14,74, Nrx: 91.88 ± 23.27. Nlg1 contro i controlli: t(22) = 0,31, p=0,76. Nrx contro i controlli: t(19) = 1,00, p=0,33. t-test, a due code).(F) Nlg1 nulli, Nrx nulli e controlli non erano diversi nella loro organizzazione topologica. I nulli non si differenziano dai controlli nel loro numero totale di rami (controlli) di ordine superiore (terminali): 43,31 ± 5,59, Nlg1: 44,27 ± 7 ,56, Nrx: 47.00 ± 11.50. Nlg1 contro i controlli: t(22) = 0,36, p=0,72. Nrx contro i controlli: t(19) = 0,99, p=0,33. t-test, a due code) o nel loro numero totale di ordini (controlli: 11,62 ± 1,94, Nlg1: 11,27 ± 2, 15, Nrx: 11.88 ± 2.36. Nlg1 contro i controlli: t(22) = 0,41, p=0,67. Nrx contro i controlli: t(19) = 0,27, p=0,79. t-test, a due code).(G) Nelle prime fasi di crescita Nlg1 arborisations nulli possiedono un certo numero di rami che sono cresciuti precocemente, ma sono più tortuosi e con un minor numero di rami laterali rispetto ai wild-type.(H) Piegatura dei rami di PM–Mns arbors tra 32 hr e 36 hr APF. La curvatura è stata misurata come differenza percentuale tra la lunghezza effettiva e la lunghezza rettilinea dei rami primari (terminali) e secondari. I rami di Nlg1 nulli sono meno rettilinei (4,13 ± 3,57%, n = 48) rispetto ai controlli (1,89 ± 2,41%, n = 38) nelle fasi tra 32 hr e 36 hr APF (Mann-Whitney U = 441, p<0,0001, a due code). Le barre rappresentano gli SD. Barre di scala: 100 µm (A),50 µm (B,G).
Per quantificare questi effetti, abbiamo usato metodi di analisi morfometrici. Nlg1 e Nrx le pergole nulle hanno mostrato significative riduzioni nell’area di copertura e nella lunghezza totale delle pergole rispetto ai controlli wild-type(Figura 4C e D). Non abbiamo trovato differenze tra i numeri totali delle diramazioni(Figura 4E). Le Nrx e le Nlg1 null arborisations non differivano significativamente tra loro in nessuna di queste misurazioni. Per determinare se la complessità dei pergolati era diversa in nulli abbiamo usato il metodo Strahler di ordinamento delle diramazioni(Figura 4F). Con questo non abbiamo trovato differenze nel numero massimo di ordini di diramazioni. Inoltre, il numero totale delle diramazioni di ordine più basso (terminale) non differisce in modo significativo tra i gruppi; una tendenza che è continuata per gli ordini successivi, con tutte le condizioni che hanno un numero di diramazioni notevolmente simile ad ogni livello.
La morfologia degli ultimi stadi Nlg1 e Nrx nulli indica un fabbisogno di queste proteine per la crescita, ma non ci dice quando sono necessarie. Per affrontare la tempistica del fabbisogno, abbiamo confrontato gli arboramenti nulli di Nlg1 con quelli dei controlli wild-type a 30-36 hr APF. PM-Mns in Nlg1 nulli in questa fase generano un numero simile di filopodi molto dinamici rispetto ai controlli. Una chiara differenza, tuttavia, è stata la ben maggiore “curvatura” – o tortuosità – dei rami nulli Nlg1 ( Figura 4G). Per valutare questo, abbiamo segnato i rami primari e secondari di Nlg1 nulli e le arborizzazioni di controllo messe in scena tra 30 hr e 36 hr APF utilizzando un indice di curvatura(Figura 4H). Questo è stato calcolato dalla differenza percentuale tra la lunghezza effettiva delle diramazioni e la distanza in linea retta tra i loro nodi. Nlg1 rami nulli sono risultati significativamente meno rettilinei di quelli dei controlli (Mann-Whitney U = 441, p<0,0001, a due code). Questo fenotipo precoce dimostra un requisito per la segnalazione Nlg1 durante le fasi molto iniziali dello sviluppo neuromuscolare pleurico.
Anche se i mutanti completi hanno mostrato fenotipi robusti e coerenti, c’è una limitazione su ciò che questi possono dirci. Non possono, ad esempio, rivelare se il fenotipo è dovuto ad un fallimento delle “interazioni locali” tra i partner sinaptici in via di sviluppo. Per affrontare questo problema abbiamo generato gli strumenti FlpStop basati su FLEX(Fisher et al., 2017) che permettono di interrompere in modo condizionato l’espressione endogena di Nlg1 in modo clonale(Figura 5A e B).
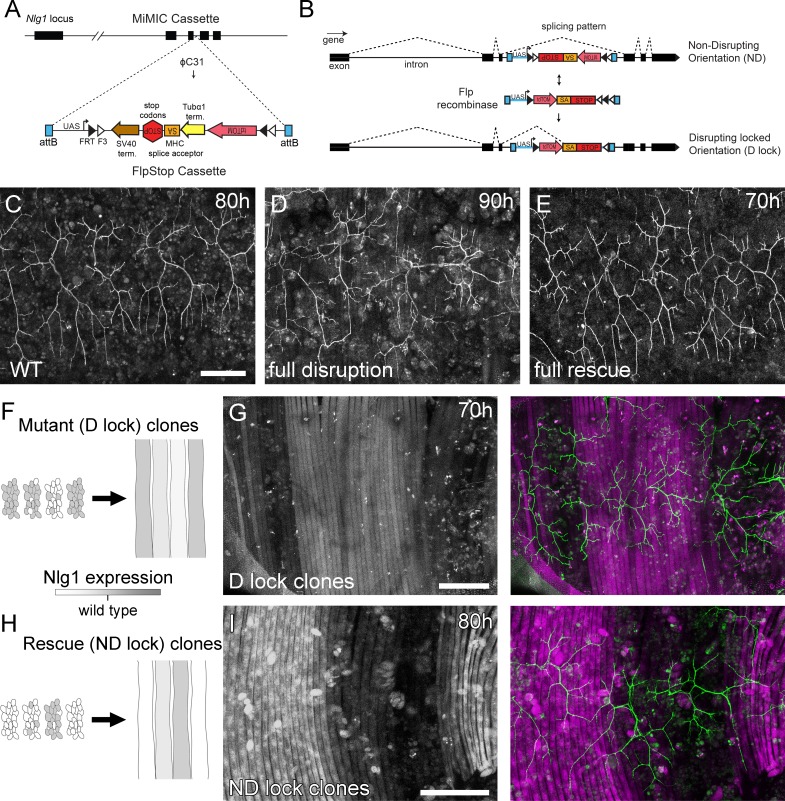
Figura 5.L’analisi del mosaico mostra un ruolo locale per la Neuroligine 1 endogena durante la crescita del pergolato.(A) Uno schema mostra l’inserimento diretto del costrutto FlpStop nel terzo introne di codifica del locus genomico Nlg1 mediante scambio di cassette mediato dalla ricombinasi (RMCE) con un sito di integrazione MiMIC.(B) Uno schema mostra il meccanismo dell’azione di FlpStop per l’interruzione condizionale di Nlg1 endogeno. Nell’orientamento inizialmente non perturbante (ND) l’accettore di giunzione e i codoni di arresto sono sul filamento non codificante e quindi non hanno effetto sulla funzione genica. In caso di inversione mediante ricombinasi FLP, i codoni di stop e di accettatore di giunzione vengono portati nel telaio sul filamento di codifica, con conseguente alterazione dell’espressione genica. La cassetta viene bloccata in questo orientamento di disturbo (D-lock) da un interruttore FLEx(Schnütgen et al., 2003). Inoltre, l’inversione porta la sequenza di codifica per tdTomato in prossimità con una sequenza UAS, abilitando l’espressione guidata da GAL4. Le linee FlpStop sono state generate anche nell’orientamento inizialmente di disturbo(D), che permette il salvataggio di Nlg1 (cloni ND-lock) e ‘accende’ tdTomato (Schema non mostrato).(C) Arborisations a 80 hr APF in un controllo di tipo wild-type(VGlut-LexA > myr::GFP).(D) L’induzione completa di cloni Nlg1 D-lock (che interrompono) utilizzando hsFlp e un lungo protocollo di shock termico produce difetti di crescita dell’arbor paragonabili ai mutanti Nlg1.(E) Germline ND-lock salva la crescita dell’albero in un fenotipo quasi selvaggio.(F) Lo schema mostra la formazione di fibre Nlg1 carenti dalla fusione dei mioblasti clonali D-lock indotti con hsFlp e un breve shock termico allo stadio larvale L3.(G) La crescita dell’arbor (visualizzato con VGlut-LexA) su regioni di D-lock cloni muscolari(Mef2-GAL4) è interrotta, mentre la crescita dell’arbor su regioni non clonali è vicino al wild-type.(H) Il modello mostra il salvataggio dell’espressione Nlg1 nelle fibre clonali formate dalla fusione dei mioblasti clonali ND-lock indotti con hsFlp e un breve shock termico allo stadio L3 larvale.(I) La crescita di Arbor sui cloni muscolari ND-lock è vicina al wild-type, mentre la crescita su regioni non clonali è interrotta. Barre di scala: 100 µm (C,D,E,G,I).
Utilizzando un inserimento MiMIC all’interno del terzo introne di codifica di Nlg1 abbiamo generato linee FlpStop in grado di salvare mosaicamente Nlg1 in uno sfondo mutante, o di interrompere mosaicamente Nlg1 in uno sfondo wild-type. Per la completa interruzione genica, le linee FlpStop sono state utilizzate in condizioni eterozigoti con un deficit che copre Nlg1. Per testare la capacità dell’orientamento non distruttivo (ND) di interrompere l’espressione di Nlg1 in caso di inversione della cassetta, abbiamo usato hsFlp per indurre un gran numero di cloni distruttivi (D-lock). Questi mostravano un fenotipo di crescita del perno molto simile a quello dei nulli Nlg1(Figura 5D). Per testare la capacità dell’orientamento perturbante (D) di essere convertito in un allele non perturbante (ND-lock), è stata generata una linea germinale invertita. In questo caso, la crescita del pergolato è stata salvata in un fenotipo quasi selvaggio(Figura 5E).
Per testare l’azione locale di Nlg1, abbiamo indotto un piccolo numero di cloni precursori muscolari FlpStop. Questo ha generato fibre contenenti un numero variabile di nuclei Nlg1 +ve (Figura 5F e H). Se visto in fasi comprese tra 70 hr e 85 hr APF, l’organizzazione di arborisations, rispetto al modello di fibre muscolari clonali, ha suggerito un ruolo locale per l’adesione mediata Nlg1 Nlg1 nella crescita dei rami. Utilizzando l’allele nell’orientamento inizialmente non dirompente, i terminali che crescono sul muscolo clonale non clonale / basso livello di muscolo clonale è apparso fenotipicamente più vicino a tipi selvatici, mentre i rami dei neuroni che crescono sul muscolo con più D-lock cloni visualizzati fenotipi paragonabili a nulli Nlg1 completo (vedi Figura 4B; n = 8 mosaici muscolari; Figura 5G) . Utilizzando l’allele nell’orientamento inizialmente perturbante è stata osservata la situazione inversa; i rami che crescono attraverso i miotoubi clonali ND-lock, in cui l’espressione Nlg1 è stata salvata, hanno mostrato morfologie più selvagge di quelle che crescono su fibre non clonali (n = 7 mosaici muscolari; Figura 5I) .

Figura 4.Neurexin e Neuroligin 1 sono necessari durante la crescita del pergolato.(A) Arborisations di assoni PM-Mn nei segmenti A3-A5 in un controllo wild-type, un Nlg1 null e un Nrx null in scena tra 76 ore e 78 ore APF(VGlut-LexA> myr::GFP). I punti gialli mostrano il contorno dell’epidermide(B) Le pergole più anteriori nel segmento A3 (A3-A) in stadi compresi tra 75 hr e 85 hr APF. Gli arborisations appartenenti ad altri motoneuroni a fianco sono stati rimossi utilizzando l’elaborazione delle immagini.(C-F) Analisi morfometrica degli arborisations A3-A di Nlg1 nulli (n = 11), Nrx nulli (n = 8 ) e controlli wild-type (n = 13) in stadi compresi tra 75 hr e 85 hr APF.(C) Nlg1 e Nrx nulli coprono territori significativamente più bassi (controlli: 47445 ± 2298 µm2, Nlg1: 29616 ± 3259 µm2, Nrx: 32696 ± 4565 µm2. Nlg1 vs controlli: t(22) = 15,67, p<0,0001. Nrx vs controlli: t(19) = 9,89, p<0,0001. t-test, a due code) (D) Totale PM-Mn controlli lunghezza perni: 2251 ± 140 µm, Nlg1: 1785 ± 265 µm, Nrx : 1758 ± 306 µm. Nlg1 vs controlli: t(22) = 5,51, p<0,0001. Nrx vs controlli: t(19) = 5,07, p<0,0001. t-test, a due code), sono significativamente diversi.(E) Il numero totale delle diramazioni PM-Mn non è significativo (controlli: 84,38 ± 10,97, Nlg1: 86,00 ± 14,74, Nrx: 91.88 ± 23.27. Nlg1 contro i controlli: t(22) = 0,31, p=0,76. Nrx contro i controlli: t(19) = 1,00, p=0,33. t-test, a due code).(F) Nlg1 nulli, Nrx nulli e controlli non erano diversi nella loro organizzazione topologica. I nulli non si differenziano dai controlli nel loro numero totale di rami (controlli) di ordine superiore (terminali): 43,31 ± 5,59, Nlg1: 44,27 ± 7 ,56, Nrx: 47.00 ± 11.50. Nlg1 contro i controlli: t(22) = 0,36, p=0,72. Nrx contro i controlli: t(19) = 0,99, p=0,33. t-test, a due code) o nel loro numero totale di ordini (controlli: 11,62 ± 1,94, Nlg1: 11,27 ± 2, 15, Nrx: 11.88 ± 2.36. Nlg1 contro i controlli: t(22) = 0,41, p=0,67. Nrx contro i controlli: t(19) = 0,27, p=0,79. t-test, a due code).(G) Nelle prime fasi di crescita Nlg1 arborisations nulli possiedono un certo numero di rami che sono cresciuti precocemente, ma sono più tortuosi e con un minor numero di rami laterali rispetto ai tipi selvatici.(H) Piegatura dei rami di PM–Mns arbors tra 32 hr e 36 hr APF. La curvatura è stata misurata come differenza percentuale tra la lunghezza effettiva e la lunghezza rettilinea dei rami primari (terminali) e secondari. I rami di Nlg1 nulli sono meno rettilinei (4,13 ± 3,57%, n = 48) rispetto ai controlli (1,89 ± 2,41%, n = 38) nelle fasi tra 32 hr e 36 hr APF (Mann-Whitney U = 441, p<0,0001, a due code). Le barre rappresentano gli SD. Barre di scala: 100 µm (A),50 µm (B,G).

Figura 5.L’analisi del mosaico mostra un ruolo locale per la Neuroligine 1 endogena durante la crescita del pergolato.(A) Uno schema mostra l’inserimento diretto del costrutto FlpStop nel terzo introne di codifica del locus genomico Nlg1 da ricombinasi mediata scambio di cassette (RMCE) con un sito di integrazione MiMIC.(B) Uno schema mostra il meccanismo dell’azione di FlpStop per l’interruzione condizionale di Nlg1 endogeno. Nell’orientamento inizialmente non perturbante (ND) l’accettore di giunzione e i codoni di arresto sono sul filamento non codificante e quindi non hanno effetto sulla funzione genica. In caso di inversione mediante ricombinasi FLP, i codoni di stop e di accettatore di giunzione vengono portati nel telaio sul filamento di codifica, con conseguente alterazione dell’espressione genica. La cassetta viene bloccata in questo orientamento di disturbo (D-lock) da un interruttore FLEx(Schnütgen et al., 2003). Inoltre, l’inversione porta la sequenza di codifica per tdTomato in prossimità con una sequenza UAS, abilitando l’espressione guidata da GAL4. Le linee FlpStop sono state generate anche nell’orientamento inizialmente di disturbo(D), che permette il salvataggio di Nlg1 (cloni ND-lock) e ‘accende’ tdTomato (Schema non mostrato).(C) Arborisations a 80 hr APF in un controllo di tipo wild-type(VGlut-LexA > myr::GFP).(D) L’induzione completa di cloni Nlg1 D-lock (che interrompono) utilizzando hsFlp e un lungo protocollo di shock termico produce difetti di crescita dell’arbor paragonabili ai mutanti Nlg1.(E) Germline ND-lock salva la crescita dell’albero in un fenotipo quasi selvaggio.(F) Lo schema mostra la formazione di fibre Nlg1 carenti dalla fusione dei mioblasti clonali D-lock indotti con hsFlp e un breve shock termico allo stadio larvale L3.(G) La crescita dell’arbor (visualizzato con VGlut-LexA) su regioni di D-lock cloni muscolari(Mef2-GAL4) è interrotta, mentre la crescita dell’arbor su regioni non clonali è vicino al wild-type.(H) Il modello mostra il salvataggio dell’espressione Nlg1 nelle fibre clonali formate dalla fusione dei mioblasti clonali ND-lock indotti con hsFlp e un breve shock termico allo stadio L3 larvale.(I) La crescita di Arbor sui cloni muscolari ND-lock è vicina al wild-type, mentre la crescita su regioni non clonali è interrotta. Barre di scala: 100 µm (C,D,E,G,I).
Complessi dinamici di proteine di adesione “sinaptiche” stabilizzano i filopodi e guidano la crescita dei rami
Una previsione da questi dati mutanti è che Nlg1 potrebbe ‘prepattern’ le giunzioni neuromuscolari PM, come si vede con i recettori dell’acetilcolina nei muscoli somatici del pesce zebra (Panzeret al., 2006). Per esplorare questa idea abbiamo esaminato la localizzazione del Nlg1 postsinaptico usando il GFP etichettato Nlg1(Banovic et al., 2010) espresso sotto il controllo del Mef2-GAL4. A 35 ore APF Nlg1::GFP etichetta debolmente l’intera membrana postsinaptica, ma forma un forte puncta solo nei siti che applicano direttamente i terminali assonali(Figura 6A). Ingrandimenti più elevati hanno mostrato una concentrazione di puncta sui rami assonali in crescita, in particolare nei punti di ramificazione e nelle punte stesse dei filopodi esplorativi(Figura 6B e Video 7).
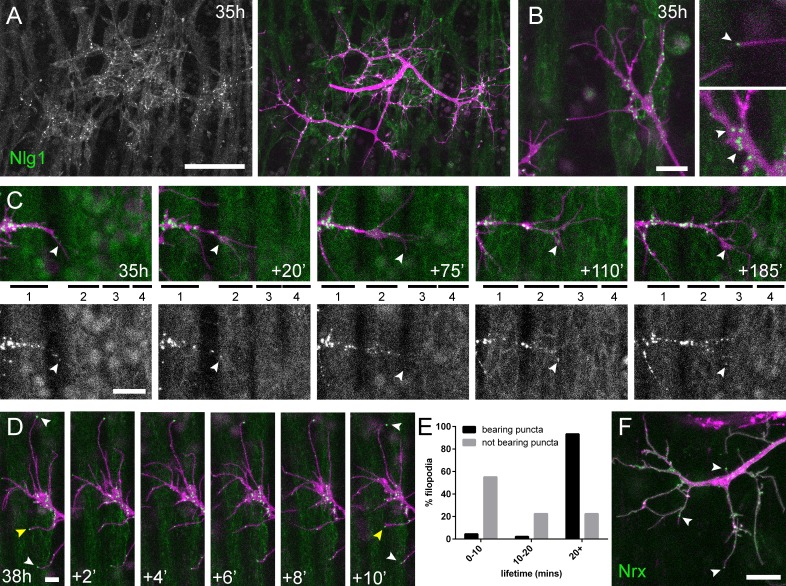
Figura 6.Complessi di adesione neuritici (CNA) contenenti Neurexin e Neuroligin 1 stabilizzano i filopodi durante la crescita del pergolato.(A) Nlg1::GFP(Mef2-GAL4; verde) espresso in muscoli a 35 hr APF forme puncta sulla membrana postsinaptica che sono disposti esclusivamente in apposizione con i terminali assone(VGlut-LexA> myr::tdTomato; magenta).(B) Gli ingrandimenti più elevati mostrano la concentrazione di Nlg1::GFP puncta nei siti di crescita dei rami e nelle punte dei filopodi.(C) L’estensione e la stabilizzazione dei filopodi sono concomitanti con il reclutamento di Nlg1::GFP puncta (punte di freccia bianche) alle loro punte. Le serie temporali mostrano l’estensione di un ramo attraverso un campo muscolare a 35 ore APF (miotubi numerati da anteriore a posteriore).(D) Dettaglio della relazione tra le dinamiche di filopodia e Nlg1::GFP puncta. Puncta (punte di freccia bianche) segnano le punte dei filopodi che persistono. La punta della freccia gialla indica un punctum che segna il limite della retrazione filopodiale.(E) Rapporto tra la durata della vita di filopodia e Nlg1::GFP puncta. Istogramma che mostra la durata della vita dei filopodi con Nlg1::GFP puncta in punta (n = 45) e senza puncta in punta (n = 49). Filopodia con Nlg1::GFP puncta erano significativamente più longeve di quelle senza puncta (con puncta: 19,36 ± 2,82 min, senza puncta: 10,73 ± 6,88 min, Mann-Whitney U = 305,5, p<0,0001, a due code).(F) Localizzazione di Nrx::GFP(OK371-GAL4; verde) in PM-Mn crescente arborizzazione assonale a 35 ore APF(mCD8::ChRFP; magenta). Le punte di freccia indicano puncta posizionata su filopodia. Le barre rappresentano le SD. Barre di scala: 50 µm (A),10 µm (B,F), 20µm(C), 5 µm (D).

Video 7.Nlg1::Le PFP puncta sono correlate alla stabilità e alla crescita dei filopodi.Nlg1::GFP (verde) nelle forme muscolari puncta che decorano i terminali assonali (magenta), in particolare nei siti di crescita dei filopodi e sulle punte dei filopodi (38 ore APF; Mef2-GAL4> Nlg1::GFP, VGlut-LexA > myr::tdTomato). I filopodi che hanno una punta stabile Nlg1::GFP puncta sono significativamente più longevi e meno mobili di quelli che non lo sono. I filopodi si ritraggono solo fino al punto dell’ultimo Nlg1 stabile::GFP punctum. I fotogrammi sono ripresi a intervalli di 1 min. Formato temporale: hh:mm.
Per chiedere come Nlg1::GFP viene reclutato alle filiali abbiamo registrato una crescita a intervalli di 5 minuti a 35 hh:mm(Figura 6C). In questo filmato abbiamo scoperto che Nlg1::GFP puncta vengono reclutate direttamente su filopodia e sulle punte delle filiali. Di conseguenza, la crescita dei rami avviene come una sequenza altamente coordinata in cui l’arrivo di Nlg1::GFP sui processi esplorativi precede la loro stabilizzazione e maturazione in rami stabili in modo iterativo.
Il reclutamento dinamico di Nlg1::GFP puncta a rami in crescita e filopodia indica un ruolo strutturale importante per Nlg1 durante la crescita precoce dei pergolati. Per esaminare la relazione tra Nlg1::GFP puncta e le dinamiche filopodiche/ramovie, abbiamo preso delle sequenze temporali più frequenti di arboricoltura tra le 30 ore e le 35 ore APF. Mostrato nella serie in Figura 6D, Nlg1::GFP puncta in applicazione ai coni di crescita e filopodi sono stati spesso trovati stabili per molti minuti. Inoltre, puncta in apposizione ai filopodi sembrava correlare con la longevità dei filopodi (punte di freccia bianche), e ha segnato regolarmente i limiti della retrazione filopodiale (punta di freccia gialla). Per valutare questa relazione, abbiamo analizzato la durata della vita dei filopodi con e senza Nlg1::puncta in time-laps di sette individui. Nel grafico della Figura 6E, il 55,1% dei filopodi non apposti a puncta (n = 49 filopodi) sono andati persi entro 10 minuti, il 22,5% sono andati persi entro 20 minuti e un ulteriore 22,5% è durato più a lungo della durata dei filopodi. D’altra parte, solo il 4,4% (2 filopodio) della popolazione apposta per puncta (n = 45 filopodio) è andato perso entro 10 minuti, il 2,2% (1 filopodio) è andato perso entro 20 minuti e il 93,3% è sopravvissuto più a lungo della durata delle registrazioni. Così, i filopodio segnalati da Nlg1::GFP puncta sono stati significativamente più longevi dei filopodio non recanti puncta(Figura 6E).
I principali partner trans-sinaptici di Neuroligins sono i Neurexins. Una previsione naturale da questo sarebbe che la Nrx presinaptica rispecchia la distribuzione postsinaptica di Nlg1::GFP. Utilizzando le GFP etichettate Nrx1 (qui di seguito denominate Nrx)(Banovic et al., 2010) espresse in motoneuroni abbiamo osservato una distribuzione puntuale nei rami in crescita, in particolare nei punti di crescita dei filipodi e nelle punte filopodiali, proprio come Nlg1::GFP(Figura 6F e Video 8). Il basso segnale e il rapido sbiancamento di Nrx::GFP hanno reso difficile seguire la dinamica delle Nrx in vivo per periodi più lunghi.

Video 8.Nrx::GFP localizza i terminali degli assoni in crescita.
Nrx::GFP espressa nel PM-Mns(OK371-GAL4) ricopre debolmente la membrana assonale, ma si forma fortemente etichettato puncta in siti equivalenti a Nlg1::GFP cioè nei terminali di ramo e alle punte di filopodia (35 hr APF). Cornici registrate ad intervalli di 1 min. Formato orario: hh:mm.
Accanto a Nrx abbiamo anche guardato due attori chiave nello sviluppo presinaptico; Syd-1 e Liprin-α. Liprin-α (proteina Lar interagente) è una proteina dell’impalcatura che è uno dei primi componenti reclutati per i complessi trans-sinaptici Nrx-Nlg1 (Owald et al.,2012). Liprin-α::GFP (Fouquetet al., 2009) è stato espresso in motoneuroni con OK371-GAL4 . Molto simile a Nrx::GFP, Liprin-α::GFP forma puncta distinti ai terminali di ramo e all’interno di filopodia (Figura 7A). Analogamente a Nlg1 postsinaptico::GFP, abbiamo trovato che il Liprin-α::GFP puncta presinaptico spesso segna i limiti della retrazione filopodiale (Figura 7B) e sembrava correlare con la stabilità filopodiale (vedi Video 9). Infatti, i filopodi con Liprinα::GFP puncta erano significativamente più longevi di quelli che non lo erano (Figura 7C). Sembra che il Liprin-α::GFP si fonde in puncta direttamente sui filopodi (Figura 7D). Per chiedere se Liprin-α::GFP puncta segna i complessi di adesione abbiamo esaminato la localizzazione di un altro interlocutore conosciuto, Syd1. Syd1::GFP(Owald et al., 2010), come Liprin-α::GFP, forma dei puncta che si localizzano all’interno dei terminali dei rami in crescita, anche sulle punte dei filopodi (dati non mostrati). Per vedere se queste due proteine colocalizzano negli stessi siti abbiamo espresso Liprin-α::GFP insieme a Strawberry con il tag Syd1 (Syd1::Straw) (Owaldet al., 2010). La grande maggioranza dei puncta di ogni proteina erano coincidenti, compresi quelli alle punte dei filopodi(Figura 7E). Al contrario, quando Liprin-α::GFP e BRP: :RFP sono stati espressi insieme, c’è stata pochissima co-localizzazione nei punti di di diramazione e mai nelle punte dei filopodi (Figura 7F). Solo molto più tardi nello sviluppo BRP e Liprin-α diventano disposti come nelle zone attive a NMJ larvale (Fouquet etal., 2009), con cluster di Liprin-α a fianco dei bordi di BRP puncta (Figura 7G).
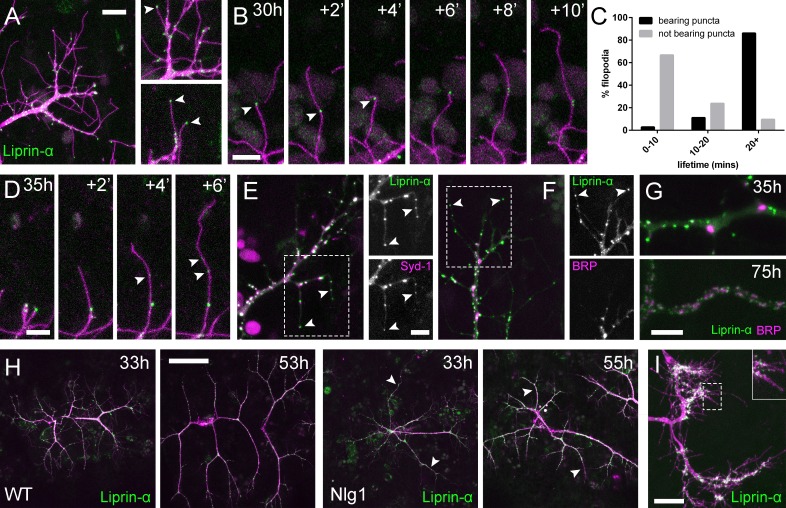
Figura 7.Complessi di adesione neuritici (NAC) contengono Liprin-α e Syd1.(A) Localizzazione di Liprin-α::GFP in crescita PM-Mn assonale arborizzazione assonale a 35 ore APF. Liprin-α::GFP ( verde) espressa con mCD8: :ChRFP (OK371-GAL4; magenta). Le immagini dello spaccato mostrano Liprin-α::GFP puncta nei rami e nelle punte dei filopodi (punte di freccia).(B) Dettaglio che mostra l’estensione di un filopodio e la sua retrazione solo fino a un Liprin-α::GFP punctum (punte di freccia).(C) Istogramma che mostra la durata di vita dei filopodio con Liprin-α::GFP puncta in punta (n = 36) e senza puncta in punta (n = 21). Filopodia con Liprin-α::GFP puncta ha vissuto significativamente più a lungo di quelli senza puncta (con puncta: 19,44 ± 1,96 min, senza puncta: 8,81 ± 5,88 min, Mann-Whitney U = 51,5, p<0,0001, a due code).(D) Le serie temporali mostrano la rapida precipitazione di nuove Liprin-α::GFP puncta (indicata dalle punte delle frecce) all’interno di un filopodio.(E) Liprin-α::GFP e Syd-1 ::Straw pun cta co-localizza nei terminali PM-Mn in crescita, anche nelle punte dei filopodio, (punte di freccia). Lieve disallineamento dovuto ai canali di imaging sequenziale.(F) Liprin-α::GFP e BRP::RFP solo co-localizzare in alcuni siti. BRP::RFP puncta non si trovano all’interno di filopodia.(G) Liprin::GFP e BRP::RFP puncta occupano regioni subcellulari distinte a 35hAPF. A 75hAPF Liprin::GFP diventa localizzato ai margini di BRP::RFP puncta lungo i rami.(H) Arborisations wild-type e Nlg1 null arborisations che esprimono Liprin-α::GFP e mCD8: :ChRFP immaginato a 33hAPF e ~20h più tardi. Rami insolitamente lunghi e non ramificati di Nlg1 nulli (punte di freccia bianche) mancano di Liprin-α::GFP puncta e sono crollati da fasi successive (I) In Eve + ve interneurons Liprin-α::GFP forma puncta distinti sulla filopodia dei terminali assonali in crescita a 24 hr APF. Le barre rappresentano le SD. Barre di scala: 10 µm (A), 5 µm (B,D,E/F,G), 50 µm (H), 20 µm (I).

Video 9.Liprin-α::Le GFP puncta sono correlate alla stabilità e alla crescita dei filopodi.
10.Liprin-α::Le GFP ( verdi) espresse in motoneuroni (magenta) hanno una localizzazione puntuale come Nlg1 e Nrx a 35 ore APF. Come Nlg1::GFP, Liprin-α::GFP puncta alle punte filopodiali sono fortemente correlati con la stabilità filopodiale e segnano regolarmente i limiti della retrazione filopodiale.(OK371-GAL4> mCD8::Cherry+ Liprin-α::GFP). Cornici registrate a intervalli di 30 s. Formato orario: mm:ss.
Per esplorare se la localizzazione di Liprin-α richiede Nlg1, abbiamo guardato Liprin-α::GFP in Nlg1 nulli ( Figura 7H). Senza Nlg1 abbiamo trovato che il Liprin-α::GFP si localizza ancora ai terminali assonali in crescita, anche alle punte di alcuni filopodi. A un esame più attento, tuttavia, abbiamo trovato che Liprin-α::GFP puncta sono in gran parte assenti dai rami terminali insolitamente lunghi e non ramificati, tipici dei crescenti Nlg1 null arborisations (punte di freccia bianche). Quando sono seguiti, questi rami collassano invariabilmente all’indietro o non riescono a crescere ulteriormente (n = 4 arborisations da quattro individui), con il risultato di avere il caratteristico aspetto stentato degli arborisations null di Nlg1.
Infine, per determinare la distribuzione subcellulare di Liprin-α::GFP nel sistema nervoso centrale abbiamo guardato Eve + ve interneurons. Come nei terminali assonali in crescita dei neuroni PM-Mn, Liprin-α::Le GFP sono localizzate sulle punte e lungo le lunghezze dei filopodi sugli arborisations assonali in crescita (Figura 7I).

Figura 6.Complessi di adesione neuritici (CNA) contenenti Neurexin e Neuroligin 1 stabilizzano i filopodi durante la crescita degli arbor.(A) Nlg1::GFP(Mef2-GAL4; verde) espresso in muscoli a 35 hr APF forme puncta sulla membrana postsinaptica che sono disposti esclusivamente in apposizione con i terminali assone(VGlut-LexA> myr::tdTomato; magenta).(B) Gli ingrandimenti più elevati mostrano la concentrazione di Nlg1::GFP puncta nei siti di crescita dei rami e nelle punte dei filopodi.(C) L’estensione e la stabilizzazione dei filopodi sono concomitanti con il reclutamento di Nlg1::GFP puncta (punte di freccia bianche) alle loro punte. Le serie temporali mostrano l’estensione di un ramo attraverso un campo muscolare a 35 ore APF (miotubi numerati da anteriore a posteriore).(D) Dettaglio della relazione tra le dinamiche di filopodia e Nlg1::GFP puncta. Puncta (punte di freccia bianche) segnano le punte dei filopodi che persistono. La punta della freccia gialla indica un punctum che segna il limite della retrazione filopodiale.(E) Rapporto tra la durata della vita di filopodia e Nlg1::GFP puncta. Istogramma che mostra la durata della vita dei filopodi con Nlg1::GFP puncta in punta (n = 45) e senza puncta in punta (n = 49). Filopodia con Nlg1::GFP puncta erano significativamente più longeve di quelle senza puncta (con puncta: 19,36 ± 2,82 min, senza puncta: 10,73 ± 6,88 min, Mann-Whitney U = 305,5, p<0,0001, a due code).(F) Localizzazione di Nrx::GFP(OK371-GAL4; verde) in PM-Mn crescente arborizzazione assonale a 35 ore APF(mCD8::ChRFP; magenta). Le punte di freccia indicano puncta posizionata su filopodia. Le barre rappresentano le SD. Barre di scala: 50 µm (A),10 µm (B,F), 20µm(C), 5 µm (D).

Video 7.Nlg1::Le PFP puncta sono correlate alla stabilità e alla crescita dei filopodi.Nlg1::GFP (verde) nelle forme muscolari puncta che decorano i terminali assonali (magenta), in particolare nei siti di crescita dei filopodi e sulle punte dei filopodi (38 ore APF; Mef2-GAL4> Nlg1::GFP, VGlut-LexA > myr::tdTomato). I filopodi che hanno una punta stabile Nlg1::GFP puncta sono significativamente più longevi e meno mobili di quelli che non lo sono. I filopodi si ritraggono solo fino al punto dell’ultimo Nlg1 stabile::GFP punctum. I fotogrammi sono ripresi a intervalli di 1 min. Formato temporale: hh:mm.

Video 8.Nrx::GFP localizza i terminali assonali in crescita.
Nrx::GFP espressa nel PM-Mns(OK371-GAL4) ricopre debolmente la membrana assonale, ma si forma fortemente etichettato puncta in siti equivalenti a Nlg1::GFP cioè nei terminali di ramo e alle punte di filopodia (35 hr APF). Cornici registrate ad intervalli di 1 min. Formato orario: hh:mm.

Figura 7.I complessi di adesione neuritici (NAC) contengono Liprin-α e Syd1.(A) Localizzazione di Liprin-α::GFP in crescita PM-Mn assonale arborizzazione assonale a 35 hr APF. Liprin-α::GFP ( verde) espressa con mCD8: :ChRFP (OK371-GAL4; magenta). Le immagini dello spaccato mostrano Liprin-α::GFP puncta nei rami e nelle punte dei filopodi (punte di freccia).(B) Dettaglio che mostra l’estensione di un filopodio e la sua retrazione solo fino a un Liprin-α::GFP punctum (punte di freccia).(C) Istogramma che mostra la durata di vita dei filopodio con Liprin-α::GFP puncta in punta (n = 36) e senza puncta in punta (n = 21). Filopodia con Liprin-α::GFP puncta ha vissuto significativamente più a lungo di quelli senza puncta (con puncta: 19,44 ± 1,96 min, senza puncta: 8,81 ± 5,88 min, Mann-Whitney U = 51,5, p<0,0001, a due code).(D) Le serie temporali mostrano la rapida precipitazione di nuove Liprin-α::GFP puncta (indicata dalle punte delle frecce) all’interno di un filopodio.(E) Liprin-α::GFP e Syd-1 ::Straw pun cta co-localizza nei terminali PM-Mn in crescita, anche nelle punte dei filopodio, (punte di freccia). Lieve disallineamento dovuto ai canali di imaging sequenziale.(F) Liprin-α::GFP e BRP::RFP solo co-localizzare in alcuni siti. BRP::RFP puncta non si trovano all’interno di filopodia.(G) Liprin::GFP e BRP::RFP puncta occupano regioni subcellulari distinte a 35hAPF. A 75hAPF Liprin::GFP diventa localizzato ai margini di BRP::RFP puncta lungo i rami.(H) Arborisations wild-type e Nlg1 null arborisations che esprimono Liprin-α::GFP e mCD8: :ChRFP immaginato a 33hAPF e ~20h più tardi. Rami insolitamente lunghi e non ramificati di Nlg1 nulli (punte di freccia bianche) mancano di Liprin-α::GFP puncta e sono crollati da fasi successive (I) In Eve + ve interneurons Liprin-α::GFP forma puncta distinti sulla filopodia dei terminali assonali in crescita a 24 hr APF. Le barre rappresentano le SD. Barre di scala: 10 µm (A), 5 µm (B,D,E/F,G), 50 µm (H), 20 µm (I).

Video 9.Liprin-α::Le GFP puncta sono correlate alla stabilità e alla crescita dei filopodi.
10.Liprin-α::Le GFP ( verdi) espresse in motoneuroni (magenta) hanno una localizzazione puntuale come Nlg1 e Nrx a 35 ore APF. Come Nlg1::GFP, Liprin-α::GFP puncta alle punte filopodiali sono fortemente correlati con la stabilità filopodiale e segnano regolarmente i limiti della retrazione filopodiale.(OK371-GAL4> mCD8::Cherry+ Liprin-α::GFP). Cornici registrate a intervalli di 30 s. Formato orario: mm:ss.
I complessi di adesione basati su Nlg1 possono dirigere la crescita in modo tropicale
La relazione tra Nlg1::GFP puncta e la dinamica filopodiale indica un ruolo per Nlg1 nella crescita degli arborisations assonali fornendo stabilità adesiva a rami e filopodi. Una previsione diretta da ciò sarebbe che se manipolassimo i livelli postsinaptici di Nlg1 nelle fasi iniziali vedremmo corrispondenti cambiamenti nella crescita di PM-Mn. Per esplorare questo abbiamo usato UAS-Nlguntaggedche è noto per essere espresso ad alti livelli e causa un forte fenotipo larvale NMJ(Banovic et al., 2010).
I livelli di Nlg1 postsinaptici elevati hanno portato alla compattazione dei terminali assonali a 33-35 ore APF, con rami distali trasformati in coni di crescita appiattiti con molti filopodi (Figura 8A e B). Questo effetto significativo sulla crescita ha portato ad arborizzazioni in fase avanzata con riduzione della lunghezza dei rami, del territorio e della complessità(Figura 8C e D). Questi rami hanno anche mantenuto un numero maggiore del solito di filopodi nelle fasi successive di sviluppo.
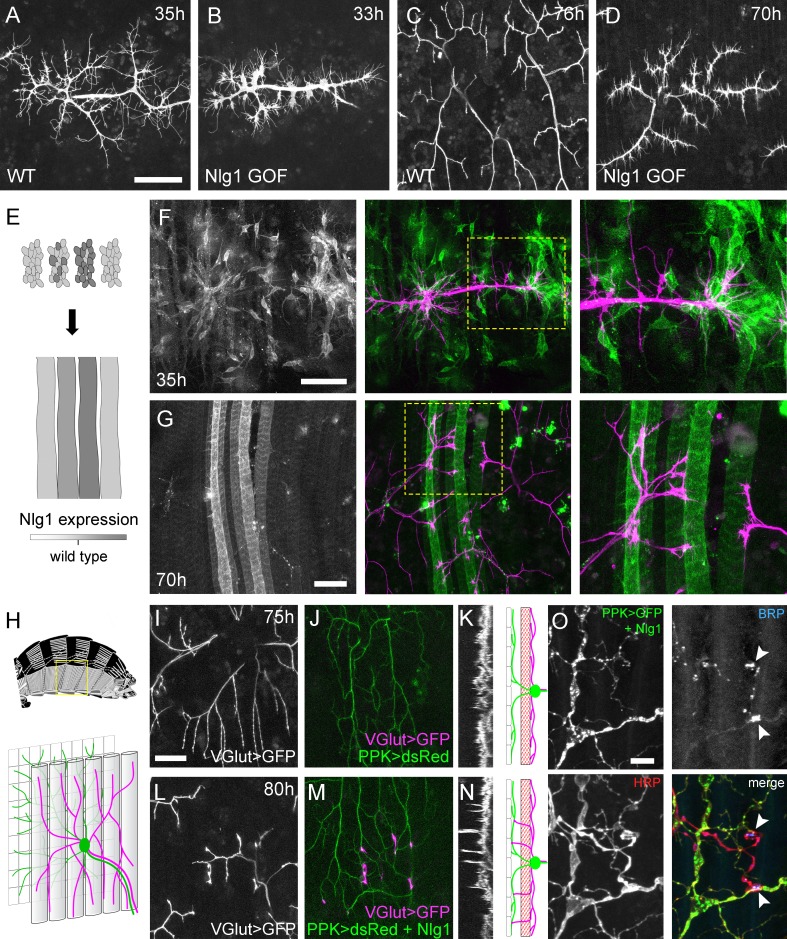
Figura 8.Neuroligin 1 agisce localmente per guidare la crescita precoce degli arboricelli.(A-D) La sovraespressione post-sinaptica Nlg1 perturba la crescita degli assoni PM-Mn.(A) Controlla gli arbitri PM-Mn a 35 ore APF e(B), PM-MN Arborisations a 33 ore APF in uno sfondo di postsinaptico Nlg1non contrassegnato espressione(Mef2-GAL4; VGlut-LexA> myr::GFP).(C) Arborisations di controllo a 76 ore APF.(D) Arborisations in un sottofondo di muscolo specifico Nlg1untagged espressione a 70 ore APF(E) Schema di generazione di cloni “flip-out”. Cloni precursori muscolari indotti con hsFlp a stadi L3 larvali producono cluster di GAL80 mioblasti negativi che si fondono per formare ‘strisce’ di fibre muscolari clonali che esprimono Nlg1untagged e myr::tdTomato.(F) A 35 ore APF, i rami dei motoneuroni PM-Mn (magenta) mostrano un’elaborazione preferenziale su Nlg1clonale.untagged che esprimono i miotobi e i mieioblasti (verdi).(G) Rami assonali a contatto con cloni, Nlg1untagged Le fibre muscolari che esprimono le fibre muscolari mostrano un fenotipo di iper-stabilizzazione. La crescita dei rami sembra essere preferibilmente diretta lungo le fibre clonali.(H-O) Espressioneectopica di Nlg1 in classe IV da neuroni sensoriali guida i cambiamenti nella morfologia assonale del motoneurone pergola assonale.(H) Lo schema mostra le posizioni relative di classe IV v’ada sensoriali di ingresso arborisations (verde), muscoli pleurici (tubi grigi) e assoni motori arborisations (magenta) nella parete pleurica del corpo addominale (schema della muscolatura adattato da Demerec , 1950).(I) Terminali degli assoni motori che esprimono il myr::GFP(VGlut-LexA) a 80 ore APF in un controllo(J) gli arborisations di ingresso v’ada nella stessa regione che esprime dsRed (PPK-Gal4; Grueber et al., 2003).(K) La proiezione trasversale mostra gli algoritmi assonali PM-Mn limitati ad un singolo piano. La proiezione trasversale schematica mostra la separazione dell’arborizzazione v’ada (verde) dai terminali degli assoni motori (magenta) da parte dei muscoli pleurici (rosso).(L-N) Nlg1untagged espressione in classe IV da neuroni sensoriali risultati in rami assonali che penetrano gli spazi vuoti tra le fibre muscolari ed entrano in contatto con gli arborisations sensoriali. Questi rami aberranti sono mostrati nella vista trasversale e corrono perpendicolarmente al resto dell’arborizzazione.(O) Filetto addominale di un adulto appena chiuso che esprime Nlg1untagged e CD8::GFP nella classe IV da neuroni sensoriali. Anti-HRP rivela i terminali degli assoni motori e l’immunoreattività BRP rivela le specializzazioni presinaptiche ai contatti tra gli assoni motori e l’arborizzazione sensoriale (punte di freccia). Barre di scala: 50 µm (A,B,C,D,F,G), 25 µm (I,J,L,M),5 µm (O).
Sebbene la sovraespressione postsinaptica completa di Nlg1untagged ha rivelato che i terminali degli assoni sono sensibili ai livelli di Nlg1 fin dalle primissime fasi, per esplorare come i diversi livelli di segnalazione Nlg1 incidono sulla crescita dei rami a livello locale abbiamo sviluppato una tecnica clonale per generare modelli di espressione molto simile al saggio ‘Bonhoeffer stripe’ (Walteret al., 1987). Con questo ‘saggio a strisce’ presentiamo motoneuroni in crescita con miotubi che esprimono diversi livelli di Nlg1untaggedsu cui crescere (Figura 8E). Nelle prime fasi (35 ore APF), la crescita PM-Mn sembrava essere diretto su cluster mioblasti / sviluppo miotubi che esprimono fortemente il Nlg1untagged(Figura 8F). Nelle fasi successive (70 ore APF), i rami a contatto con queste fibre clonali fortemente esprimono lo stesso fenotipo di iper-stabilizzazione visto con piena espressione muscolare. Al contrario, i rami dello stesso neurone a contatto con fibre da basse a non espressive sono cresciuti come al solito, dimostrando inequivocabilmente che Nlg1 impatta la crescita dei rami attraverso meccanismi locali(Figura 8G). Anche se i rami a contatto con le fibre altamente espressive avevano ridotto la crescita e la ramificazione, a volte si poteva vedere che si elaboravano lungo una fibra clonale, suggerendo che è in gioco una modalità di crescita ‘tropicale’.
Per indagare ulteriormente la segnalazione Nlg1 sulla crescita dei rami abbiamo approfittato dell’organizzazione del sistema nervoso sensoriale nella parete addominale del corpo. Come mostrato in Figura 8H, il neurone sensoriale dendritico dendritico di classe IV, v’ada, elabora sull’epidermide. I neuroni periferici di v’ada sono normalmente separati dai rami assonali motori dai muscoli pleurici dorsoventrali, che a loro volta sono innervati dal PM-Mns sulla loro superficie interna. Durante lo sviluppo precoce della pupilla, sia motore e arborisations sensoriali si trovano in prossimità molto vicino. Abbiamo previsto che se esprimessimo Nlg1 in questi neuroni sensoriali, la segnalazione indirizzerebbe la crescita degli arborisations PM-Mn in un nuovo territorio e li incoraggerebbe a fare connessioni con questi dendriti sensoriali normalmente ‘asinaptici’. Abbiamo espresso Nlg1untagged nei neuroni v’ada e poi visualizzava l’anatomia dei motoneuroni. Nei controlli, la crescita dei rami è stata limitata esclusivamente alla superficie interna del muscolo(Figura 8I e J). Questo è evidenziato da una proiezione trasversale, che mostra uno strato relativamente uniforme di terminali dei motoneuroni(Figura 8K). Al contrario, quando v’ada è stato fatto per esprimere male Nlg1untaggedPM-Mn rami assone crescono perpendicolari alla normale arborizzazione tra le fibre muscolari a contatto con i neurite sensoriali v’ada (Figura 8L-N). In diversi casi ulteriore ramificazione da questi contatti ha aumentato la complessità di questi rami ectopici PM-Mn.
Un postulato del modello tropicale di Vaughn di crescita dell’arborizzazione era che la stabilizzazione dei contatti tra i partner sinaptici putativi avrebbe portato alla connettività funzionale (Vaughn, 1989). Affinché ciò sia soddisfatto, le diramazioni generate da tale meccanismo dovrebbero ospitare terminali sinaptici maturi in seguito allo sviluppo. Abbiamo esaminato le diramazioni assonali in contatto con i dendriti dei neuroni sensoriali che esprimono Nlg1untagged in filetti addominali macchiati per il marcatore della zona attiva BRP (anticorpo nc82) e con il marcatore neurale anti-HRP. Come mostrato in Figura 😯, ad ogni contatto sono state trovate cospicue concentrazioni di BRP. Oltre a questo, abbiamo anche trovato forte immunoreattività VGlut a questi contatti sinaptici ectopici (dati non mostrati).

Figura 8.Neuroligin 1 agisce localmente per guidare la crescita precoce del pergolato.(A-D) La sovraespressione post-sinaptica Nlg1 perturba la crescita degli assoni assonali PM-Mn.(A) Controlla gli arbitri PM-Mn a 35 ore APF e(B), PM-MN Arborisations a 33 ore APF in uno sfondo di postsinaptico Nlg1untagged espressione(Mef2-GAL4; VGlut-LexA> myr::GFP).(C) Arborisations di controllo a 76 ore APF.(D) Arborisations in un sottofondo di muscolo specifico Nlg1untagged espressione a 70 ore APF(E) Schema di generazione di cloni “flip-out”. Cloni precursori muscolari indotti con hsFlp a stadi L3 larvali producono cluster di GAL80 mioblasti negativi che si fondono per formare ‘strisce’ di fibre muscolari clonali che esprimono Nlg1untagged e myr::tdTomato.(F) A 35 ore APF, i rami dei motoneuroni PM-Mn (magenta) mostrano un’elaborazione preferenziale su Nlg1clonale.untagged che esprimono i miotobi e i mieioblasti (verdi).(G) Rami assonali a contatto con cloni, Nlg1untagged Le fibre muscolari che esprimono le fibre muscolari mostrano un fenotipo di iper-stabilizzazione. La crescita dei rami sembra essere preferibilmente diretta lungo le fibre clonali.(H-O) Espressioneectopica di Nlg1 in classe IV da neuroni sensoriali guida i cambiamenti nella morfologia assonale del motoneurone pergola assonale.(H) Lo schema mostra le posizioni relative di classe IV v’ada sensoriali di ingresso arborisations (verde), muscoli pleurici (tubi grigi) e assoni motori arborisations (magenta) nella parete pleurica del corpo addominale (schema della muscolatura adattato da Demerec , 1950).(I) Terminali degli assoni motori che esprimono il myr::GFP(VGlut-LexA) a 80 ore APF in un controllo(J) gli arborisations di ingresso v’ada nella stessa regione che esprime dsRed (PPK-Gal4; Grueber et al., 2003).(K) La proiezione trasversale mostra gli algoritmi assonali PM-Mn limitati ad un singolo piano. La proiezione trasversale schematica mostra la separazione dell’arborizzazione v’ada (verde) dai terminali degli assoni motori (magenta) da parte dei muscoli pleurici (rosso).(L-N) Nlg1untagged espressione in classe IV da neuroni sensoriali risultati in rami assonali che penetrano gli spazi vuoti tra le fibre muscolari ed entrano in contatto con gli arborisations sensoriali. Questi rami aberranti sono mostrati nella vista trasversale e corrono perpendicolarmente al resto dell’arborizzazione.(O) Filetto addominale di un adulto appena chiuso che esprime Nlg1untagged e CD8::GFP nella classe IV da neuroni sensoriali. Anti-HRP rivela i terminali degli assoni motori e l’immunoreattività BRP rivela le specializzazioni presinaptiche ai contatti tra gli assoni motori e l’arborizzazione sensoriale (punte di freccia). Barre di scala: 50 µm (A,B,C,D,F,G), 25 µm (I,J,L,M),5 µm (O).
Conseguenze fisiologiche del disturbo Nlg1
Abbiamo mostrato un requisito molto presto per Nlg1 per stabilire la struttura del ramo e che i contatti ectopici fatti da PM-Mns fare su neurite v’ada sembrano maturare in neurite v’ada organizzato hemisynapses. Questi dati mostrano che dopo il contatto e la stabilizzazione c’è una gerarchia di eventi che alla fine porta alla formazione di sinapsi. Per esplorare se le interruzioni di Nlg1-Nrx incidono sulla formazione di sinapsi abbiamo colorato contro BRP per valutare la densità delle zone attive all’interno dei rami di Nlg1 nulli, Nrx nulli e animali che esprimono Nlguntagged nei muscoli a stadi pupillari prossimi all’eclosione(Figura 9A). Boutons in tutti questi animali sono stati considerati come impegni contenenti concentrazioni di puncta sinaptica. Abbiamo trovato che la densità delle sinapsi non era significativamente diversa tra Nlg1 o Nrx nulli e controlli wild-type, anche se era leggermente superiore in animali Nlg1 guadagno di funzione(Figura 9B). Questo suggerisce che gli aspetti globali dello sviluppo delle zone attive possono essere in gran parte non influenzati dalla perdita di Nlg1 o Nrx. Ci si potrebbe aspettare che i deficit funzionali derivanti da un guasto nella segnalazione di Nlg1 appropriato potrebbero essere dovuti o a morfologia difettosa, cambiamenti nella trasmissione, o entrambi. Per esplorare questo, abbiamo guardato GCaMP6m espresso nei muscoli come un proxy per misurare la depolarizzazione muscolare a fine pupale/farato stadi tardivi appena prima dell’eclosione. Nei controlli di tipo selvaggio, gli eventi di calcio muscolare in questa fase si verificano di solito in sincronia attraverso il campo muscolare(Figura 9C e D e Video 10). Al contrario, nelle pupille con guadagno di funzione Nlg1, gli eventi di calcio erano più comuni in alcuni gruppi di fibre rispetto ad altri, con conseguente sincronicità molto minore(Figura 9E e F e Video 11).
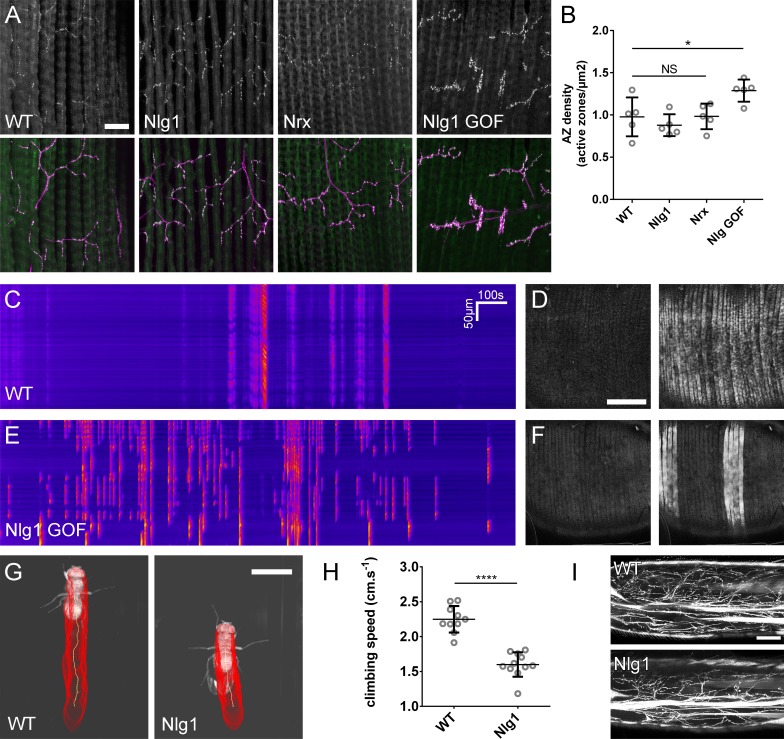
Figura 9.I ruoli di Nlg e Nrx nella costruzione di pergole dipendenti da NAC appaiono disaccoppiati dalla formazione di sinapsi e dalla neurotrasmissione.(A-B) La formazione disinapsi a livello del microscopio ottico non sembra essere influenzata da interruzioni della segnalazione Nrx-Nlg.(A) Zone attive a livello delle giunzioni neuromuscolari pleuriche in filetti addominali adulti da un controllo di tipo selvaggio, un Nlg1 nullo, un Nrx nullo e un guadagno di funzione Nlg1(Mef2-GAL4> Nlg1 non marcato) rivelato da colorazione anticorpale contro BRP.(B) Densità di zona attiva calcolata da BRP puncta nei terminali sinaptici. Non sono state riscontrate differenze significative tra le densità delle zone attive nei controlli (0,98 ± 0,23 µm-2, n = 5) e Nlg1 nulli (0.88 ± 0,13 µm-2, n = 5) o controlli e Nrx nulli (0,98 ± 0,15 µm-2, n = 5 ) (Nlg1 vs controlli: Mann-Whitney U = 9, p=0,53, a due code. Nrx vs controlli: Mann-Whitney U = 12, p=0,94, a due code). Una piccola, ma significativa differenza è stata trovata tra le densità delle zone attive nei terminali a guadagno di funzione Nlg1 (1,29 ± 0,13 µm-2, n = 5) e i controlli (Mann-Whitney U = 1, p=0,0159, a due code).(C-F) La sovraespressioneNlg1 causa cambiamenti nella morfologia assonale del perno PM-Mn, che si traducono in un’alterazione della connettività e della trasmissione.(C) GCaMP6m Δfs in un controllo e in una pupa che esprime Nlg1untagged nei muscoli(Mef2-GAL4) in scena entro 10 ore dall’eclosione,(D). Nei controlli, gli eventi di calcio sono generalmente sincroni attraverso il campo muscolare pleurico, mentre nel gain-of-function pupae eventi sono spesso limitati a sottoinsiemi muscolari più piccoli. Ciò è dimostrato dalle interruzioni nelle barre colorate sul chimografo e nelle immagini sequenziali(D e F).(G-I) La perdita di Nlg1 ha un forte impatto sulla capacità locomotoria (G) Tracciamento automatico del corpo eseguito con FlyLimbTracker (Uhlmannet al., 2017) in Icy (deChaumont et al., 2012) di un controllo e di un Nlg1 nullo, 2 giorni dopo l’occlusione(H) I voli di controllo hanno una velocità di salita significativamente più veloce rispetto ai nulli Nlg1 (controlli: 2,25 ± 0,19 cm.s-1, n = 10. Nlg1: 1,60 ± 0,18 cm.s-1, n = 11. t(8,15) = 19, p<0,0001, t-test, a due code).(I) Terminali assone motoneuroni(VGlut-LexA> myr::GFP) che innervano il femore 1 giorno dopo l’occlusione di un Nlg1 nullo e di un controllo. Le barre rappresentano le SD. Barre di scala: 20 µm (A), 100 µm (D,F,I), 0,2 cm(G).

Video 10.10. Conseguenza funzionale di una segnalazione Nlg1 interrotta; controllo.GCaMP6m è stato utilizzato come proxy per esplorare l’effetto della segnalazione Nlg1 disturbata sull’attività postsinaptica in fase avanzata. Nei controlli, l’attività del calcio entro 10 ore prima dell’eclosione è caratterizzata da cambiamenti di fluorescenza che sono sincroni attraverso il campo muscolare (Mef2-GAL4> GCaMP6m). Frameregistrati a intervalli di1 s. Formato del tempo mm:ss.

Video 11.Conseguenza funzionale della segnalazione Nlg1 perturbata; Nlg1 GOF.GCaMP6m è stato utilizzato come proxy per esplorare l’effetto della perturbazione della segnalazione Nlg1 nella fase tardiva dell’attività postsinaptica. Lasovraespressione di Nlg1 nei muscoli si traduce in un’attività del calcio muscolare eterogenea, con sottoinsiemi di muscoli che sparano più frequentemente di altri (Mef2-GAL4> GCaMP6m+ Nlg1untagged). Cornici registrate ad intervalli di 1 s. Formato orario mm:ss.
Per determinare la conseguenza funzionale dell’interruzione della segnalazione Nlg1-Nrx, abbiamo anche valutato la capacità locomotoria di Nlg1 null vola in un test di arrampicata(Figura 9G). Utilizzando la videografia e un software di tracciamento automatico abbiamo scoperto che la velocità di salita di Nlg1 nulli (n = 11) era significativamente inferiore ai controlli (n = 10) (t(8.15) = 19, p<0.0001, t-test, a due code)(Figura 9H). Abbiamo trovato interruzioni ai terminali degli assoni motoneuronali delle gambe in Nlg1 nulli, suggerendo che alcuni di questo deficit può essere un risultato diretto di innervazione anomala alla giunzione neuromuscolari (Figura 9I).

Figura 9.I ruoli di Nlg e Nrx nella costruzione di pergolato dipendente NAC appaiono disaccoppiati dalla formazione di sinapsi e neurotrasmissione.(A-B) La formazione disinapsi a livello di microscopio ottico appare in gran parte non influenzata da interruzioni della segnalazione Nrx-Nlg.(A) Zone attive a livello delle giunzioni neuromuscolari pleuriche in filetti addominali adulti da un controllo di tipo selvaggio, un Nlg1 nullo, un Nrx nullo e un guadagno di funzione Nlg1(Mef2-GAL4> Nlg1 non marcato) rivelato da colorazione anticorpale contro BRP.(B) Densità di zona attiva calcolata da BRP puncta nei terminali sinaptici. Non sono state riscontrate differenze significative tra le densità delle zone attive nei controlli (0,98 ± 0,23 µm-2, n = 5) e Nlg1 nulli (0.88 ± 0,13 µm-2, n = 5) o controlli e Nrx nulli (0,98 ± 0,15 µm-2, n = 5 ) (Nlg1 vs controlli: Mann-Whitney U = 9, p=0,53, a due code. Nrx vs controlli: Mann-Whitney U = 12, p=0,94, a due code). Una piccola, ma significativa differenza è stata trovata tra le densità delle zone attive nei terminali a guadagno di funzione Nlg1 (1,29 ± 0,13 µm-2, n = 5) e i controlli (Mann-Whitney U = 1, p=0,0159, a due code).(C-F) La sovraespressioneNlg1 causa cambiamenti nella morfologia assonale del perno PM-Mn, che si traducono in un’alterazione della connettività e della trasmissione.(C) GCaMP6m Δfs in un controllo e in una pupa che esprime Nlg1non contrassegnato nei muscoli(Mef2-GAL4) in scena entro 10 ore dall’eclosione,(D). Nei controlli, gli eventi di calcio sono generalmente sincroni attraverso il campo muscolare pleurico, mentre nel gain-of-function pupae eventi sono spesso limitati a sottoinsiemi muscolari più piccoli. Ciò è dimostrato dalle interruzioni nelle barre colorate chiare sul chimografo e nelle immagini sequenziali(D e F).(G-I) La perdita di Nlg1 ha un forte impatto sulla capacità locomotoria (G) Tracciamento automatico del corpo eseguito con FlyLimbTracker (Uhlmannet al., 2017) in Icy (deChaumont et al., 2012) di un controllo e di un Nlg1 nullo, 2 giorni dopo l’occlusione(H) I voli di controllo hanno una velocità di salita significativamente più veloce rispetto ai nulli Nlg1 (controlli: 2,25 ± 0,19 cm.s-1, n = 10. Nlg1: 1,60 ± 0,18 cm.s-1, n = 11. t(8,15) = 19, p<0,0001, t-test, a due code).(I) Terminali assone motoneuroni(VGlut-LexA> myr::GFP) che innervano il femore 1 giorno dopo l’occlusione di un Nlg1 nullo e di un controllo. Le barre rappresentano le SD. Barre di scala: 20 µm (A), 100 µm (D,F,I), 0,2 cm(G).

Video 10.10. Conseguenza funzionale di una segnalazione Nlg1 interrotta; controllo.GCaMP6m è stato utilizzato come proxy per esplorare l’effetto della segnalazione Nlg1 disturbata sull’attività postsinaptica in fase avanzata. Nei controlli, l’attività del calcio entro 10 ore prima dell’eclosione è caratterizzata da cambiamenti di fluorescenza che sono sincroni attraverso il campo muscolare (Mef2-GAL4> GCaMP6m). Frameregistrati a intervalli di1 s. Formato del tempo mm:ss.

Video 11.Conseguenza funzionale della segnalazione Nlg1 perturbata; Nlg1 GOF.GCaMP6m è stato utilizzato come proxy per esplorare l’effetto della perturbazione della segnalazione Nlg1 nella fase tardiva dell’attività postsinaptica. Lasovraespressione di Nlg1 nei muscoli si traduce in un’attività del calcio muscolare eterogenea, con sottoinsiemi di muscoli che sparano più frequentemente di altri (Mef2-GAL4> GCaMP6m+ Nlg1untagged). Cornici registrate ad intervalli di 1 s. Formato orario mm:ss.
Discussione
I pergolati assonali PM-Mn utilizzano una modalità di crescita dinamica “sinaptotropica”.
Per un corretto sviluppo e funzionamento dei circuiti neurali è fondamentale costruire pergolati della giusta dimensione e forma. Studi di imaging dal vivo nei cervelli vertebrati mostrano che la crescita neuronale è altamente dinamica e che le strutture che sembrano essere sinapsi nascenti giocano un ruolo chiave nello sviluppo di assonali e dendritiche. Si pensa che questi contatti nascenti si comportino come dei bulloni durante la costruzione, ma non è nota una comprensione dettagliata della loro composizione molecolare e del loro assemblaggio.
Per esplorare questa biologia, abbiamo cercato nella mosca neuroni che crescono in modo esuberante, simili a quelli dei sistemi visivi di pesci e rane. Il sistema motorio embrionale è stato un eccellente strumento per studiare la connettività e la crescita del pergolato, ma le sue piccole dimensioni e il suo rapido sviluppo lo rendono molto impegnativo per la crescita dell’immagine dal vivo. Gli stadi postembrionici hanno neuroni singoli identificabili, uno sviluppo più lungo e interazioni più plastiche tra cellule e vertebrati(Truman, 1990; Currie e Bate, 1991; Fernandes et al., 1991; Consoulas et al., 2000).
Gli assonali dei motoneuroni del muscolo pleurico (PM-Mns) sono superficiali e possono essere ripresi in vivo durante la metamorfosi. A differenza degli arborisations da input neuronali sensoriali, che sono stati utili per studiare la crescita dei rami neuronici(Williams e Truman, 2004; Shimono et al., 2009; Yalgin et al., 2015), gli assoni PM-Mn formano sinapsi; un tratto in comune con la maggior parte degli arborisations neuronali.
La crescita di PM-Mn è molto dinamica, con un elevato turnover di filopodi esplorativi, con solo pochi che alla fine diventano rami. I loro arborisations assonali si sviluppano in stretta associazione con i muscoli pleurici e troviamo che i filopodi assonali si stabilizzano al contatto con mioblasti o miotubi immaturi (vedi Video 2). Alcuni studi in vitro e in vivo hanno precedentemente evidenziato che la stabilità filopodiale è conferita dai contatti tra potenziali partner sinaptici(Cooper e Smith, 1992; Ziv e Smith, 1996; Jontes et al., 2000).
Per determinare se gli arboricelli assonali PM-Mn potrebbero crescere utilizzando sinapsi nascenti abbiamo immaginato il marcatore di zona attiva Bruchpilot (BRP)(Chen et al., 2014; Urwyler et al., 2015) e macchinari vescicolari (VGlut e Syt1) e abbiamo trovato localizzazioni simili di proteine sinaptiche, così come relazioni con la vita dei rami come sono state descritte in zebrafish e xenopus(Alsina et al., 2001; Niell et al., 2004; Meyer e Smith, 2006; Ruthazer et al., 2006). I BRP puncta appaiono per tracciare la progressione degli eventi di stabilizzazione dei rami. Con nostra sorpresa abbiamo anche trovato Bruchpilot in localizzazioni simili nei rami di sviluppo di interneuroni di vigilia+ interneuroni nel SNC, indicando che questo tipo di crescita non può essere limitato al sistema nervoso periferico, ma potrebbe essere comune all’interno del sistema nervoso centrale della mosca.
L’arboricoltura in crescita non richiede sinapsi funzionali
Non sono chiari i contributi esatti della sinaptogenesi, dell’attività neurale e della trasmissione sinaptica alla formazione delle reti neurali. In effetti, c’è una ricca storia riguardo alla questione se i sistemi nervosi si sviluppino in “riferimento futuro” all’attività funzionale, ma senza beneficiarne (Harrison, 1904; Weiss, 1941); si veda Haverkamp (1986) per la revisione).
È interessante notare che una gran parte della crescita del PM-Mn avviene prima dei transitori di calcio presinaptico robusto (potenziali d’azione, <42 hr APF). Inoltre, abbiamo scoperto che non fino a 60 hr APF potrebbe evocare l’attività nei muscoli stimolando i motoneuroni. Infine, né TTX o la rimozione di tutte le neurotrasmissioni vescicolari, rendendo VGlut cloni nulli, ha avuto un impatto significativo sulla morfologia matura pergola. Cline e colleghi hanno mostrato una correlazione tra la stabilizzazione della crescita dei rami assonali della cellula del ganglio della retina che portavano i rami assonali sinaptici puncta e l’attività visiva, indicando l’uso-test di contatti nascenti da attività in un modo sinaptotropico-come la crescita(Ruthazer et al., 2006). Al contrario, una serie di studi hanno dimostrato che l’attività di blocco ha un impatto limitato sulla morfologia, o gioca solo un ruolo nel perfezionamento della crescita dell’arbor(Haverkamp, 1986; Verhage et al., 2000; Varoqueaux et al., 2002; Hua et al., 2005; Ben Fredj et al., 2010). Sembra che i diversi sistemi differiscano nel loro fabbisogno di attività durante lo sviluppo dell’arbor.
L’imaging dettagliato possibile con il nostro sistema rivela che i BRP puncta entrano molto raramente in filopodia e non sono mai stabilizzati al loro interno. Abbiamo trovato la stessa cosa per le proteine associate alle vescicole sinaptiche Syt1 e VGlut. Poiché la BRP è un importante componente strutturale della citomatrice nella zona attiva, questi dati ci sono sembrati in contrasto con l’idea che le sinapsi guidino la stabilizzazione dei rami e ci hanno portato a chiederci se i puncta precedentemente riportati nei nodi dei rami nelle cellule dei gangli della retina in crescita rappresentino davvero sinapsi in buona fede. È importante notare che solo nelle ultime fasi di sviluppo le dimensioni e la distribuzione di BRP puncta sono diventate simili alle sinapsi della larva NMJ(Fouquet et al., 2009). In parallelo, i cluster di recettori del glutammato sono diventati evidenti solo negli ultimi stadi di sviluppo, molto tempo dopo che la forma a pergola è stata stabilita. Presi insieme questi dati suggeriscono che è solo negli stadi successivi dello sviluppo del pergolato che gli elementi sinaptici si accoppiano per formare sinapsi in buona fede. Gli accumuli di proteine presinaptiche visti nei primi arborisations (cioè 30-40 hr APF) possono invece segnare siti stabili o “hubs di trasporto” che aiutano ad immagazzinare/selezionare le proteine sinaptiche per un ruolo successivo nella formazione delle sinapsi.
Complessi di adesione neuritici (NAC) guidare una modalità tropicale di crescita arborizzazione
Se la trasmissione sinaptica non ha un ruolo in questo tipo di crescita dinamica del pergolato, quali sono i meccanismi responsabili? Troviamo un ruolo per una classe di proteine (molecole di adesione delle cellule sinaptiche), le neurexine presinaptiche (Nrx) e i loro partner di legame postsinaptico, le neuroligini (Nlgs).
I mutanti Nlg1 e i dati clonali FlpStop suggeriscono che Nlg1 nel muscolo è fondamentale per la crescita normale. L’analisi clonale rivela che i rami che crescono sui muscoli con livelli più bassi di espressione Nlg1 sono fenotipicamente simili a quelli dei nulli Nlg1. La crescita dei rami su territori con livelli più selvaggi di espressione Nlg1 ricorda l’aspetto tropicale suggerito nell’ipotesi originale di Vaughn.
Il lavoro in Xenopus ha precedentemente implicato le interazioni Nrx-Nlg nella crescita dei pergolati e ha ipotizzato che la formazione di sinapsi e i successivi livelli di trasmissione sinaptica si traducono direttamente nella stabilità dei rami(Chen et al., 2010). Qui proponiamo che queste molecole forniscano adesione durante le fasi di elaborazione indipendentemente dalla formazione di sinapsi. Descriviamo per la prima volta che Nlg1::GFP puncta emerge sulle membrane muscolari in vivo a seguito di contatto con filopodi presinaptici. Nlg1 si localizza sulle punte e sui fusti delle filopodi e ne regola la stabilità. I filopodi che ‘catturano’ tali puncta sono significativamente più longevi di quelli che non lo sono. Inoltre, time-lapse imaging ha rivelato che Nlg1::GFP agire come punti di ancoraggio segnando i limiti della retrazione filopodiale. Questo è molto diverso dalla crescita dei pesci zebra e delle giunzioni neuromuscolari dei topi, dove i motoneuroni crescono tra le placche prestampate dei recettori dell’acetilcolina, come se saltassero tra i gradini(Yang et al., 2001; Panzer et al., 2006; Jing et al., 2009).
Presipticamente, troviamo Nrx puncta sulle punte e lungo i pozzi di filopodia, cioè in siti che rispecchiano quelli di Nlg1. Inoltre, troviamo altre due proteine in tali siti, Liprin-α e Syd-1, che sono note per essere complesse con Nrx. Liprin-α e Syd-1 si trovano sulla membrana e si fondono in puncta dinamici che localizzano le punte dei filopodi. Liprin-α puncta sembrano limitare la retrazione filopodiale, indicando che i siti contrassegnati da questa proteina rappresentano le controparti presinaptiche ai punti di ancoraggio strutturali contrassegnati da Nlg1. La mancanza di Liprin-α nei rami lunghi e labili dei nulli Nlg1 indica che una riduzione della forza adesiva permette inizialmente una crescita dei rami non frenata, ma in definitiva genera rami instabili, che non possono essere mantenuti. Questo parla di un equilibrio tra adesione e crescita, che è supportato dal fenotipo compattato di guadagno di funzione Nlg1.
In precedenza, Syd-1 e Liprin-α sono stati trovati a svolgere un ruolo chiave nell’orchestrazione dell’assemblaggio delle sinapsi, reclutando e trattenendo altre proteine sinaptiche. Liprin-α, Syd-1 e Nrx puncta in queste fasi di crescita esuberante sono transitorie e non sembrano diventare “sinapsi future”. La loro fluidità parla di un ruolo nella morfogenesi dei rami, piuttosto che in un assemblaggio graduale, a orologeria, di macchinari sinaptici in un determinato luogo.
Sulla base delle nostre osservazioni, proponiamo che questi complessi dinamici siano composti da un sottoinsieme di proteine che sono state precedentemente chiamate ‘proteine di adesione delle cellule sinaptiche’ o driver della formazione delle sinapsi. Come placeholder suggeriamo di chiamare questi complessi di adesione neuritici puncta o NAC per evidenziare il loro ruolo nella crescita degli assoni prima della formazione delle sinapsi. Il fatto che vediamo prove dirette della formazione di questi NAC sui filopodi stessi suggerisce che le interazioni dinamiche tra i filopodi e il bersaglio postsinaptico sono determinanti fondamentali per la costruzione degli alberi.
Questo ruolo iniziale dei NAC basati su Nlg1/Nrx nella crescita degli alberi è supportato da una forte evidenza che i filopodi esplorativi e le punte dei rami sono altamente sensibili ai cambiamenti nell’espressione precoce di Nlg1 postsinaptico. I nostri cloni di mioblasto/miotubo a guadagno di funzione sembrano avere un effetto ‘iper-stabilizzante’ sui neuroni wild-type e, in ultima analisi, limitano la crescita. Inoltre vi è qualche indicazione di crescita preferenziale in regioni con elevata espressione postsinaptica Nlg1 Nlg1. Siamo stati molto sorpresi di vedere i PM-Mns wildtype crescere oltre i muscoli, in territori nuovi e fare contatti con i neuroni sensoriali di classe IV da che esprimono ectopicamente Nlg1.
Conseguenze fisiologiche del disturbo Nlg1
Il ruolo preciso che le Nrx e le Nlgs svolgono nello sviluppo del sistema nervoso è stato ampiamente contestato. I lavori precedenti hanno dimostrato il forte potenziale sinaptogeno di queste proteine esprimendole in cellule HEK o su substrati micropatterned, rivelandole come potenti regolatori della formazione di emisinapidi(Scheiffele et al., 2000; Dean et al., 2003; Graf et al., 2004; Chih et al., 2005; Lee et al., 2010; Czöndör et al., 2013). Altri hanno dimostrato che i topi privi di tre omologhi Nlg o tutti e tre gli α-Nrx costruiscono cervelli con citoarchitetture e densità sinaptiche grossolanamente normali (Missler et al., 2003; Varoqueaux et al., 2006) e sostengono che il loro ruolo è esclusivamente quello di modulare la funzione sinaptica. Gli eleganti studi di Kwon et al. (2012) suggeriscono un ruolo autonomo delle cellule Nlg nella formazione delle sinapsi dei vertebrati simile ai nostri studi clonali. I ruoli per Nlg e Nrx nella formazione delle sinapsi sono stati precedentemente descritti nella mosca(Li et al., 2007; Banovic et al., 2010; Chen et al., 2012).
La separazione della funzione di tali famiglie di geni nei vertebrati può essere difficile a causa delle copie multiple di questi geni e della loro degenerazione con altre proteine(Sugita et al., 2001; Ko et al., 2009; Siddiqui et al., 2010; Xu et al., 2010; Ko et al., 2011; Soler-Llavina et al., 2011). Qui, in questo sistema più semplice, mostriamo che i complessi di adesione basati su Nlg1/Nrx giocano un ruolo chiave nella crescita precoce degli assonali prima della formazione delle sinapsi funzionali. Inoltre, troviamo che l’interruzione della segnalazione Nlg1/Nrx ha in ultima analisi uno scarso effetto sui tempi di sviluppo delle sinapsi e sulle dimensioni delle zone attive, suggerendo che la morfogenesi degli alberi è disaccoppiata dalla formazione delle sinapsi. Una previsione di ciò è che le interruzioni della connettività funzionale potrebbero essere in gran parte dovute a interruzioni della crescita e della morfologia dell’arboricoltura. Un’osservazione importante che inquadra questo è il risultato dell’espressione ectopica di Nlg1 nella classe IV da neuroni sensoriali. Qui vediamo la generazione di una “connettività sintetica” sui neuroni sensoriali normalmente “asinaptici” da, con lo sviluppo di strutture presinaptiche mature e differenziate nelle fasi successive della pupilla, cioè siti segnati da BRP e proteine delle vescicole sinaptiche.
A sostegno di questo, il nostro calcio imaging rivela che i normali modelli di attività muscolare sono interrotti quando Nlg1 è sovraespresso, con cambiamenti nella frequenza e l’eterogeneità spaziale degli eventi di calcio. Dal momento che l’espressione postsinaptica elevata di Nlg1 si traduce in arborisations condensato, proponiamo che questo è il risultato di innervazione irregolare. L’analisi comportamentale mostra che gli adulti Nlg1 nulli Nlg1 aveva deficit significativi del comportamento motorio. Presi insieme questi dati forniscono un collegamento tra un meccanismo basato sull’adesione della crescita dell’arbor e la connettività sinaptica, che in ultima analisi influisce sulla funzione.
Conclusioni
In questo studio abbiamo dimostrato, per la prima volta al di fuori dei vertebrati, una modalità dinamica “sinaptotropica” di crescita del pergolato. A differenza dei meccanismi che sono stati proposti in precedenza, non troviamo alcuna prova che le sinapsi funzionali guidino questo tipo di crescita. I nostri dati puntano invece alle CNA dinamiche, composte da Neurexin, Neuroligin, Liprin-α e Syd-1, che svolgono un ruolo di stabilizzazione dei filopodi esplorativi e dei rami. Oltre a questo, le nostre prove che mostrano simili localizzazioni subcellulari per queste proteine nei neuroni centrali di Drosophila indicano che questa modalità di crescita è un meccanismo universale per la costruzione di alberi complessi. Può darsi che l’enfasi posta da Berry e colleghi sui filopodi nella loro “teoria filopodiale sinaptogena” fosse corretta. È un’idea allettante che tali meccanismi possano costruire arborizzazioni assonali e dendritiche di un ampio spettro di forme e dimensioni, apportando solo sottili modifiche a un algoritmo “bastone e cresce”. Esattamente quali proteine costituiscono questi complessi di adesione e come interagiscono con i macchinari che regolano il rimodellamento citoscheletrico saranno al centro di future indagini.
Materiali e metodi
| Tipo di reagente (specie) o risorsa | Designazione | Fonte o riferimento | Identificatori | Ulteriori informazioni |
|---|---|---|---|---|
| reagente genetico(D. melanogaster) | OK371-GAL4 | Centro di stoccaggio di Bloomington Drosophila | BDSC:26160 | |
| reagente genetico(D. melanogaster) | Mef2-GAL4 | Centro di stoccaggio di Bloomington Drosophila | BDSC:27390 | |
| reagente genetico(D. melanogaster) | PPK-GAL4 | Centro di stoccaggio di Bloomington Drosophila | BDSC:32078 | |
| reagente genetico(D. melanogaster) | VGlutNMJX-GAL4 | Daniels et al. (2008) | P{VGlut-GAL4.D}NMJX | |
| reagente genetico(D. melanogaster) | VGlut(Trojan)-T2A-LexA | Centro di stoccaggio di Bloomington Drosophila | BDSC:60314 | |
| reagente genetico(D. melanogaster) | Df(2L)vglut2 | Daniels et al. (2006) | ||
| reagente genetico(D. melanogaster) | Nlg1I960 | Banovic et al. (2010) | ||
| reagente genetico(D. melanogaster) | Nlg1ex2.3 | Banovic et al. (2010) | ||
| reagente genetico(D. melanogaster) | Nrx241 | Li et al. (2007) | ||
| reagente genetico(D. melanogaster) | Df(3R)BSC747 | Regalo di Hermann Aberle | FlyBase: FBab0045813 | |
| reagente genetico(D. melanogaster) | Df(3R)Exel6191 | Regalo di Hermann Aberle | FlyBase: FBab0038246 | |
| reagente genetico(D. melanogaster) | RN2-Flp | Roy et al. (2007) | ||
| reagente genetico(D. melanogaster) | UAS-myr::GFP | Pfeiffer et al., 2012 | ||
| reagente genetico(D. melanogaster) | UAS-cytoplasmicGFP | Pfeiffer et al., 2012 | ||
| reagente genetico(D. melanogaster) | UAS-Lifeact::Rubino | Centro di stoccaggio di Bloomington Drosophila | BDSC:35545 | |
| reagente genetico(D. melanogaster) | UAS-CLIP170::GFP | Stramer et al., 2010 | ||
| reagente genetico(D. melanogaster) | UAS-mCD8::ChRFP | Centro di stoccaggio di Bloomington Drosophila | BDSC:27391 | |
| reagente genetico(D. melanogaster) | UAS-myr::tdTomato | Centro di stoccaggio di Bloomington Drosophila | BDSC:30124 | |
| reagente genetico(D. melanogaster) | UAS-BRP::RFP | Regalo di Stephan Sigrist | ||
| reagente genetico(D. melanogaster) | UAS-Nlg1::PFL | Banovic et al. (2010) | ||
| reagente genetico(D. melanogaster) | UAS-Nlg1untagged | Banovic et al. (2010) | ||
| reagente genetico(D. melanogaster) | UAS-Nrx::PFL | Banovic et al. (2010) | ||
| reagente genetico(D. melanogaster) | UAS-Liprin-α::PFL | Fouquet et al. (2009) | ||
| reagente genetico(D. melanogaster) | UAS-Syd1::Paglia | Owald et al. (2010) | ||
| reagente genetico(D. melanogaster) | UAS-GCaMP6M | Centro di stoccaggio di Bloomington Drosophila | BDSC: 42750 | |
| reagente genetico(D. melanogaster) | UAS-GCaMP6M | Centro di stoccaggio di Bloomington Drosophila | BDSC: 42748 | |
| reagente genetico(D. melanogaster) | GluRIIE::GFP | Biblioteca FlyFos TransgeneOme (fTRG) | fTRG:154 | |
| reagente genetico(D. melanogaster) | BRP::POLVERE DA SPARO | Centro di stoccaggio di Bloomington Drosophila | BDSC:59411 | |
| reagente genetico(D. melanogaster) | VGlut::GFP | Centro di stoccaggio di Bloomington Drosophila | BDSC:59292 | |
| reagente genetico(D. melanogaster) | Syt1::GFP | Centro di stoccaggio di Bloomington Drosophila | BDSC:59788 | |
| reagente genetico(D. melanogaster) | Nlg1FlpStop | FlpStop costruire da Fisher et al. (2017) | ||
| reagente genetico(D. melanogaster) | LexAop-myrGFP | Centro di stoccaggio di Bloomington Drosophila | BDSC:32210 | |
| anticorpo | antiVglut (C-term) (coniglio policlonale) | Mahr e Aberle (2006) | RRID:AB_2490071; aa 561-632 | (1:10,000) |
| anticorpo | antiBRP (nc82) (monoclonale del mouse) | Studi sullo sviluppo Banca Ibridioma | RRID:AB_231486; aa 1227-1740 | (1:5) |
| anticorpo | antiGFP (Policlinico per polli) | Thermo Fisher Scientific (Invitrogeno) | Cat# PA1-86341, RRID:AB_931091 | (1:1000) |
| anticorpo | antiHRP-Cy3 (policlonale di capra) | Jackson Immunoresearch | (1:5000) | |
| anticorpo | Alexa-488 secondario | Thermo Fisher Scientific (Invitrogeno) | (1:500) | |
| anticorpo | Secondari Cy3 e Cy5 | Jackson Immunoresearch | (1:500) |
Stock di mosche
Le mosche sono state allevate con una dieta standard di lievito, farina di mais e melassa. Per esperimenti sensibili al tempo le mosche sono state allevate a 25° C,o a temperatura ambiente se non era richiesta una messa in scena precisa.
OK371-GAL4; UAS-myr::GFP
OK371-GAL4; UAS-myr::GFP, UAS-BRP::RFP
OK371-GAL4; UAS-Lifeact::Ruby/UAS-CLIP170::GFP
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Mef2-GAL4, UAS-mCD8::ChRFP
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Mef2-GAL4, UAS-myr::tdTomato
OK371-GAL4, UAS-mCD8::ChRFP/BRP::GFP
OK371-GAL4, UAS-mCD8:ChRFP/VGlut::GFP
OK371-GAL4, UAS-mCD8:ChRFP/Syt1::GFP
RN2-Flp, Tub-FRT-CD2-FRTGal4, UAS-mCD8GFP/UAS-BRP::RFP
OK371-GAL4, UAS-mCD8:ChRFP/GluRIIE::GFP
OK371-GAL4, UAS-GCaMP6m
VGlut(Trojan)-T2A-LexA; Mef2-GAL4, UAS-GCaMP6m/LexAop-TRPA1
VGlutNMJX-Gal4, UAS-mCD8::GFP, hsFlp122; FRT40A, Df(2L)VGlut2; UAS-myr::GFP
VGlutNMJX-Gal4, UAS-mCD8::GFP, hsFlp122; FRT40A, Df(2L)VGlut2/FRT40A; UAS-myr::GFP
Elav-GAL4, hsFlp122; FRT40A, Df(2L)vglut2/FRT40A; UAS-citoplasmaticiGFP
VGlut(Trojan)-T2A-LexA, LexAop-myr::tdTomato; Mef2-GAL4, UAS-Nlg1::GFP
UAS-Nrx::GFP; OK371-GAL4, UAS-mCD8::ChRFP
OK371-GAL4, UAS-mCD8::ChRFP/UAS-Liprin-α::GFP
OK371-GAL4, UAS-Liprin-α::GFP/UAS-Syd1::Paglia
OK371-GAL4, UAS-Liprin-α::GFP; UAS-BRP::RFP
OK371-GAL4, UAS-Liprin-α::GFP; UAS-BRP::RFP; DF(3R)BSC747/Nlg1ex2.3
RN2-Flp, Tub-FRT-CD2-FRT-GAL4, UAS-mCD8::mCD8::ChRFP/UAS-Liprin-α::GFP
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Df(3R)BSC747/Nlg1ex2.3
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Df(3R)BSC747/Nlg1I960
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Df(3R)Exel6191/Nrx241
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Mef2-GAL4/UAS-Nlg1untagged hsFlp122VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP, αTub84B-FRT.GAL80; Mef2-GAL4, UAS-myr ::tdTomato/UAS-Nlg1untagged
PPK-GAL4, UAS-dsRed/VGlut LexA, LexAop-myr::GFP
PPK-GAL4, UAS-dsRed/VGlut LexA, LexAop-myr::GFP; UAS-Nlg1Untagged
PPK-GAL4, UAS-mCD8::GFP; UAS-Nlg1untagged
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Nlg1FlpStop D/Df(3R)BSC747
VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP; Nlg1FlpStop ND/Df(3R)BSC747
hsFlp122VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP/Mef2GAL4; Nlg1FlpStop ND/Df(3R)BSC747
hsFlp122VGlut(Trojan)-T2A-LexA, LexAop-myr::GFP/Mef2GAL4; Nlg1FlpStop D/Df(3R)BSC747
Mef2-Gal4, UAS-GCaMP6m; UAS-Nlg1Untagged
Mef2-Gal4, UAS-GCaMP6m
Imaging
L’imaging è stato eseguito a temperatura ambiente utilizzando microscopi confocali Zeiss LSM 510 o serie 800 e obiettivi EC Plan-Neofluar 20x/0.50 o Plan-Apochromat 40x/1.3.
Montaggio e imaging dal vivo
Per una stadiazione coerente dello sviluppo, le pupae sono state raccolte a 0 ore APF (stadio prepupale bianco) e incubate su carta velina umida a 25° Cin scatole di Petri sigillate in parafilm. In preparazione per il montaggio, le pupae sono state essiccate su carta velina, immobilizzate su strisce di nastro biadesivo e accuratamente rimosse dalle loro casse pupari con pinze. Le pupae sono state montate utilizzando dei foglietti di copertura di 22 × 22 mm sotto un sottile strato di olio di alocarbone. Per sessioni di imaging superiori a 1 ora le pupae sono state montate in camere di mantenimento dell’umidità, costituite da una piattaforma di membrana semipermeabile sospesa sopra un foro in uno scivolo d’acciaio specializzato e sigillata con un anello a tenuta stagna di gelatina di petrolio.
Per gli esperimenti che richiedevano la manipolazione della temperatura, è stato costruito uno stadio specializzato regolabile in temperatura, costituito da un vetrino di vetro fissato ad un dispositivo termoelettrico Peltier di 5 × 5 cm (Maplin Electronics Ltd., Regno Unito) che è stato montato su un normale portavetrini per microscopio. Prima di ogni esperimento la temperatura dello stadio è stata calibrata utilizzando una sonda a termocoppia collegata ad un dispositivo multi-metro (Rapid Electronics Ltd., UK) e controllata da un alimentatore 0-30 v.
Analisi del mosaico
Il metodo MARCM è stato utilizzato per generare ed etichettare i cloni di motoneuroni nulli VGlut. Uno schermo preliminare MARCM utilizzando OK371-GAL4 ha scoperto che i motoneuroni del muscolo pleurico nascono durante l’onda embrionale della neurogenesi. Per generare cloni durante questa ondata di neurogenesi, gli adulti da riproduzione sono stati autorizzati a posare su piastre di gelatina d’uva con lievito per 2 ore a 25 ° C.Le uova sono state incubate per 3 ore a 25 ° C ecalore scioccato da incubazione in un bagno d’acqua a 37 ° C per 45min, seguita da un riposo a temperatura ambiente per 30 min, seguita da un ulteriore 30 min a 37 ° C. Alla schiusa, le larve sono state trasferite al cibo standard e sollevate a 25 ° C.
Per generare un piccolo numero di GAL80 ‘flip-out’ o FlpStop Mef2-GAL4 cloni muscolari positivi Mef2-GAL4 L3 larve vaganti sono stati sottoposti a shock termico per 20 minuti di incubazione in un bagno d’acqua a 37 ° C.
Dissezioni e immunocitochimica
Le dissezioni sono state realizzate in elastomero siliconico Sylgard (Dow Corning, USA) rivestito di piastre di Petri in 1x tampone fosfato salino (PBS; pH 7,3, Thermo Fisher Scientific, USA).
Per le dissezioni delle pareti del corpo addominale delle pupille, le pupille sono state rimosse dalle loro casse puparali e appuntati attraverso la testa con perni di tungsteno affilati elettroliticamente 0,1 mm di tungsteno. La punta posteriore di ogni addome è stata rimossa (da circa il segmento 6) ed è stata praticata un’incisione lungo la linea mediana dorsale fino a raggiungere il torace. Gli addominali sono stati separati dal torace tagliando lungo l’articolazione e posati in piano con perni di tungsteno aggiuntivi. Viscere sono stati rimossi da una combinazione di pipettaggio delicato e pinze. Le dissezioni della parete del corpo larvale sono state eseguite come descritto in precedenza(Broadie e Bate, 1993)
I campioni sezionati sono stati fissati in formaldeide tamponata al 3,6% per 45 minuti a temperatura ambiente e lavati tre volte in PBS contenente 0,3 Triton-X100 (Sigma, USA) (PBST). Dopo la fissazione, i campioni sono stati bloccati in PBST contenente il 4% di siero di capra (Sigma, USA) per 45 minuti e incubati in soluzioni di anticorpi primari composti con PBST durante la notte a 5° C.Dopo il risciacquo tre volte con PBST nel corso di una giornata, i campioni sono stati incubati in soluzioni di anticorpi secondari composti con PBST durante la notte a 4° C. Dopo tre risciacqui con PBST e un risciacquo finale con PBS, i campioni sono stati montati su coprivetrini rivestiti in poli-L-lisina, disidratati attraverso una serie di alcol, eliminati con xilene e montati in DePeX (BDH Chemicals, UK).
Gli anticorpi primari sono stati utilizzati alle seguenti concentrazioni: topo anti-nc82 (DSHB, USA) 1:5, coniglio anti-VGlut-C termine (Gift from Hermann Aberle; Mahr and Aberle, 2006) 1:10.000, pollo anti-GFP (Invitrogen, USA) 1:1000. Gli anticorpi secondari sono stati utilizzati alle seguenti concentrazioni: Cy3 caprino anti-HRP (Jackson Immunoresearch, USA) 1:5000, AlexaFluor 488 capra antipollo (Invitrogen, USA) 1:500, Cy5 asino anti-topo 1:500, Cy5 asino anti-coniglio 1:500 (Jackson Immunoresearch, USA).
Per le dissezioni del SNC, le pre-pupae bianche sono state raccolte e incubate a 25° C.Le pre-pupae sono state sezionate dai loro casi pupillari come descritto sopra. CNS sono stati sezionati fuori in 1x PBS in Sylgard rivestito Petri-piatti Petri. Questi sono stati poi immediatamente fissati in formaldeide 3,6% per 20 min. Il fissativo è stato lavato via accuratamente con 1x PBS. CNS sono stati montati su vetrini di vetro in Slow-Fade Antifade reagente (Thermo Fisher Scientific) e sigillati sotto i vetrini coprioggetti con smalto per unghie.
Microiniezioni
Per prepararsi all’iniezione, le crisalidi sono state asciugate su carta velina e fissate a vetrini di vetro con nastro biadesivo. Gli aghi, estratti da capillari di vetro, sono stati caricati con 0,5 mM TTX composto in PBS o una soluzione di controllo di PBS. Le iniezioni sono state effettuate nelle cavità addominali attraverso piccoli fori di accesso praticati nelle casse pupillari, utilizzando un micro iniettore Transjector-5246 (Eppendorf, Germania). Dopo l’iniezione, gli animali sono stati rimossi dal nastro adesivo con un pennello umido e incubati a 25° C.
Saggio di arrampicata
Le femmine adulte sono state usate due giorni dopo l’occlusione. Per valutare la velocità di salita, ogni mosca è stata posta in un tubo di plastica quadrato con bordi di 1 cm e pareti trasparenti. Il calibro stretto impediva alle mosche di saltare o volare. Ogni mosca è stata colpita sul fondo e la sua salita è stata registrata con una telecamera ad alta velocità S-PRI (AOS Technologies AG, Svizzera) a 700 fps, dimensione del fotogramma di 900 × 700 pixel, sotto l’illuminazione a luce rossa. Il tracciamento automatico del corpo è stato effettuato utilizzando FlyLimbTracker(Uhlmann et al., 2017) a Icy(de Chaumont et al., 2012) su una distanza da 0,27 a 0,8 cm. Per l’analisi sono state prese in considerazione solo registrazioni in cui il percorso di arrampicata aveva una linearità superiore al 90%, come determinato con il processore Motion Profiler in Icy. La velocità media di salita di ogni mosca è stata determinata calcolando lo spostamento del centroide del corpo tra ogni fotogramma su tre ripetizioni.
Analisi dell’immagine
Le pile di immagini grezze sono state importate nel software di elaborazione immagini FIJI(http://imagej.net/Fiji) per migliorare la luminosità e il contrasto. Per una maggiore chiarezza, lo strumento di selezione a mano libera è stato utilizzato per rimuovere gli oggetti oscuranti creati dalla degenerazione dei tessuti larvali e dei macrofagi su una fetta per fetta. Le proiezioni z collassate sono state importate in Photoshop (Adobe, USA) per l’assemblaggio delle figure. I cartoni animati schematici sono stati realizzati in Photoshop o Illustrator (Adobe, USA). Per generare i kymographs è stato utilizzato lo strumento re-slice in FIJI per riconfigurare l’asse delle sequenze di immagini.
Analisi statistica
Le analisi statistiche sono state effettuate utilizzando il pacchetto software GraphPad Prism (GraphPad Software Inc., USA). I significati corrispondono ai seguenti valori p: ≤0,05 = *, ≤0,01 = **, ≤0,001 = ***, ≤0,0001 = ****. Per la selezione tra test parametrici e non parametrici, i residui di ogni set di dati sono stati testati per la normalità. I risultati sono riportati con le deviazioni standard (SD).
Quantificazione dei punti sinaptici
Le relazioni tra BRP::RFP, Nlg1::GFP e Liprin-α::GFP puncta dinamiche e crescita dei rami sono state calcolate contando e tracciando manualmente i puncta in FIJI. I puncta sono stati identificati da accumuli di proteine fluorescenti che misurano tre o più pixel di diametro alla risoluzione nativa. I diametri di BRP::RFP puncta sono stati misurati per intersezione con lo strumento linea in FIJI nel loro punto più largo e calcolo dell’intera larghezza a metà del picco in fluorescenza.
Analisi morfometrica
Le ricostruzioni dell’Arbor sono state generate utilizzando il plugin semi-automatico per FIJI, Simple Neurite Tracer. Gli scheletri ricostruiti sono stati importati in un software di analisi su misura in cui sono stati calcolati la lunghezza totale dell’albero, il numero totale di rami, l’ordine Strahler e l’albero totale. L’area di pergola è stata calcolata dando alle coordinate della diramazione un’ipotetica “distanza di contatto” che rappresentava la sua area di copertura. Questo valore è stato impostato a 20 µm. Inoltre, questo software poteva essere usato per aggiungere e cancellare vertici e nodi, permettendo di correggere gli errori di tracciamento.
Indice di curvatura
Per calcolare la curvatura delle diramazioni, la lunghezza “effettiva” delle diramazioni assonali primarie, secondarie e terziarie è stata misurata utilizzando lo strumento a mano libera in FIJI come distanza tra i loro nodi (o nel caso delle diramazioni primarie, tra i nodi e le punte). Questi valori sono stati divisi per le distanze dirette tra questi nodi, misurate con lo strumento a linea retta, dando un indice di curvatura.
Densità della zona attiva
Le densità di zona attive nei terminali degli assoni sono state calcolate manualmente in FIJI utilizzando lo strumento multipunto. Le aree di bouton sono state calcolate tracciando intorno ai bouton con lo strumento di selezione a mano libera.
References
- Alsina B, Vu T, Cohen-Cory S. Visualizing synapse formation in arborizing optic axons in vivo: dynamics and modulation by BDNF. Nature Neuroscience. 2001; 4:1093-1101. DOI | PubMed
- Andreae LC, Burrone J. Spontaneous Neurotransmitter Release Shapes Dendritic Arbors via Long-Range Activation of NMDA Receptors. Cell Reports. 2015; 10:873-882. DOI | PubMed
- Banovic D, Khorramshahi O, Owald D, Wichmann C, Riedt T, Fouquet W, Tian R, Sigrist SJ, Aberle H. Drosophila neuroligin 1 promotes growth and postsynaptic differentiation at glutamatergic neuromuscular junctions. Neuron. 2010; 66:724-738. DOI | PubMed
- Ben Fredj N, Hammond S, Otsuna H, Chien CB, Burrone J, Meyer MP. Synaptic activity and activity-dependent competition regulates axon arbor maturation, growth arrest, and territory in the retinotectal projection. Journal of Neuroscience. 2010; 30:10939-10951. DOI | PubMed
- Berry M, Bradley P. The growth of the dendritic trees of Purkinje cells in irradiated agranular cerebellar cortex. Brain Research. 1976; 116:361-387. DOI | PubMed
- Broadie K, Bate M. Activity-dependent development of the neuromuscular synapse during Drosophila embryogenesis. Neuron. 1993; 11:607-619. DOI | PubMed
- Bullock TH, Horridge AG. Structure and Function in the Nervous Systems of Invertebrates. W. H. Freeman & Co: San Francisco; 1965.
- Chagnac-Amitai Y, Luhmann HJ, Prince DA. Burst generating and regular spiking layer 5 pyramidal neurons of rat neocortex have different morphological features. The Journal of Comparative Neurology. 1990; 296:598-613. DOI | PubMed
- Chen SX, Haas K. Function directs form of neuronal architecture. BioArchitecture. 2011; 1:2-4. DOI | PubMed
- Chen SX, Tari PK, She K, Haas K. Neurexin-neuroligin cell adhesion complexes contribute to synaptotropic dendritogenesis via growth stabilization mechanisms in vivo. Neuron. 2010; 67:967-983. DOI | PubMed
- Chen Y, Akin O, Nern A, Tsui CY, Pecot MY, Zipursky SL. Cell-type-specific labeling of synapses in vivo through synaptic tagging with recombination. Neuron. 2014; 81:280-293. DOI | PubMed
- Chen YC, Lin YQ, Banerjee S, Venken K, Li J, Ismat A, Chen K, Duraine L, Bellen HJ, Bhat MA. Drosophila neuroligin 2 is required presynaptically and postsynaptically for proper synaptic differentiation and synaptic transmission. Journal of Neuroscience. 2012; 32:16018-16030. DOI | PubMed
- Chih B, Engelman H, Scheiffele P. Control of excitatory and inhibitory synapse formation by neuroligins. Science. 2005; 307:1324-1328. DOI | PubMed
- Choi BJ, Imlach WL, Jiao W, Wolfram V, Wu Y, Grbic M, Cela C, Baines RA, Nitabach MN, McCabe BD. Miniature neurotransmission regulates Drosophila synaptic structural maturation. Neuron. 2014; 82:618-634. DOI | PubMed
- Consoulas C, Duch C, Bayline RJ, Levine RB. Behavioral transformations during metamorphosis: remodeling of neural and motor systems. Brain Research Bulletin. 2000; 53:571-583. DOI | PubMed
- Cooper MW, Smith SJ. A real-time analysis of growth cone-target cell interactions during the formation of stable contacts between hippocampal neurons in culture. Journal of Neurobiology. 1992; 23:814-828. DOI | PubMed
- Cuntz H, Forstner F, Borst A, Häusser M. One rule to grow them all: a general theory of neuronal branching and its practical application. PLoS Computational Biology. 2010; 6DOI | PubMed
- Currie DA, Bate M. The development of adult abdominal muscles in Drosophila: myoblasts express twist and are associated with nerves. Development. 1991; 113:91-102. PubMed
- Czöndör K, Garcia M, Argento A, Constals A, Breillat C, Tessier B, Thoumine O. Micropatterned substrates coated with neuronal adhesion molecules for high-content study of synapse formation. Nature Communications. 2013; 4DOI | PubMed
- Daniels RW, Collins CA, Chen K, Gelfand MV, Featherstone DE, DiAntonio A. A single vesicular glutamate transporter is sufficient to fill a synaptic vesicle. Neuron. 2006; 49:11-16. DOI | PubMed
- Daniels RW, Gelfand MV, Collins CA, DiAntonio A. Visualizing glutamatergic cell bodies and synapses in Drosophila larval and adult CNS. The Journal of Comparative Neurology. 2008; 508:131-152. DOI | PubMed
- de Chaumont F, Dallongeville S, Chenouard N, Hervé N, Pop S, Provoost T, Meas-Yedid V, Pankajakshan P, Lecomte T, Le Montagner Y, Lagache T, Dufour A, Olivo-Marin JC. Icy: an open bioimage informatics platform for extended reproducible research. Nature Methods. 2012; 9:690-696. DOI | PubMed
- Dean C, Scholl FG, Choih J, DeMaria S, Berger J, Isacoff E, Scheiffele P. Neurexin mediates the assembly of presynaptic terminals. Nature Neuroscience. 2003; 6:708-716. DOI | PubMed
- Demerec M. Biology of Drosophila. Wiley: New York; 1950.
- Diao F, Ironfield H, Luan H, Diao F, Shropshire WC, Ewer J, Marr E, Potter CJ, Landgraf M, White BH. Plug-and-play genetic access to drosophila cell types using exchangeable exon cassettes. Cell Reports. 2015; 10:1410-1421. DOI | PubMed
- Fernandes J, Bate M, Vijayraghavan K. Development of the indirect flight muscles of Drosophila. Development. 1991; 113:67-77. PubMed
- Fisher YE, Yang HH, Isaacman-Beck J, Xie M, Gohl DM, Clandinin TR. FlpStop, a tool for conditional gene control inDrosophila. eLife. 2017; 6DOI | PubMed
- Fouquet W, Owald D, Wichmann C, Mertel S, Depner H, Dyba M, Hallermann S, Kittel RJ, Eimer S, Sigrist SJ. Maturation of active zone assembly by Drosophila Bruchpilot. The Journal of Cell Biology. 2009; 186:129-145. DOI | PubMed
- Graf ER, Zhang X, Jin SX, Linhoff MW, Craig AM. Neurexins induce differentiation of GABA and glutamate postsynaptic specializations via neuroligins. Cell. 2004; 119:1013-1026. DOI | PubMed
- Grueber WB, Ye B, Moore AW, Jan LY, Jan YN. Dendrites of distinct classes of Drosophila sensory neurons show different capacities for homotypic repulsion. Current Biology. 2003; 13:618-626. DOI | PubMed
- Haas K, Li J, Cline HT. AMPA receptors regulate experience-dependent dendritic arbor growth in vivo. PNAS. 2006; 103:12127-12131. DOI | PubMed
- Hamada FN, Rosenzweig M, Kang K, Pulver SR, Ghezzi A, Jegla TJ, Garrity PA. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 2008; 454:217-220. DOI | PubMed
- Harrison RG. An experimental study of the relation of the nervous system to the developing musculature in the embryo of the frog. American Journal of Anatomy. 1904; 3:197-220. DOI
- Hassan BA, Hiesinger PR. Beyond molecular codes: Simple rules to wire complex brains. Cell. 2015; 163:285-291. DOI | PubMed
- Haverkamp LJ. Anatomical and physiological development of the Xenopus embryonic motor system in the absence of neural activity. Journal of Neuroscience. 1986; 6:1338-1348. PubMed
- Hossain S, Hewapathirane DS, Haas K. Dynamic morphometrics reveals contributions of dendritic growth cones and filopodia to dendritogenesis in the intact and awake embryonic brain. Developmental Neurobiology. 2012; 72:615-627. DOI | PubMed
- Hua JY, Smear MC, Baier H, Smith SJ. Regulation of axon growth in vivo by activity-based competition. Nature. 2005; 434:1022-1026. DOI | PubMed
- Jing L, Lefebvre JL, Gordon LR, Granato M. Wnt signals organize synaptic prepattern and axon guidance through the zebrafish unplugged/MuSK receptor. Neuron. 2009; 61:721-733. DOI | PubMed
- Jontes JD, Buchanan J, Smith SJ. Growth cone and dendrite dynamics in zebrafish embryos: early events in synaptogenesis imaged in vivo. Nature Neuroscience. 2000; 3:231-237. DOI | PubMed
- Kaethner RJ, Stuermer CA. Dynamics of terminal arbor formation and target approach of retinotectal axons in living zebrafish embryos: a time-lapse study of single axons. Journal of Neuroscience. 1992; 12:3257-3271. PubMed
- Ko J, Fuccillo MV, Malenka RC, Südhof TC. LRRTM2 functions as a neurexin ligand in promoting excitatory synapse formation. Neuron. 2009; 64:791-798. DOI | PubMed
- Ko J, Soler-Llavina GJ, Fuccillo MV, Malenka RC, Südhof TC. Neuroligins/LRRTMs prevent activity- and Ca2+/calmodulin-dependent synapse elimination in cultured neurons. The Journal of Cell Biology. 2011; 194:323-334. DOI | PubMed
- Kwon HB, Kozorovitskiy Y, Oh WJ, Peixoto RT, Akhtar N, Saulnier JL, Gu C, Sabatini BL. Neuroligin-1-dependent competition regulates cortical synaptogenesis and synapse number. Nature Neuroscience. 2012; 15:1667-1674. DOI | PubMed
- Lee H, Dean C, Isacoff E. Alternative splicing of neuroligin regulates the rate of presynaptic differentiation. Journal of Neuroscience. 2010; 30:11435-11446. DOI | PubMed
- Li J, Ashley J, Budnik V, Bhat MA. Crucial role of Drosophila neurexin in proper active zone apposition to postsynaptic densities, synaptic growth, and synaptic transmission. Neuron. 2007; 55:741-755. DOI | PubMed
- Mahr A, Aberle H. The expression pattern of the Drosophila vesicular glutamate transporter: a marker protein for motoneurons and glutamatergic centers in the brain. Gene Expression Patterns. 2006; 6:299-309. DOI | PubMed
- Mattila PK, Lappalainen P. Filopodia: molecular architecture and cellular functions. Nature Reviews Molecular Cell Biology. 2008; 9:446-454. DOI | PubMed
- Meyer MP, Smith SJ. Evidence from in vivo imaging that synaptogenesis guides the growth and branching of axonal arbors by two distinct mechanisms. Journal of Neuroscience. 2006; 26:3604-3614. DOI | PubMed
- Missler M, Zhang W, Rohlmann A, Kattenstroth G, Hammer RE, Gottmann K, Südhof TC. Alpha-neurexins couple Ca2+ channels to synaptic vesicle exocytosis. Nature. 2003; 423:939-948. DOI | PubMed
- Niell CM, Meyer MP, Smith SJ. In vivo imaging of synapse formation on a growing dendritic arbor. Nature Neuroscience. 2004; 7:254-260. DOI | PubMed
- Owald D, Fouquet W, Schmidt M, Wichmann C, Mertel S, Depner H, Christiansen F, Zube C, Quentin C, Körner J, Urlaub H, Mechtler K, Sigrist SJ. A Syd-1 homologue regulates pre- and postsynaptic maturation in Drosophila. The Journal of Cell Biology. 2010; 188:565-579. DOI | PubMed
- Owald D, Khorramshahi O, Gupta VK, Banovic D, Depner H, Fouquet W, Wichmann C, Mertel S, Eimer S, Reynolds E, Holt M, Aberle H, Sigrist SJ. Cooperation of Syd-1 with Neurexin synchronizes pre- with postsynaptic assembly. Nature Neuroscience. 2012; 15:1219-1226. DOI | PubMed
- Panzer JA, Song Y, Balice-Gordon RJ. In vivo imaging of preferential motor axon outgrowth to and synaptogenesis at prepatterned acetylcholine receptor clusters in embryonic zebrafish skeletal muscle. Journal of Neuroscience. 2006; 26:934-947. DOI | PubMed
- Pfeiffer BD, Truman JW, Rubin GM. Using translational enhancers to increase transgene expression in Drosophila. Proceedings of the National Academy of Sciences. 2012; 109:6626-6631. DOI | PubMed
- Rajan I, Witte S, Cline HT. NMDA receptor activity stabilizes presynaptic retinotectal axons and postsynaptic optic tectal cell dendrites in vivo. Journal of Neurobiology. 1999; 38:357-368. DOI | PubMed
- Ranganayakulu G, Schulz RA, Olson EN. Wingless signaling induces nautilus expression in the ventral mesoderm of the Drosophila embryo. Developmental Biology. 1996; 176:143-148. DOI | PubMed
- Riedl J, Crevenna AH, Kessenbrock K, Yu JH, Neukirchen D, Bista M, Bradke F, Jenne D, Holak TA, Werb Z, Sixt M, Wedlich-Soldner R. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 2008; 5:605-607. DOI | PubMed
- Roberts A, Conte D, Hull M, Merrison-Hort R, al Azad AK, Buhl E, Borisyuk R, Soffe SR. Can simple rules control development of a pioneer vertebrate neuronal network generating behavior?. Journal of Neuroscience. 2014; 34:608-621. DOI | PubMed
- Roy B, Singh AP, Shetty C, Chaudhary V, North A, Landgraf M, Vijayraghavan K, Rodrigues V. Metamorphosis of an identified serotonergic neuron in the Drosophila olfactory system. Neural Development. 2007; 2:20. DOI | PubMed
- Ruthazer ES, Akerman CJ, Cline HT. Control of axon branch dynamics by correlated activity in vivo. Science. 2003; 301:66-70. DOI | PubMed
- Ruthazer ES, Li J, Cline HT. Stabilization of axon branch dynamics by synaptic maturation. Journal of Neuroscience. 2006; 26:3594-3603. DOI | PubMed
- Sarov M, Barz C, Jambor H, Hein MY, Schmied C, Suchold D, Stender B, Janosch S, K J VV, Krishnan RT, Krishnamoorthy A, Ferreira IR, Ejsmont RK, Finkl K, Hasse S, Kämpfer P, Plewka N, Vinis E, Schloissnig S, Knust E, Hartenstein V, Mann M, Ramaswami M, VijayRaghavan K, Tomancak P, Schnorrer F. A genome-wide resource for the analysis of protein localisation in Drosophila. eLife. 2016; 5DOI | PubMed
- Scheiffele P, Fan J, Choih J, Fetter R, Serafini T. Neuroligin expressed in nonneuronal cells triggers presynaptic development in contacting axons. Cell. 2000; 101:657-669. DOI | PubMed
- Schnütgen F, Doerflinger N, Calléja C, Wendling O, Chambon P, Ghyselinck NB. A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse. Nature Biotechnology. 2003; 21:562-565. DOI | PubMed
- Shimono K, Fujimoto A, Tsuyama T, Yamamoto-Kochi M, Sato M, Hattori Y, Sugimura K, Usui T, Kimura K, Uemura T. Multidendritic sensory neurons in the adult Drosophila abdomen: origins, dendritic morphology, and segment- and age-dependent programmed cell death. Neural Development. 2009; 4:37-21. DOI | PubMed
- Siddiqui TJ, Pancaroglu R, Kang Y, Rooyakkers A, Craig AM, Marie A. LRRTMs and neuroligins bind neurexins with a differential code to cooperate in glutamate synapse development. Journal of Neuroscience. 2010; 30:7495-7506. DOI | PubMed
- Sin WC, Haas K, Ruthazer ES, Cline HT. Dendrite growth increased by visual activity requires NMDA receptor and Rho GTPases. Nature. 2002; 419:475-480. DOI | PubMed
- Soler-Llavina GJ, Fuccillo MV, Ko J, Südhof TC, Malenka RC. The neurexin ligands, neuroligins and leucine-rich repeat transmembrane proteins, perform convergent and divergent synaptic functions in vivo. PNAS. 2011; 108:16502-16509. DOI | PubMed
- Stramer B, Moreira S, Millard T, Evans I, Huang CY, Sabet O, Milner M, Dunn G, Martin P, Wood W. Clasp-mediated microtubule bundling regulates persistent motility and contact repulsion in Drosophila macrophages in vivo. The Journal of Cell Biology. 2010; 189:681-689. DOI | PubMed
- Sugita S, Saito F, Tang J, Satz J, Campbell K, Südhof TC. A stoichiometric complex of neurexins and dystroglycan in brain. The Journal of Cell Biology. 2001; 154:435-446. DOI | PubMed
- Teeter CM, Stevens CF. A general principle of neural arbor branch density. Current Biology. 2011; 21:2105-2108. DOI | PubMed
- Truman JW. Metamorphosis of the central nervous system of Drosophila. Journal of Neurobiology. 1990; 21:1072-1084. DOI | PubMed
- Uhlmann V, Ramdya P, Delgado-Gonzalo R, Benton R, Unser M. FlyLimbTracker: An active contour based approach for leg segment tracking in unmarked, freely behaving Drosophila. PLoS One. 2017; 12:e0173433. DOI | PubMed
- Urwyler O, Izadifar A, Dascenco D, Petrovic M, He H, Ayaz D, Kremer A, Lippens S, Baatsen P, Guérin CJ, Schmucker D. Investigating CNS synaptogenesis at single-synapse resolution by combining reverse genetics with correlative light and electron microscopy. Development. 2015; 142:394-405. DOI | PubMed
- Varoqueaux F, Aramuni G, Rawson RL, Mohrmann R, Missler M, Gottmann K, Zhang W, Südhof TC, Brose N. Neuroligins determine synapse maturation and function. Neuron. 2006; 51:741-754. DOI | PubMed
- Varoqueaux F, Sigler A, Rhee JS, Brose N, Enk C, Reim K, Rosenmund C. Total arrest of spontaneous and evoked synaptic transmission but normal synaptogenesis in the absence of Munc13-mediated vesicle priming. PNAS. 2002; 99:9037-9042. DOI | PubMed
- Vaughn JE, Barber RP, Sims TJ. Dendritic development and preferential growth into synaptogenic fields: a quantitative study of Golgi-impregnated spinal motor neurons. Synapse. 1988; 2:69-78. DOI | PubMed
- Vaughn JE, Henrikson CK, Grieshaber JA. A quantitative study of synapses on motor neuron dendritic growth cones in developing mouse spinal cord. The Journal of Cell Biology. 1974; 60:664-672. DOI | PubMed
- Vaughn JE. Fine structure of synaptogenesis in the vertebrate central nervous system. Synapse. 1989; 3:255-285. DOI | PubMed
- Venken KJ, Schulze KL, Haelterman NA, Pan H, He Y, Evans-Holm M, Carlson JW, Levis RW, Spradling AC, Hoskins RA, Bellen HJ. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nature Methods. 2011; 8:737-743. DOI | PubMed
- Verhage M, Maia AS, Plomp JJ, Brussaard AB, Heeroma JH, Vermeer H, Toonen RF, Hammer RE, van den Berg TK, Missler M, Geuze HJ, Südhof TC. Synaptic assembly of the brain in the absence of neurotransmitter secretion. Science. 2000; 287:864-869. DOI | PubMed
- Walter J, Henke-Fahle S, Bonhoeffer F. Avoidance of posterior tectal membranes by temporal retinal axons. Development. 1987; 101:909-913. PubMed
- Weiss P. Self-differentiation of the basic patterns of coordination. Comp Psychological Monographs. 1941; 17:1-96.
- Williams DW, Truman JW. Mechanisms of dendritic elaboration of sensory neurons in Drosophila: insights from in vivo time lapse. Journal of Neuroscience. 2004; 24:1541-1550. DOI | PubMed
- Wu GY, Zou DJ, Rajan I, Cline H. Dendritic dynamics in vivo change during neuronal maturation. Journal of Neuroscience. 1999; 19:4472-4483. PubMed
- Xu J, Xiao N, Xia J. Thrombospondin 1 accelerates synaptogenesis in hippocampal neurons through neuroligin 1. Nature Neuroscience. 2010; 13:22-24. DOI | PubMed
- Yalgin C, Ebrahimi S, Delandre C, Yoong LF, Akimoto S, Tran H, Amikura R, Spokony R, Torben-Nielsen B, White KP, Moore AW. Centrosomin represses dendrite branching by orienting microtubule nucleation. Nature Neuroscience. 2015; 18:1437-1445. DOI | PubMed
- Yang X, Arber S, William C, Li L, Tanabe Y, Jessell TM, Birchmeier C, Burden SJ. Patterning of muscle acetylcholine receptor gene expression in the absence of motor innervation. Neuron. 2001; 30:399-410. DOI | PubMed
- Ziv NE, Smith SJ. Evidence for a role of dendritic filopodia in synaptogenesis and spine formation. Neuron. 1996; 17:91-102. DOI | PubMed
Fonte
Constance WD, Mukherjee A, Fisher YE, Pop S, Blanc E, et al. () Neurexin and Neuroligin-based adhesion complexes drive axonal arborisation growth independent of synaptic activity. eLife 7e31659. https://doi.org/10.7554/eLife.31659





