Introduzione
I pazienti affetti da cancro sono tipicamente monitorati con l’imaging seriale dell’organo interessato; il rilevamento tempestivo della recidiva tumorale può avere profonde implicazioni per la morbilità e la sopravvivenza. I gliomi a basso grado (grado 2 dell’OMS) costituiscono il 15% di tutti i tumori cerebrali adulti [1- 3]. I pazienti con diagnosi di gliomi a basso grado sono seguiti da risonanze magnetiche seriali (RMN) del cervello. Il recupero per inversione fluido-attenuato (FLAIR) è la principale sequenza di imaging per la valutazione della crescita dei gliomi a basso grado [4].
Alla diagnosi iniziale, i gliomi a basso grado possono essere trattati con chirurgia, con o senza radiazioni o chemioterapia [5- 7]. Resezioni più estese di gliomi a basso grado sono associate ad un miglioramento del tempo di sopravvivenza globale e del tempo di sopravvivenza libera da progressione [8- 14]. Alcuni studi hanno riportato una correlazione tra radioterapia e deterioramento cognitivo in pazienti con gliomi a basso grado [15,16]; tuttavia, un recente studio dell’Organizzazione Europea per la Ricerca e il Trattamento del Cancro non ha trovato alcuna differenza nella cognizione globale nei pazienti trattati con radioterapia rispetto alla chemioterapia [17]. Al momento del rilevamento della crescita, i gliomi a basso grado possono rimanere allo stesso grado o possono essersi trasformati in gradi superiori [18]; possono essere nuovamente trattati con chirurgia con o senza radioterapia e chemioterapia [19,20].
La segmentazione e l’analisi delle immagini sono problemi non banali a causa dell’aspetto e della forma imprevedibile dei tumori cerebrali nella risonanza magnetica. Recentemente, diversi metodi e configurazioni di intelligenza artificiale sono stati applicati alle malattie cerebrali, compresi i tumori cerebrali [21]. Abbiamo sviluppato un metodo per la segmentazione delle immagini mediche che estrae i confini degli oggetti nella visione artificiale [22]. Il nostro metodo applica una fattorizzazione non negativa della matrice e un metodo modificato del set di livelli; non utilizza l’apprendimento profondo, i dati di formazione o le reti neurali. Il rilevamento di bruschi cambiamenti nelle caratteristiche dei sistemi fisici è un problema fondamentale nell’elaborazione dei segnali; le applicazioni includono il rilevamento e la diagnosi di guasti, la sicurezza degli aerei, la previsione di terremoti e le applicazioni biomediche, come l’elettroencefalogramma, l’elettromiografia e l’analisi ECG [23,24].
Attualmente, il confronto visivo di immagini FLAIR bidimensionali (2D) con o senza misurazione bidimensionale è il gold standard per la sorveglianza dei gliomi di basso grado. I medici confrontano le immagini 2D di una serie di studi longitudinali. Poiché il tempo di sopravvivenza complessivo del glioma a basso grado viene misurato in anni, la maggior parte dei pazienti dispone di un’ampia serie di immagini longitudinali su diversi anni. Il confronto della risonanza magnetica attuale con tutte le immagini precedenti richiede un tempo molto lungo per l’interpretazione delle immagini, che non è praticamente fattibile nell’attuale standard di pratica. Inoltre, in un tipico centro oncologico, sia in un ambiente accademico che in un ambiente privato, più medici sono coinvolti nella valutazione della crescita tumorale, introducendo un’elevata variabilità interosservatore [25]. Abbiamo ipotizzato che l’individuazione di un cambiamento nello stato del tumore, cioè la crescita tumorale, potrebbe essere migliorata da una procedura di diagnosi assistita da computer (CAD) che digitalizza il tumore e indirizza l’attenzione del medico verso un cambiamento di volume. Questo è importante perché le piccole dimensioni del tumore sono associate a una minore morbilità neurologica [2,17].
Metodi
Approvazione etica
L’Institutional Review Board dell’Università dell’Alabama a Birmingham ha approvato la ricerca; la rinuncia al consenso informato è stata concessa perché la ricerca non comportava rischi superiori al minimo e non prevedeva procedure per le quali il consenso scritto è normalmente richiesto al di fuori del contesto della ricerca. Questo studio non aveva un protocollo.
Studio di progettazione
Si tratta di uno studio osservazionale retrospettivo sull’accuratezza della diagnosi di crescita del glioma da parte di medici esperti che hanno visto le scansioni MRI in un ambiente clinico e da 7 medici esperti che, inoltre, hanno ricevuto immagini segmentate, volumi numerici e una determinazione statistica della crescita con il metodo del cambio di punto.
Selezione del paziente e dimensione dello studio
Abbiamo esaminato 165 pazienti a cui erano stati diagnosticati gliomi di grado 2 dell’OMS, visti nelle cliniche di neurooncologia dell’Università dell’Alabama a Birmingham dal 1° luglio 2017 al 14 maggio 2018 (vedi diagramma di flusso nella Fig 1). Le scansioni MRI sono state raccolte dal PACS di radiologia durante la primavera e l’estate del 2018.
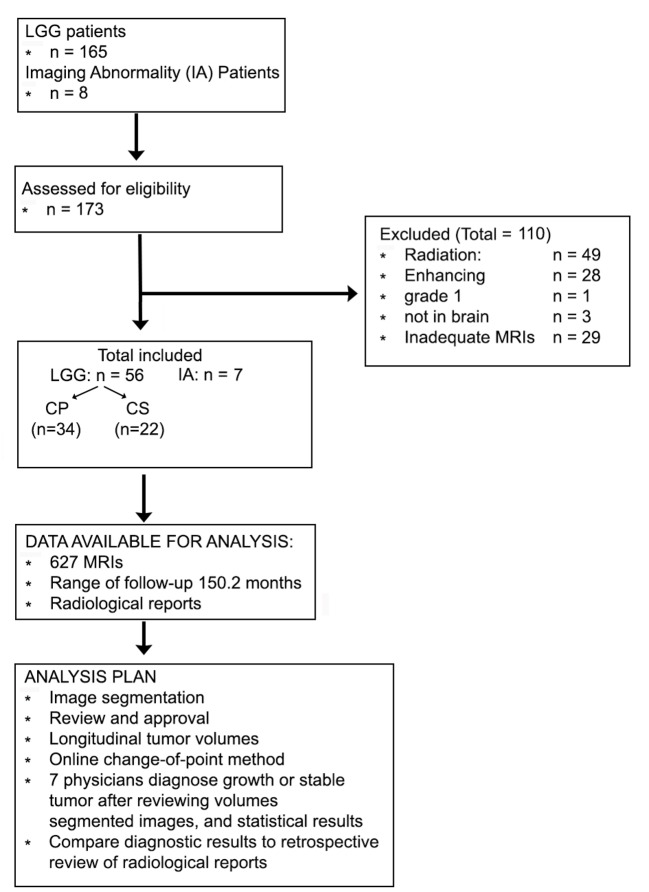
Fig. 1.Diagramma di flusso e piano di analisi.CP, progressione clinica; CS, clinicamente stabile; LLG, glioma a basso grado.
I criteri di inclusione sono stati (1) diagnosi patologica di oligodendroglioma di grado 2 (oligo), astrocitoma di grado 2 (astro), o glioma misto di grado 2 nel cervello, esclusa la ghiandola pineale, e (2) almeno 4 scansioni MRI disponibili per la revisione dopo la diagnosi iniziale o dopo il completamento della chemioterapia con temozolomide (se applicabile). I criteri di esclusione erano (1) trattamento con radioterapia dopo la diagnosi iniziale o (2) rapporti radiologici che indicavano lo sviluppo di un nuovo miglioramento senza un aumento del segnale FLAIR. I pazienti trattati con radioterapia sono stati esclusi perché la radioterapia può confondere i risultati causando un aumento indipendente del segnale FLAIR. Abbiamo escluso i pazienti i cui referti radiologici hanno descritto nuovi noduli di miglioramento senza un aumento del segnale FLAIR perché sono facilmente rilevabili dall’esame visivo.
In totale 56 gliomi hanno soddisfatto i criteri di inclusione, compresi 19 oligo, 26 astro e 11 gliomi misti; solo 2 pazienti hanno ricevuto temozolomide (Tabella 1). Tutti gli oligo hanno avuto le co-delezioni di 1p/19q, tranne 1 con una singola delezione di 19q. Al momento della revisione retrospettiva (14 maggio 2018), a 34/56 pazienti era stata diagnosticata una progressione clinica, mentre i rimanenti 22/56 erano stati diagnosticati come clinicamente stabili grazie al confronto visivo della risonanza magnetica più recente eseguita durante l’ultima visita clinica. Abbiamo esaminato le registrazioni di 8 pazienti seguiti nelle nostre cliniche per un’anomalia di imaging senza diagnosi patologica; 1 paziente è stato escluso per mancanza di informazioni di follow-up. Tutti e 7 i pazienti con anomalie di imaging sono stati considerati clinicamente stabili al momento della revisione di questo studio.
| Patologia | Numero di pazienti | Età media (anni) | Numero di maschi | Numero di femmine | Numero trattato con temozolomide |
|---|---|---|---|---|---|
| Oligodendroglioma | 19 | 47 | 11 | 8 | 1 |
| Astrocitoma | 26 | 46 | 14 | 12 | 1 |
| Glioma misto | 11 | 53 | 5 | 6 | 0 |
| Tutti | 56 | 48 | 30 | 26 | 2 |

Fig. 1.Diagramma di flusso e piano di analisi.CP, progressione clinica; CS, clinicamente stabile; LLG, glioma a basso grado.
Tempo di crescita rilevato dalle cure cliniche standard
Diversi neuro-radiologi certificati dal consiglio direttivo dell’Università dell’Alabama presso l’Ospedale di Birmingham hanno generato i rapporti radiologici dopo aver valutato ogni scansione longitudinale di risonanza magnetica. Abbiamo calcolato retrospettivamente il tempo di rilevazione della crescita dalle impressioni dei referti radiologici di questi pazienti.
Segmentazione dei tumori
In totale sono state analizzate 627 risonanze magnetiche. La segmentazione della sequenza FLAIR è stata eseguita con 2 procedure: In primo luogo, un algoritmo automatico ha classificato e contornato le diverse regioni dell’immagine; ha applicato una fattorizzazione non negativa della matrice e un metodo di set di livelli modificati (NMF-LSM) come descritto in Dera et al. [22]. Questa segmentazione automatica ha generato 8 segmenti per ogni immagine (vedi [22]), che sono stati classificati in base alla loro intensità massima. In secondo luogo, i margini tumorali finali sono stati ottenuti combinando le regioni le cui intensità massime erano superiori al livello della materia grigia. Un medico ha esaminato e approvato i margini tumorali finali. Le informazioni dettagliate sul metodo di segmentazione e sulla combinazione dei segmenti per calcolare i margini tumorali sono presentate altrove [26]. Gli organizzatori del Multimodal Brain Tumor Tumor Segmentation (BraTS) Challenge (https://www.med.upenn.edu/sbia/brats2018/data.html) hanno valutato in modo indipendente l’accuratezza di questo metodo nella segmentazione delle aree iperintense in T2/FLAIR MRI (cioè l’intera etichetta del tumore) [27]. I volumi tumorali sono stati calcolati moltiplicando la somma dei segmenti tumorali in tutte le immagini assiali per la distanza tra le immagini. I calcoli sono stati eseguiti presso il supercomputer Cheaha dell’Università dell’Alabama a Birmingham (https://docs.uabgrid.uab.edu/wiki/cheaha).
Cambiamenti repentini di punto online
Per escludere i cambiamenti FLAIR dovuti all’evoluzione dei cambiamenti post-chirurgici, il volume di base nella serie longitudinale è stato il primo minimo dopo la resezione chirurgica. Per identificare un brusco cambiamento di volume, abbiamo applicato i findchangepts di funzione in Matlab (Mathworks), rilevando un cambiamento nel livello radice-media-quadrato ad una soglia minima di 500/(volume alla linea di base) e un minimo di 2 campioni tra i punti di cambiamento. Il numero 500 corrisponde al 5% della mediana arrotondata del volume della linea di base.
Nel contesto clinico, un medico esamina l’attuale scansione MRI e la confronta con le scansioni MRI eseguite in date precedenti. Per simulare una visita in clinica, il cambio di punto online considera solo le misurazioni passate. Il tempo di crescita rilevato con il metodo CAD corrisponde al periodo di tempo tra le date della risonanza magnetica di base e il primo cambio di punto.
Revisione del rilevamento della crescita con il metodo del cambio di punto
La crescita rilevata con il metodo del cambiamento statistico del punto è stata esaminata da 7 medici che sono certificati dal consiglio di amministrazione in neuro-radiologia (AKB), neuro-immagini (LBN), neuro-oncologia (HMF, LBN, PPW, XH), oncologia delle radiazioni (MB), e neurochirurgia (JM). Per 63 casi, ai medici sono stati forniti (1) i volumi tumorali, (2) la determinazione della crescita o della stabilità con il metodo del cambiamento di punto, e (3) le immagini con segmentazione, ottenute alla (1) linea di base (come definito nella sezione precedente), (2) il punto temporale di rilevazione della crescita con il metodo del cambiamento di punto statistico, se diverso dall’ultima visita, e (3) l’ultima visita. Le immagini includevano una linea rossa che contornava i margini del tumore, delineata con il metodo della segmentazione (vedi S1 Data). Ai medici è stato chiesto di determinare se il tumore era cresciuto rispetto alla linea di base o meno. Queste scansioni e volumi di risonanza magnetica, compresi i dati di segmentazione, sono disponibili nella tabella S1 e nei dati S1 e S2.
Modello matematico dei gliomi
Gli autori hanno recentemente riportato un sistema di equazioni differenziali parziali (PDE) che modellano la crescita del glioma alla scala della risonanza magnetica e della patologia. Le equazioni includono i tassi di replicazione (mitosi), l’invasione cerebrale, l’angiogenesi e una soglia per l’ipossia; i metodi numerici utilizzati per risolvere il sistema della PDE sono dettagliati altrove [18,28,29].
Analisi statistica e adattamento delle curve
I valori p sono stati generati dal test a due code di Mann-Whitney-Wilcoxon. L’adattamento della curva è stato fatto in Matlab utilizzando la funzione di adattamento e i modelli poly1 (y = p1 * x + p2) ed exp1 (y = a * exp(b * x)). I volumi normalizzati sono stati calcolati sottraendo il volume di base e dividendo per il volume più recente. Gli intervalli di tempo dalla linea di base sono stati normalizzati dividendo per il più grande. Per identificare i tumori con crescita esponenziale del modello, abbiamo selezionato una curva normalizzata se la sua somma non lineare di quadrati dovuta all’errore (sse) era inferiore a 0,6 * sse lineare (0,6 è stato scelto in quanto produce un adattamento del modello esponenziale di r2 > 0,85 per i dati normalizzati di tutte le curve selezionate).
Risultati
Descrizione del paziente
Il metodo CAD è stato applicato alle scansioni MRI longitudinali di un totale di 63 pazienti, di cui 56 pazienti affetti da gliomi; l’età media e le proporzioni maschio e femmina sono riportate nella Tabella 1. L’intervallo, la media e la mediana del follow-up sono stati rispettivamente di 150,2, 46,6 e 33,6 mesi. Ci sono stati 3 gruppi di pazienti: 34 pazienti con gliomi di grado 2 con una progressione clinica nota, 22 pazienti con gliomi di grado 2 che erano clinicamente stabili per confronto visivo e 7 pazienti con un’anomalia di imaging, anch’essi clinicamente stabili per confronto visivo. Il gruppo di progressione clinica comprendeva 7 oligo, 18 astro e 9 gliomi misti. Il gruppo dei tumori clinicamente stabili comprendeva 12 oligo, 8 astro e 2 gliomi misti.
Il CAD rileva la crescita in anticipo
Nel gruppo di progressione clinica, il tempo mediano di crescita rilevato dal confronto visivo per oligo, astro e gliomi misti era rispettivamente di 79 mesi, 33 mesi e 56 mesi. La CAD ha aiutato i medici a rilevare la crescita in modo statisticamente significativo in 7/7 oligo (mediana = 19 mesi), 14/18 astro (mediana = 12 mesi) e 8/9 gliomi misti (mediana: 16 mesi; Tabella 2). Inoltre, i tumori erano significativamente più grandi al momento della diagnosi, quando la crescita è stata rilevata da una valutazione radiologica standard rispetto alla CAD, con valori mediani del 163% contro il 52%, del 155% contro il 50% e del 286% contro il 69% per oligo, astro e gliomi misti, rispettivamente (Tabella 2 e Fig 2).
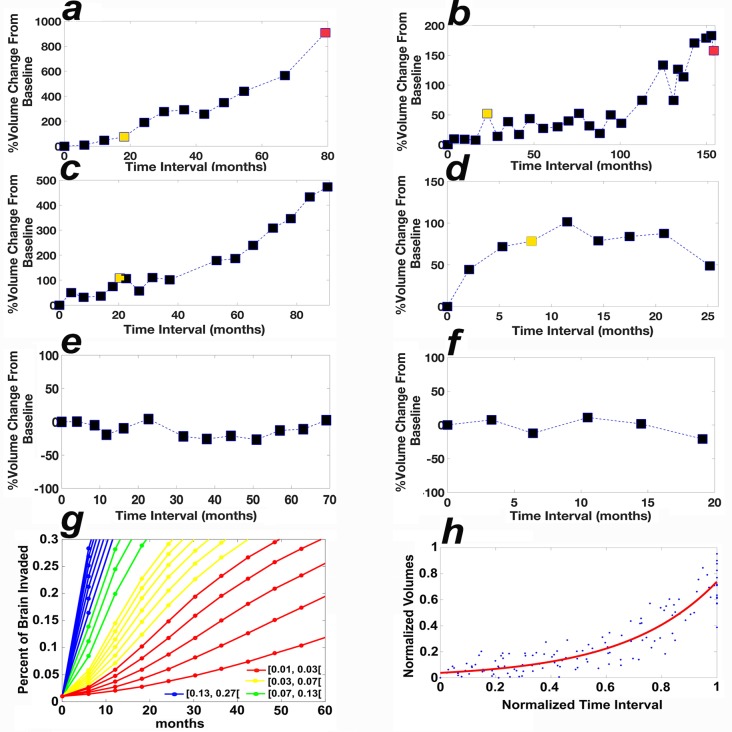
Fig. 2.Curve di crescita dei gliomi di grado 2.(a e b) I volumi tumorali di 2 pazienti del gruppo di progressione clinica, diagnosticati con oligo. (c e d) I volumi tumorali di 2 pazienti nel gruppo clinicamente stabile con diagnosi di oligo e astro, rispettivamente. I volumi al momento della crescita rilevati dal CAD e dal confronto visivo sono colorati rispettivamente in giallo e rosso. (e e e f) I volumi tumorali di 2 pazienti nel gruppo clinicamente stabile mediante CAD e confronto visivo, diagnosticati rispettivamente con un astro e un oligo. L’asse x in (a-f) corrisponde all’intervallo di tempo dalla risonanza magnetica di base. (g) I risultati delle simulazioni del modello matematico per i gliomi di grado 2, che mostrano la percentuale di cervello invaso dal tumore (asse y) in funzione del parametro per il tasso mitotico (per ora) in presenza di un basso tasso di angiogenesi (0,1/ora), vedi Scribner et al [18]. (h) L’adattamento della curva dei dati normalizzati di 14 pazienti con crescita non lineare utilizzando il modello f(x) = a * exp(b * x), coefficienti (con limiti di confidenza del 95%): a = 0.03751 (0.02759, 0,04743), b = 2,98 (2,69, 3,27), somma dei quadrati dovuti all’errore = 1,3701, r2 = 0,8580. astro, astrocitoma; CAD, diagnosi assistita da computer; oligo, oligodendroglioma.
| Patologia | Numero | ΔG | Tempo di crescita (mesi), mediana (IQR) | ΔV, mediana (IQR) | ||||
|---|---|---|---|---|---|---|---|---|
| CAD | VC | p-Valore | CAD | VC | p-Valore | |||
| Oligodendroglioma | 7 | 7 | 19 (13–23) | 79 (48–101) | <0.001 | 52% (36%–72%) | 163% (141%–479%) | 0.001 |
| Astrocitoma | 18 | 14 | 12 (10–16) | 33 (26–44) | <0.001 | 50% (37%–76%) | 155% (120%–257%) | 0.001 |
| Glioma misto | 9 | 8 | 16 (10–20) | 56 (31–70) | <0.001 | 69% (46%–116%) | 286% (203%–537%) | <0.001 |
| Tutti | 34 | 29 | 14 (11–20) | 44 (30–68) | <0.001 | 57% (36%–77%) | 174% (134%–342%) | <0.001 |

Fig. 2.Curve di crescita dei gliomi di grado 2.(a e b) I volumi tumorali di 2 pazienti nel gruppo di progressione clinica, diagnosticati con oligo. (c e d) I volumi tumorali di 2 pazienti nel gruppo clinicamente stabile con diagnosi di oligo e astro, rispettivamente. I volumi al momento della crescita rilevati dal CAD e dal confronto visivo sono colorati rispettivamente in giallo e rosso. (e e e f) I volumi tumorali di 2 pazienti nel gruppo clinicamente stabile mediante CAD e confronto visivo, diagnosticati rispettivamente con un astro e un oligo. L’asse x in (a-f) corrisponde all’intervallo di tempo dalla risonanza magnetica di base. (g) I risultati delle simulazioni del modello matematico per i gliomi di grado 2, che mostrano la percentuale di cervello invaso dal tumore (asse y) in funzione del parametro per il tasso mitotico (per ora) in presenza di un basso tasso di angiogenesi (0,1/ora), vedi Scribner et al [18]. (h) L’adattamento della curva dei dati normalizzati di 14 pazienti con crescita non lineare utilizzando il modello f(x) = a * exp(b * x), coefficienti (con limiti di confidenza del 95%): a = 0.03751 (0.02759, 0,04743), b = 2,98 (2,69, 3,27), somma dei quadrati dovuti all’errore = 1,3701, r2 = 0,8580. astro, astrocitoma; CAD, diagnosi assistita da computer; oligo, oligodendroglioma.
Tempo di crescita nei gliomi di grado 2 clinicamente stabili
Nel gruppo dei gliomi di grado 2 clinicamente stabili, il CAD ha aiutato i medici a rilevare la crescita di 7/12 oligo, 4/8 astro e 2/2 gliomi misti; il periodo mediano di follow-up è stato, rispettivamente, di 37 mesi e 19 mesi per i gliomi di grado 2 che hanno mostrato una crescita rispetto a quelli che sono rimasti stabili con il metodo CAD (Tabella 3). Il tempo mediano di crescita rilevato con il metodo CAD per oligoni, astro e gliomi misti è stato rispettivamente di 15 mesi, 12 mesi e 8 mesi (Tabella 3 e Figg. 2 e 3).
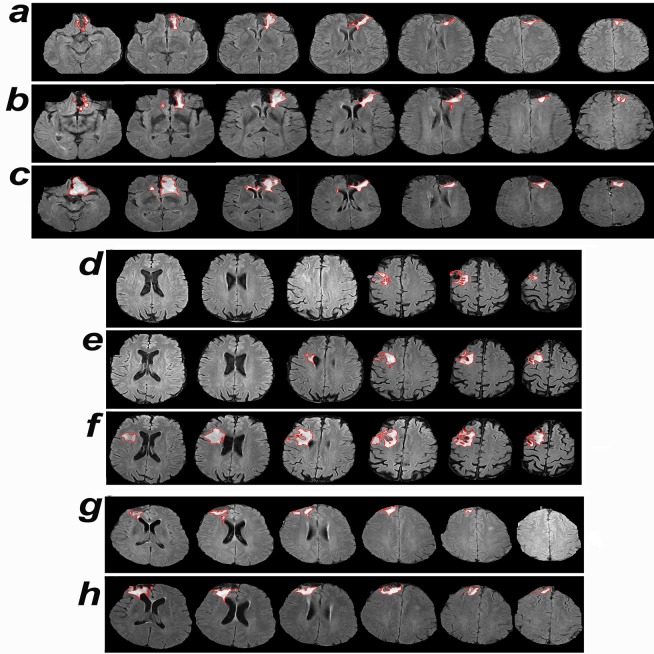
Fig 3.Tempo di crescita rilevato mediante diagnosi assistita dal computer e confronto visivo.(a-c) Risonanza magnetica assiale FLAIR assiale di un paziente del gruppo di progressione clinica, diagnosticato con un oligo, i cui volumi tumorali sono mostrati nella Fig 2B, alla linea di base (a), il punto temporale di rilevazione della crescita mediante diagnosi assistita dal computer (b), e il punto temporale di rilevazione mediante confronto visivo (c). (d-f) Risonanza magnetica assiale FLAIR assiale di un paziente clinicamente stabile con diagnosi di oligo di grado 2, i cui volumi tumorali sono mostrati nella Fig 2C, alla linea di base (d), il punto temporale di rilevazione della crescita mediante diagnosi assistita da computer (e), e l’ultima risonanza magnetica di follow-up, considerata stabile mediante confronto visivo (f). Il nostro gruppo di medici ha esaminato le immagini e ha convenuto che il tumore era cresciuto. Questo paziente ha scelto di avere una resezione; la diagnosi patologica ha rivelato un oligo di grado 3. (g e h) Risonanza magnetica assiale FLAIR di un paziente clinicamente stabile a cui è stato diagnosticato un astro, i cui volumi tumorali sono mostrati nella Fig 2D, al basale (g) e il punto temporale di rilevazione della crescita mediante diagnosi assistita dal computer (h). astro, astrocitoma; FLAIR, recupero dell’inversione a fluido attenuato; oligo, oligodendroglioma.
| Patologia | Numero | CAD G | CAD TTG | FU G | FU S | CAD ΔV |
|---|---|---|---|---|---|---|
| Oligodendroglioma | 12 | 7 | 15 (11–24) | 81 (26–86) | 19 (16–26) | 51% (45%–97%) |
| Astrocitoma | 8 | 4 | 12 (8–16) | 22 (18–24) | 18 (6–50) | 78% (64%–126%) |
| Glioma misto | 2 | 2 | 8 (7–9) | 87 (73–101) | N.A. | 42% (26%–58%) |
| Tutti | 22 | 13 | 13 (9–17) | 37 (22–88) | 19 (8–34) | 58% (46%–86%) |
Tre di questi 13 gliomi hanno mostrato un’ulteriore crescita tumorale durante il periodo di follow-up dopo il rilevamento della crescita tramite CAD. Alla luce dei risultati della CAD, il paziente le cui scansioni longitudinali della RMN sono mostrate nella Fig 3D-3F ha scelto di avere una resezione; l’esame patologico ha rivelato un oligo di grado 3 dell’OMS, una diagnosi che richiede un intervento terapeutico. Il neurochirurgo curante ha notato che mentre l’opzione chirurgica attuale era una resezione subtotale (Fig 3F), una resezione totale lorda sarebbe stata una possibilità al momento della rilevazione della crescita da parte del CAD (Fig 3E).

Fig. 3.Tempo di crescita rilevato dalla diagnosi assistita dal computer e dal confronto visivo.(a-c) Risonanza magnetica assiale FLAIR assiale di un paziente del gruppo di progressione clinica, diagnosticato con un oligo, i cui volumi tumorali sono mostrati nella Fig 2B, alla linea di base (a), il punto temporale di rilevazione della crescita mediante diagnosi assistita da computer (b), e il punto temporale di rilevazione mediante confronto visivo (c). (d-f) Risonanza magnetica assiale FLAIR assiale di un paziente clinicamente stabile con diagnosi di oligo di grado 2, i cui volumi tumorali sono mostrati nella Fig 2C, alla linea di base (d), il punto temporale di rilevazione della crescita mediante diagnosi assistita da computer (e), e l’ultima risonanza magnetica di follow-up, considerata stabile mediante confronto visivo (f). Il nostro gruppo di medici ha esaminato le immagini e ha convenuto che il tumore era cresciuto. Questo paziente ha scelto di avere una resezione; la diagnosi patologica ha rivelato un oligo di grado 3. (g e h) Risonanza magnetica assiale FLAIR di un paziente clinicamente stabile a cui è stato diagnosticato un astro, i cui volumi tumorali sono mostrati nella Fig 2D, al basale (g) e il punto temporale di rilevazione della crescita mediante diagnosi assistita dal computer (h). astro, astrocitoma; FLAIR, recupero dell’inversione a fluido attenuato; oligo, oligodendroglioma.
Gruppo di anomalie dell’immagine
Il CAD non ha rilevato la crescita in nessuno dei 7 pazienti seguiti per un’anomalia di imaging. Questi pazienti sono stati seguiti per una media di 79 mesi (IQR = 68,5 mesi) dopo la prima risonanza magnetica.
Revisione delle previsioni del metodo del cambiamento di punto
I 7 medici esperti hanno esaminato e concordato con le determinazioni di crescita (veri positivi, n = 34 + 13) e nessuna crescita (veri negativi, n = 7 + 9) nei tempi previsti dal metodo statistico online del cambio di punto (Fig 3). I dati della risonanza magnetica con i risultati della segmentazione (S1 Data) e le misurazioni volumetriche (S2 Data) con i corrispondenti intervalli di tempo sono a disposizione del lettore (vedi tabella S1).
Crescita stazionaria non lineare
I dati dimostrano che il tempo di crescita rilevato con l’ausilio del metodo CAD può essere di diversi anni inferiore a quello rilevato dal confronto visivo (Tabella 2), da cui l’importanza del tasso di crescita tumorale. Le simulazioni del modello matematico dei gliomi rivelano che la crescita può essere non lineare o quasi lineare in funzione del tasso mitotico (Fig 2G); piccoli tassi mitotici generano curve non lineari. Utilizzando i dati normalizzati dei 47 tumori con crescita (n = 47; 34 della Tabella 2 e 13 della Tabella 3), identifichiamo 14/47 tumori le cui curve di crescita normalizzate si adattano ad un modello esponenziale non lineare (Fig 2H, r2 = 0,86). Notiamo che, sebbene 22/29 tumori nel gruppo di progressione clinica abbiano continuato a crescere dopo il punto temporale di rilevazione della crescita con il metodo CAD (Fig 2A), 7 gliomi a basso grado sono rimasti in una fase stazionaria di crescita lenta (Tabella S2), che è durata più di 3 anni in 3 gliomi (Figg. 2B e 3A-3C), 18 mesi in 2 gliomi, 14 mesi in 1 glioma e 9 mesi in 1 glioma.
La crescita 3D non è omogenea
Attualmente, gli studi clinici calcolano la dimensione di un glioma come il prodotto bidimensionale dei 2 diametri perpendicolari più grandi nella sezione 2D che include la componente tumorale più grande. Questa pratica presuppone che un glioma cresca in modo omogeneo in 3D, vale a dire che cresca a tassi uguali in tutte le direzioni. La figura 4 mostra un controesempio, dove la crescita del tumore non è omogenea in 3D perché il tumore cresce più velocemente nelle sezioni lontane dalla componente tumorale assiale più grande.
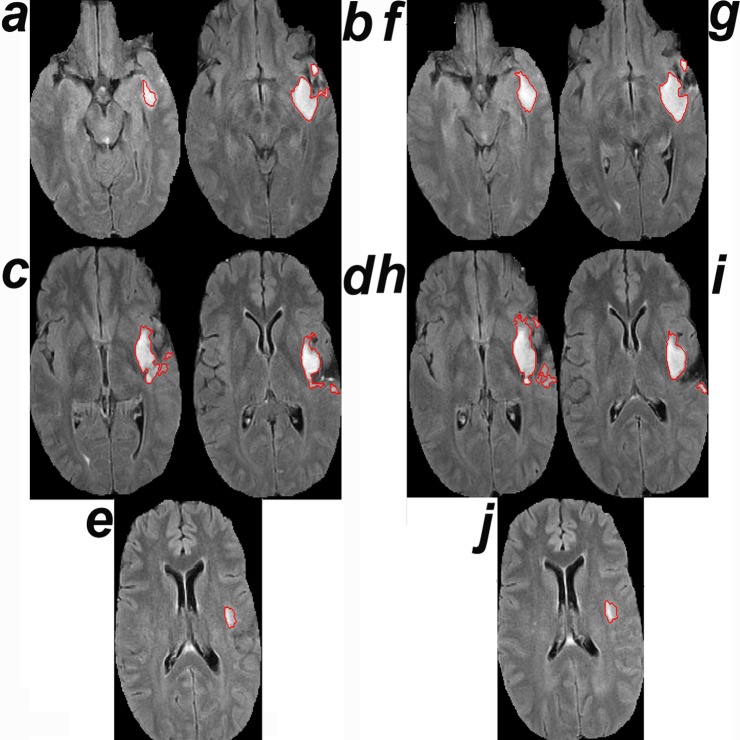
Fig. 4.Crescita lontano dalla sezione tumorale più grande.(a-e) Risonanza magnetica del tumore 4385 (vedi dati S1 e S2) al tempo 0. (f-j) Risonanza magnetica nel punto temporale di rilevazione della crescita tramite CAD. Le aree superficiali dei segmenti tumorali in (a-j) sono rispettivamente di 268, 1.174, 1.240, 962, 246, 718, 1.262, 1.764, 994 e 282 pixel2. Il tumore mostra una crescita percentuale maggiore rispetto alla linea di base nella terza dimensione (confrontare a e f: 268 e 718) rispetto alla sezione che contiene la componente tumorale più grande alla linea di base (confrontare c e h: 1.240 e 1.764). La seconda risonanza magnetica è stata ritenuta stabile dal confronto visivo.

Fig. 4.Crescita lontano dalla sezione tumorale più grande.(a-e) Risonanza magnetica del tumore 4385 (vedi dati S1 e S2) al tempo 0. (f-j) Risonanza magnetica nel punto temporale di rilevazione della crescita tramite CAD. Le aree superficiali dei segmenti tumorali in (a-j) sono rispettivamente di 268, 1.174, 1.240, 962, 246, 718, 1.262, 1.764, 994 e 282 pixel2. Il tumore mostra una crescita percentuale maggiore rispetto alla linea di base nella terza dimensione (confrontare a e f: 268 e 718) rispetto alla sezione che contiene la componente tumorale più grande alla linea di base (confrontare c e h: 1.240 e 1.764). La seconda risonanza magnetica è stata ritenuta stabile dal confronto visivo.
Discussione
Il confronto visivo degli studi radiologici longitudinali è ampiamente utilizzato in oncologia. In tutti i casi, i medici esaminano la tomografia computerizzata 2D o le immagini a risonanza magnetica per diagnosticare oggetti a 4 dimensioni, cioè un cambiamento di volume nel tempo. Qui, abbiamo esaminato 165 gliomi e analizzato i dati di un totale di 63 pazienti, comprese 627 scansioni di risonanza magnetica; inaspettatamente, abbiamo trovato grandi differenze nel rilevamento della crescita per confronto visivo e da parte dei medici aiutati dal metodo CAD. Poiché i gliomi di basso grado sono seguiti per diversi anni, i medici hanno il compito di confrontare la risonanza magnetica attuale con tutti gli studi precedenti. Le ragioni per la mancata crescita attraverso l’ispezione visiva includono (1) il gran numero di studi precedenti, che richiedono un tempo molto lungo per l’interpretazione delle immagini, (2) la pratica attuale di confrontare la risonanza magnetica attuale con un paio di scansioni di risonanza magnetica immediatamente precedenti, (3) la mancanza di determinazione della risonanza magnetica di base, (4) piccoli cambiamenti da uno studio all’altro che si sommano nel tempo, (5) che confrontando singole immagini bidimensionali manca la crescita nella terza dimensione (Fig 4), cioè, in sezioni lontane per la componente tumorale più grande (ad esempio, casi 4384, 4385, 6936, 7492, 7505, e 7736 in S1 Data), e (6) che il volume di base sembra essere un fattore per rilevare la crescita per confronto visivo; ad esempio, il tumore nella Fig 2C (caso 7504), il cui volume di base è il 42% di quello del tumore nella Fig 2B (caso 7490), è stato ritenuto stabile dopo essere cresciuto di 6 volte, mentre la crescita del tumore nella Fig 2B è stata rilevata dopo essere cresciuto solo di 2 volte.
L’analisi retrospettiva dei rapporti radiologici di questo studio fornisce una visione inalterata del panorama dell’imaging diagnostico dei gliomi in un centro di tumori cerebrali terziari. Nell’analisi delle misurazioni longitudinali dei volumi tumorali, il problema riguarda sia l’individuazione di un cambiamento del volume tumorale sia l’identificazione del momento di tale cambiamento. Queste domande vengono affrontate combinando la segmentazione del tumore con l’analisi del cambiamento di punto. Recentemente sono stati sviluppati diversi metodi di segmentazione, tra cui la visione computerizzata [3]. Il CAD migliora il rilevamento della crescita dei gliomi di grado 2, contornando i margini tumorali e generando un segnale che dirige l’attenzione del medico verso un cambiamento di punto (Fig 3). Il metodo utilizzato in questo lavoro è semiautomatico, cioè il contorno finale del tumore richiede l’approvazione umana. Questo metodo è stato classificato tra i primi 3 algoritmi, statisticamente equivalente con altri 2 algoritmi concorrenti nella sfida di BraTS 2016 [27]. Il nostro metodo di segmentazione si differenzia dagli algoritmi di apprendimento profondo in quanto non richiede la formazione offline di una biblioteca di immagini di riferimento. Il metodo del cambio di punto online è un metodo statistico adatto per simulare la visita in clinica, poiché considera solo le misurazioni passate in ogni punto temporale. È più adatto del metodo a soglia fissa perché gestisce tutti i tipi di dati ordinati nel tempo, compresi i dati provenienti da distribuzioni non normali e i dati con valori erratici [23,24]. Per escludere i cambiamenti causati dall’intervento chirurgico, la risonanza magnetica di base viene presa come quella che corrisponde al primo volume minimo dopo la resezione.
L’analisi delle 117 misurazioni delle 16 curve di crescita vero-negative, cioè stabili con il CAD e confermate dalla revisione di un medico esperto, produce una variazione percentuale di volume media e di deviazione standard dello 0,99% e del 26,54%, rispettivamente (le curve per 2 di questi casi sono mostrate nella Fig 2E e 2F). Le immagini FLAIR hanno una qualità variabile; tuttavia, le immagini di qualità inferiore hanno più probabilità di produrre una sottostima rispetto alla sovrastima della crescita tumorale, perché la CAD utilizza un approccio “medico nel ciclo” in cui un medico deve esaminare e confermare sia i risultati della segmentazione che la determinazione della crescita. Poiché il medico revisore elimina le segmentazioni e i valori erratici falsi positivi, riteniamo che nei casi in cui i volumi consecutivi mostrano una grande variazione, la misurazione più alta è più accurata rispetto al volume più basso. L’obiettivo principale del metodo CAD qui impiegato è quello di puntare l’attenzione verso un potenziale evento di crescita; il medico ha la responsabilità finale di confermare o meno. Noi sosteniamo che ridurre al minimo i falsi negativi (anche a costo di potenziali falsi positivi) è prudente e nell’interesse dei pazienti. Per esempio, se consideriamo un caso simile a quello mostrato nella Fig 2A, è possibile che un medico non confermi il primo segnale di crescita. Tuttavia, i numerosi e continui allarmi a partire dal mese 19 renderebbero auspicabile l’impossibilità di far crescere il tumore senza controllo fino al mese 80. Non abbiamo riscontrato falsi segnali positivi nei nostri set di dati, in quanto i medici esaminatori si sono sempre trovati d’accordo con il rilevamento del cambiamento di punto (S1 Data). Tuttavia, se i falsi positivi approvati dai medici sono frequenti, si potrebbe aumentare la severità del metodo del cambio di punto variando la soglia o considerando il secondo o il terzo cambio di punto.
Le valutazioni dei tumori in 2D e 3D differiscono per quanto riguarda la grandezza. Questo studio ha valutato e confrontato i volumi longitudinali dei gliomi di basso grado. Negli studi clinici, la progressione del tumore è attualmente valutata studiando le sezioni 2D del cervello che includono la componente più grande del tumore; la progressione è determinata quando il prodotto di 2 linee perpendicolari aumenta del 25%. Ad esempio, un aumento del 12% in ciascuna delle 2 dimensioni genera un aumento del 25% del prodotto in 2D (1,122 = 1,25). Moltiplicando per un aumento di terza dimensione del 12% si ottiene un aumento del volume del 41% (1,123 = 1,41). Analogamente, aumenti del 20% e del 25% in ogni dimensione producono rispettivamente un aumento del 73% e del 95% del volume. Al contrario, un aumento del 300% del volume può essere generato da un aumento del 44% in ogni dimensione (1,443 = 3).
Le tabelle di crescita numerica suggeriscono che i gliomi a basso grado possono essere distinti non solo per la loro diagnosi patologica ma anche per il loro tasso di crescita (Fig 2). Per esempio, il tumore mostrato nella Fig 2A è cresciuto ad un tasso più veloce rispetto ai tumori mostrati nella Fig 2B-2D. L’analisi volumetrica permette di calcolare il tasso di crescita dei gliomi a basso grado nel tempo, che può rivelarsi un marker biologico che può migliorare la classificazione dei tumori e guidare la terapia.
Sebbene lo studio attuale dimostri l’utilità del CAD nell’aiutare i medici a rilevare la crescita dei gliomi di grado 2 dopo l’osservazione iniziale, è probabile che sia necessario un lavoro aggiuntivo per sviluppare modelli di progressione dopo alcune terapie. Sebbene nessuno dei pazienti di questo studio abbia ricevuto radioterapia, la radioterapia e l’immunoterapia possono essere associate a un nuovo segnale FLAIR che non rappresenta la crescita tumorale.
Il principale limite di questo studio è stato il suo disegno retrospettivo, poiché il punto temporale di rilevazione della crescita tumorale è stato determinato dalla revisione retrospettiva dei referti radiologici. I risultati indicano inequivocabilmente le carenze dello stato attuale della pratica clinica che hanno permesso un aumento significativo dei volumi tumorali dalla linea di base prima che la crescita fosse rilevata. A causa di considerazioni etiche, queste grandi dimensioni di crescita tumorale non sarebbero consentite in un progetto prospettico, in quanto i coordinatori dovrebbero affrontare i segnali di crescita generati dal CAD. Un altro limite è stato il fatto che i medici che hanno convalidato i risultati volumetrici non hanno esaminato tutte le scansioni di risonanza magnetica longitudinale in assenza di segmentazione: Hanno visionato i volumi e le immagini segmentate della linea di base e delle ultime scansioni di risonanza magnetica e la risonanza magnetica ritenuta con crescita tumorale da CAD (se presente); è stata offerta loro la possibilità di visualizzare ulteriori immagini segmentate, se lo desideravano. La ragione di questo progetto è che il tempo necessario per esaminare 627 scansioni MRI è sia significativo che proibitivo; per lo stesso motivo, i medici attualmente confrontano l’attuale RM corrente con un paio di scansioni MRI immediatamente precedenti. Il numero di pazienti affetti da glioma (n = 56) è un limite; tuttavia, è equivalente al numero di pazienti in studi clinici di fase II. Un altro limite è il fatto che tutti i pazienti erano adulti; abbiamo in programma di studiare i pazienti pediatrici in futuro.
È evidente che i dati volumetrici del metodo CAD aiutano i medici a rilevare la crescita dei gliomi di basso grado in modo significativamente più precoce rispetto all’attuale pratica gold standard del confronto visivo (Tabelle 2 e 3). Tuttavia, questo studio non affronta la questione se trattare o meno e quale sia la modalità di trattamento ottimale. Ciononostante, la diagnosi precoce pone le basi per i futuri studi clinici per affrontare queste domande e per stabilire se gli interventi terapeutici precoci prolungano la sopravvivenza e migliorano la qualità della vita. In generale, la diagnosi precoce della crescita e la diagnosi a volumi tumorali più piccoli sono auspicabili perché è dimostrato che i tumori più piccoli sono associati a campi di radiazione più piccoli, a resezioni chirurgiche ottimali (vedi Fig 3D-3F) e a una sopravvivenza più lunga con meno morbilità neurologica [8- 14,19,20]. Suggeriamo di studiare interventi precoci per i casi in cui (1) la nuova crescita è in prossimità di strutture chiave non chirurgiche come il corpo calloso, (2) il tasso di crescita è elevato, o (3) il tumore è sensibile alla chemioterapia.
Poiché i gliomi a basso grado crescono a tassi variabili ma lenti, i medici devono confrontare un gran numero di immagini longitudinali che coprono diversi mesi o anni per rilevare la crescita, portando a ritardi significativi nel rilevamento dell’allargamento del tumore. I contorni del tumore prontamente disponibili generati dal computer, combinati con i dati volumetrici longitudinali e l’identificazione di un cambiamento statisticamente significativo del punto, aiutano una diagnosi rapida dell’ingrandimento tumorale. In questo modo, il CAD potrebbe evitare ritardi imprevedibili e migliorare la determinazione dell’efficacia di nuovi interventi terapeutici. Inoltre, la diagnosi precoce della crescita ha il potenziale di abbassare la morbilità, e forse la mortalità, dei pazienti con gliomi di basso grado, una possibilità che deve essere testata in studi prospettici.
Informazioni di supporto
References
- Rasmussen BK, Hansen S, Laursen RJ, Kosteljanetz M, Schultz H, Norgard BM. Epidemiology of glioma: clinical characteristics, symptoms, and predictors of glioma patients grade I-IV in the the Danish Neuro-Oncology Registry. J Neurooncol. 2017; 135(3):571-9. DOI | PubMed
- Berntsson SG, Merrell RT, Amirian ES, Armstrong GN, Lachance D, Smits A. Glioma-related seizures in relation to histopathological subtypes: a report from the glioma international case-control study. J Neurol. 2018; 265(6):1432-42. DOI | PubMed
- Crimi A, Menze B, Maier O, Reyes M, Winzeck S, Handels H. Lecture Notes in Computer Science. Springer International Publishing: Cham (Switzerland); 2016.
- Bynevelt M, Britton J, Seymour H, MacSweeney E, Thomas N, Sandhu K. FLAIR imaging in the follow-up of low-grade gliomas: time to dispense with the dual-echo?. Neuroradiology. 2001; 43(2):129-33. PubMed
- Delgado-Lopez PD, Corrales-Garcia EM, Martino J, Lastra-Aras E, Duenas-Polo MT. Diffuse low-grade glioma: a review on the new molecular classification, natural history and current management strategies. Clin Transl Oncol. 2017; 19(8):931-44. DOI | PubMed
- Buckner J, Giannini C, Eckel-Passow J, Lachance D, Parney I, Laack N. Management of diffuse low-grade gliomas in adults—use of molecular diagnostics. Nat Rev Neurol. 2017; 13(6):340-51. DOI | PubMed
- Le Rhun E, Taillibert S, Chamberlain MC. Current management of adult diffuse infiltrative low grade gliomas. Curr Neurol Neurosci Rep. 2016; 16(2):15. DOI | PubMed
- Claus EB, Horlacher A, Hsu L, Schwartz RB, Dello-Iacono D, Talos F. Survival rates in patients with low-grade glioma after intraoperative magnetic resonance image guidance. Cancer. 2005; 103(6):1227-33. DOI | PubMed
- Johannesen TB, Langmark F, Lote K. Progress in long-term survival in adult patients with supratentorial low-grade gliomas: a population-based study of 993 patients in whom tumors were diagnosed between 1970 and 1993. J Neurosurg. 2003; 99(5):854-62. DOI | PubMed
- McGirt MJ, Chaichana KL, Gathinji M, Attenello FJ, Than K, Olivi A. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. J Neurosurg. 2009; 110(1):156-62. DOI | PubMed
- Nakamura M, Konishi N, Tsunoda S, Nakase H, Tsuzuki T, Aoki H. Analysis of prognostic and survival factors related to treatment of low-grade astrocytomas in adults. Oncology. 2000; 58(2):108-16. DOI | PubMed
- Ahmadi R, Dictus C, Hartmann C, Zurn O, Edler L, Hartmann M. Long-term outcome and survival of surgically treated supratentorial low-grade glioma in adult patients. Acta Neurochir (Wien). 2009; 151(11):1359-65. DOI | PubMed
- Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008; 26(8):1338-45. DOI | PubMed
- Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery. 2008; 62(4):753-64. DOI | PubMed
- Surma-aho O, Niemela M, Vilkki J, Kouri M, Brander A, Salonen O. Adverse long-term effects of brain radiotherapy in adult low-grade glioma patients. Neurology. 2001; 56(10):1285-90. PubMed
- Ek L, Kristoffersen Wiberg M, Vestberg S. Decline in executive functions and speed in suspected low-grade gliomas: a 3-year follow-up of a clinical cohort. Appl Neuropsychol Adult. 2018; 25(4):376-84. DOI | PubMed
- Reijneveld JC, Taphoorn MJ, Coens C, Bromberg JE, Mason WP, Hoang-Xuan K. Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033–26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2016; 17(11):1533-42. DOI | PubMed
- Scribner E, Hackney JR, Machemehl HC, Afiouni R, Patel KR, Fathallah-Shaykh HM. Key rates for the grades and transformation ability of glioma: model simulations and clinical cases. J Neurooncol. 2017; 133(2):377-88. DOI | PubMed
- Baumert BG, Hegi ME, van den Bent MJ, von Deimling A, Gorlia T, Hoang-Xuan K. Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033–26033): a randomised, open-label, phase 3 intergroup study. Lancet Oncol. 2016; 17(11):1521-32. DOI | PubMed
- Jhaveri J, Liu Y, Chowdhary M, Buchwald ZS, Gillespie TW, Olson JJ. Is less more? Comparing chemotherapy alone with chemotherapy and radiation for high-risk grade 2 glioma: an analysis of the National Cancer Data Base. Cancer. 2018; 124(6):1169-78. DOI | PubMed
- Wang S, Zhang Y, Zhan T, Phillips P, Zhang Y-D, Liu G. Pathological brain detection by artificial intelligence in magnetic resonance imaging scanning. Prog Electromagn Res. 2016; 156:105-33. DOI
- Dera D, Bouaynaya N, Fathallah-Shaykh HM. Automated robust image segmentation: level set method using nonnegative matrix factorization with application to brain MRI. Bull Math Biol. 2016; 78(7):1450-76. DOI | PubMed
- Brodsky E, Darkhovsky BS. Nonparametric methods in change-point problems. Springer: New York; 1993.
- Killick R, Fearnhead P, Eckley IA. Optimal detection of changepoints with a linear computational cost. J Am Stat Assoc. 2012; 107(500):1590-8.
- Kerkhof M, Hagenbeek RE, van der Kallen BF, Lycklama ANGJ, Dirven L, Taphoorn MJ. Interobserver variability in the radiological assessment of magnetic resonance imaging (MRI) including perfusion MRI in glioblastoma multiforme. Eur J Neurol. 2016; 23(10):1528-33. DOI | PubMed
- Dera D, Raman F, Bouaynaya N, Fathallah-Shaykh HM, Crimi A, Menze B, Maier O, Reyes M, Winzeck S, Handels H. Brainlesion: glioma, multiple sclerosis, stroke and traumatic brain injuries. Lecture Notes in Computer Science. Springer International Publishing: Cham (Switzerland); 2016.
- Bakas S, Reyes M, Jakab A, Bauer S, Rempfler M, Crimi A, et al. Identifying the best machine learning algorithms for brain tumor segmentation, progression assessment, and overall survival prediction in the BRATS Challenge. arXiv:1811.02629v2. 2019 Mar 19.
- Scribner E, Saut O, Province P, Bag A, Colin T, Fathallah-Shaykh HM. Effects of anti-angiogenesis on glioblastoma growth and migration: model to clinical predictions. PLoS ONE. 2014; 9(12):e115018. DOI | PubMed
- Raman F, Scribner E, Saut O, Wenger C, Colin T, Fathallah-Shaykh HM. Computational trials: unraveling motility phenotypes, progression patterns, and treatment options for glioblastoma multiforme. PLoS ONE. 2016; 11(1):e0146617. DOI | PubMed
Fonte
Fathallah-Shaykh HM, DeAtkine A, Coffee E, Khayat E, Bag AK, et al. (2019) Diagnosing growth in low-grade gliomas with and without longitudinal volume measurements: A retrospective observational study. PLoS Medicine 16(5): e1002810. https://doi.org/10.1371/journal.pmed.1002810





