Abstract
Sono tempi duri per il diavolo della Tasmania, il più grande marsupiale carnivoro della natura. Negli ultimi due decenni, una forma contagiosa di cancro chiamata malattia del tumore del viso del diavolo ha devastato il diavolo della Tasmania e potrebbe addirittura portarlo all’estinzione(McCallum e Jones, 2006).
I tumori non sono solitamente contagiosi, ma la malattia del tumore del viso del diavolo (DFTD) lo è, con le cellule tumorali che vengono passate tra i singoli diavoli, proprio come i virus o i batteri. La malattia si trasmette quando i diavoli si mordono tra loro durante le dispute territoriali o i corteggiamenti, rendendoli più suscettibili man mano che raggiungono la maturità sessuale. Una volta che i tumori sono evidenti, l’aspettativa di vita di un diavolo è inferiore ai sei mesi(Hawkins et al., 2006). Una conseguenza del DFTD è che i diavoli raggiungono la maturità sessuale in età più giovane, a dimostrazione della forte pressione selettiva che la malattia sta esercitando su questa specie(Jones et al., 2008).
Finora sono stati trovati tumori trasmissibili solo in poche specie oltre al diavolo della Tasmania – in particolare cani e vongole a guscio morbido (Metzgeret al., 2015; Murgia et al., 2006). Il DFTD è notevole in quanto due tumori – apparentemente indipendenti – sono comparsi nelle popolazioni di diavoli selvatici in un periodo di tempo relativamente breve. I diavoli della Tasmania con tumori e lesioni al volto causate dalla DFT1 altamente contagiosa sono stati avvistati per la prima volta nel 1996(Hawkins et al., 2006); la DFT2, che si pensa sia meno patogena, è stata scoperta nel 2014(Pye et al., 2016).
Un cancro trasmissibile in una specie può essere sfortunato, ma due suggeriscono che ci sia qualcosa di più. Ora, in eLife, Hannah Siddle e colleghi – tra cui Alison Caldwell come primo autore – riferiscono che la DFT2 potrebbe essere una tattica evolutiva per eludere il sistema immunitario simile a quella usata dalla DFT1 (Caldwellet al., 2018).
La capacità di distinguere il sé da molecole diverse dal sé è al centro dell’immunologia, e i meccanismi sottostanti sono generalmente ben stabiliti. Nel sistema immunitario dei vertebrati, un gruppo di geni chiamato complesso maggiore di istocompatibilità (MHC) permette all’organismo di riconoscere e distruggere i tessuti anomali (come i tessuti infetti o tumorali) e i tessuti estranei (come i trapianti d’organo; vedi Schwartz, 1985 per una revisione).
Un gruppo di geni MHC, la classe I (MHC-I), codifica le molecole che svolgono un ruolo importante in questo processo. La maggior parte delle cellule mostra molecole di MHC-I sulla loro superficie, e queste molecole presentano peptidi che rivelano se la cellula è sé stessa o no: se viene rilevato un peptide che indica un sé mutato di una cellula patogena, un tipo specifico di cellula immunitaria, chiamata cellula T citotossica, viene allertato e inviato per distruggere la cellula.
Tuttavia, le cellule tumorali o le cellule infettate da un virus, spesso sfuggono alla morte per mano di queste cellule T perdendo le loro molecole di MHC-I, che è uno dei meccanismi impiegati dal DFT1(Siddle et al., 2013). Di conseguenza, quando l’espressione di MHC-I si riduce o si perde, le cellule T non sono in grado di vedere il tumore o la cellula infetta. Studiando le cellule tumorali DFT2 prelevate da biopsie o coltivate in laboratorio, Caldwell et al. – che hanno sede presso le università di Southampton, Tasmania, Cambridge e della Danimarca meridionale – hanno scoperto che DFT2 sembra utilizzare una tattica simile (Figura 1). Mentre ha ancora MHC-Is, il DFT2 sembra evolvere lentamente per esprimerne meno sulla sua superficie – diventando potenzialmente contagioso come il DFT1.
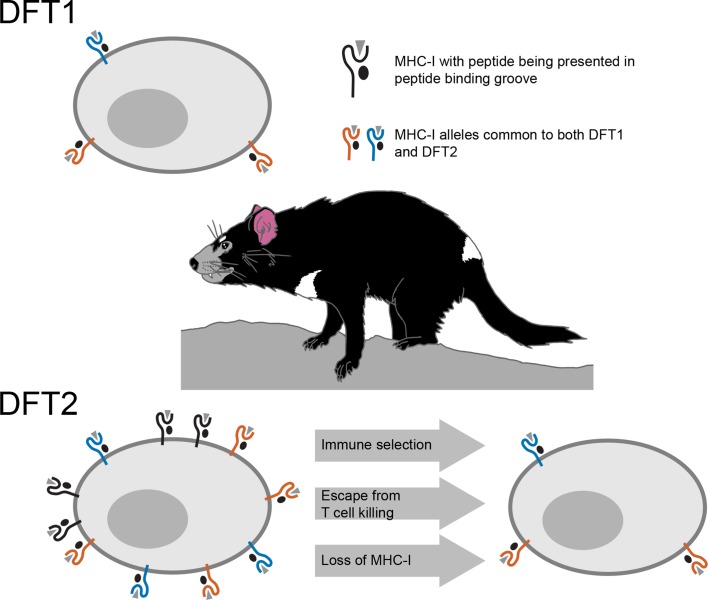
Figura 1.Schema che illustra i meccanismi alla base della malattia del tumore facciale del diavolo.Il sistema immunitario identifica le cellule che non dovrebbero essere in un organismo basato su peptidi estranei o anormali (triangoli grigi) presentati nel solco di legame delle molecole di MHC-I sulla superficie della cellula. Le cellule DFT1 (in alto) evitano il sistema immunitario del diavolo della Tasmania perdendo l’espressione delle loro molecole di MHC-I (arancione e blu). Le cellule DFT2 (in basso a sinistra) sembrano sviluppare un trucco simile, ma esprimono ancora un certo numero di molecole di MHC-I (mostrate in nero) che possono essere riconosciute dal sistema immunitario. Tuttavia, Caldwell et al. hanno scoperto che le cellule DFT2 iniziano a perdere le molecole di MHC-I (in basso a destra), il che suggerisce che questa forma di tumore potrebbe presto diventare patogena come DFT1. DFT1 e DFT2 sembrano anche condividere gli alleli genetici dei geni MHC-I (arancione e blu), suggerendo che ci può essere qualcosa su queste varianti associate con l’emergere di un tumore contagioso.
Di solito, l’MHC differisce tra gli individui di una specie a causa di una variazione genetica. Le molecole di MHC codificate da diverse varianti geniche si legano e presentano diversi insiemi di peptidi. Questo aumenta la capacità di uccidere le cellule T, fornendo una diversità di peptidi per le cellule T da riconoscere e contro cui rispondere. Questo contribuisce anche alla necessità di corrispondenze genetiche tra un donatore di organi e un ricevente. Le molecole MHC-I del DFT2, tuttavia, sono geneticamente simili tra le popolazioni diaboliche della Tasmania, e sono quindi meno suscettibili di essere viste come estranee dalle cellule T. Caldwell et al. hanno scoperto che il DFT1 e il DFT2 condividono i geni MHC-I, suggerendo che qualcosa in queste particolari varianti può essere favorevole ad evitare il sistema immunitario del diavolo.
La comparsa del DFT2 fornisce nuove intuizioni sulla precoce evoluzione dei tumori trasmissibili. Tuttavia, molte domande persistono. Resta da vedere se questi tumori sono più comuni in natura di quanto si supponga. Se erano davvero così rari, perché si sono manifestati due volte nella stessa specie? Le caratteristiche specifiche del loro sistema immunitario o del loro ambiente (perdita dell’ambiente) potrebbero rendere il diavolo della Tasmania più suscettibile all’insorgenza di tumori trasmissibili?
Tuttavia, un numero crescente di specie animali sta sperimentando sia una riduzione del numero (e, quindi, una riduzione della diversità genetica) sia una perdita di habitat naturali. Se l’insorgenza di tumori trasmissibili è dettata da un insieme di regole piuttosto che dalla semplice sfortuna, potremmo scoprire più casi di tumori contagiosi che sfruttano i comuni alleli MHC-I. I diavoli della Tasmania e altre specie in via di estinzione possono essere particolarmente vulnerabili ai tumori che sfruttano le anse del sistema immunitario.
References
- Caldwell A, Coleby R, Tovar C, Stammnitz MR, Kwon YM, Tringides M, Murchison EP, Skjødt K, Thomas GJ, Elliot T, Woods G, Siddle HV. The newly-arisen Devil facial tumour disease 2 (DFT2) reveals a mechanism for the emergence of a contagious cancer. eLife. 2018; 7DOI
- Hawkins CE, Baars C, Hesterman H, Hocking GJ, Jones ME, Lazenby B, Mann D, Mooney N, Pemberton D, Pyecroft S, Restani M, Wiersma J. Emerging disease and population decline of an island endemic, the Tasmanian devil Sarcophilus harrisii. Biological Conservation. 2006; 131:307-324. DOI
- Jones ME, Cockburn A, Hamede R, Hawkins C, Hesterman H, Lachish S, Mann D, McCallum H, Pemberton D. Life-history change in disease-ravaged tasmanian devil populations. PNAS. 2008; 105:10023-10027. DOI | PubMed
- McCallum H, Jones M. To lose both would look like carelessness: Tasmanian devil facial tumour disease. PLoS Biology. 2006; 4DOI | PubMed
- Metzger MJ, Reinisch C, Sherry J, Goff SP. Horizontal transmission of clonal cancer cells causes leukemia in soft-shell clams. Cell. 2015; 161:255-263. DOI | PubMed
- Murgia C, Pritchard JK, Kim SY, Fassati A, Weiss RA. Clonal origin and evolution of a transmissible cancer. Cell. 2006; 126:477-487. DOI | PubMed
- Pye RJ, Pemberton D, Tovar C, Tubio JM, Dun KA, Fox S, Darby J, Hayes D, Knowles GW, Kreiss A, Siddle HV, Swift K, Lyons AB, Murchison EP, Woods GM. A second transmissible cancer in tasmanian devils. PNAS. 2016; 113:374-379. DOI | PubMed
- Schwartz RH. T-lymphocyte recognition of antigen in association with gene products of the major histocompatibility complex. Annual Review of Immunology. 1985; 3:237-261. DOI | PubMed
- Siddle HV, Kreiss A, Tovar C, Yuen CK, Cheng Y, Belov K, Swift K, Pearse AM, Hamede R, Jones ME, Skjødt K, Woods GM, Kaufman J. Reversible epigenetic down-regulation of MHC molecules by devil facial tumour disease illustrates immune escape by a contagious cancer. PNAS. 2013; 110:5103-5108. DOI | PubMed
Fonte
Hansen VL, Miller RD () A ‘devil’ of a problem. eLife 7e39976. https://doi.org/10.7554/eLife.39976





