Abstract
Introduzione
Sebbene la nozione di un legame tra salute mentale e salute fisica sia stata avanzata per la prima volta secoli fa,1 la scoperta delle cause patogene di molte malattie ha portato ad un lungo periodo di quiescenza in questo campo. Negli ultimi decenni, la maggior parte delle ricerche è stata condotta nel contesto delle malattie cardiovascolari, con prove crescenti che implicano i fattori psicologici dello stress psicosociale,2 la funzione cognitiva,3 e tipi di personalità selezionati (in particolare il nevroticismo e la coscienza)4 come potenzialmente in grado di avere ruoli in vari stadi del processo di malattia, tra cui l’agire come fattori predittivi, marcatori di patologia non diagnosticata, inneschi di eventi clinici in individui con malattia subclinica, o una conseguenza della malattia somatica diagnosticata.5
È stata esplorata anche la capacità predittiva di un ulteriore fattore psicologico – il disagio psicologico (sintomi di depressione e ansia) – nello sviluppo delle malattie cardiovascolari, con meta-analisi che mostrano relazioni positive con il rischio di malattie coronariche6 e ictus.78 Come le malattie cardiovascolari, il cancro è una delle principali cause di morte e dimorbilità9 , ma pochi studi hanno esaminato i suoi legami con l’angoscia. Vari meccanismi sono stati implicati nel collegare il disagio psicologico con il cancro. L’esposizione ricorrente al disagio emotivo potrebbe diminuire la funzione delle cellule killer naturali, che è stata implicata nel controllo delle cellule tumorali.10 Di particolare rilevanza per i tumori ormonali è il suggerimento che i sintomi della depressione potrebbero portare a una disregolazione dell’asse ipotalamico dell’ipofisi surrenale (HPA), aumentare le concentrazioni di cortisolo e le risposte immunologiche e infiammatorie, e inibire la riparazione del DNA, con un impatto negativo sui processi di difesa del cancro.11 Poiché ci sono anche prove che, rispetto alle loro controparti non distorte, le persone con sintomi di angoscia hanno maggiori probabilità di fumare, essere sedentarie, avere una dieta sfavorevole e diventare obese, l’angoscia potrebbe anche aumentare la probabilità di cancro indirettamente attraverso questi fattori di rischio legati allo stile di vita.12
I pochi studi di coorte prospettici esistenti, che forniscono il miglior test di un’associazione in epidemiologia osservazionale, sono generalmente di piccole dimensioni e mostrano risultati altamente discordanti con associazioni positive, nulle e persino inverse tra angoscia e cancro segnalati.13 Altre importanti lacune nella comprensione includono la misura in cui le associazioni potrebbero dipendere dalla sede – poiché il cancro non è un’entità singola della malattia – e se un eventuale gradiente apparente potrebbe essere generato da una causalità inversa, cioè l’angoscia potrebbe essere una conseguenza delle fasi iniziali della malignità piuttosto che un potenziale predittore. È anche il caso che alcuni studi non sono sufficientemente ben caratterizzati per esplorare spiegazioni alternative per le associazioni osservate, tra cui la confusione per i comportamenti di salute, lo stato socioeconomico e l’infiammazione sistemica.
In considerazione dei limiti della base di prove esistenti, abbiamo messo in comune i dati non pubblicati dei singoli partecipanti di 16 studi di coorte prospettici basati sulla comunità che hanno utilizzato gli stessi metodi per accertare il disagio psicologico, le covariate e il cancro. In contrasto con la più comune tecnica meta-analitica a livello distudio13 , l’uso di dati grezzi non pubblicati in una serie di studi fornisce stime più precise delle associazioni tra marcatori di rischio e malattia definiti in modo uniforme; un approccio coerente al controllo statistico per le covariate plausibili e le analisi dei sottogruppi; e un metodo che ha meno probabilità di soffrire di pregiudizi di pubblicazione, che si ripercuotono sull’epidemiologia moderna. Mentre la meta-analisi dei singoli partecipanti è stata ampiamente applicata allo studio del ruolo dei fattori fisiologici per il rischio di malattia,1415al meglio delle nostre conoscenze, questa è la prima raccolta dei dati dei singoli partecipanti sul disagio psicologico, in contrapposizione alla depressione maggiore,13 e al rischio di specifici tumori maligni. In considerazione di alcuni dei meccanismi descritti che potenzialmente collegano il disagio a tumori maligni selezionati, abbiamo ipotizzato associazioni positive tra disagio e cancro per i tumori legati agli ormoni (seno, prostata, ovaia) e allo stile di vita (polmone, colorettale, pancreas, esofago, stomaco).
Metodi
I partecipanti sono stati presi dal sondaggio sanitario per l’Inghilterra (HSE)16 e dai sondaggi sanitari scozzesi (SHS)17 , una serie di esami sanitari geograficamente rappresentativi di persone appartenenti alla popolazione generale. Tra il 1994 e il 2008, sono stati condotti 16 studi indipendenti, trasversali e metodologicamente quasi identici, su base annuale (HSE; n=13) o occasionale (SHS; n=3). Lo scopo originale di questi studi era quello di monitorare le tendenze secolari della salute e dei comportamenti correlati. Un totale di 199-504 uomini e donne, di età compresa tra i 16 e i 107 anni, sono stati intervistati, con membri dello studio consenzienti collegati ai registri sanitari nazionali per lo stato vitale e, nel caso del solo SHS, l’incidenza del cancro.
Misurazione del disagio psicologico
Durante una visita domiciliare, gli intervistatori hanno somministrato moduli di intervista personale assistita dal computer che includevano la versione a 12 item del questionario generale sulla salute (GHQ-12).18 Una misura ampiamente utilizzata per misurare il disagio psicologico negli studi sulla popolazione, il GHQ-12 comprende elementi che catturano i sintomi della depressione e dell’ansia nelle quattro settimane precedenti. La risposta agli item si basa su una scala di 4 punti che segnala la presenza di un sintomo (“per niente”/”come al solito” sono stati dati un punteggio di 0; “più del solito”/”molto più del solito,” un punteggio di 1). Coerentemente con le nostre analisi precedenti,8192021abbiamo diviso le persone in quattro gruppi: asintomatici (punteggio 0), subclinicamente sintomatici (1-3), sintomatici (4-6) e altamente sintomatici (7-12). Il GHQ-12 è stato convalidato a fronte di colloqui psichiatrici standardizzati.22
23
Misurazione del cancro alla linea di base e dei dati covariata
Il cancro alla linea di base si basava sull’auto-rapporto (HSE), o auto-rapporto e registrazione del cancro (SHS). La validità dei dati di auto-rapporto del cancro è stata convalidata rispetto alle registrazioni standard dei registri dei tumori. Sebbene ci siano prove che l’aumento dell’età e la minore condizione socioeconomica sono associati a livelli di consenso più bassi,24 la capacità delle persone di riportare accuratamente una diagnosi di cancro del passato sembra essere sufficientemente alta per specifici siti tumorali di rilevanza per il nostro studio, come il seno, la prostata, il polmone e il colon.25 L’altezza e il peso sono stati misurati direttamente e l’indice di massa corporea (IMC) è stato calcolato. Un IMC di ≥30 è stato utilizzato per indicare l’obesità.26 Sono state riportate le seguenti caratteristiche: età al momento di lasciare la scuola a tempo pieno (l’età minima consentita per lasciare la scuola secondaria era di 12-16 anni a seconda dell’epoca), stato di fumo (non fumatore attuale; o <5, 5-10, 10-15, 15-20 e >20 sigarette al giorno), frequenza del consumo di alcolici (mai bevitore, ex bevitore, 1-2 bevande al mese, 1-4 bevande alla settimana, o ≥5 bevande alla settimana),1617eattività fisica (cinque o più occasioni di attività fisica da moderata a vigorosa alla settimana).
Altre covariate sono state raccolte solo in alcuni anni di indagine. La deprivazione socioeconomica basata sull’area è stata derivata collegando il codice postale del membro dello studio con l’indice di deprivazione multipla (HSE: 2001-6; SHS: 1995, 1998, 2003); la proteina C reattiva del siero, un marcatore di infiammazione sistemica, è stata misurata da campioni di sangue prelevati da un’infermiera durante una seconda visita a domicilio27 (HSE: 1998, 2003-6; SHS: 1998, 2003); l’attività fisica è stata autodenunciata (HSE: 1994, 1997-99, 2003, 2004, 2006, 2008; SHS: 1995, 1998, 2003)28; e dai dati sulla quantità di assunzione settimanale di alcol nelle indagini (HSE: 1994-95, 1997-98, 1999-2000, 2001; SHS: 2003)29 abbiamo classificato i membri dello studio in bevitori nocivi (>14 unità/settimana30).
Constatazione dei risultati: mortalità e incidenza del cancro
I membri dello studio erano collegati ai registri centrali del Servizio Sanitario Nazionale (NHS) di Southport e Dumfries, Regno Unito, le cui procedure forniscono lo stato vitale dei membri dello studio e, se del caso, le cause di morte, tra cui il cancro. I decessi per cancro sono stati indicati dal cancro registrato come la causa di morte sottostante sul certificato di morte (in contrapposizione alla causa contributiva). Le registrazioni dei tumori per la diagnosi di una malignità non mortale (incidenza) erano disponibili anche per i tre studi scozzesi attraverso il registro scozzese dei tumori. Tutti i tumori combinati sono stati indicati da ICD-9 (classificazione internazionale della malattia, nona edizione)31 codici 140-239, e ICD-1032 codici C00-D48. I singoli tumori maligni sono stati classificati come segue (ordinati con il codice ICD-9): esofago (codice ICD-9 150, codice ICD-10 C15), stomaco (codice ICD-9 151, codice ICD-10 C16), colorettale (codici ICD-9 153-154, codici ICD-10 C18-C20), fegato (codice ICD-9 155, ICD-10 codice C22), pancreas (ICD-9 codice 157, ICD-10 codice C25), polmone (ICD-9 codici 162, ICD-10 codici C34), mesotelioma (ICD-9 codici 163, ICD-10 codice C45), seno (femmina) (codice ICD-9 174, codice ICD-10 C50), ovaia (donne) (codice ICD-9 183, codice ICD-10 C56), prostata (uomini) (codice ICD-9 185, codice ICD-10 C61), vescica (codice ICD-9 188), ICD-10 codice C67), rene (codice ICD-9 189, codici ICD-10 C64 e C65), sistema nervoso centrale (codici ICD-9 191 e 192, codici ICD-10 C70-C72), non Hodgkin’.linfoma s (codici ICD-9 200 e 202, codici ICD-10 C82-C86), mieloma multiplo (codice ICD-9 203, codice ICD-10 C90.0), e leucemia (codici ICD-9 204-208, codici ICD-10 C91-C95). Una categoria di tumori legati al fumo si basava sulle prove attuali.33
34
Coinvolgimento del paziente
Nessun paziente è stato coinvolto nella definizione della presente domanda di ricerca o delle misure di esito, né è stato coinvolto nello sviluppo di piani per il reclutamento, la progettazione o l’attuazione dello studio. A nessun paziente è stato chiesto di dare consigli sull’interpretazione o di scrivere i risultati. Non ci sono piani per divulgare i risultati della ricerca ai partecipanti allo studio o alla comunità di pazienti interessata.
Analisi statistiche
Abbiamo usato dati grezzi per tutti gli anni di studio, ad eccezione del 1996 e del 2007, quando non è stata somministrata una scala di sofferenza psicologica. Nelle analisi preliminari, siamo stati in grado di determinare che l’ipotesi di pericolo proporzionale non era stata violata ispezionando le curve di sopravvivenza secondo le categorie di sofferenza. Non essendoci anche prove di un’interazione per sesso per l’associazione tra disagio psicologico e cancro (P=0,63), abbiamo messo in comune i dati per uomini e donne e abbiamo corretto le stime degli effetti per il sesso. Sono stati utilizzati modelli di pericolo proporzionali Cox35 per calcolare i rapporti di pericolo specifici dello studio con intervalli di confidenza del 95% per l’associazione tra angoscia e ogni risultato di mortalità per cancro. Come scala temporale abbiamo utilizzato l’ora del calendario (mesi), con i sopravvissuti che hanno una data di censura del 15 febbraio 2011. I rapporti di pericolo sono stati corretti al minimo (solo per età e sesso) e al massimo (età, sesso, IMC, livello di istruzione, livello di istruzione, condizione del fumo e frequenza del consumo di alcol). Nelle analisi principali, abbiamo omesso gli endpoint del cancro con un numero troppo basso di casi (<50) per fornire stime stabili degli effetti.
Le analisi di sottogruppo sono state condotte con dati disponibili solo in indagini selezionate. In questo caso, i rapporti di rischio corretti in base all’età e al sesso per l’associazione tra angoscia e cancro sono stati inoltre corretti per l’attivitàfisica36, la proteina reattiva C36, la privazione del livello di area37, la privazione del livello diarea38 e i livelli nocivi dell’assunzione di alcol39 , che a loro volta sono stati tutti collegati a selezionate neoplasie maligne presenti nelle presenti analisi. Abbiamo anche costruito modelli che utilizzano l’incidenza del cancro (solo per la SHS) per confrontarli con i risultati per il disagio e la mortalità in questo gruppo di studi.
Abbiamo usato la statistica I2 come misura del grado di incoerenza della stima dell’effetto (eterogeneità) tra gli studi (e i risultati del cancro). Sebbene le analisi preliminari abbiano mostrato che la statistica I2 tra gli studi variava tra lo 0% e il 38% a seconda dell’esito della mortalità per cancro oggetto di studio, abbiamo messo in comune le stime degli effetti specifici dello studio e i loro errori standard nelle meta-analisi degli effetti casuali per fornire stime conservative degli effetti. Tutte le analisi sono state calcolate con R versione 3.2.2, ad eccezione dell’imputazione dei dati, che è stata eseguita con SPSS (versione 22).
Risultati
Le tabelle 1 e 2 mostrano le caratteristiche dei membri dello studio secondo ciascuno dei 16 studi inclusi. La dimensione del campione di studio individuale variava da 7405 a 14 573 persone; non c’è stata alcuna differenza nel punteggio medio di sofferenza psicologica tra gli studi.
| 1994 | 1995 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2008 | Numero di partecipanti | |
| No di adulti indipendentemente dallo stato di consenso | 15 804 | 16 055 | 8582 | 15 908 | 13 947 | 11 025 | 15 647 | 10 331 | 14 836 | 12 758 | 10 303 | 14 142 | 15102 | 174 440 |
| Risposta della famiglia (%) | 77 | 78 | 76 | 74 | 76 | 75 | 74 | 74 | 73 | 72 | 74 | 68 | 64 | — |
| Consentito al collegamento della mortalità (%) | 95.6 | 93.7 | 93.9 | 94.6 | 90.1 | 71.9 | 88.4 | 88.9 | 87.3 | 75.7 | 80.6 | 82.6 | 78.2 | — |
| Incluso nel campione per l’analisi | 14 522 | 14 573 | 7654 | 14 157 | 11 441 | 7405 | 13 107 | 8717 | 12 217 | 8750 | 7649 | 11 277 | 11409 | 142 878 |
| Durata media (SD) del follow-up (anni) | 15.1 (3.8) | 14.3 (3.4) | 12.7 (2.7) | 11.8 (2.5) | 11.2 (1.8) | 9.4 (2.7) | 9.2 (1.5 | 8.4 (1.1) | 7.4 (1.0) | 6.4 (0.7) | 5.4 (0.8) | 4.5 (0.5) | 2.5 (0.3) | 142 878 |
| Morti di cancro | 687 | 727 | 297 | 529 | 244 | 258 | 336 | 144 | 211 | 75 | 129 | 85 | 40 | 142 878 |
| Età media (SD) alla linea di base (anni) | 45.6 (18.5) | 46.0 (18.4) | 45.8 (18.0) | 46.3 (18.3) | 43.5 (17.7) | 50.9 (20.7) | 46.9 (18.0) | 38.9 (19.3) | 47.2 (17.9) | 44.9 (17.5) | 53.9 (19.5) | 48.8 (18.0) | 48.4 (18.2) | 142 878 |
| Donne (%) | 54.1 | 54.1 | 53.8 | 54.6 | 53.8 | 55.7 | 54.5 | 55.7 | 55.2 | 56.0 | 54.9 | 54.9 | 55.2 | 142 878 |
| Punteggio medio (SD) del soccorso | 1.5 (2.6) | 1.6 (2.7) | 1.5 (2.6) | 1.5 (2.6) | 1.7 (2.7) | 1.5 (2.7) | 1.3 (2.4) | 1.6 (2.6) | 1.3 (2.5) | 1.4 (2.6) | 1.2 (2.4) | 1.3 (2.5) | 1.3 (2.6) | 142 878 |
| Punteggio di soccorso ≥7 (%) | 6.9 | 7.8 | 7.1 | 7.3 | 8.3 | 7.5 | 5.8 | 7.4 | 6.0 | 6.7 | 5.3 | 6.2 | 6.5 | 142 878 |
| Abbandono della scuola dopo l’età minima di abbandono (%) | 62.4 | 61.9 | 64.1 | 64.9 | 70.5 | 63.6 | 68.8 | 77.8 | 71.0 | 76.2 | 64.5 | 73.1 | 74.1 | 142 790 |
| Fumatore corrente (%) | 27.4 | 27.6 | 28.3 | 28.0 | 25.6 | 24.9 | 25.5 | 27.8 | 24.8 | 21.7 | 21.1 | 22.1 | 21.8 | 142444 |
| IMC medio (SD) | 25.9 (4.5) | 26.0 (4.5) | 26.3 (4.7) | 26.4 (4.7) | 26.1 (4.8) | 26.6 (4.8) | 26.9 (4.9) | 26.0 (5.0) | 26.9 (5.0) | 26.7 (5.0) | 27.2 (4.9) | 27.2 (5.1) | 27.2 (5.1) | 129 443 |
| Beve alcolici almeno una volta alla settimana | 62.6 | 64.6 | 66.0 | 65.9 | 52.2 | 61.6 | 65.7 | 64.9 | 65.4 | 50.5 | 62.9 | 61.4 | 60.6 | 126 022 |
| 1995 | 1998 | 2003 | Numero di partecipanti | |
| No di adulti indipendentemente dallo stato di consenso | 7932 | 9040 | 8092 | 25 064 |
| Risposta della famiglia | — | 77 | 67 | — |
| Consentito al collegamento della mortalità | 85.3 | 86.9 | 87.9 | — |
| Incluso nel campione analitico | 6484 | 7532 | 6469 | 20 485 |
| Durata media (SD) del follow-up (anni) | 13.8 (2.0) | 10.7 (1.8) | 5.7 (0.8) | 20 485 |
| Morti di cancro | 194 | 281 | 116 | 20 485 |
| Incidenza del cancro | 484 | 590 | 292 | 20 485 |
| Età media (SD) alla linea di base (anni) | 40.5 (13.2) | 45.3 (15.6) | 49.0 (17.3) | 20 485 |
| Donne (%) | 55.0 | 55.9 | 56.1 | 20 485 |
| Punteggio medio (SD) del soccorso | 1.7 (2.8) | 1.6 (2.8) | 1.4 (2.8) | 20 485 |
| Punteggio di soccorso ≥7 | 8.5 | 8.5 | 7.9 | 20 485 |
| Abbandono della scuola dopo l’età minima di abbandono (%) | 66.0 | 62.6 | 65.7 | 20 468 |
| Fumatore corrente (%) | 37.3 | 34.9 | 26.7 | 20 356 |
| IMC medio (SD) | 26.1 (4.6) | 26.7 (4.9) | 27.3 (5.1) | 18 379 |
| Beve alcolici almeno una volta alla settimana | 63.0 | 61.0 | 60.7 | 18 227 |
La Figura 1 mostra il flusso dei partecipanti dall’induzione dello studio fino al campione analitico. Circa il 18% (n=36-141) dei membri dello studio è stato escluso tra il reclutamento e le analisi, in gran parte a causa del rifiuto di essere collegato a registrazioni di morte o di cancro. Sono stati esclusi anche gli individui con una diagnosi di cancro al basale (n=3875). Ne è risultato un campione analitico massimo di 163-363 persone (55% donne, età media 46,3 anni (range 16-102)).
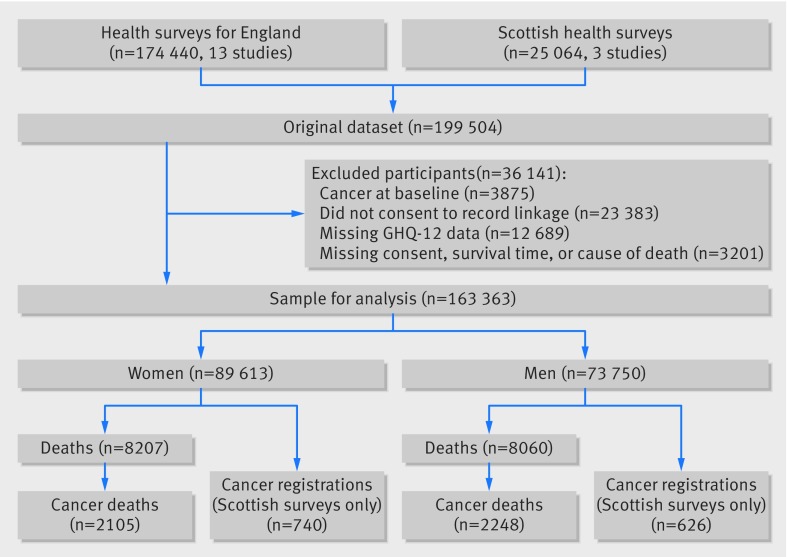
Fig. 1 Membri dello studio dall’induzione fino al campione per l’analisi: follow-up di 16 studi di coorte da indagine sanitaria per l’Inghilterra e indagine sanitaria scozzese (n=163-363). Le persone escluse possono rientrare in più di una categoria, quindi il totale supera il 36-141
La tabella 3 confronta le caratteristiche del campione analitico con i membri dello studio che erano stati esclusi. In generale, le differenze assolute erano piccole, anche se il significato a livelli convenzionali era comune a causa dell’alto numero di persone nelle analisi. Su questa base, sembravano esserci poche prove di distorsione della selezione. Nel campione analitico, i partecipanti erano intorno alla mezza età all’inizio dello studio (età media 46,3 anni; range 16-102); circa la metà erano donne (54,9%), e circa un quarto (26,3%) erano fumatori. Circa due terzi del campione ha lasciato la scuola dopo l’età dell’obbligo.
| Incluso | Escluso | Valore P | |
|---|---|---|---|
| Numero di membri dello studio | 163 363 | 36 141 | — |
| Punteggio medio (SD) di sofferenza | 1.5 (2.6) | 1.5 (2.7) | 0.12 |
| Età media (SD) (anni) | 46.3 (18.3) | 51.9 (21.4) | <0.001 |
| Donne (%) | 54.9 | 58.2 | <0.001 |
| IMC medio (SD) | 26.6 (4.8) | 26.5 (4.9) | 0.009 |
| Abbandono della scuola dopo l’età minima di abbandono (%) | 67.9 | 61.1 | <0.001 |
| Fumatore corrente (%) | 26.3 | 26.1 | 0.09 |
| Bere alcolici almeno una volta alla settimana (%) | 62.0 | 49.1 | <0.001 |
Sulla base dei 163-363 membri dello studio nel campione da analizzare, abbiamo esaminato le covariate di base secondo le quattro categorie di disagio psicologico (tabella 4). Come anticipato, i membri dello studio con punteggi di stress più alti avevano livelli meno favorevoli di una serie di caratteristiche, alcuni dei quali sono noti fattori di rischio per alcuni tumori selezionati. Quindi, rispetto alle persone con livelli di disagio più bassi, più i membri dello studio più afflitti avevano maggiori probabilità di avere un’istruzione di base, di fumare e di essere obesi. L’unica eccezione a questa osservazione è stata l’assunzione settimanale di bevande alcoliche, che è stata inferiore nelle persone che hanno segnalato livelli di disagio più elevati.
| Punteggio del disagio* | Valore P | ||||
|---|---|---|---|---|---|
| 0 | 1-3 | 4-6 | 7-12 | ||
| No di persone | 97 273 | 41 466 | 13 114 | 11 510 | — |
| Età media (SD) (anni) | 47.0 (18.0) | 45.3 (19.0) | 44.9 (18.8) | 46.6 (17.4) | <0.001 |
| Femmina (%) | 52.0 | 56.8 | 62.4 | 63.5 | <0.001 |
| Obeso (%) | 20.4 | 20.5 | 21.1 | 23.7 | <0.001 |
| Abbandono della scuola dopo l’età minima di abbandono (%) | 68.7 | 68.2 | 66.7 | 62.1 | <0.001 |
| Fumatore corrente (%) | 24.0 | 27.1 | 31.0 | 37.2 | <0.001 |
| Bere alcolici almeno una volta alla settimana (%) | 63.9 | 61.4 | 57.7 | 53.8 | <0.001 |
Durante un follow-up medio (SD) di 9,5 (4,3) anni in tutti i 16 studi ci sono stati 16-267 decessi, 4353 dei quali sono stati attribuiti al cancro di qualsiasi sito. La Figura 2 mostra la relazione corretta per età e sesso tra il disagio psicologico e la mortalità di tutte le sedi tumorali combinati secondo ciascuno dei 16 studi presenti nella presente meta-analisi. Con l’eccezione di tre studi con un numero di decessi per cancro tra i più bassi (1997, 2005 e 2006 HSE), relativi a individui con punteggi di sofferenza più bassi (0-6), quelli con livelli più alti (7-12) hanno registrato un aumento dei tassi di mortalità totale per cancro, sebbene gli intervalli di confidenza per tutti gli studi tranne cinque includano l’unità. Una statistica I2 del 2% suggerisce essenzialmente l’assenza di eterogeneità statistica nelle stime specifiche dello studio. Nei 16 studi in aggregato, dopo l’aggiustamento per l’età e il sesso, livelli più alti di sofferenza sono stati associati a un rischio maggiore del 32% di mortalità totale per cancro (hazard ratio 1,32, intervallo di confidenza del 95% da 1,18 a 1,48).
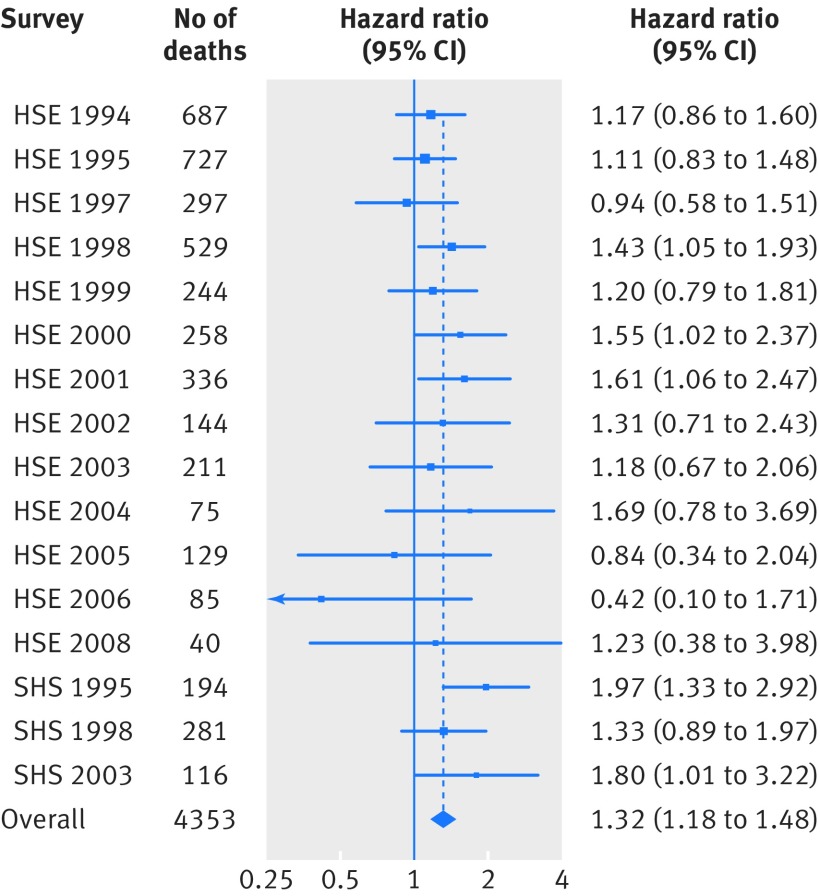
Fig. 2 Rapporti di pericolo (intervalli di confidenza del 95%) per il disagio psicologico in relazione alla mortalità per tutti i tumori combinati secondo lo studio: follow-up di 16 studi di coorte da indagine sanitaria per l’Inghilterra (HSE) e indagine sanitaria scozzese (SHS) (n=163-363). I rapporti di pericolo (corretti per l’età e il sesso) sono per il punteggio di disagio psicologico di 7-12 (più angosciato) rispetto a 0-6. I2=2%
La Figura 3 mostra le analisi per il disagio secondo 16 presentazioni tumorali indipendenti (non sovrapposte) più alcuni di questi siti in aggregato (tumore totale e tumori correlati e non correlati al fumo). Per tutti gli endpoint di tumore maligno presenti nelle analisi in cui i rapporti di pericolo sono stati corretti in base all’età e al sesso, sono stati riscontrati tassi di mortalità più elevati nelle persone con livelli di disagio più elevati, anche se non sempre è stata evidente l’importanza a livelli convenzionali. Così, dei singoli siti, nel modello con età e sesso, sono stati osservati gli effetti più deboli per il cancro ai polmoni e i più forti per il mesotelioma. Alcune di queste stime erano imprecise, come dimostrano gli ampi intervalli di confidenza a causa del basso numero di decessi per cancro. Abbiamo anche mostrato l’impatto dell’aggiustamento per una serie di ulteriori covariate. Rispetto ai rapporti di rischio corretti in base all’età e al sesso, l’aggiustamento per le covariate che includevano la posizione socioeconomica (educazione) e i comportamenti sanitari (fumo di sigaretta, assunzione di alcolici) ha avuto uno scarso effetto attenuante; in alcuni casi, infatti, è stata evidente una confusione positiva. Un’eccezione è stata il cancro legato al tabacco (compreso il polmone), per il quale, non sorprende che l’aggiunta del fumo al modello multivariabile abbia portato a una parziale attenuazione dell’associazione con il disagio (la tabella A dell’appendice 1 mostra l’impatto del controllo per i singoli fattori di confondimento nel modello multivariabile).
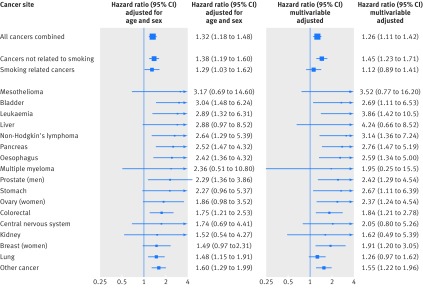
Fig. 3 Rapporti di pericolo (intervallo di confidenza del 95%) per il disagio psicologico in relazione a selezionati esiti di morte per cancro: follow-up di 16 studi di coorte da indagine sanitaria per l’Inghilterra e indagine sanitaria scozzese (n=163-363). I rapporti di pericolo sono per il punteggio di disagio psicologico di 7-12 (la maggior parte dei casi di disagio) rispetto a 0-6, e sono corretti per l’età e – ad eccezione delle analisi di singolo sesso – per il sesso (I2=15%), o multivariabili (età, sesso, IMC, livello di istruzione, condizione di fumo e consumo di alcol; I2=37%).
La tabella 5 mostra le quattro categorie di disagio psicologico che abbiamo usato per esplorare le associazioni dose-risposta con diverse presentazioni di cancro. In queste analisi ci sono state alcune prove di effetti graduali su tutto il range di sofferenza per il cancro del colorettum e della prostata. Con diversi modelli basati su diversi campioni analitici a causa della mancanza di covariate, abbiamo ricalcolato queste stime degli effetti in un set di dati non mancanti – cioè, la stessa dimensione del campione in entrambi i modelli – e i nostri risultati sono rimasti invariati.
| Cancro e aggiustamento | Morti* | No di persone | Punteggio del soccorso | Valore P per l’andamento | Punteggio di soccorso (7-12 v 0-6) | |||
|---|---|---|---|---|---|---|---|---|
| 0 | 1-3 | 4-6 | 7-12 | |||||
| Tutti i tumori | ||||||||
| Età e sesso | 4353 | 163 363 | 1 (rif) | 0,99 (0,92 a 1,08) | 1,05 (da 0,91 a 1,20) | 1,31 (1,16 a 1,49) | <0.001 | 1,32 (1,18 a 1,48) |
| Multivariabile† | 3800 | 146 008 | 1 | 0,95 (da 0,88 a 1,03) | 0,93 (da 0,78 a 1,10) | 1,22 (1,07 a 1,38) | 0.04 | 1,26 (da 1,11 a 1,42) |
| Non legato al fumo | ||||||||
| Età e sesso | 2323 | 163 363 | 1 | 0,96 (da 0,87 a 1,06) | 1,06 (da 0,89 a 1,27) | 1,36 (da 1,17 a 1,59) | <0.001 | 1,38 (1,19 a 1,60) |
| Multivariabile | 2036 | 146 008 | 1 | 0,94 (da 0,84 a 1,04) | 1,01 (da 0,82 a 1,25) | 1,43 (1,21 a 1,69) | <0.001 | 1,45 (1,23 a 1,71) |
| Fumatori | ||||||||
| Età e sesso | 2030 | 163 363 | 1 | 1,03 (0,93 a 1,15) | 1,09 (da 0,86 a 1,38) | 1,29 (1,02 a 1,64) | 0.03 | 1,29 (1,03 a 1,62) |
| Multivariabile | 1764 | 146 008 | 1 | 0,98 (0,88 a 1,09) | 0,93 (da 0,76 a 1,14) | 1,09 (da 0,86 a 1,38) | 0.92 | 1,12 (da 0,89 a 1,41) |
| Polmone | ||||||||
| Età e sesso | 992 | 163 363 | 1 | 1,10 (0,94 a 1,28) | 1,45 (1,05 a 2,00) | 1,55 (1,17 a 2,06) | <0.001 | 1,48 (1,15 a 1,91) |
| Multivariabile | 865 | 146 008 | 1 | 1,04 (da 0,88 a 1,22) | 1,21 (da 0,90 a 1,64) | 1,26 (da 0,95 a 1,66) | 0.13 | 1,26 (da 0,97 a 1,62) |
| Colorettale | ||||||||
| Età e sesso | 391 | 163 363 | 1 | 1,09 (0,86 a 1,39) | 1,48 (1,02 a 2,14) | 1,77 (da 1,20 a 2,59) | 0.01 | 1,75 (1,21 a 2,53) |
| Multivariabile | 341 | 135 888 | 1 | 1,11 (0,86 a 1,44) | 1,56 (1,05 a 2,33) | 1,89 (1,23 a 2,90) | 0.01 | 1,84 (1,21 a 2,78) |
| Seno (femmina) | ||||||||
| Età | 257 | 89 613 | 1 | 0,93 (da 0,63 a 1,37) | 0,74 (da 0,38 a 1,44) | 1,36 (da 0,87 a 2,13) | 0.97 | 1,49 (da 0,97 a 2,31) |
| Multivariabile | 213 | 78 707 | 1 | 1,03 (da 0,66 a 1,60) | 0,97 (da 0,47 a 1,99) | 1,69 (1,04 a 2,73) | 0.41 | 1,91 (da 1,20 a 3,05) |
| Prostata | ||||||||
| Età | 253 | 73 750 | 1 | 0,87 (da 0,62 a 1,22) | 1,91 (1,21 a 3,01) | 2,28 (1,33 a 3,92) | 0.004 | 2,29 (da 1,36 a 3,86) |
| Multivariabile | 216 | 67 301 | 1 | 0,93 (da 0,64 a 1,35) | 1,81 (da 0,93 a 3,52) | 2,38 (da 1,25 a 4,57) | 0.01 | 2,42 (da 1,29 a 4,54) |
| Pancreas | ||||||||
| Età e sesso | 244 | 163 363 | 1 | 1,18 (da 0,87 a 1,59) | 1,32 (da 0,75 a 2,33) | 2,09 (da 1,19 a 3,65) | 0.35 | 2,52 (da 1,47 a 4,32) |
| Multivariabile | 218 | 146 008 | 1 | 1,16 (da 0,84 a 1,59) | 1,12 (da 0,55 a 2,26) | 2,08 (1,11 a 3,89) | 0.772 | 2,76 (da 1,47 a 5,19) |
| Esofago | ||||||||
| Età e sesso | 209 | 163 363 | 1 | 1,09 (da 0,79 a 1,52) | 1,13 (da 0,51 a 2,50) | 2,43 (da 1,33 a 4,44) | 0.314 | 2,42 (da 1,36 a 4,32) |
| Multivariabile | 174 | 135 888 | 1 | 1,02 (da 0,71 a 1,47) | 1,34 (da 0,60 a 3,00) | 2,48 (da 1,25 a 4,92) | 0.38 | 2,59 (da 1,34 a 5,00) |
| Stomaco | ||||||||
| Età e sesso | 156 | 155 714 | 1 | 0,89 (da 0,60 a 1,32) | 0,83 (da 0,33 a 2,10) | 2,22 (da 0,91 a 5,39) | 0.72 | 2,27 (da 0,96 a 5,37) |
| Multivariabile | 141 | 139 323 | 1 | 0,90 (da 0,60 a 1,37) | 0,84 (da 0,30 a 2,37) | 2,52 (1,03 a 6,20) | 0.97 | 2,67 (da 1,11 a 6,39) |
| Ovaia | ||||||||
| Età | 125 | 83 424 | 1 | 0,93 (da 0,59 a 1,47) | 1,53 (da 0,76 a 3,07) | 1,71 (da 0,88 a 3,32) | 0.14 | 1,86 (0,98 a 3,52) |
| Multivariabile | 111 | 67 823 | 1 | 0,96 (da 0,60 a 1,55) | 1,87 (da 0,81 a 4,27) | 2,18 (da 1,11 a 4,28) | 0.04 | 2,37 (da 1,24 a 4,54) |
| Vescica | ||||||||
| Età e sesso | 121 | 163 363 | 1 | 1,44 (da 0,93 a 2,22) | 2,42 (1,10 a 5,31) | 3,31 (da 1,55 a 7,09) | 0.01 | 3,04 (da 1,48 a 6,24) |
| Multivariabile | 107 | 146 008 | 1 | 1,27 (da 0,79 a 2,05) | 1,92 (da 0,81 a 4,57) | 2,55 (1,02 a 6,35) | 0.18 | 2,69 (da 1,11 a 6,53) |
| Linfoma non Hodgkin | ||||||||
| Età e sesso | 110 | 151 954 | 1 | 0,77 (da 0,44 a 1,37) | 1,19 (da 0,46 a 3,10) | 1,99 (da 0,97 a 4,10) | 0.46 | 2,64 (da 1,29 a 5,39) |
| Multivariabile | 99 | 135 888 | 1 | 0,70 (da 0,38 a 1,27) | 1,22 (da 0,46 a 3,24) | 2,46 (1,06 a 5,73) | 0.33 | 3,14 (da 1,36 a 7,24) |
| Sistema nervoso centrale | ||||||||
| Età e sesso | 105 | 154 613 | 1 | 1,10 (da 0,67 a 1,81) | 1,80 (da 0,83 a 3,91) | 2,05 (da 0,78 a 5,41) | 0.10 | 1,74 (da 0,69 a 4,41) |
| Multivariabile | 96 | 138 348 | 1 | 1,07 (da 0,63 a 1,83) | 2,02 (da 0,92 a 4,42) | 2,46 (da 0,91 a 6,63) | 0.06 | 2,05 (da 0,80 a 5,26) |
| Leucemia | ||||||||
| Età e sesso | 101 | 163 363 | 1 | 0,99 (da 0,60 a 1,66) | 3,08 (da 1,16 a 8,15) | 2,61 (1,06 a 6,44) | 0.11 | 2,89 (1,32 a 6,31) |
| Multivariabile | 87 | 135 999 | 1 | 1,13 (0,65 a 1,97) | 3,86 (da 0,72 a 20,8) | 3,92 (1,36 a 11,2) | 0.06 | 3,86 (1,42 a 10,5) |
| Rene | ||||||||
| Età e sesso | 90 | 163 363 | 1 | 0,72 (da 0,39 a 1,34) | 1,40 (da 0,54 a 3,66) | 1,22 (da 0,43 a 3,45) | 0.82 | 1,52 (da 0,54 a 4,27) |
| Multivariabile | 79 | 127 961 | 1 | 0,80 (da 0,43 a 1,51) | 1,67 (da 0,63 a 4,40) | 1,40 (da 0,41 a 4,77) | 0.79 | 1,62 (da 0,49 a 5,39) |
| Fegato | ||||||||
| Età e sesso | 61 | 146 997 | 1 | 2,24 (da 1,12 a 4,48) | 3,67 (da 1,12 a 12,0) | 3,09 (da 0,97 a 9,90) | 0.07 | 2,88 (da 0,97 a 8,52) |
| Multivariabile | 53 | 125 978 | 1 | 1,57 (da 0,86 a 2,85) | NA | 1,73 (da 0,53 a 16,3) | 0.20 | 4,24 (da 0,66 a 27,0) |
| Mieloma multiplo | ||||||||
| Età e sesso | 51 | 135 555 | 1 | 0,60 (da 0,27 a 1,34) | 2,07 (da 0,42 a 10,2) | 1,80 (da 0,37 a 8,7) | 0.72 | 2,36 (da 0,51 a 10,8) |
| Multivariabile | 41 | 111 534 | 1 | 0,70 (da 0,25 a 1,99) | 4,79 (da 0,42 a 55,3) | 1,41 (da 0,18 a 11,3) | 0.83 | 1,95 (da 0,25 a 15,5) |
| Mesotelioma | ||||||||
| Età e sesso | 51 | 134 208 | 1 | 1,09 (da 0,49 a 2,41) | 2,38 (da 0,27 a 20,7) | 3,42 (da 0,68 a 17,1) | 0.80 | 3,17 (da 0,69 a 14,6) |
| Multivariabile | 51 | 120 461 | 1 | 1,12 (da 0,51 a 2,50) | 2,39 (da 0,27 a 21,6) | 3,91 (da 0,78 a 19,6) | 0.62 | 3,52 (da 0,77 a 16,2) |
| Tumori “Altri” (altri) | ||||||||
| Età e sesso | 1036 | 163 363 | 1 | 1,08 (0,93 a 1,25) | 1,36 (1,09 a 1,70) | 1,66 (1,33 al 2,08) | <0.001 | 1,60 (1,29 a 1,99) |
| Multivariabile | 908 | 146 008 | 1 | 1,01 (da 0,86 a 1,19) | 1,30 (1,01 a 1,67) | 1,58 (1,24 a 2,01) | <0.001 | 1,55 (1,22 a 1,96) |
Abbiamo poi effettuato alcune analisi pianificate dei sottogruppi. In primo luogo, come descritto, alcune potenziali covariate (attività fisica, proteina C reattiva, privazione basata sull’area, quantità di alcol consumata) sono state raccolte solo in studi selezionati e quindi non sono state inserite nelle nostre analisi principali. A causa dei numeri più piccoli, siamo stati in grado di esaminare l’impatto dell’aggiustamento per queste covariate solo sulla relazione tra l’angoscia e tutti i tumori combinati (tabella B nell’appendice 1). La forza della relazione tra l’angoscia e il cancro totale è stata poco modificata. In secondo luogo, per esplorare il ruolo della causalità inversa – le persone che entrano negli studi potrebbero avere alcuni sintomi di cancro non diagnosticato, tra cui il dolore e la stanchezza, che potrebbero causare, o essere presi per, l’angoscia mentale – abbiamo escluso i membri dello studio che sono morti nei primi cinque anni di follow-up dal particolare punto finale descritto in ogni analisi. Così facendo, abbiamo scoperto che la maggior parte delle associazioni tra angoscia e cancro erano in gran parte inalterate (fig. A nell’appendice 2).
In terzo luogo, nelle analisi correlate, dato che i dati sui decessi combinano sia l’incidenza che la sopravvivenza, abbiamo esaminato se c’era una relazione tra angoscia e incidenza basata sulla registrazione di una diagnosi di cancro (dati disponibili solo per i tre studi scozzesi) in quanto questa è più vicina all’esposizione di interesse e quindi le analisi forniscono potenzialmente una maggiore comprensione dell’eziologia. La figura 4 mostra che c’è stata una certa evidenza di effetti differenziali per il cancro di tutte le sedi combinate e per il cancro colorettale, in modo tale che le associazioni tra distress e incidenza erano più deboli, anche se quest’ultima analisi è stata particolarmente compromessa da relativamente pochi eventi.
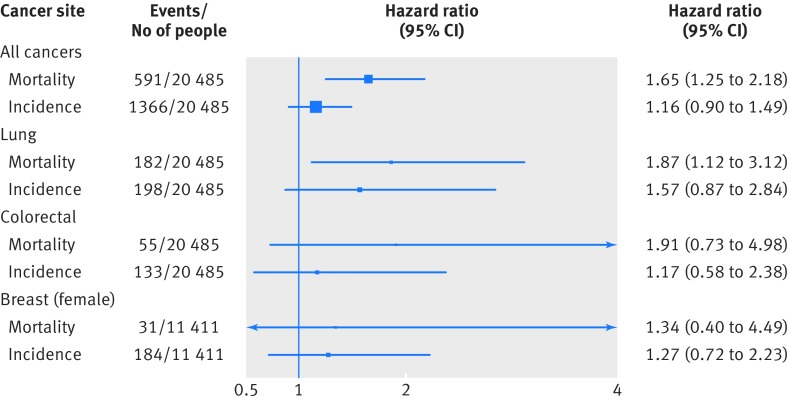
Fig. 4 Rapporti di pericolo (intervallo di confidenza del 95%) per il disagio psicologico in relazione a determinati esiti tumorali: confronto degli effetti per incidenza e mortalità nel follow-up di tre studi di coorte dell’indagine sanitaria scozzese (SHS; n=20-485). I rapporti di pericolo (corretti per l’età e il sesso) sono per il punteggio di disagio psicologico di 7-12 (più angosciato) rispetto a 0-6. Gli individui con tumori registrati prima della linea di base (n=696) sono stati esclusi dalle analisi dell’incidenza del cancro
Infine, il 18% (n=36-141) dei membri dello studio è stato escluso tra il reclutamento e le analisi, in gran parte a causa del rifiuto di essere collegato a registrazioni di morte o di cancro (fig. 1). Di conseguenza, per ciascuno dei 16 studi di coorte nell’analisi abbiamo utilizzato un’imputazione multipla multivariata basata su variabili di base disponibili per eventuali valori mancanti. Abbiamo eseguito cinque cicli di regressione, che hanno generato cinque set di dati di imputazione per ciascuno dei 16 studi, e i risultati sono stati ottenuti facendo la media dei risultati di ciascuno di questi cinque set di dati utilizzando l’approccio di Rubin.40 Questa procedura tiene conto dell’incertezza nel processo di imputazione e dell’incertezza dovuta alla variazione casuale. La meta-analisi dei risultati di questi dati specifici dello studio imputato (tabella C nell’appendice 1) ha dato risultati simili a quelli visti con l’insieme di dati non mancanti, come riportato nel presente documento.

Fig. 1 Membri dello studio dall’induzione fino al campione per l’analisi: follow-up di 16 studi di coorte da indagine sanitaria per l’Inghilterra e indagine sanitaria scozzese (n=163-363). Le persone escluse possono rientrare in più di una categoria, quindi il totale supera il 36-141

Fig. 2 Rapporti di pericolo (intervalli di confidenza del 95%) per il disagio psicologico in relazione alla mortalità da tutti i tumori combinati secondo lo studio: follow-up di 16 studi di coorte da indagine sanitaria per l’Inghilterra (HSE) e indagine sanitaria scozzese (SHS) (n=163-363). I rapporti di pericolo (corretti per l’età e il sesso) sono per il punteggio di disagio psicologico di 7-12 (più angosciato) rispetto a 0-6. I2=2%

Fig. 3 Rapporti di rischio (intervallo di confidenza del 95%) per il disagio psicologico in relazione a determinati esiti di morte per cancro: follow-up di 16 studi di coorte da indagine sanitaria per l’Inghilterra e indagine sanitaria scozzese (n=163-363). I rapporti di pericolo sono per il punteggio di disagio psicologico di 7-12 (la maggior parte dei casi di disagio) rispetto a 0-6, e sono corretti per l’età e – ad eccezione delle analisi di singolo sesso – per il sesso (I2=15%), o multivariabili (età, sesso, IMC, livello di istruzione, condizione di fumo e consumo di alcol; I2=37%).

Fig. 4 Rapporti di pericolo (intervallo di confidenza del 95%) per il disagio psicologico in relazione a determinati esiti tumorali: confronto degli effetti per incidenza e mortalità nel follow-up di tre studi di coorte dell’indagine scozzese sulla salute (SHS; n=20-485). I rapporti di pericolo (corretti per l’età e il sesso) sono per il punteggio di disagio psicologico di 7-12 (più angosciato) rispetto a 0-6. Gli individui con tumori registrati prima della linea di base (n=696) sono stati esclusi dalle analisi dell’incidenza del cancro
Discussione
Principali risultati
In questa raccolta di dati non pubblicati sui singoli partecipanti, abbiamo scoperto che le persone che si trovano nel gruppo di persone con il più alto livello di sofferenza rispetto al più basso hanno registrato un aumento del tasso di mortalità per alcuni tipi di cancro. Così, dopo l’aggiustamento per le covariate che sono fattori di rischio noti per i tumori maligni selezionati, come i comportamenti negativi per la salute, e con la causalità inversa (per censura a sinistra) e i dati mancanti (per imputazione) presi in considerazione, gli effetti più consistenti sono stati evidenti per il carcinoma del colorettum, della prostata, del pancreas e dell’esofago e per la leucemia. Per due di questi tumori maligni del colon-retto e della prostata era evidente un gradiente, tale che maggiore è il livello di sofferenza, maggiore è il rischio di mortalità per cancro. Queste associazioni forniscono un parziale supporto alle nostre ipotesi basate su plausibili meccanismi di effetto.
Utilità del presente studio
Le nostre scoperte potrebbero essere importanti per far progredire la comprensione del ruolo del disagio psicologico nell’eziologia e nella progressione del cancro, poiché gli investigatori cercano di accertare quale ruolo hanno questo e altri fattori psicologici (come lo stress psicosociale, la cognizione, la personalità, la soddisfazione della vita), se esistono, nella prevenzione e nella prognosi. Contestualizzando il valore predittivo del disagio per il rischio di cancro, confrontandolo con i fattori di rischio non psicologici stabiliti utilizzando i dati del presente studio (tabella D in appendice 1), è evidente che, a parte il cancro ai polmoni per il quale il fumo di sigaretta ha una nota influenza causale, i rapporti di rischio per i livelli di disagio più elevati sono di entità simile a quelli per il fumo corrente e l’obesità per le presentazioni tumorali selezionate. Da un punto di vista individuale, tuttavia, nessuno di questi fattori di rischio è abbastanza potente da determinare il rischio di una persona: nell’analisi della morte per un cancro comune come il colorettale, ad esempio, la sensibilità – la percentuale di persone che hanno sviluppato una malattia che aveva anche il fattore di rischio alla base – è stata solo dell’8% per il disagio psicologico, del 17% per il fumo di sigaretta corrente e del 27% per l’obesità. Come è stato dimostrato per le malattie cardiovascolari, tuttavia, dove gli algoritmi multifattoriali sono di uso diffuso nella pratica generale (come Framingham,41 QRisk42), collettivamente, questi e altri fattori di rischio potrebbero avere un’utilità predittiva per le comuni presentazioni tumorali (come il colorettale, il seno, la prostata). Nello sviluppo di tali algoritmi, il disagio psicologico potrebbe essere considerato come un componente, cosa che attualmente non avviene.43 Il fatto che questi fattori di rischio abbiano collettivamente un valore predittivo per i tumori selezionati, insieme alle osservazioni ben consolidate che i tassi di tumore differiscono sistematicamente nel tempo,44 la localizzazione,45 e il modello di migrazione,46 suggeriscono fortemente che l’insorgenza dei tumori non è un semplice processo stocastico che riflette il numero di divisioni di cellule staminali specifiche dei tessuti,47 come è stato suggerito.48
Studiare i punti di forza e le limitazioni
Il nostro studio ha alcuni punti di forza, tra cui l’uso di dati grezzi non pubblicati provenienti da studi condotti in modo simile nella popolazione generale; in quanto tali, i nostri risultati non sono soggetti a distorsioni di pubblicazione e il confronto tra gli studi è semplice. Abbiamo anche utilizzato un ampio e ben caratterizzato set di dati relativi a molti altri studi in questa specialità. Il nostro lavoro non è ovviamente privo di limiti. La valutazione del disagio psicologico con il GHQ-12 ha fatto riferimento alle quattro settimane precedenti. È improbabile che un breve periodo di sofferenza sia di rilevanza eziologica per una malattia come il cancro, che ha un lungo periodo di induzione. Ci sono prove, tuttavia, che i tassi di ricorrenza sono elevati per il disagio psicologico. Ad esempio, in una popolazione di 4363 persone in una fascia d’età simile a quella degli attuali membri dello studio, abbiamo scoperto che, sulla base del questionario generale sullo stato di salute (30 item) su un massimo di 19 anni di sorveglianza (quattro fasi di raccolta dati), due terzi del campione classificato come afflitto al basale erano anche afflitti in una o più occasioni durante il follow-up. Ciò è ampiamente coerente con i risultati relativi alla depressione clinica.49 Pertanto, una singola somministrazione di un inventario di distress sembra catturare i casi di depressione e ansia a lungo termine. Nonostante ciò, una misurazione seriale della nostra esposizione avrebbe fornito ulteriori informazioni sulla cronicità del disagio psicologico e avrebbe avuto l’ulteriore vantaggio di permetterci di imitare un trial in un contesto osservazionale, identificando un gruppo la cui depressione si è risolta nel tempo e osservando l’insorgenza del cancro in questo gruppo.
Mentre abbiamo scelto di includere una serie di esiti tumorali per esplorare la specificità dell’associazione, non tutte queste ipotesi erano guidate da un’ipotesi. È anche il caso che, dato che la nostra meta-analisi è basata su studi osservazionali, così come lo erano questi studi, confondere fattori noti o sconosciuti rimane una preoccupazione perenne. La valutazione delle caratteristiche dietetiche, ad esempio, è stata un’omissione. Questo problema potrebbe teoricamente essere aggirato in uno studio randomizzato controllato su persone in trattamento per la depressione e l’ansia che sono anche soggette a sorveglianza per eventi tumorali dove, se è realmente causale, un’inversione dei sintomi di angoscia produrrebbe un tasso più basso di cancro nei pazienti trattati. Mentre un tale studio eziologico è stato condotto nel contesto della malattia cardiovascolare, la riduzione della depressione ha prodotto un minor rischio di mortalità totale in uno50ma non ha avuto alcun impatto sui tassi di reinfarzione del miocardio in un altro51 – la logistica coinvolta con la dimensione e la durata di uno studio per le presentazioni multiple di tumori è probabilmente proibitiva. Un approccio alternativo ma correlato sarebbe quello di utilizzare la randomizzazione mendeliana nel contesto di dati osservazionali in cui una variante genica per il disagio psicologico in linea di principio fornisce una stima infondata della relazione tra un’esposizione e l’esito di una malattia.52 L’identificazione dei geni per ladepressione53 rappresenta una proposta realistica; sfortunatamente, gli studi che costituiscono la presente collaborazione non hanno catturato materiale genetico.
Confronto con altri studi
Le presenti analisi estendono notevolmente il nostro lavoroesistente21 , dove abbiamo dimostrato che i livelli più alti di sofferenza sono legati alle principali cause di mortalità, tra cui le malattie cardiovascolari, le cause esterne di morte e tutti i tumori combinati, esplorando il legame tra sofferenza e 16 diverse presentazioni di tumori. Non siamo a conoscenza di precedenti meta-analisi sui sintomi del disagio psicologico in relazione al cancro specifico del sito. In una recente meta-analisi dell’insorgenza del cancro in seguito alla valutazione della depressionemaggiore13 , che ha utilizzato studi piuttosto che dati a livello individuale ed ha escluso gli studi in cui i ricercatori hanno catturato i sintomi depressivi, il risultato aggregato per la depressione e il cancro per tutte le neoplasie in tutti i 13 studi comprendeva l’unità (rischio relativo 1,12, intervallo di confidenza del 95% da 0,99 a 1,26). Questo è stato di entità nettamente inferiore rispetto alla nostra stima tra il disagio psicologico e il cancro complessivo (rapporto di rischio multivariabile regolato 1,32, intervallo di confidenza del 95% da 1,18 a 1,48). I risultati discordanti degli studi prospettici pubblicati dopo quella meta-analisi non hanno chiarito la situazione.5455565757585960Anche all’interno dello stesso studio, tutti i tumori combinati hanno mostrato gradienti opposti con depressione nelle analisi a stratificazione sessuale.59 Gli studi di scala sufficiente per esplorare le associazioni site specific con la depressione sono rari, e i pochi che sono stati condotti mostrano effetti nulli per il colon, i polmoni e la prostata.57
60
Meccanismi di effetto
La mortalità da cancro secondo il sito anatomico – il principale risultato del nostro studio – è un insieme dell’insorgenza del cancro (eziologia) insieme alla sopravvivenza della malattia (prognosi). L’influenza del disagio psicologico sui processi che agiscono in uno o in entrambi questi stadi della malattia potrebbe quindi influenzare il rischio di mortalità da cancro. Inoltre, questi meccanismi possono essere diretti (biologici) e/o indiretti (comportamentali), e la loro azione cancerogena specifica e/o comune a presentazioni multiple.
Le persone con disagio cronico hanno tipicamente uno stile di vita meno favorevole rispetto a quelle con livelli più bassi,12 e questo è stato avanzato come uno dei mezzi con cui il disagio può essere incarnato, aumentando così il rischio di cancro. Mentre nelle nostre analisi abbiamo controllato il fumo di sigaretta, il forte consumo di alcol e l’inattività fisica – e le associazioni tenute – anche i comportamenti che cercano la salute potrebbero essere importanti, forse in una fase successiva del processo di malattia. Così, le persone in difficoltà potrebbero essere meno propense a soddisfare le richieste discreening61 , con conseguente ritardo nella diagnosi e, una volta diagnosticato il cancro, la depressione potrebbe ostacolare l’adesione al trattamento.62 Questi risultati, tuttavia, non sono universali.63 Nel presente studio non abbiamo raccolto dati sui comportamenti terapeutici.
Tra i meccanismi biologici, i disturbi dell’umore come la depressione sono stati implicati nelle vie immunitarie e sono noti per provocare risposte infiammatorie. La disregolazione immunitaria prolungata può compromettere la capacità di riparazione delle cellule esposte, contribuendo potenzialmente all’instabilità genetica e alle mutazioni, alle alterazioni della riparazione del DNA e all’inibizione dell’apoptosi.6465La disregolazione immunitaria può anche portare a una prognosi peggiore per diversi carcinomi, tra cui il cancro del colorettum, del polmone, del mesotelio e dello stomaco.66 La depressione e l’angoscia sono anche associate a marcatori di aumento dell’infiammazione, come l’interleuchina 6, la proteina C reattiva ad alta sensibilità e il recettore del fattore di necrosi tumorale solubile.67 Nelle analisi dei sottogruppi, le associazioni tra angoscia e cancro che abbiamo osservato sono rimaste invariate dopo l’aggiunta di concentrazioni di proteina C reattiva circolante al modello multivariabile, ma non abbiamo avuto dati su una serie più ampia di indicatori infiammatori. La mancanza di specificità della relazione tra distress e sede del cancro nelle nostre analisi non ha fornito un’intuizione univoca sui potenziali meccanismi, anche se, in generale, le associazioni sembravano più forti per alcuni tumori ormonali, come il carcinoma della prostata e delle ovaie. Questa osservazione è in accordo con la nozione di meccanismi correlati allo stress, che includono la disregolazione dell’ipofisi surrenale ipotalamica (HPA)68 e l’asse midollare surrenale simpatico (SAM).69
Esplorare il ruolo della causalità inversa
È plausibile che le associazioni che abbiamo trovato tra angoscia e cancro riflettano sia gli effetti del cancro diagnosticato e non diagnosticato sull’umore, sia gli effetti dell’angoscia sulla progressione del cancro, o una combinazione. Come descritto, è ben documentato che una diagnosi di cancro può dare origine ad angoscia,70 e abbiamo affrontato questa potenziale fonte di causalità inversa utilizzando la pratica standard di escludere i membri con malignità autosegnalata all’ingresso dello studio. Dopo averlo fatto, quando abbiamo esplorato il rischio tra l’angoscia e il cancro totale secondo lo studio, quelli con un follow-up più lungo hanno mostrato generalmente associazioni più deboli. Con l’aumentare della durata del follow-up, la percentuale di persone sopravvissute che sono entrate nello studio con un cancro sconosciuto diminuisce rispetto al numero totale di morti per cancro; anche l’influenza del cancro sull’angoscia dovrebbe diminuire nel tempo. Inoltre, nelle analisi degli studi scozzesi, le associazioni erano un po’ più deboli per l’incidenza del cancro che per la mortalità da cancro, anche se queste analisi non erano ben alimentate a causa del minor numero di nuovi casi di cancro. Prendendo insieme queste osservazioni, è stato suggerito che la malignità subclinica potrebbe aver avuto un impatto sull’umore. Così, per esplorare l’impatto del cancro occulto, abbiamo escluso i membri dello studio che sono morti nei primi cinque anni di follow-up. Questa pratica si basa sul presupposto che le persone con tumori occulti della varietà più letale saranno morte durante questo periodo. In queste analisi, tuttavia, i gradienti tra angoscia e cancro erano ancora visibili.
In conclusione, i nostri risultati si aggiungono alle crescenti prove di un’associazione tra disagio psicologico e condizioni fisiche, caratterizzando nuovi rapporti con la morte a seguito di presentazioni tumorali selezionate. La misura in cui queste associazioni potrebbero essere causali richiede ulteriori test con progetti di studio alternativi.
Ciò che è già noto su questo argomento
- Mentre il disagio psicologico (sintomi di depressione e ansia) è legato all’aumento dei tassi di malattie cardiovascolari, i collegamenti con diverse presentazioni di cancro non sono chiari e, per alcuni tumori maligni selezionati, non sono stati testati.
Cosa aggiunge questo studio
- Un’analisi congiunta di dati grezzi non pubblicati di 16 studi di coorte prospettici suggerisce associazioni tra angoscia e cancro, in particolare per il carcinoma del colon-retto, della prostata, del pancreas e dell’esofago e per la leucemia.
- Questo si aggiunge alla crescente evidenza che il disagio psicologico potrebbe avere una certa capacità predittiva per alcune malattie somatiche
- Poiché le prove esistenti si basano esclusivamente su studi osservazionali, sono ora necessarie ulteriori ricerche per chiarire in che misura ciascuna delle associazioni tra angoscia e cancro possa essere causale.
References
- Lancet. 2012; 380:1491-7. Publisher Full Text | DOI | PubMed
- Am J Epidemiol. 2016; 183:183-90. Publisher Full Text | DOI | PubMed
- J Behav Med. 2014; 37:881-9. Publisher Full Text | DOI | PubMed
- Nat Rev Cardiol. 2012; 9:360-70. Publisher Full Text | DOI | PubMed
- Eur Heart J. 2006; 27:2763-74. Publisher Full Text | DOI | PubMed
- JAMA. 2011; 306:1241-9. Publisher Full Text | DOI | PubMed
- Atherosclerosis. 2014; 236:385-8. Publisher Full Text | DOI | PubMed
- Lancet. 2012; 380:2095-128. Publisher Full Text | DOI | PubMed
- Ann Oncol. 2002; 13(Suppl 4):165-9. Publisher Full Text | DOI | PubMed
- Biol Psychiatry. 2003; 54:269-82. Publisher Full Text | DOI | PubMed
- Stroke. 2011; 42:2770-5. Publisher Full Text | DOI | PubMed
- Clin Pract Epidemiol Ment Health. 2007; 3:29. Publisher Full Text | DOI | PubMed
- Lancet. 2002; 360:1903-13. Publisher Full Text | DOI | PubMed
- N Engl J Med. 2011; 364:829-41. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2012; 41:1585-93. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2010; 39:345-50. Publisher Full Text | DOI | PubMed
- Manual of the General Health Questionnaire.. 1978.
- BMJ. 2012; 345:e4933. Publisher Full Text | DOI | PubMed
- Arch Intern Med. 2011; 171:1858-9. Publisher Full Text | DOI | PubMed
- Gastroenterology. 2015; 148:958-966.e4. Publisher Full Text | DOI | PubMed
- Psychol Med. 1997; 27:191-7. Publisher Full Text | DOI | PubMed
- Psychol Med. 1992; 22:939-49. Publisher Full Text | DOI | PubMed
- Am J Epidemiol. 2003; 157:539-45. Publisher Full Text | DOI | PubMed
- Am J Epidemiol. 1998; 147:556-62. Publisher Full Text | DOI | PubMed
- World Health Organ Tech Rep Ser. 1995; 854:1-452. Publisher Full Text | PubMed
- JAMA Psychiatry. 2016; 73:993-5. Publisher Full Text | DOI | PubMed
- Eur Heart J. 2013; 34:750-8. Publisher Full Text | DOI | PubMed
- J Hepatol. 2012; 57:1083-9. Publisher Full Text | DOI | PubMed
- UK Chief Medical Officers’ Alcohol Guidelines Review: Summary of Proposed New Guidelines.. 2015.
- Manual of the International Statistical Classification of Diseases, Injuries, and Causes of Death (ninth revision).. 1977.
- International Statistical Classification of Diseases and Related Health Problems (10th revision).. 1992.
- Tobacco Smoking and Involuntary Smoking. IARC Monographs on the Evaluation of Carcinogenic Risk to Humans.. 2002; Vol 38
- Ann Oncol. 2008; 19:996-1002. Publisher Full Text | DOI | PubMed
- J R Stat Soc [Ser B]. 1972; 34:187-220.
- BMJ. 2000; 321:1424-5. Publisher Full Text | DOI | PubMed
- J Epidemiol Community Health. 2007; 61:824-33. Publisher Full Text | DOI | PubMed
- J Epidemiol Community Health. 2015; 69:20-7. Publisher Full Text | DOI | PubMed
- Nutr Cancer. 2011; 63:983-90. Publisher Full Text | DOI | PubMed
- Multiple imputation for nonresponse in surveys.. 1987. DOI
- Health Serv Res. 1987; 22:499-535. Publisher Full Text | PubMed
- BMJ. 2007; 335:136. Publisher Full Text | DOI | PubMed
- Cancer Causes Control. 2000; 11:477-88. Publisher Full Text | DOI | PubMed
- Publisher Full Text
- Cancer Epidemiol Biomarkers Prev. 2010; 19:1893-907. Publisher Full Text | DOI | PubMed
- J Natl Cancer Inst. 1993; 85:1819-27. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2016; 45:605-13. Publisher Full Text | DOI | PubMed
- Science. 2015; 347:78-81. Publisher Full Text | DOI | PubMed
- Diagnostic and Statistical Manual of Mental Disorders.. 2000.
- BMJ. 2013; 346:f2570. Publisher Full Text | DOI | PubMed
- JAMA. 2003; 289:3106-16. Publisher Full Text | DOI | PubMed
- Int J Epidemiol. 2003; 32:1-22. Publisher Full Text | DOI | PubMed
- Nat Genet. 2016; 48:624-33. Publisher Full Text | DOI | PubMed
- Psychosom Med. 2009; 71:395-403. Publisher Full Text | DOI | PubMed
- Soc Psychiatry Psychiatr Epidemiol. 2007; 42:683-9. Publisher Full Text | DOI | PubMed
- J Affect Disord. 2011; 131:200-6. Publisher Full Text | DOI | PubMed
- Am J Epidemiol. 2013; 178:1712-20. Publisher Full Text | DOI | PubMed
- Br J Psychiatry. 2014; 205:183-8. Publisher Full Text | DOI | PubMed
- J Affect Disord. 2015; 173:1-8. Publisher Full Text | DOI | PubMed
- Cancer Causes Control. 2010; 21:191-9. Publisher Full Text | DOI | PubMed
- J Natl Cancer Inst Monogr. 1994; 16:171-6. Publisher Full Text | PubMed
- Oncology (Williston Park). 1999; 13:1293-301, discussion 1301-2, 1305-6. Publisher Full Text | PubMed
- BMJ Open. 2014; 4:e004295.
- Proc Natl Acad Sci U S A. 2015; 112:E4571-80. Publisher Full Text | DOI | PubMed
- Nat Clin Pract Oncol. 2008; 5:466-75. Publisher Full Text | DOI | PubMed
- Lancet Oncol. 2014; 15:e493-503. Publisher Full Text | DOI | PubMed
- Prog Neuropsychopharmacol Biol Psychiatry. 2016; 66:63-72. Publisher Full Text | DOI | PubMed
- Physiol Rev. 2007; 87:873-904. Publisher Full Text | DOI | PubMed
- Int Immunopharmacol. 2002; 2:315-24. Publisher Full Text | DOI | PubMed
- Palliat Med. 2002; 16:81-97. Publisher Full Text | DOI | PubMed
Fonte
Batty GD, Russ TC, Stamatakis E, Kivimäki M (2017) Psychological distress in relation to site specific cancer mortality: pooling of unpublished data from 16 prospective cohort studies. The BMJ 356j108. https://doi.org/10.1136/bmj.j108





