Introduzione
L’uso di antibiotici è un fattore primario di resistenza agli antibiotici, e la riduzione dell’uso di antibiotici è una strategia centrale per combattere la resistenza(Gould, 1999; Harbarth e Samore, 2005). La comprensione della relazione tra l’uso di antibiotici e la resistenza agli antibiotici è quindi fondamentale per la progettazione di strategie razionali di gestione degli antibiotici. Diversi studi hanno identificato relazioni trasversali tra l’uso di antibiotici e la resistenza, soprattutto nei paesi europei e negli Stati Uniti(Goossens et al., 2005; García-Rey et al., 2002; Bronzwaer et al., 2002; Bell et al., 2014; European Centre for Disease Prevention and Control et al., 2017; van de Sande-Bruinsma et al., 2008; MacFadden et al., 2018a). In generale, questi studi confrontano l’uso totale di antibiotici ambulatoriali con la resistenza a livello di popolazione. Tuttavia, l’uso di antibiotici non è generalmente distribuito in modo uniforme. Uno studio sulla prescrizione ambulatoriale nel Regno Unito ha rilevato che al 30% dei pazienti è stato prescritto almeno un antibiotico all’anno, con il 9% dei pazienti che ricevono il 53% di tutti gli antibiotici(Shallcross et al., 2017). Uno studio sui beneficiari di Medicare, un programma nazionale di assicurazione sanitaria che copre la stragrande maggioranza degli americani dai 65 anni in su, ha rilevato che la percentuale di beneficiari che assumono antibiotici varia a seconda dello stato americano e della classe di appartenenza del farmaco(Zhang et al., 2012). In alcuni casi, i corsi di antibiotici possono durare mesi o addirittura anni(Enzler et al., 2011; Lau et al., 2017). Poiché l’uso di antibiotici non è uniforme, l’uso totale non distingue tra un uso ampio – molte persone che ricevono poche prescrizioni – e un uso intenso – poche persone che ricevono molte prescrizioni (Berrington,2010).
È evidente che la distribuzione dell’uso di antibiotici, non solo l’uso totale, potrebbe avere un effetto sulla resistenza(Turnidge e Christiansen, 2005). Ci sono pochi studi sulla relazione tra l’esposizione ripetuta agli antibiotici sulla resistenza agli antibiotici(Costelloe et al., 2010; Hillier et al., 2007; Carothers et al., 2007; Arason et al., 1996; Nasrin et al., 2002; McMahon et al., 2003; Catry et al., 2018), e non è ancora chiaro se l’uso ampio o intenso sia associato alla resistenza a livello di popolazione. Ad esempio, se un primo ciclo di antibiotici somministrato a un paziente affetto da antibiotico-nave elimina la maggior parte dei batteri sensibili che porta con sé, un secondo ciclo nello stesso paziente avrà solo un piccolo effetto, poiché la maggior parte dei batteri sensibili è già stata eliminata. Dare quel secondo ciclo a un paziente diverso, antibiotico-naivivo, invece, avrebbe un effetto maggiore sulla resistenza a livello di popolazione. D’altra parte, l’esecuzione di più decorsi multipli in un singolo paziente potrebbe avere un effetto sinergico sulla resistenza.
L’obiettivo di questo studio è stato quello di testare l’ipotesi che l’uso intenso di antibiotici abbia un’associazione più forte con la resistenza a livello di popolazione rispetto all’uso ampio e a basso livello di antibiotici. Abbiamo utilizzato un design ecologico per confrontare la distribuzione dell’uso di antibiotici con la resistenza agli antibiotici. Sebbene un design ecologico sia potenzialmente soggetto a confusione e non possa testare definitivamente l’effetto causale della distribuzione dell’uso sulla resistenza a livello individuale, gli studi ecologici dell’uso e della resistenza sono il design più fattibile per studiare la relazione tra l’uso di antibiotici e la resistenza a livello di popolazione, e i risultati dei design ecologici giocano un ruolo importante nello sviluppo di politiche di gestione degli antibiotici(Huttner e Samore, 2011; Schechner et al., 2013).
Per testare questa ipotesi, abbiamo innanzitutto caratterizzato la distribuzione dell’uso ambulatoriale di antibiotici in due database nazionali statunitensi di richieste di prescrizione di farmaci, Truven Health MarketScan Research Database(Truven Health Analytics, 2015) e Medicare, entrambi relativi al periodo 2011-2014. Abbiamo considerato solo la prescrizione ambulatoriale di antibiotici, che rappresenta l’80-90% del totale dell’uso medico di antibiotici nel Regno Unito e in Svezia (Public Health Agency of Sweden and National Veterinary Institute, 2015; ESPAUR Writing Committee, 2014) e si presume che rappresenti una frazione simile negli Stati Uniti (Centersfor Disease Control and Prevention, 2017). A differenza dei dati sulle vendite di antibiotici e delle indagini sanitarie a livello nazionale(Hicks et al., 2015), i dati di MarketScan e Medicare, che sono stati utilizzati in precedenza per caratterizzare le variazioni nell’uso di antibiotici(Zhang et al., 2012; Suskind et al., 2016; Owusu-Edusei et al., 2015; Arizpe et al., 2016), forniscono informazioni longitudinali sulle prescrizioni di singole persone, e possono quindi distinguere tra molte persone che ricevono poche prescrizioni e poche persone che ricevono molte prescrizioni. Abbiamo caratterizzato la distribuzione dell’uso di antibiotici negli Stati Uniti suddividendo l’uso totale annuo come la somma del primo uso annuale – il primo riempimento annuale della farmacia per un antibiotico in un anno solare – e il riempimento annuale della farmacia a ripetizione – oltre il primo riempimento individuale in un anno solare. In secondo luogo, abbiamo confrontato l’uso annuale totale di antibiotici con la resistenza agli antibiotici misurata in ResistanceOpen, un campione nazionale statunitense di rapporti di suscettibilità agli antibiotici, per il 2012-2015 (cioè in ritardo di un anno (vande Sande-Bruinsma et al., 2008; Bruyndonckx et al., 2015)), valutando la relazione tra uso e resistenza negli Stati Uniti per 72 combinazioni patogeno-antibiotici. Infine, abbiamo valutato se il primo uso annuale e l’uso ripetuto annuale sono associati in modo diverso alla resistenza a livello di popolazione.
Risultati
L’uso di antibiotici non è distribuito in modo uniforme
La nostra analisi ha incluso 99,8 milioni di prescrizioni di antibiotici per farmacie ambulatoriali tra 62,4 milioni di persone, circa il 20% della popolazione statunitense, nel periodo 2011-2014, utilizzando il database MarketScan (TruvenHealth Analytics, 2015). Nel 2011, il 34% delle persone ha ricevuto un antibiotico, e il 10% delle persone ha ricevuto il 57% di tutte le prescrizioni di antibiotici. Questa distribuzione variava a seconda della popolazione, ma era simile negli anni dei dati(Figura 1-figure supplement 1). Per caratterizzare la distribuzione di specifici antibiotici, abbiamo raggruppato le singole formulazioni generiche di antibiotici in gruppi di farmaci in base alle loro strutture chimiche e ai meccanismi d’azione(File supplementare 1 – Tabella 1). Per tutti i gruppi di farmaci, la maggior parte delle persone aveva zero prescrizioni per quell’antibiotico in un dato anno, ma gli antibiotici differivano nelle loro distribuzioni(figura 1).
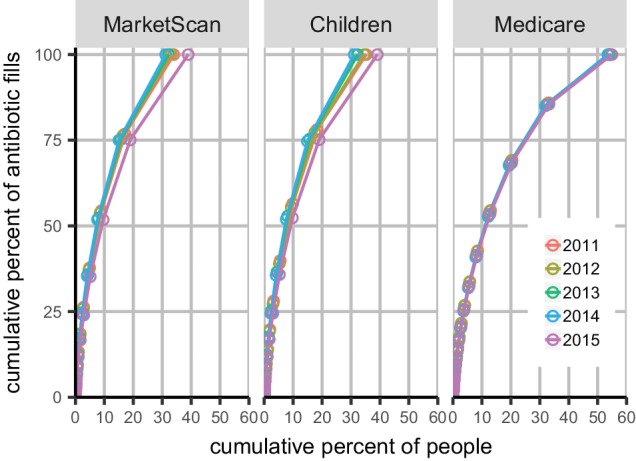
Figura 1-figura supplemento 1.La distribuzione dell’uso di antibiotici all’interno dei singoli individui.distribuzione cumulativa dell’uso di antibiotici.Le barre indicano la percentuale di membri nei dati del MarketScan con un numero diverso di riempimenti di prescrizioni nel 2011 per ciascun gruppo di farmaci. TMP/SMX: trimetoprim/sulfametossazolo.Ogni punto rappresenta un gruppo di persone con un certo numero di richieste associate per qualsiasi antibiotico, a partire da sinistra con i membri con il maggior numero di richieste. Il segmento in alto a destra mostra i membri con una richiesta di rimborso, il segmento successivo mostra i membri con due richieste di rimborso, ecc. I colori indicano gli anni dei dati. I pannelli indicano la popolazione dello studio. MarketScan: serie di dati principali. Bambini: I dati di MarketScan includono solo i membri di 15 anni e più giovani.
Abbiamo poi esaminato la distribuzione dell’uso di antibiotici per ogni gruppo di farmaci e stato USA. Per quantificare la distribuzione dell’uso di antibiotici, abbiamo etichettato ogni dichiarazione di ogni farmacia antibiotica come “prima” se si trattava del primo riempimento per quel gruppo di farmaci fatto da quell’individuo in quell’anno solare, e “ripeti” se si trattava di un secondo, terzo, ecc. riempimento per un antibiotico nello stesso gruppo di farmaci fatto dallo stesso individuo nello stesso anno solare. Le prime e ripetute richieste di rimborso di un individuo in un anno civile si sommano al numero totale di richieste di rimborso per quell’anno. Abbiamo poi suddiviso l’uso totale annuale a livello di popolazione, misurato come il riempimento della farmacia per 1000 membri all’anno, nella somma del primo uso annuale, misurato come il primo riempimento per 1000 membri all’anno, e l’uso ripetuto, misurato come il riempimento ripetuto per 1000 membri all’anno, per ogni gruppo di farmaci e stato USA. Il primo uso annuale di un gruppo di farmaci equivale alla proporzione della popolazione che assume un antibiotico in quel gruppo in quell’anno.
L’uso totale variava tra i gruppi di farmaci e tra gli stati(Figura 2). L’uso ripetuto annuale rappresentava da un quarto a un terzo dell’uso totale annuale tra farmaci e stati, con l’eccezione delle tetracicline, per le quali un uso ripetuto elevato era associato a giovani adulti(Figura 2-figure supplements 1 e 2), probabilmente per il trattamento dell’acne. Questa distribuzione del primo uso e dell’uso ripetuto è distinta dallo schema previsto dal singolo parametro Poisson e dalle distribuzioni geometriche(Figura 2), ma il rapporto tra il primo uso e l’uso ripetuto per ogni farmaco è stato quasi costante nelle regioni del Censimento degli Stati Uniti(Figura 2-figure supplement 3). Pertanto, il maggiore uso di antibiotici negli Stati del Sud(Zhang et al., 2012; Hicks et al., 2013) è attribuibile principalmente a una maggiore percentuale di persone che assumono antibiotici, non perché chi riceve antibiotici ne riceva di più.
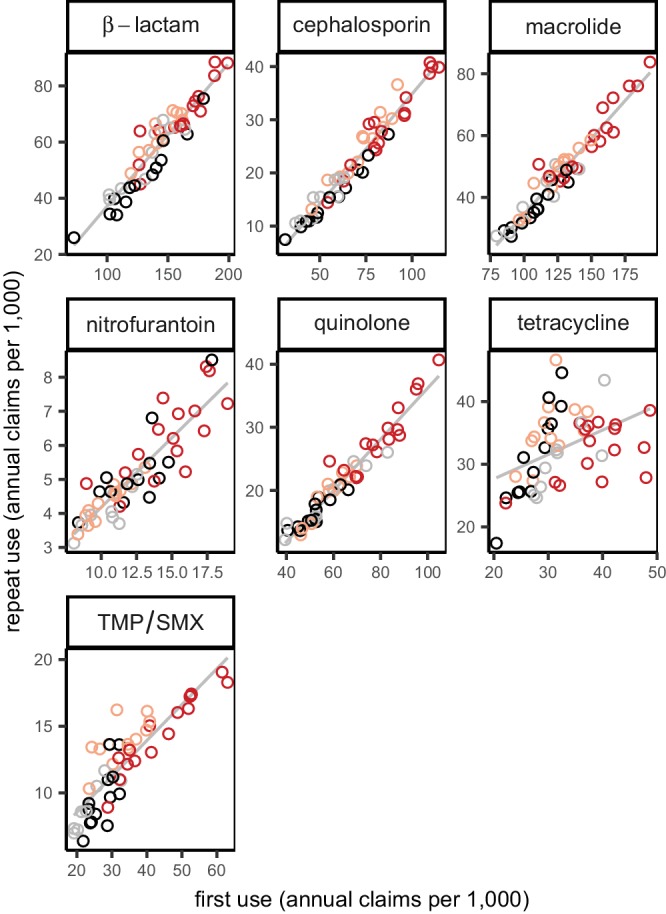
Figura 2-figure supplement 3.Distribuzione dell’uso di antibiotici negli Stati Uniti.distribuzione dell’uso di tetracicline per età.distribuzione dell’uso di antibiotici per popolazione.distribuzione dell’uso di antibiotici per regione.Ogni punto indica il primo uso e l’uso ripetuto di un singolo gruppo di farmaci in un singolo stato USA (media degli anni dei dati). I punti che cadono sulla linea nera hanno un uso tre volte superiore al primo uso rispetto all’uso ripetuto (cioè l’uso ripetuto è un quarto dell’uso totale). Le curve mostrano le relazioni tra il primo uso e l’uso ripetuto attesi dalla Poisson e le distribuzioni geometriche. TMP/SMX: trimetoprim/sulfametossazolo.I colori indicano gli anni dei dati.Ogni punto rappresenta l’uso medio di un gruppo di farmaci in uno stato attraverso gli anni dei dati. Bambini: Dati MarketScan che includono solo i membri 15 e più giovani.Ogni punto mostra l’uso di un gruppo di sostanze stupefacenti in uno stato, in media negli anni dei dati. I colori indicano la regione del censimento negli Stati Uniti (rosso, Sud; rosso chiaro, Midwest; grigio, Nord-Est; nero, Ovest). La linea mostra il miglior adattamento lineare non ponderato.

Figura 1-figure supplement 1.La distribuzione dell’uso di antibiotici all’interno degli individui.distribuzione cumulativa dell’uso di antibiotici.Le barre indicano la percentuale di membri nei dati del MarketScan con un numero diverso di riempimenti di prescrizioni nel 2011 per ciascuno dei gruppi di farmaci. TMP/SMX: trimetoprim/sulfametossazolo.Ogni punto rappresenta un gruppo di persone con un certo numero di richieste associate per qualsiasi antibiotico, a partire da sinistra con i membri con il maggior numero di richieste. Il segmento in alto a destra mostra i membri con una richiesta di rimborso, il segmento successivo mostra i membri con due richieste di rimborso, ecc. I colori indicano gli anni dei dati. I pannelli indicano la popolazione dello studio. MarketScan: serie di dati principali. Bambini: I dati di MarketScan includono solo i membri di 15 anni e più giovani.

Figura 1-figure supplement 1.Distribuzione cumulativa dell’uso di antibiotici.Ogni punto rappresenta un gruppo di persone con un certo numero di rivendicazioni associate a qualsiasi antibiotico, a partire da sinistra con i membri con il maggior numero di rivendicazioni. Il segmento in alto a destra mostra i membri con un reclamo, il segmento successivo mostra i membri con due reclami, ecc. I colori indicano gli anni dei dati. I pannelli indicano la popolazione dello studio. MarketScan: serie di dati principali. Bambini: I dati di MarketScan includono solo i membri di 15 anni e più giovani.

Figura 2-figure supplement 3.Distribuzione dell’uso di antibiotici negli Stati Uniti.distribuzione dell’uso di tetracicline per età.distribuzione dell’uso di antibiotici per popolazione.distribuzione dell’uso di antibiotici per regione.Ogni punto indica il primo uso e l’uso ripetuto di un singolo gruppo di farmaci in un singolo stato USA (media degli anni dei dati). I punti che cadono sulla linea nera hanno un uso tre volte superiore al primo uso rispetto all’uso ripetuto (cioè l’uso ripetuto è un quarto dell’uso totale). Le curve mostrano le relazioni tra il primo uso e l’uso ripetuto attesi dalla Poisson e le distribuzioni geometriche. TMP/SMX: trimetoprim/sulfametossazolo.I colori indicano gli anni dei dati.Ogni punto rappresenta l’uso medio di un gruppo di farmaci in uno stato attraverso gli anni dei dati. Bambini: Dati MarketScan che includono solo i membri 15 e più giovani.Ogni punto mostra l’uso di un gruppo di sostanze stupefacenti in uno stato, in media negli anni dei dati. I colori indicano la regione del censimento negli Stati Uniti (rosso, Sud; rosso chiaro, Midwest; grigio, Nord-Est; nero, Ovest). La linea mostra il miglior adattamento lineare non ponderato.
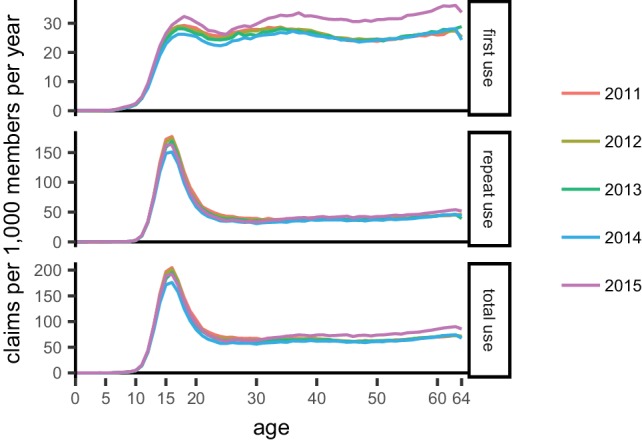
Figura 2-figure supplement 1.Distribuzione dell’uso di tetraciclina per età.I colori indicano gli anni dei dati.
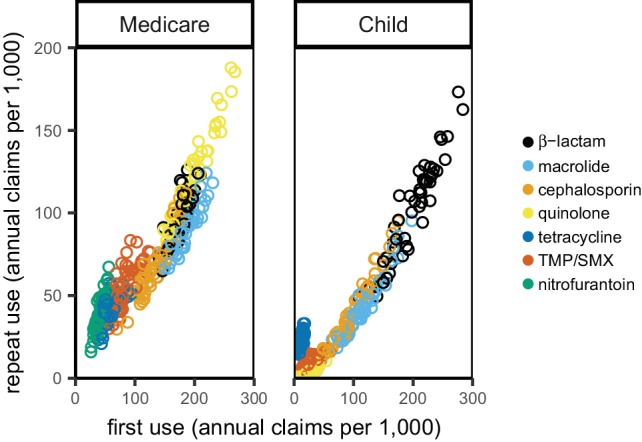
Figura 2-figure supplement 2.2. Distribuzione dell’uso di antibiotici per popolazione.Ogni punto rappresenta l’uso medio di un gruppo di farmaci in uno stato in anni di dati. Bambini: Dati MarketScan che includono solo i membri di 15 e più giovani.

Figura 2-figure supplement 3.Distribuzione dell’uso di antibiotici per regione.Ogni punto rappresenta l’uso di un gruppo di farmaci in uno stato, in media su anni di dati. I colori indicano la regione del censimento negli Stati Uniti (rosso, Sud; rosso chiaro, Midwest; grigio, Nord-Est; nero, Ovest). La linea mostra il miglior adattamento lineare non ponderato.
Paesaggio delle correlazioni tra uso totale e resistenza attraverso agenti patogeni e antibiotici
Per verificare che le nostre fonti di dati sull’uso e sulla resistenza agli antibiotici potessero essere utilizzate per distinguere le associazioni del primo uso e dell’uso ripetuto con la resistenza agli antibiotici, abbiamo prima misurato il panorama delle correlazioni di Spearman tra uso totale e resistenza agli antibiotici per più agenti patogeni e antibiotici(Goossens et al, 2005; García-Rey et al., 2002; Bronzwaer et al., 2002; Bell et al. , 2014; European Centre for Disease Prevention and Control et al., 2017; van de Sande-Bruinsma et al., 2008). Per misurare la resistenza agli antibiotici, abbiamo utilizzato ResistanceOpen, un campione nazionale statunitense di rapporti sulla suscettibilità agli antibiotici degli ospedali (MacFaddenet al., 2016), che comprendeva la resistenza di 38 agenti patogeni a 37 antibiotici in 641 rapporti sulla suscettibilità agli antibiotici di 230 organizzazioni (ospedali, laboratori e unità di sorveglianza) distribuite in 44 stati statunitensi. Sebbene la maggior parte delle organizzazioni che hanno contribuito con rapporti di suscettibilità agli antibiotici fossero ospedali, i rapporti di suscettibilità agli antibiotici degli ospedali sono orientati verso gli organismi acquisiti dalla comunità(Wang et al., 2017; Hindler and Stelling, 2007), l’uso di antibiotici da parte della comunità può guidare la resistenza agli antibiotici misurata negli ospedali(Knight et al., 2018; MacFadden et al., 2018b), e gli studi spesso confrontano i rapporti sulla suscettibilità agli antibiotici degli ospedali con l’uso di antibiotici da parte della comunità(Goossens et al., 2005; MacDougall et al., 2005; Hicks et al., 2011).
Poiché l’epidemiologia e la farmacologia di ogni combinazione di agenti patogeni e antibiotici è unica, ogni combinazione potrebbe avere una relazione unica di uso-resistenza(Turnidge e Christiansen, 2005). Abbiamo quindi aggregato la resistenza agli antibiotici negli stessi gruppi di farmaci con cui abbiamo aggregato l’uso di antibiotici(File supplementare 1 – Tabella 1) e valutato le 72 combinazioni patogeno-antibiotici che erano adeguatamente rappresentate nei dati sulla resistenza agli antibiotici (vedi Materiali e metodi). Tra queste 72 combinazioni, i coefficienti di correlazione variavano da -32% a 64% (Figura 3,File supplementare1 – Tabella 2). La correlazione più forte (Spearman’s ρ = 64%, 95% CI 41% a 80%) era tra l’uso di macrolidi e la proporzione di isolati di Streptococcus pneumoniae che erano macrolidi non suscettibili (Figura 4). I coefficienti di correlazione sono stati per lo più positivi (coefficiente di correlazione mediano 21%, IQR 8%-34%). Uso-resistenza correlazioni che coinvolgono macrolidi, chinoloni e cefalosporine erano più positivi rispetto a quelli per la nitrofurantoina, e correlazioni che coinvolgono i chinoloni erano più positivi rispetto a quelli per trimetoprim / solfametossazolo (a coppie Mann-Whitney test, a due code, FDR = 0,05). I coefficienti non erano significativamente più positivi per un particolare agente patogeno.
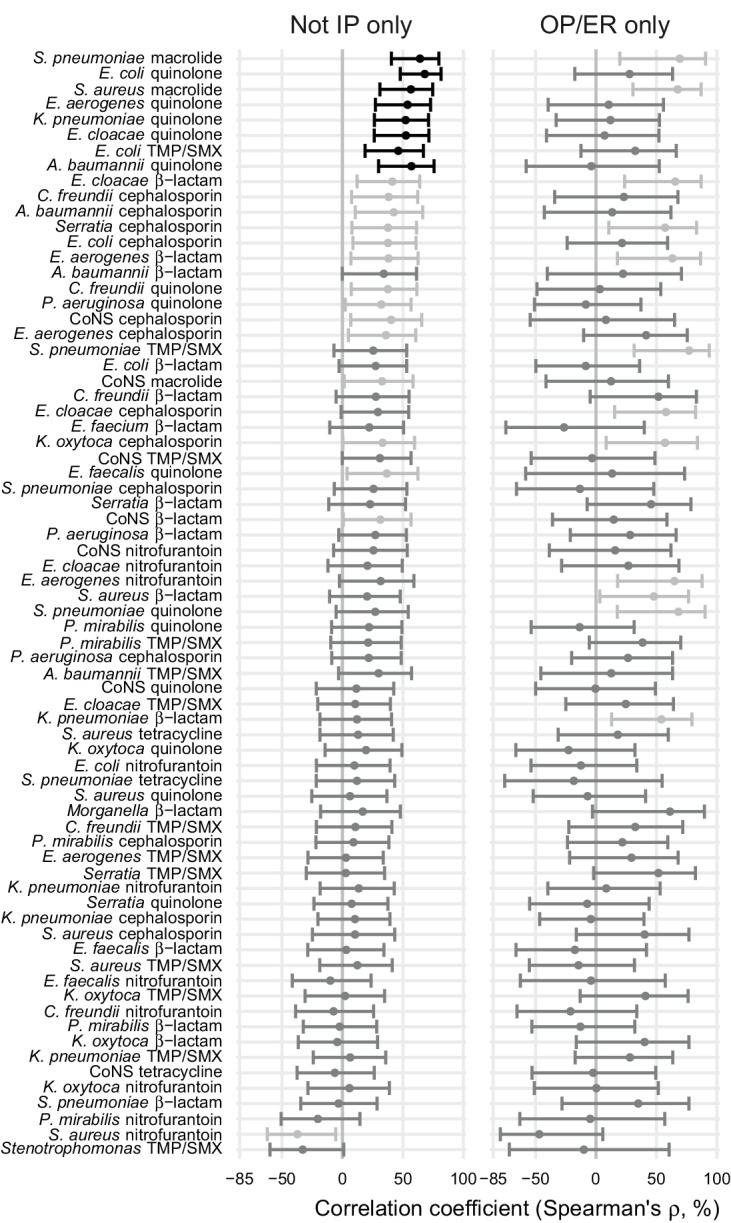
Figura 3-figure supplemento 1.Le correlazioni tra l’uso totale di antibiotici e la resistenza sono influenzate da valori positivi. dati sull’uso di antibiotici. dati sull’uso di antibiotici. dati sull’uso di antibiotici. dati sull’uso di antibiotici. dati sulla resistenza agli antibiotici.Le barre di errore mostrano intervalli di confidenza del 95%. La striscia a colori mostra visivamente i gruppi di farmaci. Il significato statistico è indicato dal colore dei punti (nero, significativo a FDR = 0,05, a due code; grigio scuro, significativo a α = 0,05, a due code; grigio chiaro, non significativo). TMP/SMX: trimetoprim/sulfametossazolo. CoNS: stafilococco coagulasi-negativo.
10.7554/eLife.39435.010Figure 3-source data 1.Antibiotic use data.Per ogni fonte di dati (MarketScan o Medicare), sottoinsieme di dati o popolazione tra i record MarketScan, stato (con ID mascherato), e il gruppo di farmaci, annuale prima e ripetute richieste di risarcimento per 1000 membri. Principale: set di dati principali. Bambini: membri al massimo 15 anni. Fornitura di giorni: il primo uso e l’uso ripetuto sono segnalati come giorni di fornitura, non come richieste di risarcimento. Pluriennale: tra i membri nei dati per tutti e quattro gli anni.Per ogni fonte di dati (MarketScan o Medicare), sottoinsieme di dati o popolazione tra i record del MarketScan, stato (con ID mascherato) e gruppo di farmaci, prima denuncia annuale e denuncia ripetuta per 1000 membri. Principale: set di dati principali. Bambini: membri al massimo 15 anni. Fornitura di giorni: il primo uso e l’uso ripetuto sono segnalati come giorni di fornitura, non come richieste di risarcimento. Pluriennale: tra i membri nei dati per tutti e quattro gli anni.
10.7554/eLife.39435.011Cifre dati a 3 fonti 2.Dati sulla resistenza agli antibiotici: per ogni gruppo di agenti patogeni e di farmaci adeguatamente rappresentato (vedi Materiali e metodi) e stato (con ID mascherato che corrisponde ai dati sull’uso di antibiotici), la proporzione di isolati raccolti in quello stato suscettibile di quel farmaco.Per ogni gruppo di agenti patogeni e farmaci adeguatamente rappresentati (vedi Materiali e metodi) e stato (con ID mascherato corrispondente ai dati sull’uso dell’antibiotico), la proporzione di isolati raccolti in quello stato sensibile a quel farmaco.Per ogni fonte di dati (MarketScan o Medicare), sottoinsieme di dati o popolazione tra i record del MarketScan, indicare (con ID mascherato) e il gruppo di farmaci, le prime richieste annuali e le richieste ripetute ogni 1000 membri. Principale: set di dati principali. Bambini: membri al massimo 15 anni. Fornitura di giorni: il primo uso e l’uso ripetuto sono segnalati come giorni di fornitura, non come richieste di risarcimento. Pluriennale: tra i membri nei dati per tutti e quattro gli anni.Per ogni gruppo di agenti patogeni e di farmaci adeguatamente rappresentato (vedi Materiali e metodi) e stato (con identificazione mascherata corrispondente ai dati sull’uso di antibiotici), la proporzione di isolati raccolti in quello stato suscettibile di quel farmaco.Le barre di errore mostrano intervalli di confidenza del 95%. La significatività statistica è indicata dal colore dei punti (nero, significativo a FDR = 0,05, a due code; grigio scuro, significativo a α = 0,05, a due code; grigio chiaro, non significativo). IP: ricoverato. OP/ER: ambulatorio/stanza di emergenza. TMP/SMX: trimetoprim/sulfametossazolo. CoNS: stafilococco coagulasi-negativo.
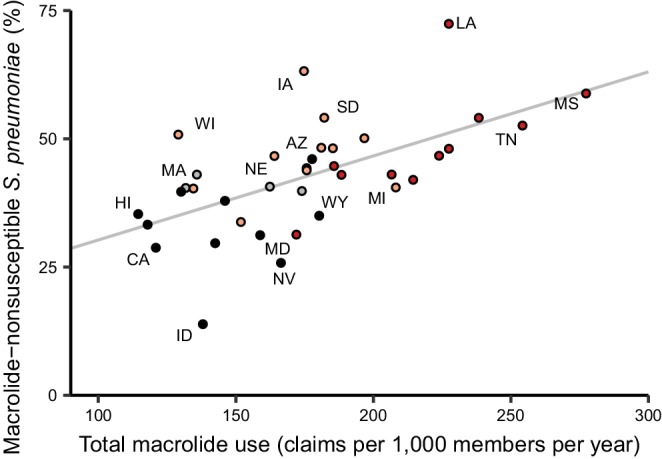
Figura 4.Figura 4. Uso totale di macrolidi e resistenza ai macrolidi tra gli Streptococcus pneumoniae correlati negli Stati Uniti.Le etichette indicano gli stati selezionati. I colori indicano la regione del censimento negli Stati Uniti (rosso, Sud; rosso chiaro, Midwest; grigio, Nord-Est; nero, Ovest). La linea mostra la migliore calzata lineare non ponderata. Gli stati del sud hanno il più alto uso di macrolidi e resistenza.
Poiché gli isolati degli adulti più anziani sono rappresentati in modo sproporzionato nei rapporti sulla suscettibilità agli antibiotici(Kanjilal et al., 2018), abbiamo sospettato che la resistenza a livello di popolazione potrebbe, in alcuni casi, correlare meglio con l’uso di antibiotici tra gli adulti più anziani. Per questo motivo abbiamo interrogato le cartelle cliniche ambulatoriali di pazienti di 65 anni e più su Medicare (vedi Materiali e metodi). Quando l’uso di antibiotici tra i beneficiari di Medicare è stato sostituito dall’uso di antibiotici come misurato nei dati del MarketScan(Figura 2-figure supplement 2), i coefficienti di correlazione erano simili (File supplementare1 – Tabelle 2 e 3). Al contrario, i bambini sono i principali portatori di alcuni agenti patogeni (ad esempio lo Streptococcus pneumoniae(García-Rodríguez e Fresnadillo Martínez, 2002)), per cui si sospetta che la resistenza possa, in altri casi, essere meglio correlata all’uso di antibiotici nei bambini. Limitando i dati sull’uso di antibiotici ai membri di età non superiore ai 15 anni(Figura 2-figure supplement 2) si sono ottenuti coefficienti simili (File supplementare1 – Tabelle 2 e 3). Pertanto, il panorama delle correlazioni che abbiamo osservato era per lo più robusto rispetto all’esatta popolazione in cui è stato misurato l’uso di antibiotici.
Abbiamo anche valutato la sensibilità dei risultati alla misurazione dell’uso di antibiotici, sostituendo la fornitura di giorni di antibiotico con il numero di riempimenti delle farmacie, e il livello geografico dell’analisi, aggregando i dati sull’uso di Medicare e i dati sulla resistenza a livello delle 306 regioni ospedaliere di riferimento che approssimano i mercati sanitari regionali(The Center for the Evaluative Clinical Sciences, Dartmouth Medical School, 1996)(File supplementare 1 – Tabelle 2 e 3). I valori assoluti dei coefficienti di correlazione erano leggermente più vicini a zero quando si utilizzano i giorni di fornitura piuttosto che i riempimenti (test Wilcoxon, a due code; differenza pseudomediana nel coefficiente di correlazione assoluto 1,9 punti percentuali, 95% CI 0,72 a 3,1) e sostanzialmente più vicini a zero quando si utilizzano le regioni di riferimento ospedaliere piuttosto che gli stati come unità di analisi (6,1 punti percentuali, 95% CI 3,0 a 9,1).
Abbiamo infine valutato la sensibilità dei risultati ai dati esatti sulla resistenza agli antibiotici(Figura 3-figure supplement 1, Supplementary file 1 – Tables 2 e 3). In primo luogo, abbiamo escluso tutti i rapporti di suscettibilità agli antibiotici le cui annotazioni indicavano l’inclusione di isolati esclusivamente dalle impostazioni dei pazienti ricoverati. La maggior parte dei rapporti include isolati da un mix di impostazioni, quindi questa analisi ha escluso solo il 7% del numero totale di isolati dai dati. In secondo luogo, abbiamo incluso solo i rapporti le cui annotazioni indicavano che gli isolati provenivano esclusivamente dalle impostazioni ambulatoriali o del pronto soccorso, che hanno conservato solo il 14% degli isolati. Le correlazioni che utilizzavano i dati di resistenza escludendo gli isolati solo in ricovero erano leggermente più forti dei dati di base (test di Wilcoxon, a due code; differenza pseudomediana nel coefficiente di correlazione assoluto 1,1 punti percentuali, 95% CI 0,01 – 2,2), ma le correlazioni calcolate utilizzando i dati solo in ricovero non erano sistematicamente più forti o più deboli.

Figura 3-figure supplemento 1.Le correlazioni tra l’uso totale di antibiotici e la resistenza sono influenzate da valori positivi.dati sull’uso di antibiotici.dati sull’uso di antibiotici.dati sull’uso di antibiotici.dati sull’uso di antibiotici.dati sulla resistenza agli antibiotici.correlazioni tra l’uso totale di antibiotici e la resistenza utilizzando sottoinsiemi dei dati sulla resistenza.Le barre di errore mostrano intervalli di confidenza del 95%. La striscia a colori mostra visivamente i gruppi di farmaci. Il significato statistico è indicato dal colore dei punti (nero, significativo a FDR = 0,05, a due code; grigio scuro, significativo a α = 0,05, a due code; grigio chiaro, non significativo). TMP/SMX: trimetoprim/sulfametossazolo. CoNS: stafilococco coagulasi-negativo.
10.7554/eLife.39435.010Figure 3-source data 1.Antibiotic use data.Per ogni fonte di dati (MarketScan o Medicare), sottoinsieme di dati o popolazione tra i record MarketScan, stato (con ID mascherato), e il gruppo di farmaci, annuale prima e ripetute richieste di risarcimento per 1000 membri. Principale: set di dati principali. Bambini: membri al massimo 15 anni. Fornitura di giorni: il primo uso e l’uso ripetuto sono segnalati come giorni di fornitura, non come richieste di rimborso. Pluriennale: tra i membri nei dati per tutti e quattro gli anni.Per ogni fonte di dati (MarketScan o Medicare), sottoinsieme di dati o popolazione tra i record del MarketScan, stato (con ID mascherato) e gruppo di farmaci, prima denuncia annuale e denuncia ripetuta per 1000 membri. Principale: set di dati principali. Bambini: membri al massimo 15 anni. Fornitura di giorni: il primo uso e l’uso ripetuto sono segnalati come giorni di fornitura, non come richieste di rimborso. Pluriennale: tra i membri nei dati per tutti e quattro gli anni.
10.7554/eLife.39435.011Cifre dati a 3 fonti 2.Dati sulla resistenza agli antibiotici: per ogni gruppo di agenti patogeni e di farmaci adeguatamente rappresentato (vedi Materiali e metodi) e stato (con ID mascherato corrispondente ai dati sull’uso di antibiotici), la proporzione di isolati raccolti in quello stato suscettibile di quel farmaco.Per ogni gruppo di agenti patogeni e farmaci adeguatamente rappresentati (vedi Materiali e metodi) e stato (con ID mascherato corrispondente ai dati sull’uso dell’antibiotico), la proporzione di isolati raccolti in quello stato sensibile a quel farmaco.Per ogni fonte di dati (MarketScan o Medicare), sottoinsieme di dati o popolazione tra i record del MarketScan, indicare (con ID mascherato) e il gruppo di farmaci, le prime richieste annuali e le richieste ripetute ogni 1000 membri. Principale: set di dati principali. Bambini: membri al massimo 15 anni. Fornitura di giorni: il primo uso e l’uso ripetuto sono segnalati come giorni di fornitura, non come richieste di rimborso. Pluriennale: tra i membri nei dati per tutti e quattro gli anni.Per ogni gruppo di agenti patogeni e di farmaci adeguatamente rappresentato (vedi Materiali e metodi) e stato (con identificazione mascherata corrispondente ai dati sull’uso di antibiotici), la proporzione di isolati raccolti in quello stato suscettibile di quel farmaco.Le barre di errore mostrano intervalli di confidenza del 95%. La significatività statistica è indicata dal colore dei punti (nero, significativo a FDR = 0,05, a due code; grigio scuro, significativo a α = 0,05, a due code; grigio chiaro, non significativo). IP: ricoverato. OP/ER: ambulatorio/stanza di emergenza. TMP/SMX: trimetoprim/sulfametossazolo. CoNS: stafilococco coagulasi-negativo.

Figura 3-figure supplement 1.Correlazioni tra l’uso totale di antibiotici e la resistenza utilizzando sottoinsiemi dei dati sulla resistenza.Le barre di errore mostrano intervalli di confidenza del 95%. Significato statistico è indicato dal colore dei punti (nero, significativo a FDR = 0,05, a due code; grigio scuro, significativo a α = 0,05, a due code; grigio chiaro, non significativo). IP: ricoverato. OP/ER: ambulatorio/stanza di emergenza. TMP/SMX: trimetoprim/sulfametossazolo. CoNS: stafilococco coagulasi-negativo.

Figura 4.Figura 4. Uso totale di macrolidi e resistenza ai macrolidi tra gli Streptococcus pneumoniae correlati negli Stati Uniti.Le etichette indicano gli stati selezionati. I colori indicano la regione del censimento negli Stati Uniti (rosso, Sud; rosso chiaro, Midwest; grigio, Nord-Est; nero, Ovest). La linea mostra la migliore calzata lineare non ponderata. Gli stati del sud hanno il più alto uso di macrolidi e resistenza.
Mancanza di prove di un’associazione più positiva con l’uso ripetuto
Dopo aver esaminato il panorama delle relazioni tra l’uso totale e la resistenza attraverso combinazioni patogeno-antibiotico, ci siamo proposti di testare l’ipotesi che l’uso ripetuto abbia un’associazione più forte con la resistenza rispetto al primo uso. Per ogni combinazione patogeno-antibiotico, abbiamo eseguito una regressione multipla che prevede una proporzione non sensibile dal primo uso e dall’uso ripetuto(Figura 5). Il primo uso e l’uso ripetuto sono altamente correlati in alcuni casi(file supplementare 1 – Tabella 4), il che amplierà gli intervalli di confidenza sui coefficienti di regressione, ma non dovrebbe introdurre distorsioni(Schisterman et al., 2017). I coefficienti di regressione per il primo utilizzo sono stati più spesso positivi che negativi (54 su 72 [75%]; test binomiale, 95% CI 63% a 84%). Cioè, il primo uso è stato associato positivamente alla resistenza quando si è controllato per l’uso ripetuto. Al contrario, i coefficienti di regressione per l’uso ripetuto erano più spesso negativi che positivi (44 su 72 [61%]; test binomiale, 95% CI 49% a 72%). Cioè, l’uso ripetuto è stato associato negativamente alla resistenza durante il controllo per il primo uso.
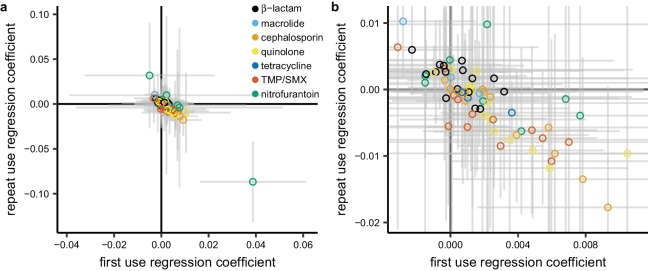
Figura 5.L’uso ripetuto tende ad essere associato negativamente alla resistenza quando si controlla per il primo uso.Ogni punto rappresenta una combinazione di agenti patogeni e antibiotici. La posizione del punto mostra i due coefficienti della regressione multipla. Le unità dei coefficienti sono proporzionalmente resistenti per ogni rivendicazione annuale per 1000 persone. Il colore indica il gruppo di farmaci. Le barre di errore mostrano il 95% di IC.a) Tutti i dati.(b) Stessi dati, che mostrano solo il gruppo centrale di punti.
Abbiamo valutato la sensibilità di questo risultato alla fascia d’età, alla fonte dei dati, alla metrica dell’uso di antibiotici, all’unità geografica di analisi e al sottoinsieme dei dati sulla resistenza come descritto sopra. In tutti i casi, i coefficienti di regressione per il primo uso nella regressione multipla hanno avuto più probabilità di essere positivi che negativi, e i coefficienti di regressione per l’uso ripetuto hanno avuto più probabilità di essere negativi che positivi in tutti i casi tranne uno(File supplementare 1 – Tabella 5). Per alcuni agenti patogeni e antibiotici, la resistenza potrebbe presumibilmente accumularsi in un individuo per molti anni(Carothers et al., 2007; McMahon et al., 2003), quindi abbiamo anche calcolato misure alternative di primo e secondo uso considerando solo gli individui che sono stati inclusi nei dati del MarketScan per ogni anno del 2011-2014, e abbiamo etichettato un riempimento antibiotico come primo uso solo se è stato il primo riempimento per quel gruppo di farmaci fatto da quell’individuo nell’intero periodo di 4 anni. In tale analisi, una proporzione simile dei coefficienti di regressione per il primo uso è risultata positiva (69%, 95% CI 57% – 80%) e i coefficienti di regressione per l’uso ripetuto sono risultati ugualmente positivi o negativi (53%, 95% CI 41% – 65%).

Figura 5.L’uso ripetuto tende ad essere associato negativamente alla resistenza quando si controlla per il primo uso.Ogni punto rappresenta una combinazione di agenti patogeni e antibiotici. La posizione del punto mostra i due coefficienti della regressione multipla. Le unità dei coefficienti sono proporzionalmente resistenti per ogni rivendicazione annuale per 1000 persone. Il colore indica il gruppo di farmaci. Le barre di errore mostrano il 95% di IC.a) Tutti i dati.(b) Stessi dati, che mostrano solo il gruppo centrale di punti.
Discussione
Paesaggio delle relazioni di uso-resistenza
Per analizzare le relazioni tra l’uso di antibiotici e la resistenza, abbiamo utilizzato set di dati nazionali statunitensi che misurano l’uso di antibiotici in 60 milioni di individui e la resistenza agli antibiotici in 3 milioni di isolati batterici per analizzare le relazioni tra l’uso di antibiotici e la resistenza, esaminando 72 combinazioni di agenti patogeni e antibiotici contemporaneamente, utilizzando fonti di dati e metodi analitici identici tra le varie combinazioni. Sebbene studi precedenti abbiano esaminato combinazioni multiple di agenti patogeni e antibiotici, di solito non vengono presi in considerazione più di cinque agenti patogeni o antibiotici contemporaneamente(Goossens et al., 2005; García-Rey et al., 2002; van de Sande-Bruinsma et al., 2008). Abbiamo scoperto che le correlazioni tra l’uso totale e la resistenza erano per lo più positive e che alcuni farmaci tendevano ad avere correlazioni più positive, ma che non c’era un chiaro schema per organismo (Bellet al., 2014). Il panorama complessivo delle correlazioni era per lo più robusto rispetto alle fasce d’età studiate, al sottoinsieme dei dati di resistenza utilizzati e alla scala geografica dell’analisi, anche se le correlazioni erano un po’ più deboli quando si conducevano analisi a scale geografiche più piccole(van de Sande-Bruinsma et al., 2008; Priest et al., 2001; Magee et al., 1999; Livermore et al., 2000). Abbiamo utilizzato l’uso ambulatoriale di antibiotici come predittore di resistenza perché l’80-90% dell’uso di antibiotici avviene in ambito ambulatoriale (Centersfor Disease Control and Prevention, 2017) e perché la maggior parte della pressione antibiotica sugli agenti patogeni è dovuta alla “selezione degli astanti”, in cui il paziente viene trattato per qualche motivo diverso da un’infezione causata da quell’agente patogeno (Tedijanto et al.,2018).
Le correlazioni che abbiamo osservato tra l’uso totale di antibiotici e la resistenza agli antibiotici in tutta la popolazione erano notevolmente più deboli rispetto a quelle di studi europei altamente citati, ma paragonabili a quelle di altre analisi di dati europei. Ad esempio, per S. pneumoniae e macrolidi, Goossens et al. (2005) hanno riportato una ρ di Spearman dell’83% e García-Rey et al. (2002) ha riportato l’85%, mentre abbiamo trovato il 62% e van de Sande-Bruinsma et al. (2008) ha riportato una mediana del 56%. Tutti questi studi hanno utilizzato metodi statistici simili, quindi le differenze nei risultati devono essere dovute ad alcuni altri fattori (ad esempio la qualità dei dati, la gamma di utilizzo degli antibiotici, la distribuzione dell’uso degli antibiotici o la biologia degli agenti patogeni). Le correlazioni tra la resistenza all’E. coli e l’uso di β-lattami, cefalosporine, trimetoprim/sulfametossazolo e chinoloni erano simili a quelle riportate negli studi sull’uso e la resistenza nei gruppi di cura primaria del Regno Unito (Priestet al., 2001; Magee et al., 1999).
La differenza più notevole, tuttavia, tra il nostro studio e i precedenti risultati ottenuti in Europa è per S. pneumoniae e β-lactami: Goossens et al. (2005) riportano una ρ di Spearman dell’84%, ma non abbiamo trovato alcuna relazione (-11%, 95% CI -41% al 22%). Proponiamo che la stretta variazione nell’uso del β-lattame negli Stati Uniti, circa il doppio tra gli Stati che utilizzano il più alto e il più basso, oscuri una correlazione che è più evidente in Europa, dove c’è una variazione quadrupla tra i paesi che utilizzano il più alto e il più basso (Goossenset al., 2005). Pertanto, i nostri risultati e quelli di Goossens et al. possono essere coerenti con la biologia sottostante. Notiamo anche che, riproducendo la metodologia di uno studio statunitense(Hicks et al., 2011) del rapporto uso-resistenza per i β-lactami e S. pneumoniae ( stati dicotomizzati come alti o bassi e calcolando il rapporto delle probabilità di resistenza), troviamo una stima puntuale coerente ma con intervalli di confidenza più ampi (1,15, 95% CI 0,75 a 1,76).
Il nostro progetto di studio può limitare l’interpretabilità del paesaggio delle relazioni tra uso e resistenza. In primo luogo, come i principali studi europei che utilizzano EARS-Net e gli studi statunitensi che utilizzano i Centri per il controllo delle malattie e la prevenzione della sorveglianza del nucleo batterico attivo, confrontiamo l’uso ambulatoriale di antibiotici in tutta la popolazione con i rapporti di suscettibilità agli antibiotici degli ospedali. Si discute il grado in cui i rapporti di suscettibilità agli antibiotici degli ospedali rappresentano le infezioni della comunità(Wang et al., 2017; MacDougall et al., 2005). Ad esempio, se l’uso ambulatoriale di antibiotici seleziona la resistenza tra le infezioni contratte in comunità e gli antibiogrammi ospedalieri riflettono i dati delle infezioni contratte in comunità e dei modelli di resistenza non correlati ai pazienti ricoverati, allora le correlazioni che misuriamo sarebbero influenzate da associazioni più deboli. Inoltre, l’uso di antibiotici e la resistenza nel contesto della comunità non è completamente indipendente dall’uso e dalla resistenza nel contesto ospedaliero(Knight et al., 2018), e il nostro approccio non tiene conto di alcuna relazione tra i due.
In secondo luogo, la resistenza agli antibiotici è dinamica nel tempo e il nostro approccio trasversale presuppone che l’uso degli antibiotici sia autocorrelato nel corso degli anni(Lipsitch, 2001) o che la resistenza cambi lentamente (Hennessyet al., 2002). Se l’uso provoca resistenza, e l’uso e la resistenza cambiano significativamente nel corso dello studio, allora le correlazioni che abbiamo misurato aggregando nel corso di tutti gli anni sarebbero influenzate da associazioni più deboli.
In terzo luogo, a causa dei limiti del potere statistico, non abbiamo considerato la possibilità che l’uso di un antibiotico possa essere scelto per la resistenza a un altro antibiotico(Pouwels et al., 2018; Weber et al., 2003). In particolare, l’uso di un antibiotico può essere scelto per la resistenza ad un altro antibiotico se i cloni dominanti di quella specie sono resistenti ad entrambi(Pouwels et al., 2018). In tal caso, se i tassi di utilizzo dei due farmaci sono correlati tra gli stati, allora la relazione apparente tra un farmaco e la resistenza a quel farmaco sarebbe influenzata verso l’alto. Inoltre, poiché la tavolozza dell’uso di antibiotici varia a seconda del paese(Van Boeckel et al., 2014) e diversi ceppi patogeni circolano in popolazioni diverse, le associazioni univariate che abbiamo osservato tra l’uso di un antibiotico e la resistenza a quell’antibiotico negli Stati Uniti potrebbero non essere applicabili in altre geografie.
Infine, come in altri studi sull’uso di antibiotici, non abbiamo affrontato il problema dell’aderenza del paziente, e gli approcci tipici per affrontare il problema dell’aderenza utilizzando i dati dei claim(Steiner e Prochazka, 1997) sono problematici quando la durata prevista del trattamento non è chiara. La correlazione misurata sarebbe quindi falsata se, ad esempio, una scarsa aderenza del paziente aumentasse la resistenza e l’aderenza del paziente fosse anche correlata all’uso di antibiotici.
Distribuzione dell’uso di antibiotici e della resistenza agli antibiotici
Abbiamo descritto la distribuzione dell’uso di antibiotici tra i gruppi di farmaci e gli Stati Uniti, trovando che il 34% della popolazione dello studio ha assunto un antibiotico in un anno, e il 10% della popolazione ha avuto il 57% dei riempimenti di antibiotici in quell’anno, in modo simile ai risultati del Regno Unito(Shallcross et al., 2017), anche se questa distribuzione variava a seconda della popolazione(Figura 1-figure supplement 1). Suddividendo l’uso totale annuale in primo uso annuale e uso annuale ripetuto, siamo stati in grado di mostrare che, per ogni farmaco, il primo uso annuale costituisce la maggior parte dell’uso totale annuale e che le variazioni nel primo uso annuale spiegano più variazioni nell’uso totale annuale che non le variazioni nell’uso annuale ripetuto. Abbiamo anche scoperto che il primo uso tende ad avere un’associazione positiva con la resistenza quando si controlla per l’uso ripetuto, mentre l’uso ripetuto tende ad avere associazioni negative con la resistenza quando si controlla per il primo uso. Questo risultato è stato ottenuto attraverso le analisi di sensibilità.
Se queste associazioni sono causali, cioè se l’uso ambulatoriale e l’uso ripetuto di antibiotici selezionano per la resistenza tra gli agenti patogeni acquisiti dalla comunità, i nostri risultati implicherebbero che la resistenza agli antibiotici nell’ambiente ambulatoriale è dovuta più al primo uso, che tende ad avere associazioni positive con la resistenza, che all’uso ripetuto. A differenza delle proposte di concentrarsi su utilizzatori intensivi di antibiotici per combattere la resistenza(Shallcross et al., 2017), questa situazione implicherebbe che la prevenzione di prescrizioni marginali tra pazienti le cui indicazioni sono borderline appropriate o inappropriate per gli antibiotici potrebbe essere la tattica più efficace per ridurre la prevalenza dei meccanismi di resistenza già stabiliti negli Stati Uniti.
Vi sono limiti all’interpretabilità di questi risultati. In primo luogo, come già detto, vi è un potenziale disallineamento tra le fonti dell’uso di antibiotici e i dati sulla resistenza agli antibiotici.
In secondo luogo, sebbene l’uso di antibiotici sia uno dei principali motori della resistenza agli antibiotici, i risultati osservati potrebbero non essere causali. Fattori che vanno oltre l’uso di antibiotici, come la densità della popolazione, giocano un ruolo nella resistenza agli antibiotici(Harbarth e Samore ,2005; MacFadden et al., 2018a). Anche se l’uso di antibiotici e la resistenza sono causalmente correlati, può essere che la resistenza influisca sull’uso di antibiotici. Ad esempio, se la resistenza a un farmaco è elevata, è più probabile che il trattamento con quel farmaco fallisca, scoraggiando l’uso ripetuto, in modo che un’elevata resistenza porti a una diminuzione dell’uso ripetuto(Wang et al., 2017; Priest et al., 2001; Pouwels et al., 2018). Studi ecologici come questo non affrontano direttamente la causalità, ed è necessario un ulteriore lavoro per distinguere i diversi percorsi causali.
In terzo luogo, le relazioni osservate a livello di popolazione tra l’uso di antibiotici e la resistenza non devono necessariamente valere anche per la relazione tra il primo e il ripetuto uso di antibiotici da parte di un individuo e il rischio di un’infezione resistente in quell’individuo. Qualsiasi confronto tra i nostri risultati a livello di popolazione e gli studi a livello individuale dovrebbe tenere conto della differenza tra le nostre misure a livello di popolazione del primo e del secondo uso di antibiotici e la tempistica individuale dell’uso di antibiotici e delle misure di resistenza.
In quarto luogo, il controllo dei fattori che vanno oltre l’uso di antibiotici potrebbe alterare l’apparente relazione tra uso di antibiotici e resistenza. In particolare, ipotizziamo che il controllo per la morbilità del paziente, che non abbiamo affrontato in questa analisi a livello di popolazione, amplificherebbe il risultato osservato, che il primo uso tende ad avere un’associazione più positiva con la resistenza agli antibiotici rispetto all’uso ripetuto. Ci aspettiamo che gli individui morbosi abbiano un uso ripetuto di antibiotici più frequente. Ci aspettiamo anche che gli individui morbosi visitino più spesso l’ospedale, ponendoli a più alto rischio di infezioni resistenti agli antibiotici indipendentemente dal loro uso di antibiotici. Pertanto, ipotizziamo che l’uso ripetuto provochi resistenza e sia anche un fattore predittivo della morbilità, che è associata alla resistenza. L’incapacità di controllare la morbilità, quindi, condiziona l’associazione tra l’uso ripetuto e la resistenza verso valori più positivi. Al contrario, il controllo della morbilità ridurrebbe le relazioni misurate tra uso ripetuto e resistenza, amplificando il nostro risultato centrale.
In quinto luogo, abbiamo definito il primo uso e l’uso ripetuto rispetto all’anno solare, mentre può essere che qualche altro lasso di tempo sia quello appropriato per questa analisi. Anche se il nostro risultato centrale è stato mantenuto quando abbiamo ridefinito il primo uso e l’uso ripetuto rispetto ad un periodo di 4 anni(File supplementare 1 – Tabella 5), può essere che, ad esempio, l’uso ripetuto all’interno di un individuo su una scala temporale più breve di un anno sia un importante fattore determinante per il rischio di resistenza in quell’individuo. Il nostro studio non distingue tra uso ripetuto che si verifica oltre i confini dell’anno solare, che è presumibilmente importante per mettere in relazione l’uso di antibiotici da parte degli individui con il loro rischio di resistenza.
Infine, notiamo che il primo uso e l’uso ripetuto sono solo un insieme di molti modi per misurare la distribuzione dell’uso di antibiotici. Ad esempio, 10 usi ripetuti potrebbero significare 1 persona con 10 usi ripetuti o 10 persone con 1 uso ripetuto ciascuna. La metrica del primo uso e quella dell’uso ripetuto non sono in grado di distinguere tra questi due casi, e può darsi che qualche altra misura della distribuzione dell’uso di antibiotici dia risultati diversi.
In conclusione, troviamo che l’uso di antibiotici a livello di popolazione e la resistenza a livello di popolazione sembra essere più strettamente legata a un uso ampiamente distribuito e a bassa intensità piuttosto che all’intensità dell’uso. In definitiva, modelli accurati che prevedano l’emergere e la diffusione della resistenza agli antibiotici richiederanno una caratterizzazione più attenta di chi ottiene quale antibiotico(Harbarth et al., 2001), quale pressione di selezione che pone sugli agenti patogeni, come questi vengono trasmessi e in chi si manifestano come infezioni(Lipsitch e Samore, 2002). Uno studio ideale sarebbe quello di confrontare la storia completa dell’esposizione ad antibiotici ambulatoriali e ospedalieri di un individuo con i dati microbiologici clinici dello stesso individuo, con riferimenti incrociati con fattori a livello di popolazione, tra un campione rappresentativo di individui a livello nazionale. I risultati a livello individuale potrebbero poi essere confrontati anche con modelli meccanicistici di resistenza per trarre inferenze sugli effetti dell’uso di antibiotici all’interno dell’ospedale(Levin et al., 1997; Colijn et al., 2010), e si potrebbe affrontare il ruolo di una resistenza coesistente e dell’uso correlato di antibiotici. In assenza di un tale set di dati, questi risultati ecologici e associativi forniscono una guida allo sviluppo di una politica di gestione degli antibiotici.
Materiali e metodi
Studiare la popolazione e l’uso di antibiotici
I dati MarketScan(Truven Health Analytics, 2015) relativi al periodo 2011-2014 sono stati utilizzati per identificare i membri del piano assicurativo e caratterizzare il loro uso ambulatoriale di antibiotici. Per garantire la qualità dei dati di distribuzione dell’uso di antibiotici, sono stati inclusi solo i membri che hanno fatto parte del loro piano assicurativo per 12 mesi durante un determinato anno civile. Le prescrizioni per gli antibiotici per via orale e iniettati sono state identificate mediante la formulazione generica(fascicolo supplementare 1 – Tabella 6) e i moduli dei farmaci(fascicolo supplementare 1 – Tabella 7). Abbiamo trattato più richieste nello stesso giorno per la stessa formulazione generica con lo stesso codice di ricarica come un unico riempimento di prescrizione. Nell’analisi principale, l’uso di antibiotici è stato misurato utilizzando riempimenti, piuttosto che giorni di fornitura del farmaco, perché alcune ricerche precedenti hanno suggerito che le prescrizioni sono meglio correlate con la resistenza(Bruyndonckx et al., 2015) e che questa scelta probabilmente non è dannosa(van de Sande-Bruinsma et al., 2008; Lipsitch, 2001). I farmaci generici sono stati raggruppati in gruppi di farmaci antibiotici progettati per corrispondere ai gruppi di farmaci antibiotico-resistenza descritti di seguito(File supplementare 1 – Tabella 1). Tutte le misure dell’uso di antibiotici sono state calcolate per ogni anno dal 2011 al 2014, e la media di ogni valore nei 4 anni è stata riportata e utilizzata nelle analisi del rapporto uso-resistenza.
L’uso di antibiotici tra i beneficiari di Medicare è stato misurato come descritto in precedenza(Olesen et al., 2018). In breve, abbiamo considerato i beneficiari a pagamento di almeno 65 anni tra e con 12 mesi di iscrizione a Medicare Parte B e Parte D su un campione del 20% di beneficiari per ogni anno dal 2011 al 2014. I dati Medicare, che fornisce il codice di avviamento postale per ogni beneficiario, sono stati aggregati anche a livello di regione di riferimento ospedaliero(The Center for the Evaluative Clinical Sciences, Dartmouth Medical School, 1996), utilizzando il codice di avviamento postale 2011 per il passaggio a livello regionale. I dati del MarketScan non includono la risoluzione a livello di codice postale.
Questo studio è stato ritenuto esente da revisione da parte del comitato di revisione istituzionale della Harvard T. H. Chan School of Public Health.
Resistenza agli antibiotici
Le prevalenze di resistenza agli antibiotici per i comuni patogeni batterici sono state identificate da ResistanceOpen, un database sviluppato in precedenza di modelli di resistenza agli antibiotici localizzati nello spazio(MacFadden et al., 2016). Questo database, continuamente aggiornato, contiene dati sulla resistenza agli antibiotici provenienti da fonti online nel periodo 2012-2015. Al momento dell’analisi, i dati sulla resistenza consistevano in circa 86.000 record, ciascuno dei quali indicava la frazione di isolati di un organismo non suscettibile di un particolare farmaco in un particolare rapporto di suscettibilità agli antibiotici (“antibiogramma”). Il numero mediano di isolati corrispondente a ciascun record era di 93, ma i record avevano fino a 75.000 isolati associati. Sette record (<0,01%) con un numero di isolati mancanti sono stati esclusi. Negli antibiogrammi che separavano S. aureus in MRSA e MSSA, la resistenza dell’aggregato S. aureus ai singoli farmaci è stata presa come media dei record MRSA e MSSA, ponderata per il numero di isolati. MRSA e MSSA non sono stati considerati come specie separate in nessuna analisi.
Gli antibiotici utilizzati nei saggi di resistenza agli antibiotici sono stati raggruppati in gruppi di farmaci antibiotici(File supplementare 1 – Tabella 1) progettati per corrispondere ai gruppi di utilizzo degli antibiotici. Se la resistenza a più di un antibiotico in un gruppo di farmaci è stata riportata per un particolare agente patogeno in un particolare antibiogramma, la resistenza a quel gruppo di farmaci per quell’agente patogeno in quell’antibiogramma è stata calcolata come media delle resistenze misurate per gli antibiotici di quel gruppo, ponderata per il numero di isolati. La proporzione di isolati non suscettibili in uno stato per una particolare combinazione patogeno-antibiotico è stata calcolata come la media delle proporzioni di ogni antibiogramma che ha contribuito in quello stato, ponderata per il numero di isolati.
Metodi statistici
L’uso di antibiotici e la resistenza sono stati confrontati utilizzando correlazioni Spearman e regressioni lineari multiple. Delle 887 combinazioni patogeno-antibiotici presenti nei dati, abbiamo analizzato le 72 combinazioni presenti in almeno 34 stati. Ciò ha escluso il 21% delle combinazioni patogeno-antibiotico-antibiogramma. Abbiamo stabilito il cut-off per il numero di stati perché l’80% della potenza per rilevare un coefficiente di correlazione di Pearson di magnitudine 0,55 a α = 0,01 in un’ipotesi a due facce richiede almeno 34 campioni. Non esiste una metodologia di calcolo della potenza semplice per le correlazioni di Spearman, quindi abbiamo usato il calcolo della potenza di Pearson come approssimazione. Abbiamo aggregato i dati di tutti gli anni, piuttosto che confrontare l’uso e la resistenza in ogni anno, a causa della scarsità dei dati sulla resistenza: di 2767 combinazioni di patogeni e stati antibiotici nei dati, solo 182 hanno dati per tutti e 4 gli anni. Nessuna combinazione patogeno-antibiotico aveva più di 4 stati con dati per tutti i 4 anni. Gli intervalli di fiducia sui coefficienti di correlazione sono stati calcolati utilizzando il metodo di trasformazione di Fisher e il metodo di approssimazione normale. Sono stati effettuati confronti multipli utilizzando il tasso di falsa scoperta (FDR) di Benjamini-Hochberg(Benjamini e Hochberg, 1995). Le regressioni multiple hanno previsto la proporzione di isolati non suscettibili di essere scoperti dal primo uso e dall’uso ripetuto.
References
- Arason VA, Kristinsson KG, Sigurdsson JA, Stefánsdóttir G, Mölstad S, Gudmundsson S. Do antimicrobials increase the carriage rate of penicillin resistant pneumococci in children? Cross sectional prevalence study. BMJ. 1996; 313:387-391. DOI | PubMed
- Arizpe A, Reveles KR, Aitken SL. Regional variation in antibiotic prescribing among medicare part D enrollees, 2013. BMC Infectious Diseases. 2016; 16DOI | PubMed
- Bell BG, Schellevis F, Stobberingh E, Goossens H, Pringle M. A systematic review and meta-analysis of the effects of antibiotic consumption on antibiotic resistance. BMC Infectious Diseases. 2014; 14DOI | PubMed
- Benjamini Y, Hochberg Y. Controlling the False Discovery Rate: A Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society. 1995; 57:289-300. DOI
- Berrington A. Antimicrobial prescribing in hospitals: be careful what you measure. Journal of Antimicrobial Chemotherapy. 2010; 65:163-168. DOI | PubMed
- Bronzwaer SL, Cars O, Buchholz U, Mölstad S, Goettsch W, Veldhuijzen IK, Kool JL, Sprenger MJ, Degener JE, European Antimicrobial Resistance Surveillance System. A European study on the relationship between antimicrobial use and antimicrobial resistance. Emerging Infectious Diseases. 2002; 8:278-282. DOI | PubMed
- Bruyndonckx R, Hens N, Aerts M, Goossens H, Cortiñas Abrahantes J, Coenen S. Exploring the association between resistance and outpatient antibiotic use expressed as DDDs or packages. Journal of Antimicrobial Chemotherapy. 2015; 70:1241-1244. DOI | PubMed
- Carothers JJ, Bruce MG, Hennessy TW, Bensler M, Morris JM, Reasonover AL, Hurlburt DA, Parkinson AJ, Coleman JM, McMahon BJ. The relationship between previous fluoroquinolone use and levofloxacin resistance in Helicobacter pylori infection. Clinical Infectious Diseases. 2007; 44:e5-e8. DOI | PubMed
- Catry B, Latour K, Bruyndonckx R, Diba C, Geerdens C, Coenen S. Characteristics of the antibiotic regimen that affect antimicrobial resistance in urinary pathogens. Antimicrobial Resistance & Infection Control. 2018; 7DOI | PubMed
- Centers for Disease Control and Prevention. Measuring Outpatient Antibiotic Prescribing. 2017. Publisher Full Text
- Colijn C, Cohen T, Fraser C, Hanage W, Goldstein E, Givon-Lavi N, Dagan R, Lipsitch M. What is the mechanism for persistent coexistence of drug-susceptible and drug-resistant strains of Streptococcus pneumoniae?. Journal of the Royal Society Interface. 2010; 7:905-919. DOI | PubMed
- Costelloe C, Metcalfe C, Lovering A, Mant D, Hay AD. Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis. BMJ. 2010; 340:c2096. DOI | PubMed
- The Center for the Evaluative Clinical Sciences, Dartmouth Medical School. TheDartmouthAtlasofHealth Care. American Hospital Publishing, Inc.; 1996. Publisher Full Text
- Enzler MJ, Berbari E, Osmon DR. Antimicrobial prophylaxis in adults. Mayo Clinic Proceedings. 2011; 86:686-701. DOI | PubMed
- European Centre for Disease Prevention and Control, European Food Safety Authority, European Medicines Agency. ECDC/EFSA/EMA second joint report on the integrated analysis of the consumption of antimicrobial agents and occurrence of antimicrobial resistance in bacteria from humans and food‐producing animals. EFSA Journal. 2017; 15DOI
- García-Rey C, Aguilar L, Baquero F, Casal J, Dal-Ré R. Importance of local variations in antibiotic consumption and geographical differences of erythromycin and penicillin resistance in Streptococcus pneumoniae. Journal of Clinical Microbiology. 2002; 40:159-164. DOI | PubMed
- García-Rodríguez JA, Fresnadillo Martínez MJ. Dynamics of nasopharyngeal colonization by potential respiratory pathogens. Journal of Antimicrobial Chemotherapy. 2002; 50:59-74. DOI | PubMed
- Goossens H, Ferech M, Vander Stichele R, Elseviers M, ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance: a cross-national database study. The Lancet. 2005; 365:579-587. DOI | PubMed
- Gould IM. A review of the role of antibiotic policies in the control of antibiotic resistance. Journal of Antimicrobial Chemotherapy. 1999; 43:459-465. DOI | PubMed
- Harbarth S, Harris AD, Carmeli Y, Samore MH. Parallel analysis of individual and aggregated data on antibiotic exposure and resistance in gram-negative bacilli. Clinical Infectious Diseases. 2001; 33:1462-1468. DOI | PubMed
- Harbarth S, Samore MH. Antimicrobial resistance determinants and future control. Emerging Infectious Diseases. 2005; 11:794-801. DOI | PubMed
- Hennessy TW, Petersen KM, Bruden D, Parkinson AJ, Hurlburt D, Getty M, Schwartz B, Butler JC. Changes in antibiotic-prescribing practices and carriage of penicillin-resistant Streptococcus pneumoniae: A controlled intervention trial in rural Alaska. Clinical Infectious Diseases. 2002; 34:1543-1550. DOI | PubMed
- Hicks LA, Chien YW, Taylor TH, Haber M, Klugman KP, Active Bacterial Core Surveillance (ABCs) Team. Outpatient antibiotic prescribing and nonsusceptible Streptococcus pneumoniae in the United States, 1996-2003. Clinical Infectious Diseases. 2011; 53:631-639. DOI | PubMed
- Hicks LA, Taylor TH, Hunkler RJ. U.S. outpatient antibiotic prescribing, 2010. New England Journal of Medicine. 2013; 368:1461-1462. DOI | PubMed
- Hicks LA, Bartoces MG, Roberts RM, Suda KJ, Hunkler RJ, Taylor TH, Schrag SJ. US outpatient antibiotic prescribing variation according to geography, patient population, and provider specialty in 2011. Clinical Infectious Diseases : An Official Publication of the Infectious Diseases Society of America. 2015; 60:1308-1316. DOI | PubMed
- Hillier S, Roberts Z, Dunstan F, Butler C, Howard A, Palmer S. Prior antibiotics and risk of antibiotic-resistant community-acquired urinary tract infection: a case-control study. Journal of Antimicrobial Chemotherapy. 2007; 60:92-99. DOI | PubMed
- Hindler JF, Stelling J. Analysis and presentation of cumulative antibiograms: a new consensus guideline from the clinical and laboratory standards institute. Clinical Infectious Diseases. 2007; 44:867-873. DOI | PubMed
- Huttner B, Samore M. Outpatient antibiotic use in the United States: time to "get smarter". Clinical Infectious Diseases. 2011; 53:640-643. DOI | PubMed
- Kanjilal S, Sater MRA, Thayer M, Lagoudas GK, Kim S, Blainey PC, Grad YH. Trends in Antibiotic Susceptibility in Staphylococcus aureus in Boston, Massachusetts, from 2000 to 2014. Journal of Clinical Microbiology. 2018; 56DOI | PubMed
- Knight GM, Costelloe C, Deeny SR, Moore LSP, Hopkins S, Johnson AP, Robotham JV, Holmes AH. Quantifying where human acquisition of antibiotic resistance occurs: a mathematical modelling study. BMC Medicine. 2018; 16DOI | PubMed
- Lau JS, Kiss C, Roberts E, Horne K, Korman TM, Woolley I. Surveillance of life-long antibiotics: a review of antibiotic prescribing practices in an Australian Healthcare Network. Annals of Clinical Microbiology and Antimicrobials. 2017; 16DOI | PubMed
- Levin BR, Lipsitch M, Perrot V, Schrag S, Antia R, Simonsen L, Walker NM, Stewart FM. The population genetics of antibiotic resistance. Clinical Infectious Diseases. 1997; 24:S9-S16. DOI | PubMed
- Lipsitch M. The rise and fall of antimicrobial resistance. Trends in Microbiology. 2001; 9:438-444. DOI | PubMed
- Lipsitch M, Samore MH. Antimicrobial use and antimicrobial resistance: a population perspective. Emerging Infectious Diseases. 2002; 8:347-354. DOI | PubMed
- Livermore DM, Stephens P, Weinberg J, Johnson AP, Gifford T, Northcott D, James D, George RC, Speller DC. Regional variation in ampicillin and trimethoprim resistance in Escherichia coli in England from 1990 to 1997, in relation to antibacterial prescribing. Journal of Antimicrobial Chemotherapy. 2000; 46:411-422. DOI | PubMed
- MacDougall C, Powell JP, Johnson CK, Edmond MB, Polk RE. Hospital and community fluoroquinolone use and resistance in Staphylococcus aureus and Escherichia coli in 17 US hospitals. Clinical Infectious Diseases. 2005; 41:435-440. DOI | PubMed
- MacFadden DR, Fisman D, Andre J, Ara Y, Majumder MS, Bogoch II, Daneman N, Wang A, Vavitsas M, Castellani L, Brownstein JS. A Platform for Monitoring Regional Antimicrobial Resistance, Using Online Data Sources: ResistanceOpen. Journal of Infectious Diseases. 2016; 214:S393-S398. DOI | PubMed
- MacFadden DR, McGough SF, Fisman D, Santillana M, Brownstein JS. Antibiotic Resistance Increases with Local Temperature. Nature Climate Change. 2018a; 8:510-514. DOI | PubMed
- MacFadden DR, Fisman DN, Hanage WP, Lipsitch M. The Relative Impact of Community and Hospital Antibiotic Use on the Selection of Extended-Spectrum Beta-lactamase-Producing Escherichia coli. Clinical Infectious Diseases. 2018b. DOI
- Magee JT, Pritchard EL, Fitzgerald KA, Dunstan FD, Howard AJ. Antibiotic prescribing and antibiotic resistance in community practice: retrospective study, 1996-8. Bmj. 1999; 319:1239-1240. DOI | PubMed
- McMahon BJ, Hennessy TW, Bensler JM, Bruden DL, Parkinson AJ, Morris JM, Reasonover AL, Hurlburt DA, Bruce MG, Sacco F, Butler JC. The relationship among previous antimicrobial use, antimicrobial resistance, and treatment outcomes for Helicobacter pylori infections. Annals of Internal Medicine. 2003; 139DOI | PubMed
- Nasrin D, Collignon PJ, Roberts L, Wilson EJ, Pilotto LS, Douglas RM. Effect of beta lactam antibiotic use in children on pneumococcal resistance to penicillin: prospective cohort study. Bmj. 2002; 324:28-30. DOI | PubMed
- Olesen SW, Barnett ML, MacFadden DR, Lipsitch M, Grad YH. Trends in outpatient antibiotic use and prescribing practice among US older adults, 2011-15: observational study. Bmj. 2018; 362DOI | PubMed
- Owusu-Edusei K, Carroll DS, Gift TL. Examining Fluoroquinolone Claims Among Gonorrhea-Associated Prescription Drug Claims, 2000-2010. American Journal of Preventive Medicine. 2015; 49:761-764. DOI | PubMed
- Pouwels KB, Freeman R, Muller-Pebody B, Rooney G, Henderson KL, Robotham JV, Smieszek T. Association between use of different antibiotics and trimethoprim resistance: going beyond the obvious crude association. Journal of Antimicrobial Chemotherapy. 2018; 73:1700-1707. DOI | PubMed
- Priest P, Yudkin P, McNulty C, Mant D. Antibacterial prescribing and antibacterial resistance in English general practice: cross sectional study. Bmj. 2001; 323:1037-1041. DOI | PubMed
- Public Health Agency of Sweden, National Veterinary Institute. Consumption of Antibiotics and Occurrence of Antibiotic Resistance in Sweden. Public Health Agency of Sweden and National Veterinary Institute: Sweeden; 2015.
- ESPAUR Writing Committee. English Surveillance Programme for Antimicrobial Utilisation and Resistance (ESPAUR). Public Health England; 2014. Publisher Full Text
- Schechner V, Temkin E, Harbarth S, Carmeli Y, Schwaber MJ. Epidemiological interpretation of studies examining the effect of antibiotic usage on resistance. Clinical Microbiology Reviews. 2013; 26:289-307. DOI | PubMed
- Schisterman EF, Perkins NJ, Mumford SL, Ahrens KA, Mitchell EM. Collinearity and Causal Diagrams: A Lesson on the Importance of Model Specification. Epidemiology. 2017; 28:47-53. DOI | PubMed
- Shallcross L, Beckley N, Rait G, Hayward A, Petersen I. Antibiotic prescribing frequency amongst patients in primary care: a cohort study using electronic health records. Journal of Antimicrobial Chemotherapy. 2017; 72:1818-1824. DOI | PubMed
- Steiner JF, Prochazka AV. The assessment of refill compliance using pharmacy records: methods, validity, and applications. Journal of Clinical Epidemiology. 1997; 50:105-116. DOI | PubMed
- Suskind AM, Saigal CS, Hanley JM, Lai J, Setodji CM, Clemens JQ, Urologic Diseases of America Project. Incidence and Management of Uncomplicated Recurrent Urinary Tract Infections in a National Sample of Women in the United States. Urology. 2016; 90:50-55. DOI | PubMed
- Tedijanto C, Olesen SW, Grad YH, Lipsitch M. Estimating the proportion of bystander selection for antibiotic resistance among potentially pathogenic bacterial flora. PNAS. 2018; 115:E11988-E11995. DOI | PubMed
- Truven Health Analytics. United States MarketScan Commercial Claims and Encounters Database. Truven Health Analytics: Ann Arbor, MI; 2015. Publisher Full Text
- Turnidge J, Christiansen K. Antibiotic use and resistance?proving the obvious. The Lancet. 2005; 365:548-549. DOI
- Van Boeckel TP, Gandra S, Ashok A, Caudron Q, Grenfell BT, Levin SA, Laxminarayan R. Global antibiotic consumption 2000 to 2010: an analysis of national pharmaceutical sales data. The Lancet Infectious Diseases. 2014; 14:742-750. DOI | PubMed
- van de Sande-Bruinsma N, Grundmann H, Verloo D, Tiemersma E, Monen J, Goossens H, Ferech M, European Surveillance of Antimicrobial Consumption Project Group, European Antimicrobial Resistance Surveillance System Group. Antimicrobial drug use and resistance in Europe. Emerging Infectious Diseases. 2008; 14:1722-1730. DOI | PubMed
- Wang A, Daneman N, Tan C, Brownstein JS, MacFadden DR. Evaluating the Relationship Between Hospital Antibiotic Use and Antibiotic Resistance in Common Nosocomial Pathogens. Infection Control & Hospital Epidemiology. 2017; 38:1457-1463. DOI | PubMed
- Weber SG, Gold HS, Hooper DC, Karchmer AW, Carmeli Y. Fluoroquinolones and the risk for methicillin-resistant Staphylococcus aureus in hospitalized patients. Emerging Infectious Diseases. 2003; 9:1415-1422. DOI | PubMed
- Zhang Y, Steinman MA, Kaplan CM. Geographic variation in outpatient antibiotic prescribing among older adults. Archives of Internal Medicine. 2012; 172:1465-1471. DOI | PubMed
Fonte
Olesen SW, Barnett ML, MacFadden DR, Brownstein JS, Hernández-Díaz S, et al. () The distribution of antibiotic use and its association with antibiotic resistance. eLife 7e39435. https://doi.org/10.7554/eLife.39435





