Catalizzatori privi di metallo, in particolare catalizzatori a base di grafene, sono stati utilizzati nelle celle a combustibile,1, 2, 3, 3, 4 dispositivi di immagazzinamento/conversione dell’energia,5, 6, 7, 7, 8, 9 nonché nell’elettrolisi dell’acqua,10, 11,12, 13 grazie alle loro proprietà stabili e controllabili del materiale. È noto che l’attività catalitica sui catalizzatori a base di grafene è in gran parte influenzata da molti fattori come la conducibilità,14,15, 16 dopanti chimici,17,18, 19, 20 difetti topologici,21,22 configurazione del legame chimico,23 livello di doping chimico,24 superficie,24 struttura3D-porosa,25, 26e strutture ibride.27 Studi recenti indicano che il controllo simultaneo di questi fattori può migliorare ulteriormente l’attività catalitica;14, 15, 16, 16, 17, 17, 18, 19, 20, 20, 21, 22, 23, 24, 25, 26, 27, 28 per esempio, Guo et al. hanno rivelato che il doping chimico che utilizza atomi di azoto piridinico su un bordo di grafene topologicamente controllato migliora la reazione di riduzione dell’ossigeno nelle celle a combustibile.23 Tuttavia, non sono ancora chiare le ragioni per cui il controllo di più fattori può migliorare ulteriormente l’attività elettrochimica. L’osservazione diretta e la visualizzazione dell’attività catalitica su scala atomica è una via promettente per capire come i fattori multipli possono avere effetti sinergici, consentendoci di ottimizzare le prestazioni dei catalizzatori privi di metalli a base di carbonio.
Le misurazioni elettrochimiche sono state utilizzate per visualizzare l’attività catalitica su scala nanometrica.29, 30, 31, 32 Queste misure, combinate con la microscopia a scansione a tunnel,29 la microscopia a forza atomica (AFM),31, 33 e gli strumenti ottici,34 possono, in linea di principio, sondare le specie chimiche transitorie durante le reazioni elettrochimiche, mentre in pratica queste misure sono molto difficili quando viene applicata la corrente elettrochimica. Per superare tali difficoltà, è stata recentemente sviluppata la microscopia a cellule elettrochimiche a scansione (SECCM), che utilizza una nanopipetta come sonda. Questa tecnica SECCM permette di rilevare la corrente elettrochimica in risoluzione spaziale sub-microscopica. Inoltre, utilizzando la mappatura della corrente SECCM, si possono analizzare le attività elettrochimiche del materiale rispetto alla struttura locale. Il SECCM è stato utilizzato per rivelare le attività dei materiali con le strutture ben definite, come i nanotubi di carbonio,35 grafeno/grafite,36policristallino Pt,37e inanofogli MoS2 scissi,38così come per le reazioni di Li-ion redox.39 L’impiego di tale tecnica per comprendere l’effetto sinergico sull’attività elettrochimica è quindi molto importante.
Qui, combinando la tecnica SECCM con le caratterizzazioni atomistiche e i calcoli della teoria funzionale della densità (DFT), sveliamo il meccanismo molecolare che sta dietro l’accelerazione HER nel grafene arricchito con grafene drogato chimicamente. Abbiamo sintetizzato il grafene arricchito con dopanti chimici vicino ai bordi creati da fori nei reticoli di grafene, e abbiamo scoperto che il grafene codopato con azoto/fosforo (NP) fornisce un’attività LEI molto migliore rispetto al grafene arricchito senza dopanti chimici e al grafene arricchito con solo azoto (N) o fosforo (P). Le misurazioni SECCM rivelano che gli NP-dopanti sul bordo del grafene forato migliorano significativamente la corrente elettrochimica. Il calcolo DFT suggerisce che gli NP-doppanti situati sui bordi aumentano il contrasto delle cariche positive e negative sui siti dell’atomo, abbassando l’energia libera di Gibbs del processo HER. Una combinazione unica della sintesi del grafene drogato arricchito ai bordi, della misura SECCM e del calcolo DFT dimostra che gli agenti di drogaggio chimici situati nei bordi intorno alle strutture dei bordi del grafene migliorano le proprietà elettrochimiche, rispetto al grafene drogato chimicamente privo di bordi e al grafene non drogato arricchito ai bordi. I risultati ottenuti forniscono un’idea della progettazione razionale dei catalizzatori privi di metallo.
Abbiamo sintetizzato il grafene N-dopato, P-dopato, NP-codopato, con strutture arricchite di bordo mediante deposito di vapore chimico (CVD) a base di metallo poroso.40, 41 Il pannello superiore della figura1a mostra gli schemi della sintesi e delle strutture arricchite dai bordi (Figura S1, Informazioni di supporto), con i bordi contenenti azoto di tipo piridinico (drogato nei bordi), azoto di tipo grafitico (drogato nel reticolo) e fosforo terziario (drogato nel reticolo) a causa delle strutture grafene arricchite dai bordi intenzionalmente preparate. I campioni sintetizzati avevano morfologie porose bicontinue e aperte, con diametri dei legamenti di 0,4-1 µm e dimensioni dei pori quasi identiche tra loro (Figure S1 e S2, Supporting Information) messe a punto da livello di nanoparticelle di SiO2 cataliticamente inerti.41 I bordi lungo il foro con diametri compresi tra 0,01 e 1 µm sono stati osservati da AFM (Figura S3, Informazioni di supporto), e le aree superficiali medie dei campioni di grafene arricchiti e privi di bordi, come determinato dal metodo di adsorbimento/desorbimento dell’azoto con la teoria Brunauer-Emmett-Teller (BET),42 erano rispettivamente 662,5 e 821,5 m2 g-1, rispettivamente (Figura S4, Informazioni di supporto). Gli spettri Raman sono stati misurati insieme alle corrispondenti immagini ottiche per rivelare la relazione tra la morfologia arricchita dai bordi e il reticolo del grafene. La densità del difetto sul grafene drogato NP con strutture di bordo è stata indicata dal rapporto delle bande D e G negli spettri di intensità Raman (ID/IG)(Figura 1b,c ). La densità dei difetti su scala atomica è altamente localizzata vicino al bordo, mentre la densità del difetto è bassa nella regione lontana dal bordo. Abbiamo anche confermato che la densità dei difetti della scala dell’atomo è alta in prossimità dei bordi di 500-600 nm e dei fori di 2 µm (vedi Figura S5 nelle Informazioni di supporto). Inoltre, la densità del difetto nella regione del bordo dei campioni drogati(ID/IG= 0,80-0,91) era superiore a quella del campione non drogato (ID/IG=0,72), il che implica che gli agenti droganti hanno influenzato la densità del difetto del bordo (Figura S6 e Tabella S1, Informazioni di supporto). Il numero di strati di grafene è stato indicato dal rapporto di intensità delle bande 2D e G(I2D/IG); i campioni di grafene drogato chimicamente(I2D/IG= 1,56-3,2) erano composti principalmente da grafene a più strati, con elevata cristallinità delle strutture del grafene, e senza caratteristiche di carbonio amorfo rilevabile (Figura S7 e Tabella S1, Informazioni di supporto). Pertanto, si conclude che la curvatura e i raggi dei legamenti del grafene sono insensibili alla presenza di spigoli; i bordi inducono solo l’alta densità di difetti nelle regioni dei bordi a causa delle loro strutture difettose.
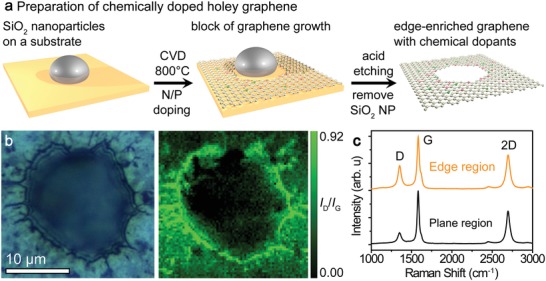
Figura 1.a) Illustrazione schematica della preparazione del grafene arricchito ai bordi con dopanti chimici. b) Immagine ottica e mappatura Raman (ID/IG)di una regione del bordo e c) gli spettri Raman del grafene drogato NP sulle regioni del bordo e del piano.
Le osservazioni delle configurazioni atomiche e la mappatura elementare in situ sono state condotte con la microscopia elettronica a trasmissione e a scansione a trasmissione (TEM e STEM). Il grafene arricchito di bordo drogato chimicamente dimostra legamenti tubolari orientati in modo casuale composti da strati di grafene (Figura2a). L’inserto della Figura 2amostra i punti di diffrazione acuti nella corrispondente area selezionata del modello di diffrazione degli elettroni, evidenziando che il campione ha un’elevata cristallinità. L’alta risoluzione (HR)-TEM ha dimostrato che la maggior parte della regione del piano ha una perfetta struttura esagonale, come nel grafene piatto 2D (Figura 2b). Al contrario, nella regione del bordo è stato osservato un reticolo di grafene distorto indotto da difetti (Figura 2c). Inoltre, le immagini del campo luminoso (BF)-STEM e la mappatura elementare dei dati della spettroscopia a perdita di energia degli elettroni (EELS) (Figura 2d) hanno mostrato che il contrasto nella regione del bordo era relativamente più luminoso di quello lontano dai bordi, mentre la regione del bordo della ruga non lo mostra (Figura S8, Informazioni di supporto). Ciò indica che gli agenti chimici dopanti erano situati nella regione del bordo, il che è coerente con gli alti valoriID/IG trovati dalla mappatura Raman (Figura 1b). I nostri risultati indicano che gli agenti chimici dopanti sono distribuiti in modo disomogeneo e quindi illustrano fortemente che la regione ai margini è la principale area ospite degli agenti dopanti.
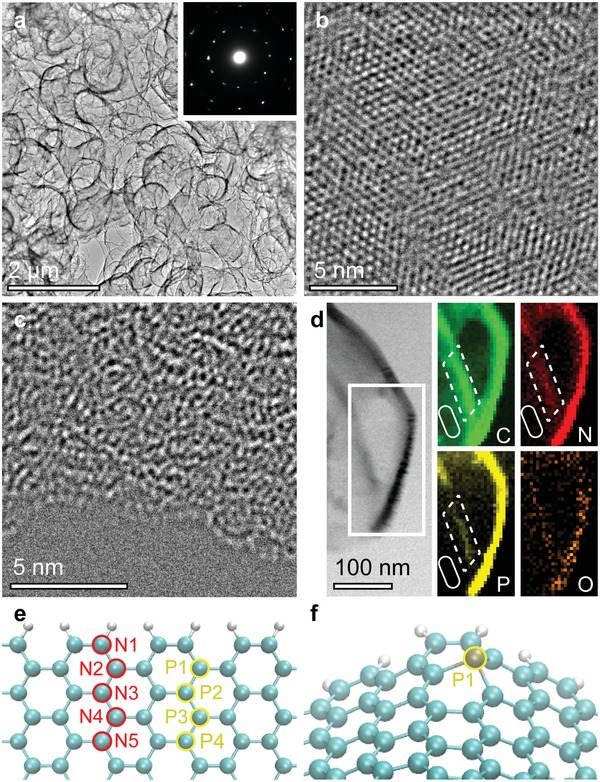
Figura 2.Caratterizzazioni atomistiche del grafene drogato NP con strutture di bordo. a) Immagine TEM a bassa risoluzione del grafene arricchito di bordo. L’inserto mostra i punti di diffrazione a zone selezionate orientate in modo casuale degli strati di grafene. b) Immagine HR-TEM del grafene su una regione piana. c) Immagine HR-TEM del grafene su una regione di bordo. d) Immagine BF-STEM e corrispondenti mappature elementari EELS (C: carbonio, N: azoto, P: fosforo, P: fosforo, O: ossigeno) intorno ad un bordo del grafene drogato NP. I punti e le linee continue rappresentano rispettivamente regioni di bordo e regioni piane. e) Modello di bordo del grafene non distorto per il calcolo dell’energia totale (eV). f) Modello di bordo distorto con un singolo atomo di fosforo in posizione P1.
Lo stato chimico di legame e la composizione chimica quantitativa sono stati studiati mediante spettroscopia fotoelettrica a raggi X (XPS) (Figure S9-S11, Informazioni di supporto). I picchi nello spettro XPS C 1s dello spettro XPS del campione drogato con NP significano grafene di alta qualità senza carburi. Inoltre, lo spettro N 1s XPS rivela che l’N-dopante forma strutture grafitiche, piridiniche e di ossido, senza nitruri; 43,44 e lo spettro P 2p XPS indica che lo stato di legame del fosforo è quello del fosforo terziario (P-C3) (132.1-132.9 eV).45, 46 Il metallo residuo è stato analizzato ed è stata osservata una piccolissima quantità di impurità di Ni e Mo (≤0,01 al%) sulla superficie (Figura S10 e S11, Informazioni di supporto) mediante misurazioni XPS. Si noti che sono stati quantitativamente stimati come inferiori a ≈1 µg mg-1 mediante l’analisi dello spettrometro ad emissione ottica al plasma accoppiato con induttività, mentre non potevano essere rilevati dalla diffrazione dei raggi X (XRD) (Figura S12, Informazioni di supporto). Le misure quantitative XPS sono riassunte nella Tabella S2 (Informazioni di supporto). Per comprendere l’influenza dei bordi sul legame chimico, abbiamo confrontato gli spettri del grafene drogato NP con e senza bordi, cresciuto nelle stesse condizioni CVD (Figure S9 e S13, Supporting Information). L’esistenza di bordi ha influito sul livello totale di dopante (aumento dell’1,03 al%), e la frazione di azoto piridinico ha mostrato concentrazioni atomiche relativamente più elevate nel campione arricchito con NP drogato con bordi (Tabella S2, Informazioni di supporto).
Per confermare il doping chimico selettivo nel bordo del grafene, abbiamo eseguito calcoli DFT con modelli di grafene non distorti e distorti (≈6% di restringimento del reticolo) per determinare l’energia totale del grafene drogato chimicamente nella regione del bordo (Figura 2e,f ). L’energia totale è stata normalizzata nella posizione con l’energia totale più bassa (cioè, N1 e P1) per il confronto. I risultati del calcolo indicano che l’energia totale nella posizione di N1 e P1 è più energeticamente stabile rispetto ad altre posizioni (0,19-0,59 eV per N e 0,40-0,67 eV per P) e l’aumento di energia totale come l’energia totale aumenta quando gli agenti chimici drogati sono posizionati lontano dal bordo (Tabella1). Inoltre, è stato rilevato che gli agenti dopanti azotati sono dopati nel bordo distorto più preferibilmente rispetto a quelli nel bordo non distorto (cioè, riduzione di 0,1 eV in ogni posizione almeno). Inoltre, l’atomo di fosforo forma il legame piramidale con i carboni (Figura 2f), che potrebbe stabilizzare il reticolo del bordo curvo del grafene come osservato (Figura 2a). Pertanto, gli agenti chimici droganti potrebbero essere drogati prevalentemente vicino al bordo del grafene. In combinazione con risultati sperimentali come la mappatura Raman, il TEM ad alta risoluzione (HR)-TEM, la mappatura EELS, i dati XPS e i calcoli DFT, abbiamo concluso che il bordo può ospitare gli agenti di drogaggio chimici e portare alle configurazioni preferenziali degli agenti di drogaggio (specialmente l’azoto piridinico nel bordo). Di conseguenza, la frustrazione geometrica47 suggerita matematicamente, indotta dai bordi, gioca un ruolo importante nell’accogliere un maggior numero di dopanti e nell’adattare le configurazioni atomiche dell’azoto piridinico, come è stato riportato in precedenza.21 Tale frustrazione strutturale indotta dai bordi dovrebbe influenzare l’attività catalitica.
| Bordo non distorto / distorto | |||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Grafene drogato N | 0/0 | 0.32/0.19 | 0.59/0.48 | 0.52/0.41 | 0.43/0.30 |
| Grafene drogato P | 0/0 | 0.58/0.50 | 0.49/0.67 | 0.49/0.40 | – |
Abbiamo successivamente misurato le prestazioni HER di campioni di grafene solo N-doppati, solo P-doppati e NP-codoppati con strutture arricchite di bordo, così come di campioni non drogati (G) e privi di bordo NP-doppati, insieme al catalizzatore Pt commerciale. Figura3a visualizza i voltammetri idrodinamici dell’HER elettrochimico a catodi di grafene in un elettrolita acido di 0,5 mH2SO4. Le sovrapotenze, η, ad una densità di corrente di 10 mA cm-2, erano 344 mV (NP), 477 mV (N), 522 mV (P), 571 mV (G), e 453 mV (NP senza bordi). Inoltre, sono state determinate le frequenze di rotazione approssimative (TOF)48, 49 a potenziali elettrodi di -200 mV (contro l’elettrodo di idrogeno reversibile, RHE) (Tabella S3, Informazioni di supporto). Il campione NP (0,64 H2/s) ha mostrato un TOF più alto rispetto al campione NP senza bordi (0,45 H2 s-1). Il campione NP mostra le attività HER più elevate tra i campioni di grafene sintetizzato. La spettroscopia di impedenza elettrochimica è stata impiegata per indagare le proprietà di trasferimento della carica (Figura S14, Informazioni di supporto). Assumendo un circuito equivalente che consiste in una combinazione parallela con una resistenza di trasferimento di carica (Rct)e una capacità elettrochimica a doppio strato (Cdl),possiamoadattare i diagrammi di Nyquist a semicerchio per analizzare il loro Rct ad un potenziale dell’elettrodo di -300 mV (V vs RHE). I valori Rcterano 21,5 Ω (NP), 73,2 Ω (N), 125 Ω (P), 1017 Ω (G), e 48,1 Ω (NP senza spigoli). Il campione NP mostra chiaramente la più bassa resistenza di trasferimento di carica, che potrebbe accelerare la cinetica HER e aumentare l’attività catalitica. Sia η che Rct sono abbassati dalla generazione di bordi sul campione NP, manifestando che i bordi miglioreranno l’attività di LEI. La stabilità elettrochimica sul ciclo e la prova di durata al potenziale di -0,34 V (V vs RHE) del campione NP è stata esaminata in 0,5 m dielettrolita H2SO4 acquoso (Figura S15, Informazioni di supporto). Il campione ha mantenuto l’85% e il 91,6% della sua densità di corrente dopo 1000 cicli e 1 giorno, rispettivamente.
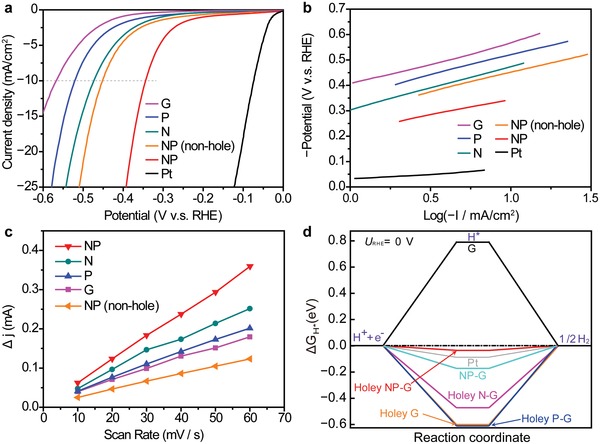
Figura 3.LEI attività di grafene drogato chimicamente con strutture di bordo. a) Voltammogrammi idrodinamici di campioni di grafene con e senza bordi in 0,5 m di elettrolita acquosoH2SO4. b) Trame di Tafel dei vari campioni di grafene. c) Differenze di corrente (Δ J =Ja–Jc) a 150 mV (V vs RHE) come funzioni di velocità di scansione. d) Profili di energia libera Gibbs calcolati da DFT.
Per ottenere informazioni sull’attività catalitica, sono stati esaminati i diagrammi di Tafel (Figura 3b) e Cdl(Figura 3c) dei campioni di grafene. Le pendenze di Tafel erano di 118-171 mV dec-1, il che suggerisce che gli HER si verificano attraverso meccanismi misti di Volmer e Heyrovsky, cioè, il desorbimento elettrochimico dell’idrogeno adsorbito (Hads) per generare molecole di idrogeno determina il tasso di HER.50 L’area superficiale elettrochimica (ECSA), che è quasi proporzionale al Cdl, può essere qualitativamente confrontata valutando i valori Cdldei campioni di grafene sulla base della voltammetria ciclica (CV) a varie velocità di sweep (Figura 3ce Figura S16, Informazioni di supporto). I valori Cdlmisurati sono stati 14,1 mF cm-2(NP ), 10,4 mF cm-2(N), 8,5 mF cm-2 (P), 7,4 mF cm-2 (G), e 5,2 mF cm-2 (NP senza bordi). Il carattere idrofilo è stato significativamente migliorato dall’aggiunta di dopanti chimici contenenti bordi, come confermato dagli angoli di contatto (Figura S17, Informazioni di supporto). I campioni di grafene drogati chimicamente con strutture di bordo avevano diminuito le pendenze di Tafel e aumentato i valori di Cdl, promuovendo così la LEI. Inoltre, abbiamo esaminato la dipendenza del rapporto bordo/area del piano dai voltammogrammi idrodinamici per indagare l’equilibrio dell’area, preparando campioni con varie quantità di nanoparticelle di SiO2 che disturbano la crescita del grafene (1 × 10-4 a 1 × 10-3 wt%), in quanto ciò è correlato con il bordo e l’area del piano regolando la quantità di bordi (Figura S18, Informazioni di supporto). Grafene drogato chimicamente (senza fori, SiO2: 0 in peso%), grafene bordo meno dosato (10-30 nm fori, SiO2: 0,50× 10-4 in peso%), e grafene hash graphene sovradosato (100-300 nm fori, SiO2: 5.0 × 10-4 wt%) hanno tutti prestazioni HER inferiori rispetto a quelle con una quantità ottimale di nanoparticelle di SiO2 (fori da 10-100 nm, SiO2: 1,0 × 10-4 wt%) in condizioni CVD simili (Figura S19, Informazioni di supporto). Inoltre, le dipendenze di concentrazione del livello di doping chimico sono state confrontate per esaminare l’influenza del livello di dopante chimico e dei fori (Figura S20, Informazioni di supporto). Il grafene drogato NP (1,37, 2,42 e 3,45 al%) senza fori dimostra che un livello di doping chimico più elevato mostra prestazioni HER più elevate, che sono coerenti con i rapporti precedenti.4, 21 È importante notare che il grafene drogato NP con fori (2,40 al%) dimostra ≈10% di sovrapotenza inferiore a 20 mAcm-2 rispetto al grafene drogato NP (2,42 al%) senza fori. Ciò indica che la creazione di un adeguato rapporto bordo/area del piano a parità di livello di doping chimico è importante per migliorare la LEI.
Per collegare le configurazioni locali con l’attività elettrochimica HER su scala nanometrica, abbiamo usato misure elettrochimiche operando per la mappatura elettrochimica nello spazio reale con SECCM. Figura4 mostra la topologia e la corrente HER in loco per i campioni di grafene drogato NP e non drogato (G) con le strutture dei bordi. Il confronto tra i dati topologici (Figura 4a) e la mappatura della corrente HER (Figura 4b) per il campione G dimostra che la regione del bordo ha una corrente HER più grande rispetto alla regione del piano. Inoltre, la corrente HER al bordo è aumentata dal doping solitario (Figura S21, Informazioni di supporto) rispetto al nondoping (Figura 4b) e ulteriormente aumentata dal codoping (Figura 4d) rispetto al doping solitario (Figura 4c,d). Per confrontare la capacità catalitica delle due regioni, abbiamo stimato il TOF delle molecole di idrogeno dai suoi dati di mappatura attuali (Figura 4b,d) e li abbiamo riassunti nella Tabella S3 (Supporting Information). Abbiamo trovato che il valore TOF del grafene drogato chimicamente al bordo raggiunge 468H2 s-1 e i valori TOF per il grafene drogato chimicamente erano circa 100-200 volte più alti al bordo rispetto alle regioni piane, e circa 10-80 volte più alti al bordo sul campione G rispetto a quelli per le regioni piane sul campione G. Questo indica chiaramente che la differenza di corrente di LEI tra il bordo e le regioni piane è molto più grande per il campione NP che per il campione G. Così, possiamo dimostrare direttamente che il doping chimico combinato e l’ingegneria dei bordi possono migliorare drasticamente l’attività di HER.
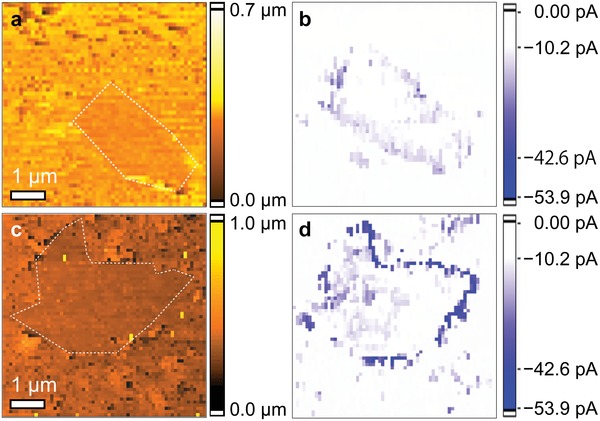
Figura 4.Mappatura della corrente SECCM. a) Topografia e b) LEI su grafene non drogato con bordi e c) topografia e d) LEI su grafene drogato NP con bordi. La mappatura corrente ottenuta è stata di -1000 mV vs Pd (equivalente a -200 mV vs RHE). I punti bianchi nelle immagini topografiche presentano la guida dei bordi.
Dopo aver confermato che i dopanti chimici sui bordi sono importanti per migliorare l’attività di LEI, abbiamo deciso di affrontare il modo in cui l’attività di LEI viene migliorata. Abbiamo effettuato calcoli DFT dell’energia libera di Gibbs, seguiti da analisi della distribuzione della carica sui campioni. Il meccanismo complessivo di LEI in un elettrolita acido prevede tre fasi: da H+++e- a 1/2 H2 attraverso l’adsorbimento di H*.51, 52 Per questi processi, i catalizzatori HER ad alta efficienza dovrebbero avere energie libere di Gibbs per l’adsorbimento di H*, |Δ GH*|,vicine allo zero. I risultati della mappatura SECCM visualizzati nella Figura 4dillustrano chiaramente che il grafene drogato NP con bordi ha una corrente di HER più grande rispetto al grafene non drogato con bordi, indicando che la barriera di attivazione per il trasporto degli elettroni è molto più piccola per il grafene drogato NP che per il grafene non drogato. Ciò è coerente con il |Δ GH*| molto più piccolodel grafene drogato NP con bordi rispetto al grafene non drogato con bordi. Il calcolo DFT suggerisce infatti che |Δ GH*|del grafene drogato NP con bordi è paragonabile al |Δ GH*| di 0,08eVper Pt. Si noti che il |Δ GH*|è calcolato scegliendo i siti altamente attivi vicino ai bordi (Figure S22-S24, Informazioni di supporto). Questo è stato seguito dal grafene N-doped con bordi (Δ GH* =-0. 46 eV); tuttavia, gli altri campioni hanno valori |Δ GH*| molto più grandi. Tale tendenza è coerente con i dati di attività HER (Figura 3a), dove i campioni NP con e senza bordi e i campioni N-doppati con bordi hanno rispettivamente l’attività HER più alta, la seconda più alta e la terza più alta. Ciò indica che la presenza della struttura dei bordi sul grafene drogato chimicamente è fondamentale per abbassare |Δ GH*|.
L’abbassamento di |Δ GH*|sul grafene drogato NP con strutture di bordo può essere tipicamente osservato agli atomi di azoto piridinico al bordo (Figure S22-S24, Informazioni di supporto). Per capire il meccanismo che sta dietro l’abbassamento del |Δ GH*|,abbiamo analizzato la distribuzione della carica. Le distribuzioni parziali di carica degli atomi del bordo sul grafene drogato NP con e senza i bordi (Figura S25, Informazioni di supporto) Al bordo, gli atomi di azoto e di carbonio vicini al fosforo sono caricati negativamente, e gli atomi di fosforo e di carbonio vicini all’azoto sono caricati positivamente. P-dopanti al bordo del grafene aumentano la carica sull’azoto piridinico, che migliora l’attività dell’azoto piridinico. La struttura del bordo aumenta anche l’accumulo di carica sugli atomi di carbonio vicino agli agenti di drogaggio chimici; in media, la carica è aumentata del 30-50%. Questo porta ad un’elevata bagnabilità dei grafeni (Figura S17, Informazioni di supporto). Pertanto, proponiamo che le regioni dei bordi caricate positivamente e negativamente indotte da dopanti chimici e difetti creino ulteriori siti catalitici contenenti ECSA sul grafene arricchito ai bordi, come riportato in precedenza.53 Inoltre, anche gli atomi di carbonio indotti dai bordi potrebbero essere siti chimicamente attivi (Figura S23).
L’attività catalitica nel grafene drogato chimicamente con strutture di bordo deriva dalla distribuzione spaziale disomogenea dei dopanti chimici e dalla loro configurazione di legame chimico. Il bordo porta frustrazione geometrica al reticolo del grafene, che accumula droganti chimici e configurazioni LEI attive vicino al bordo del grafene, mentre strati di grafene senza difetti in regioni piane relativamente poco dosate supportano il trasferimento di elettroni alle regioni del bordo. Quindi, queste regioni lavorano in modo cooperativo per migliorare la cinetica di reazione. La popolazione di energia libera e di carica di Gibbs, calcolata con DFT, dimostra che il bordo del grafene sintonizza l’adsorbimento e il desorbimento di H*, e crea stati di carica positiva e negativa, a beneficio dei processi HER.
L’analisi operando SECCM ci ha permesso di collegare la corrente elettrochimica HER con le strutture del grafene per visualizzare dove si trovano i siti cataliticamente attivi. Solo i bordi chimicamente codoppati dimostrano un’elevata attività di HER per l’effetto sinergico dei codopanti di azoto e fosforo nella regione arricchita dai bordi. Al contrario, le regioni prive di bordi, o le regioni in cui il livello di dopante chimico è relativamente basso, non mostrano attività catalitiche elevate. Ciò indica che sia gli agenti dopanti chimici concentrati vicino ai bordi (Figura 2d) che le configurazioni indotte dai bordi in scala nanometrica come l’azoto piridinico (Figura S26, Informazioni di supporto) possono essere efficaci siti di reazione catalitica. Infatti, il legame chimico dopo il test HER a 1000 cicli indica che l’N piridinico è attivamente coinvolto nella reazione HER e quindi l’N piridinico allo 0,66 al% di N piridinico perso o trasformato in N ossidato. Inoltre, abbiamo scoperto che, rispetto all’atomo di azoto, l’atomo di fosforo non è fortemente ossidato dopo il test di HER. Ciò indica che i dopanti del fosforo favoriscono l’accumulo di carica di azoto piridinico in HER. Inoltre, la rete di grafene conduttivo e bicontinuo, insieme alla struttura ottimale dei bordi, facilita il trasporto di massa e di elettroni verso i siti attivi. Di conseguenza, sintonizzando il livello di doping chimico e le configurazioni degli agenti di drogaggio chimici, i bordi associati agli agenti di drogaggio chimici migliorano significativamente la loro attività di LEI.
Combinando le misurazioni delle prestazioni di HER, le sonde di corrente elettrochimiche attraverso SECCM, la conformazione atomica ottenuta con HR-TEM e i calcoli DFT, abbiamo studiato l’attività elettrochimica del grafene drogato chimicamente con le strutture dei bordi. Abbiamo scoperto che la combinazione di doping chimico e ingegneria dei bordi può aumentare drasticamente l’attività di HER. Per comprendere il meccanismo sottostante, abbiamo visualizzato direttamente la corrente elettrochimica HER da SECCM, che ha suggerito che le strutture dei bordi arricchite di dopanti chimici possono effettivamente migliorare l’evoluzione elettrochimica dell’idrogeno. Il calcolo DFT indica che il contrasto delle intensità di carica degli atomi in un bordo è migliorato per la presenza del bordo, migliorando l’attività dell’azoto piridinico. Di conseguenza, le energie libere di Gibbs per l’adsorbimento di H* nel grafene drogato NP con strutture di bordo sono simili a quelle del Pt. Tali approcci di ingegneria dei bordi forniscono una buona comprensione e nuovi principi di progettazione per sfruttare i catalizzatori intrinseci privi di metallo. Inoltre, gli elettrocatalizzatori a base di grafene hanno ampio spazio per migliorare ulteriormente la loro attività catalitica quando combiniamo opportunamente diversi fattori di miglioramento come conducibilità, dopanti chimici, difetti topologici, configurazione del legame chimico, livello di doping chimico, superficie, bordi e struttura porosa 3D.
Conflitto di interesse
Gli autori non dichiarano alcun conflitto di interessi.
Informazioni di supporto
References
- J. Power Sources. 2006; 156:128.
- Small. 2012; 8:3550. PubMed
- J. Phys. Chem. C. 2011; 115:11170.
- Angew. Chem., Int. Ed.. 2018; 57:7568.
- Energy Environ. Sci.. 2011; 4:1113.
- Carbon. 1999; 37:165.
- Adv. Mater.. 2014; 26:849. PubMed
- ACS Catal.. 2012; 2:781.
- Nano Lett.. 2008; 8:3498. PubMed
- Angew. Chem., Int. Ed.. 2016; 55:2230.
- ACS Catal.. 2015; 5:5207.
- Chem. Rev.. 2018; 118:6337. PubMed
- Adv. Energy Mater.. 2017; 7:1602068.
- Nat. Mater.. 2007; 6:183. PubMed
- Appl. Catal., B. 2009; 88:1.
- Angew. Chem., Int. Ed.. 2018; 57:13302.
- ACS Nano. 2010; 4:1321. PubMed
- ACS Nano. 2017; 11:7293. PubMed
- Adv. Mater.. 2013; 25:4932. PubMed
- Angew. Chem., Int. Ed.. 2015; 54:2131.
- Adv. Mater.. 2016; 28:10644. PubMed
- Adv. Mater.. 2016; 28:6845. PubMed
- Science. 2016; 351:361. PubMed
- Nat. Energy. 2016; 1:16130.
- Angew. Chem., Int. Ed.. 2012; 51:3892.
- Adv. Mater.. 2014; 26:4145. PubMed
- J. Phys. Chem. Lett.. 2011; 2:242.
- Chem. Soc. Rev.. 2013; 42:3088. PubMed
- Nature. 2017; 549:74. PubMed
- Angew. Chem., Int. Ed.. 2014; 53:14120.
- Nat. Energy. 2018; 3:46.
- Curr. Opin. Electrochem.. 2017; 6:23.
- J. Am. Chem. Soc.. 2013; 135:10870. PubMed
- Nat. Commun.. 2018; 9:661. PubMed
- Proc. Natl. Acad. Sci. USA. 2012; 109:11487. PubMed
- ACS Nano. 2015; 9:3558. PubMed
- Phys. Chem. Chem. Phys.. 2014; 16:18545. PubMed
- Chem. Sci.. 2017; 8:6583. PubMed
- Nat. Commun.. 2014; 5:5450. PubMed
- Angew. Chem.. 2014; 126:4922.
- ACS Catal.. 2018; 8:3579.
- J. Am. Chem. Soc.. 1938; 60:309.
- Phys. Rev. B. 2012; 86:035436.
- ACS Nano. 2014; 8:3337. PubMed
- RSC Adv.. 2013; 3:9978.
- New J. Chem.. 2014; 38:2269.
- Carbon. 2014; 76:266.
- Nano Lett.. 2011; 11:4168. PubMed
- ACS Catal.. 2012; 2:1916.
- Chem. Soc. Rev.. 2014; 43:6555. PubMed
- Nat. Chem.. 2009; 1:37. PubMed
- Nat. Mater.. 2006; 5:909. PubMed
- ACS Nano. 2014; 8:5290. PubMed
Fonte
Kumatani A, Miura C, Kuramochi H, Ohto T, Wakisaka M, et al. (2019) Chemical Dopants on Edge of Holey Graphene Accelerate Electrochemical Hydrogen Evolution Reaction. Advanced Science 6(10): 1900119. https://doi.org/10.1002/advs.201900119





