StatementAlthough una singola dose di cellule mesenchimali stromali (MSCs) somministrato terapeuticamente non è stato in grado di migliorare il rimodellamento polmonare in casa acaro della polvere (HDM)- asma allergica indotta da asma, dosi multiple di MSCs effettivamente ridotto sia l’infiammazione polmonare e rimodellamento, migliorando la meccanica polmonare. Tuttavia, dosi multiple di CSM hanno anche portato a effetti immunosoppressivi. Questo dovrebbe essere preso in considerazione per i futuri studi clinici in pazienti con asma grave.
INTRODUZIONE
L’asma colpisce attualmente l’1%-18% della popolazione in diverse regioni del mondo e rappresenta un problema di salute pubblica in crescita. Si tratta di una malattia infiammatoria cronica caratterizzata da risposte immunitarie contro gli allergeni che provocano rimodellamento polmonare, iperreattività delle vie aeree e ostruzione del flusso d’aria. Anche se molti pazienti con asma rispondono positivamente alla terapia con corticosteroidi, con un efficiente sollievo dei sintomi, non inverte il rimodellamento stabilito, e una coorte di pazienti sperimenta ancora uno scarso controllo dei sintomi e delle esacerbazioni.1, 2
La terapia con cellule stromali mesenchimali (MSC) ha dimostrato risultati promettenti in diversi modelli di malattie polmonari, ma il suo impatto sul rimodellamento delle vie aeree è stato talvolta controverso.3, 4, 5, 6 Nei modelli di asma allergica indotta da ovoalbumina ed estratto di Aspergillus hyphal, una singola dose di CSM somministrata localmente o sistemicamente ha portato alla riduzione sia dell’infiammazione polmonare che del rimodellamento.3, 7, 8, 9, 10 Al contrario, nell’estratto di acaro della polvere di casa (HDM) – asma allergica indotta, una singola dose di CSM ha ridotto alcuni parametri infiammatori, ma non è stato in grado di migliorare la funzione polmonare o rimodellamento.4, 5 Alcuni rapporti hanno indicato che la terapia cellulare ripetuta ha prodotto migliori effetti terapeutici, sia prevenendo la progressione della malattia o riducendo ulteriormente l’infiammazione e il rimodellamento, nella silicosi sperimentale e nell’enfisema indotto dall’elastasi.6, 11 Tuttavia, l’impatto dei regimi di terapia cellulare a dosi multiple nell’asma allergica sperimentale rimane sconosciuto.
Abbiamo ipotizzato che, nell’asma allergica sperimentale, dosi multiple di CSM potrebbero esercitare effetti terapeutici migliori riducendo l’infiammazione polmonare e il rimodellamento, ma potrebbero anche produrre effetti immunosoppressivi. Per affrontare il potenziale terapeutico di un regime di CSM a dosi multiple, questo studio mirava a studiare comparativamente gli effetti di due e tre dosi di CSM umane derivate dal tessuto adiposo somministrate per via sistemica in un modello di asma allergica indotta da HDM. Gli endpoint di interesse includevano la meccanica polmonare, l’istologia, l’infiammazione e il rimodellamento; i livelli proteici di mediatori selezionati; la conta dei leucociti negli organi linfoidi primari e secondari; così come l’espressione dei marcatori associati all’immunosoppressione nel timo.
MATERIALI E METODI
Questo studio è stato approvato dal Comitato Etico del Centro di Scienze della Salute dell’Università Federale di Rio de Janeiro (CEUA-UFRJ: 047/17, Rio de Janeiro, Brasile). Tutti gli animali hanno ricevuto cure umane in conformità con i “Principi della cura degli animali da laboratorio” formulati dalla Società Nazionale per la Ricerca Medica e la Guida per la cura e l’uso degli animali da laboratorio preparata dalla U.S. National Academy of Sciences.
Isolamento e cultura degli MSC
Le MSC sono state isolate e coltivate come descritto altrove.3 Il tessuto adiposo umano è stato ottenuto da tre donne sane (età 21-45 anni) sottoposte a chirurgia plastica addominale presso l’Ospedale Clementino Fraga Filho dell’Università Federale di Rio de Janeiro, dopo l’approvazione del Comitato Etico Istituzionale (CEP-UFRJ: 088/04, Rio de Janeiro, Brasile). In breve, il tessuto adiposo è stato digerito sotto agitazione con lo 0,1% di collagenasi di tipo I (#SRC103, Sigma-Aldrich, St. Louis, Missouri) a 37°C per 30 minuti. Il pellet ottenuto è stato filtrato attraverso membrane di nylon da 10 mm e centrifugato due volte a 230 gper 5 minuti. Il pellet è stato poi risospeso in Dulbecco modificato Eagle’s medium (DMEM) (Life Technologies, Grand Island, New York) e le cellule sono state contate in un emocitometro. Le cellule sono state coltivate in un mezzo DMEM a basso contenuto di glucosio contenente il 20% di siero bovino fetale (FBS, Life Technologies), 100 unità/mL di penicillina, e 100 mg/mL di soluzione antibiotica di streptomicina (Gibco, Albuquerque, New Mexico) a 37 ° C, in un’atmosfera al 5% di CO2. Le cellule non aderenti sono state rimosse 24 ore dopo la coltura iniziale. Dopo aver raggiunto l’80% di confluenza, le cellule sono state staccate con TrypLE (Life Technologies) e trasferite in nuovi flaconi. Al terzo passaggio, la vitalità delle cellule, la densità, e la concentrazione finale (1 × 105 cellule vitali per 50 ml di soluzione fisiologica sterile) sono stati determinati da esclusione trypan blu in un emocitometro. Le cellule risultanti sono stati utilizzati negli esperimenti.
HDM indotta da asma allergica indotta da HDM e protocollo terapeutico
L’asma allergica è stata indotta dall’esposizione all’HDM come descritto altrove.4, 12 Brevemente, i topi di sesso femminile C57BL/6 (età 8-10 settimane, peso 20-25 g) sono stati divisi casualmente in due gruppi. Il gruppo HDM è stato contestato per instillazione intranasale con 25 μg di estratto di HDM (Dermatophagoidespteronyssinus; Greer Laboratories, Lenoir, North Carolina) diluito in 25 μL di PBS, tre volte a settimana, per tre settimane consecutive, mentre gli animali di controllo (CTRL) hanno ricevuto 25 μL di PBS sterile nelle stesse condizioni. Un giorno dopo l’ultima sfida HDM, il gruppo HDM è stato ulteriormente diviso per ricevere casualmente due dosi di MSC (MSC-2D) (105 AD-MSC diluito in 50 μL di 0.9% NaCl per dose), tre dosi di MSC (MSC-3D), o tre dosi di soluzione salina (SAL) per via endovenosa, tramite iniezione giugulare in anestesia (5% isoflurano). Ogni dose di MSC o soluzione salina è stata somministrata una volta al giorno per tre giorni consecutivi. Sette giorni dopo l’ultima sfida HDM, tutti gli animali sono stati eutanasia per l’analisi dei dati (Supporting Information Figure S1). Tutti gli animali sono stati pesati prima e dopo la fine del protocollo.
Meccanica polmonare
Sette giorni dopo l’ultima sfida HDM, gli animali sono stati sedati (diazepam 1 mg / kg per via intraperitoneale), anestetizzati (sodio tiopental 20 mg / kg per via intraperitoneale), tracheotomizzati, paralizzati (bromuro di vecuronio, 0.005 mg / kg per via endovenosa), e ventilato con un ventilatore a flusso costante (Samay VR15; Universidad de la Republica, Montevideo, Uruguay) impostato su RR = 100 bpm, volume di marea (VT) = 0,2 mL, e frazione di ossigeno ispirato (FIO2) = 0,21. La parete toracica anteriore è stata rimossa chirurgicamente e una pressione positiva di fine espirazione di 2 cmH2O applicata. Flusso d’aria e la pressione tracheale (Ptr) sono stati misurati,3 e la meccanica polmonare sono stati analizzati con il metodo di occlusione di fine inflazione.13 In una preparazione a torace aperto, Ptr riflette la pressione transpolmonare (PL). Brevemente, dopo l’occlusione inspiratoria di fine, c’è un iniziale rapido declino del PL(ΔP1,L) dal valore di preocclusione fino ad un punto di inflessione (Pi), seguito da un lento decadimento della pressione fino al raggiungimento di un plateau. Questo plateau corrisponde alla pressione di rinculo elastico del polmone (Pel). ΔP1,L riflette selettivamente la pressione utilizzata per superare la resistenza delle vie aeree. L’elastanza polmonare statica (Est,L) è stata determinata dividendo Pel per VT. Le misure di meccanica polmonare sono state ottenute 10 volte in ogni animale.3 Tutti i dati sono stati analizzati utilizzando il software ANADAT (RHT-InfoData, Inc, Montreal, Quebec, Canada).
Raccolta e lavorazione del BALF e dei tessuti
Il liquido di lavaggio broncoalveolare (BALF) è stato raccolto con una cannula in polietilene che è stata inserita nella trachea e attraverso la quale è stato instillato e successivamente aspirato un volume totale di 1 ml di PBS contenente 10 ml di EDTA. BALF è stato centrifugato a 300g per 10 minuti a 4°C. Il supernatante è stato rimosso e il pellet è stato risospeso in 250 μL di PBS.
Il polmone sinistro è stato rimosso, congelato immediatamente in azoto liquido, e conservato a -80°C per l’analisi molecolare, mentre il polmone destro è stato conservato in soluzione di paraformaldeide al 4% per le analisi istologiche.
Anche i linfonodi mediastinici, il midollo osseo femorale, la milza e il timo sono stati rimossi e macerati con 1 ml di PBS. I linfonodi mediastinici e il timo sono stati pesati prima della macerazione. Tutti i campioni sono stati conservati a 4°C.
Conteggio totale e differenziale delle cellule
Per la conta totale delle cellule, tutti i campioni sono stati quantificati in un emocitometro al microscopio ottico dopo la diluizione dei campioni in soluzione di Türk. Sospensioni cellulari da BALF e timo sono stati bloccati con anti-CD16/32 (eBioscience, San Diego, California) e poi colorati con anticorpi primari specifici. Le cellule T sono state caratterizzate dall’utilizzo di monoclonale anti-topo CD3 (con etichetta Pe-Cy5-), CD4 (con etichetta FITC), e CD8 (FITC-etichettati) anticorpi, mentre gli eosinofili erano caratterizzati dalla colorazione con l’anticorpo Siglec-F anti-topo (marcato con PE; BD Pharmingen, San Diego, California) nelle popolazioni polimorfonucleate. Tutti i dati sono stati acquisiti in un citometro a flusso FACSCalibur (BD Biosciences Immunocytometry Systems, San Jose, California) e analizzati con il software FlowJo X 10.0.7 (Tree Star Inc, Ashland, Oregon).
Istologia polmonare
Le sezioni (spessore 4 μm) sono state tagliate, deparaffinate e colorate per l’analisi istologica. Per la quantificazione delle fibre di collagene in setti alveolari, le sezioni sono state colorate con Sirius Red disciolto in acido picrico saturo per la successiva analisi attraverso la microscopia ottica a luce polarizzata (BX51, Olympus Latin America Inc, Miami, Florida), con ingrandimento inferiore a 400. L’area occupata dalle fibre è stata determinata dal riconoscimento densitometrico digitale (Image-Pro Plus 7.1 Software, Media Cybernetics, Silver Spring, Maryland) e divisa per l’area dei setti alveolari. I risultati sono stati espressi come area frazionaria occupata dalle fibre di collagene.3 Per la quantificazione dell’actina muscolare α-liscia (α-actina), l’immunoistochimica è stata eseguita utilizzando un anticorpo monoclonale (α-actina; Dako, Carpinteria, California) ad una diluizione di 1:500. L’analisi è stata eseguita applicando la tecnica del conteggio dei punti.14 Utilizzando una griglia a 121 punti, la proporzione di volume di α-actina è stata calcolata come rapporto tra i punti che cadono sul tessuto macchiato di actina e non macchiato. Per determinare l’infiammazione del parenchima polmonare, le fette sono state colorate con ematossilina ed eosina. I cambiamenti infiammatori sono stati classificati secondo un sistema di punteggio semiquantitativo come assenti (punteggio 0), lievi (punteggio 1-2), moderati (punteggio 3), o gravi (punteggio 4) da due ricercatori ciechi. Sono stati adottati i seguenti criteri di punteggio: 0, nessuna evidenza di infiammazione; 1, poche cellule infiammatorie nell’area peribronchiale; 2, un anello di cellule infiammatorie (uno strato di cellule profondo); 3, un anello di cellule infiammatorie profondo da due a quattro cellule; e 4, un anello di cellule infiammatorie profondo più di quattro cellule.15
Test di immunosorbimento enzimatico (ELISA)
I tessuti polmonari e gli omogeneizzati del timo sono stati utilizzati per le quantificazioni del mediatore. In breve, il polmone destro è stato isolato, omogeneizzato in soluzione tampone di lisi, centrifugato (600g per 5 minuti e 10.000g per 10 minuti), e il supernatante risultante saggiato. Il contenuto totale di proteine è stato misurato dal reagente di Bradford (Sigma-Aldrich). I livelli di proteine di IL-4, IL-13, eotassina, IL-10, fattore di crescita trasformante (TGF)-β (tessuto polmonare), e la morte cellulare programmata proteina-1 (PD-1) e IL-10 (timo) sono stati valutati da ELISA (BioLegend, San Diego, California) utilizzando anticorpi corrispondenti in conformità con le istruzioni del produttore. La concentrazione finale è stata normalizzata al contenuto proteico totale ed espressa in pg/mg.
Analisi dei marcatori associati all’immunosoppressione
Il tessuto timico è stato lisato per l’estrazione dell’RNA dal Mini Kit RNeasy Plus (Qiagen, Valencia, California) secondo le istruzioni del produttore. La concentrazione di RNA totale è stata misurata mediante spettrofotometria in un sistema Nanodrop ND1000, e il cDNA del primo filamento è stato sintetizzato dall’RNA totale utilizzando il Kit di trascrizione inversa del cDNA ad alta capacità (Applied Biosystems, Foster City, California). I livelli di mRNA relativi sono stati misurati con Bryt Green (Promega, Fitchburg, Wisconsin) utilizzando un sistema di PCR Mastercycler ep realplex PCR (Eppendorf, Amburgo, Germania). Tutti gli esperimenti sono stati eseguiti in triplice copia. Il livello relativo di ogni gene è stato normalizzato al gene di mantenimento della casa fosfoproteina ribosomica acida P0(36B4) ed espresso come il cambiamento di piega rispetto al gruppo CTRL utilizzando il metodo 2-ΔΔCt,dove Δ Ct = Ct(gene target) – Ct(gene di mantenimento).
16 L’espressione mRNA dei seguenti geni è stata analizzata: indoleamina 2,3-diossigenasi (IDO)-2, CD39, galectina, antigene citotossico associato ai linfociti T (CTLA)-4, PD-1, e IL-10. Le sequenze dei primer PCR si trovano nella tabella informativa di supporto S1.
Analisi statistica
Le differenze tra i gruppi sono state valutate utilizzando l’ANOVA a senso unico seguito dal test di Bonferroni o da un test dello Studente non accoppiato. I dati sono stati espressi come media±SD. Tutti i test sono stati eseguiti utilizzando il pacchetto software Prism 6.07 (GraphPad Software Inc, La Jolla, California), e la significatività statistica è stata stabilita a P</05.
RISULTATI
Dosi multiple di MSC riducono l’infiammazione polmonare nell’asma allergica indotta da HDM
I livelli di proteine di IL-4, IL-13, eotaxina erano più alti negli omogeneizzati del tessuto polmonare di HDM-SAL rispetto ai topi CTRL. Sia due che tre dosi di CSM hanno ridotto significativamente i livelli proteici di questi mediatori infiammatori. Non sono state osservate differenze nei livelli proteici di IL-10 tra i gruppi sperimentali (Figura 1).
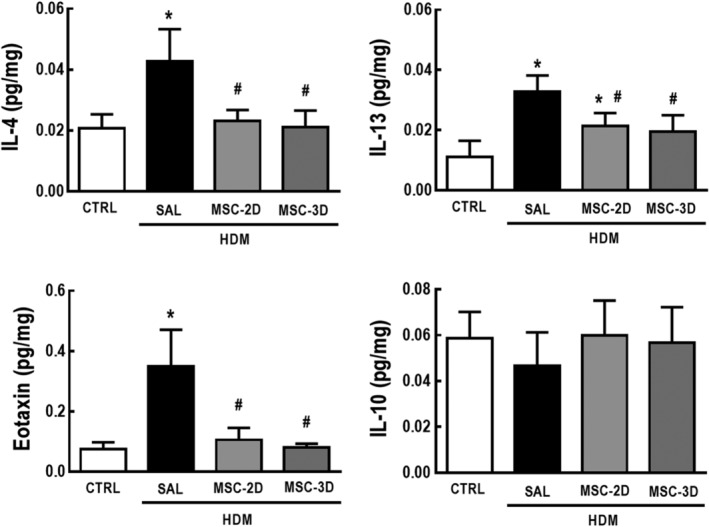
Figura 1.Dosi multiple di cellule mesenchimali stromali (CSM) hanno ridotto i livelli proteici dei mediatori associati all’infiammazione polmonare nei mediatori dell’acaro della polvere domestica (HDM)- asma allergica indotta dall’asma. Livelli proteici di interleuchina (IL)-4, IL-13, eotassina e IL-10 negli omogeneizzati del tessuto polmonare. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di animali sox per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)
Il gruppo HDM-SAL ha dimostrato un aumento del numero di cellule nelle aree peribronchiali, con punteggi di infiammazione polmonare moderata rispetto ai topi CTRL. Sia due e tre dosi di CSM hanno ridotto l’infiltrazione cellulare nelle aree peribronchiali per conteggi coerenti con un punteggio di infiammazione polmonare lieve (Figura 2).
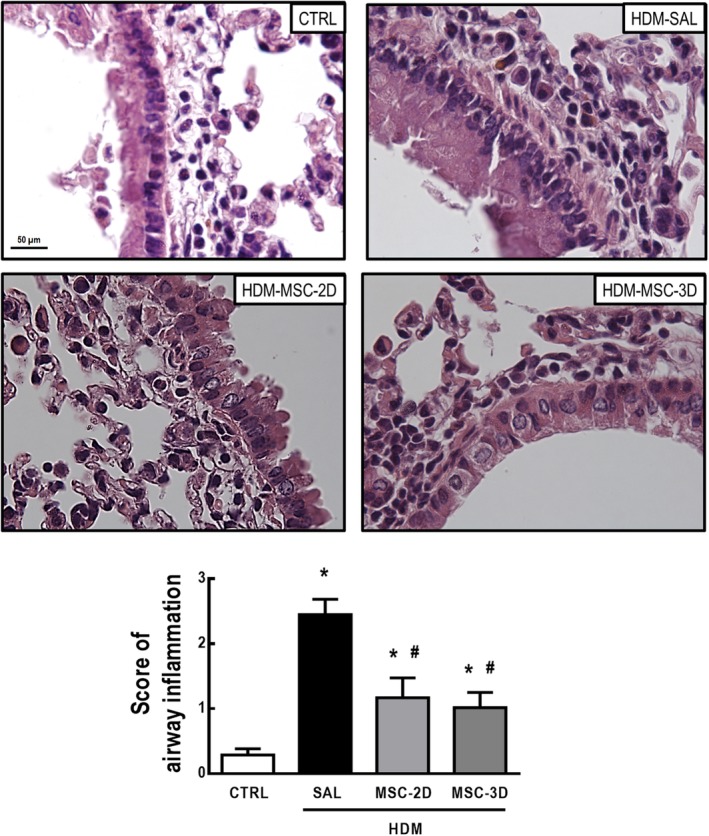
Figura 2.Figura 2. Dosi multiple di cellule mesenchimali stromali (CSM) hanno ridotto l’infiammazione polmonare nell’acaro della polvere domestica (HDM) – asma allergica indotta da asma. Fotomicrografie rappresentative del tessuto polmonare e il punteggio di infiltrazione cellulare infiltrazione in aree peribronchiali. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)
Rispetto ai topi CTRL, il gruppo HDM-SAL ha dimostrato un aumento del numero di celle totali e differenziali nel BALF. Sia due e tre dosi di MSC sono stati in grado di ridurre i leucociti totali, CD4 + T-cellule, e la conta degli eosinofili (Figura 3; Informazioni di supporto Figura S2).
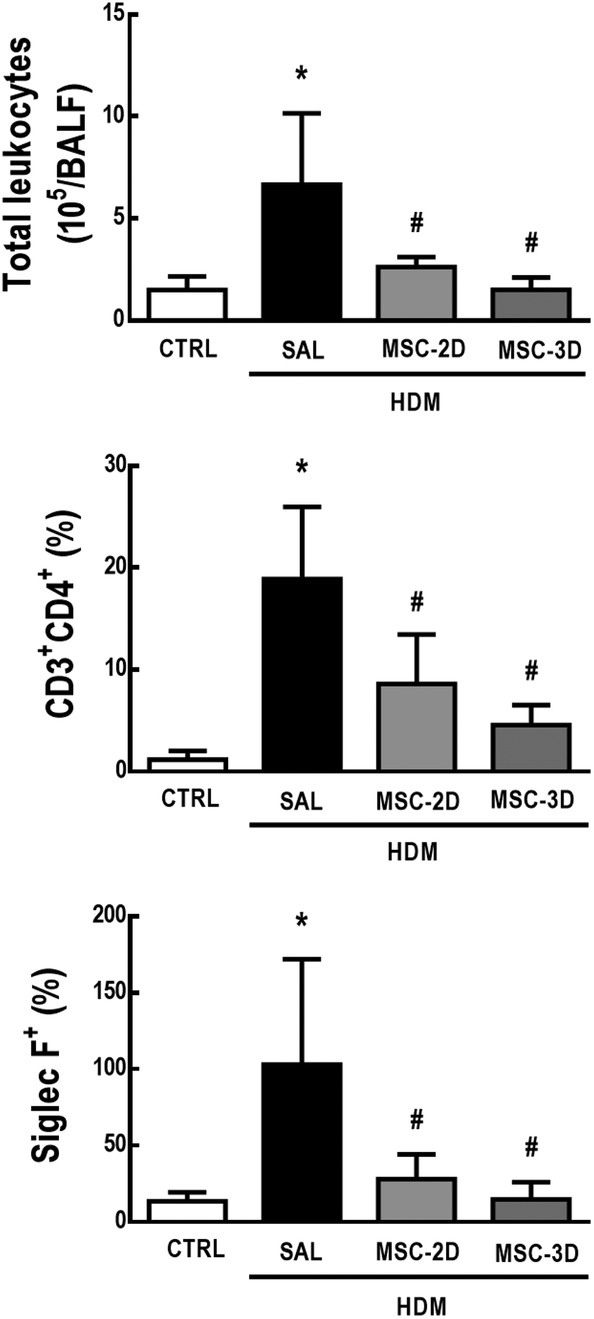
Figura 3.Figura 3. Dosi multiple di cellule mesenchimali stromali (MSC) hanno ridotto la conta totale e differenziale delle cellule nel liquido di lavaggio broncoalveolare (BALF) nell’acaro della polvere domestica (HDM) – asma allergica indotta dall’asma. Numero di leucociti totali, CD4+ cellule T ed eosinofili nel BALF. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)

Figura 1.Dosi multiple di cellule mesenchimali stromali (MSC) hanno ridotto i livelli proteici dei mediatori associati all’infiammazione polmonare associati all’acaro della polvere domestica (HDM) – asma allergica indotta dall’asma. Livelli proteici di interleuchina (IL)-4, IL-13, eotassina e IL-10 negli omogeneizzati del tessuto polmonare. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di animali sox per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)

Figura 2.Dosi multiple di cellule mesenchimali stromali (MSC) hanno ridotto l’infiammazione polmonare nell’acaro della polvere domestica (HDM)- asma allergica indotta dall’asma. Fotomicrografie rappresentative del tessuto polmonare e il punteggio di infiltrazione cellulare infiltrazione in aree peribronchiali. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)

Figura 3.Figura 3. Dosi multiple di cellule mesenchimali stromali (MSC) hanno ridotto il numero totale e differenziale di cellule nel liquido di lavaggio broncoalveolare (BALF) nell’acaro della polvere domestica (HDM) – asma allergica indotta da asma. Numero di leucociti totali, CD4+ cellule T ed eosinofili nel BALF. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)
Tre dosi di MSC hanno portato ad un’ulteriore riduzione del rimodellamento polmonare rispetto al regime a due dosi
Gli animali HDM-SAL hanno dimostrato un aumento dei livelli di TGF-β, così come della quantità di fibre di collagene e di α-actina nei setti alveolari rispetto ai topi CTRL. Sia due che tre dosi di MSC hanno ridotto i livelli di TGF-β e il contenuto di fibre di collagene nel tessuto polmonare; tuttavia, il regime a tre dosi è stato più efficace, riducendo questi parametri a livelli comparabili con il CTRL. Il regime a tre dosi, ma non due dosi di MSC, ha ridotto il contenuto di α-actina nei setti alveolari (Figura 4).
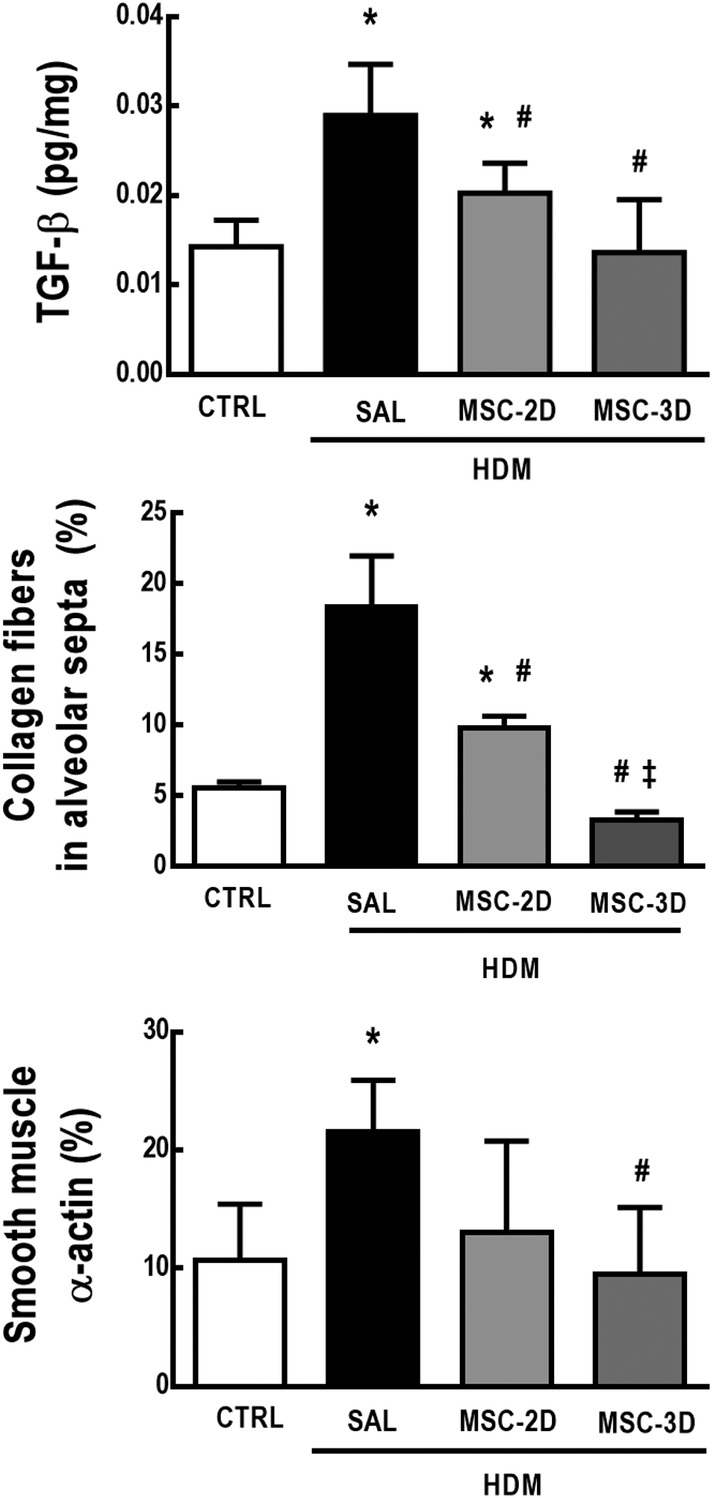
Figura 4.Un regime di tre dosi di cellule mesenchimali stromali (MSC) ha portato ad un’ulteriore riduzione del rimodellamento polmonare nell’acaro della polvere di casa (HDM) – asma allergica indotta dall’acaro della polvere – rispetto ad un regime a due dosi. Livelli di proteine del fattore di crescita trasformante (TGF)-β; contenuto di fibre di collagene nei setti alveolari e percentuale di contenuto di α-actina nel tessuto polmonare. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di cellule mesenchimali stromali (MSC) (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo.*Significativamente diverso dal CTRL (P<<<05/05). #Significativamentediverso da HDM-SAL (P<<-.05). ‡ Significativamente diverso da HDM-MSC-2D (P<-.05)

Figura 4.Un regime di tre dosi di cellule mesenchimali stromali (MSC) ha portato ad un’ulteriore riduzione del rimodellamento polmonare nell’acaro della polvere di casa (HDM) – asma allergica indotta dall’acaro della polvere – rispetto ad un regime a due dosi. Livelli di proteine del fattore di crescita trasformante (TGF)-β; contenuto di fibre di collagene nei setti alveolari e percentuale di contenuto di α-actina nel tessuto polmonare. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di cellule mesenchimali stromali (MSC) (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo.*Significativamente diverso dal CTRL (P<<<05/05). #Significativamentediverso da HDM-SAL (P<<-.05). ‡ Significativamente diverso da HDM-MSC-2D (P<-.05)
Le dosi multiple di MSC hanno portato a miglioramenti dei parametri della meccanica polmonare
I topi HDM-SAL hanno dimostrato un aumento di Est,L e ΔP1,L superiore rispetto al gruppo CTRL (rispettivamente 1,4 e 2,5 volte superiore). Sia due e tre dosi di MSC hanno ridotto questi parametri a livelli comparabili con il CTRL (Figura 5).
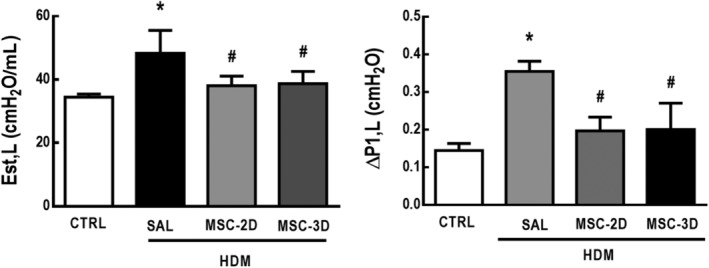
Figura 5.Dosi multiple di cellule mesenchimali stromali (MSC) hanno portato a miglioramenti nella meccanica polmonare. Elastanza polmonare statica (Est,L) e pressioni resistive (ΔP1,L). CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. Acaro della polvere di casa (HDM)-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)

Figura 5.Le dosi multiple di cellule mesenchimali stromali (MSC) hanno portato a miglioramenti nella meccanica polmonare. Elastanza polmonare statica (Est,L) e pressioni resistive (ΔP1,L). CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. Acaro della polvere di casa (HDM)-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)
Dosi multiple di CSM hanno ridotto la conta totale dei leucociti nel midollo osseo, nella milza e nei linfonodi mediastinici, ma non nel timo
La sfida salina vs HDM e il trattamento con soluzione salina vs dosi multiple di MSC non ha avuto alcun effetto sul peso corporeo (Tabella informativa di supporto S2). Tuttavia, il peso relativo del timo è stato aumentato in HDM-SAL rispetto ai topi CTRL. Entrambi i regimi MSC a due e tre dosi hanno ridotto il peso relativo del timo a livelli comparabili con il CTRL. Non sono state osservate differenze nel peso relativo dei linfonodi mediastinici tra i gruppi sperimentali (Figura di supporto S3).
Gli animali HDM-SAL hanno dimostrato un aumento della conta totale dei leucociti nel midollo osseo, nella milza, nei linfonodi mediastinici e nel timo rispetto ai topi CTRL. Entrambi i regimi MSC a due e tre dosi hanno ridotto la conta totale dei leucociti nel midollo osseo, nella milza e nei linfonodi mediastinici, ma non nel timo (Figura 6). Per escludere l’ipotesi che manipolazioni multiple per la somministrazione endovenosa di CSM possano causare stress e inducano un effetto sugli organi linfoidi, ad una coorte separata di topi (SHAM) è stata somministrata una singola finta sfida con soluzione fisiologica, mentre il gruppo CTRL è stato sfidato con soluzione fisiologica e trattato con soluzione fisiologica per tre giorni consecutivi in parallelo ai rimanenti gruppi sperimentali. Gli animali CTRL e SHAM non hanno dimostrato differenze significative nel conteggio totale delle cellule nel midollo osseo(P = .4420), milza(P = .1318), o timo( P = .7733), né qualsiasi altra alterazione fisiologica.
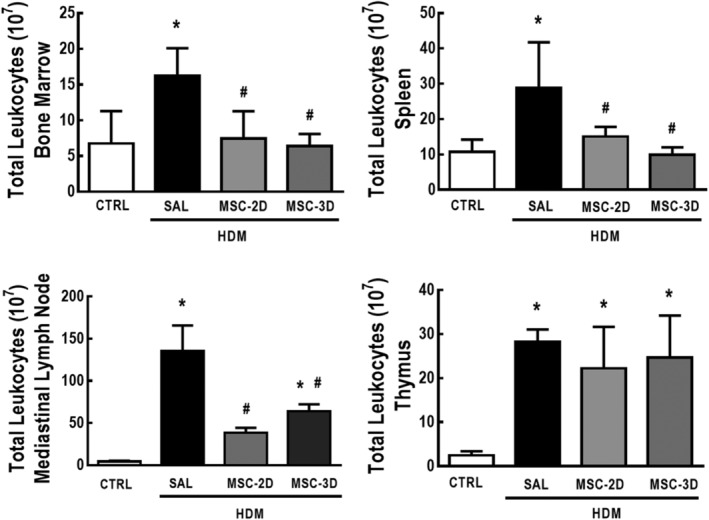
Figura 6.Figura 6. Dosi multiple di cellule mesenchimali stromali (MSC) hanno ridotto la conta totale dei leucociti in organi linfoidi in acaro della polvere domestica (HDM) – asma allergica indotta da asma. Conta totale dei leucociti nel midollo osseo, milza, linfonodi mediastinici e timo. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)

Figura 6.Le dosi multiple di cellule mesenchimali stromali (MSC) hanno ridotto la conta totale dei leucociti negli organi linfoidi degli organi linfoidi dell’acaro della polvere domestica (HDM) – asma allergica indotta dall’asma. Conta totale dei leucociti nel midollo osseo, milza, linfonodi mediastinici e timo. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<05/05)
Dosi multiple di MSCs percentuale modulata in modo differenziato di sottopopolazioni di cellule T mentre aumenta l’espressione dei marcatori immunosoppressivi nel timo
Per analizzare se dosi multiple di MSC possono portare ad un aumento dell’espressione dei marcatori immunosoppressivi, una coorte di topi è stata trattata con desametasone (DEXA; 1 mg / kg, 3 giorni consecutivi) dopo l’ultima sfida con HDM, come controllo positivo per l’immunosoppressione.
Rispetto a entrambi i gruppi CTRL e HDM-SAL, i topi HDM-DEXA hanno dimostrato una maggiore percentuale di cellule CD4+CD8+, così come una significativa riduzione della percentuale di cellule CD4+CD8low eCD4+CD8-. Anche il gruppo HDM-MSC-3D ha dimostrato un aumento della percentuale di cellule CD4+CD8+ e una riduzione della percentuale dicellule CD4+CD8low rispetto ai topi HDM-SAL. Il gruppo HDM-MSC-2D ha dimostrato una tendenza alla riduzione del numero di cellule CD4+CD8low, ma la differenza non era statisticamente significativa rispetto al gruppo CTRL (P = .0656) (Tabella informativa di supporto S3).
I gruppi CTRL e HDM-SAL avevano livelli simili di IDO-2, galectina, CTLA-4, PD-1, e IL-10, mentre i livelli di CD39 sono stati ridotti in HDM-SAL rispetto agli animali CTRL. I livelli di galectina, CTLA-4, PD-1 e IL-10 sono stati aumentati in HDM-DEXA rispetto a CTRL e HDM-SAL. Anche gli animali HDM-DEXA hanno dimostrato un aumento dei livelli di IDO-2 rispetto al CTRL. Due dosi di MSC hanno solo aumentato i livelli di galectina, mentre il regime di tre dosi di MSC ha aumentato i livelli di galectina, PD-1, e IL-10 rispetto sia al CTRL che all’HDM-SAL. I livelli di CD39 sono stati aumentati anche in HDM-MSC-3D rispetto a HDM-SAL, HDM-DEXA e HDM-MSC-2D (Figura 7). I livelli di proteine di PD-1 e IL-10 sono stati aumentati anche negli omogeneizzati del timo provenienti da animali HDM-DEXA e HMD-MSC-3D rispetto a CTRL, HMD-SAL, e HMD-MSC-2D (Figura S4).
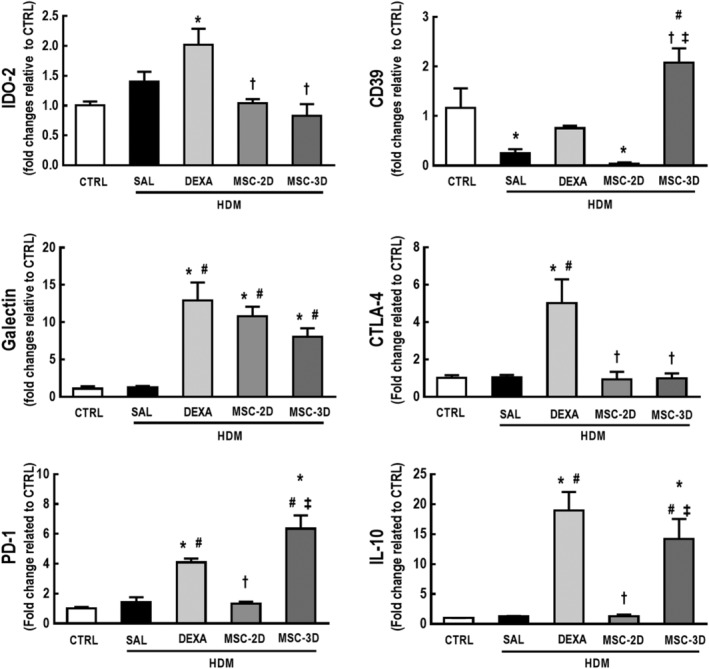
Figura 7.Figura 7. Terapia con desametasone e dosi multiple di cellule stromali mesenchimali (MSC) livelli di espressione modulati in modo differenziato di marcatori associati all’immunosoppressione nel timo dell’acaro della polvere di casa (HDM) – asma allergica indotta dall’asma. Livelli di espressione di indoleamina 2,3-diossigenasi (IDO)-2, CD39, galectina, antigene citotossico associato ai linfociti T (CTLA)-4, recettore di morte programmata (PD)-1, e interleuchina (IL)-10 nel tessuto del timo. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-DEXA, topi sfidati con HDM e trattati con desametasone. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<-.05). † Significativamente diverso da HDM-DEXA (P<-.05). ‡ Significativamente diverso da HDM-MSC-2D (P<-.05)

Figura 7.Figura 7. Terapia con desametasone e dosi multiple di cellule mesenchimali stromali (MSC) livelli di espressione modulati in modo differenziato di marcatori associati all’immunosoppressione nel timo dell’acaro della polvere di casa (HDM) – asma allergica indotta da asma. Livelli di espressione di indoleamina 2,3-diossigenasi (IDO)-2, CD39, galectina, antigene citotossico associato ai linfociti T (CTLA)-4, recettore di morte programmata (PD)-1, e interleuchina (IL)-10 nel tessuto del timo. CTRL, topi sfidati con soluzione fisiologica e trattati con soluzione fisiologica. HDM-SAL, topi sfidati con HDM e trattati con soluzione fisiologica. HDM-DEXA, topi sfidati con HDM e trattati con desametasone. HDM-MSC-2D, topi sfidati con HDM e trattati con due dosi di MSC (105 cellule per dose). HDM-MSC-3D, topi sfidati con HDM e trattati con tre dosi di MSC. I dati sono presentati come mezzi ± SD di sei animali per gruppo. *Significativamente diverso da CTRL(P<<<.05). *Significativamentediverso da HDM-SAL (P<<-.05). † Significativamente diverso da HDM-DEXA (P<-.05). ‡ Significativamente diverso da HDM-MSC-2D (P<-.05)
DISCUSSIONE
In questo studio, dosi multiple di CSM hanno portato ad una significativa riduzione sia dell’infiammazione polmonare che del rimodellamento, e ad un miglioramento della funzione polmonare in un modello di asma allergica indotta da HDM. Inoltre, dosi multiple di CSM hanno ridotto la conta totale dei leucociti nel midollo osseo, nella milza e nei linfonodi mediastinici, modulando al contempo le sottopopolazioni delle cellule T e migliorando i livelli di espressione dei mediatori associati all’immunosoppressione nel timo.
L’HDM è presente in quasi tutti gli ambienti ed è l’allergene più comune implicato nell’insorgenza dell’asma umana, interessando circa l’85% dei pazienti asmatici a livello globale.17, 18 Nei modelli sperimentali, l’HDM riproduce da vicino diverse caratteristiche distintive della malattia umana, tra cui il processo infiammatorio con Th2 e le risposte eosinofile e il rimodellamento delle vie aeree e del parenchima polmonare.4, 12, 19 In questo studio, le CSM sono state somministrate per via endovenosa 24 ore dopo l’ultima sfida dell’HDM per riprodurre una situazione clinicamente rilevante, poiché l’infiammazione e il rimodellamento polmonare sono stati stabiliti e la funzione polmonare è stata compromessa. Sebbene le MSC derivate dal midollo osseo abbiano dimostrato effetti terapeutici in questo modello di asma allergica indotta da HDM4 ,la disponibilità di queste cellule è limitata nello scenario clinico, poiché è necessaria una procedura di prelievo invasiva. Pertanto, in questo caso abbiamo utilizzato cellule raccolte da tessuto adiposo umano, che è una fonte interessante di MSC, in quanto possono essere facilmente ottenute per liposuzione. Inoltre, si stima che il tessuto adiposo contenga un numero maggiore di MSC rispetto al midollo osseo, e queste cellule sembrano essere espandibili ad un numero maggiore di passaggi,20, 21 fornendo così vantaggi interessanti per l’uso in un regime a dosi multiple.
In studi precedenti, una singola dose di CSM ha ridotto l’afflusso polmonare di cellule infiammatorie, l’iperreattività delle vie aeree e l’ipersecrezione del muco in modelli di asma allergica indotta dall’ovoalbumina.3, 7, 8, 22, 23 Nell’asma allergica indotta da HDM, una singola dose di CSM somministrata in modo profilattico ha anche impedito l’infiammazione modulando l’attivazione delle cellule epiteliali.24 Tuttavia, gli effetti sul processo infiammatorio erano solo marginali, senza miglioramenti nella funzione polmonare e nel rimodellamento quando le CSM sono state somministrate terapeuticamente.4, 5 In questo studio, sia due che tre dosi di CSM hanno ridotto la conta delle cellule infiammatorie nelle aree peribronchiali, nonché la conta totale dei leucociti, delle cellule T CD4+ e degli eosinofili nel BALF. Dosi multiple di CSM hanno anche portato a un miglioramento della meccanica polmonare. O due o tre dosi di MSCs ridotto i livelli proteici di IL-4, IL-13, eotassina nel tessuto polmonare, anche se i livelli proteici di IL-10 sono rimasti inalterati. In particolare, una singola dose di CSM derivate dal midollo osseo, ma non le CSM derivate dal tessuto adiposo, ha aumentato i livelli di IL-10 nel tessuto polmonare nell’asma allergica sperimentale,4, 5 il che suggerisce che il regime a dosi multiple di CSM derivate dal tessuto adiposo ha soppresso le risposte Th2 ed eosinofile da un meccanismo IL-10 indipendente.
IL-4 e IL-13 contribuiscono non solo al processo infiammatorio, ma anche al rimodellamento polmonare, in quanto possono indurre apoptosi delle cellule epiteliali, proliferazione dei fibroblasti, iperreattività delle vie aeree e ipersecrezione del muco.25, 26 TGF-β partecipa anche al processo di rimodellamento aumentando la deposizione della matrice extracellulare e promuovendo la differenziazione dei fibroblasti ai miofibroblasti, come riflesso dall’aumento del contenuto di α-actina dei muscoli lisci.26, 27 Sebbene una singola dose di MSC non sia stata in grado di invertire il rimodellamento polmonare in questo modello di asma allergica indotta da HDM,4 inostri attuali risultati dimostrano che dosi multiple di MSC possono esercitare questo effetto. Infatti, tre dosi di CSM sono state ancora più efficaci di un regime a due dosi, riducendo così la fibra di collagene e il contenuto di α-actina nel muscolo liscio nei setti alveolari, e i livelli di proteine di IL-13 e TGF-β a livelli comparabili a CTRL. Altri studi hanno anche dimostrato migliori effetti sul rimodellamento dopo ripetute terapie cellulari in modelli distinti di lesioni polmonari,6,11 indicando che più di una dose di CSM può indurre una riepitelizzazione più organizzata ed efficace. Inoltre, dosi multiple di CSM hanno portato a benefici terapeutici prolungati in un modello murino non obeso con diabete grave28e nel modello murino SOD1G93A della sclerosi laterale amiotrofica.29
Sebbene i meccanismi con cui le MSC inducono le azioni terapeutiche non siano del tutto chiariti, queste cellule hanno la capacità di promuovere l’immunomodulazione.3, 9, 10, 23, 30 In questo studio, dosi multiple di CSM hanno alleviato l’infiammazione polmonare, che può anche essere correlata alla riduzione della conta totale dei leucociti nel midollo osseo, nella milza e nei linfonodi mediastinici. Poiché il traffico di linfociti tra gli organi linfoidi durante il processo di differenziazione, le CSM possono bloccare la loro produzione e/omaturazione31, 32 inibendo così il reclutamento di cellule infiammatorie nei polmoni. In un modello di enfisema indotto dall’elastasi, la somministrazione ripetuta di CSM ha prodotto anche effetti immunosoppressivi sugli organi linfoidi.6 Tuttavia, i topi HDM hanno dimostrato una riduzione del peso relativo del timo, ma non della conta totale dei leucociti in questo organo, dopo dosi multiple di CSM. Pertanto, abbiamo ulteriormente studiato l’impatto di dosi multiple di CSM sulle sottopopolazioni linfocitarie, poiché il timo gioca un ruolo critico nella differenziazione e nella maturazione delle cellule T. Inoltre, un ulteriore gruppo di topi HDM è stato trattato con desametasone, una terapia raccomandata per i pazienti asmatici, come controllo positivo.2, 12 Sebbene due dosi di CSM non abbiano provocato cambiamenti significativi nelle percentuali di sottopopolazioni di cellule T rispetto ai gruppi CTRL e HDM-SAL, sia il regime a tre dosi di CSM che la terapia con desametasone hanno ridotto la percentuale di celluleCD4+CD8-low,e il desametasone ha anche ridotto la percentuale di celluleCD4+CD8- nel timo dei topi HDM. È possibile che si verifichino eventi immunosoppressivi aumentando il numero di dosi di CSM, poiché studi precedenti hanno dimostrato che le CSM umane possono migrare nel timo dopo la somministrazione e prevenire la differenziazione deilinfociti31, 32 o addirittura promuovere la sopravvivenza delle cellule T immature in stato quiescente.33, 34 Questi fenomeni potrebbero spiegare il numero invariato di leucociti nel timo dopo la terapia delle MSC. La terapia con desametasone ha anche ridotto la percentuale di cellule CD4- CD8+nel timo, come riportato altrove.35 Dosi multiple di CSM hanno portato all’inibizione della maturazione delle cellule T CD4+, ma hanno avuto meno effetto sullo sviluppo delle cellule T CD8+.
L’immunosoppressione indotta da MSC è stata riportata in modelli di disturbi autoimmuni e in studi clinici in fase iniziale, con alcuni risultati promettenti per il trattamento della malattia dell’innesto contro la malattia dell’ospite, la sclerosi multipla, il lupus eritematoso sistemico e altre condizioni.36 Tuttavia, questo è il primo studio che dimostra che dosi multiple di CSM possono indurre effetti immunosoppressivi nell’asma allergica sperimentale. Oltre al suo impatto sulle sottopopolazioni delle cellule T, il regime delle MSC a tre dosi ha anche aumentato l’espressione dei marcatori associati all’immunosoppressione nel timo. Entrambe le dosi multiple di MSC e desametasone hanno aumentato l’espressione della galectina, che può prevenire la proliferazione dei linfociti T legandosi al recettore del dominio immunoglobulina e mucina delle cellule T (TIM)-3.37, 38 Svolge anche un ruolo chiave nella generazione di DC tollerogeni39 e nell’attività regolatoria delle cellule T (Treg).40 Tre dosi di MSC e desametasone hanno anche aumentato l’espressione di PD-1 e IL-10. Mentre le MSC possono produrre ligandi PD-1 per sopprimere la proliferazione delle cellule T CD4+ arrestando il ciclo cellulare41 , l’IL-10 può agire direttamente sul percorso di segnalazione del CD28 che porta all’anergia delle cellule T.42 In particolare, tre dosi di MSC e desametasone hanno avuto un impatto diverso sull’espressione di IDO-2, CD39 e CTLA-4. Il desametasone ha aumentato i livelli di espressione di CTLA-4, una molecola costimolante che induce effetti negativi sull’attivazione delle cellule T quando è legata a CD80/CD86,43 e IDO-2, un regolatore di IDO-1 che stimola l’apoptosi delle cellule T impoverendo il triptofano.44 D’altra parte, tre dosi di MSC hanno portato ad un aumento dei livelli di espressione del CD39, che induce effetti soppressivi sulle cellule T attivate aumentando la produzione di adenosina.45 Tali differenze suggeriscono che dosi multiple di CSM e desametasone possono indurre effetti immunosoppressivi attraverso meccanismi distinti. Anche se l’immunosoppressione indotta da CSM può ridurre le lesioni tissutali nei disturbi infiammatori incontrollati, si dovrebbero prendere in considerazione possibili complicazioni, poiché l’immunosorveglianza contro gli agenti patogeni opportunistici sarebbe ridotta e i pazienti con asma grave sono già clinicamente debilitati.
Questo studio ha alcune limitazioni che dovrebbero essere affrontate. Sono state selezionate due e tre dosi di CSM piuttosto che quattro o più, poiché un ulteriore aumento del numero di dosi di CSM avrebbe sottoposto gli animali a ulteriori procedure di anestesia. Un tale uso ripetuto di agenti anestetici potrebbe ostacolare i possibili effetti benefici delle CSM. Inoltre, sarebbero necessari più gruppi sperimentali, aggiungendo così più variabili all’analisi statistica comparativa. Ulteriori studi sono giustificati per valutare comparativamente gli effetti a breve e a lungo termine di dosi multiple.
CONCLUSIONE
Nell’asma allergica indotta da HDM, dosi multiple di MSC sono state associate a riduzioni dell’infiammazione e rimodellamento, con conseguente immunosoppressione delle cellule T. Questi risultati devono essere tenuti in considerazione per i futuri studi clinici.
CONTRIBUTI DELL’AUTORE
L.L.C.: ha condotto gli esperimenti e lo studio, ha contribuito alla raccolta e all’analisi dei dati, ha interpretato i dati, ha scritto la prima bozza; J.Z.K., D.G.X., P.C.O., H.L.M.G.: ha condotto gli esperimenti e ha contribuito alla raccolta e all’analisi dei dati; M.M.M.M. ha fornito revisioni critiche per importanti contenuti intellettuali; M.L.P.L.: ha interpretato i dati, ha scritto e curato il manoscritto; F.F.C.F. e P.R.M.R. hanno contribuito all’idea, alla concezione e alla progettazione dello studio, hanno interpretato i dati, hanno curato e revisionato il manoscritto. Tutti gli autori hanno approvato la versione finale del manoscritto.
CONFLITTO DI INTERESSI
Gli autori non hanno dichiarato alcun potenziale conflitto di interessi.
Informazioni di supporto
References
- Global Strategy for Asthma Management and Prevention. 2018. Publisher Full Text
- New therapies for asthma: is there any progress?. Trends Pharmacol Sci. 2010; 31(7):335-343. PubMed
- Human adipose tissue mesenchymal stromal cells and their extracellular vesicles act differentially on lung mechanics and inflammation in experimental allergic asthma. Stem Cell Res Ther. 2017; 8(1):151. DOI | PubMed
- Therapeutic administration of bone marrow‐derived mesenchymal stromal cells reduces airway inflammation without up‐regulating Tregs in experimental asthma. Clin Exp Allergy. 2018; 48(2):205-216. DOI | PubMed
- Mesenchymal stem cells regulate airway contractile tissue remodeling in murine experimental asthma. Allergy. 2014; 69(6):730-740. PubMed
- Impact of one versus two doses of mesenchymal stromal cells on lung and cardiovascular repair in experimental emphysema. Stem Cell Res Ther. 2018; 9(1):296. DOI | PubMed
- Intratracheal administration of adipose derived mesenchymal stem cells alleviates chronic asthma in a mouse model. BMC Pulm Med. 2018; 18(1):131. DOI | PubMed
- hMSCs suppress neutrophil‐dominant airway inflammation in a murine model of asthma. Exp Mol Med. 2017; 49(1):288. DOI
- Systemic administration of human bone marrow‐derived mesenchymal stromal cell extracellular vesicles ameliorates aspergillus hyphal extract‐induced allergic airway inflammation in immunocompetent mice. Stem Cells Translational Medicine. 2015; 4(11):1302-1316. DOI | PubMed
- Mesenchymal stromal cells mediate Aspergillus hyphal extract‐induced allergic airway inflammation by inhibition of the Th19 signaling pathway. Stem Cells Translational Medicine. 2014; 3:194-205. PubMed
- Repeated administration of bone marrow‐derived cells prevents disease progression in experimental silicosis. Cell Physiol Biochem. 2013; 32(6):1681-1694. DOI | PubMed
- Glucocorticoids decrease Treg cell numbers in lungs of allergic mice. Eur J Pharmacol. 2015; 747:52-58. DOI | PubMed
- Interrupter resistance elucidated by alveolar pressure measurement in open‐chest normal dogs. J Appl Physiol. 1988; 65(1):408-414. DOI | PubMed
- Eicosapentaenoic acid enhances the effects of mesenchymal stromal cell therapy in experimental allergic asthma. Front Immunol. 2018; 9:1147. PubMed
- Intranasal delivery of T‐bet modulates the profile of helper T cell immune responses in experimental asthma. J Investig Allergol Clin Immunol. 2008; 18(5):357-365.
- Analyzing real‐time PCR data by the comparative C(T) method. Nat Protoc. 2008; 3(6):1101-1108. PubMed
- Rewired RNAi‐mediated genome surveillance in house dust mites. PLoS Genet. 2018; 14(1):1007183. DOI
- Orchestrating house dust mite‐associated allergy in the lung. Trends Immunol. 2011; 32(9):402-411. DOI | PubMed
- Serum from asthmatic mice potentiates the therapeutic effects of mesenchymal stromal cells in experimental allergic asthma. Stem Cells Translational Medicine. 2019; 8(3):301-312. DOI | PubMed
- Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells. 2006; 24(5):1294-1301. PubMed
- Comparative analysis of human mesenchymal stem cells from bone marrow, adipose tissue and umbilical cord blood as sources of cell therapy. Int J Mol Sci. 2013; 14(9):17986-18001. DOI | PubMed
- Effects of mesenchymal stromal cells play a role the oxidant/antioxidant balance in a murine model of asthma. Allergol Immunophathol. 2018; 46(2):136-143. DOI
- Alveolar macrophages are critical for the inhibition of allergic asthma by mesenchymal stromal cells. J Immunol. 2013; 191(12):5914-5924. DOI | PubMed
- Immunomodulation of airway epithelium cell activation by mesenchymal stromal cells ameliorates house dust mite‐induced airway inflammation in mice. Am J Respir Cell Mol Biol. 2015; 53(5):615-624. DOI | PubMed
- Interleukin (IL)‐4, IL‐13 and IL‐17A differentially affect the profibrotic and proinflammatory functions of fibrocytes from asthmatic patients. Mucosal Immunol. 2012; 5(2):140-149. DOI | PubMed
- Remodeling in asthma. J Allergy Clin Immunol. 2011; 128:451-462. DOI | PubMed
- Role of transforming growth factor‐β in airway remodeling in asthma. Am J Respir Cell Mol Biol. 2011; 44(2):127-133. DOI | PubMed
- Infusion with human bone marrow‐derived mesenchymal stem cells improved β‐cell function in patients and non‐obese mice with severe diabetes. Sci Rep. 2016; 6:37894. DOI | PubMed
- Analysis of the therapeutic potential of different administration routes and frequencies of human mesenchymal stromal cells in the SOD1G93A mouse model of amyotrophic lateral sclerosis. J Tissue Eng Regen Med. 2019; 13(4):649-663. DOI | PubMed
- Current understanding of the therapeutic benefits of mesenchymal stem cells in acute respiratory distress syndrome. Cell Biol Toxicol. 2019. DOI
- Human bone marrow stromal cells suppress T‐lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli. Blood. 2002; 99(10):3838-3843. PubMed
- Bone marrow mesenchymal stem cells inhibit the response of naïve and memory antigen‐specific T cells to their cognate peptide. Blood. 2003; 101(9):3722-3729. PubMed
- Bone marrow mesenchymal stem cells induce division arrest anergy of activated T cells. Blood. 2005; 105:2821-2827. PubMed
- Human mesenchymal stem cells promote survival of T cells in a quiescent state. Stem Cells. 2007; 25:1753-1760. PubMed
- The tyrosine kinase inhibitor dasatinib reduces lung inflammation and remodelling in experimental allergic asthma. Br J Pharmacol. 2016; 173(7):1236-1247. PubMed
- Current understanding of the immunosuppressive properties of mesenchymal stromal cells. J Mol Med. 2019; 97(5):605-618. PubMed
- Galectin‐1, an endogenous lectin produced by thymic epithelial cells, induces apoptosis of human thymocytes. J Exp Med. 1997; 185(10):1851-1858. PubMed
- Activation of Tim‐3‐Galectin‐9 pathway improves survival of fully allogeneic skin grafts. Transpl Immunol. 2008; 19(1):12-19. DOI | PubMed
- Tolerogenic signals delivered by dendritic cells to T cells through a galectin‐1‐driven immunoregulatory circuit involving interleukin 27 and interleukin 10. Nat Immunol. 2009; 10(9):981-991. DOI | PubMed
- Regulatory T cell‐mediated suppression of inflammation induced by DR3 signaling is dependent on galectin‐9. J Immunol. 2017; 199(8):2721-2728. DOI | PubMed
- Expression and biological function of programmed death ligands in human placenta mesenchymal stem cells. Cell Biol Int. 2013; 37(2):137-148. DOI | PubMed
- IL‐10 directly acts on T cells by specifically altering the CD28 co‐stimulation pathway. Eur J Immunol. 2000; 30(6):1683-1890. PubMed
- Molecular mechanisms of T‐cell receptor and costimulatory molecule ligation‐blockade in autoimmune disease therapy. Immunol Rev. 2009; 229(1):337-355. DOI | PubMed
- IDO2 is critical for IDO1‐mediated T‐cell regulation and exerts a non‐redundant function in inflammation. Int Immunol. 2014; 26(7):357-367. DOI | PubMed
- Mesenchymal stromal cells up‐regulate CD39 and increase adenosine production to suppress activated T‐lymphocytes. Stem Cell Res. 2011; 7(1):66-74. DOI | PubMed
Fonte
Castro LL, Kitoko JZ, Xisto DG, Olsen PC, Guedes HLM, et al. (2019) Multiple doses of adipose tissue‐derived mesenchymal stromal cells induce immunosuppression in experimental asthma. Stem Cells Translational Medicine 9(2): . https://doi.org/10.1002/sctm.19-0120





