Introduzione
Il trattamento farmaceutico e l’attuazione di programmi di riabilitazione cardiaca hanno migliorato la prognosi dei pazienti con infarto miocardico acuto (AMI).1 Per ottenere il massimo beneficio, la conformità con l’assunzione di farmaci e la riabilitazione cardiaca sono essenziali per ridurre il rischio di AMI ricorrente, scompenso cardiaco e mortalità cardiovascolare. Uno studio recente2 ha dimostrato che la non aderenza ai beta-bloccanti, agli inibitori dell’enzima di conversione dell’angiotensina e alle statine è stata associata ad un aumento della mortalità associata al sistema cardiovascolare e causa di tutti i tipi di mortalità nei pazienti con malattia coronarica. Altri studi3 hanno dimostrato che i pazienti meglio informati sono più aderenti alla terapia. Pertanto, è necessario un intervento che possa aiutare a migliorare la compliance dei pazienti con la terapia basata sulle linee guida.
In generale, il termine “eHealth” si riferisce all’erogazione di farmaci mediante l’uso delle tecnologie dell’informazione ed è stato suggerito come strumento per fornire assistenza sanitaria.4,5 Può essere consegnato con personal computer, telefoni cellulari o tablet. Un vantaggio della fornitura di assistenza sanitaria tramite questi dispositivi mobili è che è possibile utilizzare un’infrastruttura già esistente. Attualmente, la maggior parte della popolazione del mondo occidentale ha accesso a Internet ed è in possesso di uno smartphone.6 Recentemente è stato dimostrato che il 92% della popolazione olandese (di età ≥12 anni) utilizza internet e l’89% della popolazione possiede uno smartphone.7
Un indicatore specificamente associato alla conformità alla terapia basata sulle linee guida è la pressione sanguigna (BP).2,8 Pertanto, qui viene presentato uno studio clinico randomizzato di fattibilità (RCT) che studia l’effetto della tecnologia intelligente sulla BP. I risultati secondari includono la soddisfazione del paziente e il ricovero in ospedale per eventi cardiaci avversi come marcatori di fattibilità.
Metodi
Condotta di prova
Il Box è stato un RCT di fattibilità a marchio aperto, a centro singolo, a gruppo parallelo, condotto presso il Dipartimento di Cardiologia del Leiden University Medical Center di Leiden, Paesi Bassi, tra il 2016 e il 2018. Una descrizione dettagliata dei metodi è stata pubblicata in precedenza.9 I pazienti sono stati randomizzati in modo 1:1 tra un intervento di tecnologia intelligente (“The Box”) e un follow-up regolare. Il protocollo di prova completo è mostrato nel Supplemento 1.
Il follow-up regolare è stato definito come 4 visite all’ambulatorio (1, 3, 6 e 12 mesi dopo l’AMI). Una versione dettagliata di questo protocollo è stata pubblicata in precedenza.10 Per l’ambulatorio, i pazienti dovevano recarsi in ospedale. Ogni ambulatorio consisteva in un elettrocardiogramma (ECG) di 10 secondi a 12 derivazioni, una misurazione della pressione arteriosa da parte di un infermiere e un colloquio di 15 minuti con il paziente da parte di un infermiere. Le visite di 1 mese, 6 mesi e 12 mesi comprendevano analisi di laboratorio. A 3 mesi è stato eseguito un ecocardiogramma da sforzo. A 3 e 6 mesi, è stata eseguita una procedura di monitoraggio Holter di 24 ore. A 6 e 12 mesi è stato eseguito un ecocardiogramma transtoracico.
Il protocollo di questo studio è stato approvato dal Comitato di Etica Medica del Centro Medico dell’Università di Leiden. Lo studio è stato condotto in conformità ai principi della Dichiarazione di Helsinki11 e la Buona Pratica Clinica.12 Tutti i partecipanti hanno fornito il consenso informato scritto offline prima della partecipazione. I dispositivi utilizzati in questo studio sono tutti contrassegnati da Conformité Européen. Questo studio segue le linee guida per la redazione di rapporti secondo gli Standard Consolidati di Reporting Trials(CONSORT).
Gruppo d’intervento
Nel gruppo d’intervento, le visite di follow-up di 1 mese e 6 mesi sono state sostituite da una visita elettronica (e-visit). Questa e-visita consisteva in un colloquio con il paziente effettuato tramite una connessione video protetta. I pazienti hanno utilizzato un tablet, uno smartphone o un computer. Tramite internet, sia l’infermiere che i pazienti hanno effettuato il login in una sala riunioni virtuale. I pazienti potevano accedere da qualsiasi luogo (anche da casa, dal posto di lavoro o da un luogo di vacanza), a condizione che avessero una connessione internet stabile. Di conseguenza, i pazienti non dovevano venire in ospedale. Le e-visite sono state effettuate dallo stesso infermiere che effettuava le regolari visite ambulatoriali. Il contenuto del colloquio con il paziente era paragonabile a quello della regolare visita ambulatoriale.
Il Box
L’intervento tecnologico intelligente comprendeva 4 dispositivi compatibili con gli smartphone: un monitor BP (Wireless Blood Pressure Monitor; Withings), un contapassi (Pulse Ox; Withings), una bilancia pesapersone (Smart Body Scale Analyzer; Withings) e un dispositivo ECG a singola deriva (Kardia; AliveCor Inc). Il monitor BP è un dispositivo oscillometrico. Si tratta di un bracciale preformato che deve essere applicato alla parte superiore nuda del braccio. Comunica con l’applicazione dedicata al dispositivo (app) sullo smartphone tramite Bluetooth. Il gonfiaggio del bracciale deve essere avviato nell’app. I pazienti devono stare fermi con la parte superiore del braccio alla stessa altezza del torace. Il risultato della misurazione viene visualizzato nell’app. In questo modo i pazienti possono vedere immediatamente la propria PA. I dati vengono automaticamente trasferiti e integrati nella cartella clinica elettronica del reparto. In questo modo, i risultati sono a disposizione di qualsiasi medico che sia legalmente autorizzato a visualizzare la cartella clinica elettronica di un singolo paziente. I dispositivi devono essere installati e sincronizzati la prima volta che vengono utilizzati. Il contapassi è un orologio da polso che registra l’ora e il numero di passi al giorno. Questi dati, così come i dati acquisiti dalla bilancia, vengono inviati all’applicazione via Bluetooth.
Il dispositivo ECG a singola deriva è grande all’incirca come una carta di credito. È dotato di 2 elettrodi. Per registrare un ECG a singola deriva, il paziente deve posizionare 2 dita della mano destra sull’elettrodo destro e 2 dita della mano sinistra sull’elettrodo sinistro. Un segnale a ultrasuoni viene generato e convertito in un segnale elettrico nello smartphone, che viene visualizzato come ECG a singola deriva sullo schermo dello smartphone. Le letture dell’ECG sono state inviate all’ospedale, dove sono state controllate da un professionista sanitario specializzato in progetti con un’ampia formazione, sotto la supervisione di un cardiologo consulente.
Ai pazienti è stato chiesto di registrare continuamente i loro passi, la loro BP e il loro peso ogni giorno, e il loro ECG ogni giorno e di registrare i sintomi di una possibile origine cardiaca. I dati sono stati esaminati quotidianamente da un professionista specializzato in progetti con un’ampia formazione. I dati non sono stati monitorati in modo continuo. Pertanto, l’intervento con tecnologia intelligente non ha sostituito l’assistenza di emergenza. I pazienti venivano contattati nel caso in cui la loro BP sistolica superasse i 139 mm Hg o la BP diastolica superasse gli 89 mm Hg. I pazienti sono stati contattati anche in caso di aritmie appena diagnosticate o di almeno 4 contrazioni ventricolari precoci sintomatiche appena diagnosticate sull’ECG a singola deriva. Tutti i dati clinici sono stati memorizzati nelle cartelle cliniche elettroniche dipartimentali dei pazienti (EPD-Vision; Leiden University Medical Center).
Popolazione dei pazienti
I pazienti ammessi al Dipartimento di Cardiologia del Centro Medico dell’Università di Leiden con AMI erano idonei a partecipare. Le pazienti erano escluse se avevano meno di 18 anni, erano incinte, non volevano firmare il consenso informato o non erano in grado di parlare olandese o inglese.
Risultati
Il punto di arrivo primario dello studio è stata la percentuale di pazienti con BP controllata dopo 1 anno di follow-up. La BP controllata è stata definita come una BP sistolica inferiore o uguale a 139 mm Hg e una BP diastolica inferiore o uguale a 89 mm Hg. La pressione sanguigna è stata misurata alla quarta visita ambulatoriale da un infermiere con uno sfigmomanometro aneroide portatile, che è stato posizionato intorno al braccio superiore nudo di preferenza del paziente.
Soddisfazione del paziente (risultato secondario)
La soddisfazione del paziente è stata misurata utilizzando il questionario sulla soddisfazione del paziente.13 Questo questionario è stato validato per misurare la soddisfazione delle cure in 7 settori: accesso alle cure, aspetti finanziari, disponibilità di risorse, continuità delle cure, qualità tecnica, modalità interpersonali e soddisfazione generale. I pazienti hanno letto 68 dichiarazioni riguardanti l’assistenza sanitaria e hanno indicato se sono (fortemente) d’accordo, (fortemente) in disaccordo, o non sono né d’accordo né in disaccordo. Ad ogni risposta è stato assegnato un punteggio, che è stato convertito in un punteggio finale compreso tra 0 e 100. Un punteggio vicino a 100 indicava un’elevata soddisfazione del paziente. I questionari sono stati dati ai pazienti 1, 6 e 12 mesi dopo l’inclusione.
Accettazione del paziente e aderenza alle misure (solo gruppo d’intervento)
Dopo 12 mesi è stato somministrato al gruppo di intervento un questionario esplorativo non convalidato. Il questionario includeva domande sulla soddisfazione per quanto riguarda l’intervento in generale, i singoli dispositivi e le visite ambulatoriali. Una domanda è iniziata con (“Siete soddisfatti di ….”), a cui i pazienti hanno potuto rispondere con un sì o un no. Le percentuali di pazienti che hanno risposto sì sono state prese come misura dell’accettazione dell’intervento con tecnologia intelligente da parte del paziente. Se un paziente inviava una BP o un ECG a singola deriva, era considerato aderente per quella settimana.
Tasso di partecipazione
Durante lo studio, il numero di pazienti che si sono rifiutati di partecipare e le loro ragioni principali per non partecipare sono state registrate nel database. Queste ragioni sono state classificate come segue: il timore di doversi confrontare troppo spesso con la loro malattia, il timore di non essere in grado di affrontare la tecnologia, il desiderio di essere seguiti in un altro ospedale e il rifiuto di dare un motivo o un altro motivo per non partecipare.
Mortalità
La mortalità è stata contata per tutti i casi in cui un paziente è stato dichiarato morto da un medico autorizzato e registrato come deceduto nel registro comunale. La mortalità era considerata una morte cardiovascolare se la causa primaria della morte era un evento cardiovascolare (ad esempio, AMI, ospedalizzazione per insufficienza cardiaca scompensata, o tachicardia ventricolare in cardiomiopatia ischemica).
Ricoveri ospedalieri per eventi avversi cardiaci non fatali
Come punto finale secondario esplorativo per la sicurezza, sono stati registrati i ricoveri per eventi cardiaci avversi non fatali. Questi eventi sono stati valutati da un comitato clinico di end point, composto da 2 cardiologi indipendenti di alto livello, non vedendo i dati del paziente e l’assegnazione del trattamento. In caso di disaccordo, un terzo cardiologo è stato coinvolto per raggiungere una decisione. Le definizioni sono riportate nell’appendice del supplemento 2.
Analisi statistica
Il calcolo della potenza è stato effettuato con il software statistico R versione 3.2.0 per Windows (R Project for Statistical Computing). Viene utilizzato un confronto di 2 proporzioni. Si prevedeva che il 95% dei pazienti del gruppo di intervento avrebbe regolato la BP e che il 75% dei pazienti del gruppo di controllo avrebbe regolato la BP. Sono stati scelti un α di 0,05, un β di 0,20 e un margine di 0,07, ottenendo un campione di 200 pazienti.
Le analisi dei punti finali primari e secondari sono state effettuate utilizzando la versione 23.0 del software statistico SPSS (IBM Corp). I dati sono stati analizzati secondo il principio dell’intention-to-treat. Le variabili continue sono state riassunte come media e SD. Le differenze nelle variabili continue sono state testate per la significatività con un test Mann-Whitney U. Il punto finale primario è stato testato per la significatività con un test χ 2. Le differenze nei ricoveri per eventi cardiaci avversi non fatali sono state testate per la significatività con un test di Fisher esatto. Tutti i test sono stati effettuati su 2 lati. Un α ≤,05 è stato considerato statisticamente significativo. L’analisi statistica è stata effettuata da gennaio 2019 a marzo 2019.
Risultati
Pazienti
In totale sono stati inclusi 200 pazienti (età mediana, 59,7 anni [intervallo interquartile {IQR}, 52,9-65,6 anni]; 156 uomini [78%]; indice di massa corporea mediana [calcolato come peso in chilogrammi diviso per l’altezza in metri quadrati], 27,1 [IQR, 24,8-30,1]), di cui 100 sono stati randomizzati al gruppo di intervento e 100 al gruppo di controllo. Non ci sono state differenze sostanziali nelle caratteristiche di base tra il gruppo di intervento e il gruppo di controllo (età mediana, 60,1 anni [IQR, 52,7-66,3 anni] vs 59,1 anni [IQR, 53,1-65,0 anni]; indice di massa corporea mediana, 27,1 [IQR, 24,8-30,1] vs 27,1 [IQR, 24,5-30,3]; 40% vs 37% dei pazienti con ipertensione)(Tabella 1). Un diagramma di flusso CONSORT dei pazienti analizzati è mostrato nella Figura 1.
| Caratteristica | Partecipanti, n. (%) | ||
|---|---|---|---|
| Totale (N==200) | Intervento (n = 100) | Controllo (n = 100) | |
| Età, mediana (IQR) [range], y | 59.7 (52.9-65.6) [28.4-81.0] | 60.1 (52.7-66.3) [37.6-81.0] | 59.1 (53.1-65.0) [28.4-79.6] |
| Maschio | 156 (78) | 81 (81) | 75 (75) |
| Indice di massa corporea, mediano (IQR)a | 27.1 (24.8-30.1) | 27.1 (24.8-30.1) | 27.1 (24.5-30.3) |
| Livello massimo di troponina, mediana (IQR), μg/L | 2.5 (0.8-5.6) | 2.5 (0.8-5.4) | 2.4 (0.8-5.6) |
| Livello massimo di creatina chinasi, mediana (IQR), U/L | 973 (401-2047) | 973 (454-2037) | 998 (309-2070) |
| Infarto miocardico da elevazione ST | 157 (79) | 79 (79) | 78 (78) |
| Ipertensione | 77 (39) | 40 (40) | 37 (37) |
| Malattia polmonare cronica ostruttiva | 10 (5) | 6 (6) | 4 (4) |
| Diabete di tipo 2 | 23 (12) | 12 (12) | 11 (11) |
| Precedenti incidenti cardiovascolari | |||
| Infarto del miocardio | 17 (9) | 8 (8) | 9 (9) |
| Corsa | 5 (3) | 4 (4) | 1 (1) |
| Attacco ischemico transitorio | 8 (4) | 6 (6) | 2 (2) |
| Anomalie note dell’elettrocardiogramma | 21 (11) | 10 (10) | 11 (11) |
| Utilizzo dello smartphone ogni giorno | 176 (88) | 89 (89) | 87 (87) |
| Monitoraggio domestico precedente | 45 (23) | 25 (25) | 20 (20) |
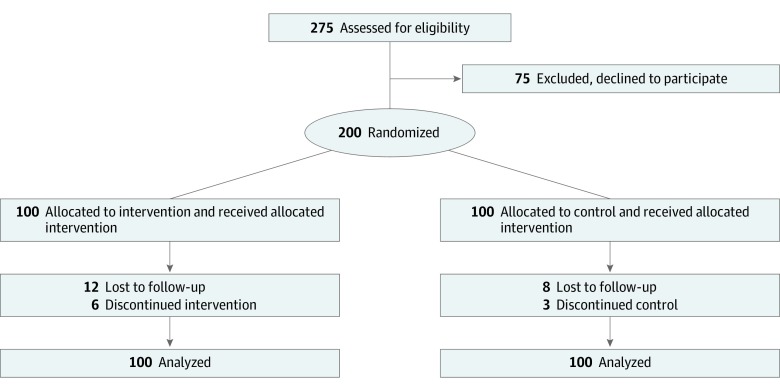
Figura 1.Diagramma di flusso CONSORT
Dei 200 pazienti inclusi nello studio, 24 non hanno raggiunto il follow-up di 1 anno. Quattro pazienti sono morti: 2 nel gruppo di intervento e 2 nel gruppo di controllo. Di questi 4 decessi, 3 avevano una causa cardiaca (1 nel gruppo di intervento e 2 nel gruppo di controllo). Un paziente è morto per intossicazione da alcol. Il tasso di mortalità per tutte le cause era del 2% in entrambi i gruppi(P>.99).
Venti pazienti sono stati persi per il follow-up (12 nel gruppo di intervento e 8 nel gruppo di controllo). Tuttavia, secondo la registrazione del comune, tutti erano vivi a 12 mesi dall’AMI.

Figura 1.Diagramma di flusso del CONSORT
BP controllata
Nel gruppo di intervento, il 79% dei pazienti aveva regolato la BP a 12 mesi. Nel gruppo di controllo, il 76% dei pazienti aveva una BP regolata. Questa differenza non era statisticamente significativa(P=.64).
Soddisfazione dei pazienti
Nel questionario sulla soddisfazione del paziente sono stati osservati risultati uguali. I punteggi medi (SD) per la soddisfazione generale sono stati di 82,6 (14,1) nel gruppo di intervento e di 82,0 (15,1) nel gruppo di controllo (P=.88). Altri ambiti ad alto punteggio sono stati interpersonali (media dei punteggi [SD], 86,9 [13,2] per l’intervento vs 86,9 [14,4] per il controllo), la comunicazione (media dei punteggi [SD], 83,4 [13,5] per l’intervento vs 85,2 [14,6] per il controllo), e la qualità tecnica (media dei punteggi [SD], 83,6 [12,4] per l’intervento vs 82,8 [13,7] per il controllo). Tutti i punteggi e i valori di P sono riportati nella Tabella 2. Nessuna differenza tra i gruppi di intervento e di controllo è stata statisticamente significativa.
| Dominio | Punteggio, medio (SD) | ValoreP | |
|---|---|---|---|
| Gruppo d’intervento | Gruppo di controllo | ||
| Accesso | 82.5 (11.7) | 81.5 (13.1) | .65 |
| Qualità tecnica | 83.6 (12.4) | 82.8 (13.7) | .77 |
| Comunicazione | 83.4 (13.5) | 85.2 (14.6) | .50 |
| Interpersonale | 86.9 (13.2) | 86.9 (14.4) | .72 |
| Tempo | 81.3 (19.9) | 82.2 (19.6) | .58 |
| Soddisfazione generale | 82.6 (14.1) | 82.0 (15.1) | .88 |
Accettazione del paziente (solo gruppo d’intervento)
Di tutti i pazienti del gruppo di intervento, il 90% ha indicato di essere soddisfatto dell’intervento con tecnologia intelligente. La soddisfazione per i singoli dispositivi è stata dell’88% per il monitor BP, dell’88% per la bilancia pesapersone, del 4% per il contapassi e dell’89% per il dispositivo ECG. In totale, l’80% dei pazienti è rimasto soddisfatto dell’e-visit. I pazienti che non erano soddisfatti hanno indicato i problemi tecnici come motivo principale della loro insoddisfazione. Infine, il 93% ha indicato di aver apprezzato il controllo supplementare da parte dell’ospedale, e il 96% ha indicato di aver apprezzato la possibilità di visualizzare i propri dati sanitari.
Aderenza
Di tutti i pazienti che hanno finito l’intervento, il 32% ha inviato misurazioni ogni settimana. In totale, il 63% ha inviato misurazioni in più dell’80% di tutte le 52 settimane in cui ha partecipato allo studio.
Tasso di partecipazione
In totale, 275 pazienti sono stati contattati per partecipare. La sperimentazione ha avuto un tasso di partecipazione del 73%. Questi pazienti avevano un’età media di 65 anni e il 64% erano maschi. La ragione principale (40%) per rifiutare la partecipazione allo studio era perché i pazienti temevano di doversi confrontare troppo spesso con la loro malattia. Altri motivi erano la paura della tecnologia (33%), il desiderio di essere seguiti in un altro ospedale (8%), nessun motivo (4%), o un altro motivo per non partecipare (15%).
Ricoveri per eventi cardiaci avversi non fatali
In totale si sono verificati 20 ricoveri per eventi cardiaci avversi non mortali. Otto si sono verificati (2 AMI ricorrenti, 2 arresti cardiaci fuori dall’ospedale e 4 rivascolarizzazioni elettive) nel gruppo di intervento e 12 (1 ricovero per insufficienza cardiaca, 2 AMI ricorrenti e 9 rivascolarizzazioni elettive) nel gruppo di controllo(Tabella 3). Queste differenze non erano statisticamente significative. Una curva Kaplan-Meier che mostra la sopravvivenza senza eventi è mostrata nella Figura 2.
| Variabile | Partecipanti, n. (%) | ValoreP | |
|---|---|---|---|
| Gruppo d’intervento (n = 100) | Gruppo di controllo (n = 100) | ||
| Tutte le cause di mortalità | 2 (2) | 2 (2) | >.99 |
| Infarto miocardico ricorrente | 2 (2) | 2 (2) | .62 |
| Ricovero in ospedale per insufficienza cardiaca | 0 | 1 (1) | >.99 |
| Rivascolarizzazione elettiva | 4 (4) | 9 (9) | .57 |
| Arresto cardiaco fuori dall’ospedale | 2 (2) | 0 | .50 |
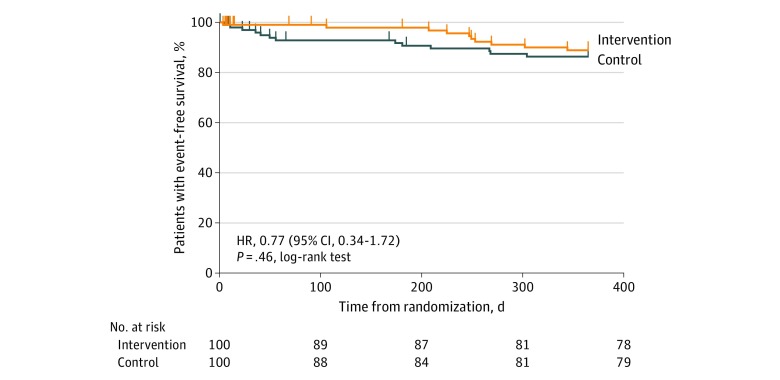
Figura 2.Curva Kaplan-Meier per la sopravvivenza senza eventi nei gruppi di intervento e di controlloL’HR indica il rapporto di pericolo.

Figura 2.Curva Kaplan-Meier per la sopravvivenza senza eventi nei gruppi di intervento e di controlloL’HR indica il rapporto di pericolo.
Discussione
Questo studio riporta i risultati di un RCT esplorativo che confronta il follow-up abilitato alla tecnologia intelligente con la consueta cura per il controllo della BP dopo l’AMI. I risultati principali sono che la percentuale di pazienti con BP regolata non differisce tra il gruppo di intervento e quello di controllo, la percentuale di ricoveri è simile in entrambi i gruppi e i punteggi di soddisfazione dei pazienti sono simili.
Negli anni ’80 erano già state effettuate prove di monitoraggio a distanza, con telemonitoraggio dei sintomi per telefono.14 Dall’introduzione dell’iPhone di Apple nel 2007, il numero di articoli scientifici sul telemonitoraggio è aumentato ogni anno.15 Diversi RCT hanno valutato l’uso della tecnologia intelligente nel follow-up dei pazienti con AMI. Questi studi utilizzano prevalentemente la tecnologia intelligente per la telerabilitazione.16,17 Una prova16 ha trovato un beneficio di morbilità associato all’uso della tecnologia degli smartphone in ambito riabilitativo, con una riduzione dei giorni persi per le riabilitazioni cardiovascolari. Ci sono prove cumulative che dimostrano che la telerabilitazione è efficace per i pazienti dopo l’AMI.16,17 In generale, il follow-up dei pazienti dopo l’AMI viene eseguito in un ambulatorio da un cardiologo o da un’infermiera specializzata. A quanto ci risulta, nessuno studio ha ancora paragonato l’uso dell’eHealth nell’ambulatorio per i pazienti dopo l’AMI. A nostra conoscenza, questo è il primo studio che sostituisce parzialmente le visite ambulatoriali fisiche da parte di e-visite in questa popolazione di pazienti. Le visite elettroniche possono ridurre i tempi e i costi per i pazienti e possono abbassare i costi generali. Pertanto, questo studio aggiunge alla letteratura esistente che l’eHealth nell’ambulatorio può essere una preziosa aggiunta. Tuttavia, dovrebbero essere eseguiti più studi per stabilire il valore dell’eHealth nel follow-up dei pazienti con AMI.
L’età media dei partecipanti al nostro RCT era di 59,7 anni, leggermente inferiore all’età media della popolazione generale dei pazienti con AMI presso il Leiden University Medical Center (63 anni).10 Questa differenza potrebbe essere spiegata dal fatto che un numero maggiore di pazienti anziani ha rifiutato la partecipazione allo studio. Tuttavia, è stato dimostrato che i pazienti che partecipano agli RCT sono, in generale, più giovani e hanno una probabilità di morte a priori inferiore rispetto ai non partecipanti.18 Pertanto, non è chiaro se la nostra popolazione di pazienti sia più giovane a causa dell’intervento o del disegno randomizzato di questo studio.
Risultati di questa prova in associazione con l’eHealth
Questo studio era un RCT di fattibilità per valutare l’effetto della tecnologia intelligente sui pazienti dopo l’AMI. Nella letteratura popolare, l’eHealth è spesso discusso come uno strumento per aumentare la qualità e la soddisfazione dei pazienti nell’assistenza, concentrandosi maggiormente sulla prevenzione della malattia (invece di curarla), aiutando a integrare l’assistenza facilitando la comunicazione tra gli operatori sanitari, riducendo la duplicazione dei test diagnostici e facendo eseguire ai pazienti alcuni dei propri test diagnostici al posto del personale sanitario addestrato.19 Sebbene si tratti di osservazioni piuttosto generiche, i risultati di questo studio supportano alcune di queste teorie: in primo luogo, i pazienti sono stati in grado di misurare la propria BP, l’ECG e il peso e di trasferire i dati all’ospedale senza la presenza o l’assistenza di personale sanitario addestrato. Ciò ha permesso la sostituzione di 2 visite ambulatoriali fisiche con 2 visite ambulatoriali digitali, che fanno risparmiare tempo ai pazienti e possono, quindi, aumentare la soddisfazione. Ciò può contribuire a ridurre i costi sociali, soprattutto per i pazienti che lavorano.
In secondo luogo, i pazienti sono stati in grado di misurare e trasferire accuratamente la BP, un ECG a singola deriva e il peso, che sono risultati diagnostici importanti per i pazienti dopo l’AMI. Questo può ridurre il tempo del personale sanitario addestrato. Inoltre, i pazienti possono più facilmente inviare all’ospedale misure clinicamente rilevanti (ECG e BP) se indicato (ad esempio, in caso di palpitazioni).
In terzo luogo, i pazienti hanno indicato che apprezzano un controllo supplementare da parte dell’ospedale, così come la possibilità di visualizzare i propri dati sanitari. Si tratta di importanti risultati secondari che sostengono indirettamente la teoria secondo cui la sanità elettronica potrebbe migliorare il coinvolgimento del paziente nelle cure cliniche. Questi risultati dovrebbero quindi essere corroborati in studi futuri.
Limitazioni
Si trattava di un RCT di fattibilità per valutare gli effetti dell’attuazione della sanità elettronica nelle cure regolari. Come tale, sono state fatte alcune scelte progettuali che avrebbero potuto influenzare il corso della sperimentazione. In primo luogo, si è deciso che ogni paziente dovesse ricevere lo stesso intervento tecnologico intelligente (bilancia pesapersone, monitor BP, dispositivo ECG e contapassi). Ogni paziente è stato istruito ad utilizzare la stessa frequenza di misurazione. Questo potrebbe aver influenzato l’aderenza della misurazione e le percentuali di drop-out nel gruppo di intervento, anche se una certa percentuale di drop-out è spesso osservata negli RCT in generale. Riconosciamo che questo abbandono potrebbe aver influenzato i tassi di soddisfazione dei pazienti, perché i pazienti che non sono soddisfatti sono intrinsecamente più propensi ad abbandonare. Pertanto, i tassi di soddisfazione dei pazienti dovrebbero essere corroborati in studi futuri.
Conclusioni
Il follow-up con l’utilizzo della tecnologia intelligente per i pazienti con AMI non ha prodotto percentuali diverse di BP regolata rispetto ai pazienti che hanno ricevuto cure standard. Questo studio dimostra che la tecnologia intelligente e le e-visite sono fattibili da implementare nel follow-up dei pazienti a basso rischio dopo l’AMI. La soddisfazione dei pazienti e i risultati clinici in questo caso sono stati simili. Le ricerche future dovrebbero confermare questi risultati e dovrebbero essere effettuate per definire ulteriormente i sottogruppi che più probabilmente beneficeranno della tecnologia degli smartphone e per personalizzare l’intervento della tecnologia intelligente in base alle esigenze specifiche di un singolo paziente.
References
- Population trends in the incidence and outcomes of acute myocardial infarction. N Engl J Med. 2010; 362(23)DOI | PubMed
- Medication nonadherence is associated with a broad range of adverse outcomes in patients with coronary artery disease. Am Heart J. 2008; 155(4):772-779. DOI | PubMed
- The impact of a primary care e-communication intervention on the participation of chronic disease patients who had not reached guideline suggested treatment goals. Patient Educ Couns. 2016; 99(4):530-541. DOI | PubMed
- E-health: transforming the physician/patient relationship. Int J Med Inform. 2001; 61(1):1-10. DOI | PubMed
- eHealth in cardiovascular medicine: a clinical update. Eur J Prev Cardiol. 2016; 23(2):5-12. DOI | PubMed
- 2016. Publisher Full Text
- 2017. Publisher Full Text
- 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2018; 39(2):119-177. DOI | PubMed
- Using smart technology to improve outcomes in myocardial infarction patients: rationale and design of a protocol for a randomized controlled trial—The Box. JMIR Res Protoc. 2017; 6(9)DOI | PubMed
- MISSION!: optimization of acute and chronic care for patients with acute myocardial infarction. Am Heart J. 2007; 153(1):14.e1-14.e11. DOI | PubMed
- World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 2013; 310(20):2191-2194. DOI | PubMed
- 1996. Publisher Full Text
- Defining and measuring patient satisfaction with medical care. Eval Program Plann. 1983; 6(3-4):247-263. DOI | PubMed
- Evaluation of a medication refill reminder system for a community pharmacy. Patient Educ Couns. 1985; 7(2):157-165. DOI | PubMed
- Mobile health in cardiology: a review of currently available medical apps and equipment for remote monitoring. Expert Rev Med Devices. 2016; 13(9):823-830. DOI | PubMed
- Effect of comprehensive cardiac telerehabilitation on one-year cardiovascular rehospitalization rate, medical costs and quality of life: a cost-effectiveness analysis. Eur J Prev Cardiol. 2016; 23(7):674-682. DOI | PubMed
- Effects of home-based training with telemonitoring guidance in low to moderate risk patients entering cardiac rehabilitation: short-term results of the FIT@Home study. Eur J Prev Cardiol. 2014; 21(2):26-31. DOI | PubMed
- External validity of clinical trials in acute myocardial infarction. Arch Intern Med. 2007; 167(1):68-73. DOI | PubMed
- The Creative Destruction of Medicine: How the Digital Revolution Will Create Better Health Care. Basic Books; 2013.
Fonte
Treskes RW, van Winden LAM, van Keulen N, van der Velde ET, Beeres SLMA, et al. (2020) Effect of Smartphone-Enabled Health Monitoring Devices vs Regular Follow-up on Blood Pressure Control Among Patients After Myocardial Infarction. JAMA Network Open 3(4): e202165. https://doi.org/10.1001/jamanetworkopen.2020.2165





