Abstract
Introduzione
La malnutrizione acuta moderata (MAM), definita come moderato spreco o bassa circonferenza media superiore del braccio (MUAC), è diffusa tra i bambini nei paesi a basso reddito. Mentre sia la prevalenza che l’incidenza sono sconosciute, lo spreco moderato colpisce da solo 33 milioni di bambini in qualsiasi momento[1]. I bambini affetti da MAM sono a rischio di morbilità e mortalità a causa di malattie infettive o di progressione verso una grave malnutrizione acuta (SAM), mentre quelli che si riprendono possono essere a rischio di ricaduta, di alterazione dello sviluppo fisico e cognitivo e, in seguito, di malattie non trasmissibili[2,3].
Ci sono poche prove per informare le raccomandazioni sulla composizione degli alimenti complementari per il trattamento dei bambini affetti da MAM, e l’Organizzazione Mondiale della Sanità (OMS) raccomanda la ricerca per sviluppare prodotti a basso costo[4]. Gli alimenti integrativi per bambini malnutriti sono basati su una matrice di miscela di mais-soia (CSB) o di integratore nutritivo a base di lipidi (LNS)[5]. Ci sono differenze sostanziali tra i due tipi di prodotti, non solo nella composizione nutrizionale, ma anche nei costi, nelle modalità di consumo e nella logistica necessaria per la consegna. Una fonte chiave di proteine nel CSB è la soia, spesso disossata (DS), che contiene livelli più elevati di anti-nutrienti (composti che compromettono l’assorbimento dei minerali) rispetto al più costoso isolato di soia (SI)[6]. Il primo prodotto LNS è stato sviluppato per il trattamento del SAM e si basava sulla composizione nutrizionale del latte terapeutico F-100, che contiene elevate quantità di prodotti lattiero-caseari e non contiene soia[7]. Questo tipo di prodotto è indicato anche come alimento terapeutico pronto all’uso (RUTF). Più recentemente è stata sviluppata una gamma di prodotti LNS, alcuni contenenti soia, per il MAM. L’inclusione del latte scremato secco (DSM) negli integratori migliora il profilo aminoacidico, fornisce ai minerali un’elevata biodisponibilità e riduce il contenuto di antinutrienti quando sostituisce le fonti proteiche vegetali, ma aumenta anche i costi[8,9].
Le prove che valutano gli effetti degli integratori usano tipicamente l’aumento di peso o il recupero nutrizionale come risultato primario, e non considerano la composizione corporea. Mentre il recupero nutrizionale, cioè l’aumento di peso per altezza z-score(WHZ) o MUAC al di sopra di specifici tagli, è un risultato programmatico consolidato, i benefici per la salute che ne derivano non sono ben noti. L’inadeguato accrescimento del tessuto privo di grassi, cioè di muscoli, organi e ossa, compromette le funzioni del corpo e la salute[10]. Il peso del tessuto privo di grasso, cioè la massa priva di grasso (FFM), può essere misurato in condizioni di campo con la tecnica della diluizione del deuterio e può essere espresso indipendentemente dalla lunghezza come indice FFM (FFMI) dividendo per la lunghezza in metri quadrati.
Il nostro obiettivo era quello di studiare l’efficacia della matrice, la qualità della soia e la percentuale di proteine totali del latte scremato secco nel trattamento del MAM nell’aumentare l’accrescimento del FFMI.
Metodi
Etica
La sperimentazione è stata approvata dal Comitato etico per la ricerca sanitaria in Burkina Faso (2012-8-059) e l’approvazione consultiva è stata ottenuta dal Comitato nazionale danese per l’etica della ricerca biomedica (1208204). La sperimentazione è stata registrata nel registro ISRCTN (ISRCTN42569496). I moduli di informazione e consenso sono stati tradotti nella lingua locale (Moré) e retrotradotti per garantire l’accuratezza. Gli assistenti hanno dato il consenso verbale e scritto (firma o impronta digitale) prima dell’iscrizione.
Progettazione dello studio
Abbiamo condotto uno studio fattoriale randomizzato 2 × 2 × 3 (Treatfood) che ha valutato gli effetti della matrice (LNS contro CSB), della qualità della soia (SI contro DS) e della percentuale di proteine da DSM (20% e 50% contro 0%), ottenendo 12 diversi integratori, alcuni dei quali corrispondono a prodotti esistenti (Fig 1). Gli integratori sono stati somministrati per 12 settimane. La prova è stata effettuata in doppio cieco per quanto riguarda la qualità della soia e il contenuto di latte, ma non la matrice.
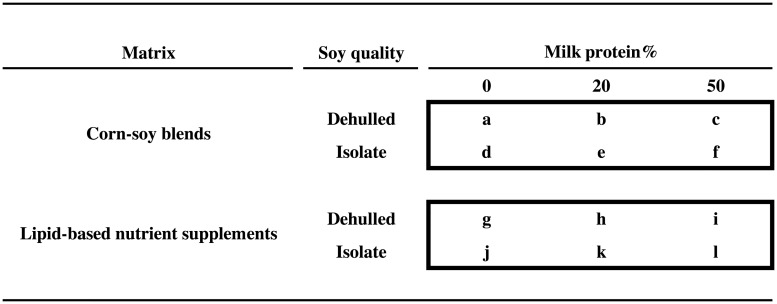
Fig 1.Integratori alimentari sperimentali.Il disegno fattoriale 2 × 2 × 3, che mostra i 12 integratori alimentari sperimentali a base di miscele di soia di mais o integratori di nutrienti a base di lipidi, con soia decorticata o isolato di soia, e con 0%, 20%, o 50% di proteine totali del latte. Due integratori corrispondono ai prodotti attualmente utilizzati: “a” (CSB+) e “b” (CSB++). Il prodotto “i” è simile a Plumpy’Sup, contenente soia decorticata ma con latte scremato secco al posto del siero di latte.

Fig. 1.Integratori alimentari sperimentali.Il 2 × 2 × 3 disegno fattoriale, che mostra i 12 integratori alimentari sperimentali a base di miscele di mais-soia o integratori di nutrienti a base di lipidi, sia con soia decorticata o isolato di soia, e con 0%, 20%, o 50% di proteine totali dal latte. Due integratori corrispondono ai prodotti attualmente utilizzati: “a” (CSB+) e “b” (CSB++). Il prodotto “i” è simile a Plumpy’Sup, contenente soia decorticata ma con latte scremato secco al posto del siero di latte.
Partecipanti
Questo esperimento è stato condotto nella Provincia del Passoré nella regione settentrionale del Burkina Faso, in una zona che si qualifica per i programmi di alimentazione supplementare basati sulla prevalenza della malnutrizione acuta [11]. La prevalenza di uno spreco moderato era del 9% e di uno spreco grave e/o di edema era dell’1,4%[12]. Una stagione “magra” di 3-5 mesi inizia di solito a giugno [13]. La prevalenza dell’infezione da HIV tra le donne di 15-49 anni era dello 0,8% [14]. La dieta familiare era a base di cereali, e il consumo di latte vaccino e di altri alimenti di origine animale era raro.
I siti di studio sono stati costruiti in 5 centri sanitari governativi (Gomponsom, Latoden, Bagaré, Bokin e Samba) e gestiti dall’organizzazione non governativa Alliance for International Medical Action (ALIMA, Senegal). Il bacino di utenza dello studio è stato definito da una distanza massima di 23 km da un sito di studio e sono stati esclusi i villaggi ritenuti inaccessibili durante la stagione delle piogge. La dimensione della popolazione nel bacino d’utenza dello studio è stata stimata in 258.000 persone.
I bambini sono stati sottoposti a screening per il MAM nei villaggi da operatori sanitari della comunità (CHW) o da squadre di screening mobili designate. Inoltre, i bambini potevano essere indirizzati ad un sito di studio da un centro sanitario, o potevano presentarsi in un sito su iniziativa di un caregiver. I bambini venivano reclutati se (a) erano residenti nel bacino idrografico al momento dell’inclusione, (b) veniva confermata una diagnosi di MAM, cioè MUAC ≥ 115 mm e < 125 mm e/o WHZ ≥ -3 e < -2, e (c) avevano 6-23 mesi di età, sulla base di una tessera sanitaria o di un calendario di eventi adattato a livello locale. I bambini non sono stati inclusi se sono stati (a) trattati per SAM (WHZ < -3 o MUAC < 115 mm o edema) o ricoverati in ospedale negli ultimi 2 mesi, (b) già in un programma nutrizionale, o (c) che richiedono il ricovero in ospedale, ad esempio, emoglobina < 50 g/l. Sono stati esclusi anche i bambini con una grave disabilità, che limitano la fattibilità delle indagini, o con sospetta allergia al latte, alle arachidi, al CSB o all’LNS.
Per ridurre al minimo la miscelazione o la condivisione di integratori sperimentali, è stato incluso nella sperimentazione solo il primo bambino con MAM identificato da una data famiglia. I fratelli con MAM o i gemelli discordanti per lo stato di MAM hanno ricevuto lo stesso integratore, ma non sono stati inclusi nello studio.
Randomizzazione
I bambini sono stati assegnati individualmente e a caso a gruppi di intervento. I supplementi sono stati designati dal produttore con un codice di 1 lettera e un codice chiave è stato conservato in una busta sigillata in una cassaforte fino al completamento dell’analisi dei dati. Le sequenze casuali, in blocchi di 12 o 24 e stratificate per sito, sono state create da una persona non coinvolta nello studio utilizzando Randomization.com(http://www.randomization.com). I supplementi sono stati confezionati in scatole individuali contenenti un trattamento completo di 12 settimane per 1 partecipante (6 sacchetti di CSB o 84 bustine di LNS). Durante la produzione, ogni scatola e sacchetto/confezione di integratore è stata etichettata con una sequenza di 12 lettere contenente il relativo codice di 1 lettera in posizione fissa e le 11 lettere rimanenti in ordine casuale. In Burkina Faso, 1 individuo non coinvolto nel reclutamento e nella raccolta dati era a conoscenza delle sequenze casuali e del codice di 1 lettera. Questo individuo ha rietichettato le caselle e i supplementi con i singoli ID di studio, e tutte le successive manipolazioni dei supplementi nei 5 siti di studio si sono basate solo sull’ID di studio. Al momento dell’iscrizione, i bambini hanno ricevuto un ID di studio dal personale senza accesso alle sequenze casuali o ai supplementi.
Intervento nutrizionale
Tutti gli integratori sperimentali sono conformi alla nota tecnica dell’OMS sugli alimenti complementari per la gestione del MAM [4]. Tutti gli integratori contenevano 500 kcal per dose giornaliera (120 g di CSB o 92 g di LNS). Il contenuto di grassi era di 11,4-11,7 g per dose giornaliera in CSB e 31,4-32,1 g per dose giornaliera in LNS. Il contenuto di proteine era di 15,9-16,8 g in CSBs e 12,5-13,5 g in LNSs. Tutti gli integratori avevano un punteggio di aminoacidi corretti per la digeribilità delle proteine (PDCAAS) superiore al 70%, come raccomandato dall’OMS [4]. La durata di conservazione per i CSB era di 9 mesi, e per gli LNS era di 2 anni. Gli ingredienti dei 12 integratori sperimentali sono riportati nella Tabella 1. Soia e maltodestrina hanno sostituito il latte nei prodotti senza latte. Più maltodestrina è stato aggiunto quando SI ha sostituito DS.
| Ingrediente | Supplemento | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| a | b | c | d | e | f | g | h | i | j | k | l | |
| Mais | 55.0 | 55.0 | 55.0 | 55.0 | 55.0 | 55.0 | ||||||
| Arachide | 27.0 | 27.0 | 27.0 | 27.0 | 27.0 | 27.0 | ||||||
| Zucchero | 9.0 | 9.0 | 9.0 | 9.0 | 9.0 | 9.0 | 27.0 | 27.0 | 27.0 | 27.0 | 27.0 | 27.0 |
| Maltodestrina | 5.6 | 3.7 | 0.3 | 12.55 | 8.4 | 2.5 | 7.8 | 5.55 | 1.9 | 13.47 | 9.05 | 2.34 |
| Latte scremato in polvere | 8.0 | 20.0 | 8.0 | 20.0 | 8.0 | 20.0 | 8.0 | 20.0 | ||||
| Grasso vegetale | 7.9 | 7.8 | 7.8 | 8.0 | 7.9 | 7.7 | 18.0 | 18.0 | 18.0 | 18.0 | 18.0 | 18.0 |
| Proteine di soia isolate | 11.4 | 8.1 | 3.2 | 8.6 | 5.5 | 0.9 | ||||||
| Farina di soia | 19.7 | 14.0 | 5.6 | 15.0 | 9.5 | 1.5 | ||||||
| Citrato di magnesio | 0.5 | 0.5 | 0.6 | 0.85 | 0.8 | 0.6 | 0.2 | 0.2 | 0.25 | 0.33 | 0.3 | 0.26 |
| Fosfato di calcio | 1.4 | 1.1 | 0.8 | 1.5 | 1.3 | 0.9 | 1.95 | 1.7 | 1.3 | 2.1 | 1.8 | 1.4 |
| Cloruro di potassio | 0.5 | 0.5 | 0.5 | 1.3 | 1.1 | 0.7 | 0.9 | 0.9 | 0.9 | 1.35 | 1.2 | 0.95 |
| Premiscela di vitamine | 0.4 | 0.4 | 0.4 | 0.4 | 0.4 | 0.4 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| Emulsionante | 1.65 | 1.65 | 1.65 | 1.65 | 1.65 | 1.65 | ||||||
Le 6 LNS avevano un imballaggio e una struttura simili, e le 6 CSB avevano un imballaggio e una struttura simili. Gli LNS erano forniti in bustine, ciascuna contenente una porzione giornaliera pronta per il consumo. I CSB erano forniti in sacchetti da 1,7 kg contenenti una razione quindicinale (si raccomandava di dividere 120 g/bambino/giorno in 3 pasti, 40 g/pasto) da cucinare con acqua e consumare come porridge. I supplementi sono stati prodotti da GC Rieber Compact (Norvegia), che non è stata altrimenti coinvolta nel progetto di prova o nell’interpretazione dei dati. Gli stessi fornitori per la materia prima principale, DS, SI e latte sono stati utilizzati sia per gli LNS che per i CSB. Gli integratori sperimentali finali sono stati testati microbiologicamente e approvati per la sicurezza alimentare da laboratori certificati (Compact India, India; TÜV SÜD, India; Dordogne Labs, Francia).
Visite di studio
I bambini sono stati programmati per visite in clinica ogni 2 settimane durante il periodo di integrazione di 12 settimane. La FFM è stata valutata al momento dell’iscrizione e dopo 12 settimane. Lo stato clinico e l’antropometria sono stati valutati ad ogni visita, eccetto la durata, che è stata misurata una volta al mese. I bambini che hanno saltato le visite programmate sono stati visitati da un CHW a casa loro e incoraggiati a tornare per il follow-up.
Per valutare la FFM, una dose di 5 g di ossido di deuterio (D2O) (99,8%; Cambridge Isotope Laboratories, USA) diluita in 5 g di acqua in bottiglia è stata pesata con precisione di 0,01 g e somministrata per via orale dopo la raccolta di campioni di saliva pre-dose. I campioni di saliva post-dose sono stati raccolti dopo un periodo di equilibrio di 3 ore, come stabilito durante lo studio pilota[15]. Per ogni valutazione, l’abbondanza di D2O è stata misurata in duplicato in campioni di saliva pre e post-dose e in un campione diluito della dose di ciascun bambino, utilizzando la spettrometria a infrarossi con trasformata di Fourier (Agilent Technologies, USA) [16]presso il St. John’s Research Institute, Bangalore, India. Per l’analisi sono stati necessari almeno 60 μl di saliva. Lo spazio di diluizione del deuterio è stato calcolato come descritto in precedenza[17], e convertito in acqua corporea totale (TBW) utilizzando un fattore di 1,044 per regolare lo scambio di protoni. FFM è stato calcolato come TBW/idratazione, utilizzando coefficienti di idratazione specifici per età e sesso[18]. La massa grassa (FM) è stata calcolata come peso meno FFM. I dati sono stati puliti per errori tipografici e valori di TBW non plausibili, sulla base dell’associazione di TBW con la lunghezza e i tagli per FM di <-0,1 (per tenere conto della normale variabilità tecnica negli studi di diluizione del deuterio) e >2,4 kg. FFM e FM sono stati divisi per lunghezza in metri quadrati per ricavare indici indipendenti dalla lunghezza, cioè indice FFM (FFMI) e indice FM (FMI)[19].
Il peso è stato misurato in duplicato con un’approssimazione di 100 g utilizzando bilance elettroniche (modello Seca 881 1021659) con doppia funzione di pesatura. La lunghezza è stata misurata in duplicato con una tavola di legno in altezza con un’approssimazione di 1 mm (sottraendo un fattore di correzione di 0,7 cm per i bambini che raggiungono un’età superiore ai 24 mesi durante l’intervento). WHZ è stato determinato nei siti di studio utilizzando le tabelle di campo dell’OMS, e questo valore è stato utilizzato per il reclutamento. In analisi successive, WHZ è stato ricalcolato utilizzando il pacchetto “zscore06” in STATA 12 (StataCorp, USA). Il MUAC è stato misurato in duplicato al più vicino 1 mm, nel punto medio tra l’olecrano e il processo di acromion utilizzando un nastro di misura standard. Il Tricipite skinfold è stato misurato in duplicato utilizzando un calibro Harpenden. Per l’analisi è stata utilizzata la media delle misurazioni in duplicato. La lunghezza del ginocchio-tallone è stata misurata utilizzando un calibro digitale (Mitutoyo, Germania), montato con tappi per ginocchio e tallone fusi in plastica dura[20]. Lo strumento ha una risoluzione di 0,01 mm. Il risultato è stato espresso come media di 5 misurazioni separate consecutive. Le misurazioni antropometriche sono state effettuate da personale addestrato, dopo sessioni di standardizzazione.
Al momento dell’iscrizione, un’infermiera di ricerca ha raccolto dati sulle caratteristiche demografiche, sullo stato delle vaccinazioni, sulla morbilità retrospettiva di 2 settimane e sui trattamenti medici utilizzando un questionario strutturato nella lingua locale. Tutti i bambini hanno ricevuto un’integrazione di vitamina A (100.000 UI se 4-8 kg; 200.000 UI se >8 kg) se non avevano ricevuto alcuna integrazione nei 6 mesi precedenti, e l’albendazolo (200 mg se 4-8 kg; 400 mg se >8 kg) e le vaccinazioni sono state somministrate secondo il programma nazionale presso i centri sanitari. Le cure mediche sono state fornite sulla base delle linee guida della Gestione Integrata delle Malattie Infantili. Il sangue venoso è stato prelevato dal braccio e testato per il Plasmodium falciparum mediante test rapido (SD Bioline Malaria Ag P.f; Standard Diagnostics, Corea). La proteina C reattiva del siero è stata determinata utilizzando un dosaggio combinato di immunosorbenti legati ad enzimi a sandwich (VitMin Lab, Germania).
Il recupero nutrizionale è stato classificato in 3 gruppi: recupero a 12 settimane (WHZ ≥ -2 e MUAC ≥ 125 mm), MAM (non risposta) a 12 settimane, o SAM in qualsiasi punto durante l’intervento. I bambini che hanno sviluppato il SAM sono stati interrotti dagli integratori sperimentali, trattati con RUTF, e trasferiti al trattamento ospedaliero se accompagnati da complicazioni mediche.
I bambini che non si sono ripresi dopo 12 settimane di integrazione hanno ricevuto 2 settimane di RUTF. I bambini che non sono aumentati di peso durante questo periodo sono stati esaminati da infermieri ricercatori e, se necessario, sono stati ricoverati in ospedale. Tutti i bambini che non si sono ripresi dal MAM dopo 2 settimane di supplementazione di RUTF sono stati sottoposti ad un ulteriore trattamento di 2 settimane. I bambini che non si sono ripresi dopo le 4 settimane totali di integrazione di RUTF sono stati rinviati in ospedale per un esame clinico più approfondito.
Durante lo studio, a causa di una sospetta contaminazione di 1 lotto di integratore sperimentale, ad alcuni bambini è stato somministrato il LNS Plumpy’Sup (Nutriset, Francia) disponibile in commercio.
Risultati
Il risultato primario è stato l’incremento di FFMI misurato con la tecnica di diluizione del deuterio. L’arricchimento D2O è stato determinato in un unico laboratorio e la pulizia dei dati è stata effettuata in cieco. Altri risultati inclusi gli incrementi in FFM, FM, FMI, peso, lunghezza, lunghezza, lunghezza del ginocchio-tallone, MUAC, tricipite della pelle pieghevole, e il recupero nutrizionale. Gravi eventi avversi non sono stati previsti dall’assunzione di integratori alimentari, ma sono stati definiti come reazione anafilattica e la morte. Gli effetti sono stati espressi come LNS rispetto a CSB, SI rispetto a DS, e 20% e 50% di proteine del latte rispetto allo 0% di proteine del latte.
Analisi statistiche
Per rilevare una differenza di 0,6-SD tra le 2 combinazioni dei 3 fattori con l’80% di potenza e il 5% di significatività, pur consentendo una perdita del 20% per il follow-up, abbiamo mirato a reclutare in totale 1.608 (= 12 × 134) bambini.
I dati sono stati inseriti due volte in EpiData 3.1 (Danimarca). Le analisi statistiche sono state effettuate utilizzando STATA 12. In assenza di un gruppo non integrato, i valori di base sono stati regressivi in base all’età per stimare il peso medio associato all’età e l’incremento di FFM in un periodo equivalente alla durata dell’intervento. Le statistiche descrittive sono presentate come medie (SD). Le variazioni medie dell’antropometria e della composizione corporea sono indicate con intervalli di confidenza del 95%.
L’analisi si è basata sul principio dell’intention-to-treat (ITT) utilizzando i dati dei casi disponibili. Il disegno fattoriale 2 × 2 × 3 è stato analizzato utilizzando un modello lineare misto con effetti casuali specifici del sito. La riduzione del modello è stata effettuata per ridurre l’interazione a 3 vie a interazioni a 2 vie o effetti principali (utilizzando test di likelihood ratio). In particolare, il modello completo che include l’interazione a 3 vie corrispondente al disegno fattoriale 2 × 2 × 3 è stato confrontato con il modello che contiene solo gli effetti principali dei 3 fattori; quindi, abbiamo testato qualsiasi tipo di interazione nel disegno fattoriale in una sola volta. I confronti a coppie dei mezzi sono stati effettuati utilizzando test post hoc t basati su modelli nei modelli ridotti. Gli effetti dell’integrazione sono presentati in termini di mezzi stimati con il 95% di IC. Tutte le analisi includevano l’aggiustamento per la misura di base dell’esito[21], età, sesso, MUAC, WHZ e mese di ammissione, ad eccezione delle analisi ITT non aggiustate, che includevano solo la misura di base dell’esito e del sito. È stata anche condotta un’analisi per protocollo (PP), che comprendeva solo i bambini che hanno completato 12 settimane di integrazione con il supplemento a cui erano stati originariamente assegnati.
La modifica dell’effetto è stata valutata per la stagione, i criteri di ammissione e la FFMI di base, lo stordimento, l’infiammazione e l’allattamento al seno. Il controllo dei modelli si è basato sui residui e sui normali diagrammi di probabilità. Il recupero è stato valutato per mezzo di test chi-squared. È stato applicato un livello di significatività di 0,05.
Rispetto al piano statistico delineato nel protocollo(S1 Text), abbiamo deviato su 2 questioni. In primo luogo, abbiamo corretto FFM per la lunghezza dividendolo per la lunghezza in metri al quadrato, cioè esprimendo l’accrescimento FFM come indice, per poterlo adattare non solo alla lunghezza della linea di base, ma anche alle variazioni di lunghezza nel tempo. In secondo luogo, inizialmente abbiamo pianificato l’aggiustamento per la molteplicità, nel caso in cui dovessimo confrontare 12 gruppi. Tuttavia, nel modello fattoriale ridotto con confronti a coppie all’interno dei fattori, non sono stati applicati adeguamenti per la molteplicità.
Risultati
Dal 9 settembre 2013 al 29 agosto 2014 abbiamo valutato 3.398 bambini, di cui 1.967 (58%) con il MAM. Di questi, 1.613 (82%) bambini sono stati randomizzati, ma 4 esclusi in quanto non ammissibili. Quindi, un totale di 1.609 bambini sono stati randomizzati secondo il disegno fattoriale 2 × 2 × 3 (Fig. 2).
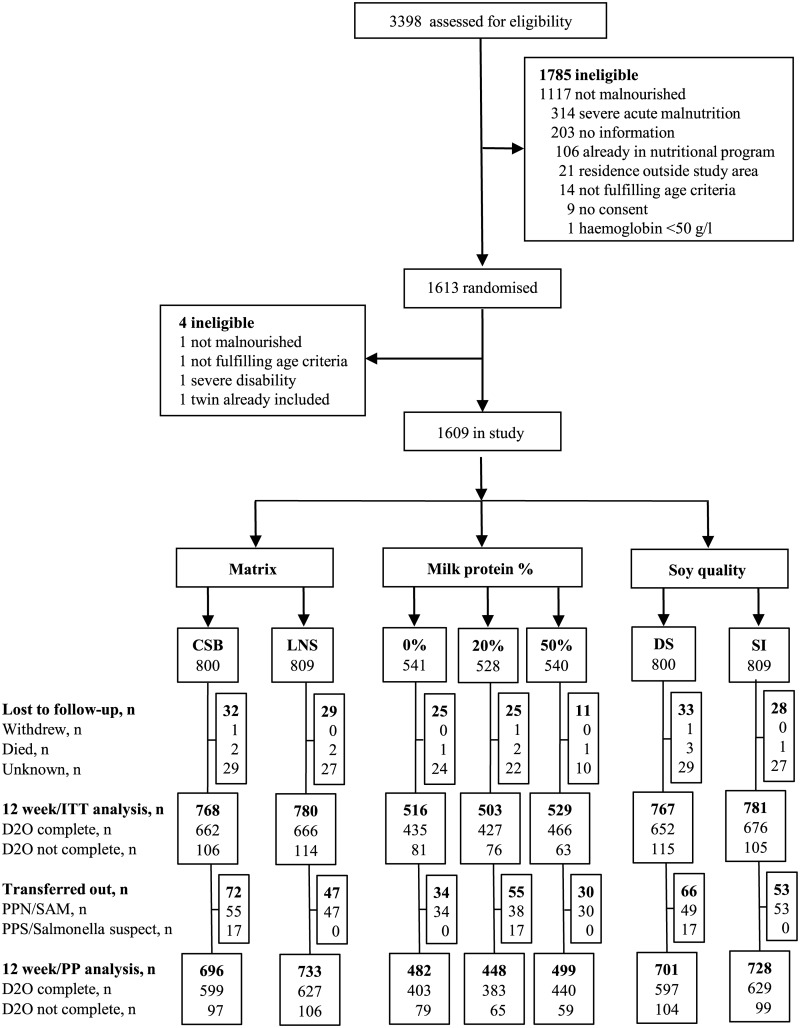
Fig 2.Profilo di prova.In totale, 3.398 bambini sono stati valutati per l’idoneità nei 5 siti di studio, e 1.609 bambini sono stati randomizzati e inclusi nello studio. CSB, miscela mais-soia; D20, misurazione dell’ossido di deuterio; DS, soia decorticata; ITT, intenzione di trattare; LNS, integratore di nutrienti a base lipidica; PP, per protocollo; PPS/Salmonella, ricevuto Plumpy’Sup a causa del sospetto di contaminazione da salmonella; PPN/SAM, ricevuto Plumpy’Nut a causa di grave malnutrizione acuta; SI, isolato di soia.
Come mostrato nella Tabella 2, la randomizzazione ha portato ad un’equivalenza di base tra le categorie dei fattori sperimentali rispetto ai potenziali confonditori.
| Caratteristica | Matrice | Qualità della soia | Percentuale di proteine del latte | ||||
|---|---|---|---|---|---|---|---|
| CSB(n = 800) | LNS(n = 809) | Scolmato(n = 800) | Isolare(n = 809) | 0%(n = 541) | 20%(n = 528) | 50%(n = 540) | |
| Dati sociodemografici | |||||||
| Età (mesi) | 11 (8–16) | 12 (8–16) | 11 (8–16) | 11 (8–16) | 11 (8–16) | 11 (8–16) | 11 (8–16) |
| Sesso femminile | 444 (56%) | 435 (54%) | 427 (53%) | 452 (56%) | 295 (55%) | 287 (54%) | 297 (55%) |
| Età materna (anni)(n = 1.580) | 26 (22–31) | 27 (22–31) | 27 (22–31) | 26 (22–31) | 27 (22–31) | 26 (22–31) | 27 (22–31) |
| Dimensione della casa | 10 (7–16) | 11 (7–16) | 11 (8–16) | 10 (7–16) | 10 (7–15) | 10 (7–16) | 11 (7–17) |
| Dati antropometrici | |||||||
| Peso per altezza z-score | −2.2 (0.5) | −2.2 (0.5) | −2.2 (0.5) | −2.2 (0.5) | −2.2 (0.5) | −2.2 (0.5) | −2.2 (0.5) |
| Circonferenza media superiore del braccio (mm) | 123 (4) | 123 (4) | 123 (4) | 123 (4) | 122 (4) | 123 (4) | 123 (4) |
| Criteri di ammissione | |||||||
| Peso per l’altezza z-score e circonferenza del braccio medio-superiore (mm) | 404 (51%) | 400 (49%) | 406 (51%) | 398 (49%) | 276 (51%) | 275 (52%) | 253 (47%) |
| Peso solo per l’altezza z-score | 171 (21%) | 166 (21%) | 168 (21%) | 169 (21%) | 111 (21%) | 110 (21%) | 116 (22%) |
| Solo circonferenza del braccio medio-alto (mm) | 225 (28%) | 243 (30%) | 226 (28%) | 242 (30%) | 154 (29%) | 143 (27%) | 171 (32%) |
| Dati paraclinici | |||||||
| Positivo al test rapido per la malaria(n = 1.601) | 324 (41%) | 320 (40%) | 322 (41%) | 322 (40%) | 216 (40%) | 207 (39%) | 221 (41%) |
| Siero proteina C reattiva > 15 mg/l (n = 1.564) | 148 (19%) | 145 (18%) | 154 (20%) | 139 (18%) | 100 (19%) | 113 (22%) | 80 (15%) |
| Allattato al seno (n = 1,607) | 755 (95%) | 766 (95%) | 755 (95%) | 766 (95%) | 515 (95%) | 493 (93%) | 513 (95%) |
Durante l’intervento, 61 (3,8%) bambini sono stati persi per il follow-up, lasciando 1.548 (96,2%) per le analisi ITT. Quattro bambini sono morti e nessun bambino ha sviluppato una reazione allergica agli integratori. L’intervento è stato interrotto prima delle 12 settimane per 119 bambini: 17 bambini sono stati integrati con Plumpy’Sup a causa del sospetto non confermato di contaminazione da salmonella del loro integratore sperimentale, mentre 102 bambini che si deterioravano in SAM sono stati passati ad alimenti terapeutici. Così, le analisi PP comprendeva 1.429 (88,8%) bambini.
Il peso medio di base (SD) era di 6,91 kg (0,93). Il peso al basale comprendeva l’83,5% (5,5) FFM. Abbiamo stimato, sulla base della regressione dei dati di base sull’età, che il peso sarebbe aumentato di 469 g (95% CI 453, 485) e FFM di 434 g (95% CI 416, 453) nell’arco di 3 mesi in assenza di integrazione. Durante l’intervento, il peso è aumentato di 0,90 kg (95% CI 0,88, 0,93), e il 93,5% (95% CI 89,6, 97,4) dell’aumento di peso comprendeva FFM. WHZ è aumentato da -2,22 (0,51) di 0,68 (95% CI 0,65, 0,72), mentre l’altezza per l’età z-score, che era -1,70 (1,1) alla linea di base, è diminuito di 0,17 (95% CI 0,15, 0,19) (Tabella 3).
| Risultato | Linea di base | Fine linea | Differenza | ||||
|---|---|---|---|---|---|---|---|
| n | Media (SD) | n | Media (SD) | n | Media (SD) | 95% CI | |
| Risultato primario | |||||||
| Indice di massa senza grassi (kg/m2) | 1,489 | 11.62 (0.87) | 1,425 | 12.41 (0.92) | 1,328 | 0.80 (0.95) | 0.74, 0.85 |
| Altri risultati | |||||||
| Massa senza grassi (kg) | 1,489 | 5.79 (0.91) | 1,425 | 6.61 (0.98) | 1,328 | 0.85 (0.49) | 0.82, 0.87 |
| Indice di massa grassa (kg/m2) | 1,489 | 2.30 (0.78) | 1,425 | 2.26 (0.81) | 1,328 | −0.05 (0.93) | −0.10, −0.002 |
| Massa grassa (kg) | 1,489 | 1.13 (0.39) | 1,425 | 1.19 (0.42) | 1,328 | 0.059 (0.48) | 0.033, 0.084 |
| Peso (kg) | 1,609 | 6.91 (0.93) | 1,548 | 7.81 (1.05) | 1,548 | 0.90 (0.47) | 0.88, 0.93 |
| Lunghezza (cm) | 1,609 | 70.4 (5.3) | 1,548 | 72.9 (5.1) | 1,548 | 2.6 (1.0) | 2.5, 2.6 |
| Peso per altezza z-score | 1,609 | −2.22 (0.51) | 1,548 | −1.53 (0.72) | 1,548 | 0.68 (0.71) | 0.65, 0.72 |
| Lunghezza del ginocchio (mm) | 1,608 | 192.2 (18.1) | 1,547 | 203.0 (18.2) | 1,546 | 10.8 (6.4) | 10.5, 11.1 |
| Circonferenza del braccio medio-superiore (mm) | 1,609 | 122.6 (4.0) | 1,548 | 130.1 (6.7) | 1,548 | 7.5 (6.1) | 7.2, 7.8 |
| Piegatura dei tricipiti (mm) | 1,607 | 6.31 (1.08) | 1,548 | 6.89 (1.26) | 1,546 | 0.57 (1.17) | 0.51, 0.63 |
| Altezza per l’età z-score | 1,609 | −1.70 (1.12) | 1,548 | −1.86 (1.06) | 1,548 | −0.17 (0.40) | −0.19, −0.15 |
LNS ha aumentato l’accrescimento di FFMI di 0,083 kg/m2 (95% CI 0,003, 0,163) rispetto al CSB. Al contrario, l’SI non ha aumentato l’FFMI (0,038 kg/m2; 95% CI -0,041, 0,118) rispetto al DS, indipendentemente dalla matrice. Avendo il 20% di proteine del latte è stato associato a 0,097 kg/m2 (95% CI -0,002, 0,196) un aumento di FFMI maggiore rispetto ad avere 0% di proteine del latte, anche se questa differenza non è stata significativa (p =0,055), e non vi è stato alcun effetto del 50% di proteine del latte (0,049 kg/m2; 95% CI -0,047, 0,146) (Tabella 4).
| Risultato | Matrice: LNS contro CSB | Qualità della soia: Isolato o decorticato | Percentuale di proteine del latte | |
|---|---|---|---|---|
| 20% contro 0% | 50% contro 0% | |||
| Risultato primario | ||||
| Indice di massa senza grassi (kg/m2) | 0.083 (0.003, 0.163) | 0.038 (−0.041, 0.118) | 0.097 (−0.002, 0.196) | 0.049 (−0.047, 0.146) |
| Altri risultati | ||||
| Massa senza grassi (g) | 37 (−10, 84) | 24 (−23, 71) | 41 (−18, 99) | 29 (−28, 87) |
| Indice di massa grassa (kg /m2) | 0.052 (−0.023, 0.127) | −0.002 (−0.077, 0.073) | −0.085 (−0.178, 0.008) | −0.063 (−0.155, 0.028) |
| Massa grassa (g) | 28 (−12, 67) | 1 (−38, 41) | −41 (−90, 8) | −30 (−77, 18) |
| Peso (g) | 75 (32, 119)1 | 36 (−8, 79) | 9 (−45, 63) | 20 (−33, 73) |
| Con SI: 128 (67, 190) | In LNS: 89 (27, 150) | |||
| Con DS: 22 (-40, 84) | In CSB: -18 (-80, 44) | |||
| Lunghezza (cm) | 0.03 (−0.06, 0.11) | 0.02 (−0.07, 0.10) | 0.03 (−0.08, 0.13) | 0.07 (−0.03, 0.17) |
| Peso per altezza z-score | 0.11 (0.04, 0.17) | 0.05 (−0.01, 0.11) | 0 (−0.07, 0.08) | 0.01 (−0.07, 0.09) |
| Lunghezza del ginocchio (mm) | 0.4 (−0.2, 1.0) | 0 (−0.6, 0.6) | 0.6 (−0.2, 1.3) | 0.7 (−0.1, 1.4) |
| Circonferenza media superiore del braccio (mm) | 1.0 (0.5, 1.6) | 0.3 (−0.2, 0.9) | 0.5 (−0.2, 1.1) | 0.2 (−0.5, 0.9) |
| Piegatura dei tricipiti (mm) | 0.16 (0.06, 0.25) | 0.06 (−0.04, 0.16) | −0.05 (−0.17, 0.07) | −0.09 (−0.21, 0.03) |
Non c’è stata alcuna modifica dell’effetto in base alla stagione, ai criteri di ammissione o alla FFMI di base, allo stordimento, all’infiammazione o all’allattamento al seno(p > 0, 05). Per l’aumento di peso, è stata trovata un’interazione tra la matrice e la qualità della soia(p = 0,017). Quindi, l’effetto principale di 75 g (95% CI 32, 119) di LNS mostrato nella Tabella 4 riflette un guadagno maggiore di 128 g (95% CI 67, 190) quando si dà LNS rispetto a CSB se entrambi contenevano SI, ma nessuna differenza tra LNS e CSB se entrambi contenevano DS (22 g; 95% CI -40, 84). Analogamente, il principale effetto di 36 g (95% CI -8, 79) di SI rispetto a DS riflette che SI ha aumentato il peso di 89 g (95% CI 27, 150) rispetto a DS se combinato con LNS, ma non se combinato con CSB (-18 g; 95% CI -80, 44). LNS rispetto a CSB ha avuto un effetto sia sul MUAC (differenza media 1 mm; 95% CI 0,5, 1,6) che sul tricipite della pelle (differenza media 0,16 mm; 95% CI 0,06, 0,25). Nessuno dei fattori ha avuto effetti sulla lunghezza e sulla lunghezza del ginocchio-tallone, anche se il 50% di proteine del latte è stato associato ad un guadagno di 0,07 cm (95% CI -0,01, 0,14) di lunghezza del ginocchio-tallone (p =0,07) rispetto allo 0% di proteine del latte.
Nel complesso, il tasso di recupero è stato superiore del 7% per LNS contro CSB (69% contro il 62%, p = 0,002), e il tasso di non risposta è stato inferiore del 6% (24% contro il 30%, p = 0,007); non vi è stata alcuna differenza nello sviluppo di SAM (7,3% contro 8,7%, p = 0,31). Non ci sono differenze tra DS e SI per quanto riguarda il tasso di recupero (65% contro 66%), il tasso di non risposta (28% contro 26%) e il rischio di SAM (7,6% contro 8,5%) (tutti p > 0,43). Allo stesso modo, non ci sono state differenze tra 0%, 20% e 50% di proteine del latte nel tasso di recupero (66%, 65% e 65%), nel tasso di non risposta (26%, 26% e 28%) e nel rischio di SAM (8,1%, 8,8% e 7,2%) (tutti p > 0,65).
Le analisi non corrette e le analisi del PP hanno mostrato risultati simili alle analisi ITT (Tabelle 5 e 6).
| Risultato | Matrice: LNS contro CSB | Qualità della soia: Isolato o decorticato | Percentuale di proteine del latte | |
|---|---|---|---|---|
| 20% contro 0% | 50% contro 0% | |||
| Risultato primario | ||||
| Indice di massa senza grassi (kg/m2) | 0.078 (−0.009, 0.165) | 0.026 (−0.062, 0.113) | 0.081 (−0.028, 0.189) | 0.056 (−0.050, 0.162) |
| Altri risultati | ||||
| Massa senza grassi (g) | 43 (−8, 94) | 18 (−33, 70) | 38 (−25, 102) | 30 (−32, 92) |
| Indice di massa grassa (kg/m2) | 0.052 (−0.028, 0.132) | 0.004 (−0.076, 0.085) | −0.084 (−0.184, 0.015) | −0.060 (−0.158, 0.037) |
| Massa grassa (g) | 37 (−5, 79) | 5 (−37, 47) | −35 (−88, 17) | −28 (−79, 23) |
| Peso (g) | 77 (31, 123) | 37 (−9, 83) | 1 (−56, 58) | 10 (−45, 66) |
| Con SI: 123 (59, 188) | In LNS: 83 (18, 148) | |||
| Con DS: 30 (-35, 95) | In CSB: -10 (-75, 55) | |||
| Lunghezza (cm) | 0.03 (−0.06, 0.12) | 0.02 (−0.07, 0.11) | 0.01 (−0.10, 0.12) | 0.07 (−0.03, 0.18) |
| Peso per altezza z-score | 0.11 (0.05, 0.18) | 0.05 (−0.01, 0.12) | 0 (−0.08, 0.08) | 0.01 (−0.07, 0.09) |
| Lunghezza del ginocchio (mm) | 0.55 (−0.07, 1.17) | −0.02 (−0.64, 0.60) | 0.49 (−0.28, 1.25) | 0.66 (−0.09, 1.42) |
| Circonferenza del braccio medio-alto (mm) | 1.2 (0.6, 1.8) | 0.3 (−0.3, 0.9) | 0.4 (−0.3, 1.1) | 0.2 (−0.5, 0.9) |
| Piegatura dei tricipiti (mm) | 0.17 (0.07, 0.27) | 0.06 (−0.04, 0.16) | −0.05 (−0.18, 0.07) | −0.09 (−0.22, 0.03) |
| Risultato | Matrice: LNS contro CSB | Qualità della soia: Isolato o decorticato | Percentuale di proteine del latte | |
|---|---|---|---|---|
| 20% contro 0% | 50% contro 0% | |||
| Risultato primario | ||||
| Indice di massa senza grassi (kg/m2) | 0.088 (0.005, 0.171) | 0.057 (−0.027, 0.140) | 0.106 (0.001, 0.210) | 0.054 (−0.046, 0.155) |
| Altri risultati | ||||
| Massa senza grassi (g) | 36 (−14, 85) | 35 (−14, 85) | 47 (−14, 109) | 30 (−29, 90) |
| Indice di massa grassa (kg/m2) | 0.077 (−0.001, 0.154) | 0.005 (−0.073, 0.083) | −0.101 (−0.198, −0.004) | −0.067 (−0.161, 0.027) |
| Massa grassa (g) | 40 (−1, 81) | 6 (−35, 47) | −49 (−100, 2) | −29 (−79, 19) |
| Peso (g) | 84 (39, 129) | 50 (5, 95) | 6 (−50, 62) | 22 (−32, 77) |
| Con SI: 128 (65, 191) | In LNS: 93 (31, 156) | |||
| Con DS: 39 (-26, 103) | In CSB: 4 (-60, 68) | |||
| Lunghezza (cm) | 0.02 (−0.06, 0.11) | 0.03 (−0.06, 0.12) | 0.02 (−0.08, 0.13) | 0.06 (−0.04, 0.17) |
| Peso per altezza z-score | 0.12 (0.06, 0.19) | 0.07 (0.01, 0.14) | 0 (−0.08, 0.08) | 0.01 (−0.07, 0.09) |
| Lunghezza del ginocchio (mm) | 0.5 (−0.1, 1.2) | 0.1 (−0.6, 0.7) | 0.6 (−0.2, 1.3) | 0.7 (−0.03, 1.49) |
| Circonferenza media superiore del braccio (mm) | 1.2 (0.7, 1.8) | 0.5 (−0.1, 1.0) | 0.4 (−0.3, 1.1) | 0.2 (−0.4, 0.9) |
| Piegatura dei tricipiti (mm) | 0.16 (0.06, 0.26) | 0.06 (−0.04, 0.16) | −0.06 (−0.19, 0.07) | −0.09 (−0.21, 0.04) |

Fig. 2.Profilo di prova.In totale, 3.398 bambini sono stati valutati per l’idoneità nei 5 siti di studio, e 1.609 bambini sono stati randomizzati e inclusi nello studio. CSB, miscela mais-soia; D20, misurazione dell’ossido di deuterio; DS, soia decorticata; ITT, intenzione di trattare; LNS, integratore di nutrienti a base lipidica; PP, per protocollo; PPS/Salmonella, ricevuto Plumpy’Sup a causa del sospetto di contaminazione da salmonella; PPN/SAM, ricevuto Plumpy’Nut a causa di grave malnutrizione acuta; SI, isolato di soia.
Discussione
Ci sono poche prove per informare la politica sulla composizione degli alimenti complementari per i bambini con MAM. Il nostro studio ha studiato l’efficacia della matrice dei fattori chiave, la qualità della soia e le proteine del latte negli integratori alimentari utilizzati per il trattamento dei giovani bambini burkinabé con MAM identificati da uno spreco moderato[22] o basso MUAC, che è spesso utilizzato per identificare il MAM nei programmi nutrizionali[23]. Le 12 settimane di integrazione hanno portato ad un elevato guadagno di FFM nei gruppi di intervento. L’FFMI era maggiore nei bambini che ricevevano LNS rispetto al CSB, e l’aumento di peso era maggiore nei bambini che ricevevano LNS con SI rispetto a LNS con DS.
Diversi studi hanno valutato l’effetto dell’integrazione sul peso nei bambini con MAM, ma mancano dati sulla composizione corporea[24-31]. Un recente studio del Mali che ha applicato gli stessi criteri di ammissione antropometrici del nostro studio e che ha anche integrato con 500 kcal/giorno per 12 settimane ha riportato un aumento di peso complessivo simile al nostro studio[29]. L’aumento di peso medio durante il nostro intervento è stato di circa 0,9 kg e comprendeva prevalentemente FFM. Per ragioni etiche, non abbiamo incluso un gruppo di controllo non integrato. Tuttavia, sulla base dei nostri dati di base, abbiamo stimato che gli interventi hanno approssimativamente raddoppiato sia il peso che l’incremento di peso nella nostra coorte complessiva, il che è supportato dalla nostra constatazione che la WHZ è aumentata di 0,68.
È interessante notare che, nonostante la diagnosi di MAM, l’alta percentuale di peso accreditato come FFM nella nostra coorte è coerente con quello che ci si aspetterebbe da bambini ben nutriti[32]. Tutti gli integratori sperimentali hanno fornito la gamma completa di sostanze nutritive per la sintesi dei tessuti muscolari e organi, il che spiega in parte l’elevato incremento di FFM. Un FFM più grande richiede una maggiore quantità di grasso per tamponare un determinato periodo di fame; quindi, l’accrescimento di grasso dovrebbe accompagnare l’accrescimento FFM. Il beneficio del grasso è stato precedentemente dimostrato da bassi livelli di leptina, un correlato ormonale del grasso, che prevede la mortalità da SAM[33]. Il modesto aumento del grasso nel nostro studio non sarà probabilmente dannoso.
Vecchi studi di riabilitazione nutrizionale dei bambini con SAM hanno riportato alti tassi di accumulo di grasso[34,35], e questo è stato replicato in uno studio di recupero rapido da SAM nei bambini indiani[36]. Questi risultati possono essere in parte spiegati da diete non adeguatamente fortificate con zinco e altri nutrienti per la crescita, vale a dire, i nutrienti essenziali per la sintesi di tessuto senza grassi[37,38]. Questi studi hanno comportato velocità di aumento di peso molto elevate, fino a 14 volte superiori a quelle di un bambino ben nutrito e circa 7 volte più veloci rispetto al nostro studio. Al contrario, non è stato riportato alcun eccesso di grasso nei bambini con SAM riabilitato con tassi di aumento di peso relativamente lenti in un recente piccolo studio che utilizzava la tecnica di diluizione del deuterio per misurare la FFM[39]. Il nostro studio, con dati sulla composizione corporea longitudinale nei bambini con MAM, fornisce prove più solide che un moderato aumento di peso attraverso l’integrazione nutrizionale può dare priorità all’accrescimento dei tessuti privi di grasso, con un piccolo aumento dell’adiposità.
LNS ha aumentato il nostro risultato primario, FFMI, una misura di FFM indipendente dalla lunghezza. Questo aumento dimostra che l’LNS rispetto al CSB porta ad un maggior numero di tessuti privi di grassi, che probabilmente mediano risultati funzionali benefici. Inoltre, l’LNS ha avuto effetti principali su diversi altri risultati, aumentando la WHZ, la MUAC, il tricipite della pelle e il tasso di recupero nutrizionale. Questi benefici dell’LNS potrebbero essere dovuti a una maggiore biodisponibilità dei nutrienti per la crescita, come lo zinco e il fosforo, rispetto al CSB, o a un apporto relativamente più elevato. Sia in uno studio pilota che nella popolazione di prova, abbiamo dimostrato che i bambini a cui è stato somministrato l’LNS consumano una percentuale maggiore di integratori rispetto a quelli a cui è stato somministrato il CSB[40- 42].
Per quanto riguarda il peso, l’interazione identificata tra la matrice e la qualità della soia rifletteva che gli LNS con SI hanno prodotto un aumento di peso di 89 g (circa il 10% di guadagno totale) maggiore rispetto agli LNS con DS. La qualità della soia non ha avuto alcun effetto sul peso per il CSB. Questo è stato inaspettato in quanto l’SI rispetto alla DS contiene meno anti-nutrienti, il che dovrebbe portare a un migliore assorbimento dei minerali[6]. È interessante notare che in precedenza abbiamo trovato una simile forte interazione tra matrice e qualità della soia rispetto a un punteggio di apprezzamento degli integratori, che indicava che i bambini preferivano la DS rispetto all’SI nel CSB, ma non nell’LNS[41].
Non ci sono stati effetti complessivi del latte, probabilmente perché il 95% dei bambini è stato allattato al seno. Tuttavia, la stima puntuale dell’effetto sulla FFMI di avere il 20% rispetto a nessuna proteina del latte era simile a quella di LNS contro CSB, anche se non significativa.
Il nostro studio non è stato creato per indagare sul rapporto costo-efficacia, il che è complicato dal fatto che i prezzi degli ingredienti fluttuano considerevolmente. Sulla base dei prezzi del mercato internazionale (ottobre 2016) e calcolati per grammo di proteina, il costo del SI è pari a circa l’80% del prezzo del DSM, mentre il costo del DS è pari al 33% del prezzo del DSM. Inoltre, una stima approssimativa basata sulle informazioni dell’UNICEF (ottobre 2016) è che il LNS è circa il doppio del costo del CSB per razione giornaliera data[43]. Tuttavia, tale confronto non tiene conto del recupero più rapido con l’LNS e degli altri costi associati. Ad esempio, il CSB richiede tempo per la preparazione, ha una durata di conservazione più breve ed è più ingombrante, con implicazioni per il trasporto e lo stoccaggio. Sono necessari studi dettagliati sul rapporto costo-efficacia per informare la politica. I nostri risultati supportano un uso più ampio degli LNS, che può anche rafforzare ulteriormente le iniziative future verso un approccio integrato alla gestione di MAM e SAM con l’uso di un unico prodotto, che può benissimo aumentare l’efficacia dei programmi e ridurre il loro costo complessivo per bambino[44].
La nostra sperimentazione ha diversi punti di forza e limiti. Un punto di forza è che il design fattoriale ci ha permesso di valutare l’effetto dei principali fattori generici negli integratori, piuttosto che confrontare prodotti diversi rispetto a molteplici fattori. Ci ha anche permesso di valutare le possibili interazioni e, in caso contrario, di avere più potere per stimare gli effetti principali. Ad esempio, questo ci ha permesso di avere il potere di rilevare un effetto principale di LNS rispetto a CSB su FFMI, e di identificare le interazioni tra matrice e qualità della soia rispetto all’aumento di peso. Tuttavia, un limite inerente alle prove di intervento alimentare è che se un ingrediente contenente macronutrienti viene aggiunto a un prodotto, allora il contenuto di altri ingredienti deve essere regolato per mantenere costante la quantità di macronutrienti e di energia per dose, il che complica l’interpretazione. Nella nostra prova, ad esempio, quando la DS viene sostituita da SI, allora la quantità di maltodestrina viene aumentata. Allo stesso modo, quando si aggiunge il latte, si riduce la quantità di soia e di maltodestrina. Quindi, in effetti, quando vediamo una forte, anche se non significativa, associazione tra il 20% di latte e FFMI, allora viene confrontato con nessun latte, ma più soia e maltodestrina. Inoltre, qualsiasi differenza tra latte e soia può non essere dovuta solo alla loro qualità proteica, ma anche agli effetti delle sostanze nutritive o degli anti-nutrienti di accompagnamento. Ad esempio, il latte è stato incluso come latte scremato, che contiene anche lattosio e minerali altamente biodisponibili. Le ricerche future sul merito relativo delle proteine del latte e della soia dovrebbero utilizzare proteine pure.
Un altro punto di forza è che abbiamo valutato la composizione corporea, poiché una dieta di scarsa qualità porterà all’accumulo di grasso a scapito del tessuto privo di grasso, che è essenziale per i risultati funzionali. Inoltre, abbiamo misurato la FFM con la tecnica di diluizione del deuterio all’avanguardia. Per il nostro risultato primario, abbiamo espresso FFM come FFMI per distinguere l’accrescimento FFM dall’aumento della lunghezza e per aumentare la precisione. I dati sulla composizione corporea ci hanno anche permesso di concludere che la preoccupazione se l’elevato contenuto di grasso nel LNS possa portare ad un elevato accumulo di grasso è ingiustificata. Anche se abbiamo trovato un aumento dello spessore della pelle nei bambini con LNS, è improbabile che il livello di accrescimento del grasso osservato sia dannoso.
Un limite del nostro studio è che l’effetto di un intervento nutrizionale dipende dallo stato nutrizionale di fondo e dall’assunzione, e la mancanza di queste informazioni limita la generalizzabilità. Inoltre, non è possibile raccogliere dati dettagliati a livello individuale sull’assunzione di un integratore in un grande studio nei bambini. Abbiamo invece condotto dei sotto-studi sull’accettabilità e sul comportamento alimentare in relazione agli integratori, per facilitare l’interpretazione dei risultati dello studio. Tuttavia, il nostro studio è stato uno studio sull’efficacia, e l’uso di integratori nella sperimentazione si è probabilmente avvicinato al loro effettivo utilizzo in un programma nutrizionale. Quindi, indipendentemente dai meccanismi sottostanti, le differenze che abbiamo identificato tra i fattori testati, in particolare per il nostro risultato primario FFMI, sono altamente rilevanti per la politica.
In conclusione, i bambini con MAM quando riabilitati dal punto di vista nutrizionale con integratori che forniscono l’intera gamma di nutrienti messi su tessuto prevalentemente privo di grassi. Tuttavia, LNS ha prodotto più tessuto privo di grassi e tassi di recupero più elevati rispetto al CSB. Inoltre, gli attuali prodotti LNS con DS possono essere migliorati passando al SI. Il ruolo del latte rispetto alla soia merita ulteriori ricerche.
Informazioni di supporto
References
- Black RE, Victora CG, Walker SP, Bhutta ZA, Christian P, de Onis M. Maternal and child undernutrition and overweight in low-income and middle-income countries. Lancet. 2013; 382:427-51. Publisher Full Text | PubMed
- Black RE, Allen LH, Bhutta ZA, Caulfield LE, de Onis M, Ezzati M. Maternal and child undernutrition: global and regional exposures and health consequences. Lancet. 2008; 371:243-60. Publisher Full Text | PubMed
- Victora CG, Adair L, Fall C, Hallal PC, Martorell R, Richter L. Maternal and child undernutrition: consequences for adult health and human capital. Lancet. 2008; 371:340-57. Publisher Full Text | PubMed
- World Health Organization. Supplementary foods for the management of moderate acute malnutrition in infants and children 6–59 months of age. World Health Organization: Geneva; 2012. Publisher Full Text
- de Pee S, Bloem MW. Current and potential role of specially formulated foods and food supplements for preventing malnutrition among 6- to 23-month-old children and for treating moderate malnutrition among 6- to 59-month-old children. Food Nutr Bull. 2009; 30:S434-63. Publisher Full Text | PubMed
- Michaelsen KF, Hoppe C, Roos N, Kaestel P, Stougaard M, Lauritzen L. Choice of foods and ingredients for moderately malnourished children 6 months to 5 years of age. Food Nutr Bull. 2009; 30:S343-404. Publisher Full Text | PubMed
- World Health Organization. Management of severe malnutrition: a manual for physicians and other senior health workers. World Health Organization: Geneva; 1999. Publisher Full Text
- Hoppe C, Andersen GS, Jacobsen S, Mølgaard C, Friis H, Sangild PT. the use of whey or skimmed milk powder in fortified blended foods for vulnerable groups. J Nutr. 2008; 138:145S-61S. PubMed
- Hoppe C, Mølgaard C, Michaelsen KF. Cow’s milk and linear growth in industrialized and developing countries. Annu Rev Nutr. 2006; 26:131-73. Publisher Full Text | PubMed
- Friis H, Michaelsen KF, Wells JC. Choice of design and outcomes in trials among children with moderate acute malnutrition. Food Nutr Bull. 2015; 36:S35-40. Publisher Full Text | PubMed
- World Health Organization. The management of nutrition in major emergencies. World Health Organization: Geneva; 2000. Publisher Full Text
- Burkina Faso Ministère de la Santé Direction de la Nutrition. Rapport Enquête Nutritionnelle Nationale (National Nutrition Survey Report). Ouagadougou: Burkina Faso Ministère de la Santé; 2013.
- .Publisher Full Text
- Institut National de la Statistique et de la Démographie. Enquête Démographique et de Santé et à Indicateurs Multiples (EDSBF-MICS IV) 2010. Institut National de la Statistique et de la Démographie: Ouagadougou; 2012. Publisher Full Text
- Fabiansen C, Yaméogo CW, Devi S, Friis H, Kurpad A, Wells JC. Deuterium dilution technique for body composition assessment: resolving methodological issues in children with moderate acute malnutrition. Isotopes Environ Health Stud. 2017; 53:344-55. Publisher Full Text | PubMed
- International Atomic Energy Agency. Introduction to body composition assessment using the deuterium dilution technique with analysis of saliva samples by Fourier transform infrared spectrometry. International Atomic Energy Agency: Vienna; 2010. Publisher Full Text
- Davies PS, Wells JC. Calculation of total body water in infancy. Eur J Clin Nutr. 1994; 48:490-5. PubMed
- Lohman TG. Current Issues in Exercise Science Series, Monograph 3. Human Kinetics Publishers: Champaign (Illinois); 1992.
- VanItallie TB, Yang MU, Heymsfield SB, Funk RC, Boileau RA. Height-normalized indices of the body’s fat-free mass and fat mass: potentially useful indicators of nutritional status. Am J Clin Nutr. 1990; 52:953-9. PubMed
- Skau JKH, Touch B, Chhoun C, Chea M, Unni US, Makurat J. Effects of animal source food and micronutrient fortification in complementary food products on body composition, iron status, and linear growth: a randomized trial in Cambodia. Am J Clin Nutr. 2015; 101:742-51. Publisher Full Text | PubMed
- Barnett AG. Regression to the mean: what it is and how to deal with it. Int J Epidemiol. 2004; 34:215-20. Publisher Full Text | PubMed
- World Health Organization. WHO child growth standards: length/height-for-age, weight-for-age, weight-for-length, weight-for-height and body mass index-for-age: methods and development. World Health Organization: Geneva; 2006.
- World Health Organization. WHO, UNICEF, WFP and UNHCR Consultation on the programmatic aspects of the management of moderate acute malnutrition in children under five years of age. Geneva; 2010. Publisher Full Text
- Matilsky DK, Maleta K, Castleman T, Manary MJ. Supplementary feeding with fortified spreads results in higher recovery rates than with a corn/soy blend in moderately wasted children. J Nutr. 2009; 139:773-8. Publisher Full Text | PubMed
- Nackers F, Broillet F, Oumarou D, Djibo A, Gaboulaud V, Guerin PJ. Effectiveness of ready-to-use therapeutic food compared to a corn/soy-blend-based pre-mix for the treatment of childhood moderate acute malnutrition in Niger. J Trop Pediatr. 2010; 56:407-13. Publisher Full Text | PubMed
- Lagrone LN, Trehan I, Meuli GJ, Wang RJ, Thakwalakwa C, Maleta K. A novel fortified blended flour, corn-soy blend “plus-plus”, is not inferior to lipid-based ready-to-use supplementary foods for the treatment of moderate acute malnutrition in Malawian children. Am J Clin Nutr. 2012; 95:212-9. Publisher Full Text | PubMed
- Nikièma L, Huybregts L, Kolsteren P, Lanou H, Tiendrebeogo S, Bouckaert K. Treating moderate acute malnutrition in first-line health services: an effectiveness cluster-randomized trial in Burkina Faso. Am J Clin Nutr. 2014; 100:241-9. Publisher Full Text | PubMed
- Karakochuk C, van den Briel T, Stephens D, Zlotkin S. Treatment of moderate acute malnutrition with ready-to-use supplementary food results in higher overall recovery rates compared with a corn-soya blend in children in southern Ethiopia: an operations research trial. Am J Clin Nutr. 2012; 96:911-6. Publisher Full Text | PubMed
- Ackatia-Armah RS, McDonald CM, Doumbia S, Erhardt JG, Hamer DH, Brown KH. Malian children with moderate acute malnutrition who are treated with lipid-based dietary supplements have greater weight gains and recovery rates than those treated with locally produced cereal-legume products: a community-based, cluster-randomized trial. Am J Clin Nutr. 2015; 101:632-45. Publisher Full Text | PubMed
- Medoua GN, Ntsama PM, Ndzana ACA, Essa’a VJ, Tsafack JJT, Dimodi HT. Recovery rate of children with moderate acute malnutrition treated with ready-to-use supplementary food (RUSF) or improved corn—soya blend (CSB+): a randomized controlled trial. Public Health Nutr. 2016; 19:363-70. Publisher Full Text | PubMed
- Stobaugh HC, Ryan KN, Kennedy JA, Grise JB, Crocker AH, Thakwalakwa C. Including whey protein and whey permeate in ready-to-use supplementary food improves recovery rates in children with moderate acute malnutrition: a randomized, double-blind clinical trial. Am J Clin Nutr. 2016; 103:926-33. Publisher Full Text | PubMed
- Fomon SJ, Haschke F, Ziegler EE, Nelson SE. Body composition of reference children from birth to age 10 years. Am J Clin Nutr. 1982; 35:1169-75. PubMed
- Bartz S, Mody A, Hornik C, Bain J, Muehlbauer M, Kiyimba T. Severe acute malnutrition in childhood: hormonal and metabolic status at presentation, response to treatment, and predictors of mortality. J Clin Endocrinol Metab. 2014; 99:2128-37. Publisher Full Text | PubMed
- Brooke OG, Wheeler EF. High energy feeding in protein-energy malnutrition. Arch Dis Child. 1976; 51:968-71. PubMed
- Fjeld CR, Schoeller DA, Brown KH. Body composition of children recovering from severe protein-energy malnutrition at two rates of catch-up growth. Am J Clin Nutr. 1989; 50:1266-75. PubMed
- Radhakrishna KV, Kulkarni B, Balakrishna N, Rajkumar H, Omkar C, Shatrugna V. Composition of weight gain during nutrition rehabilitation of severely under nourished children in a hospital based study from India. Asia Pac J Clin Nutr. 2010; 19:8-13. PubMed
- Golden BE, Golden MH. Plasma zinc, rate of weight gain, and the energy cost of tissue deposition in children recovering from severe malnutrition on a cow’s milk or soya protein based diet. Am J Clin Nutr. 1981; 34:892-9. PubMed
- Golden MH. Proposed recommended nutrient densities for moderately malnourished children. Food Nutr Bull. 2009; 30:S267-342. Publisher Full Text | PubMed
- Bahwere P, Balaluka B, Wells JC, Mbiribindi CN, Sadler K, Akomo P. Cereals and pulse-based ready-to-use therapeutic food as an alternative to the standard milk- and peanut paste-based formulation for treating severe acute malnutrition: a noninferiority, individually randomized controlled efficacy clinical trial. Am J Clin Nutr. 2016; 103:1145-61. Publisher Full Text | PubMed
- Iuel-Brockdorf A-S, Dræbel TA, Fabiansen C, Cichon B, Christensen VB, Yameogo C. Acceptability of new formulations of corn-soy blends and lipid-based nutrient supplements in Province du Passoré, Burkina Faso. Appetite. 2015; 91:278-86. Publisher Full Text | PubMed
- Iuel-Brockdorf A-S, Draebel TA, Ritz C, Fabiansen C, Cichon B, Brix Christensen V. Evaluation of the acceptability of improved supplementary foods for the treatment of moderate acute malnutrition in Burkina Faso using a mixed method approach. Appetite. 2016; 99:34-45. Publisher Full Text | PubMed
- Iuel-Brockdorf A-S, Ouedraogo A, Ritz C, Draebel TA, Ashorn P, Filteau S. Feeding behaviors during home-based treatment of moderate acute malnutrition using corn-soy blends or lipid-based nutrient supplements. Matern Child Nutr. 2016. Publisher Full Text | PubMed
- .Publisher Full Text
- Maust A, Koroma AS, Abla C, Molokwu N, Ryan KN, Singh L. Severe and moderate acute malnutrition can be successfully managed with an integrated protocol in Sierra Leone. J Nutr. 2015; 145:2604-9. Publisher Full Text | PubMed
Fonte
Fabiansen C, Yaméogo CW, Iuel-Brockdorf A, Cichon B, Rytter MJH, et al. (2017) Effectiveness of food supplements in increasing fat-free tissue accretion in children with moderate acute malnutrition: A randomised 2 × 2 × 3 factorial trial in Burkina Faso. PLoS Medicine 14(9): e1002387. https://doi.org/10.1371/journal.pmed.1002387





