Abstract
Introduzione
La comprensione dell’efficacia e della durata della protezione offerta dai vaccini per il colera per via orale è necessaria per sviluppare programmi di vaccinazione efficaci. Una meta-analisi dei vaccini per il colera per via orale uccisi ha mostrato un’efficacia protettiva media del 58% e un’efficacia protettiva media del 73%.1 Anche se gli studi di efficacia suggeriscono un calo della protezione 2 anni dopo la vaccinazione orale1pochi studi hanno riportato un’efficacia a lungo termine a due dosi, e nessuno studio prospettico a lungo termine sull’efficacia è stato fatto al di fuori dell’Asia, dove il colera è endemico da secoli. L’assenza di studi sulla durata della protezione dei vaccini per il colera per via orale al di fuori delle aree storicamente colera-endemiche dell’Asia meridionale rende necessaria la valutazione di questi effetti in altre popolazioni dove le condizioni di esposizione precedente e continuativa al Vibrio col era potrebbero essere diverse.
Il colera è stato introdotto ad Haiti nel 2010 e da allora è diventato endemico. L’uso di vaccini per il colera per via orale a cellule intere uccise, bivalenti e bivalenti (Shantha Biotechnics, Hyderabad, India) è stato implementato per la prima volta nell’ambito di una risposta globale al colera in alcune comunità ad alta incidenza di colera nelle zone rurali e urbane di Haiti nell’aprile 2012.2, 3 È stato in questo contesto che abbiamo inizialmente condotto uno studio caso-controllo per valutare l’efficacia dei vaccini per il colera per via orale a cellule intere uccise, bivalenti e bivalenti nel bacino di utenza della campagna rurale fino a 2 anni dopo la vaccinazione.2, 4 I vaccini per il colera bivalente, uccisi, bivalenti, a cellule intere, sono stati successivamente utilizzati nelle campagne di vaccinazione in altre comunità di Haiti con un’elevata incidenza di colera.
In questo studio caso-controllo, ampliamo l’analisi del nostro studio caso-controllo precedentemente descritto sull’efficacia dei vaccini per il colera per via orale ad Haiti per valutare la durata della protezione del regime standard a due dosi fino a 4 anni dopo la vaccinazione. Esaminiamo anche la durata della protezione associata ai vaccini per il colera per via orale dopo una singola dose, che ha importanti implicazioni nel contesto studiato in cui l’offerta di vaccini è scarsa.
Ricerca in contextEvidenceprima dello studioUnarevisione sistematica di PubMed e meta-analisi pubblicata nell’ottobre del 2017 ha esaminato studi randomizzati controllati e studi osservazionali che hanno riportato stime di protezione diretta contro il colera in presenza di cure mediche conferite da vaccini per il colera per via orale uccisi (vaccino bivalente a cellule intere e/o vaccino a cellule intere con sottounità B). Essi hanno incluso sette studi sperimentali e sei studi osservazionali (in Asia meridionale, paesi africani e Perù) e hanno trovato che la vaccinazione con due dosi di vaccini per il colera per via orale uccisi offriva una protezione da moderata ad elevata contro il colera medicalmente frequentato per i primi 3 anni dopo la vaccinazione. Ci sono state alcune prove che suggeriscono una protezione oltre i 3 anni. Per quanto riguarda la protezione con una sola dose, pochi studi avevano questo come endpoint primario, ma quelli che hanno trovato una protezione statisticamente significativa nel breve periodo (per esempio, fino a 1 anno dopo la vaccinazione, la protezione è stata del 69% di efficacia [95% CI 35-85] da due studi osservazionali e del 40% di efficacia da uno studio [95% CI 11-60]). Non ci sono stati studi con la protezione monodose come endpoint primario con follow-up di oltre 6 mesi dopo la vaccinazione e tutti i dati sulla protezione monodose provenivano da popolazioni con trasmissione regolare del colera. Per completare questa revisione, abbiamo cercato PubMed utilizzando i termini di ricerca “colera” e “vaccino” e (“efficacia” o “efficacia” o “proteggere”).) e senza restrizioni linguistiche per gli articoli pubblicati dal 9 luglio 2016 al 21 novembre 2017 e che hanno identificato 36 articoli, nessuno dei quali riportava la protezione diretta della vaccinazione con una singola dose di vaccini per il colera per via orale uccisi o la protezione a lungo termine con la vaccinazione a due dosi, disaggregate nel tempo.Valore aggiunto di questo studio Questostudio colma tre lacune di conoscenza cruciali relative all’efficacia a lungo termine della vaccinazione con vaccini per il colera orale bivalenti, uccisi, bivalenti e a cellule intere. In primo luogo, questo è il primo studio, a nostra conoscenza, a riportare l’efficacia sul campo di due dosi di vaccini per il colera per via orale a due cellule intere, bivalenti e uccisi, fino a 4 anni dopo la vaccinazione. Abbiamo trovato una protezione coerente con due dosi di vaccini per il colera per via orale a cellule intere uccise, bivalenti e bivalenti, che sono rimaste invariate durante i 4 anni di follow-up (l’efficacia cumulativa, rettificata a 4 anni è stata del 76%). In secondo luogo, abbiamo fornito la prima prova di una protezione a lungo termine con due dosi di vaccini per il colera per via orale a cellule intere bivalenti, uccisi, al di fuori dell’Asia meridionale, dove il colera è storicamente endemico. I tre studi esistenti sulla protezione a lungo termine dei vaccini per il colera per via orale uccisi sono stati fatti in India e in Bangladesh, dove il colera è endemico da secoli. Abbiamo fatto questo studio ad Haiti, dove il colera è endemico da poco e dove l’esposizione al colera in corso potrebbe essere diversa da quella di luoghi con colera storicamente endemico. In terzo luogo, forniamo le prime stime della durata della protezione con una singola dose di vaccini per via orale per il colera uccisi, bivalenti e a cellule intere. Abbiamo trovato un’alta prevalenza di protezione durante il primo anno, che è scesa a zero alla fine del secondo anno dopo la vaccinazione. Questi dati sono fondamentali per comprendere l’uso ottimale dei vaccini per il colera per via orale nel contesto del controllo e della prevenzione globale del colera.Implicazioni di tutte le prove disponibiliLe provesuggeriscono che, sebbene le campagne di vaccini per il colera per via orale a singola dose uccisa, bivalente e a cellule intere siano utili a breve termine, sono necessarie due dosi per una protezione a lungo termine. Questi risultati si aggiungono alle prove a sostegno dell’uso di vaccini per il colera per via orale a cellule intere uccisi, bivalenti e bivalenti, come parte di piani completi di controllo del colera e di investimenti a sostegno di una scorta globale di vaccini per il colera per via orale a cellule intere uccisi, bivalenti e bivalenti.
Metodi
Studio di progettazione
Il bacino di utenza del presente studio corrispondeva a quello di due campagne di vaccinazione. La prima campagna ha interessato due comunità rurali (Bocozel e Grand Saline) nel Dipartimento dell’Artibonite e si è svolta dal 15 aprile al 19 giugno 2012, mentre la seconda campagna si è svolta a Mirebalais nel Dipartimento Centrale dal 25 agosto al 19 settembre 2014. Ogni campagna aveva lo scopo di somministrare due dosi orali di vaccino a 14 giorni di distanza l’una dall’altra. I dettagli sulla progettazione dello studio, l’impostazione e il reclutamento dei partecipanti sono stati descritti in precedenza.4 Il reclutamento dei partecipanti è iniziato nell’ottobre 2012 nel Dipartimento di Artibonite e nel novembre 2014 nel Dipartimento Centrale ed è continuato fino al novembre 2016. Poiché la campagna di vaccinazione nel Dipartimento dell’Artibonite è avvenuta più di 2 anni prima della campagna nel Dipartimento Centrale, i partecipanti del Dipartimento dell’Artibonite hanno fornito la maggior parte delle informazioni sull’efficacia oltre i 24 mesi.
I partecipanti ammissibili dovevano soddisfare due condizioni: la residenza nel bacino di utenza del vaccino dove sono stati reclutati all’inizio dello studio e l’idoneità alla campagna di vaccinazione (cioè, di età ≥12 mesi, non incinta, e che vivevano nella regione al momento della campagna di vaccinazione).
I pazienti con diarrea acuta acquosa – definita come tre o più feci acquose non sanguinolente in un periodo di 24 ore con un inizio di 3 giorni o meno prima della presentazione – sono stati reclutati da strutture per il trattamento del colera nel bacino di utenza dello studio. I partecipanti con un campione di feci positive alla coltura per il colera V O1 sono stati assegnati al gruppo del colera. Solo una persona per famiglia è stata iscritta allo studio.
Per ogni persona affetta da colera, quattro persone della comunità sono state reclutate dalle loro residenze e assegnate al gruppo di controllo. Le persone del gruppo di controllo della comunità erano individui che potevano essere abbinati a un caso in base al luogo di residenza, al tempo di iscrizione (entro 2 settimane dal caso) e al gruppo di età (1-4 anni, 5-15 anni e >15 anni) e non hanno cercato il trattamento per la diarrea tra il primo giorno di iscrizione dei partecipanti nel loro bacino di utenza e la data di insorgenza dei sintomi nel loro caso corrispondente. Quando in un nucleo familiare era disponibile più di un controllo idoneo, è stato selezionato, quando possibile, un individuo dello stesso sesso. Se erano disponibili più di un controllo idoneo, ma entrambi erano di sesso diverso dal caso, è stato scelto quello che più si avvicinava alla persona con il colera in età. Nelle zone rurali di Haiti, le famiglie sono spesso raggruppate in un gruppo di famiglie multigenerazionali chiamato lakou.5 Nella scelta dei controlli, gli operatori dello studio si sono avvicinati alla casa più vicina alla persona del paziente assegnato al gruppo di casi, escludendo le case all’interno dello stesso lakou perché abbiamo previsto che l’esposizione al vaccino per il colera fosse altamente correlata all’interno del lakou. Gli operatori dello studio si sono poi avvicinati alla residenza più vicina fino a quando non sono stati iscritti quattro controlli corrispondenti.
Procedure
I campioni di feci sono stati raccolti in contenitori sterili e trasportati in mezzi Cary-Blair al Laboratorio Nazionale di Salute Pubblica di Haiti a Port-au-Prince o al Laboratorio delle Malattie Enteriche di Saint Marc per la successiva coltura su agar tiosolfato-citrato-sali-sucosio. L’identificazione del sierogruppo V coleraceo O1 a livello del sierotipo è stata effettuata con un metodo standard di agglutinazione su vetrino.6 La PCR non era disponibile di routine ad Haiti per la diagnosi del colera durante il periodo di studio.
Per raccogliere dati sulle caratteristiche sociodemografiche, sui fattori di rischio del colera e sulle vaccinazioni autodenunciate, gli operatori hanno intervistato i casi di colera presso l’impianto di trattamento del colera. Entro 2 settimane dall’iscrizione, gli operatori dello studio hanno visitato i pazienti nelle loro case per raccogliere ulteriori informazioni sui contenitori dell’acqua di casa e per richiedere le schede di vaccinazione per la verifica, se del caso. I controlli della comunità sono stati reclutati e intervistati nelle loro case. Per i bambini e gli altri partecipanti che non sono stati in grado di rispondere alle domande del colloquio, i tutori o un rappresentante dei familiari hanno risposto alle domande per conto del partecipante. Un collaboratore dello studio ha estratto i dati clinici dalle cartelle cliniche dei casi di colera.
Valutazione della vaccinazione
La vaccinazione orale per il colera è stata valutata tramite autodenuncia durante il colloquio faccia a faccia. Gli operatori dello studio hanno descritto il vaccino per studiare i partecipanti in termini di funzione, tempi di somministrazione e modalità di somministrazione per differenziarlo dagli altri vaccini. Se il partecipante ha riferito di aver ricevuto i vaccini per il colera per via orale, gli è stato chiesto quante dosi ha ricevuto. Abbiamo cercato di verificare la vaccinazione autodenunciata chiedendo ai soggetti che hanno riferito di aver ricevuto almeno una dose del vaccino di produrre la scheda di vaccinazione orale contro il colera durante la visita a domicilio; solo il 35% dei soggetti che hanno riferito di aver ricevuto la vaccinazione è stato in grado di produrre una scheda di vaccinazione. Questo risultato è probabilmente dovuto al lungo periodo di tempo (fino a 4 anni per alcuni partecipanti) trascorso dalle campagne di vaccinazione; inoltre, dal 2012 al 2014, oltre alle schede di vaccinazione sono stati rivisti i registri digitali dei vaccini per confermare lo stato di vaccinazione. Dal 2014 in poi, le campagne condotte dal Ministero della Salute hanno utilizzato registri cartacei che non erano suscettibili di revisione manuale. Poiché la prevalenza del vaccino autodenunciato si avvicinava maggiormente alle stime di copertura vaccinale della popolazione conosciuta,2 abbiamo usato questo come valutazione primaria dell’esposizione. Abbiamo condotto analisi di sensibilità in cui (1) abbiamo considerato solo lo stato di vaccinazione verificato come registrato da carte o registri e (2) abbiamo dato priorità alle informazioni verificate rispetto all’autodenuncia, ma abbiamo usato informazioni autodenunciate se il paziente non era in grado di produrre una carta di vaccinazione. Quest’ultimo approccio è stato utilizzato anche in altri studi di controllo dell’efficacia dei vaccini per il colera per via orale.7, 8, 9
Analisi statistica
Poiché c’è stato un ritardo tra la campagna di vaccinazione e l’inizio dello studio in ogni bacino di utenza, non abbiamo avuto dati sull’efficacia del vaccino nei primi 2 mesi successivi alla vaccinazione. L’iscrizione allo studio di controllo del caso è iniziata 2 mesi dopo la vaccinazione. Il risultato principale è stato quindi l’efficacia di una e due dosi di vaccino per il colera per via orale rispetto a zero dosi da 2 mesi a 48 mesi dopo la vaccinazione. Abbiamo utilizzato variabili indicatori per modellare il numero di dosi di vaccino ricevute (una o due) rispetto al gruppo di riferimento di nessuna vaccinazione. Abbiamo esaminato se l’efficacia del vaccino è cambiata nel tempo creando termini di interazione per il numero di dosi ricevute e il tempo tra la campagna di vaccinazione e la diagnosi di colera. Il tempo tra la campagna di vaccinazione e la diagnosi di colera è stato calcolato come il tempo che intercorre tra la data della vaccinazione e la data di ammissione al centro di cura del colera o al colloquio (se mancava la data di ammissione). La data della vaccinazione di ogni partecipante è stata stabilita sulla base delle date intermedie della campagna di vaccinazione per ogni reparto (17 maggio 2012 per il Dipartimento di Artibonite e 6 settembre 2014 per il Dipartimento Centrale) e del luogo di residenza di ogni partecipante. Abbiamo modellato il tempo trascorso dalla vaccinazione (fino a 48 mesi dopo la vaccinazione) come variabile lineare e come spline cubica naturale con tre nodi equidistanti. Abbiamo confrontato i modelli con la forma lineare con quelli con una spline utilizzando il criterio di informazione Akaike. Abbiamo usato il test Q di Cochran per verificare l’omogeneità delle stime di efficacia del vaccino nei due siti di studio.
Abbiamo calcolato i rapporti di probabilità, gli IC al 95% e i valori di p usando la regressione logistica condizionale, che rappresentava i fattori di corrispondenza. Nelle analisi multivariabili, abbiamo inoltre corretto per i seguenti fattori di rischio di colera, identificati a priori, che sono stati trovati associati al colera (a p<0-20) nelle analisi univariabili: sesso femminile, l’intervistato ha partecipato, ha frequentato la scuola, la toilette principale è la latrina, riferisce di sapere come trattare l’acqua, riferisce di trattare sempre l’acqua, la casa compra l’acqua, la fonte d’acqua (cioè, dalla pompa, l’acqua trattata, l’acqua in bottiglia, l’acqua piovana e il pozzo), il metodo di trattamento dell’acqua (cioè, compresse, bollitura e cloro), la stessa fonte d’acqua usata per lavare e bere, si guadagna da vivere con l’agricoltura, si guadagna da vivere con la pesca, ha consumato cibo o bevande fuori casa nell’ultima settimana, ha mangiato frutta o verdura cruda nell’ultima settimana, conoscenza su come evitare il colera (cioè, riscaldare il cibo, non andare in bagno vicino alla fonte d’acqua, e un altro modo non incluso nella lista), abitudini di lavaggio delle mani (cioè, prima e dopo aver toccato un bambino, e in un altro momento non incluso nella lista), membro della famiglia ha avuto diarrea negli ultimi 7 giorni, copertura del vaso d’acqua (cioè, scoperto, coperto, e parzialmente coperto), vaso d’acqua ha un rubinetto, la dimensione di apertura sul vaso d’acqua (stretto contro largo), e più di 29 min (75 ° percentile) a piedi da casa al fiume. Questo approccio è stato utilizzato per restringere una lista di fattori di rischio di colera biologicamente plausibili, pur consentendo il controllo dei più probabili fattori di rischio di colera in questo set di dati. Poiché abbiamo trovato un’ampia corrispondenza per categoria d’età, abbiamo incluso l’età come variabile continua nei modelli multivariabili per adeguarci alla confusione residua per età all’interno di una categoria d’età.
La completezza dei dati è stata elevata per i dati covariata. Pertanto, le analisi primarie sono state limitate ai casi e ai controlli che avevano informazioni complete su tutte le covariate. Abbiamo fatto analisi di sensibilità in cui abbiamo modificato le date presunte di vaccinazione (cioè, abbiamo usato le date di inizio e fine della campagna di vaccinazione, piuttosto che il punto medio); abbiamo imputato i dati covariariari mancanti; e abbiamo escluso i bambini di età inferiore ai 5 anni in quanto l’efficacia del vaccino è nota per essere inferiore in questo gruppo. L’imputazione multipla (n=25) è stata effettuata utilizzando dati covariariata e di esito e i metodi Markov Chain Monte Carlo (SAS MI Procedure), e le stime degli effetti sono state messe in comune tra i vari set di dati. A causa dei piccoli numeri, non abbiamo effettuato analisi corrette o esaminato l’efficacia nel tempo nel sottogruppo dei bambini di età inferiore ai 5 anni. Abbiamo calcolato l’efficacia del vaccino utilizzando la formula (rischio 1-relativo).10
Analisi degli indicatori di bias
Gli studi caso-controllo degli indicatori di bias sono spesso condotti in parallelo con gli studi caso-controllo dell’efficacia del vaccino per valutare la probabilità di bias in quest’ultimo.4, 7, 11, 12, 13 In precedenza abbiamo riportato i risultati dello studio degli indicatori di bias che abbiamo fatto in tandem con questo studio caso-controllo. Alcune analisi di sensibilità hanno rivelato una stima dell’indicatore di bias che era significativamente diversa da zero; tuttavia, abbiamo ricavato stime simili dell’efficacia del vaccino utilizzando sia controlli basati sulla comunità che su test negativi, il che ci ha portato a concludere che il bias, se presente, era minimo.14
Considerazioni etiche
Il consenso informato scritto è stato ottenuto per tutti i partecipanti, o da un rappresentante della sanità se il partecipante non era in grado di dare il proprio consenso. Il consenso di un genitore o di un tutore è stato ottenuto per i bambini di età inferiore ai 18 anni, e il consenso è stato richiesto ai bambini di età compresa tra i 7 e i 17 anni. Il protocollo di studio è stato approvato dal Comitato per la ricerca umana dei partner e dal Comitato nazionale di bioetica di Haiti.
Ruolo della fonte di finanziamentoI finanziatori dello studio non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta, analisi e interpretazione dei dati, nella stesura del rapporto o nella decisione di presentare il documento per la pubblicazione.
Risultati
Per l’analisi sono state incluse 178 persone assegnate al gruppo di casi e 706 persone assegnate al gruppo di controllo(figura 1). 21 dei 177 casi (12%) si sono verificati in bambini di età inferiore ai 5 anni. Abbiamo escluso quattro persone assegnate al gruppo dei casi di colera che si sono verificati oltre 48 mesi di follow-up e quattro partecipanti (due casi di colera e due controlli) per i quali non avevamo informazioni sul numero di dosi di vaccino ricevute(figura 1). La tabella 1 mostra la frequenza delle vaccinazioni nei casi di colera e nei controlli, stratificata per tempo di caso dalla vaccinazione alla diagnosi del colera. 32 casi (18%) si sono verificati più di 2 anni dopo la vaccinazione, la maggior parte di questi (n=23, 72%) si è verificata nel quarto anno, e solo nove (28%) casi si sono verificati nel terzo anno dopo la vaccinazione. I dati rilevanti per le caratteristiche sociodemografiche e i fattori di rischio di colera per questa coorte sono stati precedentemente riportati e non vengono quindi ripetuti in questa sede.14Figura 1Percorsodell’iscrizione dei casi di colera e dei controlli comunitariCTC=Centrodi trattamento del colera. HSN=Ospedale San Nicola. RHEMA=J Peter Gruits Medical Center.Tabella 1Iscrizione dei casi e controlli, per tempo dalla campagna di vaccinazioneOverallArtiboniteDepartmentCentralDepartmentCases(n=178)Controlli (n=706)Casi (n=74)Controlli (n=291)Casi (n=104)Controlli (n=415)0-12 mesi dalla campagna di vaccinazione5421511444343171Nessuno28 (52%)70 (33%)3 (27%)2 (5%)25 (58%)68 (40%)Una dose4 (7%)23 (11%)1 (9%)8 (18%)3 (7%)15 (9%)Due dosi22 (41%)122 (57%)7 (64%)34 (77%)15 (35%)88 (51%)12-24 mesi dalla campagna di vaccinazione923673413558232Nessuno44 (48%)114 (31%)10 (29%)18 (13%)34 (59%)96 (41%)Una dose15 (16%)51 (14%)2 (6%)11 (8%)13 (22%)40 (17%)Due dosi33 (36%)202 (55%)22 (65%)106 (79%)11 (19%)96 (41%)24-36 mesi dalla campagna di vaccinazione936624312Nessuno1 (11%)17 (47%)1 (17%)8 (33%)0 (0%)9 (75%)Una dose1 (11%)0 (0%)0 (0%)0 (0%)0 (0%)0 (0%)1 (33%)0 (0%)0 (0%)Due dosi7 (78%)19 (53%)5 (83%)16 (67%)2 (67%)3 (25%)36-48 mesi dalla campagna di vaccinazione2388238800Nessuno12 (52%)13 (15%)12 (52%)13 (15%)….Una dose5 (22%)2 (2%)5 (22%)2 (2%)….Due dosi6 (26%)73 (83%)6 (26%)73 (8%3)…..
Le stime dell’efficacia del vaccino a due dosi nel periodo di follow-up di 4 anni sono state del 70% (95% CI 54-80) per i dati non corretti e del 76% (59-86) per i dati corretti (p<0-0001 per entrambi; tabella 2). Utilizzando il criterio dell’informazione Akaike, abbiamo concluso che né il modello con una spline cubica naturale (stime dell’efficacia vaccinale prevista per mese indicate in appendice), né il modello con un’interazione lineare si adatta meglio ai dati rispetto al modello che presuppone un’efficacia vaccinale costante durante i 4 anni di follow-up (valore p per l’interazione quando il tempo trascorso dalla vaccinazione è stato modellato come variabile lineare=0-57). I criteri di informazione Akaike per i diversi modelli sono confrontati nell’appendice. Abbiamo concluso che l’efficacia a due dosi non variava in modo significativo durante il periodo di follow-up di 4 anni e che qualsiasi variabilità osservata era dovuta al caso. Il termine di interazione tra la vaccinazione a due dosi e il tempo trascorso dalla vaccinazione è stato quindi escluso dal modello finale.Tabella 2Analisi dell’efficacia del vaccino a due dosi con il vaccino bivalente per via orale per il colera a cellule intere bivalenti in 4 anni di follow-upValore non aggiustatoAdjustedAdjustedVE (95% CI)p valoreVE (95% CI)p valoreCompletecase analysesAllages70* (54-80)<0-000176† (59-86)<0-0001≥5 anni di età73* (58-83)<0-000177† (58-88)<0-000101Analisi multiple imputateTutte le età Non applicabile..76* (59-86)<0-0001≥5 anni di etàNon applicabile..76* (58-87)<0-0001VE=Efficacia del vaccino.*Le analisi non corrette e quelle con imputazione multipla comprendono 178 casi e 706 controlli quando tutte le età sono state incluse, e 157 casi e 623 controlli quando i bambini di età inferiore ai 5 anni sono stati esclusi.†L’analisi completa corretta dei casi di tutte le età comprende 166 casi e 696 controlli. L’analisi corretta dei casi completi, esclusi i bambini di età inferiore ai 5 anni, comprende 145 casi e 616 controlli.
25 casi (14%) e 76 controlli (11%) hanno ricevuto una singola dose di vaccino(tabella 1). Le stime corrette dell’efficacia della singola dose sono diminuite log-linearmente ad ogni mese dalla vaccinazione (pinterazione=0-0004; stime del modello in appendice), e il tempo di modellizzazione dalla vaccinazione con una spline cubica naturale non ha migliorato l’adattamento del modello rispetto alla forma lineare (appendice). Abbiamo osservato un’elevata efficacia del vaccino che varia dal 96% al 79% durante il primo anno dopo la vaccinazione, che alla fine è scesa a 0 dopo il mese 20, anche se il limite di confidenza più basso del 95% è sceso sotto 0 dopo il mese 16(figura 2).Figura 2Stime corrette dell’efficacia vaccinale di una singola dose di vaccini per il colera orale a cellule intere uccise, bivalenti e bivalenti, nell’arco di 24 mesi.
La distribuzione dei casi secondo il tempo trascorso dalla vaccinazione è riportata nellatabella 3. Solo due (10%) di questi 21 casi in bambini di età inferiore ai 5 anni hanno ricevuto una singola dose, mentre 13 (62%) hanno ricevuto due dosi. L’efficacia del vaccino monodose non corretta è stata del 10% in questo gruppo (95% IC -468 a 86), e l’efficacia del vaccino a due dosi è stata del 32% (95% IC -117 a 79). Quando abbiamo limitato le analisi ai primi 2 anni di follow-up, l’efficacia di una dose non corretta è stata del 67% (95% CI -250 a 97) e l’efficacia di due dosi non corrette è stata del 48% (95% CI -75 a 85). Nessuna di queste stime è stata significativa. Quando abbiamo esaminato l’efficacia del vaccino nei bambini di età inferiore ai 5 anni al momento della vaccinazione (rispetto al periodo del colera), non ci sono stati cambiamenti degni di nota (appendice).Tabella 3Casi in bambini di età inferiore ai 5 anni, per tempo dalla vaccinazione(%)0-12 mesi dalla vaccinazione (n=53)Nessuno0(0)Una dose0 (0)Due dosi4 (100)Totale4 (8)*12-24mesi dalla vaccinazione (n=93)Nessuno6 (40)Una dose1 (7)Due dosi8 (53)Totale15 (16)*24-36 mesi dalla vaccinazione (n=9)Nessuno0 (0)Una dose1 (50)Due dosi1 (50)Totale2 (22)*36-48mesi dalla vaccinazione (n=22)Totale0 (0)*Percentuale di tutti i casi verificatisi in bambini di età inferiore ai 5 anni in quel periodo di tempo.
I risultati sono stati simili sia per le analisi a una dose che per quelle a due dosi quando abbiamo escluso i bambini di età inferiore ai 5 anni(tabella 2, appendice), quando abbiamo fatto analisi multivariabili su set di dati imputati moltiplicati per tener conto della piccola quantità di dati covariarianti mancanti(tabella 2, appendice) e quando abbiamo variato le date presunte di vaccinazione (appendice). Non abbiamo trovato alcuna prova di eterogeneità di effetto tra i due siti di studio (appendice) e le stime del modello erano simili quando abbiamo limitato i dati ai primi due anni di follow-up (appendice). L’efficacia media di due dosi è stata coerente indipendentemente dal fatto che la vaccinazione sia stata valutata tramite autodenuncia, verifica o una combinazione dei due metodi (appendice). Al contrario, l’efficacia a dose singola era simile alle analisi primarie quando abbiamo accettato l’autodenuncia per gli individui che non potevano produrre una scheda di vaccinazione, ma non era significativamente diversa da zero quando abbiamo considerato un partecipante vaccinato solo se poteva essere verificato tramite scheda o registro (appendice).
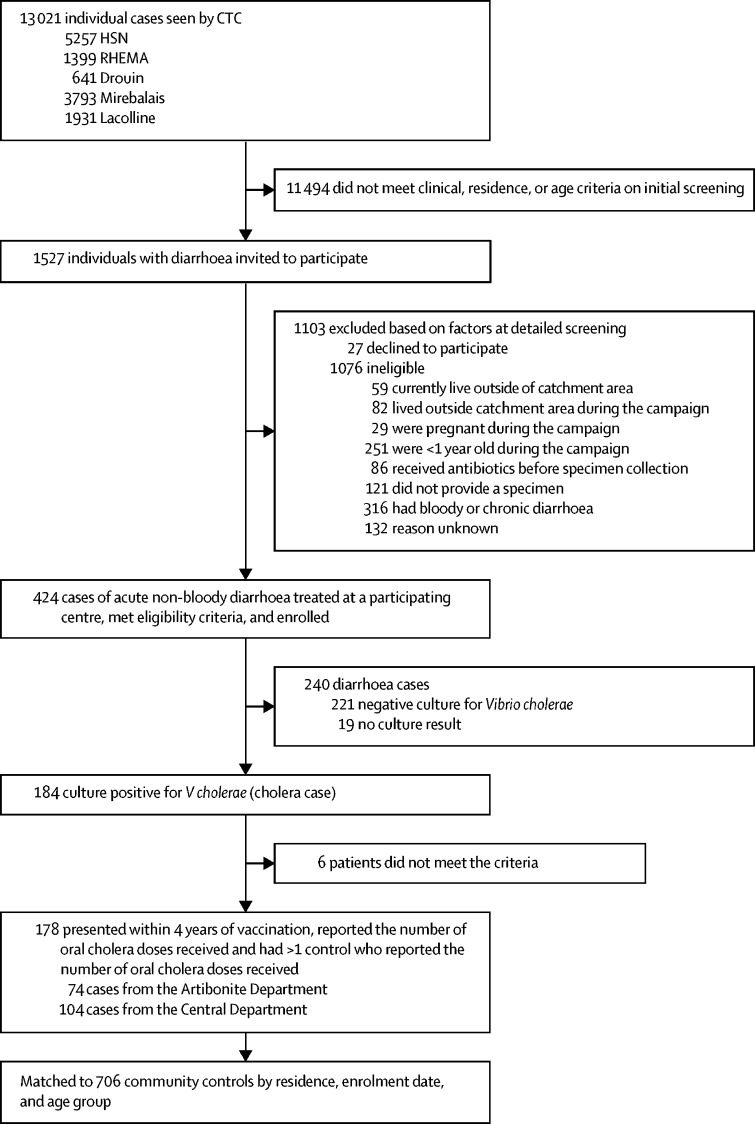
Figura 1.Panoramica dell’iscrizione dei casi di colera e dei controlli della comunitàCTC=Centro di trattamento del colera. HSN=Ospedale San Nicola. RHEMA=Centro medico Peter Gruits.
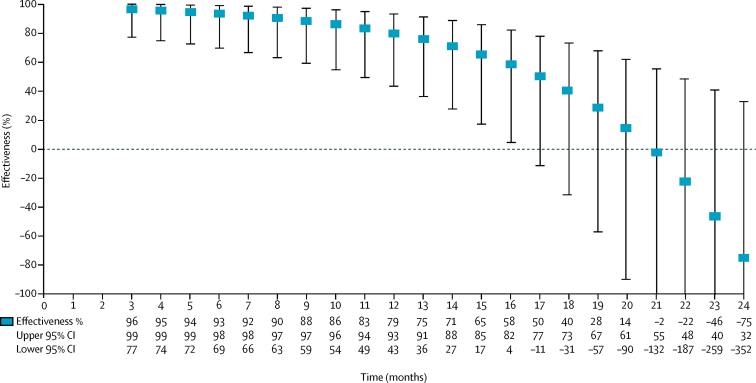
Figura 2.Stime corrette dell’efficacia vaccinale di una singola dose di vaccini per il colera per via orale a cellule intere uccise, bivalenti e bivalenti, nell’arco di 24 mesi.
Discussione
Abbiamo trovato una protezione coerente e duratura del 76% con due dosi di vaccini per il colera per via orale, bivalenti, bivalenti, a cellule intere fino a 4 anni dopo la vaccinazione. Questi dati provenienti da Haiti sono i primi, a nostra conoscenza, provenienti da fuori dell’Asia a fornire la prova dell’efficacia a lungo termine di due dosi di vaccini per il colera per via orale, bivalenti, bivalenti, a cellule intere, uccisi e a sostenere il ruolo della vaccinazione come parte degli sforzi di controllo del colera. I nostri risultati sono coerenti con la protezione a lungo termine con due dosi di vaccino a lungo termine dei vaccini per il colera orale bivalente, bivalente e a cellule intere uccisi, riportata in studi condotti in India (65% e 69%)15, 16 e Vietnam (50%). Sebbene la stima dell’efficacia a lungo termine sia stata inferiore nello studio del Vietnam, quasi un terzo dei casi di colera non ha avuto una conferma colturale; se alcuni di questi casi clinicamente diagnosticati non avessero avuto il colera, ci si sarebbe aspettato che ciò avrebbe attenuato le stime dell’efficacia del vaccino. L’efficacia del vaccino a due dosi che abbiamo osservato nei bambini di età inferiore ai 5 anni, sebbene non significativa, corrisponde alle stime medie riportate in una recente meta-analisi1 (30% [95% CI 15-42]) ed evidenzia la necessità di strategie alternative per ridurre l’incidenza del colera in questo gruppo vulnerabile.13
La vaccinazione contro il colera con il regime standard a due dosi può essere impegnativa, soprattutto in situazioni di crisi, conflitti o emergenze umanitarie. Per questo motivo, l’uso di una singola dose è stato proposto come misura temporanea per ridurre il rischio di colera a breve termine, portando a un interesse a comprendere l’effetto protettivo di una singola dose di vaccini per il colera per via orale.17, 18 Uno studio di modellazione ha suggerito che l’approccio monodose potrebbe evitare un maggior numero di casi di colera generando una maggiore immunità della mandria rispetto a quanto si potrebbe ottenere vaccinando meno persone con due dosi; tuttavia, questi risultati si sono basati su scarsi dati di efficacia a breve termine della monodose.19 Le nostre stime sull’efficacia della monodose sono apparse più alte o più estese, o entrambe, rispetto a quelle riportate in precedenza; tuttavia, gli intervalli di confidenza intorno alle nostre stime erano ampi a causa di un numero relativamente piccolo di individui che hanno ricevuto una singola dose (cioè, abbiamo mirato a dare a tutti nella campagna due dosi). L’unica prova di efficacia in dose singola ha riportato una protezione del 40% (95% CI 11-60) nell’arco di 6 mesi,20 mentre un’analisi caso per caso ha riportato un’efficacia dell’87% (70-100) entro 2 mesi.21 Abbiamo stimato l’efficacia al 96% (95% CI 77-99) a 3 mesi e al 93% (69-98) a 6 mesi. Analogamente, anche se la media di due studi che hanno riportato un’efficacia cumulativa di una dose è stata del 69% (95% CI 35-85) nel corso di un anno,1 abbiamo trovato un’efficacia del 79% (43-93) alla fine di quell’anno. È importante sottolineare che la nostra analisi ci ha permesso di stimare l’efficacia in un determinato momento, rispetto a fornire stime medie su un intervallo di tempo durante il quale l’efficacia potrebbe essere in calo; pertanto, le nostre stime non sono direttamente confrontabili con le stime medie. Il vantaggio di questo approccio analitico è che ci ha permesso di esaminare i cambiamenti di efficacia nel tempo. Per la vaccinazione con una dose singola, uccisa, bivalente, bivalente, di vaccini per il colera per via orale a cellule intere, abbiamo trovato che l’efficacia sembrava diminuire completamente entro 2 anni; tuttavia, gli intervalli di confidenza includevano un’efficacia dello 0% dopo 16 mesi. Studi futuri con un numero maggiore di destinatari di dosi singole consentiranno stime più precise della protezione a breve e a lungo termine, ed è necessario un ulteriore lavoro per comprendere i contesti e le strategie di attuazione in cui la vaccinazione monodose è più appropriata ed efficace.
I limiti di questo studio includono il numero relativamente piccolo di persone vaccinate con una singola dose e il numero relativamente piccolo di casi di colera che si verificano a 3 anni o più dalla vaccinazione. Questi piccoli numeri hanno portato a intervalli di confidenza più ampi intorno alle stime di efficacia della singola dose e potrebbero aver nascosto piccoli cali di efficacia in due dosi nel tempo. Inoltre, ci mancava un registro di vaccinazione a norma d’oro per la valutazione delle vaccinazioni. L’autodichiarazione del numero di dosi di vaccino ricevute è imperfetta in quanto potrebbe essere richiamata in modo differenziato dai casi e dai controlli. Anche il ricorso alle schede di vaccinazione per la valutazione delle vaccinazioni è problematico perché gli individui potrebbero smarrire le proprie schede. Questo fattore è stato un evento comune nel presente studio: l’assorbimento documentato del vaccino nel Dipartimento di Artibonite era tra il 79% e il 92% a Bocozel e il 63% a Grand Saline; tuttavia, solo il 44% dei controlli in questa regione poteva produrre una scheda di vaccinazione.2 Ciò potrebbe essere dovuto alle condizioni ambientali in cui è difficile conservare le tessere cartacee in modo sicuro, o a causa della mancanza di esperienza di vaccinazione per gli adulti nella regione, o entrambe le cose. Questa limitazione non sembra influire sulle stime a lungo termine dei vaccini per il colera a due dosi per via orale, che sono robusti per il metodo di valutazione del vaccino. Tuttavia, quando abbiamo calcolato l’efficacia di una sola dose usando una vaccinazione verificata, ci è rimasto solo il 20% del campione iniziale di partecipanti che hanno riferito di aver ricevuto una dose, e l’associazione protettiva di una singola dose non era più evidente. Anche se quest’ultima analisi è molto incline al pregiudizio, le nostre stime della durata della protezione associata a una singola dose devono comunque essere interpretate con cautela.
Un terzo limite è che abbiamo approssimato la data di vaccinazione sulla base della zona di residenza al momento del reclutamento per lo studio e la data intermedia della campagna di vaccinazione in quel bacino di utenza. Dato che le date delle campagne per ogni bacino di utenza non si sono estese per più di 65 giorni e che i risultati sono rimasti invariati nelle analisi di sensibilità utilizzando le date di inizio e fine di ogni campagna, non crediamo che questa limitazione abbia influenzato i risultati del nostro studio. I test PCR per il colera non erano disponibili ad Haiti al momento del nostro studio e ci siamo basati sulla coltura delle feci. Tuttavia, non ci aspettiamo che l’assenza di PCR per la diagnosi del colera abbia influenzato i nostri risultati perché la conseguenza di una diagnostica meno sensibile sarebbe stata l’errata classificazione e la conseguente esclusione dei casi di colera con un risultato di coltura falso negativo e questo è improbabile che sia associato alla vaccinazione contro il colera.
In conclusione, la vaccinazione con due dosi di vaccini per il colera per via orale, bivalenti e bivalenti, ha fornito una protezione coerente contro il colera frequentato dal punto di vista medico per oltre 4 anni ad Haiti, dove il colera è recentemente diventato endemico. Inoltre, la vaccinazione con una sola dose ha offerto una protezione a breve termine contro il colera medicalmente frequentato. I nostri risultati sono generalizzabili ad altri contesti con epidemie e colera appena endemico. Questi risultati si aggiungono alle prove a sostegno dell’uso di vaccini per il colera per via orale a cellule intere uccise, bivalenti e bivalenti, come parte di piani di controllo globale del colera e aggiungono prove al caso di investimento per il continuo sostegno di una scorta globale di vaccini per il colera per via orale a cellule intere uccise, bivalenti e bivalenti.
References
- Bi Q, Ferreras E, Pezzoli L. Protection against cholera from killed whole-cell oral cholera vaccines: a systematic review and meta-analysis. Lancet Infect Dis. 2017; 17:1080-1088. PubMed
- Ivers LC, Teng JE, Lascher J. Use of oral cholera vaccine in Haiti: a rural demonstration project. Am J Trop Med Hyg. 2013; 89:617-624. PubMed
- Juste MAJ, Francois J, Peck M. Cholera vaccination in urban Haiti. Am J Trop Med Hyg. 2013; 89:671-681. PubMed
- Ivers LC, Hilaire IJ, Teng JE. Effectiveness of reactive oral cholera vaccination in rural Haiti: a case-control study and bias-indicator analysis. Lancet Glob Health. 2015; 3:e162-e168. PubMed
- Edmond YM, Randolph SM, Richard GL. The lakou system: a cultural, ecological analysis of mothering in rural Haiti. J Pan Afr Stud. 2007; 2:19-32.
- WHO. World Health Organization: Geneva; 2003. Publisher Full Text
- Luquero FJ, Grout L, Ciglenecki I. Use of Vibrio cholerae vaccine in an outbreak in Guinea. N Engl J Med. 2014; 370:2111-2120. PubMed
- Anh DD, Lopez AL, Thiem VD. Use of oral cholera vaccines in an outbreak in Vietnam: a case control study. PLoS Negl Trop Dis. 2011; 5:e1006. PubMed
- Ferreras E, Chizema-Kawesha E, Blake A. Single-dose cholera vaccine in response to an outbreak in Zambia. N Engl J Med. 2018; 378:577-579. PubMed
- Halloran ME, Struchiner CJ, Longini IM. Study designs for evaluating different efficacy and effectiveness aspects of vaccines. Am J Epidemiol. 1997; 146:789-803. PubMed
- Shapiro ED. Case-control studies of the effectiveness of vaccines: validity and assessment of potential bias. Pediatr Infect Dis J. 2004; 23:127-131. PubMed
- Lucas MES, Deen JL, von Seidlein L. Effectiveness of mass oral cholera vaccination in Beira, Mozambique. N Engl J Med. 2005; 352:757-767. PubMed
- Thiem VD, Deen JL, von Seidlein L. Long-term effectiveness against cholera of oral killed whole-cell vaccine produced in Vietnam. Vaccine. 2006; 24:4297-4303. PubMed
- Franke MF, Jerome JG, Matias WR. Comparison of two control groups for estimation of oral cholera vaccine effectiveness using a case-control study design. Vaccine. 2017; 35:5819-5827. PubMed
- Wierzba TF, Kar SK, Mogasale VV. Effectiveness of an oral cholera vaccine campaign to prevent clinically-significant cholera in Odisha State, India. Vaccine. 2015; 33:2463-2469. PubMed
- Bhattacharya SK, Sur D, Ali M. 5 year efficacy of a bivalent killed whole-cell oral cholera vaccine in Kolkata, India: a cluster-randomised, double-blind, placebo-controlled trial. Lancet Infect Dis. 2013; 13:1050-1056. PubMed
- Parker LA, Rumunu J, Jamet C. Neighborhood-targeted and case-triggered use of a single dose of oral cholera vaccine in an urban setting: feasibility and vaccine coverage. PLoS Negl Trop Dis. 2017; 11:e0005652. PubMed
- Parker LA, Rumunu J, Jamet C. Adapting to the global shortage of cholera vaccines: targeted single dose cholera vaccine in response to an outbreak in South Sudan. Lancet Infect Dis. 2017; 17:e123-e127. PubMed
- Azman AS, Luquero FJ, Ciglenecki I, Grais RF, Sack DA, Lessler J. The impact of a one-dose versus two-dose oral cholera vaccine regimen in outbreak settings: a modeling study. PLoS Med. 2015; 12:e1001867. PubMed
- Qadri F, Wierzba TF, Ali M. Efficacy of a single-dose, inactivated oral cholera vaccine in Bangladesh. N Engl J Med. 2016; 374:1723-1732. PubMed
- Azman AS, Parker LA, Rumunu J. Effectiveness of one dose of oral cholera vaccine in response to an outbreak: a case-cohort study. Lancet Glob Health. 2016; 4:e856-e863. PubMed
Fonte
Franke MF, Ternier R, Jerome JG, Matias WR, Harris JB, et al. (2018) Long-term effectiveness of one and two doses of a killed, bivalent, whole-cell oral cholera vaccine in Haiti: an extended case-control study. The Lancet. Global Health 6(9): . https://doi.org/10.1016/S2214-109X(18)30284-5





