Abstract
Introduzione
Nelle epidemie del virus Ebola (EVD), gli operatori sanitari (HCW) sono colpiti in modo sproporzionato. Nell’epidemia di Ebola 2014-2016 in Africa occidentale, la percentuale di operatori sanitari infettati è stata dell’1,45% in Guinea (contro lo 0,02% della popolazione generale), dell’8,07% in Liberia (contro lo 0,11%) e del 6,85% in Sierra Leone (contro lo 0,06%) [1]. L’epidemia si è verificata in paesi che hanno alcune delle più basse proporzioni di HCW pro capite al mondo[2]. Questo fatto, unito alla rapida diffusione dell’epidemia, all’alto tasso di mortalità dei casi [3-7] e alle gravi preoccupazioni sollevate dalla comunità internazionale, ha spinto l’Organizzazione Mondiale della Sanità (OMS) a dichiarare l’epidemia come “emergenza sanitaria pubblica di interesse internazionale” e ha portato ad un’escalation del dispiegamento di squadre mediche internazionali di emergenza (EMT) in Africa occidentale (principalmente in Guinea, Liberia e Sierra Leone) a partire dalla fine del 2014 [8]. Questi EMT includevano operatori di acqua, servizi igienici e igienici (WASH) e di laboratorio, epidemiologi, ingegneri, tecnici, logistici e personale operativo, oltre a medici. Ad oggi, l’OMS riferisce che 40 organizzazioni di 19 Paesi hanno inviato EMT in Africa occidentale in risposta all’epidemia di Ebola del 2014-2016 [9]; oltre 3.000 persone sono state inviate in Africa occidentale dai soli Centri statunitensi per il controllo e la prevenzione delle malattie [10]. Nonostante questo dispiegamento su larga scala, sono stati diagnosticati pochi casi di EVD tra i lavoratori EMT: 24 sono stati trattati in Europa o negli Stati Uniti[8].
A Kikwit, Repubblica Democratica del Congo, in un’epidemia di Ebola nel 1995, 8/402 (2%) operatori sanitari nella zona dell’epidemia avevano una sierologia positiva in assenza di EVD diagnosticata. Tra i contatti domestici asintomatici dei casi, la prevalenza di sierologia positiva è stata compresa tra l’1% e il 46% in diversi studi che hanno utilizzato diversi test[11-16]. Più recentemente, la sierologia positiva per l’infezione da virus Ebola (EBOV) è stata trovata nel 12,0% (11/92) dei contatti domestici con sintomi in Sierra Leone, e nel 2,6% (10/389) di quelli senza sintomi, utilizzando un test IgG altamente sensibile e specifico[17]. Una recente meta-analisi ha stimato che il 27% di tutte le infezioni sono asintomatiche[18], con risultati simili da un “punto caldo” in Sierra Leone [19]. È quindi plausibile che le infezioni asintomatiche o pauci-sintomatiche si siano verificate nei malati di cancro al seno ma siano sfuggite alla diagnosi.
Descriviamo la prevalenza di anticorpi contro l’EBOV nei campioni di fluido orale (OFS) di individui che sono tornati nel Regno Unito o in Irlanda dopo aver risposto all’epidemia di EVD dell’Africa occidentale, così come le potenziali esposizioni all’EBOV e l’esperienza di malattia in Africa occidentale o entro 1 mo dal ritorno.
Metodi
Reclutamento
Gli inviti a partecipare sono stati inviati a persone conosciute dagli autori e attraverso organizzazioni che sostengono lo sviluppo di EMT che coinvolgono personale con sede nel Regno Unito, tra cui organizzazioni non governative (ONG), istituzioni affiliate al governo del Regno Unito e la London School of Hygiene & Tropical Medicine (LSHTM). Una richiesta è stata inserita sia nell’e-mail che alla fine del questionario online per inoltrare l’e-mail ad altre persone idonee – “Snowball sampling” [20]. L’e-mail descriveva lo scopo dello studio e le modalità di raccolta dei dati e includeva un link a un foglio informativo online, un modulo di consenso e un questionario.
Lo studio è stato anche pubblicizzato tramite manifesti e cartoline in occasione di incontri selezionati a cui gli aventi diritto potevano partecipare (con il permesso degli organizzatori dell’incontro). Le informazioni sullo studio e un link al sondaggio sono stati distribuiti anche attraverso le piattaforme dei social media (Facebook e Twitter).
Sono stati reclutati presso l’LSHTM e tramite contatti personali anche gli individui di controllo del Regno Unito che non sono stati esposti a filovirus.
Per questo studio è stata utilizzata una procedura di consenso online che consisteva in un foglio informativo e in un modulo di consenso inclusi all’inizio del sondaggio online (cfr. S2 Text). Il sondaggio è stato accessibile solo dopo il consenso ed è stato aperto il 16 dicembre 2015 e chiuso il 16 giugno 2016. L’approvazione etica è stata ottenuta dal Comitato etico della ricerca LSHTM (approvazione #9475). Tutti i dati sono stati memorizzati sul server di dati sicuri di LSHTM e sono stati sottoposti a registrazione degli accessi ai file.
Criteri di ammissibilità
I partecipanti ammissibili erano di età ≥18 anni, avevano viaggiato in Africa occidentale durante l’epidemia di EVD del 2014-2016 come parte della risposta, non erano mai risultati positivi all’EBOV mediante PCR e non avevano mai ricevuto un vaccino contro il filovirus.
I controlli nel Regno Unito erano inammissibili se avevano un’età inferiore ai 18 anni, avevano assunto farmaci immunosoppressori nell’ultimo anno, avevano trascorso un periodo prolungato (>1 mo) in qualsiasi Paese con trasmissione di EBOV, avevano mai avuto contatti con pazienti esposti o infettati da filovirus, avevano lavorato con filovirus in laboratorio o avevano partecipato a uno studio sul vaccino contro il filovirus.
Questionario
Il questionario chiedeva informazioni demografiche di base e informazioni sull’impiego dei rimpatriati in Africa occidentale e su eventuali rischi professionali o potenziali esposizioni (vedi testo S2 ). Ai rimpatriati è stato chiesto se avevano avuto una malattia febbrile durante il loro dispiegamento o entro 1 mo dal ritorno. Per coloro che utilizzano dispositivi di protezione individuale (DPI), sono stati chiesti dettagli sui metodi utilizzati per il doffing. È stata utilizzata un’ampia definizione di DPI, che comprendeva una tuta protettiva (con o senza cappuccio) con guanti (singole o multiple paia) e con protezione per gli occhi, con o senza protezione respiratoria.
Kit di raccolta dei fluidi per via orale
I dispositivi per la raccolta dei fluidi orali (Oracol S10, Malvern Medical Developments) sono stati inviati tramite il servizio postale del Regno Unito a persone consenzienti. I ritirati hanno raccolto l’OFS utilizzando una spugna massaggiata lungo il bordo della gengiva per 90 s. I ritirati potevano seguire un opuscolo illustrativo o seguire un link a una dimostrazione video(http://tinyurl.com/lshtmsample).
Al fine di ridurre al minimo i potenziali ritardi, è stata inclusa la richiesta di inviare i campioni entro 24 ore dalla raccolta. I campioni sono stati conservati a -80°C entro 24 ore dal ricevimento presso LSHTM. La raccolta è continuata fino a quando 300 rimpatriati hanno acconsentito a partecipare e il reclutamento stava rallentando. Tutte le analisi sono state effettuate dopo la fine della raccolta dei dati.
Test a campione
Gli OFS sono stati testati per la glicoproteina IgG EBOV utilizzando un test di cattura IgG. È stato dimostrato che i livelli di glicoproteina IgG della glicoproteina EBOV per via orale sono strettamente correlati con il livello di IgG plasmatiche(R2= 0,78)[14]. In uno studio sul campo in Sierra Leone, il saggio ha avuto una sensibilità del 96% (93/97 pazienti recuperati con PCR-confermata EVD sono risultati positivi) e una specificità del 100% (339/339 controlli sono risultati negativi)[17]. I test sono stati effettuati in due lotti il 12 maggio 2016 e il 22 giugno 2016 e i campioni ricevuti dopo il 22 giugno 2016 sono stati distrutti. I campioni sono stati scongelati ed estratti con 1 ml di terreno di trasporto. Cento microlitri di estratto sono stati incubati in singoli pozzetti rivestiti con IgG antiumane, insieme a due controlli positivi e due negativi, prima di essere lavati. E’ stato aggiunto un coniugato di EBOV Zaire ricombinante (ceppo Mayinga) antigene glicoproteico (rGPδTM, cat. 0501-016, IBT Bioservices) accoppiato con antigene perossidasi di rafano, ulteriormente incubato e poi lavato. Il coniugato legato è stato rilevato utilizzando il substrato TMB, e le misurazioni della densità ottica (OD) sono state effettuate su un lettore di micropiastre ELx808 Ultra (Biotek Instruments) e analizzate utilizzando il software Kineticalc per Windows (BioTek). Il taglio per ogni piastra è stato preso come media dei controlli negativi in quella piastra più 0,1 OD, derivato da un metodo di curva standard applicato ai campioni riportati altrove[21,22]. Affinché una piastra sia valida, l’OD del controllo positivo doveva essere >1,0, e quello del controllo negativo <0,1. Le OD normalizzate (NOD) sono state calcolate utilizzando il rapporto tra l’OD del test e il taglio di prova definito. Un NOD > 1 è stato considerato reattivo.
Quelli con OFS reattivi sono stati contattati e sono stati raccolti 5 ml di sangue. I campioni di plasma sono stati testati presso il Public Health England (PHE) per l’EBOV RNA utilizzando un pan-Ebola PCR in tempo reale[23], e per gli anticorpi EBOV utilizzando il test di cattura IgG e, inoltre, un ELISA competitivo che comprendeva un anticorpo monoclonale 4G7 murino marcato con un anticorpo monoclonale 4G7 e un doppio test di bridging dell’antigene (DABA), che utilizzano entrambi la stessa glicoproteina ricombinante del test di cattura IgG. Infine, i campioni di plasma sono stati inviati al Jenner Institute di Oxford, dove sono stati testati utilizzando un ELISA che rileva IgG alla glicoproteina del ceppo EBOV Mayinga (aminoacidi 1-649 della proteina GenBank AHX24649.1), un test interno utilizzato per misurare la risposta del vaccino Ebola [24]. A causa di un limitato apporto di antigene glicoproteico ricombinante e di anticorpo monoclonale al PHE, non sono stati analizzati campioni negativi utilizzando questi test di seconda linea. Il controllo positivo in tutti i test PHE è stato una diluizione 1:200 di siero di un paziente con Ebola recuperato nel Regno Unito. Non è stato incorporato alcun controllo di qualità interno per verificare la presenza di immunoglobuline totali adeguate negli OFS, ma tutti i campioni sono stati controllati visivamente per garantire che i tamponi non estratti non fossero secchi.
Metodi statistici
Le analisi sono state effettuate utilizzando STATA 14 (StataCorp).
Il rischio di infezione negli individui è stato classificato come molto basso, basso, intermedio o alto, utilizzando la stratificazione elaborata da Jacobs et al.[25], applicata alle risposte a testo libero del sondaggio da parte dei rimpatriati, con la modifica di includere le violazioni nei DPI. L’utilizzo di questo sistema, essendo fisicamente vicino (<1 m) ad un individuo con confermata EVD mentre non indossava DPI, o con una violazione dei DPI, costituiva un rischio molto basso se non c’era contatto fisico diretto, basso rischio se c’era contatto fisico diretto, e rischio intermedio se il paziente aveva vomito, diarrea o sanguinamento. Il contatto con i fluidi corporei, sia direttamente dal paziente che con l’ambiente, era considerato a rischio intermedio se non vi era esposizione a pelle o mucose rotte o ad alto rischio se vi era contatto con queste aree. Nell’esposizione transcutanea (come una lesione da puntura d’ago), il rischio era considerato elevato se l’oggetto tagliente era un ago a foro cavo appena usato e alto se l’oggetto tagliente era stato contaminato dal contatto con un paziente EVD confermato o con fluidi corporei. Il rischio di una lesione percutanea era considerato intermedio se l’oggetto tagliente non era noto per essere stato contaminato direttamente[25].
I fattori associati al rischio di esposizione, di contrarre una malattia febbrile o diarroica in Africa occidentale o entro 1 mo dal ritorno, e di essere sottoposti a test per l’EBOV durante tale malattia sono stati determinati utilizzando la regressione logistica. I fattori che raggiungono p < 0,1 nell’analisi univariata sono stati inclusi in un modello multivariabile. I test di tendenza sono stati calcolati utilizzando il test del likelihood ratio per confrontare un modello lineare con un modello categorico.
Risultati
Partecipanti
Non è stato possibile stimare il numero di persone che hanno ricevuto il sondaggio via e-mail, ma il consenso online è stato ricevuto da 300 persone, che hanno tutte completato il sondaggio; di queste, 268 (89,3%) hanno restituito un OFS e sono state incluse nell’analisi. Cinquantatre partecipanti al controllo del Regno Unito hanno dato il loro consenso e hanno fornito un OFS utilizzando le stesse procedure.
Dati descrittivi
L’età mediana per chi restituiva un campione era leggermente più vecchia di quella di chi non lo restituiva (39 contro 33 anni, rispettivamente; p = 0,07); tutte le altre caratteristiche erano simili tra i gruppi. Dei 268 rimpatriati che hanno restituito i campioni, 152 (57%) erano donne; l’età mediana era di 36 anni (intervallo interquartile [IQR] 30-45). La maggioranza aveva lavorato più di recente in Sierra Leone (253, 94%) e aveva lavorato nei DPI (230, 86%)(Tabella 1). L’età media dei controlli era di 35 anni (IQR 31-40), e 35 (66%) erano donne.
| Caratteristica | Numero (percentuale) o mediana (IQR) |
|---|---|
| Demografia | |
| Femmina | 152 (56.7%) |
| Età (anni) | 36 (30–45) |
| Paese in cui ha lavorato più di recente | |
| Sierra Leone | 253 (94.4%) |
| Liberia | 12 (4.5%) |
| Guinea | 3 (1.1%) |
| Ruoli svolti (i rimpatriati possono sceglierne più di uno) | |
| Laboratorio | 95 |
| Medico | 70 |
| Infermiera | 54 |
| Ricerca | 37 |
| Gestione/operazioni | 28 |
| Allenatore | 23 |
| Epidemiologo | 19 |
| Coinvolgimento/tracciabilità della comunità | 18 |
| Lavaggio del personale | 11 |
| Finanza | 3 |
| Ingegnere | 3 |
| Farmacista | 2 |
| Assistente sociale/equipaggio di seppellimento/tecnologia dell’informazione/giornalista/visitatore/logistico/nutrizionista1 | 7 |
| Lavorato in DPI (laboratorio o clinica) | 233 (86.9%) |
| Tempo in paese (giorni) | 30 (20–40) |
| Esperienze precedenti | |
| Lavoro di laboratorio con i filovirus | 11 |
| Epidemia di febbre emorragica | 7 |
| Sia il lavoro di laboratorio che quello relativo all’epidemia | 3 |
Contatto ed esposizione
La possibile esposizione è stata accertata attraverso diverse domande e le risposte a testo libero sono state incoraggiate a descrivere gli incidenti in modo più completo. Ventuno (8%) individui hanno riferito di aver avuto un contatto fisico diretto con pazienti con confermata o sospetta EVD senza indossare DPI. Cinquantacinque (21%) hanno risposto “sì” (47) o “incerti” (8) quando è stato chiesto loro se avevano avuto un’esposizione significativa o un evento “quasi-mancato”. Utilizzando le descrizioni a testo libero, alle esposizioni è stato assegnato un livello di rischio di trasmissione(Riquadro 1). In tutto, 43 (16%) individui avevano esposizioni potenziali: 27 (10%) a rischio molto basso, 10 (4%) a rischio basso, cinque (2%) a rischio intermedio e uno ad alto rischio(Fig. 1).
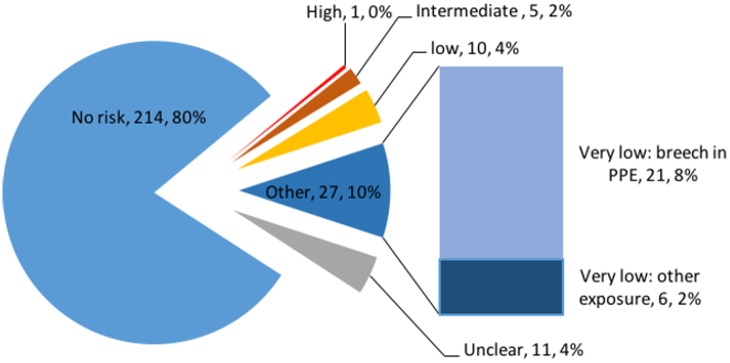
Fig. 1.Rischio di trasmissione del virus Ebola in 268 individui che si sono recati in Africa occidentale in risposta all’epidemia di Ebola del 2014-2016.DPI, dispositivi di protezione individuale.
Latabella 2 mostra i fattori associati alla segnalazione di qualsiasi rischio di trasmissione rispetto alla segnalazione del rischio no/non chiaro. La quantità di tempo trascorso in DPI in laboratorio o nella zona clinica rossa è stata associata a un aumento delle probabilità di incorrere in un rischio di trasmissione EBOV(p per trend = 0,02, escludendo coloro che non indossano DPI). I soggetti che ritornano avevano maggiori probabilità di segnalare un rischio di esposizione se avessero svolto un ruolo clinico (29% di 123) rispetto a un ruolo di laboratorio (3% di 90) (odds ratio 13,4 [95% CI 3,8-47,0] dopo l’aggiustamento per il tempo nei DPI) (Tabella 2). Dopo l’adeguamento per il ruolo e i giorni nei DPI, nessun altro fattore è stato associato al rischio. I diversi metodi di rimozione dei DPI sono stati associati al ruolo, quindi non sono stati associati in modo indipendente al rischio.
| Fattore | Numero (percentuale) | Rischio di trasmissione EVD, n (percentuale) | OR non regolato (95% CI) | Aggiustato OPPURE1 (95% CI) | p-Valore |
|---|---|---|---|---|---|
| Sesso | |||||
| Femmina | 152 (56.7) | 20 (13.2) | 1 | ||
| Maschio | 116 (43.3) | 23 (19.8) | 1.6 (0.8–3.1) | ||
| Gruppo d’età (anni) | |||||
| 19–30 | 73 (27.2) | 8 (11.0) | 1 | ||
| 31–40 | 99 (36.9) | 19 (19.2) | 1.9 (0.8–4.7) | ||
| 41–50 | 45 (16.8) | 8 (17.8) | 1.8 (0.6–5.1) | ||
| ≥51 | 51 (19.0) | 8 (16.7) | 1.5 (0.5–4.3) | ||
| Paese | |||||
| Sierra Leone | 253 (94.4) | 41 (16.2) | 1 | ||
| Guinea/Liberia | 15 (5.6%) | 2 (13.3) | 0.8 (0.2–3.7) | ||
| Struttura2 | |||||
| Struttura 1 | 72 (26.9) | 16 (22.2) | 1 | ||
| Struttura 2 | 67 (25.0) | 7 (10.5) | 0.4 (0.2–1.1) | ||
| Struttura 3 | 53 (19.8) | 3 (5.7) | 0.2 (0.1–0.8) | ||
| Impianto 4 | 13 (4.9) | 6 (46.2) | 3.0 (0.9–10.2) | ||
| Altro | 63 (23.5) | 11 (17.5) | 0.7 (0.3–1.7) | ||
| Ruolo3 | <0.01 | ||||
| Lavoro di laboratorio | 90 (33.6) | 3 (3.3) | 1 | 1 | |
| Lavoro clinico | 123 (45.9) | 35 (28.5) | 11.5 (3.5–38.9) | 13.4 (3.8–47.0) | |
| Altro ruolo4 | 55 (20.5) | 5 (9.1) | 2.9 (0.7–12.7) | 8.7 (1.6–47.4) | |
| Giorni in DPI5 | 0,02; test per l’andamento, 0,026 | ||||
| 1–25 | 77 (28.7) | 13 (16.9) | 1 | 1 | |
| 26–35 | 83 (31.0) | 9 (10.8) | 0.6 (0.2–1.5) | 1.3 (0.5–3.6) | |
| 36–60 | 38 (14.2) | 9 (23.7) | 1.5 (0.6–4.0) | 2.3 (0.8–6.4) | |
| >60 | 22 (8.2) | 9 (41.0) | 3.4 (1.2–9.6) | 4.7 (1.5–14.8) | |
| Nessuno | 48 (17.9) | 3 (6.3) | 0.3 (0.1–0.4) | 0.3 (0.1–1.4) | |
| Precedenti lavori sulla febbre emorragica virale | |||||
| Nessun lavoro precedente | 247 (92.2) | 41 (16.6) | 1 | ||
| Lavoro precedente | 21 (7.8) | 2 (9.5) | 0.5 (0.1–2.3) | ||
| Spray di cloro per la rimozione dei DPI7 | |||||
| Senza spruzzi | 98 (36.6) | 7 (7.1) | 1 | ||
| Spray di cloro | 132 (49.3) | 33 (25.0) | 4.3 (1.8–10.3) | ||
| Non applicabile | 38 (14.2) | 3 (7.9) | 1.1 (0.3–4.6) | ||
| Assistenza alla rimozione dei DPI7 | |||||
| Nessuna assistenza | 108 (40.3) | 13 (12.0) | 1 | ||
| Assistenza | 122 (45.5) | 27 (22.1) | 2.1 (1.0–4.3) | ||
| Non applicabile | 38 (14.2) | 3 (7.9) | 0.6 (0.2–2.3) |
Più di un terzo dei rimpatriati ha riferito di aver avuto contatti con pazienti affetti da EVD recuperati (98/268, 37%). La maggior parte di questi (57/98, 58%) sono stati contatti fisici diretti (strette di mano o abbracci) con pazienti al momento della dimissione da un centro di cura per l’Ebola (ETC), che è stato incoraggiato. Altri hanno descritto la vita o il lavoro con i pazienti guariti (9, 3%) o il contatto all’interno di una clinica di follow-up (14, 5%), oppure hanno riferito il contatto ma non hanno fornito una chiara descrizione (18, 7%). Questi contatti non sono stati inclusi come rischi di trasmissione.

Fig. 1.Fig. 1. Rischio di trasmissione del virus Ebola in 268 persone che si sono recate in Africa occidentale in risposta all’epidemia di Ebola del 2014-2016.DPI, dispositivi di protezione individuale.
Riquadro 1. Esempi di classificazione del rischio, e relative descrizioni a testo libero tratte dall’indagine, su 268 persone che si sono recate in Africa occidentale in risposta all’epidemia di Ebola del 2014-2016.
Rischio nullo o non chiaro: contatto diretto con la popolazione locale senza malattie note; guanto esterno strappato, guanto interno intatto.
“I bambini e alcuni adulti si avvicinerebbero a voi inaspettatamente e vi afferrerebbero il braccio, ecc. A contatto con la gente del posto, non sembravano malati come se camminassero per strada o giocassero”.
“Guanto strappato in isolatore ma guanti rimasti intatti e nessun contatto fluido”.
Rischio molto basso: vivere o lavorare con qualcuno con EVD non diagnosticato ma nessun contatto fisico diretto; violazioni nei DPI senza contaminazione visibile o esposizione alla pelle rotta
“Vestito strappato durante la cura di una donna malata che stava bene”
“Maschera strappata”
“La persona con cui alloggiavo nella stessa sistemazione si è infettata”
Basso rischio: contatto fisico diretto con il paziente che non ha vomito, diarrea o emorragia.
“Il contatto con il medico infetto successivamente confermato… il contatto è stato sintomatico ma ‘secco’”.
“Un collega locale che lavorava presso la nostra ETU [unità di trattamento di Ebola] è venuto al lavoro mentre era sintomatico per circa 5 giorni senza informarci, è risultato positivo ed è morto di EVD una settimana dopo”.
Rischio intermedio: contatto fisico diretto con un paziente con diarrea, vomito o emorragia; contatto diretto con i fluidi corporei di un paziente affetto da EVD.
“Tagliare la mano sulla fiala artesunata (attraverso i guanti) mentre si trovava nella zona rossa”.
“Vomitare mentre si indossano solo i guanti”.
“Toccato maschera con sangue sui guanti (non poteva respirare, ha dovuto estrarre la maschera dal viso)”.
Alto rischio: esposizione di mucose o pelle rotta a fluidi corporei da un paziente EVD, o ferite da taglio da un ago/altro usato su un paziente EVD (non appena usato o non con un ago a foro cavo).
“Lesione da taglio con una fiala di farmaco rotta all’interno della zona rossa con guanti sporchi e contaminati”.
Malattia auto-referita e test
Dei 268 rimpatriati che non hanno mai avuto l’EVD, 57 (21%) hanno avuto una malattia febbrile o diarroica in Africa occidentale o entro un mese dal ritorno. La tabella 3 mostra i fattori associati alla malattia e all’esame per l’EBOV se il rimpatriato ha avuto diarrea e/o febbre.
| Fattore | Numero (percentuale) | Esperienza di malattia, n (percentuale) | OR (95% CI) | p-Valore | Testato per il virus Ebola, n (percentuale) | OR (95% CI) | p-Valore |
|---|---|---|---|---|---|---|---|
| Sesso | |||||||
| Femmina | 152 (56.7) | 32 (21.1) | 1 | 10 (31.3) | 1 | ||
| Maschio | 116 (43.3) | 25 (21.6) | 1.0 (0.6–1.9) | 7 (28.0) | 0.8 (0.3–2.7) | ||
| Fascia d’età (anni) | |||||||
| 19–30 | 73 (27.2) | 20 (27.4) | 1 | 6 (30.0) | 1 | ||
| 31–40 | 99 (36.9) | 21 (21.2) | 0.7 (0.4–1.4) | 6 (28.6) | 0.9 (0.2–3.6) | ||
| 41–50 | 45 (16.8) | 8 (17.8) | 0.6 (0.2–1.4) | 1 (12.5) | 0.3 (0.0–3.3) | ||
| ≥51 | 51 (19.0) | 8 (15.7) | 0.5 (0.2–1.2) | 4 (50.0) | 2.3 (0.4–12.6) | ||
| Ruolo1 | <0.01 | ||||||
| Lavoro di laboratorio | 90 (33.6) | 11 (12.2) | 1 | 4 (34.4) | 1 | ||
| Lavoro clinico | 123 (45.9) | 35 (28.5) | 2.9 (1.4–6.0) | 12 (34.3) | 0.9 (0.2–3.8) | ||
| Altro ruolo2 | 55 (20.5) | 11 (20.0) | 1.8 (0.7–4.5) | 1 (9.1) | 0.2 (0.0–1.9) | ||
| Rischio di EVD | |||||||
| Nessun rischio/scioglimento | 225 (84.0) | 47 (20.9) | 1 | 12 (25.5) | 1 | ||
| Rischio | 43 (16.0) | 10 (23.3) | 1. 1 (0.5–2.5) | 5 (50.0) | 2.9 (0.7–11.9) | ||
| Struttura3 | |||||||
| Struttura 1 | 72 (26.9) | 14 (19.4) | 1 | 7 (50.0) | 1 | ||
| Struttura 2 | 67 (25.0) | 18 (26.9) | 1.5 (0.7–3.4) | 5 (27.8) | 0.4 (0.1–1.7) | ||
| Impianto 3 | 53 (19.8) | 8 (15.1) | 0.7 (0.3–1.9) | 1 (12.5) | 0.1 (0.0–1.5) | ||
| Impianto 4 | 13 (4.9) | 7 (53.9) | 4.8 (1.4–16.6) | 3 (42.9) | 0.8 (0.1–4.7) | ||
| Altro | 63 (23.5) | 10 (15.9) | 0.8 (0.3–1.9) | 1 (10.0) | 0.1 (0.0–1.1) | ||
| Risultato della malattia | <0.01 | ||||||
| Malattia nel paese | 21 (36.8) | 1 (4.8) | 1 | ||||
| Malattia nel Regno Unito | 17 (29.8) | 11 (64.7) | 36.7 (3.9–244.8) | ||||
| Altra causa | 19 (33.3) | 5 (26.3) | 7.1 (0.8–68.0) |
Il personale clinico è stato il più probabile ad aver sperimentato una malattia; il 29% (35 su 123) rispetto al 20% (11 su 55) del personale “altro” e il 12% (11 su 90) del personale di laboratorio (p < 0,01) (Tabella 3). Dopo l’adeguamento per il ruolo, nessun altro fattore è stato associato alla malattia.
Tra i 57 rimpatriati che hanno avuto una malattia febbrile o diarroica, il 30% (17 rimpatriati) è stato sottoposto al test per l’infezione da EBOV all’epoca. Uno dei 21 (5%) che si è ammalato nel paese aveva una PCR EBOV, rispetto a 11 su 17 (65%) che si sono ammalati al ritorno (odds ratio 36,7 [95% CI 3,9-244,8]). Di coloro che si sono ammalati e sono stati classificati come a rischio nullo o non chiaro (47 rimpatriati), 12 (25%) sono stati sottoposti a test, rispetto a cinque dei dieci (50%) con un certo rischio. L’individuo con un’esposizione ad alto rischio non ha descritto una malattia e non è stato sottoposto a test. Dei cinque con esposizioni a rischio intermedio, tre erano malati, e due di questi sono stati testati.
Risultati di laboratorio
La frequenza dei valori NOD per i 268 OFS sono mostrati in Fig 2, accanto a quelli di 53 controlli. Tutti i campioni dei controlli del Regno Unito e tutti i campioni dei rimpatriati, tranne due, erano ben al di sotto della soglia (massimo NOD 0,7). I due campioni che erano reattivi al primo test hanno avuto risultati simili nei test successivi. Il plasma di questi individui è stato testato ulteriormente, come descritto di seguito.
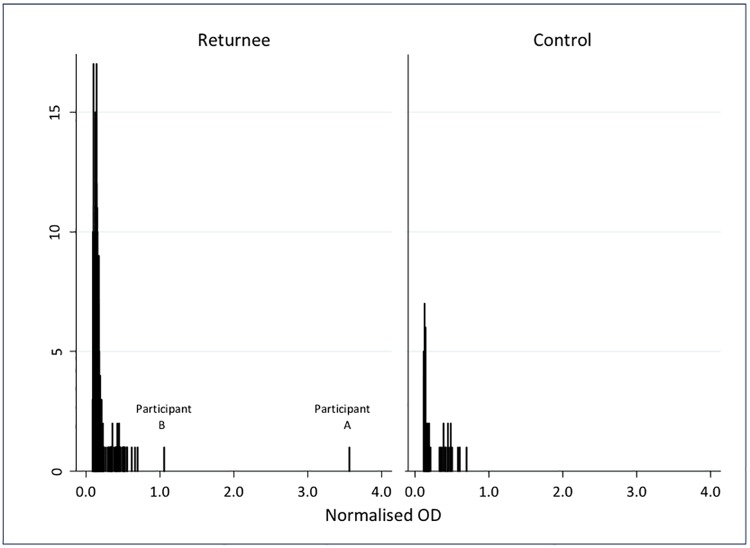
Fig 2.Risultati normalizzati della densità ottica per IgG in campioni di fluidi orali di 268 individui che si sono recati in Africa occidentale in risposta all’epidemia di Ebola del 2014-2016 e 53 controlli nel Regno Unito.

Fig 2.Fig. 2. Risultati normalizzati della densità ottica per IgG in campioni di fluido orale di 268 individui che si sono recati in Africa occidentale in risposta all’epidemia di Ebola del 2014-2016 e 53 controlli nel Regno Unito.
Partecipante A
La partecipante A era un’operatrice di laboratorio donna che ha trascorso un totale di 30 d in un laboratorio di Ebola in Africa occidentale. Non ha descritto un’esposizione significativa o una malattia febbrile, e non è stata sottoposta a PCR per l’infezione da EBOV in nessun momento del suo dispiegamento o al suo ritorno.
L’OFS è stata reattiva su tre test, con NOD 3.55, 3.27, e 3.12. Nel plasma, il test di cattura IgG è stato reattivo due volte (NOD 4.5 e 5.4), il DABA è stato reattivo due volte (NOD 2.6 e 3.2), ma il test competitivo è stato non reattivo due volte (NOD 0.44 e 0.49), e il test ELISA indiretto interno al Jenner Institute è stato non reattivo. L’EBOV PCR su plasma era negativo.
Partecipante B
La partecipante B era un medico donna che ha trascorso 40 d nella zona clinica rossa, non ha descritto un’esposizione significativa o alcuna malattia e non è stata sottoposta a PCR per l’infezione da EBOV durante il suo dispiegamento o al ritorno. L’OFS ha mostrato un basso livello di reattività sul saggio di cattura IgG (NOD 1.05, 1.26 e 0.88). Un simile basso livello di reattività è stato osservato nel saggio di cattura delle IgG del plasma (NOD 1.40 e 1.24). Il plasma non è risultato reattivo su DABA (NOD 0,43 e 0,41), sul saggio competitivo (NOD 0,47 e 0,45) e sull’ELISA indiretto del Jenner Institute. L’EBOV PCR su plasma era negativo.
Discussione
Questo è il primo esame a nostra conoscenza di possibili infezioni non diagnosticate con EBOV in HCW internazionali e altri soccorritori che lavorano durante l’epidemia di Ebola in Africa occidentale 2014-2016. Più del 99% non ha avuto alcuna reattività al test di screening, rendendo l’infezione non diagnosticata, al massimo, un evento molto raro. I due individui con test di reattività per IgG all’antigene della glicoproteina EBOV non hanno riportato alcuna esposizione significativa. Uno di questi individui ha dimostrato un livello di reattività intorno al cutoff, illustrando una reattività non specifica, una possibile scoperta nella diagnostica sierologica[26]. L’altro individuo ha avuto risultati che erano reattivi nel test di cattura delle IgG a un livello visto in pazienti con EVD recuperati[17], e reattivi in un DABA, ma non in un test competitivo e non in un ELISA indiretto separato per IgG. Sia il test di cattura che il DABA impiegano esattamente lo stesso antigene ricombinante (glicoproteina EBOV); pertanto, ci si può aspettare una positività concordante su entrambi. Il test competitivo, tuttavia, utilizza l’anticorpo monoclonale 4G7, un costituente della terapia proposta per l’EVD ZMAb[27], che compete con l’anticorpo del partecipante per il legame con la stessa glicoproteina ricombinante EBOV e ci si aspetta che sia intrinsecamente più specifico. Il risultato di questo ritorno potrebbe essere spiegato attraverso la reattività crociata, la presenza di un anticorpo che si lega ad un singolo epitopo sulla glicoproteina EBOV usata nel test di cattura PHE IgG che non era presente sulla glicoproteina EBOV usata nell’ELISA indiretto IgG del Jenner Institute IgG e non è stato prodotto in risposta all’infezione da EBOV. In alternativa, il rimpatriato potrebbe essere stato infettato da un piccolo inoculo e aver generato una risposta minima delle cellule B della memoria successiva, con il risultato di un anticorpo a bassa avidità o con un profilo epitopico limitato. Un anticorpo a bassa attitudine non sembra una spiegazione adeguata poiché i titoli geometrici medi degli anticorpi nei contatti domestici asintomatici non diagnosticati dei casi di EVD in Sierra Leone non erano significativamente diversi da quelli dei pazienti guariti[17]. Dal momento che il rimpatriato non è mai stato sintomatico, ha mostrato una mancanza di reattività consistente e robusta nei test sierologici, e non ha avuto viremia plasmatica rilevabile, il follow-up clinico non è stato ritenuto necessario, ed è stato rifiutato quando gli è stato offerto.
Il liquido orale EBOV IgG ha dimostrato di avere un’eccellente concordanza con il plasma EBOV IgG, e il saggio di cattura EBOV IgG ha dimostrato un’eccellente sensibilità e specificità[17]. Utilizzando questo test, la sieropositività è stata trovata nel 2,6% di 389 contatti domestici asintomatici in Sierra Leone[17]. Utilizzando saggi di diversi formati, il 7,5% dei 187 contatti non diagnosticati in precedenza erano sieropositivi in Sierra Leone[19], e tra l’1% e il 46% nei precedenti focolai[11- 13,15,16], anche se sono state espresse notevoli preoccupazioni circa la specificità dei saggi utilizzati per generare questi dati [16,28]. Nel nostro studio, i campioni sono stati raccolti da individui a varie lunghezze di tempo dopo il loro ritorno dall’Africa occidentale, ma non più di 2 anni. L’entità della risposta anticorpale è stata dimostrata diminuire nel tempo in alcuni studi sui vaccini[29], ma è rimasta rilevabile diversi anni dopo l’infezione naturale in epidemie precedenti[30]. È possibile che la sensibilità del test sia stata diminuita dal fatto che l’OFS è rimasto a temperatura ambiente durante la spedizione; tuttavia, questo sembra improbabile in quanto le concentrazioni di anticorpi nel liquido orale hanno dimostrato una stabilità a varie temperature fino a 7 d quando testato con saggi di cattura simili a quelli utilizzati nel nostro studio[31].
Non abbiamo dimostrato alcuna evidenza di infezione da EBOV in individui che sono stati considerati a rischio di trasmissione, o in persone che hanno avuto sintomi febbrili o diarroici durante il potenziale tempo di incubazione di EBOV. Una percentuale preoccupante di intervistati ha avuto un contatto fisico diretto con pazienti affetti da EVD confermati o sospetti, o con eventi vicini al fallimento o all’esposizione all’interno della zona rossa, molti dei quali hanno soddisfatto criteri di rischio di esposizione simili a quelli di coloro cui è stato somministrato il favipiravir come profilassi post-esposizione[25]. Nessuno dei rimpatriati ha riferito di essere stato evacuato dal punto di vista medico o di aver ricevuto una profilassi post-esposizione, ma questo non è stato chiesto direttamente.
La segnalazione di un evento classificato come molto basso, basso, intermedio o ad alto rischio per la trasmissione di EBOV è stata associata allo svolgimento di un ruolo clinico piuttosto che di laboratorio. Sono state descritte le fiale rotte e le violazioni dei DPI di laboratorio nei laboratori Ebola[32]. Tuttavia, il lavoro di laboratorio può consentire una maggiore previsione del rischio e una gestione guidata dal protocollo rispetto al lavoro con i pazienti, che possono presentare confusione durante il corso dell’EVD[6]. Il debriefing regolare dopo il lavoro nella zona clinica rossa o in laboratorio e la segnalazione senza colpe di “near miss” dovrebbe essere parte della pratica di routine nel lavoro di risposta ai EMT. Insieme all’ulteriore sviluppo e alla pubblicazione di strumenti attraverso i quali è possibile classificare il rischio di esposizione, il personale dovrebbe ricevere consigli realistici sul proprio livello di rischio per ridurre la confusione ed evitare l’ansia, consentendo al tempo stesso di identificare coloro che presentano un rischio più che minimo. Le risposte dei rimpatriati che hanno partecipato a questo studio potrebbero essere utilizzate per informare la progettazione dell’ETC e la pianificazione della forza lavoro per prevenire la potenziale esposizione all’EBOV. Ad esempio, le segnalazioni di personale che ha subito lacerazioni della pelle a causa di fiale di vetro rotte nella zona rossa dovrebbero portare a prendere in considerazione un divieto totale dell’uso di fiale di vetro in questa zona. Le segnalazioni di DPI staccati o strappati dovrebbero portare a ulteriori test di robustezza e di vestibilità delle tute DPI, a un’attenta progettazione degli ETC in modo che le tute non si strappino a causa dell’aggancio su porte o angoli e alla conferma che in ogni ETC esistono protocolli per la gestione dei guasti dei DPI mentre si trovano nella zona rossa.
Lo svolgimento di un ruolo clinico (infermieri/docenti/paramedici) è stato fortemente associato alla descrizione di una malattia, rispetto al lavoro di laboratorio o all’assunzione di altri ruoli. Il personale clinico indossava DPI per la maggior parte delle interazioni cliniche, riducendo al minimo il rischio di contrarre un’infezione da pazienti affetti da EVD. Tuttavia, la cura di colleghi malati o il fatto di mescolarsi maggiormente con il personale nazionale dell’Africa occidentale può aver aumentato l’esposizione di questo gruppo ad agenti patogeni trasmissibili ai quali erano immuno-naïve, come le infezioni virali del tratto respiratorio superiore. Riguarda il fatto che un’alta percentuale di rimpatriati che hanno avuto una malattia febbrile o diarroica mentre si trovavano in Africa occidentale o entro un mese dal ritorno non sono stati testati con la PCR per l’EBOV in quel momento.
Il test per l’infezione da EBOV era più fortemente associato all’esperienza di una malattia nel Regno Unito rispetto a quando si trovava ancora in Africa occidentale. La malattia in Africa occidentale può aver portato al ricovero in un centro di cura dove altri pazienti affetti da EVD confermati venivano curati o all’evacuazione medica nel Regno Unito. Anche se queste sarebbero state allarmanti per l’individuo e costose per l’organizzazione o il paese di origine, la presentazione precoce della malattia è stata associata a un miglioramento della sopravvivenza[33,34]. Le politiche delle ONG, ove disponibili, sono state riviste dagli autori e spesso hanno affermato che l’EBOV dovrebbe essere testato “dopo un periodo di osservazione” e se i sintomi non sono “risolti o progrediti”. La natura pragmatica di queste politiche dovrebbe essere vista nel contesto dell’ansia indotta dai test, così come la potenziale esposizione all’interno di una struttura di test[35]. Questo studio fornisce una rassicurante mancanza di prove di infezione da EBOV in individui che non erano stati precedentemente testati per l’EBOV, ma che avevano avuto una malattia coerente con EVD leggermente sintomatica. Dovrebbero essere avviate una revisione, una critica e una standardizzazione concordata dei protocolli per la gestione della malattia nel personale assunto a livello nazionale e internazionale durante le epidemie.
Questo studio comprendeva 268 persone che hanno restituito gli OFS. Non si trattava di un campione casuale, ed è possibile che coloro che erano a conoscenza di possibili esposizioni o che avevano avuto sintomi fossero particolarmente desiderosi di partecipare. PHE ha condotto uno screening di routine di tutti gli individui che sono tornati nel Regno Unito dall’Africa occidentale al picco dell’epidemia, tra il 14 ottobre 2014 e il 4 dicembre 2015. Durante questo periodo, 646 individui sono stati designati a basso rischio di esposizione (tra cui personale WASH, epidemiologi, consulenti sanitari e tracciatori di contatto) o ad alto rischio di esposizione (tra cui gli operatori sanitari che forniscono assistenza ai pazienti affetti da EVD, gli addetti all’obitorio e le squadre di seppellimento)[36]. L’uso del liquido orale per i test, insieme all’uso di un dispositivo di autocampionamento, ha probabilmente aumentato i tassi di risposta e la partecipazione al nostro studio[37]; ha evitato il disagio e l’inconveniente del prelievo di sangue, e ha migliorato la logistica per la raccolta dei campioni, data la diffusione geografica dei rimpatriati nel Regno Unito e in Irlanda.
Limitando lo studio al personale internazionale, solo 11 dei quali avevano precedenti esperienze con i filovirus, abbiamo potuto valutare il rischio di contrarre l’EBOV mentre lavoravano nei DPI o rispondevano in altro modo all’epidemia, senza il rischio non quantificabile sperimentato dagli operatori sanitari nazionali che potrebbero essere stati esposti a familiari, amici e colleghi infetti. Tali contatti sono stati identificati come la fonte di infezione nella maggior parte delle infezioni da HCW in Sierra Leone[38]. Siamo anche stati in grado di valutare la potenziale trasmissione a persone che hanno lavorato in ruoli che non prevedevano prevalentemente il lavoro diretto con pazienti affetti da EVD, tra cui epidemiologi, personale impegnato nella comunità, ricercatori e personale di supporto come quelli della finanza o dell’IT. Alcuni di questi individui hanno descritto il contatto sia con i casi positivi che con quelli recuperati, e hanno ritenuto di aver avuto eventi quasi mancanti o esposizioni significative. Una chiara correlazione tra il livello di esposizione ai casi di EVD e i loro fluidi corporei e il rischio di acquisizione di EVD è stata documentata in precedenza[17,39]. È possibile che in questo studio non siano stati rilevati potenziali eventi di trasmissione o livelli di rischio, in particolare per quanto riguarda la variazione del componente di protezione degli occhi dei DPI; l’EBOV era stato rilevato nel tessuto polmonare[40], e la trasmissione è stata documentata in individui che non ricordavano il contatto fisico con un caso confermato da cui avevano contratto l’infezione[41].
La segnalazione di una malattia non dichiarata in precedenza durante il periodo di incubazione per l’EVD, o la mancata segnalazione immediata di un evento quasi mancante, può essere oggetto di critiche o anche di una revisione disciplinare professionale[42]. Ciononostante, i rimpatriati che hanno partecipato a questo studio sembravano disposti a segnalare questi eventi. Ciò è stato aiutato evitando l’interazione faccia a faccia attraverso l’uso di un modulo di consenso online e di un questionario – un metodo che è stato precedentemente dimostrato per aumentare la segnalazione di risposte socialmente indesiderate [43]– e dichiarando esplicitamente nel questionario che non avremmo identificato specifiche strutture di trattamento o ONG.
Conclusione
La stragrande maggioranza dei rispondenti internazionali all’epidemia di EVD che hanno partecipato a questo studio non aveva alcuna prova dell’infezione da EBOV. Ciò dovrebbe fornire ulteriori prove a sostegno dell’efficacia delle procedure di prevenzione e controllo dell’infezione da ETC e dei DPI. In considerazione della mancanza di prove dell’infezione nonostante la frequenza dei sintomi coerenti con l’EVD (febbre e diarrea) e il livello sconcertante di sottotest in quel momento, si dovrebbe prendere in considerazione la revisione e la standardizzazione delle politiche di gestione della malattia. Il livello di preoccupazione espresso dai rimpatriati in merito alla potenziale esposizione all’EBOV sia all’interno che all’esterno delle aree della zona rossa dovrebbe evidenziare le aree per un migliore supporto al personale nazionale e internazionale, e la necessità di standardizzare i protocolli per la valutazione e la gestione delle esposizioni tra le organizzazioni.
Informazioni di supporto
References
- Evans DK, Goldstein M, Popova A. Health-care worker mortality and the legacy of the Ebola epidemic. Lancet Glob Health. 2015; 3:e439-e440. DOI | PubMed
- World Health Organization. WHO global health workforce statistics. World Health Organization: Geneva; 2016. Publisher Full Text
- Schieffelin JS, Shaffer JG, Goba A, Gbakie M, Gire SK. Clinical illness and outcomes in patients with Ebola in Sierra Leone. N Engl J Med. 2014; 371:2092-2100. DOI | PubMed
- Bah EI, Lamah MC, Fletcher T, Jacob ST, Brett-Major DM. Clinical presentation of patients with Ebola virus disease in Conakry, Guinea. N Engl J Med. 2015; 372:40-47. DOI | PubMed
- Qin E, Bi J, Zhao M, Wang Y, Guo T. Clinical features of patients with Ebola virus disease in Sierra Leone. Clin Infect Dis. 2015; 61:491-495. DOI | PubMed
- Hunt L, Gupta-Wright A, Simms V, Tamba F, Knott V. Clinical presentation, biochemical, and haematological parameters and their association with outcome in patients with Ebola virus disease: an observational cohort study. Lancet Infect Dis. 2015; 15:1292-1299. DOI | PubMed
- Camacho A, Kucharski A, Aki-Sawyerr Y, White MA, Flasche S. Temporal changes in Ebola transmission in Sierra Leone and implications for control requirements: a real-time modelling study. PLoS Curr. 2015; 7
- Uyeki TM, Mehta AK, Davey RT, Liddell AM, Wolf T. Clinical management of Ebola virus disease in the United States and Europe. N Engl J Med. 2016; 374:636-646. DOI | PubMed
- World Health Organization. Emergency medical teams and World Health Organization. World Health Organization: Geneva; 2016. Publisher Full Text
- Centers for Disease Control and Prevention. Ebola (Ebola virus disease): CDC’s role. Centers for Disease Control and Prevention: Atlanta; 2016. Publisher Full Text
- Clark D V, Kibuuka H, Millard M, Wakabi S, Lukwago L. Long-term sequelae after Ebola virus disease in Bundibugyo, Uganda: a retrospective cohort study. Lancet Infect Dis. 2015; 15:905-912. DOI | PubMed
- Bertherat E, Renaut A, Nabias R, Dubreuil G, Georges-Courbot MC. Leptospirosis and Ebola virus infection in five gold-panning villages in northeastern Gabon. Am J Trop Med Hyg. 1999; 60:610-615. PubMed
- Rowe AK, Bertolli J, Khan AS, Mukunu R, Muyembe‐Tamfum JJ. Clinical, virologic, and immunologic follow‐up of convalescent Ebola hemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo. J Infect Dis. 1999; 179:S28-S35. DOI | PubMed
- Leroy E, Baize S, Volchkov V, Fisher-Hoch S, Georges-Courbot M-C. Human asymptomatic Ebola infection and strong inflammatory response. Lancet. 2000; 355:2210-2215. PubMed
- Johnson KM, Breman JG, Burke J, Declerq R, Ghysebrechts G. Ebola haemorrhagic fever in Zaire, 1976. Bull World Health Organ. 1978; 56:271-293. PubMed
- Bower H, Glynn J. A systematic review and meta-analysis of seroprevalence surveys of ebolavirus infection. Sci Data. 2016; 4:160133.
- Glynn J, Bower H, Johnson S, Houlihan C, Montesano C. Asymptomatic infection and unrecognised Ebola virus disease: prevalence of Ebola virus sero-positivity in a large cross-sectional survey in Ebola-affected households, Sierra Leone, using a new non-invasive assay. Lancet Infect Dis. 2017.
- Dean NE, Halloran ME, Yang Y, Longini IM. Transmissibility and pathogenicity of Ebola virus: a systematic review and meta-analysis of household secondary attack rate and asymptomatic infection. Clin Infect Dis. 2016; 62:1277-1286. DOI | PubMed
- Richardson ET, Kelly JD, Barrie MB, Mesman AW, Karku S. Minimally symptomatic infection in an Ebola “hotspot”: a cross-sectional serosurvey. PLoS Negl Trop Dis. 2016; 10:e0005087. DOI | PubMed
- Biernacki P, Waldorf D. Snowball sampling: problems and techniques of chain referral sampling. Sociol Methods Res. 1981; 10:141-163.
- Lambe T, Rampling T, Samuel D, Bowyer G, Ewer K. Detection of vaccine induced antibodies to Ebola virus in oral fluid. Open Forum Infect Dis. 2016; 3:ofw031. DOI | PubMed
- Frey A, Di Canzio J, Zurakowski D. A statistically defined endpoint titer determination method for immunoassays. J Immunol Methods. 1998; 221:35-41. PubMed
- Trombley AR, Wachter L, Garrison J, Buckley-Beason VA, Jahrling J. Comprehensive panel of real-time TaqMan polymerase chain reaction assays for detection and absolute quantification of filoviruses, arenaviruses, and New World hantaviruses. Am J Trop Med Hyg. 2010; 82:954-960. DOI | PubMed
- Ewer K, Rampling T, Venkatraman N, Bowyer G, Wright D. A monovalent chimpanzee adenovirus Ebola vaccine boosted with MVA. N Engl J Med. 2016; 374:1635-1646. DOI | PubMed
- Jacobs M, Aarons E, Bhagani S, Buchanan R, Cropley I. Post-exposure prophylaxis against Ebola virus disease with experimental antiviral agents: a case-series of health-care workers. Lancet Infect Dis. 2015; 15:1300-1304. DOI | PubMed
- Fierz W. Basic problems of serological laboratory diagnosis. Methods Mol Med. 2004; 94:393-427. PubMed
- Zeitlin L, Whaley KJ, Olinger GG, Jacobs M, Gopal R. Antibody therapeutics for Ebola virus disease. Curr Opin Virol. 2016; 17:45-49. DOI | PubMed
- Bausch DG. Sequelae after Ebola virus disease: even when it’s over it’s not over. Lancet Infect Dis. 2016; 15:865-866.
- Stanley DA, Honko AN, Asiedu C, Trefry JC, Lau-Kilby AW. Chimpanzee adenovirus vaccine generates acute and durable protective immunity against ebolavirus challenge. Nat Med. 2014; 20:1126-1129. DOI | PubMed
- Natesan M, Jensen SM, Keasey SL, Kamata T, Kuehne AI. Human survivors of disease outbreaks caused by Ebola or Marburg virus exhibit cross-reactive and long-lived antibody responses. Clin Vaccine Immunol. 2016; 23:717-724. DOI | PubMed
- Morris M, Cohen B, Andrews N, Brown D. Stability of total and rubella-specific IgG in oral fluid samples: the effect of time and temperature. J Immunol Methods. 2002; 266:111-116. PubMed
- Sealy TK, Erickson BR, Taboy C, Stroher U, Towner JS. Laboratory response to Ebola—West Africa and United States. Morb Mortal Wkly Rep. 2016; 65:44-49.
- Crowe SJ, Maenner MJ, Kuah S, Erickson BR, Coffee M. Prognostic indicators for Ebola patient survival. Emerg Infect Dis. 2016; 22:217-223. DOI | PubMed
- Rosello A, Mossoko M, Flasche S, Van Hoek AJ, Mbala P. Ebola virus disease in the Democratic Republic of the Congo, 1976–2014. Elife. 2015; 4:e09015. DOI | PubMed
- Arkell P, Youkee D, Brown CS, Kamara A, Kamara TB. Quantifying the risk of nosocomial infection within Ebola Holding Units: a retrospective cohort study of negative patients discharged from five Ebola Holding Units in Western Area, Sierra Leone. Trop Med Int Heal. 2017; 22:32-40.
- Public Health England. Monthly summary 14: 07/01/2016. Public Health England: London; 2016. Publisher Full Text
- Virtanen A, Nieminen P, Luostarinen T, Anttila A. Self-sample HPV tests as an intervention for nonattendees of cervical cancer screening in Finland: a randomized trial. Cancer Epidemiol Biomarkers Prev. 2011; 20:1960-1969. DOI | PubMed
- Olu O, Kargbo B, Kamara S, Wurie AH, Amone J. Epidemiology of Ebola virus disease transmission among health care workers in Sierra Leone, May to December 2014: a retrospective descriptive study. BMC Infect Dis. 2015; 15:416. DOI | PubMed
- Bower H, Johnson S, Bangura MS, Kamara AJ, Kamara O. Attack rates for Ebola virus disease in Ebola-affected households, Sierra Leone. Emerg Infect Dis. 2016; 22:1403-1411. DOI | PubMed
- Biava M, Caglioti C, Bordi L, Castilletti C, Colavita F. Detection of viral RNA in tissues following plasma clearance from an Ebola virus infected patient. PLOS Pathog. 2017; 13:e1006065. DOI | PubMed
- Roels TH, Bloom AS, Buffington J, Muhungu GL, Mac Kenzie WR. Ebola hemorrhagic fever, Kikwit, Democratic Republic of the Congo, 1995: risk factors for patients without a reported exposure. J Infect Dis. 1999; 179:S92-S97. DOI | PubMed
- Ebola nurse Pauline Cafferkey accused of concealing high temperature. Nurs Stand. 2016; 30:8.
- Gnambs T, Kaspar K. Disclosure of sensitive behaviors across self-administered survey modes: a meta-analysis. Behav Res Methods. 2015; 47:1237-1259. DOI | PubMed
Fonte
Houlihan CF, McGowan CR, Dicks S, Baguelin M, Moore DAJ, et al. (2017) Ebola exposure, illness experience, and Ebola antibody prevalence in international responders to the West African Ebola epidemic 2014–2016: A cross-sectional study. PLoS Medicine 14(5): e1002300. https://doi.org/10.1371/journal.pmed.1002300





