Abstract
Dichiarazione di rilevanza
A concentrazioni relativamente basse, l’etanolo inibisce l’attività di molti termini presinaptici(Liu e Hunt, 1999). Cambiamenti omeostatici nell’attività presinaptica si propongono come base per la formazione della tolleranza funzionale(Koob e Bloom, 1988; Ghezzi e Atkinson, 2011). Attualmente non sappiamo dove l’etanolo si lega per determinare cambiamenti nell’attività presinaptica e nell’omeostasi. Ora dimostriamo che l’etanolo si lega al dominio C1 della proteina Munc13-1 a concentrazioni intossicanti e inibisce il legame del diacilglicerolo (DAG). Ridurre l’attività della Drosophila Dunc13 ortholog porta ad un cambiamento omeostatico che promuove la resistenza comportamentale e fisiologica ai livelli intossicanti di etanolo. Quindi, le proteine Unc13 sono probabilmente siti per l’azione dell’etanolo all’interno del compartimento presinaptico che portano alla tolleranza.
Introduzione
La dipendenza dall’alcol rimane uno dei problemi di salute mentale più significativi in tutto il mondo. Una sfida importante è capire come l’etanolo cambia il comportamento e il cervello durante la discesa nella dipendenza. Un approccio promettente è quello di esaminare gli endofenotipi di questa malattia in sistemi modello(Dick et al., 2006; Salvatore et al., 2015). Uno dei principali endofenotipi per lo sviluppo dell’alcolismo è la sensibilità comportamentale ingenua all’etanolo, in cui i figli degli alcolisti aumentano di quattro volte la probabilità di alcolismo tra coloro che hanno una ridotta sensibilità ingenua agli effetti inebrianti dell’alcol (Schuckit, 1980, 1994; Schuckit et al., 1996). La resistenza ingenua all’intossicazione da etanolo può essere meccanicamente correlata alla formazione di tolleranza che segue l’esposizione ad alte concentrazioni di etanolo (Harris et al., 2008; Mayfield et al., 2008).
Durante l’esposizione all’alcool di abbuffata, l’etanolo crea cambiamenti diffusi e di lunga durata nell’attività neurale, alterando sia l’attività presinaptica che quella postsinaptica. Un effetto dell’etanolo sul rilascio presinaptico è visto a concentrazioni inferiori a 100 mM, dove questo farmaco produce tipicamente i suoi effetti sedativi(Diamond e Gordon, 1997). Un singolo polimorfismo aminoacidico nella proteina della zona attiva Munc-18 e il suo omologo unc-18 sono stati trovati per generare una forte resistenza alla sedazione di etanolo in topo e Caenorhabditis elegans, rispettivamente(Fehr et al., 2005; Graham et al., 2009). Questa mutazione in Unc18 ha anche diminuito la frequenza di rilascio delle vescicole sinaptiche(Graham et al., 2009). La perdita delle proteine delle vescicole sinaptiche Rab-3A e del suo omologo Rab-3 risulta anche nella resistenza alla sedazione dell’etanolo sia in C. elegans che nel topo(Kapfhamer et al., 2008). L’etanolo inibisce il rilascio di vescicole presinaptiche in fette di ippocampo di ratto indotte dalla depolarizzazione extracellulare K+ innescata e dipendente dall’attività dei canali del calcio in tensione(Maldve et al., 2004). Dal Munc-18, Rab-3A, e canali a tensione sono essenziali per l’esocitosi presinaptica, l’etanolo può alterare l’attività presinaptica cambiando la probabilità di fusione della vescicola sinaptica. Il meccanismo attraverso il quale l’etanolo ha effetti sulla riduzione dell’attività presinaptica è sconosciuto, ma un candidato è il canale BK a grande conduttanza slowpoke. L’attività del canale BK slowpoke ha un ruolo importante nella sedazione e nella tolleranza all’etanolo sia nella Drosophila che in C. elegans(Davies et al., 2003; Cowmeadow et al., 2005, 2006). L’etanolo può legarsi direttamente ai canali BK e il legame è essenziale per la sedazione dell’etanolo in C. eleg ans(Bukiya et al., 2014; Davis et al., 2014). Tuttavia, il canale BK è espresso sia presinapticamente che postsinapticamente, e non è ancora chiaro quanto del cambiamento nell’attività presinaptica sia attribuito al legame dell’etanolo ai canali BK presinaptici(Sailer et al., 2006).
Munc13-1 è anche una proteina legante dell’alcol e un forte candidato per la produzione di un effetto dell’alcol nel compartimento presinaptico(Das et al., 2013). Munc13-1 è una proteina della zona attiva essenziale per la fusione delle vescicole sinaptiche(Betz et al., 1997, 1998; Rhee et al., 2002). Munc13-1 interagisce direttamente con e coordina diversi altri membri del macchinario di fusione delle vescicole in zone di azione presinaptica nel cervello dei mammiferi, tra cui sintassiina, RIM, Munc18, e canali di calcio a tensione (VGCC),(Rizo e Xu, 2015). Il dominio C1 di Munc13-1 lega il diacilglicerolo (DAG), che promuove la localizzazione della membrana di questa proteina e abbassa la barriera energetica per la fusione delle vescicole, facilitando il rilascio delle vescicole sinaptiche(Basu et al., 2007). L’etanolo si lega al dominio Munc13-1 C1 in vitro a concentrazioni inferiori a 100 mM(Das et al., 2013). La riduzione del livello di Dunc13, l’ortologia di Drosophila di Munc13-1, porta a mosche che si autosomministra l’etanolo a livelli significativamente più alti rispetto ai controlli wild-type(Das et al., 2013). Qui dimostriamo che l’etanolo inibisce il legame del DAG al dominio Munc13-1 C1 a concentrazioni fino a 25 mM. Inoltre, dimostriamo in Drosophila che l’etanolo compromette il rilascio delle vescicole sinaptiche nei neuroni eccitatori a valle dell’afflusso di Ca2+ nella zona attiva e che la riduzione di Dunc13 produce una resistenza comportamentale e fisiologica agli effetti sedativi dell’etanolo.
Materiali e metodi
Vola ceppi
Tutte le mosche sono state allevate su alimenti standard di farina di mais a 25°C su un ciclo di 12/12 h luce / buio. Tutte le scorte sono state incrociate sullo sfondo del Canton-S per un minimo di sei generazioni prima dell’analisi comportamentale. Dunc13P84200/ciD(FBst0300878) è stato generosamente fornito dal Kyoto Stock Center. Dunc13KK101383 La linea RNAi (RRID: FlyBase_FBst0479208) è stata fornita dal Centro Risorse di Vienna Drosophila. L’elav-Gal4(FBst0008760, RRID: BDSC_8760), UAS-Arclight (RRID: BDSC_51056, FBst0051056 ), UAS-GCaMP5(RRID: FlyBase_FBst0042037 ) e Dunc13JF02440 La linea RNAi (RRID: BDSC_29548) è stata fornita dal Bloomington Drosophila Stock Center. La n-syb-Gal4 è stata generosamente fornita da Herman Dierick (Baylor College of Medicine). L’Or42b-Gal4 è stato gentilmente fornito da Scott Pletcher (Università del Michigan). Il tublin-Gal80ts2, ry506e UAS-pHluorin sono stati generosamente forniti da Ronald L. Davis (Scripps, FL).
Il cDNA Munc13.1-EGFP è stato digerito dal vettore pBRETU(Roman et al., 1999; Das et al., 2013), e clonato nel vettore pUAST-attB(Bischof et al., 2007). Il vettore Munc13.1-pUAST-attB è stato ricombinato in attP40 nel secondo cromosoma, e la posizione e l’orientamento sono stati confermati dalla PCR.
Per il test di sedazione dell’etanolo, il Dunc13P84200/+ genotipo è stato generato dall’incrocio di femmine vergini di ry506, con w+; +; ry506 Dunc13P84200/ciDmaschi. Per il completamento funzionale di Dunc13P84200, il genotipo sperimentale è stato generato dall’incrocio di femmine vergini di w+; tublin-Gal80ts; ry506 Dunc13/ciDcon w+; UAS-Munc13-1 (o UAS-dunc13A); elav-Gal4;+ maschi. Per l’imaging ottico, il genotipo Or42b-Gal4/+; UAS- pHluorina (o Arclight, GCaMP5)/+ è stato generato incrociando le femmine vergini di Or42b-Gal4, con UAS-pluorina (o Arclight, GCaMP5) maschi, e il genotipo Or42b-Gal4/+; UAS- pHluorina/+; Dunc13P84200/+ è stato generato dall’incrocio di femmine vergini di Or42b-Gal4;; Dunc13P84200/ciDcon i maschi di UAS-pHluorin.
Sedazione con etanolo
Il test di perdita di etanolo del riflesso di raddrizzamento (LOR) è stato eseguito come descritto in precedenza(van der Linde et al., 2014). Le mosche femmine sono state raccolte e messe in fiale contenenti cibo fresco (1 n = 30 mosche per fiala) per 24 ore prima del test comportamentale. Sono state poi trasferite nelle fiale di plastica vuote dell’apparecchio di prova ed esposte ad un flusso di vapore di etanolo (50% se non si è notato) ad un flusso di 250 ml/min per 1 h per testare la sensibilità all’etanolo. Il vapore di etanolo è stato prodotto facendo bolle d’aria fresca attraverso il 100% di etanolo e acqua pura e mescolando i due tipi di vapori. La % di etanolo si riferisce alla percentuale del flusso finale di aria/etanolo costituito dall’aria gorgogliata attraverso l’etanolo. La percentuale di mosche sedate in ogni fiala è stata registrata a intervalli di 5 minuti. Una mosca era considerata sedata se era caduta sul dorso o sul fianco e non riusciva a raddrizzarsi. Il tempo fino al 50% di LOR è stato calcolato per ogni tubo di esposizione per interpolazione lineare dei due punti di tempo intorno alla mediana e poi calcolato in media sul numero di tubi(Ojelade et al., 2015).
Metabolismo e assorbimento dell’etanolo
Il metabolismo dell’etanolo e il test di assorbimento sono stati descritti in precedenza(Urizar et al., 2007). Per studiare l’assorbimento dell’etanolo, 30 mosche femmina sono state esposte al 50% di vapore di etanolo ad una portata di 250 ml/min per 0, 20, 40, o 60 min. Subito dopo l’esposizione, le mosche sono stati congelati in azoto liquido e omogeneizzato in 200 microlitri di 50 mM Tris-HCl, pH 7,5. L’omogeneizzato è stato poi centrifugato a 15.000 × g a 4°C per 20 minuti, e il surnatante è stato raccolto. La concentrazione di etanolo nel supernatante è stata misurata utilizzando il kit Ethanol Assay (catalogo #MAK076, Sigma-Aldrich). Per determinare se sono state saggiate quantità equivalenti di mosche per ogni genotipo, la concentrazione di proteine negli estratti di mosca è stata misurata utilizzando il dosaggio delle proteine DC (Bio-Rad Laboratories). Il metabolismo dell’etanolo è stato esaminato esponendo le mosche al 50% di vapore di etanolo per 60 min e permettendo alle mosche di recuperare per un periodo di 0, 30, 60, o 120 min. La concentrazione di etanolo negli estratti di mosca è stata misurata alla fine di ogni periodo di recupero.
Immagini ottiche e iniezione di etanolo
L’imaging ottico è stato eseguito su mosche dal vivo come descritto in precedenza con modifiche(Zhang e Roman, 2013). Ogni mosca femmina è stata fissata su una punta di pipetta e la sua testa è stata fissata all’apertura della punta con la cera. La cuticola sulla parte superiore della testa è stata rimossa e ricoperta con un pezzo di involucro di plastica.
Prima dell’iniezione, ogni mosca femmina sezionata è stata controllata toccando delicatamente la punta della sua gamba anteriore con una pinza. Se il femore della mosca non mostrava alcun movimento, veniva scartato perché poteva essere morto o prossimo alla morte. Per iniettare etanolo, un piccolo pezzo di punta della pipetta che conteneva la mosca fissa è stato rimosso per esporre il suo scutello. Un perno di insetto (catalogo #26002-10, Fine Science Tools) è stato inserito tra lo scutello e lo scutello per fare un foro. Una pipetta di vetro (diametro superiore ∼20 μm), è stato inserito nel foro. Poi un iniettore (MINJ-PD, Tritech Research) collegato con la pipetta di vetro è stato acceso per iniettare ∼0.1 μl soluzione di etanolo in volare. La soluzione iniettata era la soluzione di Ringer più il 15% di etanolo.
Dopo 10 minuti, la mosca iniettata è stata ripresa sotto un microscopio confocale verticale con un obiettivo 20× (SP8, Leica). L’acetato di etile è stato diluito in olio minerale all’1% ed erogato con un flusso d’aria ad una velocità di 400 ml/min gorgogliato attraverso l’olio minerale. L’erogazione degli odori è stata effettuata con un regolatore di stimolo CS55 (Syntech), che ha aggiunto l’odore ad un flusso d’aria. Le mosche sono state esposte ad 1-min di aria e poi 3-s odore; non ci sono stati disturbi meccanici durante il passaggio dall’aria all’odore.
Dopo l’imaging, ogni mosca è stata tolta dalla punta della pipetta per controllare la vitalità. La maggior parte delle mosche esposto movimenti delle gambe. Tuttavia, se le zampe di una mosca non hanno mostrato alcun movimento, è stato considerato morto, e i dati sono stati scartati.
Biochimica
Il dominio Munc13-1 C1 nel vettore pGEX-KG è stato gentilmente fornito dal Dr. Josep Rizo (University of Texas Southwestern Medical Center di Dallas, TX). Le mutazioni site-specific nel dominio Munc 13-1 C1 sono state introdotte con la PCR presentando la mutazione in primer oligonucleotidici utilizzando il kit di mutagenesi QuikChange II Site-Directed Mutagenesis (Agilent Technologies). Il dominio Munc 13-1 C1 wild-type o il mutante fuso con il glutatione S-transferasi(GST) sono stati espressi in BL21 DE3 oro Escherichia coli (Agilent Technologies). Munc13.1C1 e il suo mutante E582A sono stati purificati secondo i metodi descritti in precedenza(Das et al., 2013). Il trasferimento di energia di risonanza a fluorescenza (FRET) tra Munc13.1 C1 e dansyl-DAG è stato determinato utilizzando un fluorimetro PTI (Photon Technology Instruments; Pany e Das, 2015). I campioni contenenti Munc13.1C1 (1 μM) e dansyl-DAG (1 μM) in tampone (50 mM Tris, 100 mM NaCl e 5 mM ZnSO4;pH 8) sono stati incubati per 30 minuti a 25°C. Per misurare l’effetto dell’etanolo, le miscele sono state incubate con etanolo (25 e 50 mM) per 30 minuti a 25 ° C. I campioni sono stati poi eccitati a 280 nm, e gli spettri di emissione sono stati registrati da 300 a 550 nm. I massimi di emissione di Munc13.1 C1 e dansyl-DAG sono stati trovati a 337 e 500 nm, rispettivamente. Gli indici FRET relativi sono stati calcolati in base all’intensità della fluorescenza a 500 nm con la formula: [(Fi + Munc13.1C1) – (Fi, -Munc13.1C1)] – [(F0 + Munc13.1C1) – (F0- Munc13.1C1)], dove Fi + Munc13.1C1 e Fi – Munc13.1C1 sono le intensità di Dansyl-DAG in presenza e assenza di Munc13.1C1, rispettivamente, e F0+ Munc13.1C1 e F0- Munc13.1C1 sono le intensità di fluorescenza della soluzione tampone in presenza o assenza di Munc13.1C1, rispettivamente. La variazione delle intensità di fluorescenza per ogni concentrazione di alcol è stata normalizzata utilizzando l’equazione: (1-F/F0) × 100, dove F e F0 sono intensità di dansyl-DAG più Munc13.1C1 in presenza o in assenza di alcol.
Progettazione sperimentale e analisi statistica
Le differenze tra due gruppi sono state testate con test a due code non accoppiate Student’s t; le differenze tra i dati multigruppo sono state testate con ANOVA (trattamento × genotipo) a due vie, seguite da test post hoc Bonferroni-Dunn. I test di Student&rsquo sono stati analizzati nei confronti dei genotipi all’interno di questi dati. Per ogni mosca negli esperimenti di imaging ottico, il rapporto massimo di variazione dell’intensità di fluorescenza prima e dopo la stimolazione sono stati calcolati prima. Poi il rapporto di veicoli a iniezione di mosche e di etanolo a iniezione di mosche è stato analizzato da due code, non accoppiato Student’s t test. Per t test e ANOVA, α = 0,05.
Risultati
Il legame dell’etanolo al dominio C1 inibisce il legame DAG
L’etanolo può influenzare la sedazione legandosi al Munc13-1/Dunc13 e cambiando direttamente l’attività di questi regolatori di adescamento delle vescicole. In precedenza, l’etanolo è stato trovato per legare il residuo E582 nel dominio di legame C1 DAG di Munc13-1(Das et al., 2013). Poiché la distanza tra il residuo di legame dell’etanolo E582 e il sito di legame del DAG, His567, è solo 8,8 A, il legame dell’etanolo al dominio C1 può avere un impatto sul legame del DAG(Das et al., 2013). Per indagare su questa domanda, abbiamo misurato l’effetto dell’etanolo sulla capacità del dominio Munc13-1 C1 di legare i DAG in vivo. FRET tra il dominio C1 e dansyl-DAG è stato utilizzato per quantificare le quantità relative di DAG legati al dominio C1 in vitro. La fluorescenza del dominio C1 a ∼340 nm ha eccitato il dansyl-DAG e l’emissione di dansyl-DAG è stata quantificata a 500 nm (Fig. 1A,B). Nel complesso, la variazione della concentrazione di etanolo e del genotipo del dominio C1 ha avuto un effetto significativo sul legame dansyl-DAG(F(3,14) = 10,321, p < 0,001; genotipo, t = 4,058, p = 0,001). Concentrazioni di etanolo di 25 e 50 mM hanno ridotto significativamente FRET tra il dominio wild-type Munc13-1 C1 e dansyl-DAG(t = 16,97 e t = 12,121, rispettivamente, p < 0,001 per entrambi). Tuttavia, FRET tra il Munc13-1E582A e il dansyl DAG non è stato significativamente alterato da 25 e 50 mM di etanolo(t = 0,439, p = 0,684 e t = 0,781, p = 0,479, rispettivamente). Questa resistenza all’etanolo ha fatto sì che il mutante E582Un dominio C1 era significativamente meno sensibile agli effetti dell’etanolo sia a 25 che a 50 mM di concentrazione rispetto al dominio C1 wild-type(t = 3,68, p = 0,021 e t = 7,21, p = 0,002; Fig. 1C). Quindi, il legame dell’etanolo al dominio C1 riduce l’affinità per il DAG, presumibilmente portando ad una ridotta attività del Munc13-1. Questa inibizione si basa sull’interazione dell’etanolo con il dominio C1 a E582.
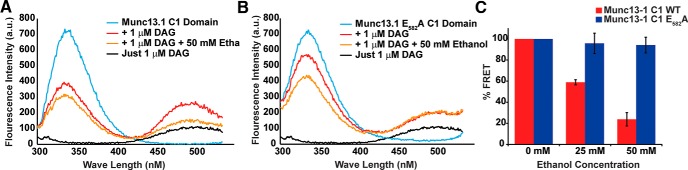
Figura 1.Il legame dell’etanolo al dominio C1 inibisce il legame DAG. AL’emissione spettrale dopo l’eccitazione a 290 nm rivela FRET tra il dominio C1 Munc13-1 e il dansyl-DAG (traccia rossa). Il picco di emissione del dominio C1 raggiunge i picchi a ∼335 nm (traccia ciano), mentre il picco di emissione del dansyl-DAG si trova a 500 nm (traccia nera). Questo FRET è interrotto da 50 mM di etanolo (traccia verde). B, Emissione spettrale della mutazione Munc13-1 E582A dopo l’eccitazione da 290-nm di luce è mostrato. C, Il legame del dansyl-DAG come rivelato dall’emissione di FRET a 500 nm è ridotto sia a 25 che a 50 mM di concentrazione di etanolo. La mutazione del dominio E582A C1 non riesce a legare l’etanolo(Das et al., 2013). L’etanolo non inibisce il legame dansyl-DAG al dominio E582A Munc13-1 C1(n = 3 ciascuno; *p < 0,05, ***p < 0,001). Le barre di errore sono un errore standard della media (SEM).

Figura 1.Il legame dell’etanolo al dominio C1 inibisce il legame DAG. AL’emissione spettrale dopo l’eccitazione a 290 nm rivela FRET tra il dominio Munc13-1 C1 e il dansyl-DAG (traccia rossa). Il picco di emissione del dominio C1 raggiunge i picchi a ∼335 nm (traccia ciano), mentre il picco di emissione del dansyl-DAG si trova a 500 nm (traccia nera). Questo FRET è interrotto da 50 mM di etanolo (traccia verde). B, Emissione spettrale della mutazione Munc13-1 E582A dopo l’eccitazione da 290-nm di luce è mostrato. C, Il legame del dansyl-DAG come rivelato dall’emissione di FRET a 500 nm è ridotto sia a 25 che a 50 mM di concentrazione di etanolo. La mutazione del dominio E582A C1 non riesce a legare l’etanolo(Das et al., 2013). L’etanolo non inibisce il legame dansyl-DAG al dominio E582A Munc13-1 C1(n = 3 ciascuno; *p < 0,05, ***p < 0,001). Le barre di errore sono un errore standard della media (SEM).
L’etanolo inibisce il rilascio di vescicole presinaptiche in Drosophila
Se l’inibizione indotta dall’etanolo dell’attività di Munc13-1 è un meccanismo importante per gli effetti dell’etanolo sull’attività presinaptica, allora l’etanolo dovrebbe avere un impatto sul rilascio delle vescicole sinaptiche in vivo, senza influenzare gli eventi di attivazione presinaptica precedenti. Per esaminare questa previsione, abbiamo misurato l’effetto dell’etanolo sull’attività presinaptica in Drosophila dei neuroni sensoriali olfattivi OR42b (OSN) utilizzando tecniche di fisiologia ottica. I neuroni OR42b sono neuroni colinergici eccitatori che sono fortemente attivati dall’acetato di etile(Hallem e Carlson, 2006). Gli assoni OSN OR42b OSN convergono nei glomeruli DM1(Gao et al., 2000; Couto et al., 2005). La linea Or42b-Gal4 è stata utilizzata per pilotare tre diversi sensori geneticamente codificati: ArcLight per misurare i cambiamenti nella depolarizzazione della membrana(Cao et al., 2013); G-CaMP5 per misurare l’afflusso di Ca2+ nel compartimento presinaptico(Akerboom et al., 2012); e synapto-pHluorin per misurare la fusione delle vescicole sinaptiche(Yuste et al., 2000; Reiff et al., 2005). Queste variazioni di fluorescenza sono state misurate nei glomeruli DM1 del lobo antennali dopo una presentazione in 3-s dell’acetato di etile. Per misurare l’effetto dell’etanolo sui cambiamenti fisiologici nel OR42b OSN, abbiamo iniettato o 0,1 μl veicolo o il 15% di etanolo prima di imaging ogni mosca. L’etanolo iniettato mosche fermato i normali movimenti delle gambe, ed è apparso completamente sedato per un periodo di ∼20 min. Le mosche sono stati tutti ripresi durante questo periodo di sedazione. Veicolo iniettato mosche ha continuato i movimenti delle gambe normali durante tutto il periodo di imaging. Le mosche che non hanno recuperato i movimenti delle gambe dopo 20 minuti sono state escluse dall’analisi.
Le mosche sedate con etanolo non hanno avuto alcun cambiamento rilevabile nelle depolarizzazioni della membrana indotta dall’acetato di etile all’interno dei compartimenti presinaptici di OR42b OSNs rispetto alle mosche ad iniezione veicolare(t = 0,198, p = 0,845; Fig 2A,B). Allo stesso modo, non siamo riusciti a rilevare un cambiamento significativo nell’afflusso di Ca2+ indotto dall’acetato di etile nel compartimento presinaptico OR42b OSN dopo la sedazione con etanolo(t = 0,744, p = 0,464; Fig. 2C,D). Al contrario, una significativa diminuzione dell’acetato di etile ha provocato la fusione delle vescicole sinaptiche nelle mosche sedate con etanolo(t = 4,129, p = 0,0002; Fig 2E,F). Insieme, questi dati che indicano che i livelli inebrianti di etanolo inibiscono la fusione delle vescicole sinaptiche in gran parte indipendente dai potenziali d’azione in arrivo e dal conseguente afflusso di Ca2+ nel compartimento presinaptico. Questi dati sono coerenti con un ruolo per l’inibizione indotta dall’etanolo dell’attività di Dunc13, portando ad una riduzione del rilascio presinaptico. Rimane possibile che l’etanolo possa ancora influenzare l’afflusso di Ca+2 all’interno del compartimento presinaptico in altre scale temporali, come i minuti, ma che non siamo stati in grado di rilevare questo effetto. Munc13-1 migliora la funzione del VGCC presinaptico attraverso interazioni dirette tra questi canali e il dominio Munc13 C2B(Calloway et al., 2015). Quindi, rimane possibile che l’etanolo possa sottilmente inibire il VGCC e l’attività presinaptica inibendo il legame tra Munc13-1 e DAG.
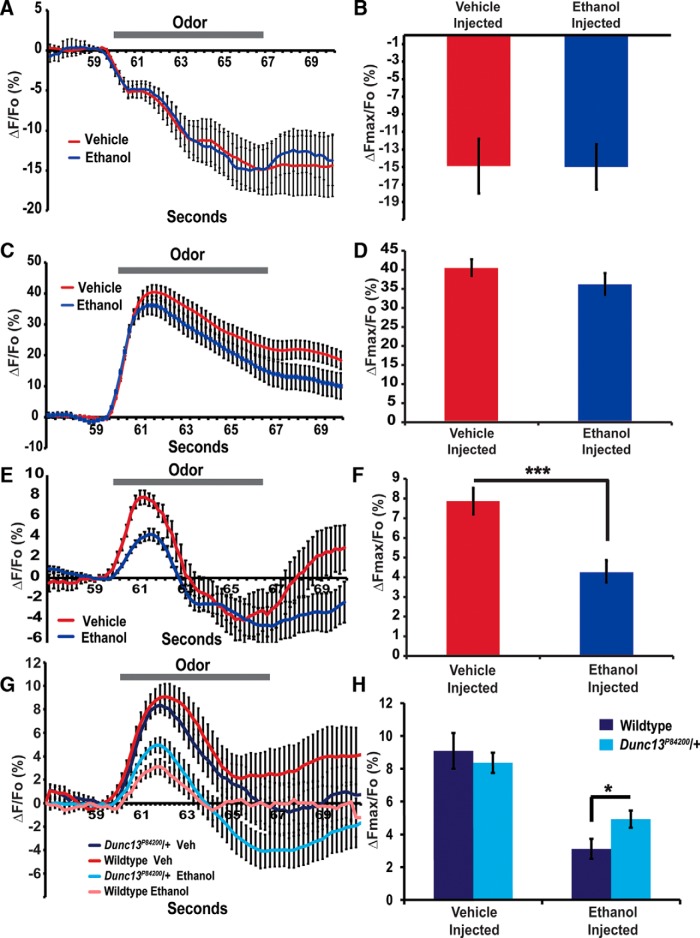
Figura 2.L’etanolo inibisce specificamente il rilascio delle vescicole presinaptiche alle sinapsi eccitatorie. A, BL’attività presinaptica è stata provocata dall’acetato di etile consegnato alle antenne e ripreso all’interno dei glomeruli DM3. Le mosche sono state riprese con ArcLight per misurare la depolarizzazione della membrana, che porta ad una diminuzione della fluorescenza massima (ΔFmax). L’intossicazione dovuta all’iniezione di etanolo non ha avuto alcun impatto sulla depolarizzazione misurata in % ΔFmax/Fo (p > 0, 05, n = 17). C, DLe mosche sono state anche riprese con G-CaMP5 per indicare la concentrazione intracellulare di Ca2+. L’aumento del Ca2+ porta ad un aumento della fluorescenza. L’intossicazione dovuta all’iniezione di etanolo non ha avuto alcun impatto sull’afflusso di Ca2+ misurato in % ΔFmax/Fo (p > 0, 05, n = 15). E, F, Le mosche sono stati ripresi con la pHluorina per mostrare il rilascio della vescicola presinaptica. L’intossicazione dovuta all’iniezione di etanolo ha ridotto significativamente la fusione delle vescicole sinaptiche, misurata in % ΔFmax/Fo (***p < 0, 001, n = 17). G, H, Nelle mosche a iniezione, Dunc13P84200/+ Gli eterozigoti non mostrano una riduzione significativa del rilascio delle vescicole sinaptiche(p > 0,05, n = 19); tuttavia, hanno mostrato una depressione meno indotta da etanolo del rilascio sinaptico (*p < 0,05, n = 25 ), dopo che è stato iniettato il 15% di etanolo. Tutte le barre di errore sono SEM.
Infine, abbiamo chiesto se l’inibizione della fusione delle vescicole presinaptiche in risposta all’etanolo è stata alterata nel Dunc13resistente al comportamento.P84200/+ vola. Il Dunc13P84200 L’allele è un mutante a perdita di funzione con un inserimento dell’elemento P nel locus Dunc13(Aravamudan et al., 1999). Gli omozigoti per questo allele non riescono a visualizzare la neurotrasmissione nella giunzione neuromuscolare embrionale e muoiono in ritardo nell’embriogenesi(Aravamudan et al., 1999). Gli eterozigoti hanno livelli del 4% di Dunc13 mRNA (Daset al., 2013). In questo esperimento, c’è stata una differenza significativa tra i gruppi(F(2,81) = 21.474, p < 0,0001). Come precedentemente mostrato, l’iniezione di etanolo ha diminuito la fusione delle vescicole nel OR42b OSNs suscitato da acetato di etile, tuttavia, il Dunc13P84200/+ le mosche erano meno sensibili a questa inibizione presinaptica rispetto ai controlli wild-type(t = 2,224, p = 0,031; Fig 2G,H). Ingenuo Dunc13P84200/+ eterozigoti sono fisiologicamente più resistenti all’inibizione dell’attività presinaptica dell’etanolo.

Figura 2.L’etanolo inibisce specificamente il rilascio delle vescicole presinaptiche alle sinapsi eccitatorie. A, BL’attività presinaptica è stata provocata dall’acetato di etile consegnato alle antenne e ripreso all’interno dei glomeruli DM3. Le mosche sono state riprese con ArcLight per misurare la depolarizzazione della membrana, che porta ad una diminuzione della fluorescenza massima (ΔFmax). L’intossicazione dovuta all’iniezione di etanolo non ha avuto alcun impatto sulla depolarizzazione misurata in % ΔFmax/Fo (p > 0, 05, n = 17). C, DLe mosche sono state anche riprese con G-CaMP5 per indicare la concentrazione intracellulare di Ca2+. L’aumento del Ca2+ porta ad un aumento della fluorescenza. L’intossicazione dovuta all’iniezione di etanolo non ha avuto alcun impatto sull’afflusso di Ca2+ misurato in % ΔFmax/Fo (p > 0, 05, n = 15). E, F, Le mosche sono stati ripresi con la pHluorina per mostrare il rilascio della vescicola presinaptica. L’intossicazione dovuta all’iniezione di etanolo ha ridotto significativamente la fusione delle vescicole sinaptiche, misurata in % ΔFmax/Fo (***p < 0, 001, n = 17). G, H, Nelle mosche a iniezione, Dunc13P84200/+ Gli eterozigoti non mostrano una riduzione significativa del rilascio delle vescicole sinaptiche(p > 0,05, n = 19); tuttavia, hanno mostrato una depressione meno indotta da etanolo del rilascio sinaptico (*p < 0,05, n = 25 ), dopo che è stato iniettato il 15% di etanolo. Tutte le barre di errore sono SEM.
L’attività di Dunc13 modula la sedazione dell’etanolo
Per esaminare se l’interazione Dunc13-etanolo impatti risposte comportamentali a questo farmaco, abbiamo ulteriormente esaminato l’effetto di ridurre l’attività del Dunc13 sulla sensibilità comportamentale all’etanolo. Dunc13P84200/+ In precedenza era stato mostrato che le mosche mostravano un livello significativamente più alto di autosomministrazione di etanolo(Das et al., 2013). Poiché gli aumenti dell’autosomministrazione di etanolo in Drosophila sono probabilmente una risposta alle proprietà edoniche di questo farmaco(Devineni e Heberlein, 2009; Kaun et al., 2011; Xu et al., 2012), è possibile che l’aumento dell’autosomministrazione nel Dunc13P84200/+ eterozigoti è dovuto ad una differenza ingenua nella sensibilità agli effetti neurali dell’etanolo. Per determinare se l’attività di Dunc13 è coinvolta nell’intossicazione da etanolo, abbiamo esaminato gli eterozigoti per il Dunc13P84200 mutazione in un saggio LOR(van der Linde et al., 2014). Nel saggio LOR, le mosche sono esposte al vapore di etanolo, che entra passivamente attraverso il sistema respiratorio, aumentando la loro concentrazione interna di alcol(van der Linde et al., 2014). Questo porta a un progressivo aumento del numero di mosche che con il tempo perdono il loro riflesso destro. Utilizziamo il T1/2, che è il tempo necessario al 50% delle mosche per perdere il loro riflesso raddrizzante, per confrontare le differenze nel tasso di intossicazione(van der Linde et al., 2014).
Geneticamente riducendo l’attività di Dunc13 si ottiene una ridotta sensibilità agli effetti sedativi dell’etanolo. Il Dunc13P84200/+ gli eterozigoti sono significativamente più resistenti agli effetti sedativi dell’etanolo rispetto ai controlli wild-type(t = 7,246, p < 0,001; Fig. 3A). Questo aumento della resistenza al vapore di etanolo trovato nel Dunc13P84200/+ eterozigoti non era dovuto a differenze nell’assorbimento dell’etanolo(F(4,41) = 9,19, differenza genotipo t = 0,583, p = 0,563; Fig. 3B), o nella velocità con cui gli eterozigoti metabolizzano l’etanolo(F(4,43) = 11,16, differenza di genotipo t = 0,037, p = 0,971; Fig. 3C). Inoltre, guidando l’espressione del Dunc13KK101383 Il transgene RNAi in tutto il sistema nervoso utilizzando il driver n-Syb-Gal4, ha anche ridotto drasticamente la sensibilità alla sedazione dell’etanolo(F(2,33) = 72, 73, p < 0,0001; Fig. 3D). Il LOR T1/2 per il genotipo sperimentale, con il Dunc13 RNAi guidato in tutto il sistema nervoso, era significativamente più lungo sia del controllo del driver Gal4(t = 7,36, p < 0,0001) che dei genotipi di controllo del Dunc13 RNAi (t = 19,18, p < 0,0001). Le mosche erano vitali, il che ha suggerito un parziale abbattimento di Dunc13 nel tessuto neurale. Infine, abbiamo indotto l’espressione del Dunc13JF02440 RNAi transgene post-sviluppo nei neuroni con i transgeni elav-Gal4 e Gal80ts20(McGuire et al., 2003). Ci sono state differenze significative tra i gruppi in questo esperimento(F(3,31) = 5, 191, p < 0,005). Un’induzione di 24 ore a 30°C dell’espressione di Dunc13 RNAi porta anche ad una significativa diminuzione della sensibilità alla sedazione dell’etanolo rispetto al controllo del genotipo (t = 2,95, p = 0,011; Fig. 3E). Quindi, riducendo l’attività di Dunc13 attraverso la mutazione o utilizzando due linee di RNAi non sovrapposte espresse nel sistema nervoso da due driver neuronali indipendenti, tutti i risultati in mosche che sono più resistenti agli effetti sedativi dell’etanolo. L’indipendenza di questi driver e delle linee RNAi fornisce una forte indicazione che la riduzione dell’attività di Dunc13, simile a quella di Dunc13P84200/+ mosche aploinsufficienti, produce una resistenza agli effetti sedativi dell’etanolo. La capacità del Dunc13indottoJF02440 L’espressione dell’RNAi per diminuire la sensibilità alla sedazione dell’etanolo suggerisce inoltre che questo cambiamento deriva da una risposta fisiologica piuttosto che da una risposta di sviluppo alla ridotta attività di Dunc13, tuttavia, il transgene RNAi è stato espresso per 2 d in questo esperimento, che permetterebbe una risposta omeostatica alla ridotta attività di Dunc13.
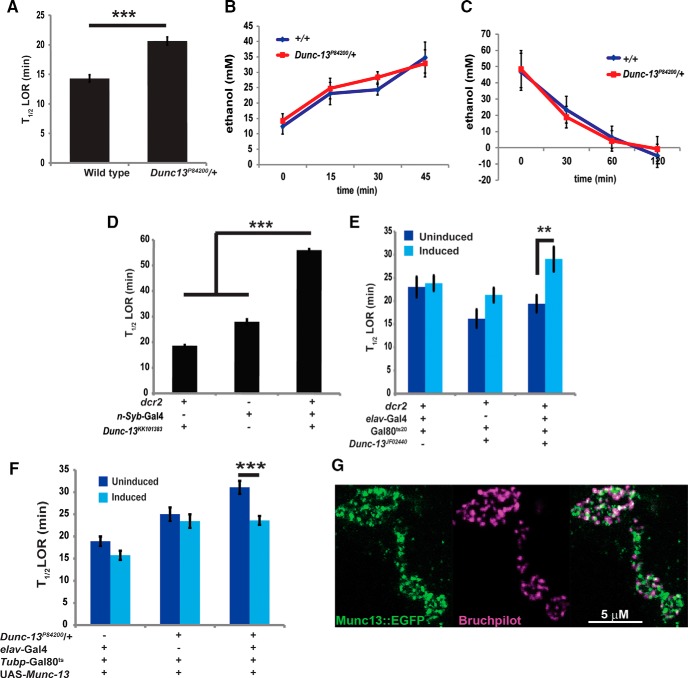
Figura 3.Una riduzione dell’attività Dunc13 porta ad una maggiore resistenza alla sedazione dell’etanolo. AIl Dunc13P84200/+ eterozigoti richiedono un tempo maggiore per raggiungere il 50% di LOR (T1/2 LOR) livelli di riflesso (***p < 0,001, n = 17). B, La concentrazione di etanolo è stata determinata in Dunc13P84200/+ e mosche di controllo esposte al 50% di vapore di etanolo per 0, 15, 30, o 45 min; non sono state riscontrate differenze significative(p > 0,05, n = 6). C, La capacità di Dunc13P84200/ + e le mosche di controllo per metabolizzare l’etanolo è stato determinato esponendo prima le mosche al vapore di etanolo per 45 minuti, e poi misurando l’etanolo rimanente nelle mosche 0, 30, 60, e 120 minuti dopo l’esposizione. Non sono state rilevate differenze significative nel metabolismo dell’etanolo in ogni punto temporale(t = 0,037, p > 0,05, n = 6). D, L’espressione neurale del Dunc13KK101383 Il transgene RNAi ha portato ad un LOR T1/2 significativamente più lento rispetto ai controlli del genotipo (***p < 0,05, n = 10). E, L’espressione neurale indotta del Dunc13JF02440 I transgeni RNAi hanno anche portato ad un LOR T1/2 significativamente più lento rispetto al controllo del genotipo interno(p < 0,01, n = 8). L’induzione è stata realizzata con un trattamento termico di 24 ore a 30°C, seguito da un periodo di recupero di 3 ore a temperatura ambiente. F, L’induzione dell’espressione di un cDNA di tipo selvaggio Munc13-1 cDNA per 48 h ha portato ad una significativa diminuzione di LOR per il Dunc13P84200/+ vola (***p = 0,001, N = 9). L’induzione è stata realizzata con un trattamento termico di 48 h, 30°C, seguito da un periodo di recupero di 3 h a temperatura ambiente. GMunc13-1::EGFP è colocalizzato con Bruchpilot, una proteina localizzata in zone attive presinaptiche, nel compartimento presinaptico della giunzione muscolare neurale larvale. Tutte le barre di errore sono SEM.
Abbiamo inoltre verificato il requisito per i livelli wild-type di Dunc13 per la normale sensibilità alla sedazione salvando l’aploinsufficienza del Dunc13P84200/+ eterozigoti. In precedenza, avevamo dimostrato che un ratto Munc13-1::EGFP cDNA era in grado di salvare il Dunc13P84200/+ aumento del fenotipo di autosomministrazione dell’etanolo quando l’espressione è stata indotta in tutto il sistema nervoso(Das et al., 2013). Qui, abbiamo esaminato se Munc13-1::EGFP espressione potrebbe anche integrare il Dunc13P84200 haploinsufficienza nella sedazione di etanolo(F(3,56) = 9,875, p < 0,0001). L’espressione indotta di questo Munc13-1::EGFP transgene (48 h a 30°C) ha ridotto il fenotipo di sensibilità alla sedazione con etanolo di Dunc13P84200/+ femmine(t = 3,90, p = 0,001; Fig. 3G). L’attività di Munc13-1 può quindi integrare funzionalmente l’attività di Dunc13 necessaria per la normale sensibilità alla sedazione dell’etanolo. Questi dati indicano inoltre che la sensibilità alla sedazione dell’etanolo è modulata dall’attività di Dunc13/Munc13-1.
Abbiamo poi esaminato se Munc13-1::EGFP potrebbe anche salvare la letalità di Dunc13P84200 omozigoti. Due diversi UAS-Munc13-1:: I transgeni dell’EGFP non sono riusciti a salvare la tardiva letalità embrionale di Dunc13P84200 quando è guidato da Tubp-Gal4, elav-Gal4, o n-Syb-Gal4, suggerendo che Munc13-1 potrebbe non essere in grado di completare completamente le funzioni neurali di Dunc13 (oltre 300 progenie di ogni genotipo, senza alcun omozigote Dunc13vitaleP84200progenie adulta). Una possibile ragione per la mancanza di una completa integrazione potrebbe essere dovuta a problemi nel traffico della proteina relativamente grande Munc13-1::EFGP al compartimento presinaptico. Per vedere se la proteina Munc13-1::GFP è stato localizzato al compartimento presinaptico in Drosophila, abbiamo esaminato la giunzione neuromuscolare delle larve del3 ° istar con il genotipo: UAS-Munc13-1::GFP/+; nsyb-Gal4/+. Munc13-1::EGFP si trovava all’interno del compartimento presinaptico in puncta. Bruchpilot, una proteina localizzata in zone attive presinaptiche(Wagh et al., 2006), è stata trovata in gran parte colocalizzata con Munc13-1::EGFP, anche se esistono alcuni Munc13-1::EGFP puncta che non si sovrappongono ai segnali di Bruchpilot e viceversa(Fig. 3H). Quindi, il Munc13-1 è stato trafficato in compartimenti presinaptici.

Figura 3.Una riduzione dell’attività di Dunc13 porta ad una maggiore resistenza alla sedazione con etanolo. AIl Dunc13P84200/+ eterozigoti richiedono un tempo maggiore per raggiungere il 50% di LOR (T1/2 LOR) livelli di riflesso (***p < 0,001, n = 17). B, La concentrazione di etanolo è stata determinata in Dunc13P84200/+ e mosche di controllo esposte al 50% di vapore di etanolo per 0, 15, 30, o 45 min; non sono state riscontrate differenze significative(p > 0,05, n = 6). C, La capacità di Dunc13P84200/ + e le mosche di controllo per metabolizzare l’etanolo è stato determinato esponendo prima le mosche al vapore di etanolo per 45 minuti, e poi misurando l’etanolo rimanente nelle mosche 0, 30, 60, e 120 minuti dopo l’esposizione. Non sono state rilevate differenze significative nel metabolismo dell’etanolo in ogni punto temporale(t = 0,037, p > 0,05, n = 6). D, L’espressione neurale del Dunc13KK101383 Il transgene RNAi ha portato ad un LOR T1/2 significativamente più lento rispetto ai controlli del genotipo (***p < 0,05, n = 10). E, L’espressione neurale indotta del Dunc13JF02440 I transgeni RNAi hanno anche portato ad un LOR T1/2 significativamente più lento rispetto al controllo del genotipo interno(p < 0,01, n = 8). L’induzione è stata realizzata con un trattamento termico di 24 ore a 30°C, seguito da un periodo di recupero di 3 ore a temperatura ambiente. F, L’induzione dell’espressione di un cDNA di tipo selvaggio Munc13-1 cDNA per 48 h ha portato ad una significativa diminuzione di LOR per il Dunc13P84200/+ vola (***p = 0,001, N = 9). L’induzione è stata realizzata con un trattamento termico di 48 h, 30°C, seguito da un periodo di recupero di 3 h a temperatura ambiente. GMunc13-1::EGFP è colocalizzato con Bruchpilot, una proteina localizzata in zone attive presinaptiche, nel compartimento presinaptico della giunzione muscolare neurale larvale. Tutte le barre di errore sono SEM.
Discussione
Il lavoro che presentiamo qui identifica un nuovo meccanismo presinaptico per modulare la sensibilità alla sedazione dell’etanolo. L’etanolo si lega al dominio C1 di Munc13-1(Das et al., 2013), che inibisce il legame DAG in vitro. Questa inibizione si verifica all’interno del range fisiologicamente intossicante di 25-50 mM di etanolo (Majchrowicz, 1975). Inibendo il legame DAG si riduce l’attività delle proteine Unc13 riducendo la localizzazione della membrana di questa proteina, portando ad una maggiore barriera energetica per la fusione delle vescicole e una riduzione del rilascio delle vescicole sinaptiche(Lackner et al., 1999; Basu et al., 2007). Abbiamo trovato utilizzando in vivo approcci ottici fisiologici in Drosophila che i livelli di etanolo inebrianti non hanno influenzato in modo significativo né la depolarizzazione della membrana né l’afflusso di Ca2 + all’interno del compartimento presinaptico dei neuroni OR42b attivati, ma la fusione delle vescicole sinaptiche è stata drammaticamente inibita nei neuroni da questi livelli inebrianti di etanolo. Anche se i nostri risultati non mostrano un effetto significativo sui livelli di Ca2+ presinaptici dopo l’alcol, non possiamo escludere che la localizzazione dei microdomini di Ca2+ non sia stata influenzata dall’etanolo. Tuttavia, i nostri risultati di imaging indicano che l’etanolo agisce per inibire il rilascio delle vescicole sinaptiche a valle dell’afflusso di Ca2+ in tensione, il che è coerente con l’inibizione dell’attività presinaptica da parte dell’etanolo attraverso la riduzione del legame del DAG a Dunc13.
Per verificare un ruolo per Dunc13 nella sensibilità fisiologica e comportamentale all’etanolo, abbiamo esaminato le mosche che avevano ridotto i livelli di attività di Dunc13. Una semplice previsione sarebbe che queste mosche geneticamente sensibilizzate, avendo già perso un po’ di attività di Dunc13, sarebbero più sensibili agli effetti dell’etanolo. Tuttavia, le mosche geneticamente sensibilizzate erano fisiologicamente e comportamentalmente resistenti alle concentrazioni sedative di etanolo. Il Dunc13P84200/+ eterozigoti mostrato una ridotta sensibilità agli effetti acuti dell’etanolo sulla fusione delle vescicole sinaptiche negli OSN OR42b, e queste mosche hanno mostrato anche una ridotta sensibilità comportamentale alla sedazione dell’etanolo. La ridotta sensibilità comportamentale all’etanolo nel Dunc13P84200/+ eterozigoti è stato parzialmente invertito dall’espressione neurale di Dunc13 o di Munc13-1 cDNA, indicando che il fenotipo è stato prodotto da un’aploinsufficienza di Dunc13. Inoltre, due linee di Dunc13 RNAi indipendenti e non sovrapposte mostravano anche una ridotta sensibilità alla sedazione. Insieme questi dati indicano che la riduzione dei livelli di Dunc13 riduce la risposta ingenua agli effetti sedativi dell’etanolo.
Il complemento funzionale di Munc13-1 per l’aploinsufficienza di Dunc13 nel test LOR ma non per la vitalità del Dunc13P84200 omozigoti indica una funzione almeno parzialmente conservata tra questi ortologi in Drosophila. Ci possono essere diverse ragioni per l’incapacità di un cDNA Munc13-1 di salvare la letalità dell’omozigote Dunc13P84200 mosche, comprese le differenze nell’attività funzionale, nei livelli di espressione e nella localizzazione delle proteine. Munc13-1 contiene diversi domini funzionali identificati: dominio C1 per il legame DAG(Betz et al., 1998), dominio CBS per il legame della calmodulina(Dimova et al., 2009), dominio C2A per l’eterodimerizzazione con RIM e la regolazione dei successivi passaggi di docking e priming delle vescicole(Betz et al., 2001; Camacho et al., 2017), dominio C2B per il legame del fosfolipide e dei VGCC(Shin et al., 2010; Calloway et al., 2015), dominio C2C, che può legare la membrana plasmatica(Rizo e Südhof, 1998), e dominio MUN per il legame della sintassiina (Liet al., 2011). Anche se i domini C1, CBS, C2B, C2B, C2C e MUN dei mammiferi unc-13 e Drosophila unc-13 sono altamente conservati, Dunc13 manca un dominio C2A conservato(Aravamudan et al., 1999). Attualmente non è chiaro se la proteina Dunc13 interagisce fisicamente con il RIM nelle vescicole ancorate, ma poiché si tratta di un’interazione centrale per l’adescamento delle vescicole, è probabile che questa interazione sia conservata in Drosophila. È interessante notare che il dominio C2A e le sequenze N-terminali vicine sono necessarie per l’isoforma L di C. elegans unc-13 per essere correttamente localizzato nella zona attiva(Hu et al., 2013; Zhou et al., 2013). Abbiamo trovato che il Munc13-1::EGFP è stato localizzato a puncta nella giunzione muscolare neurale larvale larvale, anche se non completamente sovrapposto con la proteina Bruchpilot zona attiva.
In che modo una riduzione dell’attività di Dunc13 porta ad una resistenza agli effetti sedativi dell’etanolo?
Il Dunc13P84200/+ l’aploinsufficienza e le linee di RNAi Dunc13 neurally-espresse probabilmente imitano gli effetti iniziali di concentrazioni intossicanti di etanolo su questa proteina riducendo geneticamente la sua attività. La riduzione genetica o farmacologica dell’attività di Dunc13 dovrebbe generare una riduzione diffusa della dimensione del pool facilmente rilasciabile (RRP; Augustin et al., 1999). Questa riduzione dell’RRP produrrebbe una depressione sinaptica, innescando una risposta omeostatica nelle sinapsi colpite(Davis e Goodman, 1998; Frank, 2014). Il lavoro della giunzione muscolare neurale Drosophila ha dimostrato due meccanismi convergenti per l’aumento omeostatico dell’attività presinaptica: il potenziamento dell’afflusso di Ca2+ attraverso i VGCC e l’aumento del RRP(Frank et al., 2009; Müller et al., 2012). Nelle sinapsi centrali dei vertebrati sono stati scoperti simili meccanismi omeostatici presinaptici in cui l’inibizione dell’attività porta ad aumenti sia dell’afflusso di Ca2+ presinaptico che del rilascio delle vescicole sinaptiche(Zhao et al., 2011). La parte presinaptica di questo processo può essere in gran parte guidata da cambiamenti nell’attività della chinasi ciclo-dipendente 5 (CDK5)(Kim e Ryan, 2010). La soppressione dell’attività sinaptica riduce l’attività della CDK5, che a sua volta promuove l’afflusso di Ca2+ presinaptica e aumenta il pool di vescicole a riposo disponibile per la promozione nel RRP(Kim e Ryan, 2010).
I cambiamenti omeostatici nell’efficacia sinaptica causati dall’etanolo che riduce l’attività di Dunc13 possono imitare la tolleranza. La resistenza e la tolleranza all’etanolo condividono una risposta ridotta a questo farmaco, ma si differenziano per la loro ontogenesi. La tolleranza è una ridotta risposta all’alcol causata dalla precedente esposizione a questo farmaco, mentre la resistenza si riferisce a una differenza innata nella sensibilità all’alcol(Ghezzi e Atkinson, 2011; Rothenfluh et al., 2014). La Drosophila melanogaster subisce una tolleranza funzionale se esposta ad alti livelli di alcol, ma non sviluppa tolleranza metabolica(Scholz et al., 2000). Questa tolleranza funzionale nella Drosophila può essere di lunga durata e dipendere da cambiamenti epigenetici nell’espressione genica e nella sintesi di nuove proteine(Berger et al., 2004; Cowmeadow et al., 2006; Engel et al., 2016).
Ci sono state crescenti evidenze da Drosophila che indicano che lo sviluppo della tolleranza funzionale è innescato da cambiamenti nell’attività presinaptica. Alleli condizionali nel gene della dinamina shibire(shi) possono bloccare completamente la formazione di una rapida tolleranza funzionale(Krishnan et al., 2012). A temperature non permissive, la dominante negativa shits gli alleli bloccano il riciclaggio delle vescicole sinaptiche con conseguente esaurimento del pool vescicolare e perdita di attività presinaptica, nonché altri eventi endocitosi-dipendenti, come l’internalizzazione dei recettori(Kosaka e Ikeda, 1983). Quando questo blocco nel riciclaggio delle vescicole è stato indotto durante la sedazione, c’è stato un fallimento nella produzione di tolleranza, mentre se si è verificato dopo l’esposizione iniziale all’abbuffata, non c’è stato alcun impatto sulla tolleranza, indicando un ruolo per shi nell’induzione della tolleranza(Krishnan et al., 2012). È interessante notare che il blocco dell’attività neurale durante la sedazione con un paraliticots allele condizionale in un canale di sodio in tensione o alleli sensibili alla temperatura della proteina NSF comatosa non ha bloccato la formazione di tolleranza funzionale. Questi dati suggeriscono che la dinamica nel pool di vescicole presinaptiche durante la sedazione con etanolo, e non i cambiamenti nell’attività presinaptica di per sé, sono necessari per la formazione della tolleranza(Krishnan et al., 2012).
Le esposizioni all’alcool che inducono la tolleranza funzionale comportano anche variazioni durature dei livelli di diverse proteine presinaptiche necessarie per l’induzione della tolleranza funzionale(Ghezzi et al., 2013). Alcuni di questi cambiamenti trascrizionali necessari per la tolleranza cronica richiedono l’attività della deacetilasi dell’istone Sir2(Engel et al., 2016). Questi cambiamenti epigenetici Sir2-dipendenti regolano l’attività delle proteine presinaptiche, tra cui la sinapsi e probabilmente anche il canale Ca2+ a tensione di cacofonia e la cdk5 chinasi, che sono noti per avere ruoli importanti nelle risposte omeostatiche presinaptiche alla ridotta attività sinaptica(Davis, 2013; Frank, 2014). I mutanti in sinapsi sono difettosi nella formazione della tolleranza, ma non nella sedazione ingenua (Godenschwegeet al., 2004; Engel et al., 2016). Inoltre, per lo sviluppo della tolleranza funzionale è necessario aumentare il livello del canale BK slowpoke(Cowmeadow et al., 2005; Cowmeadow et al., 2006; Li et al., 2013). L’aumento del slowpoke aumenta la capacità di sparare con la frequenza di noleggio(Ghezzi et al., 2010). Questo aumento della cottura ad alta frequenza può invertire la depressione sinaptica facilitando la capacità di Ca+2 di aumentare la velocità di rifornimento del RRP(Wang e Kaczmarek, 1998).
In sintesi, ci sono forti prove di specifici cambiamenti omeostatici nell’attività presinaptica alla base della tolleranza all’etanolo, e un innesco iniziale per questi cambiamenti può essere l’etanolo che inibisce il legame del DAG al dominio C1 di Dunc13. Una previsione verificabile da questa ipotesi per l’inibizione di Dunc13 come evento iniziale nella formazione della tolleranza è che composti o mutazioni, come il Munc13-1 E582A, che inibiscono il legame dell’etanolo al dominio C1, ridurranno la formazione della tolleranza(Das et al., 2013). Tuttavia, affinché questi reagenti siano utili per chiarire il ruolo dell’inibizione di Dunc13 nella formazione della tolleranza, devono avere un effetto limitato sull’attività di Dunc13/Munc13-1 in assenza di etanolo. Altrimenti possono portare agli stessi cambiamenti omeostatici negli animali ingenui che si trovano dopo l’esposizione a livelli intossicanti di etanolo.
References
- Optimization of a GCaMP calcium indicator for neural activity imaging. J Neurosci. 2012; 32:13819-13840. DOI | PubMed
- Drosophila UNC-13 is essential for synaptic transmission. Nat Neurosci. 1999; 2:965-971. DOI | PubMed
- Munc13-1 is essential for fusion competence of glutamatergic synaptic vesicles. Nature. 1999; 400:457. DOI | PubMed
- Munc13-1 C1 domain activation lowers the energy barrier for synaptic vesicle fusion. J Neurosci. 2007; 27:1200-1210. DOI | PubMed
- Rapid and chronic: two distinct forms of ethanol tolerance in Drosophila. Alcohol Clin Exp Res. 2004; 28:1469-1480. PubMed
- Direct interaction of the rat unc-13 homologue Munc13-1 with the N terminus of syntaxin. J Biol Chem. 1997; 272:2520-2526. DOI | PubMed
- Munc13-1 is a presynaptic phorbol ester receptor that enhances neurotransmitter release. Neuron. 1998; 21:123-136. DOI | PubMed
- Functional interaction of the active zone proteins Munc13-1 and RIM1 in synaptic vesicle priming. Neuron. 2001; 30:183-196. DOI | PubMed
- An optimized transgenesis system for Drosophila using germ-line-specific phiC31 integrases. Proc Natl Acad Sci USA. 2007; 104:3312-3317. DOI | PubMed
- An alcohol-sensing site in the calcium- and voltage-gated, large conductance potassium (BK) channel. Proc Natl Acad Sci USA. 2014; 111:9313-9318. DOI | PubMed
- The active-zone protein Munc13 controls the use-dependence of presynaptic voltage-gated calcium channels. Elife. 2015; 4
- Heterodimerization of Munc13 C2A domain with RIM regulates synaptic vesicle docking and priming. Nat Commun. 2017; 8:15293. DOI | PubMed
- Genetically targeted optical electrophysiology in intact neural circuits. Cell. 2013; 154:904-913. DOI | PubMed
- Molecular, anatomical, and functional organization of the Drosophila olfactory system. Curr Biol. 2005; 15:1535-1547. DOI | PubMed
- The slowpoke gene is necessary for rapid ethanol tolerance in Drosophila. Alcohol Clin Exp Res. 2005; 29:1777-1786. PubMed
- Ethanol tolerance caused by slowpoke induction in Drosophila. Alcohol Clin Exp Res. 2006; 30:745-753. DOI | PubMed
- The pre-synaptic Munc13-1 binds alcohol and modulates alcohol self-administration in Drosophila. J Neurochem. 2013; 126:715-726. DOI | PubMed
- A central role of the BK potassium channel in behavioral responses to ethanol in C. elegans. Cell. 2003; 115:655-666. PubMed
- Homeostatic signaling and the stabilization of neural function. Neuron. 2013; 80:718-728. DOI | PubMed
- Synapse-specific control of synaptic efficacy at the terminals of a single neuron. Nature. 1998; 392:82-86. DOI | PubMed
- Conserved single residue in the BK potassium channel required for activation by alcohol and intoxication in C. elegans. J Neurosci. 2014; 34:9562-9573. DOI | PubMed
- Preferential ethanol consumption in Drosophila models features of addiction. Curr Biol. 2009; 19:2126-2132. DOI | PubMed
- Cellular and molecular neuroscience of alcoholism. Physiol Rev. 1997; 77:1-20. DOI | PubMed
- Endophenotypes successfully lead to gene identification: results from the collaborative study on the genetics of alcoholism. Behav Genet. 2006; 36:112-126. DOI | PubMed
- Structural insights into the calmodulin-Munc13 interaction obtained by cross-linking and mass spectrometry. Biochemistry. 2009; 48:5908-5921. DOI | PubMed
- Sir2/Sirt1 links acute inebriation to presynaptic changes and the development of alcohol tolerance, preference, and reward. J Neurosci. 2016; 36:5241-5251. DOI | PubMed
- The syntaxin binding protein 1 gene (Stxbp1) is a candidate for an ethanol preference drinking locus on mouse chromosome 2. Alcohol Clin Exp Res. 2005; 29:708-720. PubMed
- Homeostatic plasticity at the Drosophila neuromuscular junction. Neuropharmacology. 2014; 78:63-74. DOI | PubMed
- A presynaptic homeostatic signaling system composed of the Eph receptor, ephexin, Cdc42, and Ca V 2.1 calcium channels. Neuron. 2009; 61:556-569. DOI | PubMed
- Convergent projections of Drosophila olfactory neurons to specific glomeruli in the antennal lobe. Nat Neurosci. 2000; 3:780-785. DOI | PubMed
- Homeostatic control of neural activity: a Drosophila model for drug tolerance and dependence. Int Rev Neurobiol. 2011; 99:23-50. DOI | PubMed
- BK channels play a counter-adaptive role in drug tolerance and dependence. Proc Natl Acad Sci USA. 2010; 107:16360-16365. DOI | PubMed
- Alcohol-induced histone acetylation reveals a gene network involved in alcohol tolerance. PLoS Genet. 2013; 9:e1003986. DOI | PubMed
- Flies lacking all synapsins are unexpectedly healthy but are impaired in complex behaviour. European Journal of Neuroscience. 2004; 20(3):611-622. PubMed
- UNC-18 modulates ethanol sensitivity in Caenorhabditis elegans. Mol Biol Cell. 2009; 20:43-55. DOI | PubMed
- Coding of odors by a receptor repertoire. Cell. 2006; 125:143-160. DOI | PubMed
- Ethanol’s molecular targets. Sci Signal. 2008; 1:re7. DOI | PubMed
- UNC-13L, UNC-13S, and Tomosyn form a protein code for fast and slow neurotransmitter release in Caenorhabditis elegans. Elife. 2013; 2:e00967. DOI | PubMed
- Loss of RAB-3/A in Caenorhabditis elegans and the mouse affects behavioral response to ethanol. Genes Brain Behav. 2008; 7:669-676. DOI | PubMed
- A Drosophila model for alcohol reward. Nat Neurosci. 2011; 14:612-619. DOI | PubMed
- CDK5 serves as a major control point in neurotransmitter release. Neuron. 2010; 67:797-809. DOI | PubMed
- Cellular and molecular mechanisms of drug dependence. Science. 1988; 242:715-723. PubMed
- Possible temperature‐dependent blockage of synaptic vesicle recycling induced by a single gene mutation in Drosophila. Dev Neurobiol. 1983; 14:207-225. DOI
- A role for dynamin in triggering ethanol tolerance. Alcohol Clin Exp Res. 2012; 36:24-34. DOI | PubMed
- Facilitation of synaptic transmission by EGL-30 G q α and EGL-8 PLCβ: DAG binding to UNC-13 is required to stimulate acetylcholine release. Neuron. 1999; 24:335-346. DOI | PubMed
- The crystal structure of a Munc13 C-terminal module exhibits a remarkable similarity to vesicle tethering factors. Structure. 2011; 19:1443-1455. DOI | PubMed
- A DNA element regulates drug tolerance and withdrawal in Drosophila. PLoS One. 2013; 8:e75549. DOI | PubMed
- The drunken synapse: studies of alcohol related disorders. Klewer Academic/Plenum Publishing Corp: New York; 1999.
- High-frequency firing helps replenish the readily releasable pool of synaptic vesicles. Nature. 1998; 394:384. DOI | PubMed
- Induction of physical dependence upon ethanol and the associated behavioral changes in rats. Psychopharmacologia. 1975; 43:245-254. PubMed
- Ethanol selectively inhibits enhanced vesicular release at excitatory synapses: real-time visualization in intact hippocampal slices. Alcohol Clin Exp Res. 2004; 28:143-152. DOI | PubMed
- Genetic factors influencing alcohol dependence. Br J Pharmacol. 2008; 154:275-287. DOI | PubMed
- Spatiotemporal rescue of memory dysfunction in Drosophila. Science. 2003; 302:1765-1768. DOI | PubMed
- RIM controls homeostatic plasticity through modulation of the readily-releasable vesicle pool. J Neurosci. 2012; 32:16574-16585. DOI | PubMed
- RhoGAP18B isoforms act on distinct Rho-family GTPases and regulate behavioral responses to alcohol via cofilin. PLoS One. 2015; 10:e0137465. DOI | PubMed
- Alcohol binding in the C1 (C1A+C1B) domain of protein kinase C epsilon. Biochim Biophys Acta. 2015; 1850:2368-2376. DOI | PubMed
- In vivo performance of genetically encoded indicators of neural activity in flies. J Neurosci. 2005; 25:4766-4778. PubMed
- Beta phorbol ester- and diacylglycerol-induced augmentation of transmitter release is mediated by Munc13s and not by PKCs. Cell. 2002; 108:121-133. DOI | PubMed
- C2-domains, structure and function of a universal Ca2+-binding domain. J Biol Chem. 1998; 273:15879-15882. PubMed
- The synaptic vesicle release machinery. Annu Rev Biophys. 2015; 44:339-367. DOI | PubMed
- New series of Drosophila expression vectors suitable for behavioral rescue. Biotechniques. 1999; 27:54-56. PubMed
- Neurobiology of alcohol dependence. Elsevier: New York; 2014.
- Immunolocalization of BK channels in hippocampal pyramidal neurons. Eur J Neurosci. 2006; 24:442-454. DOI | PubMed
- Endophenotypes for alcohol use disorder: an update on the field. Curr Addict Rep. 2015; 2:76-90. DOI | PubMed
- Functional ethanol tolerance in Drosophila. Neuron. 2000; 28:261-271. PubMed
- Biological markers: metabolism and acute reactions to alcohol in sons of alcoholics. Pharmacol Biochem Behav. 1980; 13:9-16. DOI
- Alcohol sensitivity and dependence. EXS. 1994; 71:341-348. PubMed
- Alcohol challenges in young men from alcoholic pedigrees and control families: a report from the COGA project. J Stud Alcohol. 1996; 57:368-377. PubMed
- Munc13 C2B domain is an activity-dependent Ca2+ regulator of synaptic exocytosis. Nat Struct Mol Biol. 2010; 17:280-288. DOI | PubMed
- Drosophila homer is required in a small set of neurons including the ellipsoid body for normal ethanol sensitivity and tolerance. J Neurosci. 2007; 27:4541-4551. DOI | PubMed
- The FlyBar: administering alcohol to flies. J Vis Exp. 2014.
- Bruchpilot, a protein with homology to ELKS/CAST, is required for structural integrity and function of synaptic active zones in Drosophila. Neuron. 2006; 49:833-844. DOI | PubMed
- The propensity for consuming ethanol in Drosophila requires rutabaga adenylyl cyclase expression within mushroom body neurons. Genes Brain Behav. 2012; 11:727-739. DOI | PubMed
- Synapto-pHluorins: chimeras between pH-sensitive mutants of green fluorescent protein and synaptic vesicle membrane proteins as reporters of neurotransmitter release. Methods Enzymol. 2000; 327:522-546. PubMed
- Presynaptic inhibition of gamma lobe neurons is required for olfactory learning in Drosophila. Curr Biol. 2013; 23:2519-2527. DOI | PubMed
- Homeostatic synaptic plasticity through changes in presynaptic calcium influx. J Neurosci. 2011; 31:7492-7496. DOI | PubMed
- Position of UNC-13 in the active zone regulates synaptic vesicle release probability and release kinetics. Elife. 2013; 2:e01180. DOI | PubMed
Fonte
Xu S, Pany S, Benny K, Tarique K, al-Hatem O, et al. (2018) Ethanol Regulates Presynaptic Activity and Sedation through Presynaptic Unc13 Proteins in . eNeuro 5(3): ENEURO.0125-18.2018. https://doi.org/10.1523/ENEURO.0125-18.2018





