Abstract
Introduzione
La tubercolosi (TBC) è un problema di salute globale, con due milioni di vittime ogni anno (OMS, 2015b). La tubercolosi è la più antica malattia infettiva umana conosciuta, eppure non sono disponibili un vaccino o una terapia efficace e affidabile. L’unico vaccino impiegato, il Bacillus Calmette Guerin (BCG), è stato sviluppato nel 1921, ma non riesce a proteggere dalla TBC polmonare adulta (Fine, 1989, 1995; Udani, 1994; Colditz et al., 1995; Brewer, 2000; Simona e Traian, 2013; OMS, 2015a). La terapia attuale per la TBC, adottata come “Trattamento a breve termine (DOTS), riconosciuto a livello internazionale, consiste in antibiotici mutiple toxic e comporta un lungo regime associato a un rischio significativo per la generazione di organismi resistenti ai farmaci (Davies, 1996; Byrd e Davis, 2007). La maggior parte dei Paesi, indipendentemente dal loro status socioeconomico, sono minacciati dall’attacco di ceppi multipli ed estremamente resistenti ai farmaci (MDR e XDR) di Mycobacterium tuberculosis(M.tb; Byrd e Davis, 2007; Davies, 1996). Inoltre, questi antibiotici mostrano una tossicità epatica e immunitaria, con il potenziale di causare epatiti e di eliminare le cellule T specifiche dell’antigene (Fountain et al., 2005; Cox et al., 2008). Quest’ultima complicazione può portare a un’ipersuscettibilità alla riattivazione della malattia e alla reinfezione dopo il trattamento (Iseman, 1993; Cox et al., 2008). Pertanto, una strategia terapeutica alternativa che eviti queste limitazioni è urgentemente necessaria per combattere questo organismo mortale.
In seguito all’infezione, il sistema immunitario dell’ospite confina tipicamente l’organismo e solo una frazione (~10%) degli individui infettati da M.tb progredisce verso la malattia della TBC (Flynn e Chan, 2001). Sia i topi che gli esseri umani con difetti genetici nella segnalazione di IFN-γ sono altamente suscettibili alle malattie micobatteriche (Flynn e Chan, 2001) . È ormai assodato che le cellule T CD4+ CD4+ che producono IFN-γ giocano un ruolo importante nella protezione dell’ospite contro la TBC (Flynn e Chan, 2001; Sweeney et al., 2011) . Di conseguenza, i topi carenti di interleuchina (IL)-12, il recettore IL-12, i trasduttori di segnale di attivazione e fattore di trascrizione (STAT)-4, e T-bet, ognuno dei quali presenta risposte immunitarie Th1 difettose, sono altamente suscettibili all’infezione da M.tb (Lienhardt et al., 2002; Cooper et al., 2007). È stato ben documentato che la M.tb inibisce la differenziazione cellulare Th1 smorzando la produzione di IL-12 nei macrofagi infetti (Hickman et al., 2002; Trinchieri, 2003; Cooper et al., 2007). D’altra parte, le cellule T regolatorie (Tregs) e le cellule Th2 che producono IL-4 hanno dimostrato di aiutare la progressione della malattia inibendo le risposte cellulari Th1 (Kursar et al., 2007; Scott-Browne et al., 2007; Chen e Konkel, 2010; Shafiani et al., 2010; Yoshimura et al., 2010). Il ruolo delle cellule Th17 produttrici di IL-17 durante l’infezione primaria è meno compreso (Chatterjee et al., 2011), ma il suo ruolo nell’immunità protettiva contro la reinfezione e la sua importanza per l’efficacia del vaccino sono ben documentati (Chatterjee et al., 2011). Tutti i sottoinsiemi di cellule Th, comprese le cellule Th1, Th2, Th17 e Treg sono in un equilibrio dinamico, e quindi l’elevazione delle risposte Th1 aiuta la clearance batterica non solo migliorando le risposte immunitarie mediate dalle cellule, ma anche inibendo le risposte immunitarie umorali indesiderate (Flynn e Chan, 2001). Di conseguenza, l’immunoterapia può essere preferibile al trattamento antibiotico per evitare la generazione di ceppi MDR e XDR di M.tb.
Per identificare nuovi agenti immunomodulatori con un potenziale terapeutico contro la TBC ci siamo concentrati sugli agenti etnomedici, che sono tipicamente ben tollerati dai pazienti. Nei nostri sforzi per caratterizzare tali composti, abbiamo identificato un gran numero di composti etnomedici che hanno mostrato una potente attività immunomodulatoria (Chattopadhyay et al., 2012; Mukherjee et al., 2013; Jnawali et al., 2016; Lee e Suh, 2016; Gomez-Cansino et al., 2017). Uno di questi composti è la bergenina, un acido tri-idrossibenzoico o C-glicoside dell’acido 4-O-metil gallico (Stanford et al., 1990; Narita et al., 1998; Patel et al., 2012) noto come Paashaanbhed in Ayurveda. Si tratta di un composto ben tollerato negli esseri umani la cui potenziale utilità per il trattamento di malattie infettive non è stato precedentemente studiato. Abbiamo scoperto che la bergenina ha una potente attività immunomodulatoria e induce selettivamente fenotipi IFN-γ- e IL-17 che producono fenotipi sia nelle cellule T CD4+ e CD8+. Di conseguenza, bergenina potentemente migliorato la clearance di M.tb da host topo infetto. Meccanicamente, abbiamo scoperto che questi effetti della bergenina sulle risposte delle cellule Th erano dovuti all’induzione di MAPK, ERK1/2 e SAPK/JNK nei macrofagi infetti. Collettivamente, i nostri risultati suggeriscono che l’aggiunta di bergenina alla terapia antibiotica convenzionale può promuovere l’eliminazione degli organismi M.tb nei pazienti.
Risultati e discussione
Attività immunomodulante della bergenina in vitro
Il nostro obiettivo era quello di influenzare le risposte delle cellule Th contro M.tb utilizzando un nuovo immunomodulatore. Dagli studi sul vaccino è chiaro che le risposte Th1 sono essenziali ma non sufficienti per la protezione dell’ospite contro la TBC (Bhattacharya et al., 2014a,b). Pertanto, abbiamo esaminato una varietà di composti a base vegetale per l’attività anti-micobatterica e immunomodulatoria. I farmaci etnomedici sono tipicamente ben tollerati e possiedono una potente efficacia contro una varietà di malattie (Staub et al., 2015). Tali prodotti naturali con proprietà medicinali sono spesso estratti di erbe e spezie naturali che includono uno o più composti attivi. Abbiamo esaminato i composti etnomedici per i reagenti che migliorano l’efficacia terapeutica dell’ATT. Abbiamo selezionato la bergenina, un C-glicoside dell’acido gallico 4-O-metilico (Stanford et al., 1990; Narita et al., 1998; Patel et al., 2012), per ulteriori analisi e abbiamo trovato che mostra una potente attività immunomodulatoria. La sua potenziale efficacia contro le malattie infettive non è stata testata in precedenza. Il nostro obiettivo iniziale era quello di determinare se la bergenina ha una qualche attività antimicrobica. A questo scopo abbiamo eseguito un test ALAMAR Blue. Abbiamo trattato il ceppo M.tb H37Rv con bergenina e abbiamo usato l’isoniazide come controllo positivo. I risultati hanno indicato che la bergenina manca di attività antimicrobica diretta (Figura 1A). Successivamente abbiamo valutato gli effetti della bergenina sulle cellule immunitarie dell’ospite. Abbiamo incubato macrofagi murini con bergenina e misurato la produzione di NO e TNF-α. È interessante notare che la bergenina ha indotto la secrezione di NO (Figura 1B) così come TNF-α (Figura 1C). I test di vitalità cellulare hanno mostrato che la bergenina non mostra citotossicità contro i macrofagi (Figura 1D). Per esaminare l’effetto della bergenina sulle cariche batteriche nelle cellule infette abbiamo eseguito saggi in vitro Colony Forming Unit (CFU). Abbiamo infettato i macrofagi con H37Rv, li abbiamo trattati con bergenina e successivamente abbiamo misurato le CFU in vari punti temporali. Abbiamo scoperto che il trattamento con bergenina riduce significativamente la carica batterica (Figura 1E). Questi dati sono stati ulteriormente rafforzati dalla profilazione dei livelli di IL-12 nei macrofagi dopo l’infezione da H37Rv con o senza trattamento con bergenina (Figura 1F). Collettivamente questi dati suggeriscono che la bergenina manca di attività anti-micobatterica diretta ma indirettamente uccide M.tb nei macrofagi infetti.
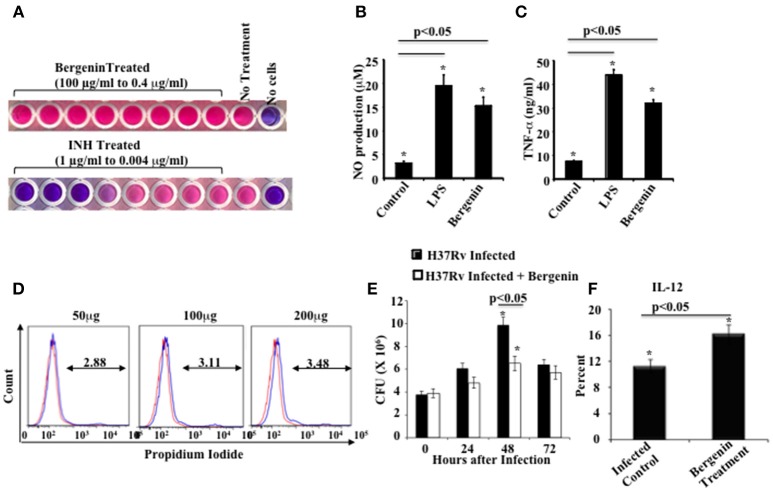
Figura 1.In vitro effetti della bergenina sui macrofagi. (A) Attività antimicotica della bergenina e dell’isoniazide (INH) valutata dal saggio Alamar Blue. (B,C) Misurazione della produzione di NO (B) e TNF-α (C) da parte dei macrofagi dopo il trattamento con bergenina (50μg/ml) o LPS (1μg/ml). D) dosaggio dello ioduro di propidio per la vitalità cellulare dopo il trattamento dei macrofagi con concentrazioni graduate di bergenina. La linea rossa rappresenta i macrofagi non trattati. E) Sopravvivenza batterica nei macrofagi infettati con H37Rv e trattati con o senza bergenina. (F) Percentuale di produzione di IL-12 con o senza trattamento con bergenina. I risultati indicati sono rappresentativi di quattro esperimenti indipendenti. Le barre di errore indicano i mezzi ± SD. *p< 0.05.

Figura 1.In vitro effetti della bergenina sui macrofagi. (A) Attività anti-micobatterica di bergenina e isoniazide (INH) come valutato dal saggio Alamar Blue. (B,C) Misurazione della produzione di NO (B) e TNF-α (C) da parte dei macrofagi dopo il trattamento con bergenina (50μg/ml) o LPS (1μg/ml). D) dosaggio dello ioduro di propidio per la vitalità cellulare dopo il trattamento dei macrofagi con concentrazioni graduate di bergenina. La linea rossa rappresenta i macrofagi non trattati. E) Sopravvivenza batterica nei macrofagi infettati con H37Rv e trattati con o senza bergenina. (F) Percentuale di produzione di IL-12 con o senza trattamento con bergenina. I risultati indicati sono rappresentativi di quattro esperimenti indipendenti. Le barre di errore indicano i mezzi ± SD. *p< 0.05.
Bergenin migliora le risposte immunitarie specifiche di M.tb in vivo
Successivamente, abbiamo valutato l’efficacia in vivo della bergenina contro la TBC in un modello murino di infezione da M.tb. Abbiamo infettato i topi C57BL/6 con una bassa dose (~110 CFU) di M.tb H37Rv attraverso la via aerosol. In vari punti temporali dopo l’infezione abbiamo raccolto polmoni e milza per la determinazione delle cariche batteriche. Abbiamo scoperto che il trattamento con bergenina riduce significativamente il numero di lesioni granulomatiche, come mostrato nelle immagini macroanatomiche dei polmoni (Figura 2A), e le cariche batteriche erano circa 2 tronchi più bassi rispetto agli animali non trattati (Figura 2B). Questi risultati suggeriscono che le risposte immunitarie adattive giocano un ruolo importante nella capacità della bergenina di migliorare la clearance batterica. Questi dati sono stati ulteriormente rafforzati dalle analisi istologiche dei polmoni, che hanno rivelato un numero ridotto di granulomi dopo il trattamento con bergenina (Figura 2C).
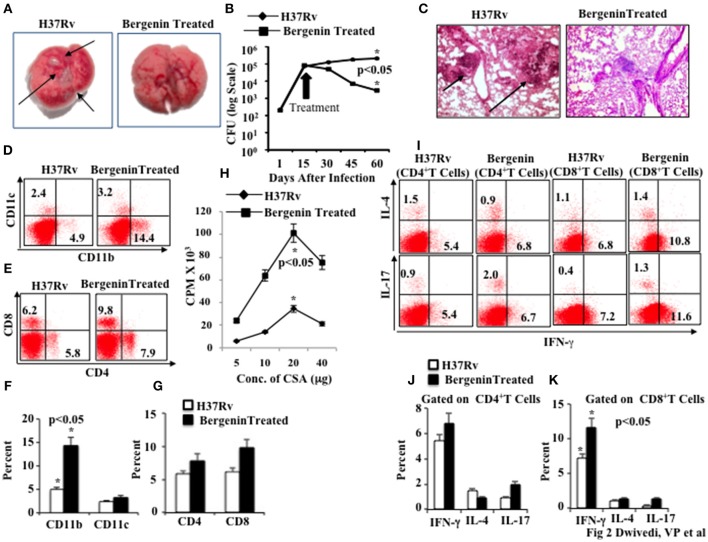
Figura 2.Effetto immunomodulante della bergenina sui topi infettati con Mycobacterium tuberculosis. (A) Immagini macroanatomiche per mostrare gli effetti della bergenina sui polmoni dei topi infetti da H37Rv. Le frecce indicano le lesioni nel polmone di topi infetti da M.tb. (B) CFU dagli omogeneizzati polmonari di topi che sono stati infettati con H37Rv e trattati con bergenina. (C) Immagini di istologia per mostrare gli effetti della bergenina sull’infezione. Le frecce indicano le lesioni granulomatiche nella sezione polmonare di topi infetti da M.tb. (D,F) Dati FACS per mostrare la percentuale di cellule dendritiche (CD11c+) e macrofagi (CD11b+). ( E,G) Dati FACS per mostrare la percentuale di cellule T CD4+ e CD8+. (H) La proliferazione di splenociti isolati da topi infetti da H37Rv e trattati con bergenina in risposta al CSA è stata misurata con il test di incorporazione della [3H]-timidina. (I-K) Colorazione intracellulare per IFN-γ, IL-4, e IL-17 di cellule T CD4+ e CD8+ isolate dalla milza di topi trattati con H37Rv e bergenina. I risultati mostrati sono rappresentativi di tre esperimenti indipendenti con sei topi all’interno di ogni gruppo. Le barre di errore indicano i mezzi ± SD. *p< 0.05.
Successivamente, abbiamo fenotipizzato diverse cellule immunitarie nella milza degli animali trattati con bergenina. Abbiamo scoperto che il trattamento con bergenina aumenta significativamente la prevalenza dei macrofagi (cellule CD11b+) e delle cellule dendritiche (cellule CD11c+; Figure 2D,F), che sono le principali APC che giocano un ruolo importante nell’induzione della risposta immunitaria adattiva. Abbiamo anche trovato un aumento della prevalenza di cellule CD4+ T e CD8+ T nella milza (Figure 2E,G) e nei polmoni (Figure S1A,B) dopo il trattamento con bergenina. Successivamente, abbiamo studiato la proliferazione delle cellule T specifiche dell’antigene M.tb negli splenociti degli animali infetti e abbiamo scoperto che il trattamento con bergenina migliora significativamente la proliferazione delle cellule T specifiche dell’antigene (Figura 2H). Per studiare gli effetti sulla produzione di citochine da parte delle cellule T abbiamo eseguito la colorazione intracellulare delle citochine caratteristiche Th1, Th2 e Th17. Abbiamo scoperto che il trattamento con bergenina aumenta la frequenza delle cellule T che producono IFN-γ- e IL-17, mentre non sono state osservate differenze significative per le cellule T che producono IL-4 (Figura 2I-K ). Presi insieme, i nostri dati suggeriscono che la bergenina promuove la generazione di risposte immunitarie protettive contro la TBC.

Figura 2.Effetto immunomodulante della bergenina su topi infettati con Mycobacterium tuberculosis. (A) Immagini macroanatomiche per mostrare gli effetti della bergenina sui polmoni dei topi infetti da H37Rv. Le frecce indicano le lesioni nel polmone di topi infetti da M.tb. (B) CFU dagli omogeneizzati polmonari di topi che sono stati infettati con H37Rv e trattati con bergenina. (C) Immagini di istologia per mostrare gli effetti della bergenina sull’infezione. Le frecce indicano le lesioni granulomatiche nella sezione polmonare di topi infetti da M.tb. (D,F) Dati FACS per mostrare la percentuale di cellule dendritiche (CD11c+) e macrofagi (CD11b+). ( E,G) Dati FACS per mostrare la percentuale di cellule T CD4+ e CD8+. (H) La proliferazione di splenociti isolati da topi infetti da H37Rv e trattati con bergenina in risposta al CSA è stata misurata con il test di incorporazione della [3H]-timidina. (I-K) Colorazione intracellulare per IFN-γ, IL-4, e IL-17 di cellule T CD4+ e CD8+ isolate dalla milza di topi trattati con H37Rv e bergenina. I risultati mostrati sono rappresentativi di tre esperimenti indipendenti con sei topi all’interno di ogni gruppo. Le barre di errore indicano i mezzi ± SD. *p< 0.05.
Bergenin induce i percorsi MAPK, ERK e SAPK/JNK nei macrofagi
Poiché la bergenina induce la produzione di NO e TNF-α da parte dei macrofagi e riduce la carica batterica in queste cellule, abbiamo studiato i suoi effetti sulla segnalazione MAPK nei macrofagi, che è di fondamentale importanza per l’induzione delle citochine pro-infiammatorie (Whitmarsh et al., 1997; Zarubin e Han, 2005) . Macrofagi peritoneali derivati da topi C57BL/6 sono stati trattati con bergenina (50 μg / ml) per vari punti di tempo e l’attivazione di percorsi MAPK (p38 MAPK, ERK1/2, e SAPK / JNK) è stato studiato tramite Western blotting (Figura 3) . Relativamente ai macrofagi non trattati un aumento dipendente dal tempo nella fosforilazione di p38 MAPK, ERK1/2, e SAPK/JNK è stato osservato nei macrofagi trattati con bergenina. In particolare, non fosforilati p38 MAPK p38, ERK1/2, SAPK/JNK, e livelli di GAPDH sono rimasti inalterati dopo il trattamento con bergenina (Figura 3A). Al fine di determinare il contributo di MEK-1/2 abbiamo isolato i macrofagi peritoneali, trattato queste cellule con un inibitore MEK-1/2 (U0126 da Cell Signaling Technologies) durante la notte, seguita da infezione con H37Rv e il trattamento con o senza bergenina. Quarantotto ore dopo abbiamo raccolto le cellule per il test delle UFC, che ha rivelato che il trattamento con bergenina non era in grado di ridurre la carica batterica in presenza dell’inibitore ERK (Figura 3B). Pertanto, questi risultati suggeriscono che la bergenina può mirare alla via chinasi MAP per alterare le risposte immunitarie dell’ospite.
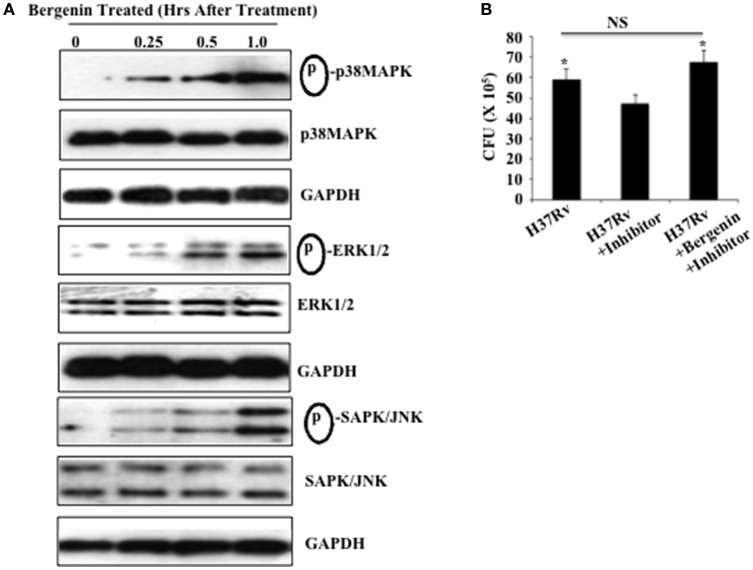
Figura 3.Il trattamento con bergenina attiva la via MAPK. (A) I macrofagi peritoneali sono stati non trattati o trattati con 50-μg/ml bergenina per periodi di tempo diversi. Fosforilazione di p38 MAPK, ERK1/2, e SAPK / JNK è stata valutata in lisato cellulare intero lisato di bergenina trattati o non trattati con bergenina macrofagi da Western blot. (B) Carico batterico nei macrofagi dopo il trattamento con MEK-1/2 inibitore (U0126 da Cell Signaling Technologies). Abbiamo isolato i macrofagi peritoneali, trattato queste cellule con un inibitore MEK-1/2 (20 μM) durante la notte, seguito da infezione con H37Rv e trattamento con o senza bergenina. Quarantotto ore dopo abbiamo raccolto le cellule per il saggio CFU, che ha rivelato che il trattamento con bergenina non era in grado di ridurre la carica batterica in presenza dell’inibitore MEK-1/2. I risultati qui mostrati sono rappresentativi di tre esperimenti indipendenti. *Indicasignificativo per p-valore.

Figura 3.Il trattamento con bergenina attiva il percorso MAPK. (A) I macrofagi peritoneali sono stati non trattati o trattati con 50-μg/ml bergenina per periodi di tempo diversi. Fosforilazione di p38 MAPK, ERK1/2, e SAPK / JNK è stata valutata in lisato cellulare intero lisato di bergenina trattati o non trattati con bergenina macrofagi da Western blot. (B) Carico batterico nei macrofagi dopo il trattamento con MEK-1/2 inibitore (U0126 da Cell Signaling Technologies). Abbiamo isolato i macrofagi peritoneali, trattato queste cellule con un inibitore MEK-1/2 (20 μM) durante la notte, seguito da infezione con H37Rv e trattamento con o senza bergenina. Quarantotto ore dopo abbiamo raccolto le cellule per il saggio CFU, che ha rivelato che il trattamento con bergenina non era in grado di ridurre la carica batterica in presenza dell’inibitore MEK-1/2. I risultati qui mostrati sono rappresentativi di tre esperimenti indipendenti. *Indicasignificativo per p-valore.
Conclusioni
M.tb sopravvive all’interno degli ospiti sensibili alterando le risposte delle cellule Th protettive dell’ospite. Un meccanismo chiave nell’immunità protettiva contro la TB è la produzione indotta da IFN-γ di radicali NO da parte dei macrofagi (Dwivedi et al., 2012) . Così, gli animali che sono difettosi nella produzione di IL-12, inducibile NO sintasi, IFN-γ, o proteine coinvolte nei loro percorsi di segnalazione mostrano una maggiore suscettibilità all’infezione da M.tb (Dwivedi et al., 2012) . Inoltre, è stato dimostrato che M.tb non solo previene le risposte Th1, ma facilita anche le risposte Th2 (Rook, 2007; Dwivedi et al., 2012; Bhattacharya et al., 2014a,b) che si oppongono alle risposte Th1 protettive dell’ospite. I fagociti, dove gli organismi M.tb si replicano, sono la fonte predominante di IL-12 che guida la differenziazione cellulare Th1 (Flynn et al., 1993; Rahman et al., 2015). D’altra parte, le cellule Th2 e Tregs facilitano la progressione della malattia inibendo le risposte Th1 protettive dell’ospite. È interessante notare che le cellule Th17 svolgono un ruolo cruciale nella resistenza dell’ospite durante le infezioni secondarie (Chatterjee et al., 2011). Recentemente, abbiamo dimostrato che l’inibizione simultanea delle cellule Th2 e Tregs riduce significativamente il carico tubercoloso negli animali infetti, ma non è in grado di eliminare completamente gli organismi M.tb dall’ospite (Bhattacharya et al., 2014a,b). Pertanto, abbiamo sottoposto a screening diversi composti a base vegetale per l’immunità protettiva contro l’infezione da M.tb. Abbiamo selezionato un composto, la bergenina, per ulteriori analisi. Bergenin mostra proprietà anti-epatotossiche, anti-ulcerogene, anti-HIV, anti-aritmiche, neuroprotettive, antinfiammatorie e immunomodulatorie (Patel et al., 2012). Meccanicamente, la bergenina media alcune delle sue proprietà benefiche proteggendo le cellule dallo stress ossidativo (Patel et al., 2012). Ad esempio, l’attività di scavenging dei radicali liberi della bergenina protegge dalla perossidazione liposomica indotta dalle radiazioni, dalla carbonilazione delle proteine e dai danni al DNA (Patel et al., 2012). Nei nostri studi bergenina non ha mostrato una diretta attività anti-micobatterica, ma ha mostrato una potente attività immunomodulatoria, ha indotto la produzione di NO e TNF-α nei macrofagi, e ha ridotto il carico batterico delle cellule infette. In vitro bergenina indotta citochine nei macrofagi che ha creato un ambiente favorevole alla uccisione dei microbi, ma questo è stato insufficiente per la clearance efficace dei bacilli. Tuttavia, in un modello murino di infezione da M.tb bergenina bergenina indotta macrofagi e l’espansione delle cellule dendritiche e promosso la generazione di M.tb specifiche risposte immunitarie adattive. Così, bergenina in vivo sembra attivare non solo i macrofagi, ma anche altri tipi di cellule come le cellule dendritiche e le cellule T che contribuiscono all’uccisione efficace dei batteri, fornendo una potenziale spiegazione per le differenze osservate nei nostri studi in vitro e in vivo.
Abbiamo scoperto che la bergenina promuove l’espansione delle risposte protettive Th1 e Th17, con effetti limitati sulle risposte Th2. Inoltre, abbiamo dimostrato che la bergenina migliora l’attivazione della via chinasi MAP nei macrofagi infetti, che è di fondamentale importanza per l’induzione delle citochine pro-infiammatorie (Whitmarsh et al., 1997; Zarubin e Han, 2005). L’attivazione delle chinasi MAP nei macrofagi fornisce l’immunità protettiva dell’ospite durante l’infezione da M.tb e produce varie molecole effettori che mostrano attività anti-micobatterica. Ad esempio, ERK induce la secrezione di iNOS e NO nei macrofagi (Chan et al., 2001). Tuttavia, M.tb contiene meccanismi di evasione immunitaria per limitare l’attività delle chinasi MAP (Schorey e Cooper, 2003). L’attivazione delle MAP chinasi da parte della bergenina può contrastare questi meccanismi di evasione immunitaria micobatterica.
Presi insieme, i nostri dati suggeriscono che la bergenina, un potente composto immunomodulante, induce forti risposte cellulari protettive Th1 e Th17 e riduce drasticamente il carico micobatterico negli animali infetti. Uno dei nostri obiettivi futuri è quello di utilizzare la bergenina come terapia aggiuntiva all’ATT (terapia anti-tubercolosi) che può eventualmente ridurre la durata del trattamento, la tossicità associata all’ATT, la reinfezione e la riattivazione della malattia e l’emergenza di varianti batteriche resistenti ai farmaci. Inoltre, la bergenina è promettente come coadiuvante per i vaccini contro la TBC.
Materiali e metodi
Dichiarazione etica
Gli esperimenti sugli animali sono stati eseguiti secondo le linee guida approvate dall’Institutional Animal Ethics Committee dell’International Centre for Genetic Engineering and Biotechnology (ICGEB; New Delhi, India) e le linee guida del Department of Biotechnology (governo indiano). Tutti i topi utilizzati per gli esperimenti sono stati eticamente sacrificati per asfissia nell’anidride carbonica secondo le normative istituzionali e del Dipartimento di Biotecnologia del governo indiano.
Topi
C57BL/6 (6-8 settimane di età) sono stati forniti dal nostro istituto (ICGEB, New Delhi, India). Tutti gli animali sono stati mantenuti nella struttura per animali dell’ICGEB.
Batteri
Il ceppoM.tb H37Rv è stato un regalo gentile da parte del deposito della Colorado State University. Gli organismi sono stati coltivati in 7H9 (Middlebrooks, Difco™, USA) medium integrato con il 10% di ADC (albumina, destrosio e catalisi; Difco™, USA) e con lo 0,05% di glicerolo Tween 80 e lo 0,2% di glicerolo, e le colture sono state coltivate fino alla fase intermedia. Aliquote delle colture nel 20% di glicerolo sono state conservate a -80°C e queste scorte crioconservate sono state utilizzate per le infezioni.
Isolamento dei composti
Giovani o tenere foglie di Shorea robusta L. sono state raccolte durante tutto l’anno dalla vicina foresta della zona tribale di Hazaribagh (Jharkhand, India). Gli esemplari sono stati identificati e autenticati da un tassonomista dell’Indagine Botanica dell’India (Shibpur, Howrah, India). Per l’isolamento del(i) composto(i) attivo(i), un estratto di metanolo è stato suddiviso tra n-butanolo saturo d’acqua e acqua, e la parte organica è stata concentrata sotto pressione ridotta ad un residuo marrone scuro (98 g). Il residuo è stato cromatografato su colonna di gel di silice (60-120 mesh), e l’eluizione graduata è stata effettuata con cloroformio (100%) e una miscela di cloroformio-metanolo in un rapporto di 95:5, 90:10, e 80:20, e raccolti come frazioni. Su 176 sotto-frazioni (200 ml ciascuna) sono state raccolte 6 frazioni principali, basate su punti simili su TLC. Queste frazioni sono state successivamente ricromatografate con cloroformio graduato (100%) seguito da una miscela di cloroformio-metanolo in un rapporto di 99:1, 97:3, 95:5, 93:7, 90:10, 85:15 e 80:20 e sono state separate da TLC in tre frazioni, di cui la frazione 2 e 3 ha mostrato una significativa attività antimicrobica. Il ricromatografo della frazione 2, eluito con CHCl3-MeOH (95:5) e CHCl3-MeOH (80:20) su gel di silice (100-200 mesh) ha prodotto un solido incolore (Compound 1, resa ≈ 0,075%), mentre la frazione 3 ha prodotto un microago cristallizzato giallo pallido (Compound 2, resa ≈ 0,059%). La caratterizzazione chimica è stata eseguita da IR (spettrometro JASCO7300 FTIR), Massa (Q-TOF Micromass Spectrometer), 1HNMR(a 600 e 300 MHz), e 13CNMR(a 150 e 74,99 MHz) da spettrometro Bruker AVANCE 600 con TMS come standard interno in C5D5N e / o MeOD. I punti di fusione (m.p.) sono stati misurati su un apparecchio Yanagimoto Micro Melting Point Apparatus, mentre il polarimetro digitale JASCO DIP-370 è stato utilizzato per il rilevamento delle rotazioni ottiche.
Caratterizzazione del composto isolato
Gli spettri IR di un microago incolore cristallizzato, ottenuto da un estratto di metanolo con punto di fusione a 236°C, mostravano bande di assorbimento a 3.391, 1.704, 1.462 Cm-1 dovute a gruppi idrossi e keto, e doppi legami aromatici. Il picco ionico quasi-molecolare [M+Na]+ a m/z 351 ha rivelato il suo peso molecolare a 328. Queste informazioni, insieme ai dati degli spettri 13CNMR e DEPT, hanno suggerito la formula molecolare come: C14H16O9. Inoltre, un segnale a δ 7.70 (1H)in1H spettri NMR era dovuto ad un protone aromatico, mentre il singoletto appuntito di tre protoni a δ 3.99 indicava un gruppo metossi aromatico; un singoletto a δ 164.7 era dovuto ad un gruppo COOH, mentre un segnale a δ 62,8 indicava un gruppo CH2OH; e un picco metilico a δ 60,5 confermava il gruppo metossi, insieme a sei segnali metilici a δ 111,3, 83,7, 81,6, 75,8, 74,1, e 72,4. Quindi, collettivamente questi dati suggeriscono che il Compound 1 era bergenina (Mukherjee et al., 2013).
Saggio blu di Alamar
I bacilli sono stati coltivati fino a metà della fase di log (OD600 0,6-0,8) e aggiunti ad una piastra a 96 pozzetti contenente due diluizioni seriali di bergenina (1 μg/ml) a OD600 finale di0, 01. Isoniazide (1 μg/ml) è stato utilizzato come controllo positivo. Dopo l’incubazione a 37 ° C per 5 giorni 1X alamar blu (Thermo Fisher Scientific) è stato aggiunto in ogni pozzetto e un cambiamento di colore da blu a rosa è stato osservato dopo 16 h di incubazione. I pozzetti contenenti solo media e senza bacilli sono serviti come controllo negativo e i pozzetti che avevano solo bacilli senza alcun farmaco sono stati trattati come controllo positivo.
Infezione da M.tb dei topi e stima delle unità di formazione delle colonie (CFU)
I topi sono stati infettati con M.tb H37Rv attraverso la via aerosol utilizzando una camera aerosol di Madison (University of Wisconsin, Madison, WI) con il suo nebulizzatore pre-calibrato per depositare un totale di ~110 CFU nei polmoni di ogni topo come descritto in precedenza (Chatterjee et al., 2011). In breve, le scorte di micobatteri recuperate da un congelatore a -80°C sono state scongelate rapidamente e sottoposte a leggera ultrasonicazione per ottenere una sospensione cellulare singola. Quindici millilitri della sospensione cellulare batterica (10 × 106 cellule per ml) sono stati posti nel nebulizzatore della camera aerosol Madison pre-calibrato per erogare via aerosol il numero desiderato di CFU ai polmoni degli animali posti all’interno della camera. Un giorno dopo la procedura di esposizione aerosol, tre topi scelti a caso sono stati sacrificati in vari punti di tempo e gli organi sono stati raccolti, omogeneizzati in 0,2 micron filtrato PBS contenente 0,05% Tween 80 e placcato su 7H11 Middlebrooks (Difco USA) piastre contenenti il 10% di acido oleico, albumina, destrosio e catalisi (OADC) (Difco, USA). Gli omogeneizzati polmonari e della milza non diluiti, diluiti 10 volte e diluiti 100 volte, sono stati placcati in duplicato sulle piastre 7H11 di cui sopra e incubati a 37°C per 21-28 giorni. Le colonie sono stati contati e CFU sono stati stimati. Topi provenienti da vari gruppi sono stati eutanasia nei punti di tempo indicati in vari esperimenti e dei loro organi sono stati raccolti per ottenere conteggi CFU e / o sottopopolazioni di cellule immunitarie per gli studi immunologici, come descritto in altre sottosezioni.
Somministrazione di farmaci
Quattro milligrammi o chilogrammi di bergenina in 100 μl di PBS sono stati somministrati per via intraperitoneale ogni giorno durante l’intera fase di trattamento.
Isolamento dei macrofagi peritoneali del topo
A topi di sesso femminile C57BL/6 di sei-otto settimane è stata somministrata un’iniezione i.p. di 2 ml di tioglicolato medio (4%). Cinque giorni dopo l’iniezione i macrofagi sono stati ottenuti con il lavaggio peritoneale. I macrofagi sono stati lavati una volta con PBS a freddo e risospesi in RPMI-1640 a freddo e contati con il metodo di esclusione Trypan blu. Le cellule (0,5 × 106 per pozzetto) sono stati seminati su piastre a 12 pozzetti e mantenuto a 37 ° C in RPMI-1640 medio integrato con o senza penicillina-streptomicina (1.000 unità / ml) e il 10% di calore inattivato siero fetale di vitello fetale. Dopo l’incubazione notturna, le cellule non aderenti sono state lavate e la purezza dei macrofagi aderenti è stata determinata mediante analisi citometrica a flusso utilizzando l’anticorpo anti-CD11b, che ha suggerito che >95% delle cellule nel lavaggio peritoneale erano macrofagi.
Determinazione della citotossicità
Monostrato di macrofagi in piastre di coltura tissutale a 96 pozzetti (1,0 × 105 cellule / ml) sono stati coltivati e incubati a 37 ° C in 5% di CO2 per 6h, diverse concentrazioni di composto di prova sono stati aggiunti ai pozzetti di coltura in triplicato ad un volume finale di 100 microlitri, e incubato per 48 h. Successivamente, il terreno è stato sostituito con RPMI fresco contenente 1 mg / ml di ioduro di Propidio. Le cellule sono state incubate a 37°C per 15 minuti e poi lavate con PBS e acquisite e analizzate con un citometro a flusso FACS Canto II (BD Biosciences, USA).
Analisi FACS
Per la colorazione intracellulare delle citochine, le cellule sono state trattate con 50 ng/ml PMA e 500 ng/ml ionomicina in presenza di 10 μg/ml di brefeldina A (Sigma-Aldrich o e-Biosciences, USA) aggiunti durante le ultime 6 ore di coltura. Le cellule sono state lavate due volte con PBS, risospese in un tampone di permeabilizzazione (Cytofix/Cytoperm kit; BD), e colorate con i seguenti anticorpi monoclonali coniugati fluorescentemente: anti-CD4 (clone GK1.5)-alloficocianina (APC), anti-IFN-γ (clone XMG1.2)- isotiocianato di fluoresceina (FITC), anti-IFN-γ (clone XMG1.2)-APC, anti-IL-4 (clone GK1.5)-ficoeritrina (PE) (e-Biosciences, USA). L’intensità della fluorescenza è stata misurata con citometria a flusso (FACS Canto II; BD) e i dati sono stati analizzati con Flow Jo (Tree star, USA).
[3H]-saggio di incorporazione dell’imidina di splenociti
Le milze dei topi C57BL/six sono state macerate da vetrini glassati in completo RPMI-1640 (Gibco, Invitrogen, UK) e trasformate in una singola sospensione cellulare. I globuli rossi (RBC) sono stati lisati con tampone di lisi delle cellule RBC e lavati con RPMI-1640 completo. Splenociti sono stati contati e placcati a 0,1 × 106 cellule / pozzetto in piastre a 96 pozzetti e stimolati con diverse concentrazioni di antigene solubile completo M.tb (CSA). Le cellule sono state coltivate per 48 h e poi pulsato con timidina tritiated(3H-TdR, 1,0 μCi per pozzetto; Amersham Biosciences UK) prima di misurare l’incorporazione di 3H-TdR per mezzo di un cell harvester e liquido scintillazione contatore 16 h più tardi (Perkin Elmer, UK).
Blotting occidentale
Macrofagi peritoneali derivati da topi C57BL/6 sono stati trattati con bergenina (50 μg/ml) per 15 min, 30 min, o 1 h. Il lisato cellulare intero è stato preparato utilizzando tampone di lisi (50 mM Tris-HCl, pH 7,4, 5 mM EDTA, 120 mM NaCl, 0,5% Nonidet P-40, 0,5 mM NaF, 1 mM ditiotreitolo, 0.5 mM fenilmetilsulfonil fluoruro) insieme ad una miscela di inibitori della fosfatasi (78.420; Thermo Scientific) e una miscela di inibitori della proteasi (78.410; Thermo Scientific) per 1 h. I campioni sono stati elettroforesi su un gel di SDS-poliacrilammide al 10% e elettrodeposizione su membrane di polivinilidenedifluoruro (PVDF). I blot sono stati bloccati per 1 h in 5% BSA in PBST (PBS con 0,1% Tween 20), e p-ERK, ERK, p-P38, p-P38, P38, p-SAPK/JNK, e SAPK/JNK proteine sono stati rilevati con anti-ERK, -pERK, -P38, -pP38, -pP38, e -JNK anticorpi policlonali, rispettivamente, ad una diluizione come raccomandato dal produttore (Cell Signaling Technologies). La perossidasi di rafano coniugata con immunoglobulina G coniugata con la capra anti-coniglio (diluita 1:2500) è stata utilizzata come anticorpo secondario (Cell Signaling Technologies). L’immunocolorazione per GAPDH è stata effettuata per confermare un carico uguale.
Analisi statistica
Tutti i dati sono stati ricavati da almeno tre esperimenti indipendenti. Le analisi statistiche sono state condotte utilizzando il software SPSS10 e i valori sono stati presentati come media ± SD. Differenze significative tra i gruppi sono state determinate da ANOVA seguito dal test di confronto multiplo di Tukey (software SPSS). Un valore di p < 0,05 è stato accettato come indicazione di significatività statistica.
Contributi degli autori
VD, DB, VY, DS, SK, MS e DO hanno fatto gli esperimenti. L’isolamento, la caratterizzazione della bergenina è stata fatta da DO e DC. VD, AR, DC, LV e GD hanno scritto il manoscritto.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
References
- Bhattacharya D., Dwivedi V. P., Kumar S., Reddy M. C., Kaer L. V., Moodley P.. Simultaneous inhibition of T helper 2 and T regulatory cell differentiation by small molecules enhances Bacillus Calmette-Guerin vaccine efficacy. J. Biol. Chem.. 2014b; 289:33404-33411. DOI | PubMed
- Bhattacharya D., Dwivedi V. P., Maiga M., Maiga M., Kaer L. V., Bishai W. R.. Small molecule-directed immunotherapy against recurrent infection by Mycobacterium tuberculosis. J. Biol. Chem.. 2014a; 289:16508-16515. DOI | PubMed
- Brewer T. F.. Preventing tuberculosis with Bacillus Calmette-Guerin vaccine: a meta-analysis of the literature. Clin. Infect. Dis.. 2000; 31:64-67. DOI | PubMed
- Byrd T. F., Davis L. E.. Multidrug-resistant tuberculous meningitis. Curr. Neurol. Neurosci. Rep.. 2007; 7:470-475. DOI | PubMed
- Chan E. D., Morris K. R., Belisle J. T., Hill P., Remigio L. K., Brennan L. K.. Induction of inducible nitric oxide synthase-NO by lipoarabinomannan of Mycobacterium tuberculosis is mediated by MEK1-ERK, MKK7-JNK, and NF- B signaling pathways. Infect. Immun.. 2001; 69:2001-2010. DOI | PubMed
- Chatterjee S., Dwivedi V. P., Singh Y., Siddiqui I., Sharma P., Kaer L. V.. Early secreted antigen ESAT-6 of Mycobacterium tuberculosis promotes protective T helper 17 cell responses in a toll-like receptor-2-dependent manner. PLoS Pathog.. 2011; 7:e1002378. DOI | PubMed
- Chattopadhyay D., Mukherjee H., Bag P., Ojha D., Konreddy A. K., Dutta S.. Inhibition of NO2, PGE2, TNF-α and iNOS expression by Shorea robusta L: an ethnomedicine used for antiinflammatory and analgesic activity. Evid. Based Complement. Altern. Med.. 2012; 2012:254849. DOI | PubMed
- Chen W., Konkel J. E.. TGF- beta and “adaptive” Foxp3 regula-tory T cells. J. Mol. Cell Biol.. 2010; 2:30-36. DOI | PubMed
- Colditz G. A., Berkey C. S., Mosteller F., Brewer T. F., Wilson M. E., Burdick E.. The efficacy of bacillus Calmette-Guerin vaccination of newborns and infants in the prevention of tuberculosis: meta-analyses of the published literature. Pediatrics. 1995; 96:29-35. PubMed
- Cooper A. M., Solache A., Khader S. A.. Interleukin-12 and tuberculosis: an old story revisited. Curr. Opin. Immunol.. 2007; 19:441-447. DOI | PubMed
- Cox H. S., Morrow M., Deutschmann P. W.. Long term efficacy of DOTS regimens for tuberculosis: systematic review. BMJ. 2008; 336:484-487. DOI | PubMed
- Davies J.. Origins and evolution of antibiotic resistance. Microbiologia. 1996; 12:9-16. PubMed
- Dwivedi V. P., Bhattacharya D., Chatterjee S., Prasad D. V. R., Chattopadhyay D., Kaer L. V.. Mycobacterium tuberculosis directs T helper 2 cell differentiation by inducing interleukin-1β production in dendritic cells. J. Biol. Chem.. 2012; 287:33656-33663. DOI | PubMed
- Fine P. E.. The BCG story: lessons from the past and implications for the future. Rev. Infect. Dis.. 1989; 11:353-359. DOI | PubMed
- Fine P. E.. Variation in protection by BCG: implications of and for heterologous immunity. Lancet. 1995; 346:1339-1345. DOI | PubMed
- Flynn J. L., Chan J.. Immunology of tuberculosis. Annu. Rev. Immunol.. 2001; 19:93-129. DOI | PubMed
- Flynn J. L., Chan J., Triebold K. J., Dalton D. K., Stewart T. A., Bloom B. R.. An essential role for interferon in resistance to Mycobacterium tuberculosis infection. J. Exp. Med.. 1993; 178:2249-2254. DOI | PubMed
- Fountain F. F., Tolley E., Chrisman C. R., Self T. H.. Isoniazid hepatotoxicity associated with treatment of latent tuberculosis infection: a 7-year evaluation from a public health tuberculosis clinic. Chest. 2005; 128:116-123. DOI | PubMed
- Gomez-Cansino R., Guzman-Gutierrez S. L., Campos-Lara M. G., Inesespitia-Pinzon C., Ricardo Reyes-Chilpa R.. Natural compounds from mexican medicinal plants as potential drug leads for anti-tuberculosis drugs. An. Acad. Bras. Ciênc.. 2017; 89:31-43. DOI | PubMed
- Hickman S. P., Chan J., Salgame P.. Mycobacterium tuberculosis induces differential cytokine production from dendritic cells and macrophages with divergent effects on naïve T cell polarization. J. Immunol.. 2002; 168:4636-4642. DOI | PubMed
- Iseman M. D.. Treatment of multidrug-resistant tuberculosis. N. Engl. J. Med.. 1993; 329:784-791. DOI | PubMed
- Jnawali H. N., Jeon D., Jeong M.-C., Lee E., Jin B., Ryoo S.. Antituberculosis activity of a naturally occurring Flavonoid, Isorhamnetin. J. Nat. Prod.. 2016; 79:961-969. DOI | PubMed
- Kursar M., Koch M., Mittrücker H. W., Nouailles G., Bonhagen K., Kamradt T.. Cutting edge: regulatory T cells prevent efficient clearance of Mycobacterium tuberculosis. J. Immunol.. 2007; 178:2661-2665. DOI | PubMed
- Lee H., Suh J. W.. Anti-tuberculosis lead molecules from natural products targeting Mycobacterium tuberculosis ClpC1. J. Ind. Microbiol. Biotechnol.. 2016; 43:205-212. DOI | PubMed
- Lienhardt C., Azzurri A., Amedei A., Fielding K., Sillah J., Sow O. Y.. Active tuberculosis in Africa is associated with reduced Th1 and increased Th2 activity in vivo. Eur. J. Immunol.. 2002; 32:1605-1613. DOI | PubMed
- Mukherjee H., Ojha D., Bharitkar Y. P., Ghosh S., Mondal S., Kaity S.. Evaluation of the wound healing activity of Shorea robusta, an Indian Ethnomedicine, and its isolated constituent(s) in topical formulation. J. Ethnopharmacol.. 2013; 149:335-343. DOI | PubMed
- Narita M., Ashkin D., Hollender E. S., Pitchenik A. E.. Paradoxical worsening of tuberculosis following antiretroviral therapy in patients with AIDS. Am. J. Respir. Crit. Care Med.. 1998; 158:157-161. DOI | PubMed
- Patel D. K., Patel K., Kumar R., Gadewar M., Tahilyani V.. Pharmacological and analytical aspects of bergenin: a concise report. Asian Pacific J. Trop. Dis.. 2012; 2:163-167. DOI
- Rahman M. A., Sobia P., Dwivedi V. P., Bhawsar A., Singh D. K., Sharma P.. Mycobacterium tuberculosis TlyA negatively regulates Th1 and Th17 differentiation and promotes tuberculosis pathogenesis. J. Biol. Chem.. 2015; 290(23):14407-14417. DOI | PubMed
- Rook G. A.. Th2 cytokines in susceptibility to tuberculosis. Curr. Mol. Med.. 2007; 7:327-337. DOI | PubMed
- Schorey J. S., Cooper A. M.. Macrophage signalling upon mycobacterial infection: the MAP kinases lead the way. Cell. Microbiol.. 2003; 5:133-142. DOI | PubMed
- Scott-Browne J. P., Shafiani S., Tucker-Heard G., Ishida-Tsubota K., Fontenot J. D., Rudensky A. Y.. Expansion and function of Foxp3-expressing T regulatory cells during tuberculosis. J. Exp. Med.. 2007; 204:2159-2169. DOI | PubMed
- Shafiani S., Tucker-Heard G., Kariyone A., Takatsu K., Urdahl K. B.. Pathogen-specific regulatory T cells delay the arrival of effector T cells in the lung during early tuberculosis. J. Exp. Med.. 2010; 207:1409-1420. DOI | PubMed
- Simona L., Traian M.. History of BCG vaccine. Maedica. 2013; 8:53-58. PubMed
- Stanford J. L., Bahr G. M., Byass P., Corrah T., Dowlati Y., Lucas S.. A modern approach to the immunotherapy of tuberculosis. Bull. Int. Union Tuberc. Lung Dis.. 1990; 65:27-29. PubMed
- Staub P. O., Geck M. S., Weckerle C. S., Casu L., Leonti M.. Classifying diseases and remedies in ethnomedicine and ethnopharmacology. J. Ethnopharmacol.. 2015; 174:514-519. DOI | PubMed
- Sweeney K. A., Dao D. N., Goldberg M. F., Hsu T., Venkataswamy M. M., Henao-Tamayo M.. A recombinant Mycobacterium smegmatis induces potent bactericidal immunity against Mycobacterium tuberculosis. Nat. Med.. 2011; 17:1261-1268. DOI | PubMed
- Trinchieri G.. Interleukin-12 and the regulation of innate resistance and adaptive immunity. Nat. Rev. Immunol.. 2003; 3:133-146. DOI | PubMed
- Udani P. M.. BCG vaccination in India and tuberculosis in children: newer facets. Indian J. Pediatr.. 1994; 61:451-462. DOI | PubMed
- Whitmarsh A. J., Yang S. H., Su M. S., Sharrocks A. D., Davis R. J.. Role of p38 and JNK mitogen-activated protein kinases in the activation of ternary complex factors. Mol. Cell. Biol.. 1997; 17:2360-2371. DOI | PubMed
- WHO. Tuberculosis Vaccine Development. Geneva; 2015a.
- WHO. Global Tuberculosis Report. Geneva; 2015b.
- Yoshimura A., Wakabayashi Y., Mori T.. Cellular and molecular basis for the regulation of inflammation by TGF-beta. J. Biochem.. 2010; 147:781-792. DOI | PubMed
- Zarubin T., Han J.. Activation and signaling of the p38 MAP kinase pathway. Cell Res.. 2005; 15:11-18. DOI | PubMed
Fonte
Dwivedi VP, Bhattacharya D, Yadav V, Singh DK, Kumar S, et al. (2017) The Phytochemical Bergenin Enhances T Helper 1 Responses and Anti-Mycobacterial Immunity by Activating the MAP Kinase Pathway in Macrophages. Frontiers in Cellular and Infection Microbiology 7149. https://doi.org/10.3389/fcimb.2017.00149





