Abstract
Introduzione
Una gamma diversificata di animali è in grado di rilevare visivamente gli oggetti in movimento all’interno di ambienti disordinati. Questa discriminazione è un compito complesso, soprattutto in risposta a un piccolo bersaglio che genera un contrasto molto debole in quanto si muove su uno sfondo altamente strutturato. L’elaborazione neurale alla base di questo comportamento deve potenziare un segnale localizzato, debole e variabile, che può stimolare solo uno o due fotorecettori a sua volta. Piuttosto che rispondere semplicemente in modo reattivo, alcuni animali anticipano addirittura il percorso di un bersaglio prevedendo la sua futura posizione. Nella retina dei vertebrati, l’elevato guadagno iniziale combinato con l’adattamento e la sensibilizzazione neuronale permette alle risposte da una rete di cellule gangliari sovrapposte di ‘tenere il passo’ con l’attuale posizione del bersaglio e tenere conto di ritardi neuronali lenti (Berry etal., 1999; Kastner e Baccus, 2013). Questa codifica prevede obiettivi che si muovono in linea retta, con inversioni di traiettoria che provocano un’esplosione sincrona di attività da una popolazione di cellule gangliari(Schwartz et al., 2007; Chen et al., 2014). Tuttavia, questa anticipazione non utilizza la traiettoria recente per estrapolare le probabili posizioni dei bersagli in tempi futuri. Piuttosto, l’ultima posizione osservata rimane sensibilizzata dopo la scomparsa del bersaglio. Ciò si differenzia dagli studi sugli osservatori umani, dove un bersaglio temporaneamente occluso comporta una maggiore sensibilità nella posizione estrapolata in avanti(Watamaniuk e McKee, 1995). Questa codifica predittiva delle future posizioni del bersaglio indica la presenza di ulteriori meccanismi di elaborazione al di là della retina.
Come i giocatori di palla umana, anche le libellule stimano la posizione del bersaglio, catturando singole prede in un disordine visivo, anche in mezzo a uno sciame di potenziali alternative(Corbet, 1999). Di recente abbiamo descritto un neurone “vincitore-offerta-tutto” nella libellula, che potrebbe servire per la selezione competitiva di un singolo bersaglio, ignorando un distrattore (Wiedermane O’Carroll, 2013). In altri modelli animali, i circuiti inibitori guidano la selezione degli stimoli salienti(Mysore e Knudsen, 2013) e la direzione dell’attenzione verso i bersagli è evidenziata dalla modulazione del guadagno di contrasto(Moran e Desimone, 1985; Reynolds et al., 2000). Non si sa come la predizione si rapporta alla selezione degli stimoli salienti(Zirnsak et al., 2014) e come la selezione, la predizione e l’attenzione siano codificate a livello neuronale è un argomento di intensa indagine scientifica.
Qui abbiamo utilizzato registrazioni intatte, in vivo, del sistema di piccoli neuroni target-selettivi in libellule predatrici per rivelare i cambiamenti locali di sensibilità che si verificano durante il tracciamento del bersaglio. Abbiamo dimostrato che questo comporta un grande aumento del guadagno di contrasto appena prima della più recente localizzazione del bersaglio, con soppressione nell’ambiente circostante. Abbiamo indagato l’estensione spaziale, la persistenza temporale e la sintonizzazione della direzione all’interno di questa regione di miglioramento. I nostri dati mostrano che un aumento locale del guadagno si diffonde in avanti dopo un ritardo, anche anticipando il percorso dei primer presentati all’occhio controlaterale e spostato verso la linea mediana visiva. Inoltre, la sintonizzazione della direzione si sposta per corrispondere al percorso precedente. Tali attributi di risposta differenziano questa elaborazione neuronale dai modelli tipici di selettività della direzione e sono ideali per l’inseguimento predittivo di una libellula (Mischiatiet al., 2015).
Risultati
I campi ricettivi sono modulati dalla storia degli stimoli
I neuroni “Small target motion detector” (STMD) nella libellula, Hemicordulia tau, sono sintonizzati sulle dimensioni e sulla velocità del bersaglio e sono altamente sensibili al contrasto (O’Carroll1993, Wiederman et al., 2008, 2013). Un STMD identificato, CSTMD1, risponde selettivamente a un bersaglio piccolo e mobile, anche quando è incorporato in scene naturali(Wiederman e O’Carroll, 2011). Anche il CSTMD1 mostra una forma sofisticata di attenzione selettiva. La risposta neuronale alla presentazione di due bersagli in movimento simultaneo non si traduce semplicemente in una sommatoria o in un’inibizione neuronale. Al contrario, il CSTMD1 risponde in modo vincente, selezionando un singolo bersaglio come se il distrattore non esistesse nemmeno(Wiederman e O’Carroll, 2013).
Abbiamo mappato il campo ricettivo del CSTMD1 misurando l’attività di spiking in risposta ad un singolo bersaglio nero quadrato (1,5°x1,5°) che si muove lungo traiettorie in diverse posizioni spaziali nel campo visivo. In una regione, una matrice a griglia (10 × 10) di breve, verticale, traiettorie di destinazione evocano deboli risposte neuronali (Figura 1A). Per ogni breve traiettoria di 200 ms, tracciamo il tasso di picco medio su una finestra di analisi di 100 ms (da 50 a 150 ms). Questa colormap rappresenta l’attività di picco in risposta a brevi traiettorie per ciascuna delle 100 posizioni spaziali corrispondenti. In confronto, presentiamo un identico bersaglio quadrato spostato lungo lunghe traiettorie verticali(Figura 1B, Video 1) e le risposte dei segmenti nelle stesse posizioni spaziali corrispondenti alle traiettorie corte della Figura 1A (tasso medio di picco su 100 ms bins). Questo rivela una maggiore attività complessiva di picco in risposta alle lunghe e continue traiettorie del bersaglio. Qui indaghiamo questo effetto della storia degli stimoli separando le traiettorie in componenti; un primer e una sonda. Ogni risposta di stimolo quando viene presentata da sola, tuttavia, la risposta iniziale della sonda è influenzata dal guadagno indotto da un primer precedente (Figura 1C). Notiamo che le risposte neuronali si costruiscono lentamente in centinaia di millisecondi – una proprietà che abbiamo precedentemente chiamato facilitazione(Nordström et al., 2011). Per la condizione di primer e sonda (dove un primer precede sempre lo stimolo della sonda) le risposte alla sonda sono facilitate (regione verde, cfr. nero con andamento temporale blu). Questo effetto di facilitazione non è semplicemente dovuto alla cinetica lenta, in quanto entrambe le risposte hanno un rapido decorso temporale di decadimento quando lo stimolo termina(Dunbier et al., 2012).10.7554/eLife.26478.003Figure 1.CSTMD1 campo ricettivo mappato con bersagli alla deriva.(A) Piccoli bersagli (quadrati neri, 1,5°x1,5°) si muovono lungo brevi traiettorie (200 ms) che sono sia verticalmente che orizzontalmente sfasati su una griglia 10 × 10. I pittogrammi sono illustrativi e non in scala. La colormap rivela le risposte del CSTMD1 a questi stimoli producendo un campo ricettivo “non facilitato” (finestra di analisi 50-150 ms).(B) Orizzontalmente offset obiettivi sono alla deriva verticalmente il display del monitor lungo lunghe traiettorie continue che suscitano forti, risposte agevolate (100 ms bins a corrispondenti posizioni spaziali in A).(C) La separazione di lunghe traiettorie in due componenti (primer seguito da sonda), permette di esaminare gli effetti facilitatori all’interno di una breve finestra di analisi (prima della sonda auto-prime, regione verde). In un singolo neurone, abbiamo esaminato i corsi di tempo di risposta (media di 140 repliche nell’arco di due ore) alla sonda ripetuta da sola (linea blu) e le condizioni di primer e sonda (linea nera) (D)Abbiamo precedentemente descritto i campi ricettivi facilitati in risposta ai bersagli alla deriva attraverso l’intero display visivo. I bersagli che si muovono verso destra (offset verticale) rivelano l’inibizione nel campo visivo di un occhio (in risposta al movimento dalla periferia verso la zona frontale) e l’eccitazione nell’altro (dal frontale alla periferia).(E) Il campo ricettivo facilitato mappato con bersagli mobili verso l’alto (colori caldi) è più forte del più debole, anche se di forma simile, campo ricettivo non facilitato in A. I bersagli spostati verso l’alto nell’altro emifield visivo inibiscono le risposte al di sotto dei livelli spontanei (traccia di dati).DOI:http://dx.doi.org/10.7554/eLife.26478.003Video1.Stimolo visivo per la Figura 1.Il campo ricettivo del CSTMD1 è mappato con una serie di bersagli alla deriva su percorsi brevi(Figura 1A), o un singolo bersaglio alla deriva attraverso la stessa posizione su un percorso lungo(Figura 1B). La separazione di un lungo percorso del bersaglio in due componenti (un primer ed una sonda) ci permette di quantificare la facilitazione indotta da un primer(Figura 1C). Tutti gli studi sono stati presentati in ordine casuale. In questo video gli studi sono presentati senza periodi di riposo, mentre negli esperimenti gli studi sono stati separati da almeno 7 s per minimizzare l’assuefazione.DOI:http://dx.doi.org/10.7554/eLife.26478.00410.7554/eLife.26478.004
In precedenza, abbiamo riportato campi ricettivi nel loro stato agevolato(Dunbier et al., 2012), mappati utilizzando bersagli che si muovono lungo traiettorie orizzontali lunghe(Figura 1D) o verticali(Figura 1E). Questi rivelano il campo eccitatorio ricettivo del CSTMD1 che si estende dalla dorsale, linea mediana visiva alla periferia. Disomogeneità spaziale all’interno di questo campo recettivo (interpolato per ridurre gli artefatti di binning) è probabilmente il risultato di integrazione dendritica sottostante e locali differenze di sintonia spazio-temporale. Nell’altro emisfero visivo (linea mediana a 0° azimut), un bersaglio alla deriva genera inibizione (Figura 1D,E), con attività soppressa al di sotto dei livelli spontanei (0 picchi/s da un’attività spontanea di 11 ± 4 picchi/s, media ± std.).
Qual è l’effetto su un array 2D di risposte ‘sonda’ (percorsi brevi in Figura 1A ) quando un lungo primer viene presentato lungo una singola traiettoria, vincolata , immediatamente precedente ad ogni sonda? Un tale esperimento ci fornirebbe un’istantanea dell’effetto della storia dello stimolo (il bersaglio del primer) sul campo ricettivo corrente. La Figura 2 fornisce esempi di risposte individuali, neuronali a brevi traiettorie del bersaglio (sonde, frecce blu), sia con che senza una precedente traiettoria del bersaglio di durata 1 s (primer, freccia nera). Per ogni posizione della sonda (in una griglia 10 × 10), abbiamo misurato la velocità di picco all’interno di una finestra temporale di 100 ms (le regioni verdi ombreggiate in Figura 2). L’effetto del primer è stato calcolato come differenza (∆ spike rate) tra la risposta della sonda quando preceduta dal primer (primer e sonda, frecce nere e blu) e le condizioni della sola sonda (freccia blu). In questo paradigma, abbiamo cambiato l’offset spaziale (salti) tra primer e sonda senza alcun ritardo(Figura 2A,B) o a seguito di una pausa di 300 ms(Figura 2C,D). Abbiamo anche testato una condizione in cui il bersaglio del primer andava alla deriva verso la linea mediana della libellula, attraverso il campo visivo dell’altro occhio (Figura 2E,F). Assicurandosi che i primer non sono entrati nella regione di sovrapposizione binoculare, qualsiasi cambiamento suscitato nelle posizioni sonda (nell’occhio opposto) deve aver attraversato emisferi cerebrali.10.7554/eLife.26478.005Figure 2.A primer target cambia le risposte della sonda.(A) Tracce di esempio di risposta CSTMD1 di un CSTMD1 a un bersaglio sonda da solo (freccia blu) o a seguito di un bersaglio primer (freccia nera). L’effetto del primer viene misurato come la differenza (∆ tasso di picco) nell’attività di risposta (primer & sonda – sonda da sola) nella corrispondente finestra di 100 ms (regione verde ombreggiata, con vista ingrandita a destra).(B) Con il primer vincolato spazialmente, ripetiamo gli studi di primer & probe e probe da solo in un array a griglia di 100 posizioni (200 studi in totale, randomicamente interleaved).(C, D) Si inserisce una pausa di 300 ms tra le condizioni in cui il primer scompare prima dell’inizio della sonda (cioè simulando un’occlusione del bersaglio).(E, F) Un primer posto nel campo visivo dell’altro occhio e spostato verso i test visivi della linea mediana per le informazioni che attraversano gli emisferi cerebrali.DOI:http://dx.doi.org/10.7554/eLife.26478.005
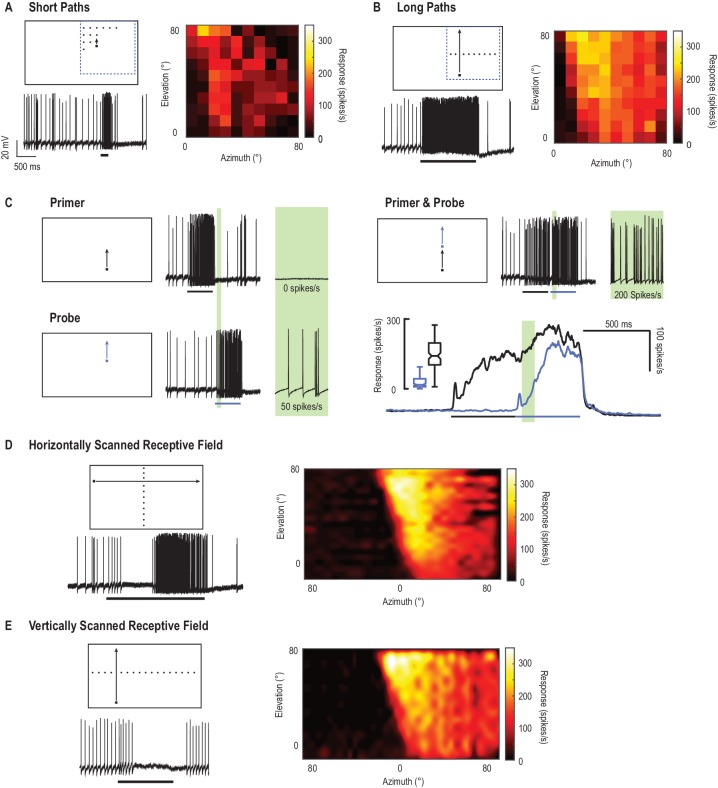
Figura 1.Il campo ricettivo del CSTMD1 mappato con obiettivi alla deriva.(A) Piccoli bersagli (quadrati neri, 1,5°x1,5°) si muovono lungo brevi traiettorie (200 ms) che sono sia verticalmente che orizzontalmente sfasati su una griglia 10 × 10. I pittogrammi sono illustrativi e non in scala. La colormap rivela le risposte del CSTMD1 a questi stimoli producendo un campo ricettivo “non facilitato” (finestra di analisi 50-150 ms).(B) Orizzontalmente offset obiettivi sono alla deriva verticalmente il display del monitor lungo lunghe traiettorie continue che suscitano forti, risposte agevolate (100 ms bins a corrispondenti posizioni spaziali in A).(C) La separazione di lunghe traiettorie in due componenti (primer seguito da sonda), permette di esaminare gli effetti facilitatori all’interno di una breve finestra di analisi (prima della sonda auto-prime, regione verde). In un singolo neurone, abbiamo esaminato i corsi di tempo di risposta (media di 140 repliche nell’arco di due ore) alla sonda ripetuta da sola (linea blu) e le condizioni di primer e sonda (linea nera) (D)Abbiamo precedentemente descritto i campi ricettivi facilitati in risposta ai bersagli alla deriva attraverso l’intero display visivo. I bersagli che si muovono verso destra (offset verticale) rivelano l’inibizione nel campo visivo di un occhio (in risposta al movimento dalla periferia verso la zona frontale) e l’eccitazione nell’altro (dal frontale alla periferia).(E) Il campo ricettivo facilitato mappato con bersagli mobili verso l’alto (colori caldi) è più forte del più debole, anche se di forma simile, campo ricettivo non facilitato in A. I bersagli spostati verso l’alto nell’altro emifield visivo inibiscono le risposte al di sotto dei livelli spontanei (traccia di dati).DOI:
http://dx.doi.org/10.7554/eLife.26478.003

Video 1.2. Stimolo visivo per la Figura 1.Il campo ricettivo del CSTMD1 è mappato con una serie di bersagli che vanno alla deriva su percorsi brevi(Figura 1A), o un singolo bersaglio che va alla deriva attraverso la stessa posizione su un percorso lungo(Figura 1B). La separazione di un lungo percorso del bersaglio in due componenti (un primer e una sonda) ci permette di quantificare la facilitazione indotta da un primer(Figura 1C). Tutti gli studi sono stati presentati in ordine casuale. In questo video gli studi sono presentati senza periodi di riposo, mentre negli esperimenti gli studi sono stati separati da almeno 7 s per minimizzare l’assuefazione.DOI:
http://dx.doi.org/10.7554/eLife.26478.004
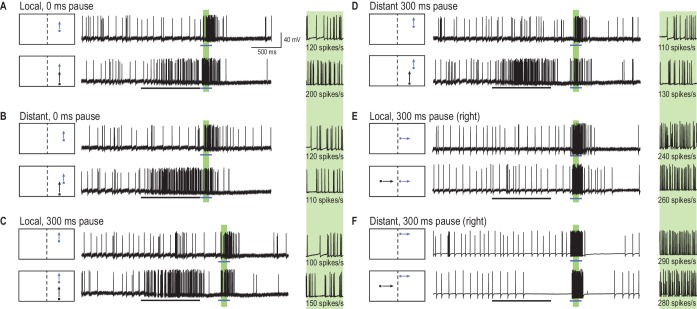
Figura 2.Un target di primer cambia le risposte della sonda.(A) Tracce di esempio della risposta del CSTMD1 ad un bersaglio della sonda da solo (freccia blu) o a seguito di un bersaglio di primer (freccia nera). L’effetto del primer viene misurato come la differenza (∆ tasso di picco) nell’attività di risposta (primer & sonda – sonda da sola) nella corrispondente finestra di 100 ms (regione verde ombreggiata, con vista ingrandita a destra).(B) Con il primer vincolato spazialmente, ripetiamo gli studi di primer & probe e probe alone in un array a griglia di 100 posizioni (200 studi in totale, randomicamente interleaved).(C, D) Si inserisce una pausa di 300 ms tra le condizioni in cui il primer scompare prima dell’inizio della sonda (cioè simulando un’occlusione del bersaglio).(E, F) Un primer posto nel campo visivo dell’altro occhio e spostato verso i test visivi della linea mediana per le informazioni che attraversano gli emisferi cerebrali.DOI:
http://dx.doi.org/10.7554/eLife.26478.005
Modulazione predittiva del guadagno
LaFigura 3A mostra la mappa bidimensionale completa della modulazione del guadagno indotta dal primer, mediata attraverso ripetute registrazioni intracellulari del CSTMD1 in diversi animali. I campi ricettivi sono corretti dal punto di vista prospettico dal punto di vista della libellula ad una mappa dell’occhio di libellula (specchiata lungo la linea mediana verticale) e levigata utilizzando l’interpolazione bicubica per rimuovere gli artefatti di binning. Le linee di contorno della Figura 3A-C indicano le risposte medie non attenuate alla sola condizione della sonda. Nelle prove con primer e sonda, il bersaglio del primer si è spostato verso l’alto (Figura 3A,B, Video 2) o verso destra (Figura 3C) lungo percorsi diversi in ogni prova, ma vincolato all’interno di una regione larga 5° (indicata dalla casella bianca delineata). Al CSTMD1 abbiamo registrato da (con i suoi ingressi eccitanti situati nella parte centrale destra del cervello), i bersagli in movimento verso l’alto e verso destra rappresentano stimoli progressivi (cioè che si muovono da fronte a fronte). La piccola variazione nel percorso del primer ha diminuito l’assuefazione locale da un primer ripetuto che percorre esattamente la stessa traiettoria. Le prove con la sola sonda e quelle con il primer e la sonda sono state randomizzate. La mappa a colori rivela la variazione media dell’attività neuronale (∆ tasso di picco) provocata dal primer spazialmente vincolato per ogni posizione della sonda (primer e sonda – sonda da sola). La figura 3A rivela un pronunciato “focus” di maggiore sensibilità appena prima della posizione finale del bersaglio di priming e un’estesa regione di soppressione nelle località circostanti (media, n = 9 libellule). Quindi, quello che in precedenza abbiamo definito come facilitazione è un fenomeno più complesso – il miglioramento locale con la soppressione del tasso di picco suscitato da sonde saltate nell’ambiente circostante. Qui usiamo il termine “messa a fuoco” per riferirci sia al potenziamento locale che alla diffusa inibizione concomitante. Tale elaborazione neuronale può essere indicativa di un meccanismo di attenuazione, piuttosto che di un’eccitazione o sensibilizzazione globale(Slagter et al., 2016). Nella Figura 3A, abbiamo osservato una grande variazione media del tasso di picco – oltre il 50% di aumento all’interno del centro di messa a fuoco (p=0,0007, n = 9) e fino al 50% di diminuzione nelle località circostanti (p=0,005, n = 9).10.7554/eLife.26478.006Figura 3.Un fuoco predittivo facilita le risposte ad un bersaglio in movimento.(A) Il campo ricettivo della sonda in risposta a brevi traiettorie verticali è indicato da linee di contorno (media, n = 9 libellule). La mappa a colori mostra il cambiamento del tasso di picco (per ogni posizione) dovuto alla traiettoria del primer immediatamente precedente che viene presentata all’interno della casella bianca delineata. Il cambiamento nell’attività di spike nella finestra di analisi corrispondente rivela un miglioramento >50% davanti al bersaglio in movimento (rosso), ma la soppressione nel contorno (blu).(B) Con un ritardo di 300 ms introdotto dopo il primer, il fuoco si diffonde in avanti (mappa a colori, n = 7 libellule), stimando la posizione teorica futura del bersaglio (mirino bianco).(C) Il primer si sposta verso la linea mediana nel campo visivo dell’altro occhio, evitando la sovrapposizione binoculare. Il fuoco si trasferisce tra gli emisferi cerebrali, con un miglioramento spazialmente localizzato di fronte al bersaglio e la soppressione a quote più elevate (mappa a colori, n = 7 libellule).(D) Abbiamo esaminato la significatività statistica di tutte e tre le mappature (Figura A-C) calcolando la dimensione dell’effetto in ogni posizione spaziale (Cohen’s d). Vediamo valori all’interno dell’intervallo ±1,8, ben al di sopra di quelli considerati come dimensioni di effetto di grandi dimensioni (>0,5). Per i punti spaziali di interesse (+), calcoliamo la corrispondente significatività statistica (valore P) tra le versioni primer & probe e probe alone (E) C’è uno spostamento in avanti nella regione di messa a fuoco (media ± SEM, p=0,03, n = 12 libellule) dopo un’occlusione (cfr. 100 ms pausa, linea gialla con 300 ms pausa, linea verde). Le posizioni di destinazione previste a seguito di occlusioni sono indicate con un reticolo di colori (3° per 100 ms e 9° per 300 ms).DOI:http://dx.doi.org/10.7554/eLife.26478.006
Se il primer scompare per 300 ms prima di ogni sonda, è ancora evidente una messa a fuoco altrettanto intensa(Figura 3B, Video 2), ma ora diffusa in avanti in estensione spaziale (p=0,005, n = 7 libellule). Il fuoco sembra tener conto della posizione del bersaglio previsto se avesse continuato sulla sua traiettoria originale (fino ad una posizione come indicato dal reticolo bianco in Figura 3B,C), anche se con una maggiore incertezza data la sua più ampia estensione spaziale (media, n = 7 libellule). Inoltre, se spostiamo un primer orizzontale verso la linea mediana visiva nell’occhio controlaterale prima che scompaia per 300 ms, il fuoco si trasferisce attraverso il cervello all’emisfero omolaterale(Figura 3C). Abbiamo poi osservato un miglioramento (rosso) localizzato in un’ampia regione prima della traiettoria del primer (p = 0,004, n = 7 libellule), ma una forte soppressione (blu) a quote più elevate (p = 0,02, n = 7 libellule). Le libellule hanno una piccola area di sovrapposizione binoculare tra i due occhi corrispondente al campo visivo frontale e dorsale(Horridge, 1978). Il nostro stimolo è stato attentamente progettato per evitare che questa regione scompaia poco prima di entrare nell’area di sovrapposizione. Pertanto, il nostro risultato non può essere spiegato con una facilitazione che si rigenera nell’occhio omolaterale. Piuttosto deve comportare un trasferimento localizzato e interemisferico di informazioni. Inoltre, una combinazione localizzata e spazialmente separata di valorizzazione e soppressione (regioni rosse e blu nella Figura 3C) non può essere spiegata da un semplice meccanismo globale, come, ad esempio, un rimbalzo post-inibizione a seguito di un forte stimolo inibitorio(Bolzon et al., 2009). Questo trasferimento di un focus predittivo tra emisferi cerebrali è probabile che giochi un ruolo cruciale nella previsione della posizione del bersaglio durante i voli di inseguimento in cui l’inseguitore tenta di fissare il bersaglio frontalmente(Mischiati et al., 2015). I voli di inseguimento prolungati di conspecifici comportano percorsi altamente contorti in cui il bersaglio può facilmente passare da un campo visivo all’altro(Land e Collett, 1974). Nella Figura 3D, mostriamo le dimensioni dell’effetto delle tre mappe(Figura 1A-C) in tutte le posizioni spaziali. Questi valori d di Cohen sono le differenze medie tra primer & probe e probe da soli (∆ spike rate), divisi per la deviazione standard di queste differenze. I valori d di Cohen oltre 0,5 sono considerati grandi dimensioni effetto, quindi i nostri valori fino a 1,8 sia in direzioni eccitatorie e inibitorie sono considerevoli. Per particolari punti in queste mappe(Figura 3D, +’s) calcoliamo i valori P accoppiati, a due code, evidenziando l’effetto statisticamente significativo del primer.Video 2.Visual stimolo per la Figura 3. Il campo ricettivo non facilitato è mappato da una griglia 10 × 10 di sonde che si muovono su percorsi brevi (Figura 3A, linee dicontorno, solo cinque prove mostrate in questo video). Un primer va alla deriva su una lunga traiettoria verso il centro dello schermo, prima di ripetere la presentazione di ogni sonda. Prove identiche sono replicate con una pausa di 300 ms che separa il primer dalla sonda(Figura 3B). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:http://dx.doi.org/10.7554/eLife.26478.00710.7554/eLife.26478.007
LaFigura 3E mostra i dati di altre 12 libellule, dove abbiamo mappato il fuoco di diffusione in avanti seguendo un ritardo di 100 ms o 300 ms lungo una singola dimensione. Questi dati (media ± SEM) mostrano che un piccolo (6°) salto all’indietro esattamente sul percorso precedentemente innescato ripristina già la magnitudo della risposta a quella della risposta non attenuata (linea tratteggiata), mentre salti più grandi all’indietro (12°) rivelano una potente soppressione. Considerando che il salto più grande in questo caso sta stimolando una parte del campo ricettivo che ha visto per ultimo il bersaglio fino a 700 ms prima, la profonda inibizione vista per questo stimolo suggerisce che il bersaglio primer precedente esercita effetti duraturi sul campo ricettivo circostante. I bersagli che saltano in avanti dopo un ritardo rivelano uno spostamento di facilitazione, diffondendosi ulteriormente in avanti dopo 300 ms (linea verde), rispetto ai 100 ms (linea gialla). Esaminando la differenza media combinata attraverso tutti i salti in avanti (6°, 12° e 18°) si nota una differenza statisticamente significativa tra le pause di 100 ms e 300 ms (p=0,03, d di Cohen = 0,7). Qui il bersaglio della sonda ha seguito direttamente ‘sul percorso’ verso lo stimolo di adescamento, senza i piccoli offset orizzontali (fino a 5°, Figura 3A-C regione di adescamento bianco ) utilizzati in precedenza per limitare l’assuefazione locale.
In altre otto libellule, invece di limitare la posizione del nostro primer, abbiamo invece testato le risposte alle sonde che atterravano sempre nella stessa posizione seguendo diversi primer. Questa sonda stereotipata ha seguito o un salto nello spazio, o una pausa nel tempo, o una combinazione di entrambi i test. La Figura 4A-D mostra i tempi di risposta normalizzati dei singoli esempi di CSTMD1. Il piccolo salto istantaneo di 4° davanti al primer porta ad un andamento del tempo di risposta con un aumento molto rapido ad un livello simile allo stato completamente facilitato (Figura 4A). Tuttavia, un salto istantaneo di 12° provoca un andamento del tempo di risposta simile (più lento) alla sonda non facilitata (linea grigia), confermando la limitata misura in cui la facilitazione si estende inizialmente davanti al percorso del bersaglio. Un grande salto di 20° in avanti (Figura 4A) che bypassa completamente la regione di messa a fuoco, rivela ancora una volta la soppressione del contorno, con un andamento del tempo di risposta molto più lento rispetto al controllo. Salti istantanei all’indietro(Figura 4B) rivelano anche una potente soppressione.10.7554/eLife.26478.008Figure 4.Spatial salti e pause temporali nelle traiettorie del bersaglio.(A) La risposta normalizzata del CSTMD1 ad una breve traiettoria della sonda costruisce oltre diverse centinaia di millisecondi (linea grigia) ed è modificata dalla posizione e dal tempo di un bersaglio di adescamento di 500 ms. Le sonde sono saltate in avanti immediatamente dopo il primer, rivelano risposte kfacilitate (4° in avanti), risposte non facilitate (12° in avanti) e soppressione (20° in avanti), indicative della regione di messa a fuoco in Figura 3.(B) Un salto immediatamente indietro sul percorso del primer mostra risposte non facilitate (4° dietro) o fortemente inibite (12° o 20° dietro).(C) L’inserimento di una pausa temporale tra il primer e la sonda mostra che la facilitazione più debole persiste nella posizione del primer per oltre 500 ms, diminuendo con l’aumentare della durata della pausa.(D) La combinazione di una breve pausa con un salto rivela una diffusione in avanti della facilitazione che potrebbe spiegare un’occlusione. (A-D, n = 9 repliche tecniche da una libellula) (E) Nella posizione dell’ultimo bersaglio visto (dimensione del salto 0°), le risposte della sonda diminuiscono a volte dopo la scomparsa del primer (p=0,0005). In confronto, le risposte alle sonde saltate di 12° e 20° in avanti aumentano se abbinate alle corrispondenti durate di occlusione di 300 ms (p=0,008) e 500 ms (p=0,008). Gli asterischi indicano il significato, n = 8 libellule.DOI:http://dx.doi.org/10.7554/eLife.26478.008
Le pause senza salto (0°), mostrano che la forza di facilitazione decade lentamente nel tempo nell’ultima posizione vista del bersaglio (Figura 4C,E, d diCohen= 4,48). Senza pausa (0 ms), le risposte più forti si verificano 4° davanti al bersaglio in movimento (Figura 4E) come osservato nei campi ricettivi 2D (Figura 3A). Dato che il bersaglio si muove a 40°/s, avrebbe attraversato 4°, 12° e 20° durante le ‘occlusioni’ di pausa di 100 ms, 300 ms e 500 ms rispettivamente. Quando i salti più grandi sono abbinati alle rispettive pause, come ci si potrebbe aspettare durante le occlusioni di traiettoria (12° e 300 ms; 20° e 500 ms) c’è un aumento statisticamente significativo dell’attività di picco risultante (Figura4E, Cohen d = 2.0 e 2.32 rispettivamente).
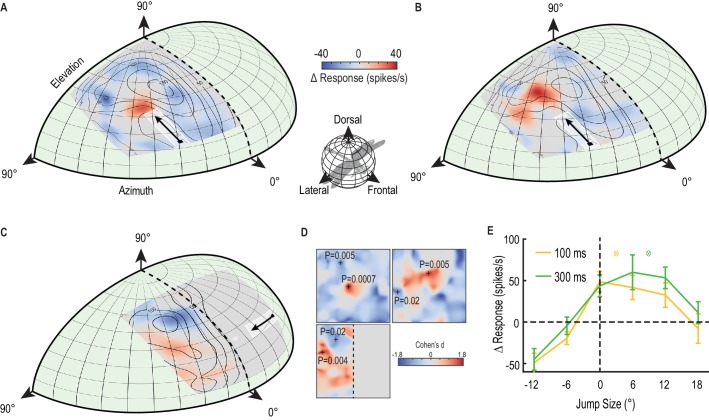
Figura 3.Un focus predittivo facilita le risposte ad un target in movimento.(A) Il campo ricettivo della sonda in risposta a brevi traiettorie verticali è indicato da linee di contorno (media, n = 9 libellule). La mappa a colori mostra il cambiamento del tasso di picco (per ogni posizione) dovuto alla traiettoria del primer immediatamente precedente che viene presentata all’interno della casella bianca delineata. Il cambiamento nell’attività di spike nella finestra di analisi corrispondente rivela un miglioramento >50% davanti al bersaglio in movimento (rosso), ma la soppressione nel contorno (blu).(B) Con un ritardo di 300 ms introdotto dopo il primer, il fuoco si diffonde in avanti (mappa a colori, n = 7 libellule), stimando la posizione teorica futura del bersaglio (mirino bianco).(C) Il primer si sposta verso la linea mediana nel campo visivo dell’altro occhio, evitando la sovrapposizione binoculare. Il fuoco si trasferisce tra gli emisferi cerebrali, con un miglioramento spazialmente localizzato di fronte al bersaglio e la soppressione a quote più elevate (mappa a colori, n = 7 libellule).(D) Abbiamo esaminato la significatività statistica di tutte e tre le mappature (Figura A-C) calcolando la dimensione dell’effetto in ogni posizione spaziale (Cohen’s d). Vediamo valori all’interno dell’intervallo ±1,8, ben al di sopra di quelli considerati come dimensioni di effetto di grandi dimensioni (>0,5). Per i punti spaziali di interesse (+), calcoliamo la corrispondente significatività statistica (valore P) tra le versioni primer & probe e probe alone (E) C’è uno spostamento in avanti nella regione di messa a fuoco (media ± SEM, p=0,03, n = 12 libellule) dopo un’occlusione (cfr. 100 ms pausa, linea gialla con 300 ms pausa, linea verde). Le posizioni di destinazione previste a seguito di occlusioni sono indicate con un reticolo di colori (3° per 100 ms e 9° per 300 ms).DOI:
http://dx.doi.org/10.7554/eLife.26478.006

Video 2.Stimolo visivo per la Figura 3.Il campo ricettivo non facilitato è mappato da una griglia 10 × 10 di sonde che si muovono su percorsi brevi (Figura 3A, linee di contorno, solo cinque prove mostrate in questo video). Un primer va alla deriva su una lunga traiettoria verso il centro dello schermo, prima di ripetere la presentazione di ogni sonda. Prove identiche sono replicate con una pausa di 300 ms che separa il primer dalla sonda(Figura 3B). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:
http://dx.doi.org/10.7554/eLife.26478.007
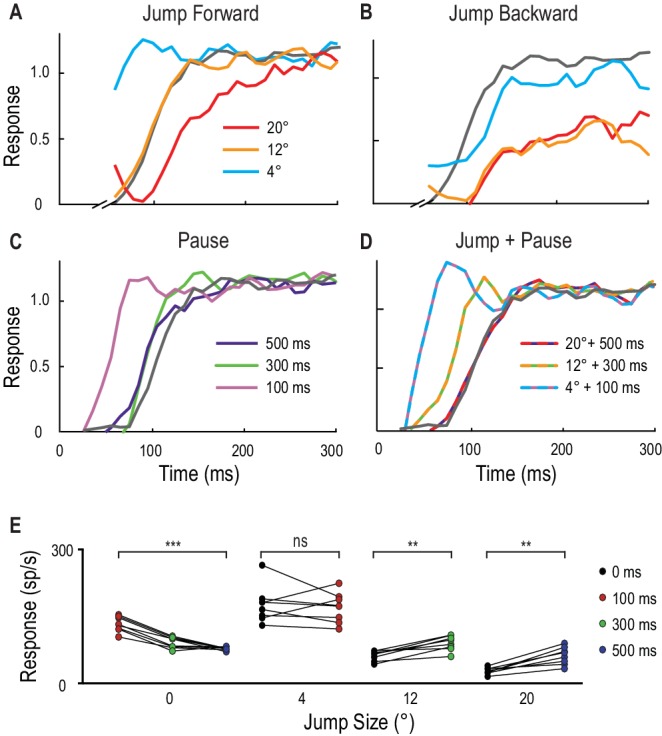
Figura 4.Salti spaziali e pause temporali nelle traiettorie di destinazione.(A) La risposta normalizzata del CSTMD1 ad una breve traiettoria di sonda costruisce oltre diverse centinaia di millisecondi (linea grigia) ed è modificata dalla posizione e dal tempo di un bersaglio di adescamento di 500 ms. Le sonde sono saltate in avanti immediatamente dopo il primer, rivelano risposte kfacilitate (4° in avanti), risposte non facilitate (12° in avanti) e soppressione (20° in avanti), indicative della regione di messa a fuoco in Figura 3.(B) Un salto immediatamente indietro sul percorso del primer mostra risposte non facilitate (4° dietro) o fortemente inibite (12° o 20° dietro).(C) L’inserimento di una pausa temporale tra il primer e la sonda mostra che la facilitazione più debole persiste nella posizione del primer per oltre 500 ms, diminuendo con l’aumentare della durata della pausa.(D) La combinazione di una breve pausa con un salto rivela una diffusione in avanti della facilitazione che potrebbe spiegare un’occlusione. (A-D, n = 9 repliche tecniche da una libellula) (E) Nella posizione dell’ultimo bersaglio visto (dimensione del salto 0°), le risposte della sonda diminuiscono a volte dopo la scomparsa del primer (p=0,0005). In confronto, le risposte alle sonde saltate di 12° e 20° in avanti aumentano se abbinate alle corrispondenti durate di occlusione di 300 ms (p=0,008) e 500 ms (p=0,008). Gli asterischi indicano il significato, n = 8 libellule.DOI:
http://dx.doi.org/10.7554/eLife.26478.008
I primer aumentano la sensibilità al contrasto
I dati presentati fino ad ora dimostrano la validità di un complesso meccanismo predittivo che funziona per aumentare le risposte in una regione in cui è probabile che un obiettivo visto nel recente passato si sposti nel prossimo futuro. Nei primati, un effetto noto di tali effetti di attenuazione o di aspettativa è l’aumento della sensibilità al contrasto locale (controllo del guadagno)(Reynolds et al., 2000; Carrasco et al., 2000). Per quantificare le variazioni di guadagno, abbiamo misurato le risposte alle diverse sonde di contrasto, precedute da un primer a basso o alto contrasto(Figura 5A,B, Video 3). Entrambi i primer hanno indotto un grande aumento della risposta, con un campo di uscita più ampio (aumento della risposta massima) e un aumento maggiore di 5 volte della sensibilità di contrasto(Figura 5C, soglia di contrasto ridotta da 0,071 a 0,013 per stimoli vicini alla soglia, C50 da 0,36 a 0,13, n = 9 libellule). I primer di contrasto più bassi inducono essi stessi una minore attività complessiva durante lo stimolo di adescamento(Figura 5D, Cohen d = 0,97), ma il loro effetto sulle risposte successive agli stimoli presentati nella posizione prevista è notevolmente simile ai primer ad alto contrasto (cfr. rosa con linee rosse nella Figura 5C). Ciò suggerisce che la modulazione del guadagno non è suscitata solo dal contrasto dello stimolo o dall’attività neuronale indotta dal primer in sé, ma piuttosto dalla presenza del target. Ciò può indicare un processo di “commutazione”, come quello suggerito per i circuiti neurali nel tronco cerebrale uditivo del barbagianni (Mysoreet al., 2011), piuttosto che un meccanismo di controllo del guadagno più semplice e dipendente dall’attività. Un’altra caratteristica interessante della sensibilità al contrasto facilitata è che la spinta del guadagno di risposta è maggiore a metà contrasto, con saturazione più morbida a contrasti elevati, estendendo la gamma di contrasti su cui la risposta è modulata di un ordine di grandezza completo. Entrambe le osservazioni hanno senso considerando il contesto naturale per il rilevamento del bersaglio. Durante i voli di inseguimento, le risorse potrebbero quindi essere dirette verso la posizione prevista del bersaglio, indipendentemente dal suo contrasto variabile mentre si muove su uno sfondo disordinato. Inoltre, la riduzione della pendenza della funzione di sensibilità di contrasto ridurrebbe la varianza della risposta complessiva ai cambiamenti nel contrasto del bersaglio selezionato, un fenomeno osservato anche negli esseri umani(Avidan et al., 2002).10.7554/eLife.26478.009Figure 5.Low o ad alto contrasto primer aumentare la sensibilità di contrasto della sonda.(A) O un primer a basso o alto contrasto è presentato prima di variare le sonde di contrasto (funzione di sensibilità di contrasto). Queste o continuano la traiettoria del percorso o saltano ad una posizione distante.(B) Tracce di dati di esempio delle risposte ai primer a basso (grigio) o alto (nero) contrasto che sono presentate prima di una serie di sonde di contrasto variabili (blu chiaro, medio e blu scuro)(C) La sensibilità del CSTMD1 alle sonde di contrasto variabili mostra una funzione sigmoidale (grigio), con la linea tratteggiata che indica una soglia di rilevamento al di sopra dei livelli spontanei. A seguito di un vicino primer a basso contrasto (rosa) o ad alto contrasto (rosso), la sensibilità di contrasto è sostanzialmente aumentata (n = 9 libellule, p<0,0001). Un primer distante (giallo) non provoca facilitazioni, anche se l’attività di spiking durante i primer a basso e alto contrasto (finali 100 ms) è significativamente diversa (inset, n = 9 libellule, p=0,02).(D) In risposta ad uno stimolo eccitatorio (ad esempio, la stimolazione ad alto contrasto), il potenziale di membrana sottostante è iperpolarizzato, una forma di movimento dopo l’effetto (MAE).(E) Il movimento iperpolarizzante dopo l’effetto è correlato alla forza (ad esempio il contrasto obiettivo) dello stimolo.DOI:http://dx.doi.org/10.7554/eLife.26478.009Video3.Stimolo visivo per la Figura 5.Sonde di contrasto variabile deriva su percorsi brevi per determinare la sensibilità di contrasto non facilitato(Figura 5C, solo 1 contrasto mostrato in video). Le sonde sono quindi precedute da un primer ad alto contrasto che va alla deriva sullo stesso percorso orizzontale della sonda – High Contrast Primed (locale), o su un diverso percorso orizzontale – High Contrast Primed (distante). Le prove primerizzate vengono ripetute anche con primer a basso contrasto (Primer a basso contrasto). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:http://dx.doi.org/10.7554/eLife.26478.01010.7554/eLife.26478.010
I nostri risultati mostrano anche che l’aumentata sensibilità al contrasto è localizzata nella regione di messa a fuoco evidente nella Figura 3. Un primer più distante, spostato di 20° sul lato della sonda, non evoca la facilitazione della funzione di sensibilità di contrasto (Figura 5C). Invece, la funzione di sensibilità di contrasto rivela un effetto più debole della soppressione del bordo osservato nei campi ricettivi 2-D(Figura 3). Questi esperimenti di contrasto hanno utilizzato una durata del primer più breve (600 ms vs. 1 s), suggerendo che la soppressione potrebbe risultare in parte dall’attività globale del CSTMD1, piuttosto che dall’elaborazione presinaptica. Facilitare gli stimoli certamente aumentare il tasso di cottura contro un potenziale di membrana costantemente iperpolarizzante(Figura 5D). A seguito di un primer ad alto contrasto, questo movimento iperpolarizzante dopo l’effetto (MAE) raggiunge quasi 4 mV e sopprime la successiva attività di spiking per diverse centinaia di millisecondi(Figura 5D, E), una attenuazione che può competere con la facilitazione spazialmente localizzata. L’interazione tra il corso del tempo di facilitazione e la soppressione a lungo termine con la cinetica lenta può essere analoga alla “inibizione del ritorno” osservata negli esperimenti sui tempi di reazione umana (Posnere Cohen, 1984).
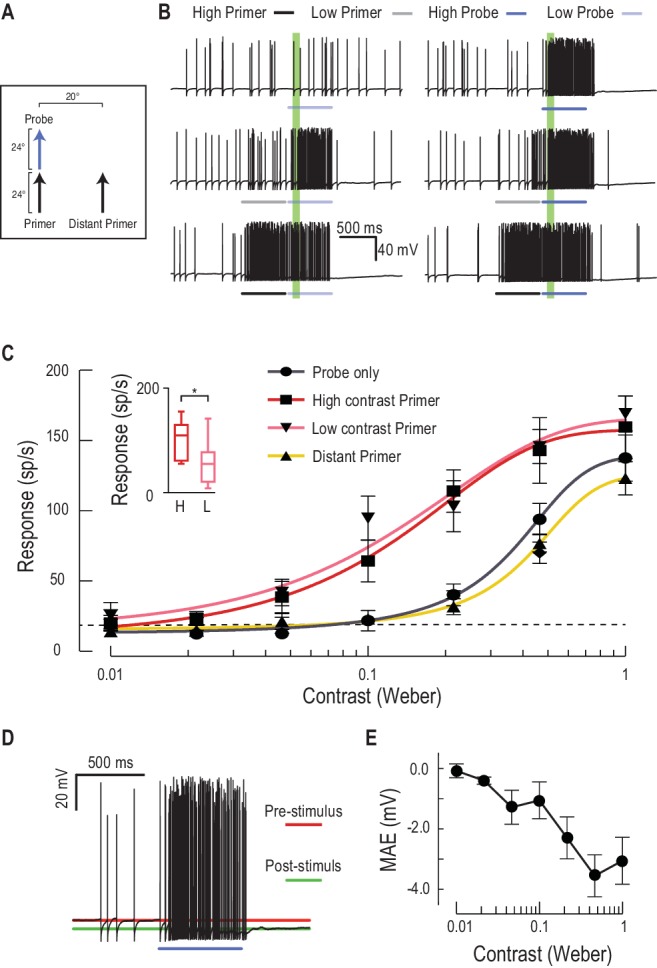
Figura 5.Primer a basso o alto contrasto aumentano la sensibilità di contrasto della sonda.(A) O un primer a basso o alto contrasto è presentato prima di variare le sonde di contrasto (funzione di sensibilità di contrasto). Queste o continuano la traiettoria del percorso o saltano verso un punto distante.(B) Tracce di dati di esempio delle risposte ai primer a basso (grigio) o alto (nero) contrasto che sono presentate prima di una serie di sonde di contrasto variabili (blu chiaro, medio e blu scuro)(C) La sensibilità del CSTMD1 alle sonde di contrasto variabili mostra una funzione sigmoidale (grigio), con la linea tratteggiata che indica una soglia di rilevamento al di sopra dei livelli spontanei. A seguito di un vicino primer a basso contrasto (rosa) o ad alto contrasto (rosso), la sensibilità di contrasto è sostanzialmente aumentata (n = 9 libellule, p<0,0001). Un primer distante (giallo) non provoca facilitazioni, anche se l’attività di spiking durante i primer a basso e alto contrasto (finali 100 ms) è significativamente diversa (inset, n = 9 libellule, p=0,02).(D) In risposta ad uno stimolo eccitatorio (ad esempio, la stimolazione ad alto contrasto), il potenziale di membrana sottostante è iperpolarizzato, una forma di movimento dopo l’effetto (MAE).(E) Il movimento iperpolarizzante dopo l’effetto è correlato alla forza (ad esempio il contrasto obiettivo) dello stimolo.DOI:
http://dx.doi.org/10.7554/eLife.26478.009

Video 3.4. Stimolo visivo per la Figura 5.Sonde di variabilità del contrasto vanno alla deriva su percorsi brevi per determinare la sensibilità di contrasto non attenuata(Figura 5C, solo 1 contrasto mostrato in video). Le sonde sono quindi precedute da un primer ad alto contrasto che va alla deriva sullo stesso percorso orizzontale della sonda – High Contrast Primed (locale), o su un diverso percorso orizzontale – High Contrast Primed (distante). Le prove primerizzate vengono ripetute anche con primer a basso contrasto (Primer a basso contrasto). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:
http://dx.doi.org/10.7554/eLife.26478.010
I primer inducono la direzionalità
La risposta facilitata del CSTMD1 sembra essere solo debolmente selettiva in termini di direzione quando viene stimolata con obiettivi che si muovono lungo percorsi prolungati. All’interno di ogni campo elettromagnetico, il CSTMD1 ha una debole preferenza per il movimento progressivo verso l’alto e lontano dalla linea mediana (verso destra per i neuroni qui registrati)(Nordström et al., 2011). Per verificare se il focus anticipa anche la direzione di un bersaglio in movimento, abbiamo presentato un primer che si muove lungo una delle quattro direzioni cardinali, seguito da una sonda che si muove in otto possibili direzioni(Figura 6A,B, Video 4). Le risposte della sola sonda sono sia deboli che debolmente selettive per direzione(Figura 6C, punti grigi). Ma tutti e quattro i primer facilitano le risposte al massimo nella direzione del percorso del primer, spostando la sintonizzazione della direzione in modo che corrisponda a quella del primer (Figura 6C). Il rapporto b1/b0 è una misura della forza della direzionalità che è simile per ciascuna delle condizioni(Figura 6D). Tuttavia, l’entità della facilitazione(Figura 6E) è considerevolmente più grande nella debole direzione preferita del CSTMD1 (verso l’alto e verso destra per il CSTMD1 di questo emisfero). Tali bersagli sarebbero quelli che si allontanano dalla direzione della libellula (Olberg, 1986) con il CSTMD1 simmetrico a specchio che dovrebbe mostrare la preferenza direzionale ai bersagli progressivi che si muovono verso l’alto e verso sinistra. Ciò suggerisce che la preferenza sia della sintonizzazione sottostante che del reclutamento di facilitazione può essere collegata ad un ruolo di controllo nell’elaborazione a valle delle traiettorie del bersaglio per l’inseguimento. A seguito di un’inversione della traiettoria del bersaglio(Figura 6F, linee blu e viola), la risposta del CSTMD1 è fortemente inibita rispetto alla corrispondente risposta della sola sonda (linee grigie). Questo contrasta con i risultati nella retina vertebrata, dove un sottoinsieme di cellule gangliari rispondono fortemente e in modo sincrono alle inversioni di movimento(Schwartz et al., 2007).10.7554/eLife.26478.011Figure 6.Primer direzione stabilisce selettività direzione della sonda.(A) Primer di quattro direzioni possibili (a destra, verso l’alto, a sinistra, verso il basso) preceduto risposte sonda in ciascuna delle otto direzioni possibili.(B) Esempi di tracce individuali ad un sottoinsieme delle condizioni dell’esperimento. Il periodo di analisi è indicato in verde.(C) Le risposte della sonda sono deboli (punti grigi) fino a seguire un primer (in una delle quattro direzioni cardinali) e sono più facilitate nella direzione del primer (media ± SEM, n = 9 libellule).(D) Il b1/b0 è un indice che mostra la forza della direzionalità.(E) La grandezza e la direzione del vettore del grafico polare (media ±95% CI), mostra che la selettività della direzione della sonda si allinea generalmente con la direzione del primer.(F) Sia verso l’alto o verso il basso sonda da sola (linee grigie) evocano risposte robuste. Tuttavia, le “inversioni” (sonde opposte in direzione opposta a quella di un primer precedente) generano una forte e duratura inibizione (corso del tempo medio, n = 9 libellule).DOI:http://dx.doi.org/10.7554/eLife.26478.011Video4.Stimolo visivo per la Figura 6.Sonde deriva in 8 direzioni uniche per determinare la sintonizzazione direzione non facilitato di CSTMD1(Figura 6C, solo 4 direzioni mostrate nel video). Le stesse 8 sonde sono precedute da primer che si muovono in ognuna delle 4 direzioni cardinali (solo verso l’alto primer mostrato). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:http://dx.doi.org/10.7554/eLife.26478.01210.7554/eLife.26478.012
Il reclutamento di risposte potenziate nella direzione di marcia rappresenta un’alterazione della selettività di direzione nei rilevatori di movimento locali sottostanti, o deriva dalla posizione di offset del fuoco della modulazione di guadagno situato poco prima della posizione del bersaglio più recente(Figura 3A)? Abbiamo testato questo fatto saltando lo stimolo della sonda di 4° in avanti nel centro previsto della regione di messa a fuoco (Figura 7A, Video 5). Questo stimolo ha indotto una selettività di direzione molto più debole(Figura 7B) rispetto a quelle che si irradiano lontano dalla fine dello stesso percorso di adescamento (rapporto b1/b0 di 0,32 vs. 0,50, p=0,04). Le sonde che invertono la direzione rispetto al primer non sono facilitate, tranne quando la sonda salta di 4° nel centro di messa a fuoco (Figura 7C, d diCohen= 3,90). Quindi, il focus predittivo della modulazione del guadagno è un fenomeno spaziale, stabilito dalla traiettoria passata. Ciò suggerisce che l’apparente selettività della direzione indotta dai primer non è dovuta ad alcun cambiamento nella polarizzazione locale dei rivelatori di movimento sottostanti a una qualsiasi direzione di stimolo, ma piuttosto allo spostamento complessivo del fuoco davanti alla posizione del bersaglio. Sulla traiettoria di sviluppo di un bersaglio, la selettività della direzione (qui quantificata come grandezza vettoriale) è stabilita anche più rapidamente del guadagno nella risposta facilitata (Figura 7D). L’emergere della sintonizzazione direzionale solleva l’intrigante possibilità che la modulazione aiuti l’anticipazione delle traiettorie del bersaglio – promuovendo l’aspettativa di un percorso continuo. Come tale sintonizzazione corrisponda ad inseguimenti a circuito chiuso della libellula con la sua preda o conspecifici non è ancora noto.10.7554/eLife.26478.013Figure 7.Direction selectivity è il risultato di una facilitazione spaziale.(A) L’esperimento di direzione è ripetuto, ora con un salto di 4° in avanti sotto i riflettori.(B) Le risposte sono facilitate per tutte le direzioni (media ± SEM, n = 5 libellule) con selettività direzione diminuita (b1/b0).(C) Le sonde nella direzione opposta al loro corrispondente primer non rivelano alcuna facilitazione o inibizione, tranne quando saltano [J] sotto i riflettori (p=0,03).(D) L’ampiezza della selettività di direzione si basa su una scala temporale più veloce rispetto all’inizio della risposta.DOI:http://dx.doi.org/10.7554/eLife.26478.013Video5.Stimolo visivo per la Figura 7.Probes sono presentati in modo identico alla Figura 6C. Tuttavia, qui le sonde sono preceduti da un primer verticale che termina 4 ° sotto la posizione di inizio sonda (Figura 7B). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:http://dx.doi.org/10.7554/eLife.26478.01410.7554/eLife.26478.014
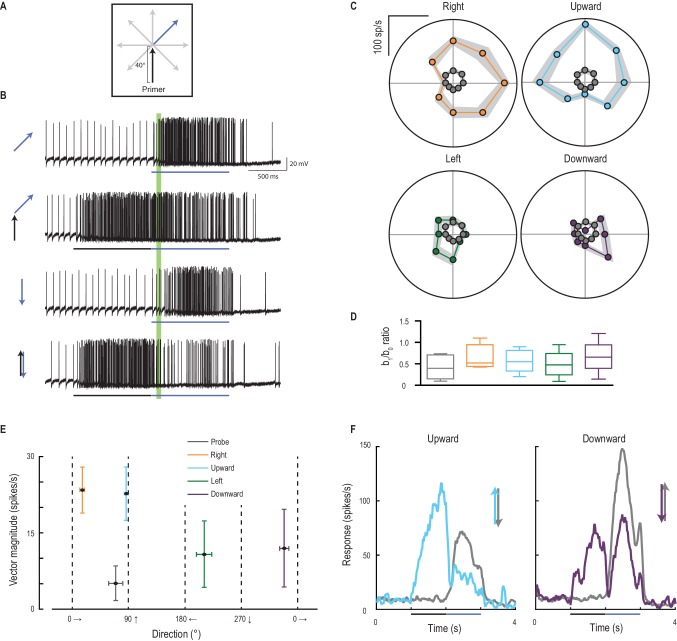
Figura 6.La direzione del primer stabilisce la selettività della direzione della sonda.(A) I primer di quattro possibili direzioni (destra, verso l’alto, sinistra, verso il basso) precedono le risposte della sonda in ognuna delle otto possibili direzioni.(B) Esempi di tracce individuali ad un sottoinsieme delle condizioni dell’esperimento. Il periodo di analisi è indicato in verde.(C) Le risposte della sonda sono deboli (punti grigi) fino a seguire un primer (in una delle quattro direzioni cardinali) e sono più facilitate nella direzione del primer (media ± SEM, n = 9 libellule).(D) Il b1/b0 è un indice che mostra la forza della direzionalità.(E) La grandezza e la direzione del vettore del grafico polare (media ±95% CI), mostra che la selettività della direzione della sonda si allinea generalmente con la direzione del primer.(F) Sia verso l’alto o verso il basso sonda da sola (linee grigie) evocano risposte robuste. Tuttavia, le “inversioni” (sonde opposte in direzione opposta a quella di un primer precedente) generano una forte e duratura inibizione (tempo medio percorso, n = 9 libellule).DOI:
http://dx.doi.org/10.7554/eLife.26478.011

Video 4.Stimolo visivo per la Figura 6.Le sonde vanno alla deriva in 8 direzioni uniche per determinare la sintonizzazione della direzione non filtrata del CSTMD1(Figura 6C, solo 4 direzioni mostrate nel video). Le stesse 8 sonde sono precedute da primer che si muovono in ognuna delle 4 direzioni cardinali (solo verso l’alto primer mostrato). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:
http://dx.doi.org/10.7554/eLife.26478.012
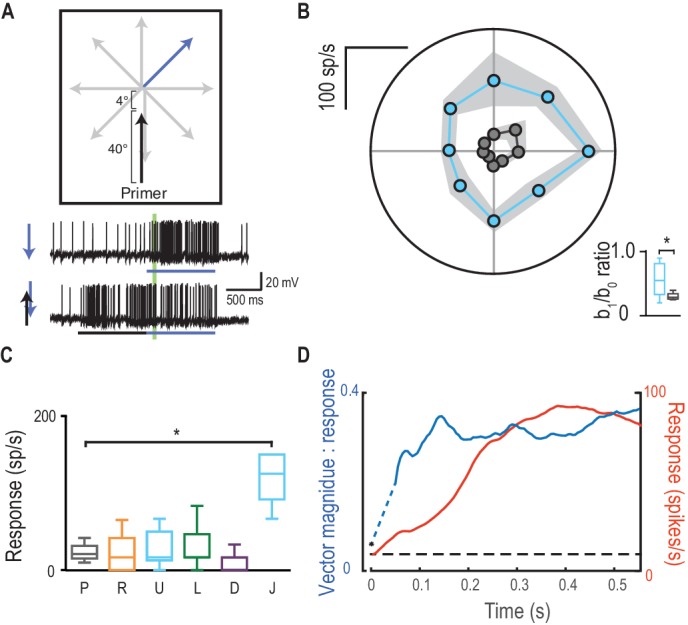
Figura 7.La selettività della direzione è il risultato di una facilitazione spaziale.(A) L’esperimento di direzione è ripetuto, ora con un salto di 4° in avanti nel riflettore.(B) Le risposte sono facilitate per tutte le direzioni (media ± SEM, n = 5 libellule) con selettività di direzione diminuita (b1/b0).(C) Le sonde nella direzione opposta al loro corrispondente primer non rivelano alcuna facilitazione o inibizione, tranne quando saltano [J] sotto i riflettori (p=0,03).(D) L’ampiezza della selettività di direzione si basa su una scala temporale più veloce rispetto all’inizio della risposta.DOI:
http://dx.doi.org/10.7554/eLife.26478.013

Video 5.Stimolo visivo per la Figura 7.Le sonde sono presentate in modo identico alla Figura 6C. Tuttavia, qui le sonde sono precedute da un primer verticale che termina 4° sotto la posizione di inizio sonda (Figura 7B). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:
http://dx.doi.org/10.7554/eLife.26478.014
Facilitazione nei neuroni retinotopici precedenti
Il CSTMD1 è un neurone di ordine superiore con ingressi nel tubercolo ottico anteriore, una destinazione di uscita del mesencefalo dei lobi interniuroni ottici. Abbiamo anche testato la componente facilitatoria della modulazione del guadagno predittivo nei probabili neuroni pre-cursore: STMD a piccolo campo (SF) situati in una fase precedente dell’elaborazione visiva(Barnett et al., 2007). Gli SF-STMD organizzati retinotopicamente hanno ingressi nel lobula esterno, una regione simile alla corteccia visiva primaria dei mammiferi(Okamura e Strausfeld, 2007; O’Carroll 1993). Hanno proprietà simili a quelle delle cellule end-stop (ipercomplesse)(Nordström e O’Carroll, 2009), che sono modulate da stimoli contestuali presentati al di fuori del loro classico campo ricettivo (Polatet al., 1998). Abbiamo presentato primer al di fuori dei campi ricettivi di SF-STMD, che a loro volta non inducono alcuna attività al di sopra dei livelli spontanei(Figura 8A,B, Video 6, n = 13 libellule), con stimoli sonda che si limitano al campo ricettivo classico (eccitatorio). I primer che si muovono verso il campo ricettivo facilitano le risposte della sonda di oltre il 40%, mentre quelli che si allontanano non provocano alcuna facilitazione. Questa modulazione del guadagno predittivo può essere ereditata e migliorata a valle, poiché osserviamo la facilitazione anche in altri neuroni STMD a grande campo, con un guadagno medio di oltre l’80%(Figura 8C, d di Cohen = 1,02). Le risposte individuali di STMD sia di piccolo che di grande campo variano in forza di facilitazione, così come l’attività complessiva. L’organizzazione retinotopica(Figura 8D) e la facilitazione osservata negli SF-STMD li rendono candidati ideali per mediare un trasferimento interemisferico della modulazione di guadagno predittivo localizzato. A sostegno di questa ipotesi, almeno un assone identificato (riempito di coloranti) SF-STMD attraversa il cervello con un’arborizzazione di uscita situata all’interno di un’area limitata del lobula controlaterale(Figura 8D). Neuroni come questo sono quindi perfettamente adatti per la modulazione interemisferica spazialmente localizzata, sia eccitatoria che inibitoria mostrata in Figura 3C.10.7554/eLife.26478.015Figure 8.SF-STMD sono facilitati da un primer che si muove verso il campo ricettivo.(A) I primer si muovono o verso (rosso) o lontano (giallo) dal campo ricettivo classico (RF), precedendo un bersaglio sonda all’interno della RF (media, n = 13 libellule).(B) Al di fuori del campo ricettivo, le risposte del primer non differiscono significativamente dall’attività spontanea. I primer che si muovono verso il campo ricettivo aumentano le risposte della sonda di oltre il 40% (p=0,0004, n = 13 libellule).(C) I singoli STMD, con campi ricettivi piccoli o grandi, mostrano vari gradi di facilitazione (blu). La facilitazione media (nero) aumenta le risposte di oltre il 40% nel campo piccolo (n = 13 libellule), dell’80% negli STMD a campo grande (n = 11 libellule) e del 50% nel CSTMD1 (dati non mostrati).(D) Sei campi ricettivi STMD a campo piccolo (RF) sono prevalentemente fronto-dorsali e presentano variazioni nelle dimensioni complessive e nelle posizioni spaziali. Le linee di contorno rappresentano 25 picchi/s. L’SF-STMD con contorni viola chiaro è lo stesso neurone in E, con ingressi nella regione binoculare del campo visivo destro della libellula, mentre i dendriti di ingresso sono nell’emisfero sinistro (E) L’assone diun SF-STMD attraversa il cervello, potenzialmente sottostante il trasferimento della modulazione locale di guadagno predittivo.DOI:http://dx.doi.org/10.7554/eLife.26478.015Video6.Stimolo visivo per la figura 8.Probes sono presentati all’interno del campo recettivo di un piccolo campo neuronale STMD STMD. Le sonde sono precedute da primer che vanno alla deriva verso il campo recettivo, o lontano dal campo recettivo(Figura 8A). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:http://dx.doi.org/10.7554/eLife.26478.01610.7554/eLife.26478.016
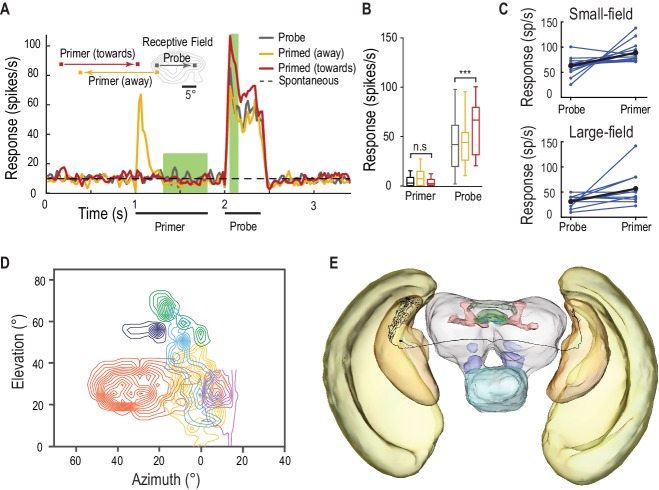
Figura 8.Gli SF-STMD sono facilitati da un primer che si muove verso il campo ricettivo.(A) I primer si muovono verso (rosso) o lontano (giallo) dal classico campo ricettivo (RF), precedendo un bersaglio sonda all’interno della RF (media, n = 13 libellule).(B) Al di fuori del campo ricettivo, le risposte del primer non differiscono significativamente dall’attività spontanea. I primer che si muovono verso il campo ricettivo aumentano le risposte della sonda di oltre il 40% (p=0,0004, n = 13 libellule).(C) I singoli STMD, con campi ricettivi piccoli o grandi, mostrano vari gradi di facilitazione (blu). La facilitazione media (nero) aumenta le risposte di oltre il 40% nel campo piccolo (n = 13 libellule), dell’80% negli STMD a campo grande (n = 11 libellule) e del 50% nel CSTMD1 (dati non mostrati).(D) Sei campi ricettivi STMD a campo piccolo (RF) sono prevalentemente fronto-dorsali e presentano variazioni nelle dimensioni complessive e nelle posizioni spaziali. Le linee di contorno rappresentano 25 picchi/s. L’SF-STMD con contorni viola chiaro è lo stesso neurone in E, con ingressi nella regione binoculare del campo visivo destro della libellula, mentre i dendriti di ingresso sono nell’emisfero sinistro (E) L’assone diun SF-STMD attraversa il cervello, potenzialmente sottostante il trasferimento della modulazione locale di guadagno predittivo.DOI:
http://dx.doi.org/10.7554/eLife.26478.015

Video 6.Stimolo visivo per la Figura 8.Le sonde sono presentate all’interno del campo ricettivo di un neurone STMD a campo piccolo. Le sonde sono precedute da primer che vanno alla deriva verso il campo ricettivo, o lontano dal campo ricettivo(Figura 8A). Tutti gli studi sono stati presentati in ordine casuale, separati da periodi di riposo di almeno 7 s.DOI:
http://dx.doi.org/10.7554/eLife.26478.016
Discussione
I campi neuronali ricettivi sono definiti dalle loro risposte eccitatorie e inibitorie alla stimolazione. Popolazioni di tali risposte chiariscono la funzione di rete, ad esempio, come sistemi di controllo nel comportamento di volo degli insetti(Gonzalez-Bellido et al., 2013; Maisak et al., 2013). Tuttavia, i nostri risultati mostrano che oltre alla selettività dello stimolo (contrasto, dimensione, velocità), il campo ricettivo di un neurone è anche una rappresentazione dinamica del contesto spaziale (Wiedermane O’Carroll, 2013) e temporale. Qui la modulazione del campo dinamico ricettivo rappresenta la codifica anticipatoria, un’influenza più complessa della storia rispetto al semplice adattamento neuronale, alla sensibilizzazione, all’assuefazione o alla fatica. Infatti, tale complessità nell’elaborazione è evidente anche nella “omessa risposta allo stimolo” nella retina vertebrale, dove una componente omessa di un modello periodico predetermina una robusta attività neuronale (Schwartzet al., 2007). Questi esempi evidenziano che il cervello è una ‘macchina predittiva’ (Rao &Ballard 1999). Tuttavia, invece di codificare la novità o l’inaspettato, i neuroni STMD prevedere la coerenza della traiettoria di un bersaglio selezionato, il tutto mentre sopprimendo distrattori.
La selettività della direzione è, in effetti, una semplice forma di previsione. Ad esempio, il correlatore Hassenstein-Reichardt fornisce una risposta non lineare e facilitata quando un punto adiacente viene stimolato in un periodo futuro(Hassenstein e Reichardt, 1956). Tuttavia, tali modelli selettivi di direzione non possono spiegare l’osservazione di una modulazione del guadagno di viaggio che si diffonde in avanti, più lunga è l’occlusione. Né questi modelli possono spiegare i cambiamenti nella direzione preferita, determinata dalla precedente direzione di marcia del bersaglio. Tali modelli non si traducono in un ‘interruttore’ invariante di contrasto che stabilisca la forza di messa a fuoco, né la presenza di un ampio contorno soppressivo. Inoltre, gli effetti qui descritti sono su scala più ampia sia spazialmente (decine di gradi) che temporalmente (centinaia di millisecondi) rispetto ai processi locali di rilevazione del movimento, come l’analisi ottica del flusso (decine di millisecondi, Guo e Reichardt, 1987). Infine, i nostri risultati mostrano un focus locale, predittivo di facilitazione che attraversa gli emisferi cerebrali, che è un attributo che ricorda più le reti attenzionali di ordine superiore, piuttosto che i circuiti di codifica del movimento locale.
I nostri risultati di un aumento di oltre il 400% della sensibilità al contrasto sono coerenti con gli studi che danno il via all’attenzione spaziale nei vertebrati, anche se con un aumento significativamente maggiore. Ad esempio, l’aumento del guadagno di contrasto degli osservatori umani è aumentato di circa il 40% per gli stimoli presentati in un luogo frequentato(Carrasco et al., 2000), con contestuale diminuzione del guadagno di contrasto per gli stimoli presentati altrove(Pestilli e Carrasco, 2005). Risultati simili si osservano anche nelle registrazioni di singole unità del macaco V4, dove i reticoli presentati in luoghi frequentati suscitano risposte equivalenti ad un aumento del 51% del contrasto degli stimoli(Reynolds et al., 2000). Mentre è in corso un dibattito sul fatto che l’attenzione moduli il guadagno di contrasto(Reynolds et al., 2000) o il guadagno di risposta(Lee e Maunsell, 2010), la facilitazione nel CSTMD1 rivela una combinazione di entrambi(Figura 5C). La modulazione del guadagno del CSTMD1 potrebbe essere una componente intrinseca del meccanismo di previsione, o il risultato del bersaglio di adescamento che agisce come uno spunto che dirige l’attenzione verso i bersagli previsti.
Abbiamo già segnalato in precedenza che CSTMD1 si occupa selettivamente di un bersaglio quando viene presentato con un paio di stimoli concorrenti, ignorando completamente il distrattore(Wiederman e O’Carroll, 2013). Nelle prove ripetute, il bersaglio selezionato non era sempre lo stesso e anche occasionalmente veniva commutato a metà prova. Ciò solleva l’intrigante possibilità che il focus predittivo si “blocchi” su un singolo bersaglio, sopprimendo i distrattori. Il controllo del guadagno predittivo misurato qui fornisce una possibile spiegazione di questo comportamento – un feedback positivo che permette al neurone di bloccare un singolo oggetto, mentre altri meccanismi, tra cui l’inibizione globale, possono aiutare a sopprimere gli oggetti concorrenti. I futuri esperimenti riguarderanno i parametri degli stimoli (ad esempio il tempo, la salienza) che permettono al focus predittivo di passare da un bersaglio all’altro. Inoltre, stiamo attualmente indagando se il focus predittivo e la selezione competitiva è suscitata dal basso verso l’alto dagli stimoli (esogeni) o include una componente dall’alto verso il basso (endogeni). Cioè, per una libellula che si nutre in uno sciame, sono gli attributi della salienza del bersaglio a guidare la selezione dell’inseguimento, o la libellula sta scegliendo la sua preda da meccanismi interni più complessi?
Per decenni, gli scienziati hanno studiato la base neuronale del “rilevamento del movimento elementare” nelle mosche vere (Ditteri). Con gli esperimenti morfologici(Takemura et al., 2013) e fisiologici(Maisak et al., 2013) che fanno significativi progressi nel chiarire questo circuito, l’attenzione si sta ora spostando verso altri compiti visivi come la discriminazione delle caratteristiche(Aptekar et al., 2015; Keleş e Frye, 2017). Fino ad ora, c’è stato un divario tra queste “semplici” operazioni visive e le elaborazioni di ordine superiore osservate nei mammiferi. I nostri risultati rivelano la libellula come un modello sorprendentemente sofisticato, ma tracciabile, che permette di indagare i principi fisiologici e morfologici fondamentali alla base della previsione neuronale e dell’attenzione selettiva.
Materiali e metodi
Elettrofisiologia
Abbiamo registrato da un totale di 63 libellule maschio selvatiche catturate, Hemicordulia. Gli animali sono stati immobilizzati con una miscela di cera e resina (1:1) e fissati ad un supporto magnetico articolato. La testa è stata inclinata in avanti e un piccolo foro sezionato nella superficie posteriore, esponendo il lobo ottico sinistro.
Abbiamo tirato gli elettrodi di silicato di alluminio su un estrattore di elettrodi Sutter Instruments P-97, e li abbiamo riempiti con soluzione di KCl 2M. Gli elettrodi sono stati inseriti attraverso la guaina neurale nel complesso del lobula prossimale utilizzando uno stepper piezoelettrico (Marzhauser-Wetzlar PM-10), con resistenza tipica tra 50-150 MΩ. Le risposte intracellulari sono state digitalizzate a 5 kHz con un convertitore A/D a 16 bit (National Instruments) per l’analisi off-line con MATLAB.
Le cellule appena penetrate sono state presentate con piccoli bersagli, barre e reticoli ad ampio campo per la classificazione. I neuroni sono stati classificati come STMD quando rispondevano in modo robusto a stimoli visivi composti da piccoli bersagli mobili e non rispondevano a barre o grigliati. Il CSTMD1 è stato identificato dal suo caratteristico campo ricettivo, dalla regolazione della risposta e dai potenziali d’azione. I neuroni STMD sono stati categorizzati in campi piccoli o grandi mappando i loro campi ricettivi con bersagli alla deriva (una mezza larghezza inferiore o superiore a 25°).
Stimoli visivi e analisi dei dati
Abbiamo presentato degli stimoli sui monitor LCD ad alta definizione (120 Hz e oltre). L’animale è stato posizionato a 20 cm di distanza e centrato sulla linea mediana visiva. Gli stimoli di contrasto sono stati presentati al centro dello schermo per ridurre al minimo gli artefatti fuori asse. Gli script degli stimoli(https://github.com/swiederm/predictive-gain) sono stati scritti usando Psychtoolbox di MATLAB ed integrati nel sistema di acquisizione dati (Wiedermanet al., 2017; una copia è archiviata all’indirizzo https://github.com/elifesciences-publications/predictive-gain). Se non diversamente specificato, tutti i bersagli erano 1,5°x1,5° quadrati neri alla deriva a 40°/s. Un minimo di 7 s di riposo tra una prova e l’altra è stato implementato per evitare assuefazione o facilitazione da prove precedenti. I dati sono stati esclusi solo per danni patologici del neurone o per assuefazione estesa (cessazione dell’esperimento). Tutti i mezzi sono calcolati da repliche biologiche (cioè misurazioni ripetute da neuroni identificati in animali diversi). Ogni replicato biologico rappresenta la media tra 1 e 10 repliche tecniche.
Test statistici
Riportiamo la P esatta (a meno che non sia minuscola). A causa delle piccole dimensioni del campione, tutti i test sono non parametrici, a due facce e tengono conto di confronti multipli. Tutti i grafici di box e baffi indicano la mediana, l’interquartile e l’intero intervallo minimo/massimo (baffi).
Focalizzazione predittiva della modulazione del guadagno: Abbiamo mappato l’estensione spaziale di questo focus con una serie di bersagli sonda 200 ms presentati in modo casuale attraverso una griglia 10 × 10 di posizioni all’interno del campo ricettivo eccitatorio del CSTMD1. Abbiamo calcolato il tasso di picco all’interno di una finestra di analisi (50-150 ms) dopo l’inizio della sonda in ogni posizione. Abbiamo randomicamente interleaved stimoli sonda non innescato con (nel 50% degli studi) sonde corrispondenti che hanno seguito un target di 1 secondo di primer (n = 9 libellule). I bersagli di priming si sono spostati verticalmente verso l’alto dello schermo a 32°/s, presentati in modo pseudo casuale all’interno di una regione larga 5° (scatola bianca delineata) per ridurre al minimo l’assuefazione locale indotta dal primer. Per ogni posizione spaziale (100 in totale), abbiamo calcolato la differenza tra la risposta della sonda (dopo il primer) con la risposta della sonda (senza primer). Il rumore inter-triale e interneuronale nelle colorme di messa a fuoco è stato ridotto facendo la media tra le matrici interpolate e leggermente lisciate (gaussiane, σ = 0,5) delle libellule. Questo metodo di riduzione del rumore ritrae efficacemente il risultato dell’aggiunta del bersaglio del primer, tuttavia, può leggermente offuscare la regione di messa a fuoco a causa della media dei campioni. Un secondo esperimento ha seguito lo stesso protocollo tranne che con una pausa di 300 ms inserita tra il primer e la sonda (n = 7 libellule). Un terzo esperimento ha avuto il primer che si muoveva orizzontalmente all’interno del campo visivo dell’occhio controlaterale con attenzione per evitare la regione frontale di 10° di sovrapposizione binoculare. Questo esperimento comprendeva anche una pausa di 300 ms inserita tra il primer e la sonda (n = 7 libellule). Per esaminare il significato di queste mappe, abbiamo creato le versioni d di Cohen. Per ogni posizione spaziale(loc), abbiamo calcolato la differenza media (primer & probe – probe alone) attraverso la dimensione del campione (n, numero di libellule) e diviso per la deviazione standard di queste differenze attraverso la dimensione del campione. Questa dimensione dell’effetto rappresenta la variazione media osservata in ogni posizione (attraverso libellule) normalizzata dalla deviazione standard in ogni posizione (attraverso libellule). Si noti che per evitare di dividere per zero errori, non abbiamo calcolato i valori d di Cohen per l’emifieldio inibitorio (mappa per la Figura 3C) che non ha alcuna attività, e quindi la deviazione standard minima. Per specifiche località di interesse, abbiamo testato la significatività statistica calcolando il valore t-statistico accoppiato e il valore P a due code.μloc=∑i=1n((primer e sonda)i -(sonda da solo)-μ)-μ)2σloc= 1n-1∑i=1n((primer esonda)i – (sonda da sola)i)- μ)2Cohen′s dloc= ulocσloctloc=Cohen′s dloc⋅n
Ulteriori esperimenti sono stati condotti lungo un percorso a 1 dimensione. In primo luogo, con una posizione vincolata del primer (n = 12 libellule) e poi con una posizione vincolata della sonda (n = 8 libellule). Per i corsi del tempo, abbiamo normalizzato le risposte dividendo per controlli completamente facilitati (posizioni spaziali corrispondenti), rendendo così conto della disomogeneità spaziale nel campo ricettivo. I confronti statistici hanno applicato sia i test di Wilcoxon che quelli di Friedman con confronti multipli.
Sensibilità al contrasto
Abbiamo variato il contrasto (7 valori) di un bersaglio di una sonda che è andato alla deriva verso l’alto attraverso il campo ricettivo del CSTMD1 (n = 9). Il contrasto del bersaglio (Weber) è stato definito come:cw=Itarget-IbackgroundIbackground
Le sonde si sono spostate verso l’alto per 600 ms in due possibili punti separati orizzontalmente di 20°. Per ogni contrasto della sonda, abbiamo misurato le risposte in una finestra di analisi (50-150 ms) dopo l’inizio. I primer sono andati alla deriva verso l’alto per 600 ms, sia verso la posizione della sonda (primer) che spostata di 20° verso il lato (primer distante). Il contrasto del primer era di 1,0 (alto contrasto) o 0,2 (basso contrasto). Le risposte del primer sono state quantificate negli ultimi 100 ms di movimento del primer. Abbiamo inserito una pausa di 50 ms tra primer e sonda e primer per assicurare che la risposta residua del primer non fosse attribuita alla sonda. L’ordine di prova di tutti gli esperimenti di sensibilità di contrasto è stato randomizzato. I parametri (in alto, in basso, logIC50 e hill-slope) di ogni funzione di sensibilità di contrasto sono stati confrontati con una somma extra di quadrati F test, mentre le risposte ai primer sono state confrontate dal test Wilcoxon. Per definire una soglia di rilevabilità per la stima della sensibilità di contrasto, abbiamo misurato l’attività spontanea nel periodo di 1 s di pre-stimolo in tutti i 630 test (n = 9 libellule). Per ogni neurone, le risposte sono state abbattute (20 ms) prima di calcolare il 95° percentile superiore delle risposte abbattute.
Selettività di direzione
Abbiamo misurato la selettività della direzione del CSTMD1 facendo andare alla deriva le sonde in 8 direzioni da un punto centrale nel campo ricettivo eccitatorio del CSTMD1 (n = 9). I primer sono andati alla deriva per 1 s in ciascuna delle 4 direzioni cardinali che terminano nella posizione della sonda. In un esperimento a parte, i primer andati alla deriva verticalmente hanno terminato 4° sotto la posizione della sonda, ponendo tutte le sonde nel centro del fuoco (n = 5). Le risposte della sonda sono state analizzate in una finestra (40-100 ms) dopo l’inizio della sonda. Questa finestra è più breve e anticipata rispetto ad altri esperimenti per tener conto della rapida instaurazione della selettività della direzione della sonda.
Quantifichiamo la selettività della direzione in due modi. Regressiamo le risposte sul modello sinusoidale R(θ )=b0+b1 sin(θ + φ), dove R è la risposta alla direzione θ , b0 è l’offset, b1 è la componente direzionale della risposta e φ è la fase (direzione preferita). Quantifichiamo anche il vettore polare medio per ogni condizione, calcolando intervalli di confidenza del 95% sia per la direzione del vettore che per la magnitudine del vettore in tutte le celle.
Le differenze in b1/b0 rapporto tra le prove che sono state innescate verso l’alto, e verso l’alto dopo un salto in avanti sono state confrontate con un test di Mann-Whitney. La varianza delle risposte ai bersagli che tornano indietro nella direzione opposta al primer sono state analizzate da un test di Kruskal-Wallis, seguito dai confronti multipli di Dunn. Abbiamo applicato il test di Kruskal-Wallis perché i dati di regolazione della direzione con(Figura 7C, condizione J) e senza(Figura 7C, condizioni P U R L D) un salto in avanti è stato ottenuto da diversi campioni indipendenti.
Facilitazione SF-STMD
Le risposte sono state suscitate da 400 ms traiettorie della sonda, iniziando il movimento all’interno del campo ricettivo classico e alla deriva nella direzione preferita del neurone. Primers sono stati o alla deriva per 800 ms ‘verso’ il campo recettivo eccitatorio, o dall’interno del campo recettivo eccitatorio in movimento ‘via’. Primer terminato almeno 8 ° di distanza dal classico campo recettivo, e sono stati seguiti da una pausa di 200 ms prima della comparsa dello stimolo sonda. Risposte Primer sono stati analizzati in una finestra 300-800 ms dopo l’insorgenza, mentre la sonda era 50-150 ms dopo l’insorgenza della sonda.
I rimanenti esperimenti a grande e piccolo campo sono stati eseguiti su popolazioni di neuroni con attività complessiva variabile. Per normalizzare, le risposte neuronali per un dato neurone sono stati divisi da un fattore pari alla risposta media del neurone alle sonde in tutte le condizioni di adescamento. Per convertire le risposte di nuovo in picchi / s, abbiamo moltiplicato la risposta normalizzata per il fattore medio per tutti i neuroni nel set di dati. Come tutte le condizioni sono state accoppiate tra campioni indipendenti, confrontiamo le risposte tra le condizioni con un test di Friedman, seguito da confronti multipli di Dunn. Tutti i test statistici presentati sono a due code.
Riempimento del colorante
La morfologia di un neurone SF-STMD è stata visualizzata mediante l’etichettatura intracellulare con Lucifer Yellow. La ionoforesi è stata ottenuta facendo passare 3nA di corrente negativa attraverso elettrodi riempiti in punta con il 4% di soluzione di Lucifer Yellow in 0,1M LiCl. I cervelli sono stati poi accuratamente sezionati, fissati durante la notte in paraformaldeide al 4% a 4°C, disidratati in serie di etanolo (70%, 90%, 100%, 100%, 100%), cancellati in salicilato di metile e montati su un vetrino per immagini a fluorescenza.
Disponibilità dei dati
I dati ottenuti sono gestiti secondo il Codice australiano ARC/NHMRC per la condotta responsabile della ricerca. I dati grezzi dei test sperimentali e delle simulazioni numeriche sono memorizzati su un server gestito localmente. I dati sperimentali e numerici elaborati sono disponibili sul server di gestione dati dell’Università di Adelaide(https://adelaide.figshare.com).
References
- Aptekar JW, Keleş MF, Lu PM, Zolotova NM, Frye MA. Neurons forming optic glomeruli compute figure-ground discriminations in Drosophila. Journal of Neuroscience. 2015; 35:7587-7599. DOI | PubMed
- Avidan G, Harel M, Hendler T, Ben-Bashat D, Zohary E, Malach R. Contrast sensitivity in human visual areas and its relationship to object recognition. Journal of Neurophysiology. 2002; 87:3102-3116. DOI | PubMed
- Barnett PD, Nordström K, O’carroll DC. Retinotopic organization of small-field-target-detecting neurons in the insect visual system. Current Biology. 2007; 17:569-578. DOI | PubMed
- Berry MJ, Brivanlou IH, Jordan TA, Meister M. Anticipation of moving stimuli by the retina. Nature. 1999; 398:334-338. DOI | PubMed
- Bolzon DM, Nordström K, O’Carroll DC. Local and large-range inhibition in feature detection. Journal of Neuroscience. 2009; 29:14143-14150. DOI | PubMed
- Carrasco M, Penpeci-Talgar C, Eckstein M. Spatial covert attention increases contrast sensitivity across the CSF: support for signal enhancement. Vision Research. 2000; 40:1203-1215. DOI | PubMed
- Chen EY, Chou J, Park J, Schwartz G, Berry MJ. The neural circuit mechanisms underlying the retinal response to motion reversal. Journal of Neuroscience. 2014; 34:15557-15575. DOI | PubMed
- Corbet PS. Dragonflies: Behavior and Ecology of Odonata. Cornell Univ Press: Ithaca; 1999.
- Dunbier JR, Wiederman SD, Shoemaker PA, O’Carroll DC. Facilitation of dragonfly target-detecting neurons by slow moving features on continuous paths. Frontiers in Neural Circuits. 2012; 6DOI | PubMed
- Gonzalez-Bellido PT, Peng H, Yang J, Georgopoulos AP, Olberg RM. Eight pairs of descending visual neurons in the dragonfly give wing motor centers accurate population vector of prey direction. PNAS. 2013; 110:696-701. DOI | PubMed
- Guo A, Reichardt W. An estimation of the time constant of movement detectors. The Science of Nature. 1987; 74:91-92. DOI
- Hassenstein B, Reichardt W. Systemtheoretische Analyse Der Zeit, Reihenfolgen Und Vorzeichenauswertung Bei Der Bewegungsperzeption Des Rüsselkäfers Chlorophanus. Zeitschrift Für Naturforschung B. 1956; 11:513-524. DOI
- Horridge GA. The separation of visual axes in apposition compound eyes. Philosophical Transactions of the Royal Society B: Biological Sciences. 1978; 285:1-59. DOI | PubMed
- Kastner DB, Baccus SA. Spatial segregation of adaptation and predictive sensitization in retinal ganglion cells. Neuron. 2013; 79:541-554. DOI | PubMed
- Keleş MF, Frye MA. Object-Detecting neurons in Drosophila. Current Biology. 2017; 27:680-687. DOI | PubMed
- Land MF, Collett TS. Chasing behaviour of houseflies (Fannia canicularis). Journal of Comparative Physiology. 1974; 89:331-357. DOI
- Lee J, Maunsell JH. The effect of attention on neuronal responses to high and low contrast stimuli. Journal of Neurophysiology. 2010; 104:960-971. DOI | PubMed
- Maisak MS, Haag J, Ammer G, Serbe E, Meier M, Leonhardt A, Schilling T, Bahl A, Rubin GM, Nern A, Dickson BJ, Reiff DF, Hopp E, Borst A. A directional tuning map of Drosophila elementary motion detectors. Nature. 2013; 500:212-216. DOI | PubMed
- Mischiati M, Lin HT, Herold P, Imler E, Olberg R, Leonardo A. Internal models direct dragonfly interception steering. Nature. 2015; 517:333-338. DOI | PubMed
- Moran J, Desimone R. Selective attention gates visual processing in the extrastriate cortex. Science. 1985; 229:782-784. DOI | PubMed
- Mysore SP, Asadollahi A, Knudsen EI. Signaling of the strongest stimulus in the owl optic tectum. Journal of Neuroscience. 2011; 31:5186-5196. DOI | PubMed
- Mysore SP, Knudsen EI. A shared inhibitory circuit for both exogenous and endogenous control of stimulus selection. Nature Neuroscience. 2013; 16:473-478. DOI | PubMed
- Nordström K, O’Carroll DC. Feature detection and the hypercomplex property in insects. Trends in Neurosciences. 2009; 32:383-391. DOI | PubMed
- Nordström K, Bolzon DM, O’Carroll DC. Spatial facilitation by a high-performance dragonfly target-detecting neuron. Biology Letters. 2011; 7:588-592. DOI | PubMed
- O’Carroll D, O’Carroll DC. Feature-detecting neurons in dragonflies. Nature. 1993; 362:541-543. DOI
- Okamura JY, Strausfeld NJ. Visual system of calliphorid flies: motion- and orientation-sensitive visual interneurons supplying dorsal optic glomeruli. The Journal of Comparative Neurology. 2007; 500:189-208. DOI | PubMed
- Olberg RM. Identified target-selective visual interneurons descending from the dragonfly brain. Journal of Comparative Physiology A. 1986; 159:827-840. DOI
- Pestilli F, Carrasco M. Attention enhances contrast sensitivity at cued and impairs it at uncued locations. Vision Research. 2005; 45:1867-1875. DOI | PubMed
- Polat U, Mizobe K, Pettet MW, Kasamatsu T, Norcia AM. Collinear stimuli regulate visual responses depending on cell’s contrast threshold. Nature. 1998; 391:580-584. DOI | PubMed
- Posner MI, Cohen Y. Components of visual orienting. Attention and Performance X: Control of Language Processes. 1984; 32:531-556.
- Rao RP, Ballard DH. Predictive coding in the visual cortex: a functional interpretation of some extra-classical receptive-field effects. Nature Neuroscience. 1999; 2:79-87. DOI | PubMed
- Reynolds JH, Pasternak T, Desimone R. Attention increases sensitivity of V4 neurons. Neuron. 2000; 26:703-714. DOI | PubMed
- Schwartz G, Harris R, Shrom D, Berry MJ. Detection and prediction of periodic patterns by the retina. Nature Neuroscience. 2007; 10:552-554. DOI | PubMed
- Slagter HA, Prinssen S, Reteig LC, Mazaheri A. Facilitation and inhibition in attention: functional dissociation of pre-stimulus alpha activity, P1, and N1 components. NeuroImage. 2016; 125:25-35. DOI | PubMed
- Takemura SY, Bharioke A, Lu Z, Nern A, Vitaladevuni S, Rivlin PK, Katz WT, Olbris DJ, Plaza SM, Winston P, Zhao T, Horne JA, Fetter RD, Takemura S, Blazek K, Chang LA, Ogundeyi O, Saunders MA, Shapiro V, Sigmund C, Rubin GM, Scheffer LK, Meinertzhagen IA, Chklovskii DB. A visual motion detection circuit suggested by Drosophila connectomics. Nature. 2013; 500:175-181. DOI | PubMed
- Watamaniuk SN, McKee SP. Seeing motion behind occluders. Nature. 1995; 377:729-730. DOI | PubMed
- Wiederman SD, Shoemaker PA, O’Carroll DC. A model for the detection of moving targets in visual clutter inspired by insect physiology. PLoS One. 2008; 3DOI | PubMed
- Wiederman SD, O’Carroll DC. Discrimination of features in natural scenes by a dragonfly neuron. Journal of Neuroscience. 2011; 31:7141-7144. DOI | PubMed
- Wiederman SD, Shoemaker PA, O’Carroll DC. Correlation between OFF and ON channels underlies dark target selectivity in an insect visual system. Journal of Neuroscience. 2013; 33:13225-13232. DOI | PubMed
- Wiederman SD, O’Carroll DC. Selective attention in an insect visual neuron. Current Biology. 2013; 23:156-161. DOI | PubMed
- Wiederman SD, Dunbier JR, Fabian JM, Evans BJE, O’Carroll DC. 2017.
- Zirnsak M, Steinmetz NA, Noudoost B, Xu KZ, Moore T. Visual space is compressed in prefrontal cortex before eye movements. Nature. 2014; 507:504-507. DOI | PubMed
Fonte
Wiederman SD, Fabian JM, Dunbier JR, O’Carroll DC, Rieke F, et al. () A predictive focus of gain modulation encodes target trajectories in insect vision. eLife 6e26478. https://doi.org/10.7554/eLife.26478





