Introduzione
Lo stafilococco aureo causa una varietà di malattie che vanno dalle infezioni della pelle e dei tessuti molli alla batteriemia potenzialmente letale.1 Inoltre, lo S. aureus ha acquisito una resistenza a più classi di antibiotici che una volta erano efficaci.2 Un esempio classico è la comparsa, negli anni ’60, di isolati clinici di ceppi di S. aureus aureus resistenti alla meticillina (MRSA ) che hanno mostrato resistenza agli antibiotici β-lattamici.3 Più recentemente, alcuni ceppi di MRSA hanno mostrato una ridotta suscettibilità agli antibiotici più recenti come la daptomicina e agli antibiotici di ultima generazione come la vancomicina e il linezolid.4 Oltre alla resistenza acquisita attraverso l’inattivazione mutazionale, S. aureus sviluppa altre strategie per minare l’effetto degli antibiotici, come la residenza all’interno delle cellule immunitarie dell’ospite5 , che formano biofilm e diventano persistitori dormienti.6 Queste situazioni rappresentano una sfida spaventosa per lo sviluppo di nuovi modi di trattare le infezioni da MRSA.
Al limite dell’area post-antibiotica, i ricercatori stanno adottando diversi approcci per affrontare le infezioni causate dal MRSA. La riconversione dei farmaci antitumorali, antimicotici e antinfiammatori esistenti è stata perseguita sfruttando la loro consolidata fattibilità e le loro proprietà antibatteriche.7 L’applicazione terapeutica dei batteriofagi offre un’altra promettente alternativa per combattere le infezioni da stafilococco.8 Inoltre, nuovi approcci sono sviluppati attraverso il targeting dei fattori di virulenza specifici del MRSA. Più del 90% di tutti gli isolati clinici di S. aureus generano un pigmento dorato, la stafilossantina (STX).9 STX si condensa nel microdominio funzionale della membrana di S. aureus,10 dotando S. aureus di integrità della membrana e di eccellenti proprietà antiossidanti.11 Da quando Nizet e i suoi collaboratori hanno chiarito il ruolo fondamentale di STX, il fattore di virulenza che protegge S. aureus dall’uccisione basata sui neutrofili,12 lo spogliamento di questo importante pigmento dal MRSA è diventato un nuovo approccio terapeutico.13 Una gamma di inibitori del colesterolo sintetico è stata sfruttata per inibire la biosintesi di STX[[qv: 12,13b]]]. Chen et al. hanno scoperto che naftifine, un farmaco antimicotico approvato dalla FDA, ha bloccato la biosintesi di STX attraverso l’inibizione della desaturasi del diafitoene.14 Jabra-Rizk et al. hanno dimostrato che il sesquiterpene farnesolo, un metabolita naturale della pianta, ha efficacemente soppresso la produzione di STX attraverso il legame del dominio attivo della deidrosqualene sintasi, compromettendo così l’integrità della membrana.15 Tuttavia, la somministrazione di agenti esogeni ha ottenuto solo un’efficacia limitata, forse a causa di un’azione off-targeting.16 Pertanto, gli approcci privi di farmaci per sradicare STX sono stati urgentemente desiderati.
Qui, attraverso l’imaging di assorbimento transitorio senza etichetta dei cromofori non fluorescenti in S. aureus , troviamo accidentalmente che STX è soggetto a fotolisi e questo processo di fotolisi dipende fortemente dalla lunghezza d’onda di eccitazione. Con la spettroscopia di assorbimento, identifichiamo che la lunghezza d’onda ottimale per la fotolisi di STX è di circa 460 nm. Sveliamo anche che la luce a 460 nm induce la rottura del legame STX C=C utilizzando la spettroscopia Raman e la spettrometria di massa. Scopriamo poi che la fotolisi di STX eleva transitoriamente la permeabilità della membrana e rende l’MRSA altamente suscettibile all’attacco delle specie reattive dell’ossigeno. Sulla base di questi risultati, abbiamo sviluppato una sinergia altamente efficace tra la fotolisi di STX e il perossido di idrogeno a bassa concentrazione, che è ben consolidata nell’eliminazione di MRSA in fase stazionaria, persisteri MRSA, biofilm di S. aureus e modelli di ferite di topi infetti da MRSA. Troviamo anche che la fotolisi STX potrebbe aiutare le cellule macrofagiche ad eliminare l’MRSA intracellulare, mentre l’antibiotico ad alta concentrazione fallisce. Le nostre scoperte aprono nuove opportunità per il trattamento delle infezioni da MRSA.
Risultati e discussione
STX Photobleaching Rivelato sotto un microscopio ad assorbimento transitorio
Inizialmente abbiamo cercato di differenziare MRSA da S. aureus meticillina-suscettibile S. aureus mediante l’ imaging di assorbimento transitorio (Figura S1, Informazioni di supporto) dei loro cromofori intrinseci. Intrigante, una volta che l’MRSA coltivato è stato posto sotto il microscopio, il forte segnale misurato a zero ritardo tra la pompa 520 nm e 780 nm impulsi sonda rapidamente attenuato su seconda scala(Figura1a; Film S1, Informazioni di supporto). Abbiamo ipotizzato che uno specifico cromoforo in MRSA sia incline al fotocromo in base alle impostazioni sopra menzionate. Per verificare questo, abbiamo applicato alla curva del corso del tempo un modello di fotosensibilizzazione sviluppato per i fotosensibilizzatori17( Figura 1b, vedi Metodi nelle Informazioni di supporto )(1) y=y0+A∗exp-tτ11++.τ1τ2∗1-exp-tτ1 dove t è la durata dell’irradiazione della luce, y è l’intensità del segnale, y0 e A sono costanti,τ 1 e τ 2 sono le costanti di tempo rispettivamente per il primo e secondo ordine di fotocolorazione. Il primo ordine di sbiancamento avviene a bassa concentrazione di cromofori (τ 2 = ∞). Lo sbiancamento del secondo ordine avviene quando domina lo sbiancamento ad alta concentrazione di cromofori circostanti (τ 1 = ∞, Figura S2, Informazioni di supporto). La derivazione dell’equazione (1) è dettagliata nelle Informazioni di supporto. Sorprendentemente, questo modello di fotocolorazione si adatta bene alla curva del corso del tempo grezzo (τ 1 = ∞, τ 2 = 0.15 ± 0.02 s). Inoltre, l’esaurimento dell’ossigeno (Na2S2O4: oxygen scavenger) ha mostrato un effetto trascurabile sulla velocità di fotocolorazione (τ 2 = 0,14 ± 0,01 s, Figura S3a, Informazioni di supporto). Lo stesso fenomeno è stato osservato nel S. aureo sensibile alla meticillina ( Figura S3b, Informazioni di supporto). Per determinare se l’ossigeno gioca un ruolo essenziale durante questo processo di fotoblancatura, abbiamo mantenuto la soluzione estratta di cromoforo gorgogliante con azoto gassoso per 2 h al fine di esaurire l’ossigeno.18 Abbiamo scoperto che l’esaurimento dell’ossigeno non ha influito sul processo di fotobleaching (Figura S3c, Informazioni di supporto). Collettivamente, questi dati supportano un processo di fotobleaching di secondo ordine.
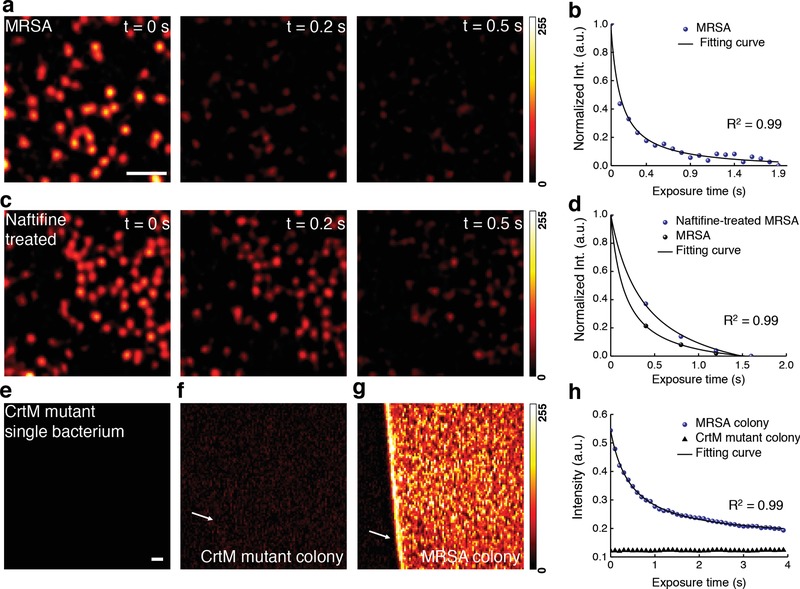
Figura 1.Figura 1. Photobleaching di stafiloxantina in MRSA scoperto da microscopia ad assorbimento transitorio. a) Pseudocolore immagini time-lapse di MRSA. Barra di scala = 5 µm, si applica alle immagini in (a) e (c). b) rappresentativo time-lapse segnale (normalizzato) da MRSA. c) Pseudocolore immagini time-lapse di MRSA naftifine-trattati. d) Segnali rappresentativi time-lapse (normalizzati) da MRSA e MRSA trattato naftifine. e-g) Immagini pseudocolore di CrtM mutante, colonia mutante CrtM e colonia MRSA a t = 0 s, rispettivamente. Barra di scala = 20 μm, si applica a (e-g). h) Segnali rappresentativi raw time-lapse della colonia MRSA e della colonia mutante CrtM. Le frecce bianche indicano l’interfaccia tra aria e campione. I segnali time-lapse sono stati montati da Equation (1). Le immagini sono state elaborate a partire da dati grezzi con un range dinamico di 0-255 attraverso ImageJ.
Successivamente, si è cercato di dedurre il cromoforo specifico all’interno di MRSA che rappresenta il fenomeno del fotobleaching osservato. È noto che i carotenoidi sono fotosensibili a causa dei legami C=C coniugati.19 Pertanto, abbiamo ipotizzato che STX, il principale pigmento carotenoide residente nella membrana cellulare dell’MRSA, sia stato sottoposto a fotosensibilità nel nostro studio di assorbimento transitorio. Per testare questa ipotesi, abbiamo trattato MRSA con naftifine per bloccare la sintesi di STX.14 L’MRSA trattato ha mostrato una minore intensità del segnale (Figura 1c) e più lenta velocità di fotosabbiatura (Figura 1d). In particolare, τ 2di MRSA trattato con naftifine (0,39 ± 0,07 s) è 2,5 volte quello di MRSA (0,15 ± 0,02 s), in coerenza con il secondo ordine di fotosintesi. Inoltre, nessun segnale transitorio di assorbimento è stato osservato in ceppo S. aureus con mutazione in deidrosqualene sintasi (CrtM) (Figura 1e) che è responsabile della biosintesi STX.11 Per evitare l’errore sistematico suscitato dalla misurazione di singoli batteri, abbiamo ripetuto la stessa analisi usando colonie batteriche. Si è scoperto che la colonia mutante CrtM (Figura 1f,h) mostrava solo uno sfondo indotto dalla modulazione in fase incrociata,20 mentre la colonia MRSA mostrava un forte contrasto con lo sfondo (Figura 1g) e un rapido decadimento del fotosintesi (Figura 1h). Presi nel loro insieme, questi dati confermano che STX in MRSA rappresenta il fenomeno del fotobleaching osservato.

Figura 1.Fotosabbiatura di stafiloxantina in MRSA scoperto da microscopia ad assorbimento transitorio. a) Pseudocolore immagini time-lapse di MRSA. Barra di scala = 5 µm, si applica alle immagini in (a) e (c). b) rappresentativo time-lapse segnale (normalizzato) da MRSA. c) Pseudocolore immagini time-lapse di MRSA naftifine-trattati. d) Segnali rappresentativi time-lapse (normalizzati) da MRSA e MRSA trattato naftifine. e-g) Immagini pseudocolore di CrtM mutante, colonia mutante CrtM e colonia MRSA a t = 0 s, rispettivamente. Barra di scala = 20 μm, si applica a (e-g). h) Segnali rappresentativi raw time-lapse della colonia MRSA e della colonia mutante CrtM. Le frecce bianche indicano l’interfaccia tra aria e campione. I segnali time-lapse sono stati montati da Equation (1). Le immagini sono state elaborate a partire da dati grezzi con un range dinamico di 0-255 attraverso ImageJ.
Photobleaching ad ampio campo di STX da un dispositivo portatile
Nello studio sull’assorbimento transitorio, quando si modifica l’irradianza della pompa a 520 nm mentre si fissa l’intensità della sonda a 780 nm, sia l’intensità del segnale che τ 2 sono cambiate drasticamente (Figura S4a,c, Informazioni di supporto), mentre l’alterazione dell’irradianza della sonda ha influenzato solo l’intensità del segnale di assorbimento transitorio ma non τ 2 (Figura S4b,d, Informazioni di supporto). Questi risultati implicano collettivamente che l’efficacia del fotobleaching dipende fortemente dalla lunghezza d’onda di eccitazione (Figura S4e, Supporting Information), il che è coerente con il fatto che il fotobleaching è basato sull’assorbimento del cromoforo.21
Per trovare la lunghezza d’onda ottimale per lo sbiancamento di STX, abbiamo misurato lo spettro di assorbimento dell’estratto grezzo di STX da S. aureus. L’estratto ha mostrato un forte assorbimento nella finestra da 400 a 500 nm(Figura2a). Sulla base di questo risultato, abbiamo costruito un dispositivo portatile composto da un LED blu con una lunghezza d’onda di emissione centrale a 460 nm per lo sbiancamento a largo campo STX (Figura 2b). Abbiamo esposto l’estratto grezzo di STX alla luce a 460 nm (intensità, 90 mW cm-2) per diversi intervalli di tempo. Notevolmente, il caratteristico colore dorato del STX è scomparso entro 30 minuti di esposizione, mentre il gruppo di controllo sotto la luce ambiente è rimasto invariato (Figura 2c). Il suo assorbimento entro 400-500 nm finestra è diminuito drasticamente oltre 460 nm di esposizione alla luce (Figura 2d). La densità ottica a 470 nm (dalla Figura 2d) rispetto alla dose di luce a 460 nm può essere ben equipaggiata con Equazione (1) (Figura 2e). Inoltre, gli estratti di MRSA naftifine-trattato o CrtM-mutante MRSA erano insensibili all’esposizione alla luce a 460 nm, indicata dal loro spettro di assorbimento quasi invariato (Figura S5a-c, Informazioni di supporto). Questi risultati suggeriscono collettivamente che STX è incline a fotosensibilità sotto l’irraggiamento della luce a 460 nm.
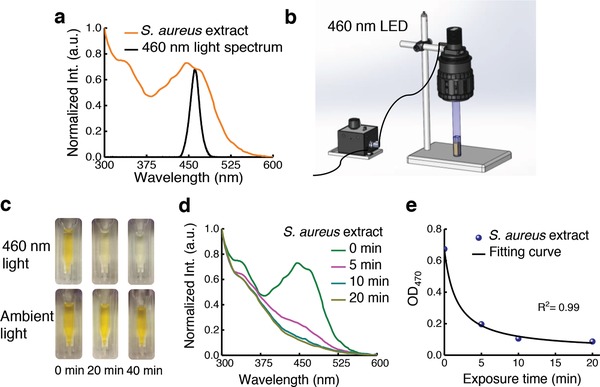
Figura 2.La stafilossantina è incline al fotobleaching sotto l’irraggiamento della luce blu. a) Spettro di assorbimento dell’estratto di STX grezzo (marrone) e profilo di emissione di un LED blu (nero). b) Illustrazione schematica di un dispositivo portatile di fotobleaching ad ampio campo basato su LED. c) Immagini di estratto di STX grezzo esposto alla luce a 460 nm e alla luce ambientale a diversi intervalli di tempo. d) Spettri di assorbimento dell’estratto di STX grezzo su diversi tempi di esposizione alla luce a 460 nm. e) OD di estratto di STX grezzo a 470 nm adattato da (d) oltre 460 nm tempo di esposizione alla luce. I punti di dati sono stati adattati da Equazione (1).

Figura 2.Figura 2. La stafiloxantina è incline al fotobleaching sotto l’irraggiamento della luce blu. a) Spettro di assorbimento dell’estratto di STX grezzo (marrone) e profilo di emissione di un LED blu (nero). b) Illustrazione schematica di un dispositivo portatile di fotobleaching ad ampio campo basato su LED. c) Immagini di estratto di STX grezzo esposto alla luce a 460 nm e alla luce ambientale a diversi intervalli di tempo. d) Spettri di assorbimento dell’estratto di STX grezzo su diversi tempi di esposizione alla luce a 460 nm. e) OD di estratto di STX grezzo a 470 nm adattato da (d) oltre 460 nm tempo di esposizione alla luce. I punti di dati sono stati adattati da Equazione (1).
La spettrometria di massa e la spettroscopia Raman svelano la fotochimica di STX sotto i 460 nm di irraggiamento luminoso
Per comprendere la natura chimica di questo processo di fotobleaching, abbiamo studiato i prodotti di degradazione di STX indotti dall’irradiazione della luce a 460 nm attraverso la spettrometria di massa (MS). La Figura S6 nelle Informazioni di Supporto presenta lo spettro MS dell’estratto di MRSA con m/z che varia da 200 a 1000 eV ad un’energia di collisione di 10 eV. Un picco abbondante appare a m/z = 721,5, mentre un picco più debole a m/z = 819,5 ([M+H]+) è coerente con il peso molecolare di STX(Mw= 818,5 g mol-1). Per scoprire la relazione tra m/z = 721,5 e 819,5, abbiamo gradualmente aumentato l’energia di collisione da 0 a 20 eV. In figura3a, l’abbondanza di m/z = 721,5 aumenta rispetto a quella di m/z = 819,5 con l’aumento dell’energia di collisione, indicando che m/z = 721,5 è uno ione prodotto da m/z = 819,5. Quando l’energia di collisione era superiore a 30 eV, m/z = 241,5, un prodotto dello ione precursore m/z = 721,5, è diventato dominante e si è presentato come un marcatore stabile (Figura 3a). Così, per quantificare con precisione la quantità di STX rispetto alla dose di luce a 460 nm, abbiamo preso di mira l’area di picco in cromatografia liquida ad alte prestazioni (HPLC) cromatogrammi ad alte prestazioni (HPLC) cromatogrammi specificamente dallo ione m/z = 241,5 (Figura 3b). La Figura 3cillustra la dinamica di sbiancamento di STX indotta dall’esposizione a 460 nm. 5 min 460 nm esposizione alla luce (dose: 27 J cm-2) decomposto il 90% di STX estratto da ≈109 unità di formazione di colonia (CFU mL-1) MRSA, e una dose di 54 J cm-2 sbiancato tutti i pigmenti STX (dati non mostrati). Al contrario, gli estratti di naftifine-trattato e CrtM-mutante S. aureus hanno avuto una risposta trascurabile all’esposizione alla luce a 460 nm, come mostrato nella Figura S5d-f nelle Informazioni di supporto.

Figura 3.Figura 3. Spettrometria di massa e spettroscopia Raman svelare la fotochimica della stafiloxantina sotto l’esposizione alla luce 460 nm. a) Spettri MS di estratto grezzo STX greggio a diverse energie di collisione (CE). Picchi di m / z = 819,5, 721,5, e 241,5 sono evidenziati da frecce nere. b) HPLC cromatogrammi HPLC di STX estratto da MRSA concentrato oltre 460 nm esposizione alla luce ad una intensità di 90 mW cm-2. c) La quantità di STX calcolato da (b). La quantificazione di STX è determinata dall’area di picco di STX nei cromatogrammi HPLC indicati alla lettera b). I punti di dati sono misurati con l’equazione (1). d) Spettri Raman di STX grezzo (estratti da MRSA concentrato) sotto diverse dosi di luce a 460 nm. 460 nm intensità della luce: 200 mW cm-2. Lunghezza d’onda di eccitazione Raman: 532 nm, tempo di acquisizione: 30 s. e) Vista ingrandita di (d) nell’intervallo di spostamento Raman da 1500 a 1600 cm-1, gli spostamenti Raman a 1522 e 1527 cm-1 sono evidenziati da frecce nere e linee tratteggiate. f,g) Cromatogrammi UPLC di STX f) e uno dei suoi prodotti corrispondenti g) esposizione alla luce oltre 460 nm. h) Percorso di degradazione tentativo di STX sotto l’irraggiamento della luce a 460 nm.
Successivamente, abbiamo impiegato la spettroscopia Raman per chiarire come l’irraggiamento della luce a 460 nm degrada STX. STX ha mostrato un picco abbondante allo spostamento Raman di 1522 cm-1( Figura 3d), che è stato assegnato ai carotenoidi batterici.22 Con l’aumento della durata dell’esposizione alla luce a 460 nm, l’intensità del Raman a 1522 cm-1 diminuisce drasticamente (Figura 3d). Fenomeno simile è stato osservato in singolo MRSA (Figura S7, Informazioni di supporto). In particolare, abbiamo trovato un aumento di ≈5 cm-1 di spostamento Raman dopo l’esposizione alla luce a 460 nm (Figura 3e), che probabilmente risulta da una diminuzione del numero di legami C=C coniugati23durante il processo di fotocolorazione. Valeva la pena notare che il contenuto proteico (indicato dallo spostamento Raman a circa 1000 cm-1) è rimasto invariato durante il processo di fotosaldatura (Figura 3e). Questi risultati suggeriscono che l’irraggiamento della luce a 460 nm rompe la molecola STX.
Abbiamo inoltre utilizzato il tempo di volo MS/MS per quantificare questo processo di fotolisi. Diverso dal m / z = 819,5 picco dove STX si trova nel cromatografo HPLC, STX mostra un picco principale a m / z = 841,5 nel cromatogrammi ultraperformance cromatografia liquida (UPLC) (Figura 3f), che è un complemento tra STX e Na + ([M + Na]+). Degradazione di STX rafforzerebbe l’aggregazione di segmenti chimici. Di conseguenza, abbiamo vagliato una patch di prodotti dopo la degradazione di STX (Figura S8, Informazioni di supporto). In particolare, l’intensità del picco a m/z = 643,5 corrispondente ad un’aggiunta tra un segmento di STX con H+ ([M+H]+) è aumentata significativamente come esposizione alla luce a 460 nm allungata (Figura 3g). La Figura 3hsuggerisce un potenziale meccanismo di come questo segmento potrebbe formarsi dalla scomposizione del legame C=C in STX dopo l’esposizione alla luce a 460 nm. Questi risultati sottolineano che STX può essere fotolizzato dalla luce a 460 nm. Notiamo che l’interpretazione di altri prodotti (Figura S8, Informazioni di supporto) richiede un’ulteriore analisi approfondita.

Figura 3.Figura 3. Spettrometria di massa e spettroscopia Raman svelare la fotochimica della stafiloxantina sotto l’esposizione alla luce 460 nm. a) Spettri MS di estratto grezzo STX greggio a diversa energia di collisione (CE). Picchi di m / z = 819,5, 721,5, e 241,5 sono evidenziati da frecce nere. b) HPLC cromatogrammi HPLC di STX estratto da MRSA concentrato oltre 460 nm esposizione alla luce ad una intensità di 90 mW cm-2. c) La quantità di STX calcolato da (b). La quantificazione di STX è determinata dall’area di picco di STX nei cromatogrammi HPLC indicati alla lettera b). I punti di dati sono misurati con l’equazione (1). d) Spettri Raman di STX grezzo (estratti da MRSA concentrato) sotto diverse dosi di luce a 460 nm. 460 nm intensità della luce: 200 mW cm-2. Lunghezza d’onda di eccitazione Raman: 532 nm, tempo di acquisizione: 30 s. e) Vista ingrandita di (d) nell’intervallo di spostamento Raman da 1500 a 1600 cm-1, gli spostamenti Raman a 1522 e 1527 cm-1 sono evidenziati da frecce nere e linee tratteggiate. f,g) Cromatogrammi UPLC di STX f) e uno dei suoi prodotti corrispondenti g) esposizione alla luce oltre 460 nm. h) Percorso di degradazione tentativo di STX sotto l’irraggiamento della luce a 460 nm.
La fotolisi di STX da sola non è sufficiente ad eliminare l’MRSA
Dato che STX è fondamentale per l’integrità della membrana cellulare di S. a ureus,11 ci siamo chiesti se la fotolisi di STX potrebbe eliminare il MRSA. La luce blu a 405 e 470 nm è stata utilizzata per uccidere l’MRSA, come recensito da Wang et al.24 Tuttavia, l’efficacia è limitata e il meccanismo molecolare rimane elusivo. Abbiamo stabilito sopra che il STX è il bersaglio molecolare dell’irradiazione della luce blu. Di conseguenza, abbiamo scoperto che l’aumento della dose di luce a 460 nm ha diminuito costantemente il livello di MRSA CFU mL-1(figura4a). Inoltre, MRSA era più sensibile all’esposizione alla luce a 460 nm rispetto al mutante CrtM (Figura S9, Informazioni di supporto). Tuttavia, l’efficienza di uccisione satura a un livello di 216 J cm-2( Figura 4a). Per indagare il motivo, abbiamo continuamente monitorato la crescita di MRSA in mezzo fresco dopo 10 min 460 nm di esposizione alla luce. Notevolmente, MRSA esposto alla luce a 460 nm è stato in grado di recuperare e moltiplicarsi dopo essere stato coltivato in mezzo (Figura 4b). Abbiamo anche misurato CFU mL-1 di 460 nm MRSA esposto alla luce MRSA dopo essere stato coltivato in mezzo fresco per 30 min. Sembra che la luce a 460 nm mette MRSA in uno stato “traumatizzato” diverso da una forma di morte, e l’MRSA traumatizzato potrebbe recuperare e moltiplicarsi rapidamente nel mezzo fresco (Figura 4c). Dal momento che STX è arricchito in microdominio di membrana ed è essenziale per l’integrità della membrana,11 abbiamo condotto un test di permeabilità della membrana25 prima e dopo la fotolisi di STX. Abbiamo trovato che la permeabilità della membrana da 460 nm MRSA esposto alla luce MRSA significativamente aumentata rispetto al gruppo di controllo (Figura 4d,e ). Tuttavia, la luce esposta MRSA è in grado di recuperare l’integrità della membrana cellulare dopo essere stato coltivato in mezzo fresco entro 30 min (Figura 4d, e ). Insieme, queste osservazioni suggeriscono che la fotolisi STX da sola non è sufficiente per uccidere MRSA completamente.
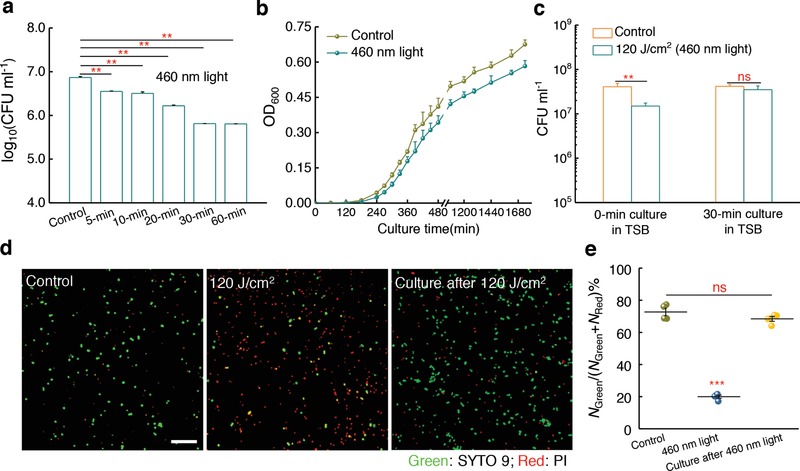
Figura 4.Stafilossantina fotolisi stafilossantina eleva transitoriamente permeabilità della membrana MRSA e non è in grado di sradicare MRSA completamente. a) Log cambiamento in unità di formazione di colonia MRSA (CFU mL-1) dopo il trattamento con luce 460 nm a diverse dosi. Intensità: 60 mW cm-2, N= 3. b) Curve di crescita di MRSA dopo nessun trattamento (controllo) o trattamento con 120 J cm-2 460 nm irradianza luce (N = 6).c ) MRSA CFU mL-1 dopo nessun trattamento (controllo) o trattamento con 120 J cm-2 460 nm irradianza luce, e 30 min cultura in mezzo TSB dopo 120 J cm-2 460 nm irradianza luce (N = 3). d) Imaging a scansione laser confocale della permeabilità della membrana dopo nessun trattamento (controllo) o trattamento con 120 J cm-2 460 nm di luce, e 30 min di coltura in mezzo TSB dopo 120 J cm-2 460 nm di irradianza della luce. Barra di scala = 10 µm. Verde: membrana intatta; Rosso: membrana danneggiata. e) Analisi statistica della permeabilità della membrana cellulare per (d). NGreene NRedsono il numero di MRSA con membrana intatta e membrana danneggiata, rispettivamente(N = 4). Le barre di errore mostrano l’errore standard della media (SEM). Test t non accoppiato a due code (***: p < 0, 001, **: p < 0,01, ns: non significativo).

Figura 4.Figura 4. Stafilossantina fotolisi stafilossantina fotolisi eleva transitoriamente permeabilità della membrana MRSA e non è in grado di sradicare MRSA completamente. a) Log cambiamento in unità di formazione di colonia MRSA (CFU mL-1) dopo il trattamento con luce 460 nm a dosi diverse. Intensità: 60 mW cm-2, N= 3. b) Curve di crescita di MRSA dopo nessun trattamento (controllo) o trattamento con 120 J cm-2 460 nm irradianza luce (N = 6).c ) MRSA CFU mL-1 dopo nessun trattamento (controllo) o trattamento con 120 J cm-2 460 nm irradianza luce, e 30 min cultura in mezzo TSB dopo 120 J cm-2 460 nm irradianza luce (N = 3). d) Imaging a scansione laser confocale della permeabilità della membrana dopo nessun trattamento (controllo) o trattamento con 120 J cm-2 460 nm di luce, e 30 min di coltura in mezzo TSB dopo 120 J cm-2 460 nm di irradianza della luce. Barra di scala = 10 µm. Verde: membrana intatta; Rosso: membrana danneggiata. e) Analisi statistica della permeabilità della membrana cellulare per (d). NGreene NRedsono il numero di MRSA con membrana intatta e membrana danneggiata, rispettivamente(N = 4). Le barre di errore mostrano l’errore standard della media (SEM). Test t non accoppiato a due code (***: p < 0, 001, **: p < 0,01, ns: non significativo).
Attacco di fotolisi e perossido di idrogeno STX e perossido di idrogeno Sradicare sinergicamente il plancton MRSA
Abbiamo poi chiesto se la fotolisi STX potrebbe transitoriamente migliorare l’assorbimento cellulare del perossido di idrogeno, una delle specie più comuni di ossigeno reattivo.26 Abbiamo eseguito l’imaging a fluorescenza a scansione laser confocale di S. aureus con una sonda fluorescente (vedi Metodi nelle Informazioni di supporto) per l’immagine del perossido di idrogeno intracellulare. È risultato che dopo l’esposizione alla luce a 460 nm, l’MRSA trattato conH2O2ha mostrato un’intensità di fluorescenza molto più forte rispetto all’MRSA trattato da solo con H2O2 o all’MRSA non trattato (figura5a,b). Non è stata trovata alcuna differenza significativa tra l’MRSA trattato dasolo con H2O2e l’MRSA non trattato (Figura 5b), indicando che l’MRSA non trattato ha la capacità di neutralizzare l’H2O2. Questa prova dimostra che la fotolisi STX aumenta l’ingresso del perossido di idrogeno nei batteri, che può causare un’intensificazione della tossicità dell’MRSA.
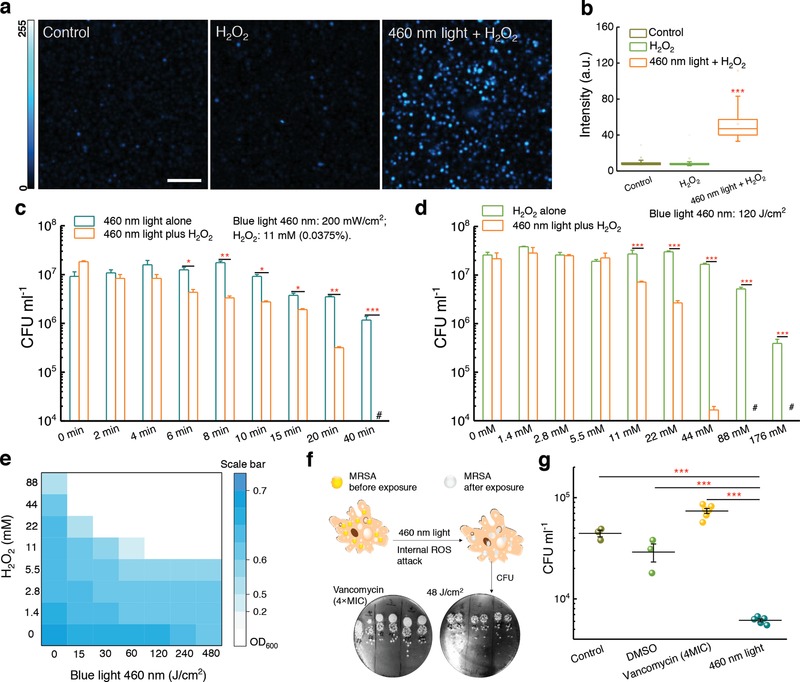
Figura 5.Figura 5. Stafiloxantina fotolisi e specie reattive dell’ossigeno specie reattive eliminare sinergicamente planctoniche MRSA e MRSA intracellulare. a) Immagini in fluorescenza da immagini di scansione laser confocale di scansione intracellulareH2O2dopo nessun trattamento (controllo), 0,15%H2O2, o 460 nm luce combinata con lo 0,15%H2O2. Barra di scala = 10 µm. b) Box chart analisi dell’intensità di fluorescenza in (a). c) MRSA CFU mL-1 dopo il trattamento con la sola luce a 460 nm, e il trattamento con H2O2 più luce a460nm (N = 3). d) MRSA CFU mL-1 dopo il trattamento con la sola H2O2,eil trattamento con luce a 460 nm più H2O2 (N = 3). e) Saggi di microdiluizione del brodo di scacchiera che mostrano il potenziamento dose-dipendente di H2O2 da irradiazione di luce 460 nm contro MRSA USA300. f) Schema che illustra l’utilizzo di luce 460 nm per il trattamento intracellulare MRSA. Immagini di piastre di diffusione da vancomicina (4 × MIC) e 460 nm gruppi trattati con luce 460 nm sono mostrati. g) CFU mL-1 risultati di MRSA intracellulare dopo nessun trattamento o trattamento con vancomicina (4 × MIC), e 460 nm luce (48 J cm-2) (N = 3-6). Le barre di errore mostrano SEM. Unpaired t-test a due code (***: p < 0, 001, **: p < 0,01, ns: non significativo).
Per esaminare l’effetto battericida della fotolisi di STX quando combinato con perossido di idrogeno, abbiamo misurato la vitalità di MRSA esposto aH2O2dopo l’esposizione alla luce a 460 nm. Quando MRSA è stato trattato con luce 460 nm (dose: 108 J cm-2) seguita da concentrazioni crescenti di H2O2, una riduzione significativa (p<0,001) in CFU mL-1 è stata ottenuta (Figura 5c). Sorprendentemente, 480 J cm J-2 460 nm esposizione alla luce combinata con lo 0,0375% di H2O2(tempo di coltura: 30 min) sradicato 107 MRSA CFU mL-1 completamente (Figura 5c). Pertanto, abbiamo ipotizzato che 460 nm luce eH2O2lavorare sinergicamente per sradicare MRSA. Per verificare questo effetto sinergico, abbiamo eseguito le stesse misurazioni a varie dosi di luce a 460 nm vari, fissando la concentrazione diH2O2(Figura 5d). Poi abbiamo calcolato un indice di concentrazione battericida frazionaria (FBCI),27 che è ampiamente utilizzato nella ricerca farmaceutica, per valutare il comportamento combinatorio tra due agenti. FBCI è stato calcolato utilizzando FBC che sta per concentrazione frazionaria battericida e MBC che definisce la concentrazione battericida minima. FBC del farmaco A = MBC del farmaco A in combinazione con il farmaco B diviso per MBC del solo farmaco A, FBC del farmaco B = MBC del farmaco B in combinazione con il farmaco A diviso per MBC del solo farmaco B. Il FBCI = FBC del farmaco A + FBC del farmaco B. Si ritiene che un FBCI di ≤0,5 dimostri una sinergia, mentre un FBCI di 1,0 definisce un effetto additivo. Un FBCI > 2 definisce un antagonismo. Come mostrato in Figura 5c,d, 44 × 10-3m di H2O2insieme a 120 J cm-2 (20 min) elimina circa il 99,9% del MRSA USA300. Dal momento che 200 mW cm-2 460 nm luce non ha eliminato tutti i MRSA USA300 dopo 40 minuti di esposizione (480 J cm-2), abbiamo(2) FBC didroga una luce blu<120 Jcm-2480 Jcm-2=0.25
Da quando abbiamo scoperto che 176 × 10-3m H2O2nonè in grado di eliminare il 99.il 9% dei batteri, abbiamo (3) FBC drug of drug of×10-3 M-176×10-3 M=0.25
Pertanto, FBCI = FBC di luce blu + FBC diH2O2< 0,25 + 0,25 = 0,5. Questo risultato indica che il fotobleaching STX funziona in sinergia con il perossido di idrogeno per eliminare l’MRSA USA300.
Successivamente, abbiamo condotto un test di microdiluizione del brodo di scacchiera28 per calcolare l’indice di concentrazione frazionaria inibitoria (FICI), che è un altro indice comunemente usato per valutare il comportamento combinatorio. In questo saggio, il FICI è calcolato utilizzando il FIC che sta per concentrazione frazionaria inibitoria e il MIC che definisce la concentrazione minima inibitoria. FIC del farmaco A = MIC del farmaco A in combinazione con il farmaco B diviso per la MIC del solo farmaco A, FIC del farmaco B = MIC del farmaco B in combinazione con il farmaco A diviso per la MIC del solo farmaco B, e indice FICI = FIC del farmaco A + FIC del farmaco B. Un FICI di ≤0,5 è considerato per dimostrare la sinergia. Un FICI di 1,0 è definito come additivo. Un antagonismo è definito come una FICI > 2.0. Dalla Figura 5e, possiamo calcolare il range di FICI(4) FICI< 30 Jcm-2480 Jcm-2+22×10-3 M88×10-3 M=0.31
Questi dati confermano ulteriormente la sinergia tra il fotobleaching STX e l‘H2O2nel trattamento di MRSA USA300. Da notare che questo trattamento non ha colpito altre specie di stafilococchi, come lo Staphylococcus epidermidis (Figura S10, Informazioni di supporto), che non hanno i carotenoidi.

Figura 5.Figura 5. Stafiloxantina fotolisi e specie di ossigeno reattivo specie di ossigeno eliminare sinergicamente planctoniche MRSA e MRSA intracellulare. a) Immagini in fluorescenza da immagini a scansione laser confocale di immagini diH2O2intracellulare dopo nessun trattamento (controllo), 0,15%H2O2, o 460 nm luce combinata con lo 0,15%H2O2. Barra di scala = 10 µm. b) Box chart analisi dell’intensità di fluorescenza in (a). c) MRSA CFU mL-1 dopo il trattamento con la sola luce a 460 nm, e il trattamento con H2O2 più luce a460nm (N = 3). d) MRSA CFU mL-1 dopo il trattamento con la sola H2O2,eil trattamento con luce a 460 nm più H2O2 (N = 3). e) Saggi di microdiluizione del brodo di scacchiera che mostrano il potenziamento dose-dipendente di H2O2 da irradiazione di luce 460 nm contro MRSA USA300. f) Schema che illustra l’utilizzo di luce 460 nm per il trattamento intracellulare MRSA. Immagini di piastre di diffusione da vancomicina (4 × MIC) e 460 nm gruppi trattati con luce 460 nm sono mostrati. g) CFU mL-1 risultati di MRSA intracellulare dopo nessun trattamento o trattamento con vancomicina (4 × MIC), e 460 nm luce (48 J cm-2) (N = 3-6). Le barre di errore mostrano SEM. Unpaired t-test a due code (***: p < 0, 001, **: p < 0,01, ns: non significativo).
La fotolisi STX e l’attacco delle specie di ossigeno reattive (ROS) eliminano in modo sinergico l’MRSA intracellulare
Studi risalenti agli anni ’70 hanno dimostrato che l’MRSA è in grado di invadere e sopravvivere all’interno delle cellule dei mammiferi, in particolare all’interno dei macrofagi.5 Sebbene i macrofagi secernano piccole molecole effettori, tra cui il ROS, i batteri, tra cui l’MRSA, sono in grado di neutralizzare queste molecole effettori producendo antiossidanti come l’STX.29 Nel frattempo, gli antibiotici sono generalmente inefficaci per eliminare l’MRSA intracellulare in gran parte a causa dello scudo della membrana fagocitica, che rappresenta una minaccia allarmante per le cellule ospiti.5 Come abbiamo dimostrato che la fotolisi di STX piùH2O2uccidono sinergicamente MRSA, ci siamo chiesti se la luce a 460 nm potrebbe sinergizzare con il ROS all’interno delle cellule macrofagiche per eliminare l’MRSA intracellulare (illustrato nella Figura 5f). Per valutare questo punto, abbiamo prima infettato le cellule macrofagiche con MRSA per 1 h. Poi, i macrofagi infetti sono stati esposti a 2 min 460 nm luce (48 J cm-2) due volte su un intervallo di 6 h. Macrofagi trattati sono stati successivamente lisati per enumerare CFU mL-1 di MRSA (piastre di diffusione mostrato in Figura 5f). Figura 5gcompilato l’analisi statistica di CFU mL-1 da diversi gruppi. Rispetto al gruppo di controllo, una riduzione di unlog10 di CFU mL-1 è stata trovata nel gruppo trattato con luce a 460 nm. Al contrario, la vancomicina ad alta concentrazione (5× MIC) non è stata in grado di eliminare l’MRSA intracellulare (Figura 5f,g). Inoltre, abbiamo scoperto che il sangue intero fresco poteva eliminare la maggior parte dell’MRSA dopo la fotolisi STX con luce blu (Figura S11, Informazioni di supporto). Questi risultati suggeriscono collettivamente che la fotolisi del STX potrebbe aiutare le cellule macrofagiche a sradicare l’MRSA intracellulare.
La fotolisi di STX e il perossido di idrogeno sradicano in modo efficiente l’MRSA stazionario in fase stazionaria, i persisteri e S. aureus nei biofilm
Oltre a risiedere all’interno delle cellule immunitarie dell’ospite, S. aureus è in grado di entrare nella fase stazionaria o di diventare un persisore multifarmaco tollerante30per minare l’efficacia degli antibiotici. I persisteri potrebbero sfuggire agli effetti degli antibiotici senza subire alterazioni genetiche.31 Inoltre, i persisteri sembrano essere una delle principali cause di infezioni croniche, poiché queste cellule rimangono meno sensibili agli antibiotici.31 Per indagare se la fotolisi STX potrebbe potenziare la bassa concentrazione di H2O2 per sradicare le cellule dei persister, sono stati incubati MRSA USA300 in fase logaritmica con 10× MIC ciprofloxacina (Figura S12, Informazioni di supporto) per 6 ore per uccidere le cellule attive al fine di generare cellule dei persister (Figura S13, Informazioni di supporto).32 Stazionaria fase MRSA è stato ottenuto da coltura MRSA in media per 24 ore. Poi, diversi trattamenti successivamente sono stati impiegati di conseguenza. Si è scoperto che la fotolisi STX combinata con H2O2 a bassa concentrazione ha ridotto le CFU mL-1 di circa due ordini di grandezza rispetto ad altri gruppi nel caso di entrambi i MRSA stazionari fase MRSA (Figura6a) e persiste (Figura 6b). Questa efficacia fornisce indizi per il trattamento delle infezioni croniche.
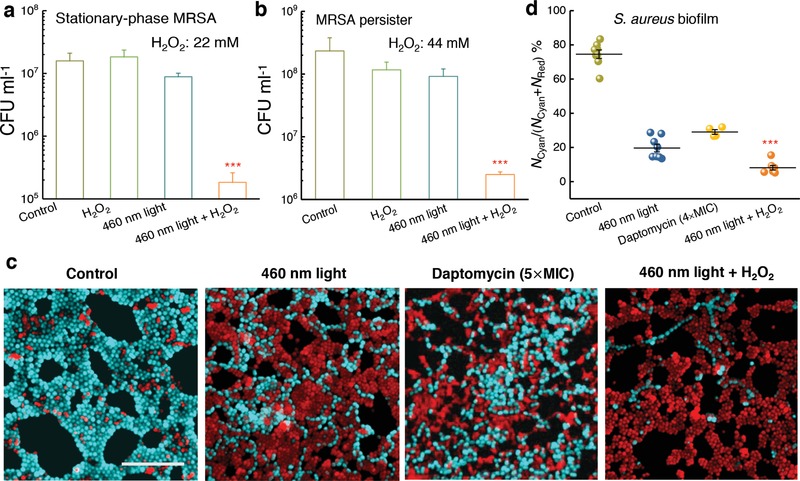
Figura 6.Figura 6. Stafiloxantina fotolisi eH2O2eliminare efficacemente stazionaria fase MRSA, persiste, e S. aureus all’interno di un biofilm. a) CFU mL-1 di MRSA stazionario fase dopo vari trattamenti. Dose:H2O2, 22 × 10-3m, 460nm luce, 120 J cm-2 (N = 3). b) CFU mL-1 di MRSA persiste dopo vari trattamenti. Dose:H2O2, 44 × 10-3m,luce 460nm, 120 J cm-2 (N = 3). c) Immagini influorescenza di S. aureus con membrana cellulare intatta (ciano) e danneggiato (rosso) all’interno di un biofilm dopo vari trattamenti. Barra di scala = 10 μm. 460 nm luce: 30 min di esposizione, 360 J cm-2. H2O2: 0,045%, 20 min di coltura, poi estinto da 0,5 mg mL-1 soluzione di catalisi. d) Analisi statistica della percentuale di sopravvivenza di S. aureus all’interno del biofilm. Sopravvivenza percentuale = NCyan /(NCyan + NRed), doveNCyan e NRedrappresentano il numero di S. a ureus con membrana cellulare intatta e danneggiata, rispettivamente. Le barre di errore mostrano SEM da almeno tre repliche. Unpaired t-test a due code non accoppiate (***: p < 0, 001 ), *** indica una differenza significativa rispetto agli altri tre gruppi.
S. aureus potrebbe anche formare biofilm recalcitranti per eludere gli antibiotici.33 A causa delle difficoltà di penetrazione degli antibiotici nella matrice del biofilm, definita come sostanza polimerica extracellulare,33 i biofilm batterici rappresentano una fonte significativa di fallimento del trattamento e di infezioni ricorrenti.33 Rispetto agli antibiotici, un vantaggio ineguagliabile della nostra terapia di fotolisi consiste nel fatto che i fotoni possono penetrare facilmente attraverso una membrana cellulare o un biofilm, o anche uno strato di tessuto. Per esplorare se la fotolisi STX combinata conH2O2potrebbe sradicare S. aureus all’interno di un biofilm, abbiamo fatto crescere biofilm sul fondo di un piatto di vetro rivestito di polilisina e poi abbiamo applicato luce a 460 nm o daptomicina (controllo positivo) per trattare questi biofilm. Poi abbiamo colorato i biofilm trattati con sonde a fluorescenza dal vivo/morte (informazioni di supporto) e abbiamo condotto una microscopia a scansione laser confocale per esaminare l’efficacia dei trattamenti di cui sopra. La Figura 6cmostra che la sola luce a 460 nm (dose: 360 J cm-2) ha traumatizzato S. aureus dell ‘80%. La Figura 6dmostra che 460 nm luce (dose: 360 J cm-2) più H2O2(0, 045%, 20 minuti di tempo di coltura) ha ridotto S. aureus CFU mL-1 del 92%. In particolare, la daptomicina (5× MIC, tempo di coltura 24 ore) ha eliminato solo S. aureus CFU mL-1 del 70% ( Figura 6d). Questi risultati implicano un modo efficace per eliminare i biofilm di S. a ureus coltivati su un impianto medico o su un tessuto ospite.

Figura 6.Figura 6. Fotolisi della stafiloxantina eH2O2eliminano efficacemente l’MRSA in fase stazionaria, i persisteri e S. aureus all’interno di un biofilm. a) CFU mL-1 di MRSA in fase stazionaria dopo vari trattamenti. Dose:H2O2, 22 × 10-3m, 460nm luce, 120 J cm-2 (N = 3). b) CFU mL-1 di MRSA persiste dopo vari trattamenti. Dose:H2O2, 44 × 10-3m,luce 460nm, 120 J cm-2 (N = 3). c) Immagini influorescenza di S. aureus con membrana cellulare intatta (ciano) e danneggiato (rosso) all’interno di un biofilm dopo vari trattamenti. Barra di scala = 10 μm. 460 nm luce: 30 min di esposizione, 360 J cm-2. H2O2: 0,045%, 20 min di coltura, poi estinto da 0,5 mg mL-1 soluzione di catalisi. d) Analisi statistica della percentuale di sopravvivenza di S. aureus all’interno del biofilm. Sopravvivenza percentuale = NCyan /(NCyan + NRed), doveNCyan e NRedrappresentano il numero di S. a ureus con membrana cellulare intatta e danneggiata, rispettivamente. Le barre di errore mostrano SEM da almeno tre repliche. Unpaired t-test a due code non accoppiate (***: p < 0, 001 ), *** indica una differenza significativa rispetto agli altri tre gruppi.
STX Fotolisi e H2O2 Ridurre efficacemente il carico di MRSA in due modelli di ferite di topi indotti da MRSA
I promettenti risultati ottenuti dai suddetti studi in vitro ci hanno portato a valutare l’efficacia della fotolisi di STX in un modello animale infetto da MRSA. Le infezioni della pelle come l’ulcerazione del piede diabetico e le infezioni del sito chirurgico34 sono cause comuni di morbilità in ambito sanitario. In particolare, S. aureus rappresenta il 40% di queste infezioni.35 Per ottimizzare i parametri per l’esperimento in vivo, abbiamo prima dimostrato che 2 min 460 nm di esposizione alla luce (dose: 24 J cm-2) potrebbero causare una significativa riduzione della percentuale di sopravvivenza dell’MRSA (Figura S14a, Informazioni di supporto). Poi, due volte maggiore efficienza antimicrobica è stato ottenuto quando coltivato conH2O2(20 minuti di tempo di coltura, 0,045% 0,045%) successivamente. Inoltre, 5 min di coltura conH2O2dopo 2 min 460 nm di esposizione alla luce (dose: 24 J cm-2) ha effettivamente eliminato l’MRSA del 60% (Figura S14b, Informazioni di supporto). In particolare, la dose di luce a 460 nm applicata per trattare l’infezione delle ferite del topo era ben al di sotto del limite di sicurezza ANSI per l’esposizione cutanea.36 Questi parametri sono stati utilizzati per applicare il nostro trattamento di fotolisi ad un modello animale infetto da MRSA.
Per indurre lesioni cutanee nei topi (5 gruppi; 5 topi per gruppo), abbiamo gravemente irritato la pelle dei topi con un’iniezione intradermica contenente108 CFU di MRSA USA300(Figura6b).7a), la principale fonte di infezioni della pelle e dei tessuti molli indotte da S. aureus in Nord America.37 60 h dopo l’iniezione, ferita formatasi nel sito di infezione (Figura 7b, in alto). Successivamente sono stati somministrati trattamenti topici a ciascun gruppo, due volte al giorno per tre giorni consecutivi. Le ferite di tutti i gruppi trattati sono apparse più sane rispetto al gruppo di controllo (Figura 7b, in alto). Poi, i topi sono stati eutanasia umana, e i tessuti delle ferite sono stati rimossi in modo asettico per quantificare il carico di MRSA nelle ferite (Informazioni di supporto). Abbiamo ulteriormente esaminato le condizioni fisiologiche delle ferite. Il non trattato, l’acido fusidico trattato con acido fusidico (controllo positivo), e 460 nm gruppi trattati con luce a 460 nm tutti hanno mostrato la formazione di pus sotto la ferita, in cui risiedono tessuti morti, batteri, macrofagi e neutrofili.38 Questo sintomo suggerisce che il sistema immunitario dei topi ha combattuto contro i batteri che risiedono all’interno del tessuto della ferita. Al contrario, i topi che ricevevano soloH2O2o 460 nm di luce più il trattamentoH2O2mostravano ferite pulite, prive di materiale purulento, gonfiori e arrossamenti intorno al bordo della ferita (Figura 7b, in basso).
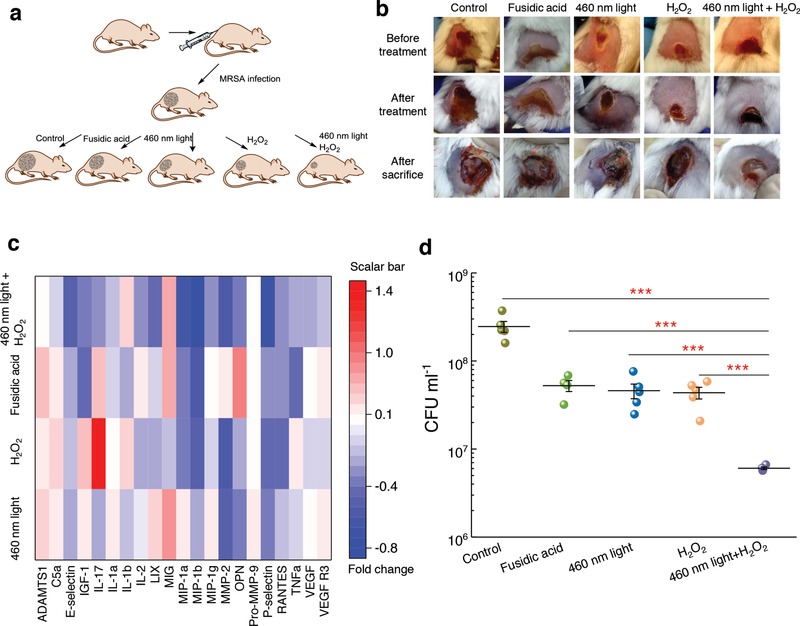
Figura 7.Figura 7. La fotolisi della stafiloxantina el’H2O2riducono efficacemente il carico di MRSA in un modello di ferita di topo infetto da MRSA. a) Schema del disegno dell’esperimento (non disegnato in scala). b) Immagini di ferite di topo di cinque diversi gruppi prese prima del trattamento, dopo il trattamento, e dopo il sacrificio. Le frecce rosse indicano la formazione di pus. c) Mappa termica delle principali citochine proinfiammatorie e dei marcatori nei campioni di tessuto omogeneizzato ottenuti da topi trattati con luce a 460 nm,H2O2, luce a 460 nm piùH2O2, o acido fusidico. Il riquadro rosso indica l’upregolazione; il riquadro blu indica l’downregolazione; il bianco indica l’assenza di cambiamenti significativi. La barra di scala rappresenta il cambiamento di piega rispetto al gruppo non trattato. d) MRSA CFU mL-1 dopo nessun trattamento (controllo) o trattamento di tre giorni consecutivi con acido fusidico al 2% (vaselina come veicolo), luce 460 nm, H2O2, e luce 460nm più H2O2. Dose: luce 460 nm, 24 J cm-2, H2O2, 0,045%. Le barre di errore mostrano il SEM di cinque repliche. Outlier è stato rimosso attraverso il test Q di Dixon. Unpaired t-test a due code non accoppiato (***: p < 0, 001 ).
Per quantificare l’effetto antinfiammatorio, abbiamo valutato un pannello di citochine presenti nel supernatante dei tessuti omogeneizzati estratti dalle ferite dei topi. Analizzando l’omogeneizzato cutaneo raccolto dal modello di ferite di topi MRSA, abbiamo trovato la più alta percentuale di variazione di piega negativa da circa 200 tipi di citochine nella luce 460 nm piùH2O2gruppotrattatorispetto agli altri gruppi (Figura S15, Informazioni di supporto). Degno di nota, il gruppo trattato con luce a 460 nm piùH2O2ha dimostrato il più alto rapporto di diminuzione dell’espressione di queste citochine proinfiammatorie (Figura 7c). In particolare, una diminuzione significativa è stata osservata nel gruppo 460 nm luce piùH2O2 trattatogruppo per quanto riguarda le citochine proinfiammatorie chiave (TNF-α, IL-1α, IL-2, IL-17, MIP-1α, MIP-1β, LIX) rispetto agli altri gruppi. Inoltre, vi è stata una diminuzione dell’espressione del recettore 3 del fattore di crescita endoteliale vascolare (VEGF R3) nei campioni ottenuti dal gruppo 460 nm luce piùH2O2 trattato. Questo marcatore è sovraespresso nelle ferite infiammatorie croniche, con conseguente compromissione della ricostruzione della ferita.39 Questi risultati supportano un’infiammazione significativamente ridotta nelle ferite dei topi trattati con luce a 460 nm piùH2O2, il che può suggerire che nel tessuto della ferita esista una quantità ridotta di MRSA.
Per quantificare il carico di MRSA nelle ferite, i tessuti della ferita sono stati omogeneizzati e inoculati su piastre di agar salina di mannitolo(S. aureus specifico) per il conteggio delle UFC. I risultati hanno mostrato che la luce 460 nm piùH2O2gruppotrattato con H2O2ha mostrato una riduzione significativa MRSA rispetto a tutti gli altri gruppi (Figura 7d). Notevolmente, la luce 460 nm piùH2O2gruppo trattato ha mostrato più di 1,5-log10 riduzione di CFU mL-1 rispetto al gruppo non trattato, e più di unlog10 riduzione rispetto al gruppo trattato con acido fusidico (Figura 7d). Insieme, questi risultati dimostrano che la luce a 460 nm sensibilizza l’MRSA in un’infezione della pelle all’H2O2, e fornisce un trattamento più efficace degli antibiotici.
Per confermare l’efficacia terapeutica della nostra fototerapia, abbiamo inoltre utilizzato un ceppo bioluminescente MRSA USA300 per il monitoraggio in vivo del carico di MRSA in un modello di abrasione del topo (vedi Metodi nelle Informazioni di supporto). Il segnale di bioluminescenza di questo ceppo MRSA luminescente è proporzionale al numero di batteri vivi, consentendo così il monitoraggio in tempo reale dell’efficacia terapeutica. Dopo essere stati infettati per 3 ore, le ferite dei topi sono state applicate rispettivamente con perossido di idrogeno e luce a 460 nm più perossido di idrogeno. Degno di nota, abbiamo trovato che l’onere MRSA nel gruppo trattato con sinergia ha una riduzione di un anno dopo il trattamento (Figura8a,b). Nel gruppo del gruppo trattato con perossido di idrogeno, il carico di MRSA si è ridotto all’inizio. Tuttavia, è rapidamente ritornato (Figura 8a,c). La sinergia tra la fotolisi STX eH2O2, come mostrato qui, implica un nuovo modo per pulire efficacemente le ferite dei pazienti o la sterilizzazione della sala operatoria.

Figura 8.Figura 8. In vivo immagini di bioluminescenza in vivo bioluminescenza di topi infetti da MRSA modello di abrasione topi sotto i trattamenti indicati. a) Immagini rappresentative bioluminescenza di topi infetti da MRSA in diversi punti di tempo dopo i trattamenti. Luce blu: 460 nm, 120 J cm-2(10 min di irradiazione).H2O2: 13,2 × 10-3m. b,c)Analisi quantitativa del segnale di bioluminescenza di MRSA USA300 all’interno del topo ferito dopo il trattamento da 460 nm luce più H2O2 b)eil trattamento da H2O2 c), rispettivamente (N = 5). Le barre di errore mostrano il SEM.

Figura 7.Figura 7. Stafiloxantina fotolisi eH2O2ridurre efficacemente il carico di MRSA in un MRSA infetto da MRSA modello di ferita di topi. a) Schema di disegno dell’esperimento (non disegnato in scala). b) Immagini di ferite di topi di cinque diversi gruppi presi prima del trattamento, dopo il trattamento, e dopo il sacrificio. Le frecce rosse indicano la formazione di pus. c) Mappa termica delle principali citochine proinfiammatorie e dei marcatori nei campioni di tessuto omogeneizzato ottenuti da topi trattati con luce a 460 nm,H2O2, luce a 460 nm piùH2O2, o acido fusidico. Il riquadro rosso indica l’upregolazione; il riquadro blu indica l’downregolazione; il bianco indica l’assenza di cambiamenti significativi. La barra di scala rappresenta il cambiamento di piega rispetto al gruppo non trattato. d) MRSA CFU mL-1 dopo nessun trattamento (controllo) o trattamento di tre giorni consecutivi con acido fusidico al 2% (vaselina come veicolo), luce 460 nm, H2O2, e luce 460nm più H2O2. Dose: luce 460 nm, 24 J cm-2, H2O2, 0,045%. Le barre di errore mostrano il SEM di cinque repliche. Outlier è stato rimosso attraverso il test Q di Dixon. Unpaired t-test a due code non accoppiato (***: p < 0, 001 ).

Figura 8.Figura 8. In vivo immagini di bioluminescenza in vivo di MRSA-infetti modello di abrasione topi sotto i trattamenti indicati. a) Immagini rappresentative bioluminescenza di topi MRSA-infetti in diversi punti di tempo dopo i trattamenti. Luce blu: 460 nm, 120 J cm-2(10 min di irradiazione).H2O2: 13,2 × 10-3m. b,c)Analisi quantitativa del segnale di bioluminescenza di MRSA USA300 all’interno del topo ferito dopo il trattamento da 460 nm luce più H2O2 b)eil trattamento da H2O2 c), rispettivamente (N = 5). Le barre di errore mostrano il SEM.
Conclusione
Attraverso l’imaging di assorbimento transitorio senza etichetta dei cromofori in MRSA, troviamo che STX, il pigmento dorato all’interno di S. aureus, è soggetto a fotolisi, soprattutto nella regione di luce blu. Troviamo inoltre che la fotolisi di STX eleva temporaneamente la permeabilità della membrana per le piccole molecole. Sulla base di questi risultati, l’eliminazione efficiente di MRSA si ottiene combinando la fotolisi di STX con il successivo attacco ROS sia in vitro che in vivo. La fotolisi STX combinata con perossido di idrogeno a bassa concentrazione inattiva in modo efficiente le cellule stazionarie a crescita lenta e i persister MRSA. Grazie alla vantaggiosa capacità di penetrazione della luce rispetto agli antibiotici, la fotolisi STX potrebbe non solo aiutare le cellule macrofagiche ad eliminare l’MRSA intracellulare, ma anche ridurre il numero di batteri sessili all’interno dei biofilm se combinata con il perossido di idrogeno. L’efficacia di questo trattamento sinergico è dimostrata in due modelli di infezione da ferite di topi. Questi risultati suggeriscono un nuovo modo per trattare le infezioni causate da S. aureus in clinica, ad esempio, le ulcere diabetiche. Notando che la pigmentazione è una caratteristica dei microbi patogeni multipli,40 il nostro lavoro mostra il potenziale eccitante del trattamento di batteri multifisici resistenti ai farmaci sfruttando la fotochimica e la fotofisica uniche dei loro pigmenti intrinseci.
Sezione sperimentale
Metodi sperimentali e saggi dettagliati sono illustrati nelle Informazioni di supporto. Per il modello di infezione da ferite sottocutanee di topi, questo esperimento animale è stato condotto seguendo i protocolli approvati dal Purdue Animal Care and Use Committee (PACUC). Per il modello di abrasione dei topi, questo esperimento animale è stato approvato dal Subcommittee on Research Animal Care (IACUC) del Massachusetts General Hospital e sono stati in conformità con le linee guida dei National Institutes of Health.
Conflitto di interessi
Gli autori non dichiarano alcun conflitto di interessi.
Informazioni di supporto
References
- PLoS Pathog.. 2011; 7:e1002307. PubMed
- J. Infect. Dis.. 2017; 215:S9. PubMed
- Adv. Drug Delivery Rev.. 2014; 78:3. PubMed
- Antimicrob. Agents Chemother.. 2016; 60:3970. PubMed
- Nature. 2015; 527:323. PubMed
- Nature. 2011; 473:216. PubMed
- Nature. 2018; 556:103. PubMed
- Viruses. 2014; 6:2551. PubMed
- Manual of Clinical Microbiology. American Society of Microbiology: Washington, DC; 2015.
- Cell. 2017; 171:1354. PubMed
- Antimicrob. Agents Chemother.. 2011; 55:526. PubMed
- Science. 2008; 319:1391. PubMed
- Acc. Chem. Res.. 2010; 43:1216. PubMed
- Nat. Chem. Biol.. 2016; 12:174. PubMed
- Antimicrob. Agents Chemother.. 2006; 50:1463. PubMed
- Nat. Chem. Biol.. 2006; 2:329. PubMed
- Proc. SPIE. 2000; 3909:81.
- Talanta. 1994; 41:211. PubMed
- Analyst. 2015; 140:4584. PubMed
- Nature. 2009; 461:1105. PubMed
- Eur. J. Histochem.. 2000; 44:419. PubMed
- Cell. Microbiol.. 2015; 17:832. PubMed
- J. Chem. Phys.. 1991; 94:4161.
- Drug Resist. Updates. 2017; 33–35:1.
- Proc. Natl. Acad. Sci. USA. 2016; 113:E7077. PubMed
- Cell Death Dis.. 2011; 2:e213. PubMed
- Trends Biotechnol.. 2007; 25:547. PubMed
- Antimicrob. Agents Chemother.. 2010; 54:4678. PubMed
- J. Exp. Med.. 2005; 202:209. PubMed
- Annu. Rev. Microbiol.. 2010; 64:357. PubMed
- Appl. Environ. Microbiol.. 2013; 79:7116. PubMed
- Sci. Rep.. 2016; 6:29707. PubMed
- Science. 1999; 284:1318. PubMed
- Infect. Drug Resist.. 2012; 5:87. PubMed
- Antimicrob. Agents Chemother.. 2005; 49:2260. PubMed
- American National Standard for Safe Use of Lasers, ANSI Z136.1. Laser Institute of America; 2014.
- West. J. Emerg. Med.. 2017; 18:201. PubMed
- Clin. Microbiol. Rev.. 2013; 26:255. PubMed
- Am. J. Pathol.. 2000; 156:1499. PubMed
- Trends Microbiol.. 2009; 17:406. PubMed
Fonte
Dong P, Mohammad H, Hui J, Leanse LG, Li J, et al. (2019) Photolysis of Staphyloxanthin in Methicillin‐Resistant . Advanced Science 6(11): 1900030. https://doi.org/10.1002/advs.201900030





